Everolimus
7 sản phẩm
 Dược sĩ Khánh Huyền
Dược sĩ chuyên môn
Dược sĩ Khánh Huyền
Dược sĩ chuyên môn
Ước tính: 6 phút đọc,
Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
Bài viết biên soạn dựa theo
Dược thư quốc gia Việt Nam, lần xuất bản thứ ba
Đây là phiên bản mới nhất của Dược thư Việt Nam do Bộ Y tế ban hành Quyết định số 3445/QĐ-BYT ngày 23 tháng 12 năm 2022
Trang 725-728, tải PDF TẠI ĐÂY
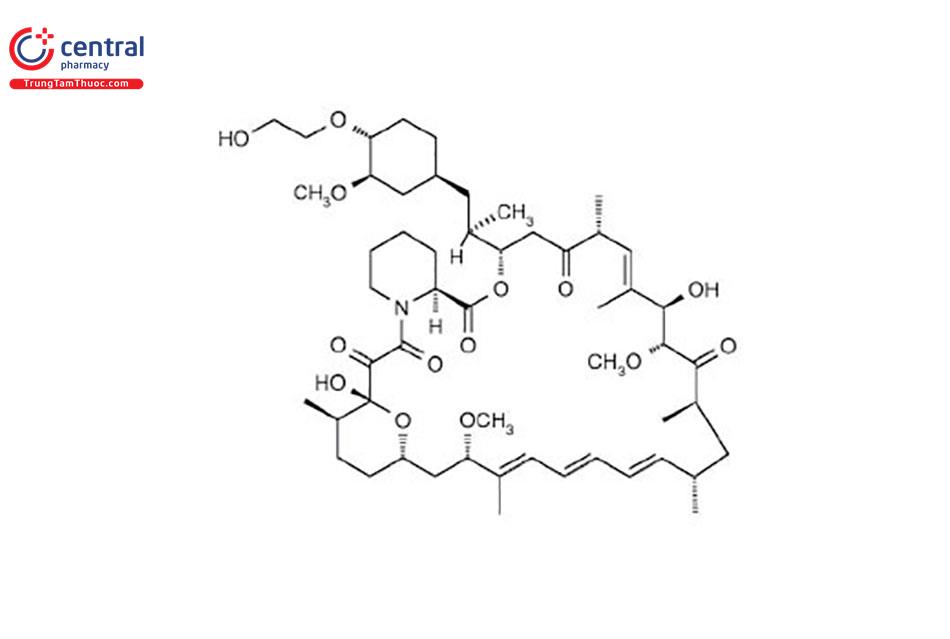
EVEROLIMUS
Tên chung quốc tế: Everolimus
Mã ATC: L04AAIS, LOIXE10.
Loại thuốc: Thuốc ức chế miễn dịch chọn lọc hoặc thuốc chống ung thư nhóm ức chế protein kinase.
1 Dạng thuốc và hàm lượng
Viên nén: 0,25 mg. 0,5 mg, 0,75 mg, 1 mg, 2,5 mg, 5 mg, 10 mg.
Viên phân nền phân tán: 2 mg, 3 mg, 5 mg.
2 Dược lực học
Đích của rapamycin ở động vật có vú (mammalian target of rapamycin-mTOR), một serin threonin kinase chủ chốt trong tế bảo, đồng vai trò trung tâm trong việc điều hòa sự phát triển, tăng sinh và sống sót của tế bào. Con đường dẫn truyền tin hiệu qua mTOR bị hoạt động quá mức trong một số bệnh ung thư và bệnh u xơ cứng củ (hay TSC). Everolimus gắn với một protein nội bảo là FKBP-12 để tạo thành phức hợp thuốc, phức hợp này gần đặc hiệu với phức hợp 1 của mTOR (mTORCI) và do đó ức chế hoạt động của mTOR. Everolimus làm giảm hoạt động mTOR, dẫn đến giảm hoạt động của protein kinase riboxom S6 (S6K1) và protein liên kết (4EBP-1), 2 enzym được mTOR hoạt hóa, do vậy giảm tổng hợp protein. S6K1 phosphoryl hóa vùng hoạt động 1 của thụ thể estrogen dẫn đến hoạt hóa thụ thể này không phụ thuộc vào việc gắn kết với ligand. Thêm vào đó everolimus ức chế biểu hiện các yếu tố cảm ứng tình trạng thiếu oxy (ví dụ HIF-lα) và giảm biểu hiện của các yếu tố liên quan đến tăng sinh mạch của khối u (ví dụ yếu tố tăng trưởng nội mô mạch máu - VEGF). Ức chế mTOR bằng everolimus đã cho thấy sự giảm tăng sinh tế bào, giảm sự tạo mạch màu và giảm sử dụng Glucose in vitro và hoặc in vivo.
Hoạt hóa liên tục con đường dẫn truyền PI3K/AKT/mTOR có thể dẫn đến ung thư vú kháng với liệu pháp nội tiết. Thí nghiệm in vitro cho thấy everolimus có hiệu quả trên tế bào ung thư phụ thuộc estrogen và HER2+, phối hợp chất ức chế Akt, HER2 hoặc aromatase với everolimus có thể có tác dụng hiệp đồng chống ung thư.
Phức hợp ức chế gen sinh ung thư TSCI và TSC2 (Tuberin- sclerosis complexes) điều hòa hoạt động của mTORC1. Mất hoặc giảm hoạt động của TSC1 hoặc TCS2 dẫn đến hoạt hóa mTOR. Trong bệnh u xơ cứng củ (TSC), một bệnh do rối loạn gen, đột biến không hoạt hóa TCS1 hoặc TCS2 dẫn đến sự hình thành của các mô thừa trong toàn bộ cơ thể cũng như sự hình thành các cơn co giật và động kinh. Sự hoạt động quá mức của mTOR dẫn đến loạn sản tế bào thần kinh, phá vỡ cấu trúc vỏ não, gây ra những bất thường về sự phát triển và chức năng của hệ thần kinh. Trong mô hình động vật có rối loạn hoạt động của mTOR ở não, dùng chất ức chế mTOR giúp giảm co giật, ngăn ngừa cơn co giật mới và giảm tử vong sớm.
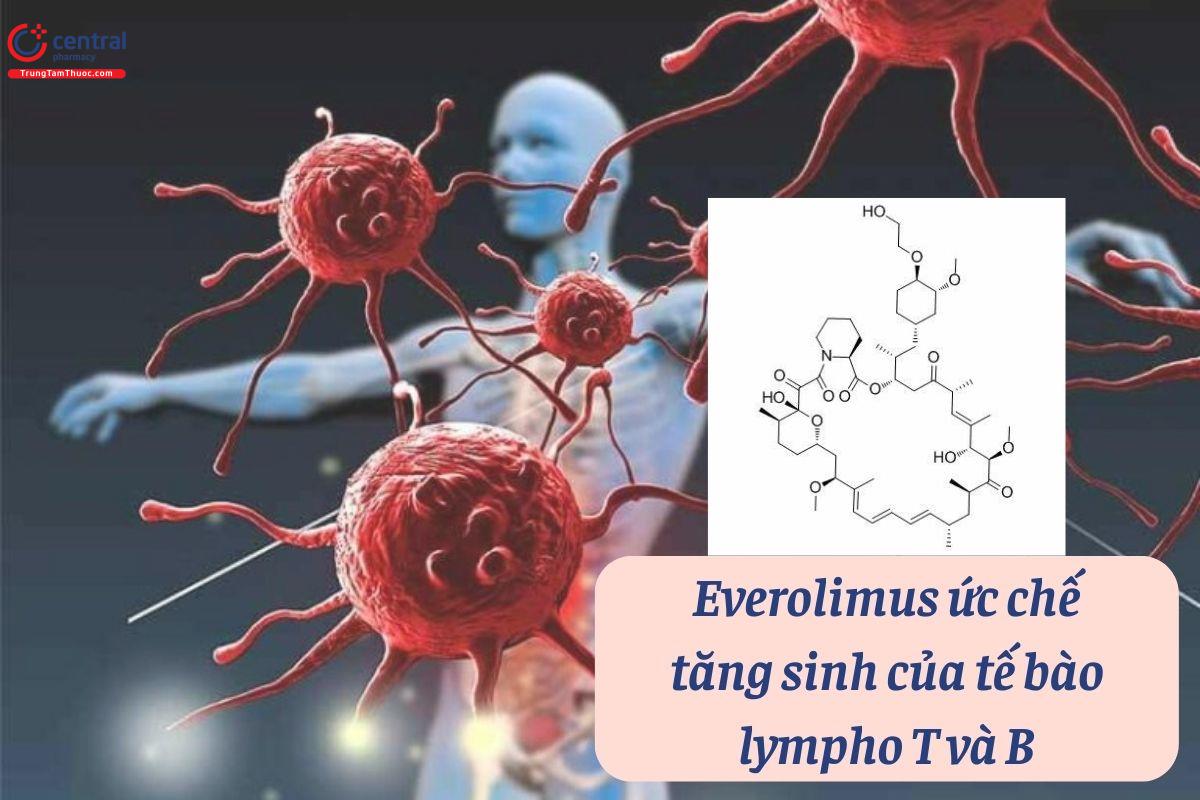
Everolimus ức chế tăng sinh của tế bào lympho T và B (các tế bào này được hoạt hóa và tăng sinh bởi kháng nguyên và Interleukin IL-2 và IL-15). Trên mô hình chuột và linh trưởng, everolimus giảm thải ghép thận giúp kéo dài thời gian sống thêm của mảnh ghép.
3 Dược động học
3.1 Hấp thu
Sau khi uống thuốc khoảng 1 - 2 giờ thuốc đạt nồng độ đỉnh trong máu. Với liều 0,5 - 2 mg, uống 2 lần một ngày ở bệnh nhân ghép tạng, Cmax và AUC của thuốc tỉ lệ với liều dùng khi ở trạng thái cân bằng. Ở bệnh nhân ung thư, Cmax.... tỉ lệ với liều dùng trong khoảng liều 5 - 10 mg uống 1 lần/ngày. Bữa ăn nhiều mỡ giảm AUC 22% và giảm Cmax... 54% sau khi uống liều 10 mg. Bữa ăn ít mỡ giảm AUC 32% và giảm Cmax 42%.
Dạng viên nén pha hỗn dịch uống có Cmax..., thấp hơn viên nên thường 20-36%.
3.2 Phân bố
Tỉ lệ thuốc trong máu và trong huyết tương của everolimus là khoảng 17 - 73%, tùy vào nồng độ thuốc trong khoảng 5 - 5 000 nanogam/ml. Tỉ lệ này là khoảng 20% ở bệnh nhân ung thư dùng liều 10mg/ngày. Tỉ lệ gắn với protein huyết tương là 74% ở người khỏe mạnh hoặc suy giảm chức năng gan mức độ trung bình. Ở bệnh nhân có khối u giai đoạn tiến triển, Vd là 191 lít ở ngăn trung tâm và 517 lít ở ngăn ngoại vi.
3.3 Chuyển hóa
Thuốc là cơ chất của CYP3A4 và là cơ chất và chất ức chế trung bình của P-glycoprotein (PgP), sau khi uống, everolimus là thành phần chính trong máu. 6 chất chuyển hóa có tác dụng yếu hơn everolimus khoảng 100 lần cũng được phát hiện trong máu.
3.4 Thải trừ
Nửa đời thải trừ là khoảng 30 giờ. Trên bệnh nhân dùng liều đơn 3 mg gắn phóng xạ, 80% hoạt tính phóng xạ thấy trong phân và 5% trong nước tiểu, nhưng không phát hiện thấy thuốc trong nước tiểu và phân.
Ở bệnh nhân suy gan AUC của thuốc tăng.
Suy thận sau ghép tạng không ảnh hưởng đến dược động học của thuốc.
4 Chỉ định
4.1 Điều trị ung thư
Phối hợp với exemestan điều trị ung thư vú tiến triển ở bệnh nhân ung thư vú đã mãn kinh và có thụ thể nội tiết dương tính và thụ thể HER-2 âm tính sau khi thất bại điều trị với letrozol hoặc Anastrozol. U thần kinh nội tiết nguồn gốc tụy biệt hóa tốt hoặc trung bình, không phẫu thuật được, tiến triển tại chỗ hoặc di căn.
U thần kinh nội tiết không chức năng nguồn gốc dạ dày ruột hoặc phổi, tiến triển, không phẫu thuật được và biệt hóa tốt (độ 1 hoặc 2). Ung thư biểu mô thận tiến triển ở người lớn sau khi thất bại điều trị với sunitinib hoặc sorafenib.
4.2 Điều trị bệnh u xơ cứng củ (Tuberous Scleroris Complex-TSC)
Người lớn bị u cơ mỡ mạch thận và u xơ cứng củ chưa cần phẫu thuật ngay; người lớn hoặc trẻ em trên 1 tuổi bị u xơ cứng củ có u sao bào khổng lồ ở màng nội tủy (SEGA) cần điều trị nhưng không thể phẫu thuật; điều trị bổ sung cho người lớn và trẻ em trên 2 tuổi có cơn động kinh khởi phát từng phần liên quan đến u xơ cứng củ.
4.3 Dự phòng thải ghép
Dùng trong phác đồ phối hợp với ciclosporin vi nhũ tương và corticoid, dự phòng thải ghép ở bệnh nhân ghép thận, tim có nguy cơ miễn dịch thấp đến trung bình. (Thận trọng khi dùng cho bệnh nhân ghép tim vì khi phối hợp với thymoglobulin có liên quan đến tăng nguy cơ tử vong).
Dùng phối hợp với Tacrolimus và corticoid dự phòng thải ghép ở bệnh nhân ghép gan trưởng thành.
5 Chống chỉ định
Bệnh nhân dị ứng với everolimus hoặc với các dẫn xuất rapamycin khác như sirolimus, temsirolimus.
6 Thận trọng
Thận trọng khi điều trị chống thải ghép, chưa có nghiên cứu trên bệnh nhân có nguy cơ miễn dịch cao.
Everolimus làm tăng khả năng nhiễm vi khuẩn, nấm, virus hoặc sinh vật đơn bào. Nhiễm trùng này có thể tại chỗ hoặc toàn thân và có khả năng nặng và tử vong. Do vậy phải áp dụng các biện pháp dự phòng phù hợp hoặc điều trị khỏi các bệnh nhiễm trùng trước khi dùng everolimus hoặc điều chỉnh liều everolimus khi điều trị liều cao (không phải liều chống thải ghép) tùy theo mức độ nhiễm trùng.
Tiêm vắc xin khi dùng các thuốc ức chế miễn dịch có thể ảnh hưởng đến đáp ứng miễn dịch. Nên tránh tiêm vắc xin sống trong thời gian dùng everolimus.
Cũng như các dẫn chất khác của rapamycin, everolimus làm tăng nguy cơ viêm phổi không do nhiễm trùng (bao gồm viêm phổi kế) thậm chí đã có những ca nặng và tử vong. Cần hướng dẫn bệnh nhân thông báo ngay những dấu hiệu mới hoặc dấu hiệu nặng lên của đường hô hấp.Thận trọng khi dùng phối hợp với các thuốc là cơ chất của CYP3A4 mà có khoảng điều trị hẹp hoặc các thuốc cảm ứng hoặc ức chế enzym CYP3A4.
Everolimus có khả năng làm tăng glucose huyết và lipid huyết. Do đó phải giám sát các thông số này khi bắt đầu và suốt quá trình điều trị với everolimus, đặc biệt là khi dùng cùng các thuốc khác cũng có tác động tương tự lên chuyển hóa. Khuyên bệnh nhân có chế độ ăn uống và luyện tập khoa học. Điều chỉnh liều everolimus khi các độc tỉnh trên chuyển hóa ở mức độ 3 hoặc 4. Khi đang dùng everolimus để chống thải ghép, có thể dùng thuốc điều trị rối loạn mì máu nếu gặp tình trạng này.
Thận trọng khi phối hợp với các thuốc ức chế men chuyển do làm tăng nguy cơ phù mạch.
Everolimus giống như các thuốc ức chế mTOR khác có thể làm chậm lành vết thương và tăng các biến chứng tại vết thương.
Vô sinh do giảm hoặc không có tinh trùng ở nam giới có thể xảy ra do thuốc tác động ức chế nhân lên của các tế bào phân chia nhanh như tinh trùng.
Các phản ứng quá mẫn như phản ứng phản vệ, khó thở, đau ngực, phù mặt đã được quan sát thấy ở bệnh nhân dùng everolimus. Suy thận, kể cả suy thận cấp có thể tử vong đã được ghi nhận. Cần theo dõi chức năng thận, đặc biệt ở bệnh nhân có thêm yếu tố nguy cơ gây suy giảm chức năng thận.
Với các bệnh nhân ghép tạng, everolimus làm tăng nguy cơ huyết khối động mạch và tĩnh mạch thận hoặc động mạch gan dẫn đến tăng nguy cơ mất mảnh ghép thậm chí tử vong (ở bệnh nhân ghép gan) trong vòng 30 ngày sau phẫu thuật ghép tạng. Thuốc còn làm tăng nguy cơ các bệnh huyết khối vi mạch/xuất huyết giảm tiểu cầu huyết khối/hội chứng urê tan huyết khi dùng kèm ciclosporin, do đó cần theo dõi các thông số huyết học.
Thận trọng khi dùng cho bệnh nhân ghép tim: Vì có khả năng làm tăng nguy cơ tử vong liên quan đến nhiễm trùng nặng trong vòng 3 tháng sau khi ghép. Nguy cơ tử vong trên có thể liên quan đến việc dùng phối hợp với thymoglobulin.
Bệnh nhân không dung nạp galactose, thiếu men lapp lactase hoặc hấp thu kém glucose-galactose không nên dùng everolimus liều cao.
Viêm miệng xảy ra trong vòng 8 tuần đầu ở các bệnh nhân dùng everolimus liều không phải liều chống thải ghép.
Nguy cơ xảy ra các tác dụng không mong muốn nặng và tử vong ở bệnh nhân trên 65 tuổi cao có thể cao hơn gấp 2 đến 3 lần so với bệnh nhân dưới 65 tuổi dùng everolimus.
7 Thời kỳ mang thai
Không có đủ thông tin về việc sử dụng everolimus trên phụ nữ mang thai. Dựa vào các nghiên cứu trên động vật cho thấy thuốc có độc tính cho phôi và thai. Chưa rõ nguy cơ tiềm tàng của thuốc trên người nhưng cơ chế của thuốc cho thấy everolimus có thể ảnh hưởng có hại cho thai nhi khi dùng cho phụ nữ mang thai. Do đó không nên dùng everolimus cho phụ nữ mang thai. Những phụ nữ trong độ tuổi sinh sản phải sử dụng phương pháp tránh thai có hiệu quả cao trong khi dùng thuốc và đến 8 tuần sau khi kết thúc điều trị.
8 Thời kỳ cho con bú
Chưa rõ everolimus có được bài tiết vào sữa mẹ hay không. Tuy nhiên nghiên cứu trên chuột cho thấy everolimus và chất chuyển hóa có thể vào sữa của chuột cho con bú. Vì vậy phụ nữ dùng everolimus không nên cho con bú trong khi điều trị và đến 2 tuần sau khi kết thúc điều trị.

9 Tác dụng không mong muốn (ADR)
Thông tin về ADR của thuốc chủ yếu từ dữ liệu của các nghiên cứu lâm sàng trên bệnh nhân ung thư và bệnh nhân ghép tạng.
9.1 Rất thường gặp
Nhiễm trùng và nhiễm ký sinh trùng: nhiễm khuẩn ở các cơ quan khác nhau.
Mẫu và bạch huyết: thiếu máu, giảm bạch cầu và tiểu cầu ở bệnh nhân ghép tạng.
Chuyển hóa và dinh dưỡng ăn không ngon, tăng đường huyết, tăng cholesterol huyết; ở bệnh nhân ghép tạng có các ADR tăng lipid huyết, tăng đái tháo đường mới mắc, giảm Kali huyết.
Thần kinh: loạn vị giác, nhức đầu.
Hô hấp, ngực và trung thất: viêm mô phổi, chảy máu cam. Tiêu hóa: viêm miệng, tiêu chảy, buồn nôn.
Da: nổi ban, ngứa.
Toàn thân: mệt mỏi, suy nhược, phù ngoại biên, giảm cân.
9.2 Thường gặp
Khối u lành tính hoặc ác tính hoặc không rõ ở bệnh nhân ghép tạng. Máu và hệ bạch huyết: giảm tiểu cầu, giảm bạch cầu trung tính, giảm bạch cầu, giảm tế bào lympho (rất thường gặp ở bệnh nhân ghép tạng), giảm toàn bộ tiểu cầu và huyết khối vi mạch ở bệnh nhân ghép tạng.
Chuyển hóa và dinh dưỡng: tăng triglycerid máu, hạ phosphat huyết, bệnh đái tháo đường, tăng lipid huyết, hạ kali huyết, mất nước.
Tâm thần: mất ngủ.
Hệ mạch: xuất huyết, tăng huyết áp.
Hô hấp, ngực và trung thất: ho, khó thở.
Hệ tiêu hóa: nôn, khô miệng, đau bụng, đau miệng, khó tiêu, khó nuốt.
Mô liên kết và mô cơ xương: đau khớp.
Thận và tiết niệu: protein niệu, suy thận.
Sinh sản: kinh nguyệt không đều, u nang buồng trứng.
Toàn thân: sốt, viêm niêm mạc.
Xét nghiệm: tăng AST, tăng ALT, tăng creatinin huyết.
9.3 Ít gặp
U lympho/rối loạn tăng sinh lympho sau ghép tạng. Máu và bạch huyết: giảm toàn bộ tiểu cầu.
Hệ miễn dịch: quá mẫn.
Hệ thần kinh: mất vị giác.
Hệ tim mạch: suy tim sung huyết, huyết khối tĩnh mạch sâu.
Hô hấp, ngực và trung thất: ho ra máu, thuyên tắc mạch phổi.
Thận và tiết niệu: tiểu nhiều ban ngày, suy thận cấp.
Sinh sản: mất kinh, suy tuyến sinh dục nam ở bệnh nhân ghép tạng.
Toàn thân: đau ngực không phải nguyên nhân do tim.
9.4 Hiếm gặp
Máu và bạch huyết: bất sản hồng cầu đơn thuần.
Hô hấp, ngực và trung thất: hội chứng suy hô hấp cấp. Da và mô dưới da: phù mạch.
Toàn thân: chậm lành vết thương.
Hướng dẫn cách xử trí ADR
Bảng dưới đây hướng dẫn xử trí các ADR dựa trên mức độ nặng theo tiêu chuẩn thông dụng để đánh giá các biến cố bất lợi của Viện ung thư quốc gia Hoa Kỳ (NCI-CTCAE):
| ADR | Độ nặng | Xử trí | |
| Viêm phổi không nhiễm khuẩn |
Độ 2 |
Tạm dừng everolimus cho đến khi ADR này giảm xuống dưới độ 1, Bắt đầu dùng lại với liều bằng 50% liều cũ, có thể dùng chế độ cách ngày nếu không có viên hàm lượng thấp. |
Ngừng hẳn thuốc nếu không giảm triệu chứng về độ 1 trong vòng 4 tuần. |
| Độ 3 | Nếu ADR tái phát ở độ 3, ngừng hẳn thuốc. |
||
| Độ 4 | Ngừng hẳn thuốc | ||
| Viêm miệng | Độ 2 | Tạm dừng everolimus cho đến khi ADR này giảm xuống dưới độ 1 thì dùng lại thuốc. Nếu phải dùng lại thuốc với liều thấp và không có viên hàm lượng thấp, có thể dùng chế độ cách ngày. |
Bắt đầu dùng lại với liều như cũ. Nếu xuất hiện lại ADR ở độ 2, xử trí như phần chung, liều dùng lại bằng nửa liều cũ. |
| Độ 3 | Bắt đầu dùng lại với liều bằng 50% liều cũ. | ||
| Độ 4 | Ngừng hẳn thuốc | ||
| Rối loạn chuyển hóa | Độ 3 | Dừng thuốc cho đến khi giảm xuống độ 2, 1 hoặc 0. Bắt đầu dùng lại với liều bằng 50% liều cũ, có thể dùng chế độ cách ngày nếu không có viên hàm lượng thấp. | |
| Độ 4 | Ngừng hẳn thuốc | ||
| ADR không trên huyết học khác | Độ 2 | Tạm dừng everolimus cho đến khi ADR này giảm xuống dưới độ 1 thì dùng lại thuốc. | Bắt đầu dùng lại với liều liều như cũ. Nếu xuất hiện lại ADR ở độ 2, xử trí như phần chung, liều dùng lại bằng nửa liều cũ. |
| Độ 3 | Bắt đầu dùng lại với liều bằng 50% liều cũ. Nếu xuất hiện lại ADR này độ 3, dừng hẳn thuốc. | ||
| Độ 4 | Ngừng hẳn thuốc | ||
| Giảm tiểu cầu | Độ 2 (< 75,≥ 50 ×109/l) | Tạm dừng everolimus cho đến khi ADR này giảm xuống độ 0, 1 thì dùng lại liều như cũ. | |
| Độ 3&4 (<50 ×109/l) |
Tạm dừng everolimus cho đến khi ADR này giảm xuống độ 0, 1 thì dùng lại liều 50% liều cũ. Có thể dùng chế độ cách ngày nếu không có viên hàm lượng thấp. | ||
| Giảm bạch cầu trung tính | Độ 3 ( <1, 2 0,5 ×109/l) |
Tạm dừng everolimus cho đến khi ADR này giảm xuống độ 0, 1, 2 thì dùng lại liều như cũ. | |
| Độ 4 (< 0,5×109/l) |
Tạm dừng everolimus cho đến khi ADR này giảm xuống độ 0, 1, 2 thì dùng lại liều 50% liều cũ. Có thể dùng chế độ cách ngày nếu không có viên hàm lượng thấp. | ||
| Sốt giảm bạch cầu | Độ 3 | Tạm dừng everolimus cho đến khi ADR này giảm xuống độ 0, 1, 2 và không còn sốt thì dùng lại liều 50% liều cũ. Có thể dùng chế độ cách ngày nếu không có viên hàm lượng thấp. | |
| Độ 4 | Ngừng hẳn thuốc. | ||
Xử trí các ADR có thể bằng cách điều chỉnh liều dùng hoặc tạm dừng điều trị. Khi gặp các tác dụng không mong muốn mức độ nhẹ (độ 1), thường không cần điều chỉnh liều dùng. Ngoài ra có thể áp dụng các biện pháp điều trị cho các mức độ nặng khác:
Rối loạn chuyển hóa và các ADR không trên huyết học: Điều trị nội khoa thích hợp và theo dõi bệnh nhân.
Viêm miệng: Hướng dẫn bệnh nhân sử dụng biện pháp điều trị tại chỗ, cần tránh nước súc miệng có cồn, iod, hoặc húng tây vì chúng làm nặng thêm tình trạng này.
Viêm phổi không do nhiễm trùng: Chẩn đoán loại trừ nhiễm khuẩn. Nếu các triệu chứng ở độ 2 hoặc 3, có thể dùng corticoid cho đến khi cải thiện triệu chứng. Có thể cân nhắc phác đồ dự phòng nhiễm trùng cơ hội ở những bệnh nhân này.
10 Liều lượng và cách dùng
10.1 Cách dùng
Với viên nén thông thường: Nuốt nguyên viên thuốc với một cốc nước lọc, không nghiền trước khi uống. Nên uống thuốc vào các thời điểm cố định trong ngày, giữa các lần uống thuốc cách nhau khoảng 12 tiếng, có thể uống cùng với bữa ăn hoặc không nhưng nên giống nhau giữa các lần uống thuốc. Uống cùng thời điểm với tacrolimus hoặc ciclosporin trong điều trị chống thải ghép.
Với viên nén phân tán: Người chuẩn bị thuốc đeo găng tay khi chuẩn bị thuốc để tránh tiếp xúc. Có thể phân tán thuốc bằng cách cho vào trong cốc nhỏ (dung tích tối đa 100 ml) chứa 25 ml nước lọc hoặc cho viên thuốc vào xi lanh 10ml rồi hút 5ml nước lọc. Đợi 3 phút cho thuốc phân tán rồi khoắng nhẹ cốc nước hoặc lắc nhẹ xi lanh rồi uống hết lượng thuốc. Tráng lại dụng cụ pha thuốc bằng nước và uống để đảm bảo uống hết thuốc. Mỗi lần pha không quá 10 mg thuốc. Nếu dùng liều lớn hơn thì pha như lại như trên. Không nghiền hay bẻ viên thuốc.
10.2 Liều lượng
10.2.1 Điều trị ung thư
Chỉ chọn 1 trong 2 dạng bào chế: Viên nén thông thường hoặc viên nén phân tán.
Liều khuyến cáo hàng ngày là 10 mg, uống 1 lần/ngày. Dùng thuốc đến khi đạt được hiệu quả lâm sàng hoặc khi không thể dung nạp được do độc tính của thuốc.
10.2.2 Điều trị các bệnh liên quan đến u xơ cứng củ (TSC)
U xơ cứng củ và u cơ mỡ mạch thận: Liều khuyến cáo hàng ngày là 10 mg, uống 1 lần/ngày. Dùng thuốc đến khi đạt được hiệu quả sàng hoặc khi không thể dung nạp được do độc tính của thuốc. U xơ cứng củ có liên quan SEGA: Liều khởi đầu khuyến cáo là 4,5 mg/m2, uống 1 lần/ngày cho đến khi bệnh tiến triển hoặc không dung nạp thuốc do độc tính.
U xơ cứng củ có liên quan cơn động kinh khởi phát từng phần: Liều khởi đầu khuyến cáo là 5 mg/m2, uống 1 lần/ngày cho đến khi bệnh tiến triển hoặc không dung nạp thuốc do độc tính.
Liều tiếp theo trong điều trị u xơ cứng củ có liên quan SEGA và cơn động kinh khởi phát một phần cần phải dựa vào giám sát nồng độ thuốc trong máu.
Chỉnh liều để đạt được nồng độ đáy trong khoảng 5 nanogam/ml đến 15 nanogam/ml.
Công thức chỉnh liều như sau:
Liều mới = liều hiện tại × (nồng độ đích/nồng độ hiện tại)
Bất cứ liều ở thời điểm chỉnh liệu nào cũng không được vượt quá 5 mg. Có thể phải đo nồng độ đáy vài lần để đạt được nồng độ đích. Thời điểm giám sát nồng độ thuốc trong máu nên được thực hiện như trong bảng sau:
| Thời điểm (1) |
Thời điểm định lượng so với (1) |
| Bắt đầu dùng everolimus (viên nên thường hoặc viên phân tán) | 1 đến 2 tuần |
| Thay đổi liều của everolimus (viên nên thường hoặc viên phân tán) | 1 đến 2 tuần |
| Chuyển từ viên nên thường sang viên phân tán | 1 đến 2 tuần |
| Bắt đầu hoặc kết thúc các thuốc cảm ứng CYP3A4 mạnh hoặc P-glycoprotein | 2 tuần |
| Bắt đầu hoặc kết thúc các thuốc ức chế CYP3A4 trung bình hoặc P-glycoprotein | 2 tuần |
| Thay đổi chức năng gan | 2 tuần |
| Liều dùng đã ổn định nhưng có thay đổi BSA | Mỗi 3 đến 6 tháng |
| Liều dùng và BSA ổn định | Mỗi 6 đến 12 tháng |
Dự phòng thải ghép: Bệnh nhân cần được theo dõi nồng độ thuốc trong máu.
Ghép tim, thận: Dùng thuốc sớm nhất có thể sau khi ghép tạng với liều khởi đầu 0,75 mg/lần uống 2 lần/ngày, dùng cùng với Ghép gan: Dùng sau khi phẫu thuật ghép gan ít nhất 30 ngày với liều khởi đầu 1 mg, uống 2 lần/ngày cùng với tacrolimus.
Sau đó có thể phải chỉnh liều của thuốc dựa vào nồng độ thuốc trong máu, mức độ dung nạp và đáp ứng của bệnh nhân, sự thay đổi của phác đồ phối hợp đặc biệt là khi giảm liều của ciclosporin theo trình tự khuyến cáo trong phác đồ phối hợp với everolimus, hoặc dùng cùng với các thuốc cảm ứng hoặc ức chế CYP3A4. Việc chỉnh liều dựa vào nồng độ đáy của thuốc vào thời điểm 4 - 5 ngày sau lần chỉnh liều trước. Khoảng nồng độ đáy trong máu toàn phần khuyến cáo ở mức 3 - 8 nanogam/ml theo phương pháp định lượng sắc ký hoặc miễn dịch, tuy nhiên không nên đánh giá sự thay đổi nồng độ bằng các test khác nhau. Cần tăng liều gấp đôi nếu nồng độ đây dưới ngưỡng 3 nanogam/ml, cần giảm 0,25 mg cho mỗi lần uống nếu có 2 lần định lượng liên tiếp nồng độ thuốc trên ngưỡng 8 nanogam/ml.
Với bệnh nhân suy gan nhẹ (Child-Pugh A), liều khởi đầu giảm còn 2/3 so với liều thông thưởng. Với bệnh nhân suy gan mức độ trung bình hoặc nặng (Child-Pugh B, C) liều khởi đầu giảm xuống còn một nửa so với liều khuyến cáo thông thưởng. Các liều tiếp theo được điều chỉnh đảm bảo nồng độ đáy trong khoảng khuyến cáo 3 - 8 nanogam/ml.
10.2.3 Chỉnh liều cho bệnh nhân suy gan:
Với bệnh nhân điều trị ung thư và xơ cứng củ và u cơ mỡ mạch thận, suy gan nhẹ (Child-Pugh A) dùng liều 7,5 mg/ngày và giảm xuống 5 mg/ngày nếu không dung nạp; suy gan trung bình (Child-Pugh B) dùng liều 5 mg/ngày và giảm xuống 2,5 mg/ngày nếu không dung nạp; suy gan nặng (Child-Pugh C) chỉ dùng nếu cân nhắc lợi ích vượt trội nguy cơ và dùng liều không quá 2,5 mg/ngày. Với bệnh nhân u xơ cứng củ có liên quan SEGA và cơn động kinh khởi phát một phần, suy gan mức độ nặng (Child-Pugh C) dùng liều 2,5 mg/m2 một lần/ngày và chỉnh liều theo nồng độ thuốc trong máu.
10.2.4 Chỉnh liều khi gặp tác dụng không mong muốn (xem mục Hướng dẫn cách xử trí ADR).
Chỉnh liều khi phối hợp thuốc:
Phối hợp với các thuốc ức chế CYP3A4 trung bình và P-glycoprotein: Với bệnh nhân điều trị ung thư và xơ cứng củ và u cơ mỡ mạch thận: Giảm liều xuống còn 2,5 mg uống 1 lần/ngày. Có thể tăng lên 5 mg/lần/ngày nếu dung nạp được. Khi dừng các thuốc ức chế, sau 3 ngày dùng lại liều everolimus như trước khi phối hợp thuốc. Với bệnh nhân u xơ cứng củ có liên quan SEGA và cơn động kinh khởi phát một phần: Giảm liều hàng ngày 50%, chuyển sang chế độ dùng liều cách ngày nếu liều này thấp hơn chế phẩm có hàm lượng thấp nhất. Dùng lại liều như trước khi phối hợp khi dùng thuốc ức chế được 3 ngày. Giám sát nồng độ everolimus trong máu khi bắt đầu và dừng các thuốc ức chế.
Phối hợp với các thuốc cảm ứng CYP3A4 mạnh và P-glycoprotein: Tránh dùng các thuốc đó cùng với everolimus nếu có thể. Với bệnh nhân điều trị ung thư và xơ cứng củ và u cơ mỡ mạch thận, tăng liều lên gấp đôi liều đang dùng. Mỗi lần có thể tăng 5 mg hoặc ít hơn. Khi ngừng các thuốc cảm ứng 5 ngày, dùng lại liều của everolimus như trước khi phối hợp thuốc. Với bệnh nhân u xơ cứng củ có liên quan SEGA và cơn động kinh khởi phát một phần thì tăng liều lên gấp đôi liều đang dùng. Mỗi lần có thể tăng 5 mg hoặc ít hơn. Khi ngừng các thuốc cảm ứng 5 ngày, dùng lại liều của everolimus như trước khi phối hợp thuốc. Nếu dùng củng cả một thuốc ức chế mạnh và một thuốc cảm ứng mạnh CYP3A4, có thể không cần chỉnh liều. Giám sát nồng độ thuốc trong máu khi bắt đầu và khi dừng các thuốc cảm ứng.
11 Tương tác thuốc
Các thuốc ức chế CYP3A4 và ức chế P-glycoprotein có thể làm tăng nồng độ everolimus trong máu. Nên tránh phối hợp everolimus với các thuốc ức chế mạnh CYP3A4 và P-glycoprotein (như ketoconazol, itraconazol, ritonavir, Clarithromycin, telithromycin), giảm liều khi phối hợp với các thuốc ức chế P-glycoprotein và ức chế CYP3A4 trung bình (như Erythromycin, Verapamil, ciclosporin, fluconazol, Diltiazem, amprenavir, fosampretavir, aprepitant). Nên tránh dùng nước Bưởi chùm, khế, cam Seville và các đồ ăn khác đã biết có ảnh hưởng đến hoạt tính của cytochrom P450 và P-glycoprotein trong thời gian điều trị.
Những thuốc cảm ứng CYP3A4 hoặc P-glycoprotein có thể làm giảm nồng độ everolimus trong máu do làm giảm chuyển hóa hoặc đẩy thuốc ra khỏi tế bào ruột. Nên tránh dùng đồng thời everolimus với các thuốc này. Nếu phải dùng phối hợp với các chất gây cảm ứng mạnh CYP3A4 hoặc P-glycoprotein (như Rifampicin, rifabutin, có St. John, carbamazepin, Phenobarbital, Phenytoin, efavirenz, nevirapin) cần chỉnh liều everolimus (xem mục Liều lượng). Nồng độ một số thuốc là cơ chất của CYP3A4 như Midazolam có thể tăng khi dùng qua đường uống cùng với everolimus. Tuy nhiên không cần phải điều chỉnh liều các thuốc này.
Phối hợp với ciclosporin làm tăng độc tính trên thận và giảm tốc độ lọc cầu thận, tăng nguy cơ huyết khối vi mạch, giảm tiểu cầu huyết khối, chứng urê tan máu.
Tránh phối hợp với thuốc ức chế men chuyển do tăng nguy cơ phù mạch.
Tăng nguy cơ độc tính trên thận khi dùng cùng các thuốc độc với thận.
12 Quá liều và xử trí
12.1 Triệu chứng
Thông tin báo cáo về quá liều trên người còn hạn chế. Các liều đơn đến 70 mg được dùng và có thể dung nạp được.
12.2 Xử trí
Cần áp dụng các biện pháp điều trị hỗ trợ chung cho các trường hợp quá liều.
Cập nhật lần cuối: 2019