Hướng dẫn thực hành lâm sàng 'Bệnh tuyến giáp trong thai kỳ' ACOG 2020

Trungtamthuoc.com - Ngày 21 tháng 5 năm 2020, Hội Sản Phụ khoa Mỹ (ACOG) đã công bố bản Hướng dẫn thực hành lâm sàng 'Bệnh tuyến giáp trong thai kỳ', cập nhật và bổ sung thông tin cho bản phát hành trước đó vào tháng 4 năm 2015.
ACOG PRACTICE BULLETIN (BẢN TIN THỰC HÀNH ACOG)
Clinical Management Guidelines for Obstetrician–Gynecologists (Hướng dẫn quản lý lâm sàng dành cho bác sĩ sản phụ khoa)
Tải PDF bản gốc Hướng dẫn thực hành lâm sàng: Bệnh tuyến giáp trong thai kỳ tại đây và PDF bản dịch tại đây
Replaces Practice Bulletin Number 148, April 2015 (Thay thế Bản tin Thực hành Số 148, tháng 4 năm 2015)
Dịch bởi: Bác sĩ Vũ Văn Tài

1 Bệnh tuyến giáp trong thai kỳ
Các kết cục thai kỳ bất lợi thường gặp trong cả nhiễm độc hormone giáp và suy giáp. Cũng có mối quan ngại về sự phát triển của con sẽ bị ảnh hưởng nếu mẹ bị bệnh lý tuyến giáp trên lâm sàng. Ngoài ra, các thuốc mà ảnh hưởng đến tuyến giáp của mẹ có thể qua nhau thai và ảnh hưởng đến tuyến giáp thai nhi. Hướng dẫn này đánh giá các thay đổi sinh lý bệnh liên quan đến tuyến giáp xảy ra trong thai kỳ và kết cục của mẹ và thai nhi sẽ bị ảnh hưởng như thế nào nếu mẹ bị bệnh tuyến giáp lâm sàng và dưới lâm sàng. Thông cáo Thực hành này được cập nhật với thông tin về chẩn đoán và quản lý bệnh tuyến giáp ở phụ nữ mang thai và bao gồm một phác đồ lâm sàng mới về quản lý bệnh tuyến giáp trong thai kỳ.

2 Đại cương
2.1 Thay đổi chức năng tuyến giáp trong thai kỳ
Trong thai kỳ, chức năng tuyến giáp có sự thay đổi đáng kể và có thể nhầm với các bệnh lý tuyến giáp của mẹ. Thể tích tuyến giáp của mẹ tăng ở bất cứ vị trí nào từ 10% đến 30% trong ba tháng đầu và được cho là do tăng dịch ngoại bào và thể tích máu trong thai kỳ (1). Ngoài ra, có những thay đổi về nồng độ hormone tuyến giáp và chức năng tuyến giáp trong suốt thai kỳ. Bảng 1 mô tả kết quả xét nghiệm chức năng tuyến giáp thay đổi như thế nào trong thai kỳ bình thường và trong bệnh lý tuyến giáp lâm sàng và dưới lâm sàng. Đầu tiên, nồng độ hormone tuyến giáp toàn phần hoặc liên kết của mẹ tăng cùng với nồng độ globulin liên với tuyến giáp trong huyết thanh. Thứ hai, nồng độ thyrotropin (còn được gọi là hormone kích thích tuyến giáp [TSH]), đóng vai trò trung tâm trong việc sàng lọc và chẩn đoán nhiều rối loạn tuyến giáp, giảm ở đầu thai kỳ do kích thích yếu các thụ thể TSH gây ra bởi số lượng đáng kể gonadotropin màng đệm người (hCG) trong 12 tuần đầu thai kỳ. Do đó, kích thích bài tiết hormone tuyến giáp, và kết quả làm tăng nồng độ thyroxine tự do (T4) trong huyết thanh, sau đó ức chế hormone giải phóng thyrotropin ở vùng dưới đồi, do đó hạn chế bài tiết TSH từ tuyến yên. Sau ba tháng đầu thai kỳ, nồng độ TSH trở về giá trị ban đầu và tăng dần trong ba tháng cuối liên quan đến sự tăng trưởng của nhau thai và sự sản xuất deiodinase nhau thai (2). Các thay đổi sinh lý này nên được xem xét khi diễn giải kết quả xét nghiệm chức năng tuyến giáp (Bảng 1) trong thai kỳ.
Bảng 1. Các thay đổi kết quả xét nghiệm chức năng tuyến giáp trong bệnh lý tuyến giáp
| Tình trạng mẹ | TSH* | T4 tự do |
|---|---|---|
| Cường giáp lâm sàng | Giảm | Tăng |
| Cường giáp dưới lâm sàng | Giảm | Không thay đổi |
| Suy giáp lâm sàng | Giảm | Giảm |
| Suy giáp dưới lâm sàng | Tăng | Không thay đổi |
Viết tắt : T4 , thyroxine ; TSH, hormone kích thích tuyến giáp
* Nồng độ TSH giảm ở đầu thai kỳ bởi kích thích yếu thụ thể TSH do lượng gonadotropin màng đệm người đáng kể trong 12 tuần đầu tiên của thai kỳ. Sau tam cá nguyệt thứ nhất, nồng độ TSH trở về giá trị ban đầu.
2.2 Xét nghiệm chức năng tuyến giáp trong thai kỳ
Tốt nhất, các khoảng tham chiếu về chức năng tuyến giáp trong thai kỳ được thiết lập ở mức quần thể tại chỗ với thai phụ không mắc bệnh lý tuyến giáp. Hiệp hội tuyến giáp Hoa Kỳ khuyến cáo rằng khi không có sẵn khoảng tham chiếu tại chỗ, khoảng tham chiếu dưới cho TSH có thể giảm 0,4 mU/L và khoảng tham chiếu trên cho TSH có thể giảm 0,5 mU/L vào cuối tam cá nguyệt thứ nhất (3). Ngoài tam cá nguyệt thứ nhất, TSH bình thường hóa trở lại khoảng tham chiếu như không mang thai (3) và có thể sử dụng khoảng tham chiếu như ở người không mang thai. Các khoảng tham chiếu cho T4 toàn phần và T3 toàn phần cũng nên được điều chỉnh với thai kỳ. Giới hạn trên của khoảng tham chiếu cho T4 toàn phần và T3 toàn phần có thể tăng khoảng 50% sau 16 tuần tuổi thai (3, 4). Trước 16 tuần tuổi thai, nồng độ T4 toàn phần và T3 toàn phần tăng dần so với người lớn không mang thai. Những điều chỉnh này đối với khoảng tham chiếu của T4 toàn phần và T3 toàn phần là cần thiết để giải thích cho sự gia tăng globulin liên kết với tuyến giáp trong thai kỳ (3).
2.3 Chức năng tuyến giáp thai nhi
Tuyến giáp thai nhi bắt đầu tập trung iod và tổng hợp hormone tuyến giáp khi thai được khoảng 12 tuần tuổi (5, 6). Điều đó nói lên rằng, T4 của mẹ được truyền sang thai nhi trong toàn bộ thai kỳ và rất quan trọng cho sự phát triển não bộ bình thường của thai nhi, đặc biệt là trước khi tuyến giáp thai nhi bắt đầu hoạt động (7). Khoảng 30% T4 trong huyết thanh dây rốn khi sinh có nguồn gốc từ mẹ (8). Tiền sử rối loạn tuyến giáp của mẹ và đặc biệt là sử dụng Propylthiouracil hoặc methimazole trong thai kỳ, hoặc tiền sử đã biết về các kháng thể kháng thụ thể tuyến giáp ở mẹ nên được thông báo cho bác sĩ sơ sinh hoặc bác sĩ nhi khoa, những người sẽ chăm sóc trẻ sau sinh vì chúng có thể tác động xấu đến chức năng tuyến giáp trẻ sơ sinh.
2.4 Cường giáp

Nồng độ TSH giảm và nồng độ T4 tự do tăng đặc trưng cho tình trạng cường giáp lâm sàng (Bảng 1). Cường giáp xảy ra ở 0,2 - 0,7% thai kỳ và bệnh Graves chiếm 95% các trường hợp này (9, 10). Các dấu hiệu và triệu chứng của cường giáp bao gồm bồn chồn, lo lắng, run tay, nhịp tim nhanh, tiêu chảy, đổ mồ hôi nhiều, không chịu được nóng, sút cân, bướu cổ, mất ngủ, hồi hộp trống ngực và tăng huyết áp. Các đặc điểm riêng biệt của bệnh Graves là bệnh về mắt (các dấu hiệu bao gồm lid lag và co rút mí mắt) và bệnh về da (các dấu hiệu bao gồm phù niêm khu trú hoặc trước xương chày). Mặc dù một số triệu chứng của cường giáp tương tự như các triệu chứng bình thường của thai kỳ hoặc một số bệnh không liên quan đến tuyến giáp, nhưng kết quả xét nghiệm chức năng tuyến giáp huyết thanh có thể giúp phân biệt bệnh tuyến giáp với các bệnh này. Nhiễm độc giáp ở mẹ được điều trị không đầy đủ có liên quan đến nguy cơ tiền sản giật với các biểu hiện nặng, suy tim ở mẹ và bão giáp cao hơn so với nhiễm độc giáp ở mẹ được điều trị, đã được kiểm soát (11–14).
2.5 Ảnh hưởng đối với thai nhi và trẻ sơ sinh

Nhìn chung, kết cục thai kỳ phụ thuộc vào việc kiểm soát chuyển hóa đã đạt được trước và trong khi mang thai hay chưa (15). Cường giáp được điều trị không đầy đủ có liên quan đến gia tăng các ca sinh non được chỉ định về mặt y tế, cân nặng khi sinh thấp, sẩy thai và thai chết lưu (11, 12, 16, 17). Nguy cơ đối với thai nhi và trẻ sơ sinh liên quan đến bệnh Graves có liên quan đến bản thân bệnh này hoặc liên quan đến việc điều trị bệnh bằng thioamide (propylthiouracil hoặc methimazole). Do sự tồn tại dai dẳng các kháng thể của mẹ, khả năng nhiễm độc giáp thai nhi nên được xem xét ở tất cả thai phụ có tiền sử bệnh Graves (9). Nhiễm độc giáp thai nhi thường biểu hiện với nhịp tim thai nhanh và thai tăng trưởng kém. Nếu nghi ngờ nhiễm độc giáp thai nhi, cần tham vấn ý kiến bác sĩ lâm sàng có chuyên môn về các bệnh lý như vậy.
Do một tỷ lệ lớn bệnh tuyến giáp ở thai phụ là do các kháng thể đi qua nhau thai, có mối lo ngại về nguy cơ phát triển bệnh suy giáp và cường giáp qua trung gian miễn dịch ở trẻ sơ sinh. Thai phụ bị Graves có thể có globulin miễn dịch kích thích tuyến giáp (TSI) và globulin miễn dịch ức chế liên kết TSH (còn được gọi là globulin miễn dịch ức chế liên kết thyrotropin) tương ứng có thể kích thích hoặc ức chế tuyến giáp của thai nhi. Trong một số trường hợp, các globulin miễn dịch ức chế liên kết TSH của mẹ có thể gây suy giáp thoáng qua ở trẻ sơ sinh của thai phụ bị Graves (18, 19). Ngoài ra, 1–5% trong số những trẻ sơ sinh này bị cường giáp hoặc bệnh Graves sơ sinh do globulin miễn dịch kích thích tuyến giáp của mẹ đi qua nhau thai (20, 21). Ở trẻ sơ sinh, các kháng thể của mẹ được đào thải chậm hơn thioamid, điều này đôi khi dẫn đến chậm biểu hiện bệnh Graves ở trẻ sơ sinh (21). Do đó, bác sĩ nhi khoa nên được thông báo về bệnh Graves ở mẹ tại thời điểm sinh và trẻ sơ sinh nên được theo dõi về khả năng phát triển bệnh Graves (21). Tỷ lệ mắc bệnh Graves ở trẻ sơ sinh không liên quan đến chức năng tuyến giáp hiện tại của mẹ. Trẻ sơ sinh của sản phụ mắc bệnh Graves đã được điều trị bằng phẫu thuật hoặc iod-131 phóng xạ trước khi mang thai và mẹ không cần điều trị bằng thioamide, vẫn có thể có kháng thể lưu hành, do đó vẫn có nguy cơ mắc bệnh Graves sơ sinh và nên được theo dõi thích hợp (3).
2.6 Cường giáp dưới lâm sàng
Cường giáp dưới lâm sàng, được báo cáo ở 0,8–1,7% thai phụ (22, 23), đặc trưng bởi nồng độ TSH huyết thanh thấp bất thường với nồng độ T4 tự do trong khoảng tham chiếu bình thường (24) (Bảng 1). Điều quan trọng là nó không liên quan đến các kết cục thai kỳ bất lợi (22, 25, 26). Không khuyến cáo điều trị cho thai phụ bị cường giáp dưới lâm sàng vì không cho thấy lợi ích đối với mẹ hoặc thai nhi. Ngoài ra, về mặt lý thuyết, có những nguy cơ đối với thai nhi vì thuốc kháng giáp đi qua nhau thai và có thể ảnh hưởng xấu đến chức năng tuyến giáp của thai nhi.
2.7 Suy giáp

Suy giáp lâm sàng làm phức tạp 2-10 trên 1.000 thai kỳ (10). Suy giáp được chẩn đoán dựa trên các giá trị xét nghiệm với TSH trên giới hạn trên của khoảng tham chiếu bình thường và T4 tự do dưới giới hạn dưới của khoảng tham chiếu bình thường (Bảng 1). Suy giáp có thể biểu hiện với các dấu hiệu lâm sàng không đặc hiệu, mà không thể phân biệt được với các dấu hiệu hoặc triệu chứng thông thường của thai kỳ, như mệt mỏi, táo bón, không chịu được lạnh, chuột rút và tăng cân. Các dấu hiệu lâm sàng khác bao gồm phù, da khô, rụng tóc và pha thư giãn của phản xạ gân sâu kéo dài. Bướu cổ có thể có hoặc không và có khả năng cao xảy ra ở thai phụ bị viêm tuyến giáp Hashimoto (còn được gọi là bệnh Hashimoto) hoặc những người sống ở vùng thiếu Iod là bệnh dịch. Viêm tuyến giáp hashimoto là nguyên nhân phổ biến nhất gây suy giáp trong thai kỳ và đặc trưng bởi sự phá hủy tuyến giáp do các tự kháng thể, đặc biệt là kháng thể Peroxidase kháng giáp.
Cần bổ sung iod đầy đủ cho mẹ để tổng hợp T4 ở mẹ và thai nhi. Phần lớn thai phụ sống ở Hoa Kỳ được bổ sung iod đầy đủ (3). Tuy nhiên, khi so với các nhóm phụ nữ khác có cùng mức iod thấp, phụ nữ trong độ tuổi sinh sản có nguy cơ mắc bệnh cao hơn. Lượng iod được khuyến cáo trong chế độ ăn hàng ngày là 220 microgam đối với phụ nữ mang thai và 290 microgam đối với phụ nữ đang cho con bú (27). Lợi ích của việc bổ sung iod thường xuyên trong thai kỳ, đặc biệt thai phụ sống ở những vùng thiếu iod nhẹ, chưa được xác định rõ ràng (28, 29). Cần lưu ý rằng không phải lúc nào iod cũng có trong các loại vitamin tổng hợp bổ sung, bao gồm cả vitamin trước sinh. Hơn nữa, không phải loại muối nào bán trên thị trường cũng được bổ sung thêm iod.
Các kết cục chu sinh bất lợi như sẩy thai tự nhiên, tiền sản giật, sinh non, nhau bong non và thai chết lưu có liên quan đến suy giáp lâm sàng không được điều trị (30, 31). Liệu pháp thay thế hormone tuyến giáp đầy đủ trong thai kỳ ở phụ nữ bị suy giáp lâm sàng sẽ giảm thiểu nguy cơ mắc các kết cục bất lợi (32, 33).
2.8 Ảnh hưởng đối với thai nhi và trẻ sơ sinh
Suy giáp lâm sàng ở mẹ khi không được điều trị có liên quan đến tăng nguy cơ sinh con nhẹ cân và suy giảm sự phát triển tâm thần kinh của con (25, 31). Tuy nhiên, hiếm khi các kháng thể ức chế tuyến giáp của mẹ đi qua nhau thai và gây suy giáp ở thai nhi. Tỷ lệ suy giáp thai nhi ở con của những phụ nữ bị viêm tuyến giáp Hashimoto được ước tính chỉ là 1 trên 180.000 trẻ sơ sinh (34).
2.9 Suy giáp dưới lâm sàng
Nồng độ TSH huyết thanh tăng nhưng nồng độ T4 tự do bình thường đặc trưng cho tình trạng suy giáp dưới lâm sàng (24) (Bảng 1). Tỷ lệ suy giáp dưới lâm sàng trong thai kỳ được ước tính là 2–5% (10, 35-37). Ở phụ nữ khỏe mạnh, trong thai kỳ, suy giáp dưới lâm sàng không có khả năng tiến triển thành suy giáp lâm sàng.
Suy giáp dưới lâm sàng trong thai kỳ ngày càng được quan tâm bởi hai nghiên cứu quan sát gợi ý rằng tình trạng giảm chức năng tuyến giáp ở mẹ chưa được chẩn đoán có thể liên quan đến sự suy giảm phát triển thần kinh ở con (38, 39). Tuy nhiên, một thử nghiệm ngẫu nhiên có đối chứng lớn được công bố vào năm 2012, Controlled Antenatal Thyroid Screening (được gọi là CATS), và Maternal–Fetal Medicine Units Network’s Randomized Trial of Thyroxine Therapy for Subclinical Hypothyroidism hoặc Hypothyroxinemia Diagnosed During Pregnancy được công bố vào năm 2017 đã chứng minh không có sự khác biệt về sự phát triển nhận thức thần kinh ở trẻ em đến 5 tuổi được sinh ra từ những sản phụ được sàng lọc và điều trị suy giáp dưới lâm sàng (40, 41). Hơn nữa, theo dõi trẻ em từ nghiên cứu CATS đến 9 tuổi xác nhận rằng không có sự cải thiện về phát triển thần kinh ở con của những sản phụ được điều trị (42). Trong một số nghiên cứu, suy giáp dưới lâm sàng ở mẹ cho thấy có liên quan với tỷ lệ sinh non, nhau bong non, nhập viện vào đơn vị chăm sóc đặc biệt, tiền sản giật với các dấu hiệu nặng và đái tháo đường thai kỳ cao hơn (25, 26, 35, 43 ). Tuy nhiên, các nghiên cứu khác đã không xác định được mối liên hệ giữa suy giáp dưới lâm sàng ở mẹ và các kết cục sản khoa bất lợi này (17, 36, 44). Hiện tại, không có bằng chứng nào cho thấy việc xác định và điều trị suy giáp dưới lâm sàng trong thai kỳ giúp cải thiện các kết cục này (40-42, 45).
3 Cân nhắc và khuyến cáo lâm sàng
3.1 Những thai phụ nào nên tầm soát bệnh lý tuyến giáp?
Không khuyến cáo tầm soát thường quy bệnh lý tuyến giáp trong thai kỳ vì việc xác định và điều trị suy giáp dưới lâm sàng ở mẹ không được chứng minh là giúp cải thiện kết cục thai kỳ và chức năng nhận thức - thần kinh ở con. Chỉ định xét nghiệm chức năng tuyến giáp nên được thực hiện ở thai phụ có tiền sử bản thân hoặc gia đình mắc bệnh lý tuyến giáp, đái tháo đường loại 1 hoặc nghi ngờ bệnh lý tuyến giáp trên lâm sàng. Không chỉ định các xét nghiệm chức năng tuyến giáp ở thai phụ có tuyến giáp to nhẹ vì tuyến giáp thường to ra lên đến 30% trong thai kỳ (46). Ở thai phụ có bướu cổ đáng kể hoặc các nhân tuyến giáp rõ ràng, xét nghiệm chức năng tuyến giáp là thích hợp, vì các dấu hiệu khi khám lâm sàng này sẽ được coi là nằm ngoài giới hạn bình thường có thể chấp nhận được đối với thai kỳ.
Kết quả của nghiên cứu CATS và Maternal–Fetal Medicine Units Network’s Randomized Trial of Thyroxine Therapy for Subclinical Hypothyroidism hoặc thử nghiệm Hypothyroxinemia Diagnosed During Pregnancy năm 2017 chứng minh rằng việc sàng lọc và điều trị thai phụ bị suy giáp dưới lâm sàng trong thai kỳ không giúp cải thiện chức năng nhận thức của con họ lần lượt ở 3 tuổi và 5 tuổi (40, 41). Do đó, American College of Obstetricians and Gynecologists, the Endocrine Society, và the American Association of Clinical Endocrinologists khuyến cáo không tầm soát thường quy bệnh lý tuyến giáp trong thai kỳ và chỉ nên xét nghiệm trong thai kỳ cho những thai phụ tăng nguy cơ bị suy giáp lâm sàng (47, 48 ). Hội tuyến giáp Hoa Kỳ hiện tại nhận thấy rằng không có đủ dữ liệu để khuyến cáo hoặc chống lại việc tầm soát thường quy bệnh lý tuyến giáp (3).
3.2 Những xét nghiệm nào được dùng để chẩn đoán bệnh lý tuyến giáp trong thai kỳ?
Cả TSH và hormone tuyến giáp đều được sử dụng để chẩn đoán bệnh lý tuyến giáp trong thai kỳ (Hình 1). Nếu được chỉ định, xét nghiệm sàng lọc đầu tay nên định lượng để đánh giá tình trạng tuyến giáp đó là TSH. Giả sử chức năng tuyến yên-vùng dưới đồi bình thường, tồn tại mối quan hệ tuyến tính nghịch giữa TSH và hormone tuyến giáp trong huyết thanh, như vậy các thay đổi nhỏ ở nồng độ hormone lưu hành cũng sẽ tạo ra những thay đổi lớn ở TSH. Hơn nữa, vì các xét nghiệm hormone tự do được sử dụng bởi hầu hết các phòng xét nghiệm lâm sàng không dùng các kỹ thuật phân tách vật lý, chẳng hạn như thẩm tách trạng thái cân bằng (equilibrium dialysis), kết quả xét nghiệm phụ thuộc vào nồng độ protein liên kết riêng lẻ và chỉ là ước tính nồng độ T4 tự do lưu hành thực sự. Do đó, TSH là chỉ số đáng tin cậy nhất về tình trạng tuyến giáp vì nó gián tiếp phản ánh nồng độ hormone tuyến giáp do tuyến yên cảm nhận. Khi nồng độ TSH cao hoặc thấp bất thường, nên thực hiện xét nghiệm tiếp theo là đo nồng độ T4 tự do để xác định xem liệu có rối loạn chức năng tuyến giáp lâm sàng hay không. Trong trường hợp nghi ngờ cường giáp, cũng nên đo nồng độ T3 toàn phần (Hình 1). T3 toàn phần được ưu tiên sử dụng hơn T3 tự do vì các xét nghiệm để ước tính T3 tự do có độ tin cậy kém hơn so với các xét nghiệm đo T4 tự do (4). Nên theo dõi nồng độ T4 tự do ở thai phụ đang điều trị cường giáp, và liều lượng thuốc kháng giáp (thioamide) nên được điều chỉnh sao cho phù hợp để đạt được nồng độ T4 tự do ở giới hạn trên bình thường trong thai kỳ. Trong số thai phụ mà cũng bị nhiễm độc giáp với T3, nên theo dõi T3 toàn phần với nồng độ mục tiêu ở giới hạn trên bình thường trong thai kỳ.
3.3 Các thuốc nên được dùng để điều trị cường giáp lâm sàng trong thai kỳ, và các thuốc này được dùng và điều chỉnh trong thai kỳ như thế nào?

Thai phụ bị cường giáp lâm sàng nên được điều trị bằng thuốc kháng giáp (thioamide). Có thể dùng propylthiouracil hoặc methimazole, cả hai loại thioamide đều dùng để điều trị cho thai phụ bị cường giáp lâm sàng. Việc lựa chọn thuốc phụ thuộc vào tam cá nguyệt thai kỳ, đáp ứng với trị liệu trước đó và liệu nhiễm độc giáp chiếm ưu thế là T4 hay T3. Thai phụ nên được tư vấn về các nguy cơ và lợi ích của hai loại thioamid được mô tả dưới đây bằng cách cùng đưa ra quyết định chung để xây dựng một kế hoạch điều trị thích hợp.
Methimazole thường được tránh trong tam cá nguyệt thứ nhất vì có liên quan đến một bệnh lý phôi thai hiếm gặp, đặc trưng bởi teo thực quản hoặc chít hẹp lỗ mũi sau cũng như bất sản lớp biểu bì, khiếm khuyết da bẩm sinh (49). Trong một tổng quan năm 2012 trên 5.967 trẻ sinh sống ở những thai phụ đã biết mắc bệnh Graves, nguy cơ dị tật thai lớn cao gấp 2 lần ở những người phơi nhiễm với methimazole so với những người phơi nhiễm với propylthiouracil (49). Cụ thể, 7 trong số 9 trường hợp bất sản lớp biểu bì, và chỉ có 1 trường hợp bị teo thực quản, xảy ra ở trẻ sơ sinh phơi nhiễm với methimazole. Do đó, propylthiouracil thường được kê đơn để kiểm soát cường giáp trong ba tháng đầu thai kỳ.
Sau ba tháng đầu thi kỳ, có thể sử dụng methimazole hoặc propylthiouracil để điều trị cường giáp. Trong một số trường hợp hiếm gặp, propylthiouracil gây độc tính đáng kể trên lâm sàng (4), điều này đã thúc đẩy một số bác sĩ lâm sàng chuyển sang dùng methimazole sau ba tháng đầu. Tuy nhiên, việc chuyển đổi từ propylthiouracil sang methimazole có thể dẫn đến tình trạng cường giáp được kiểm soát kém. Cả hai loại thuốc đều có những tác dụng phụ đã biết và phải được cân nhắc với nhau và thảo luận với bệnh nhân (4). Do đó, một số thai phụ được dùng duy trì propylthiouracil trong suốt thai kỳ. Ngoài ra, propylthiouracil làm giảm chuyển đổi T4 thành T3 và được ưu tiên dùng cho nhiễm độc giáp với T3 chiếm ưu thế (4). Quyết định liên quan đến việc chuyển đổi từ thuốc này sang thuốc khác và cách chuyển đổi thường được thảo luận cùng với các bác sĩ chuyên khoa về nội tiết hoặc y học mẹ - bào thai. Nếu việc chuyển đổi được cho là phù hợp, tỷ lệ liều lượng propylthiouracil/methimazole được khuyến cáo là 20:1 (Hình 1).
Giảm bạch cầu thoáng qua xảy ra lên tới 10% thai phụ khi dùng thuốc thioamide, nhưng tình trạng này không cần ngừng điều trị. Tuy nhiên, < 1% bệnh nhân dùng thuốc thioamide, đột ngột xuất hiện chứng mất bạch cầu hạt và bắt buộc phải ngừng thuốc. Sự xuất hiện tình trạng mất bạch cầu hạt không liên quan đến liều lượng, và vì tình trạng này khởi phát cấp tính nên xét nghiệm số lượng bạch cầu nối tiếp trong khi điều trị là không hữu ích. Do đó, nếu bị sốt hoặc đau họng, thai phụ được hướng dẫn ngừng thuốc ngay lập tức và báo cáo cho bác sĩ để xét nghiệm công thức máu toàn bộ (50).
Liều lượng thioamide ban đầu được dùng theo kinh nghiệm. Nếu chọn propylthiouracil, có thể bắt đầu dùng liều uống 100–600 mg/ngày, chia ba lần, tùy thuộc vào mức độ nặng trên lâm sàng (3). Liều thông thường ở bệnh nhân trung bình là 200-400 mg/ngày. Nếu dùng methimazole, khuyến cáo dùng liều uống khởi đầu hàng ngày là 5–30 mg, chia hai lần (mặc dù tần suất có thể giảm xuống một lần mỗi ngày khi liệu pháp duy trì được thiết lập). Mục tiêu là điều trị với liều thioamide thấp nhất có thể để duy trì nồng độ T4 tự do cao hơn một chút hoặc trong giới hạn bình thường cao, bất kể nồng độ TSH (3). Ở thai phụ nhiễm độc giáp với T3 chiếm ưu thế, nên theo dõi T3 toàn phần.
Thuốc chẹn beta có thể được dùng như một liệu pháp bổ trợ cho tình trạng hồi hộp trống ngực có triệu chứng. Propranolol là thuốc được ưu tiên trong thai kỳ và được bắt đầu với liều 10–40 mg, uống ba đến bốn lần mỗi ngày (4).
3.4 Các thuốc nên được dùng để điều trị suy giáp lâm sàng trong thai kỳ, và các thuốc này được dùng và điều chỉnh trong thai kỳ như thế nào?
Thai phụ bị suy giáp lâm sàng nên được điều trị bằng liệu pháp thay thế hormone tuyến giáp đầy đủ để giảm thiểu nguy cơ các kết cục bất lợi. Để điều trị suy giáp lâm sàng trong thai kỳ, hiệp hội tuyến giáp Hoa Kỳ và hiệp hội các bác sĩ nội tiết lâm sàng Hoa Kỳ khuyến cáo liệu pháp thay thế T4, bắt đầu bằng levothyroxine với liều 1-2 microgam/kg/ngày hoặc khoảng 100 microgam/ngày (3, 30). Thai phụ không còn chức năng tuyến giáp sau khi cắt bỏ tuyến giáp hoặc điều trị bằng iod phóng xạ có thể cần liều lượng cao hơn. Nên tránh dùng các chế phẩm hormone tuyến giáp có chứa T3 (ví dụ, chiết xuất tuyến giáp sấy khô hoặc T3 tổng hợp) trong thai kỳ vì lượng T3 cao so với T4 trong các chế phẩm này dẫn đến nồng độ T3 của mẹ trên mức sinh lý và nồng độ T4 thấp. Để hệ thần kinh trung ương của thai nhi phát triển tốt, rất cần hormone T4 của mẹ (3).
Không giống như thai phụ bị cường giáp, đánh giá điều trị ở thai phụ bị suy giáp được hướng dẫn bằng cách đo nồng độ TSH thay vì nồng độ T4 tự do. Nên theo dõi nồng độ TSH ở thai phụ đang được điều trị suy giáp, và liều levothyroxine nên được điều chỉnh sao cho phù hợp với mức TSH mục tiêu giữa giới hạn dưới của khoảng tham chiếu và 2,5 milliunits/L. Hormone kích thích tuyến giáp thường được đánh giá sau mỗi 4–6 tuần trong khi điều chỉnh thuốc (3, 46).
Mang thai có liên quan đến việc tăng nhu cầu T4 ở khoảng 1/3 phụ nữ đang được bổ sung hormone tuyến giáp (51, 52). Nồng độ estrogen tăng dường như làm gia tăng nhu cầu T4 (53). Có thể cân nhắc tăng 25% liều thay thế T4 trước khi xác nhận có thai đối với những phụ nữ đang điều trị suy giáp đã biết ở thời điểm đến khám tiền sản.
3.5 Vai trò của việc tầm soát hoặc xét nghiệm các tự kháng thể tuyến giáp trong thai kỳ?
Đo lượng kháng thể kháng giáp trong các trường hợp rối loạn chức năng tuyến giáp lâm sàng và dưới lâm sàng đã được đề xuất. Các tự kháng thể đối với peroxidase tuyến giáp và thyroglobulin đã được xác định lên tới 20% phụ nữ trong độ tuổi sinh sản (54). Phụ nữ có các kháng thể peroxidase tuyến giáp tăng nguy cơ tiến triển thành bệnh tuyến giáp và phát triển bệnh viêm tuyến giáp sau sinh (55). Tuy nhiên, hầu hết những người có kết quả xét nghiệm dương tính với các kháng thể này đều ở trạng thái bình giáp.
Không khuyến cáo xét nghiệm thường quy tìm kháng thể peroxidase kháng giáp ở phụ nữ bình giáp (ví dụ: không có tiền sử bệnh lý tuyến giáp và xét nghiệm chức năng tuyến giáp bình thường) vì việc thay thế hormone tuyến giáp đối với kháng thể peroxidase kháng giáp đơn thuần không cho thấy cải thiện kết cục thai kỳ. Trong một phân tích hệ thống dữ liệu từng bệnh nhân bao gồm 47.045 thai phụ, tình trạng kháng thể peroxidase tuyến giáp vẫn liên quan đáng kể với sinh non sau khi điều chỉnh suy giáp dưới lâm sàng (43). Tuy nhiên, trong hai thử nghiệm sau đó, liệu pháp levothyroxine, khi được so sánh với không điều trị hoặc giả dược, không làm giảm tỷ lệ sinh non hoặc cải thiện các kết cục khác ở phụ nữ bình giáp dương tính với kháng thể peroxidase tuyến giáp (56, 57). Tương tự, không có tương tác nào giữa tình trạng kháng thể peroxidase tuyến giáp và nhóm điều trị trong Maternal–Fetal Medicine Units Network’s Randomized Trial of Thyroxine Therapy for Subclinical Hypothyroidism hoặc Hypothyroxinemia Diagnosed During Pregnancy công bố vào năm 2017, không cho thấy sự khác biệt về phát triển nhận thức thần kinh ở con hoặc kết cục thai kỳ ở phụ nữ được điều trị bằng levothyroxine (41).
Xác định các kháng thể tuyến giáp bao gồm kháng thể kháng thụ thể tuyến giáp và globulin miễn dịch kích thích tuyến giáp ở phụ nữ bị bệnh Graves có thể xác định được thai phụ có thai nhi hoặc trẻ sơ sinh gia tăng nguy cơ mắc cường giáp (3). Xác định các kháng thể này có thể giúp tăng cường theo dõi thai nhi với đánh giá tăng trưởng nối tiếp bằng siêu âm hoặc theo dõi thai nhi trước sinh. Một số bác sĩ lâm sàng có thể sử dụng tình trạng kháng thể để hướng dẫn tần suất đánh giá thai nhi ở thai phụ bị cường giáp, trong khi một số bác sĩ khác có thể lựa chọn đánh giá huyết thanh bất kể tình trạng kháng thể. Do đó, xét nghiệm có thể không ảnh hưởng đến việc quản lý và không có bằng chứng mạnh để đánh giá thường quy các kháng thể này. Trong các trường hợp cường giáp trong thai kỳ, tham khảo ý kiến của bác sĩ chuyên khoa y học mẹ - bào thai có thể hữu ích trong việc lập kế hoạch xét nghiệm và quản lý.
3.6 Các thay đổi trong chức năng tuyến giáp xảy ra với ốm nghén nặng, và có nên thực hiện xét nghiệm chức năng tuyến giáp thường quy ở thai phụ bị ốm nghén nặng hay không?
Trong giai đoạn đầu thai kỳ, các đặc điểm sinh hóa thoáng qua của cường giáp có thể gặp ở 3–11% thai phụ (58, 59). Nhiều thai phụ bị ốm nghén nặng có nồng độ T4 huyết thanh cao bất thường và nồng độ TSH thấp. Trong một tổng quan hệ thống năm 2014 về các dấu ấn đối với ốm nghén nặng, 2/3 trong số 34 nghiên cứu đã công bố phân tích chức năng tuyến giáp cho thấy nồng độ TSH giảm hoặc nồng độ T4 tự do tăng ở thai phụ có triệu chứng khi so sánh với thai phụ không có các triệu chứng ốm nghén nặng (60). Các bất thường về chức năng tuyến giáp này là kết quả của sự kích thích thụ thể TSH do nồng độ hCG cao.
Cường giáp sinh lý này, còn được gọi là cường giáp thai kỳ thoáng qua, có thể liên quan đến đa thai hoặc chửa trứng. Thai phụ bị cường giáp thai kỳ thoáng qua hiếm khi có triệu chứng và điều trị bằng thuốc thioamide không cho thấy có lợi ích (30) và do đó, không được khuyến cáo. Hơn nữa, cường giáp thai kỳ thoáng qua không liên quan đến kết cục thai kỳ xấu (59). Quản lý mong đợi ở những thai phụ bị ốm nghén nặng và kết quả xét nghiệm chức năng tuyến giáp bất thường thường dẫn đến giảm nồng độ T4 tự do trong huyết thanh song song với giảm nồng độ hCG sau tam cá nguyệt thứ nhất. Tuy nhiên, nồng độ TSH có thể vẫn bị ức chế trong vài tuần sau khi nồng độ T4 tự do trở về bình thường (37). Do đó, không khuyến cáo xét nghiệm chức năng tuyến giáp ở những bệnh nhân bị ốm nghén nặng trừ khi có các dấu hiệu rõ ràng khác của cường giáp lâm sàng.
3.7 Chẩn đoán và điều trị bão giáp và suy tim do nhiễm độc giáp trong thai kỳ như thế nào ?
Trong thai kỳ, bão giáp và suy tim do nhiễm độc giáp là những tình trạng hiếm gặp, cấp tính và đe dọa tính mạng. Bão giáp trong thai kỳ có nguy cơ cao gây suy tim ở mẹ (61). Bão giáp được đặc trưng bởi tình trạng tăng chuyển hóa do quá nhiều hormone tuyến giáp. Đây là một chẩn đoán lâm sàng trong bối cảnh nhiễm độc giáp nặng kèm theo mất bù toàn thân (4). Hệ thống chấm điểm lâm sàng như Thang điểm Burch-Wartofsky có thể được dùng để xác nhận chẩn đoán và đánh giá mức độ nặng của bệnh. Bão giáp thường biểu hiện trên lâm sàng như là sự kết hợp của các dấu hiệu và triệu chứng sau: sốt, nhịp tim nhanh, rối loạn nhịp tim và rối loạn chức năng hệ thần kinh trung ương (4).
Suy tim và tăng áp động mạch phổi do bệnh cơ tim do tác dụng của quá nhiều T4 trên cơ tim thường gặp hơn trong thai kỳ so với bão giáp và đã được xác định ở 9% thai phụ bị cường giáp không được kiểm soát (61). Tình trạng mất bù thường được khởi phát bởi tiền sản giật, thiếu máu, nhiễm khuẩn huyết hoặc sự kết hợp của các tình trạng này. Thông thường, bệnh cơ tim và tăng áp động mạch phổi do T4 có thể đảo ngược. (61–63).
Nếu nghi ngờ bão giáp hoặc suy tim do nhiễm độc giáp, nên đánh giá nồng độ T4 tự do, T3 toàn phần và TSH trong huyết thanh để xác định chẩn đoán, nhưng không nên trì hoãn điều trị trong khi chờ đợi kết quả. Điều trị tương tự nhau đối với bão giáp và suy tim do nhiễm độc giáp trong thai kỳ và nên được thực hiện ở khu vực chăm sóc đặc biệt có thể bao gồm các đơn vị chăm sóc đặc biệt trong đơn vị chuyển dạ và sinh (Hộp 1).
Song song với việc điều trị bão giáp, cũng nên điều trị cả nguyên nhân nền khởi phát bệnh (ví dụ: nhiễm trùng, chấn thương). Điều quan trọng cũng cần lưu ý rằng ngay cả khi tình trạng thai nhi không an toàn trong giai đoạn cấp tính của bão giáp, nhưng tình trạng đó có thể cải thiện khi tình trạng của người mẹ ổn định. Nhìn chung, cần thận trọng để tránh chấm dứt thai kỳ khi có bão giáp.
3.8 Đánh giá chức năng tuyến giáp ở thai nhi như thế nào?

Tiền sử cường giáp ở mẹ có thể dẫn đến nhiễm độc giáp thai nhi bất kể tình trạng tuyến giáp của mẹ hiện tại. Do đó, chẩn đoán nhiễm độc giáp thai nhi nên được xem xét trong các trường hợp cường giáp ở mẹ có biến chứng phù thai, thai giới hạn tăng trưởng, bướu cổ thai nhi hoặc nhịp tim thai nhanh dai dẳng (64). Trong trường hợp nghi ngờ nhiễm độc giáp thai nhi, khuyến cáo tham vấn ý kiến của bác sĩ chuyên khoa y học mẹ - bào thai (64). Không khuyến cáo đánh giá thường quy chức năng tuyến giáp thai nhi bằng siêu âm để đánh giá bướu cổ hoặc qua mẫu máu cuống rốn (65, 66). Mẫu máu cuống rốn chỉ được dùng trong một số ít trường hợp khi không thể loại trừ một cách hợp lý bệnh lý tuyến giáp thai nhi bằng các đánh giá thai không xâm lấn chẳng hạn như siêu âm và giám sát trước sinh (3, 47).
3.9 Đánh giá nhân giáp hoặc ung thư tuyến giáp trong thai kỳ như thế nào ?
Các nhân tuyến giáp được phát hiện ở 1–2% phụ nữ trong độ tuổi sinh sản và tỷ lệ tăng theo tuổi (37). Quản lý nhân tuyến giáp có thể sờ thấy được trong thai kỳ phụ thuộc vào phân tầng nguy cơ bao gồm các yếu tố như tuổi thai và kích thước của nhân. Vì vậy, khi thai phụ có nhân giáp nên hỏi bệnh sử, khám lâm sàng toàn diện, xét nghiệm TSH huyết thanh và siêu âm vùng cổ. Siêu âm phát hiện một cách đáng tin cậy các nhân > 0,5 cm. Ước tính rằng 90-95% các nhân giáp đơn độc là lành tính (67, 68). Các đặc điểm trên hình ảnh siêu âm liên quan đến bệnh ác tính bao gồm khối giảm âm, bờ không đều và vi vôi hóa (69). Khi có cả ba đặc điểm trên, tương quan với nguy cơ ác tính > 70% (3). Nếu kết quả siêu âm nghi ngờ bệnh lý ác tính, có thể thực hiện chọc hút tế bào bằng kim nhỏ (FNA) để kiểm tra mô bệnh học, bao gồm chất chỉ điểm khối u và nhuộm miễn dịch để đánh giá độ ác tính (67, 70). Không khuyến cáo xạ hình bằng iod phóng xạ trong thai kỳ vì về mặt lý thuyết có nguy cơ liên quan đến chiếu xạ thai nhi. Tuy nhiên, nếu vô tình dùng iod phóng xạ trước 12 tuần tuổi thai, hiệp hội tuyến giáp Hoa Kỳ lưu ý rằng tuyến giáp thai nhi chưa hoạt động chức năng đáng kể cho đến khoảng 12 tuần tuổi, vì vậy dường như không có nguy cơ bị tổn thương (3).
Đánh giá ung thư tuyến giáp trong thai kỳ bao gồm một cách tiếp cận đa chuyên khoa. Biệt hóa tốt và diễn tiến chậm là đặc điểm đặc trưng của hầu hết các carcinoma tuyến giáp. Khả năng ung thư tuyến giáp là một phần của hội chứng ung thư gia đình di truyền là khó xảy ra nhưng vẫn cần được xem xét. Khi bệnh lý ác tính tuyến giáp được chẩn đoán trong tam cá nguyệt thứ nhất hoặc thứ hai, có thể tiến hành cắt bỏ tuyến giáp trước tam cá nguyệt thứ ba, nhưng lo ngại vô tình cắt bỏ tuyến cận giáp thường dẫn đến lựa chọn trì hoãn phẫu thuật cho đến sau sinh. Ở thai phụ không có bằng chứng ung thư tuyến giáp tiến triển hoặc thai phụ được chẩn đoán ung thư tuyến giáp trong tam cá nguyệt thứ ba, có thể trì hoãn phẫu thuật sang giai đoạn ngay sau sinh (3, 69).
3.10 Chẩn đoán và điều trị viêm tuyến giáp sau sinh như thế nào?
Viêm tuyến giáp sau sinh được định nghĩa là rối loạn chức năng tuyến giáp trong vòng 12 tháng sau sinh có thể bao gồm các bằng chứng cường giáp, suy giáp hoặc cả hai trên lâm sàng. Viêm tuyến giáp tự miễn thoáng qua được phát hiện ở khoảng 5–10% phụ nữ trong năm đầu tiên sau sinh (55, 71). Xu hướng viêm tuyến giáp sau sinh có trước khi mang thai và có liên quan trực tiếp đến việc tăng nồng độ tự kháng thể tuyến giáp trong huyết thanh (55). Trong thực hành lâm sàng, viêm tuyến giáp sau sinh hiếm khi được chẩn đoán vì nó thường phát triển nhiều tháng sau sinh và gây ra các triệu chứng mơ hồ và không đặc hiệu (72).
Trên lâm sàng, viêm tuyến giáp sau sinh có biểu hiện rất đa dạng. Theo kinh điển, hai giai đoạn lâm sàng có thể nhận biết, có thể phát triển nối tiếp nhau. Nồng độ TSH và T4 tự do bất thường khởi phát mới xác nhận chẩn đoán của một trong hai giai đoạn. Thông thường, giai đoạn đầu được đặc trưng bởi nhiễm độc giáp do phá hủy, với các triệu chứng gây ra bởi sự giải phóng quá mức hormone tuyến giáp do phá vỡ nang tuyến giáp. Khởi phát đột ngột và thường thấy một bướu cổ nhỏ, không đau. Viêm tuyến giáp sau sinh có thể gây ra các triệu chứng cường giáp như mệt mỏi, dễ kích thích, sút cân, hồi hộp trống ngực hoặc không chịu được nóng (73). Giai đoạn nhiễm độc giáp này thường chỉ kéo dài vài tháng và thường chỉ có triệu chứng nhẹ. Điều trị bằng thioamide nhìn chung không hiệu quả, nhưng nếu các triệu chứng của bệnh nhân đủ nặng, thuốc chẹn beta có thể hữu ích. Giai đoạn thứ hai thông thường là suy giáp lâm sàng xảy ra từ 4 đến 8 tháng sau sinh, và tuyến giáp to cũng như các triệu chứng suy giáp như mệt mỏi, táo bón hoặc trầm cảm là phổ biến (73). Trong các trường hợp trầm cảm sau sinh, cũng như với bất kỳ chẩn đoán trầm cảm mới nào, sàng lọc TSH để loại trừ chẩn đoán rối loạn chức năng tuyến giáp là hợp lý (74).
Ở hầu hết phụ nữ bị viêm tuyến giáp sau sinh, tình trạng này sẽ tự thoái triển. Tuy nhiên, khoảng 1/3 số phụ nữ mắc một trong hai loại viêm tuyến giáp sau sinh cuối cùng sẽ phát triển thành suy giáp lâm sàng vĩnh viễn, và tỷ lệ tiến triển hàng năm là 3,6% (71, 73, 75–77). Những trường hợp này nên được quản lý với sự phối hợp của các bác sĩ chuyên khoa thích hợp và Hiệp hội tuyến giáp Hoa Kỳ khuyến cáo xét nghiệm chức năng tuyến giáp định kỳ để đánh giá suy giáp lâm sàng (3). Nguy cơ viêm tuyến giáp sau sinh và nguy cơ phát triển suy giáp vĩnh viễn tăng ở phụ nữ có tự kháng thể tuyến giáp, đặc biệt phụ nữ có hiệu giá kháng thể cao hơn.
4 Tóm tắt các khuyến cáo
Dựa vào bằng chứng khoa học tốt và nhất quán, chúng tôi đưa ra các khuyến cáo sau (Level A):
- Không khuyến cáo tầm soát thường quy bệnh lý tuyến giáp trong thai kỳ vì việc xác định và điều trị suy giáp dưới lâm sàng ở mẹ không được chứng minh là giúp cải thiện kết cục thai kỳ và chức năng nhận thức - thần kinh ở con
- Nếu được chỉ định, xét nghiệm sàng lọc đầu tay nên định lượng để đánh giá tình trạng tuyến giáp đó là TSH
- Nên theo dõi nồng độ TSH ở thai phụ đang được điều trị suy giáp, và liều levothyroxine nên được điều chỉnh sao cho phù hợp với mức TSH mục tiêu giữa giới hạn dưới của khoảng tham chiếu và 2,5 milliunits/L. Hormone kích thích tuyến giáp thường được đánh giá sau mỗi 4–6 tuần trong khi điều chỉnh thuốc.
- Thai phụ bị suy giáp lâm sàng nên được điều trị bằng liệu pháp thay thế hormone tuyến giáp đầy đủ để giảm thiểu nguy cơ các kết cục bất lợi.
- Nên theo dõi nồng độ T4 tự do ở thai phụ đang được điều trị cường giáp, và liều thuốc kháng giáp (thioamide) nên được điều chỉnh sao cho phù hợp để đạt được mức T4 tự do ở giới hạn trên của khoảng tham chiếu bình thường trong thai kỳ. Trong số thai phụ cũng bị nhiễm độc giáp với T3, T3 toàn phần nên được theo dõi với mức mục tiêu ở giới hạn trên của khoảng tham chiếu bình thường trong thai kỳ.
- Thai phụ bị cường giáp lâm sàng nên được điều trị bằng thuốc kháng giáp (thioamide).
Dựa vào bằng chứng khoa học hạn chế và không nhất quán, chúng tôi đưa ra các khuyến cáo sau (Level B):
- Có thể dùng propylthiouracil hoặc methimazole, cả hai loại thioamide đều dùng để điều trị cho thai phụ bị cường giáp lâm sàng. Việc lựa chọn thuốc phụ thuộc vào tam cá nguyệt thai kỳ, đáp ứng với trị liệu trước đó và liệu nhiễm độc giáp chiếm ưu thế là T4 hay T3
Chủ yếu dựa vào sự đồng thuận và ý kiến chuyên gia, chúng tôi đưa ra các khuyến cáo sau (Level C):
- Chỉ định xét nghiệm chức năng tuyến giáp nên được thực hiện ở thai phụ có tiền sử bản nhân hoặc gia đình mắc bệnh lý tuyến giáp, đái tháo đường loại 1, hoặc nghi ngờ bệnh lý tuyến giáp trên lâm sàng.
- Không khuyến cáo xét nghiệm chức năng tuyến giáp ở bệnh nhân bị ốm nghén nặng trừ khi có các dấu hiệu rõ ràng khác của cường giáp lâm sàng.
Hộp 1. Quản lý nội khoa bão giáp hoặc suy tim do nhiễm độc giáp trong thai kỳ
|
• Ức chế tuyến giáp giải phóng T3 và T4 Propylthiouracil, uống liều tải 1.000 mg, sau đó uống 200 mg mỗi 6 giờ Dùng iod 1-2 giờ sau khi uống propylthiouracil : - natri iodua, 500-1,000 mg IV mỗi 8 giờ hoặc - Kali iodua, 5 giọt nhỏ miệng mỗi 8 giờ hoặc - Dung dịch Lugol, 10 giọt nhỏ miệng mỗi 8 giờ hoặc - Lithium cacbonat (nếu bệnh nhân có tiền sử phản vệ với iod), uống 300 mg mỗi 6 giờ • Ngăn chặn sự chuyển đổi thêm T4 thành T3 ở ngoại vi Bốn liều Dexamethasone, 2 mg IV mỗi 6 giờ hoặc Ba liều Hydrocortisone, 100 mg IV mỗi 8 giờ • Propranolol, Labetalol và esmolol đều đã được dùng thành công để kiểm soát nhịp tim nhanh. Tuy nhiên, cần phải thận trọng nếu dùng thuốc chẹn beta khi bị suy tim. • Các biện pháp hỗ trợ, như kiểm soát nhiệt độ, khi cần Viết tắt: IV, TM; T3, triiodothyronine; T4, thyroxine. |
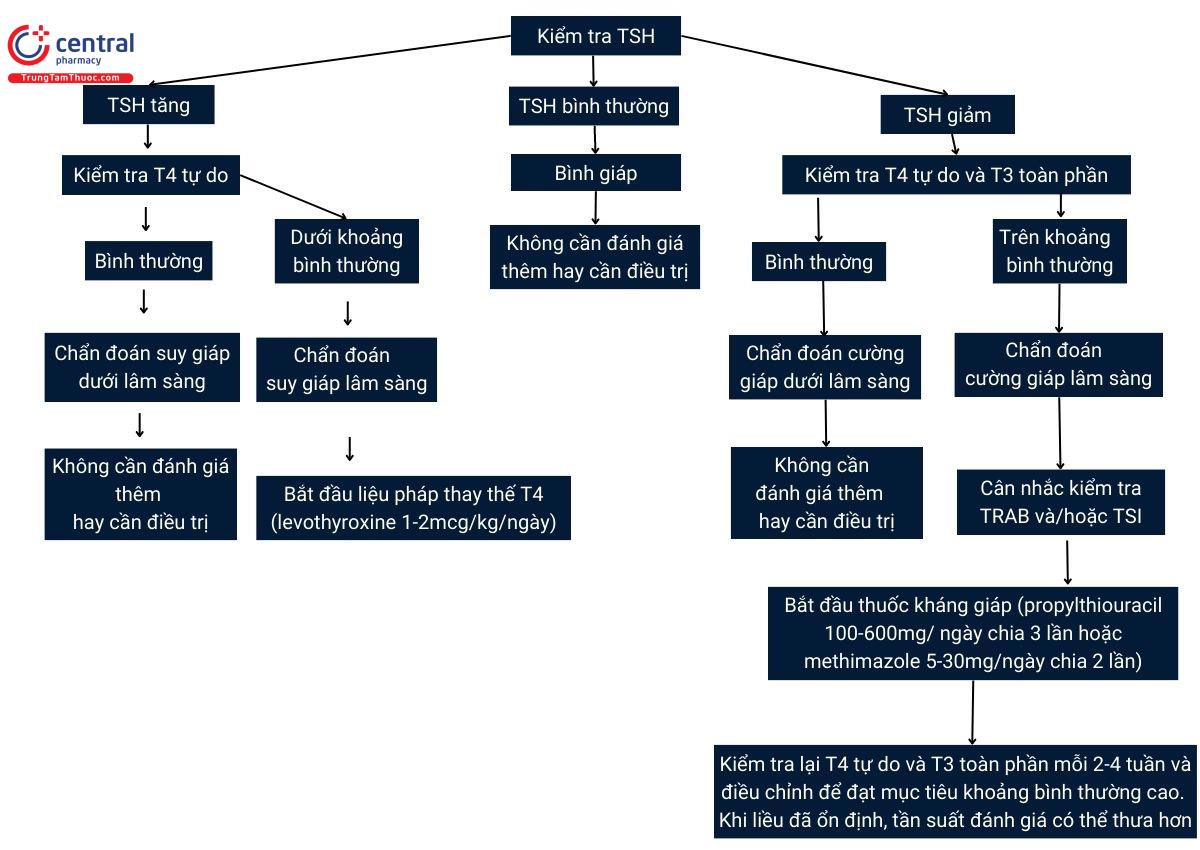
Hình 1. Lưu đồ lâm sàng quản lý bệnh tuyến giáp trong thai kỳ. Viết tắt: T3, triiodothyronine; T4, thyroxine; TRAB, kháng thể kháng thụ thể tuyến giáp; TSH, hormone kích thích tuyến giáp; TSI, globulin miễn dịch kích thích tuyến giáp. *Nên dùng propylthiouracil trong ba tháng đầu thai kỳ vì methimazole có liên quan với dị tật bẩm sinh. Propranolol có thể được bắt đầu với liều 10–40 mg mỗi 6-8 giờ đối với thai phụ bị hồi hộp trống ngực có triệu chứng hoặc các triệu chứng tăng chuyển hóa khác. † Giới hạn bình thường của T3 toàn phần trong thai kỳ gấp 1,5 lần giới hạn bình thường khi không mang thai.
5 Tài liệu tham khảo
1. Vannucchi G, Covelli D, Vigo B, Perrino M, Mondina L, Fugazzola L. Thyroid volume and serum Calcitonin changes during pregnancy. J Endocrinol Invest 2017;40: 727–32. (Level II-3)
2. Huang SA. Physiology and pathophysiology of type 3 deiodinase in humans. Thyroid 2005;15:875–81. (Level III)
3. Alexander EK, Pearce EN, Brent GA, Brown RS, Chen H, Dosiou C, et al. 2017 guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and the postpartum [published erratum appears in Thyroid 2017;27:1212]. Thyroid 2017;27:315–89. (Level III)
4. Ross DS, Burch HB, Cooper DS, Greenlee MC, Laurberg P, Maia AL, et al. 2016 American Thyroid Association guidelines for diagnosis and management of hyperthyroidism and other causes of thyrotoxicosis [published erratum appears in Thyroid 2017;27:1462]. Thyroid 2016;26:1343– 421. (Level III)
5. Bernal J. Thyroid hormone receptors in brain development and function. Nat Clin Pract Endocrinol Metab 2007;3: 249–59. (Level III)
6. Calvo RM, Jauniaux E, Gulbis B, Asunción M, Gervy C, Contempré B, et al. Fetal tissues are exposed to biologically relevant free thyroxine concentrations during early phases of development. J Clin Endocrinol Metab 2002; 87:1768–77. (Level III)
7. Korevaar TI, Muetzel R, Medici M, Chaker L, Jaddoe VW, de Rijke YB, et al. Association of maternal thyroid function during early pregnancy with offspring IQ and brain morphology in childhood: a population-based prospective cohort study. Lancet Diabetes Endocrinol 2016;4:35–43. (Level II-2)
8. Thorpe-Beeston J, Nicolaides KH, Snijders RJ, Felton CV, McGregor AM. Thyroid function in small for gestational age fetuses. Obstet Gynecol 1991;77:701–6. (Level II-3)
9. Ecker JL, Musci TJ. Thyroid function and disease in pregnancy. Curr Probl Obstet Gynecol Fertil 2000;23:109–22. (Level III)
10. Dong AC, Stagnaro-Green A. Differences in diagnostic criteria mask the true prevalence of thyroid disease in pregnancy: a systematic review and meta-analysis. Thyroid 2019;29:278–89. (Systematic Review and Meta-Analysis)
11. Davis LE, Lucas MJ, Hankins GD, Roark ML, Cunningham FG. Thyrotoxicosis complicating pregnancy. Obstet Gynecol 1989;160:63–70. (Level III)
12. Millar LK, Wing DA, Leung AS, Koonings PP, Montoro MN, Mestman JH. Low birth weight and preeclampsia in pregnancies complicated by hyperthyroidism. Obstet Gynecol 1994;84:946–9. (Level II-2)
13. Krassas GE, Poppe K, Glinoer D. Thyroid function and human reproductive health. Endocr Rev 2010;31:702–55. (Level III)
14. Pearce EN. Management of thyrotoxicosis: preconception, pregnancy, and the postpartum period. Endocr Pract 2019; 25:62–8. (Level III)
15. Uenaka M, Tanimura K, Tairaku S, Morioka I, Ebina Y, Yamada H. Risk factors for neonatal thyroid dysfunction in pregnancies complicated by Graves’ disease. Eur J Obstet Gynecol Reprod Biol 2014;177:89–93. (Level III)
16. Aggarawal N, Suri V, Singla R, Chopra S, Sikka P, Shah VN, et al. Pregnancy outcome in hyperthyroidism: a case control study. Gynecol Obstet Invest 2014;77:94–9. (Level II-2)
17. Sheehan PM, Nankervis A, Araujo Júnior E, Da SC. Maternal thyroid disease and preterm birth: systematic review and meta-analysis. J Clin Endocrinol Metab 2015;100: 4325–31. (Systematic Review and Meta-Analysis)
18. Matsuura N, Harada S, Ohyama Y, Shibayama K, Fukushi M, Ishikawa N, et al. The mechanisms of transient hypothyroxinemia in infants born to mothers with Graves’ disease. Pediatr Res 1997;42:214–8. (Level III)
19. McKenzie JM, Zakarija M. Fetal and neonatal hyperthyroidism and hypothyroidism due to maternal TSH receptor antibodies. Thyroid 1992;2:155–9. (Level III)
20. Weetman AP. Graves’ disease. N Engl J Med 2000;343: 1236–48. (Level III)
21. van der Kaay DC, Wasserman JD, Palmert MR. Management of neonates born to mothers with Graves’ disease. Pediatrics 2016;137:e20151878. (Level III)
22. Casey BM, Dashe JS, Wells CE, McIntire DD, Leveno KJ, Cunningham FG. Subclinical hyperthyroidism and pregnancy outcomes. Obstet Gynecol 2006;107:337–41. (Level II-2)
23. Diéguez M, Herrero A, Avello N, Suárez P, Delgado E, Menéndez E. Prevalence of thyroid dysfunction in women in early pregnancy: does it increase with maternal age? Clin Endocrinol (Oxf) 2016;84:121–6. (Level II-3)
24. Surks MI, Ortiz E, Daniels GH, Sawin CT, Col NF, Cobin RH, et al. Subclinical thyroid disease: scientific review and guidelines for diagnosis and management. JAMA 2004; 291:228–38. (Level III)
25. Tudela CM, Casey BM, McIntire DD, Cunningham FG. Relationship of subclinical thyroid disease to the incidence of gestational diabetes. Obstet Gynecol 2012;119:983–8. (Level II-3)
26. Wilson KL, Casey BM, McIntire DD, Halvorson LM, Cunningham FG. Subclinical thyroid disease and the incidence of hypertension in pregnancy. Obstet Gynecol 2012;119: 315–20. (Level II-3)
27. Institute of Medicine. Dietary reference intakes: the essential guide to nutrient requirements. Washington, DC: National Academies Press; 2006. Available at: https:// www.nap.edu/catalog/11537/dietary-reference-intakes-theessential-guide-to-nutrient-requirements. Retrieved January 10, 2020. (Level III)
28. Harding KB, Peña‐Rosas JP, Webster AC, Yap CM, Payne BA, Ota E, et al. Iodine supplementation for women during the preconception, pregnancy and postpartum period. Cochrane Database of Systematic Reviews 2017, Issue 3. Art. No.: CD011761. DOI: 10.1002/14651858.CD011761. pub2. (Systematic Review and Meta-Analysis)
29. Pearce EN, Lazarus JH, Moreno-Reyes R, Zimmermann MB. Consequences of iodine deficiency and excess in pregnant women: an overview of current knowns and unknowns. Am J Clin Nutr 2016;104(suppl 3):918S–23S. (Level III)
30. Casey BM, Leveno KJ. Thyroid disease in pregnancy. Obstet Gynecol 2006;108:1283–92. (Level III)
31. Yazbeck CF, Sullivan SD. Thyroid disorders during pregnancy. Med Clin North Am 2012;96:235–56. (Level III)
32. Abalovich M, Gutierrez S, Alcaraz G, Maccallini G, Garcia A, Levalle O. Overt and subclinical hypothyroidism complicating pregnancy. Thyroid 2002;12:63–8. (Level III)
33. Bryant SN, Nelson DB, McIntire DD, Casey BM, Cunningham FG. An analysis of population-based prenatal screening for overt hypothyroidism. Obstet Gynecol 2015;213:565.e1–6. (Level II-2)
34. Brown RS, Bellisario RL, Botero D, Fournier L, Abrams CA, Cowger ML, et al. Incidence of transient congenital hypothyroidism due to maternal thyrotropin receptorblocking antibodies in over one million babies. J Clin Endocrinol Metab 1996;81:1147–51. (Level II-3)
35. Casey BM, Dashe JS, Wells CE, McIntire DD, Byrd W, Leveno KJ, et al. Subclinical hypothyroidism and pregnancy outcomes. Obstet Gynecol 2005;105:239–45. (Level II-2)
36. Cleary-Goldman J, Malone FD, Lambert-Messerlian G, Sullivan L, Canick J, Porter TF, et al. Maternal thyroid hypofunction and pregnancy outcome. Obstet Gynecol 2008;112:85–92. (Level II-3)
37. Fitzpatrick DL, Russell MA. Diagnosis and management of thyroid disease in pregnancy. Obstet Gynecol Clin North Am 2010;37:173–93. (Level III)
38. Haddow JE, Palomaki GE, Allan WC, Williams JR, Knight GJ, Gagnon J, et al. Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child. N Engl J Med 1999;341:549–55. (Level II-2)
39. Pop VJ, Kuijpens JL, van Baar AL, Verkerk G, van Son MM, de Vijlder JJ, et al. Low maternal free thyroxine concentrations during early pregnancy are associated with impaired psychomotor development in infancy. Clin Endocrinol (Oxf) 1999;50:149–55. (Level II-3)
40. Lazarus JH, Bestwick JP, Channon S, Paradice R, Maina A, Rees R, et al. Antenatal thyroid screening and childhood cognitive function [published erratum appears in N Engl J Med 2012;366:1650]. N Engl J Med 2012;366:493–501. (Level I)
41. Casey BM, Thom EA, Peaceman AM, Varner MW, Sorokin Y, Hirtz DG, et al. Treatment of subclinical hypothyroidism or hypothyroxinemia in pregnancy. Eunice Kennedy Shriver National Institute of Child Health and Human Development Maternal–Fetal Medicine Units Network. N Engl J Med 2017;376:815–25. (Level I)
42. Hales C, Taylor PN, Channon S, Paradice R, McEwan K, Zhang L, et al. Controlled antenatal thyroid screening II: effect of treating maternal suboptimal thyroid function on child cognition. J Clin Endocrinol Metab 2018;103:1583–91. (Level II-2)
43. Korevaar TI, Derakhshan A, Taylor PN, Meima M, Chen L, Bliddal S, et al. Association of thyroid function test abnormalities and thyroid autoimmunity with preterm birth: a systematic review and meta-analysis. Consortium on Thyroid and Pregnancy—Study Group on Preterm Birth [published erratum appears in JAMA 2019;322:1718]. JAMA 2019;322:632–41. (Systematic Review and MetaAnalysis)
44. Casey BM, Dashe JS, Spong CY, McIntire DD, Leveno KJ, Cunningham GF. Perinatal significance of isolated maternal hypothyroxinemia identified in the first half of pregnancy. Obstet Gynecol 2007;109:1129–35. (Level II-3)
45. Cappola AR, Casey BM. Thyroid function test abnormalities during pregnancy. JAMA 2019;322:617–9. (Level III)
46. Fister P, Gaberscek S, Zaletel K, Krhin B, Gersak K, Hojker S. Thyroid volume changes during pregnancy and after delivery in an iodine-sufficient Republic of Slovenia. Eur J Obstet Gynecol Reprod Biol 2009;145:45–8. (Level III)
47. De Groot L, Abalovich M, Alexander EK, Amino N, Barbour L, Cobin RH, et al. Management of thyroid dysfunction during pregnancy and postpartum: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2012;97:2543–65. (Level III)
48. Garber JR, Cobin RH, Gharib H, Hennessey JV, Klein I, Mechanick JI, et al. Clinical practice guidelines for hypothyroidism in adults: cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. American Association of Clinical Endocrinologists and American Thyroid Association Taskforce on Hypothyroidism in Adults [published errata appear in Thyroid 2013;23:251; Thyroid 2013;23:129]. Thyroid 2012;22:1200–35. (Level III)
49. Yoshihara A, Noh J, Yamaguchi T, Ohye H, Sato S, Sekiya K, et al. Treatment of Graves’ disease with antithyroid drugs in the first trimester of pregnancy and the prevalence of congenital malformation. J Clin Endocrinol Metab 2012; 97:2396–403. (Level II-3)
50. Brent GA. Clinical practice. Graves’ disease. N Engl J Med 2008;358:2594–605. (Level III)
51. Abalovich M, Alcaraz G, Kleiman-Rubinsztein J, Pavlove MM, Cornelio C, Levalle O, et al. The relationship of preconception thyrotropin levels to requirements for increasing the levothyroxine dose during pregnancy in women with primary hypothyroidism. Thyroid 2010;20:1175–8. (Level III)
52. Alexander EK, Marqusee E, Lawrence J, Jarolim P, Fischer GA, Larsen PR. Timing and magnitude of increases in levothyroxine requirements during pregnancy in women with hypothyroidism. N Engl J Med 2004;351:241–9. (Level III)
53. Arafah BM. Increased need for thyroxine in women with hypothyroidism during estrogen therapy. N Engl J Med 2001;344:1743–9. (Level II-3)
54. Thangaratinam S, Tan A, Knox E, Kilby MD, Franklyn J, Coomarasamy A. Association between thyroid autoantibodies and miscarriage and preterm birth: meta-analysis of evidence. BMJ 2011;342:d2616. (Systematic Review and Meta-Analysis)
55. Stagnaro-Green A, Pearce E. Thyroid disorders in pregnancy. Nat Rev Endocrinol 2012;8:650–8. (Level III)
56. Wang H, Gao H, Chi H, Zeng L, Xiao W, Wang Y, et al. Effect of levothyroxine on miscarriage among women with normal thyroid function and thyroid autoimmunity undergoing in vitro fertilization and embryo transfer: a randomized clinical trial. JAMA 2017;318:2190–8. (Level I)
57. Dhillon-Smith R, Middleton LJ, Sunner KK, Cheed V, Baker K, Farrell-Carver S, et al. Levothyroxine in women with thyroid peroxidase antibodies before conception. N Engl J Med 2019;380:1316–25. (Level I)
58. Yeo CP, Khoo DH, Eng PH, Tan HK, Yo SL, Jacob E. Prevalence of gestational thyrotoxicosis in Asian women evaluated in the 8th to 14th weeks of pregnancy: correlations with total and free beta human Chorionic gonadotrophin. Clin Endocrinol (Oxf) 2001;55:391–8. (Level II-3)
59. Kinomoto-Kondo S, Umehara N, Sato S, Ogawa K, Fujiwara T, Arata N, et al. The effects of gestational transient thyrotoxicosis on the perinatal outcomes: a case–control study. Arch Gynecol Obstet 2017;295:87–93. (Level II-2)
60. Niemeijer MN, Grooten IJ, Vos N, Bais JM, van der Post JA, Mol BW, et al. Diagnostic markers for hyperemesis gravidarum: a systematic review and metaanalysis. Obstet Gynecol 2014;211:150.e1–15. (Systematic Review and Meta-Analysis)
61. Sheffield JS, Cunningham FG. Thyrotoxicosis and heart failure that complicate pregnancy. Obstet Gynecol 2004; 190:211–7. (Level III)
62. Siu C, Zhang X, Yung C, Kung AW, Lau C, Tse H. Hemodynamic changes in hyperthyroidism-related pulmonary hypertension: a prospective echocardiographic study. J Clin Endocrinol Metab 2007;92:1736–42. (Level II-3)
63. Vydt T, Verhelst J, De Keulenaer G. Cardiomyopathy and thyrotoxicosis: tachycardiomyopathy or thyrotoxic cardiomyopathy? Acta Cardiol 2006;61:115–7. (Level III)
64. Brand F, Liégeois P, Langer B. One case of fetal and neonatal variable thyroid dysfunction in the context of Graves’ disease. Fetal Diagn Ther 2005;20:12–5. (Level III)
65. Cohen O, Pinhas-Hamiel O, Sivan E, Dolitski M, Lipitz S, Achiron R. Serial in utero ultrasonographic measurements of the fetal thyroid: a new complementary tool in the management of maternal hyperthyroidism in pregnancy. Prenat Diagn 2003;23:740–2. (Level III)
66. Luton D, Le Gac I, Vuillard E, Castanet M, Guibourdenche J, Noel M, et al. Management of Graves’ disease during pregnancy: the key role of fetal thyroid gland monitoring. J Clin Endocrinol Metab 2005;90:6093–8. (Level III)
67. Hegedüs L. Clinical practice. The thyroid nodule. N Engl J Med 2004;351:1764–71. (Level III)
68. Kwong N, Medici M, Angell TE, Liu X, Marqusee E, Cibas ES, et al. The influence of patient age on thyroid nodule formation, multinodularity, and thyroid cancer risk. J Clin Endocrinol Metab 2015;100:4434–40. (Level II-2)
69. Gharib H, Papini E, Garber JR, Duick DS, Harrell RM, Hegedüs L, et al. American Association of Clinical Endocrinologists, American College of Endocrinology, and Associazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules—2016 update. Endocr Pract 2016;22:622–39. (Level III)
70. Bartolazzi A, Gasbarri A, Papotti M, Bussolati G, Lucante T, Khan A, et al. Application of an immunodiagnostic method for improving preoperative diagnosis of nodular thyroid lesions. Thyroid Cancer Study Group. Lancet 2001;357:1644–50. (Level II-3)
71. Nathan N, Sullivan SD. Thyroid disorders during pregnancy. Endocrinol Metab Clin North Am 2014;43:573– 97. (Level III)
72. Stagnaro-Green A, Glinoer D. Thyroid autoimmunity and the risk of miscarriage. Best Pract Res Clin Endocrinol Metab 2004;18:167–81. (Level III)
73. Muller AF, Drexhage HA, Berghout A. Postpartum thyroiditis and autoimmune thyroiditis in women of childbearing age: recent insights and consequences for antenatal and postnatal care. Endocr Rev 2001;22:605– 30. (Level II-3)
74. Bergink V, Pop VJ, Nielsen PR, Agerbo E, Munk-Olsen T, Liu X. Comorbidity of autoimmune thyroid disorders and psychiatric disorders during the postpartum period: a Danish nationwide register-based cohort study. Psychol Med 2018;48:1291–8. (Level II-2)
75. Cunningham FG, Leveno KJ, Bloom SL, Dashe JS, Hoffman BL, Casey BM, et al, editors. Williams obstetrics. 25th ed. New York, NY: McGraw-Hill Education; 2018. (Level III)
76. Lucas A, Pizarro E, Granada ML, Salinas I, Roca J, Sanmartí A. Postpartum thyroiditis: long-term follow-up. Thyroid 2005;15:1177–81. (Level III)
77. Premawardhana LD, Parkes AB, Ammari F, John R, Darke C, Adams H, et al. Postpartum thyroiditis and long-term thyroid status: prognostic influence of thyroid peroxidase antibodies and ultrasound echogenicity. J Clin Endocrinol Metab 2000;85:71–5. (Level II-3)

