Hướng dẫn thực hành lâm sàng 'Thai giới hạn tăng trưởng' ACOG 2021

Trungtamthuoc.com - Ngày 1 tháng 2 năm 2021, Ủy ban về thực hành phụ khoa thuộc Hiệp hội sản phụ khoa Hoa Kỳ (ACOG) đã công bố bản Hướng dẫn thực hành lâm sàng "Thai giới hạn tăng trưởng" thay thê cho bản hướng dẫn trước đó (Bản tin Thực hành Số 204, tháng 2 năm 2019).
Chú ý: Phần bôi đỏ trong bài viết là phần được xác định là điểm khác biệt (bổ sung hoặc sửa đổi) so với phiên bản trước đó
AMERICAN COLLEGE OF OBTETRICIANS AND GYNECOLOGISTS (HIỆP HỘI SẢN PHỤ KHOA HOA KỲ ACOG)
ACOG PRACTICE BULLETIN (BẢN TIN THỰC HÀNH ACOG)
Clinical Management Guidelines for Obstetrician–Gynecologists (Hướng dẫn quản lý lâm sàng dành cho bác sĩ sản phụ khoa)
Fetal Growth Restrictio (Thai giới hạn tăng trưởng - Xem bài gốc tại đây)
Dịch bởi: Bác sĩ Vũ Văn Tài
1 Thai giới hạn tăng trưởng
Thai giới hạn tăng trưởng (Fetal growth restriction, intrauterine growth restriction) là một biến chứng phổ biến của thai kỳ mà liên quan đến một loại các kết cục chu sinh bất lợi. Thiếu sự đồng thuận về thuật ngữ, nguyên nhân và tiêu chuẩn chẩn đoán, cùng với sự không chắc chắn xung quanh việc quản lý tối ưu và thời điểm chấm dứt thai kỳ đối với thai nhi bị giới hạn tăng trưởng. Một thách thức nữa là khó phân biệt giữa thai nhỏ về mặt thể chất và đáp ứng phù hợp tiềm năng tăng trưởng của nó với thai nhỏ không đáp ứng tiềm năng tăng trưởng do tình trạng bệnh lý nền. Mục đích của tài liệu này là xem xét chủ đề thai giới hạn tăng trưởng với trọng tâm là thuật ngữ, nguyên nhân, công cụ chẩn đoán và giám sát, hướng dẫn quản lý và thời điểm chấm dứt thai kỳ.

2 Đại cương
2.1 Thuật ngữ
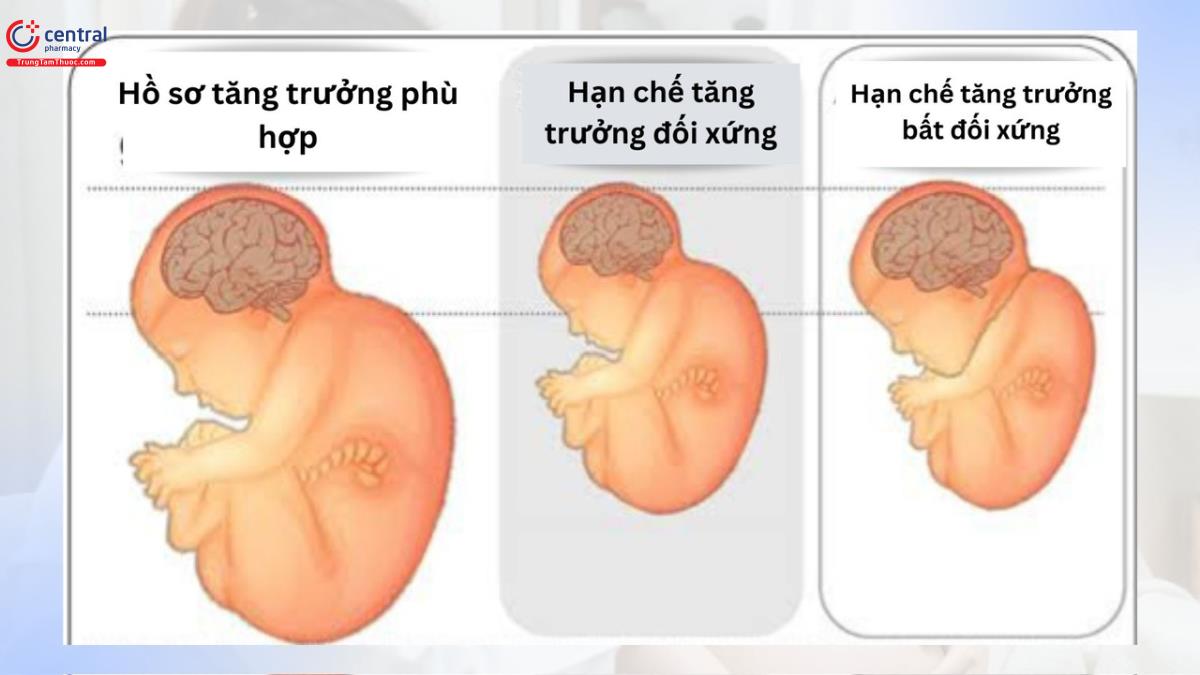
Thuật ngữ để phân loại thai nhi và trẻ sơ sinh không đạt được cân nặng theo tiêu chuẩn quần thể là không nhất quán. Sự trao đổi giữa các bác sĩ sản khoa và bác sĩ sơ sinh sẽ thuận lợi hơn bằng các thuật ngữ được định nghĩa rõ ràng mà mô tả cân nặng của thai nhi và trẻ sơ sinh theo cân nặng tuyệt đối hoặc bách phân vị cân nặng cho một tuổi thai nhất định (1–4). Trong tài liệu này, thuật ngữ “thai giới hạn tăng trưởng” sẽ được dùng để mô tả những thai nhi có cân nặng ước tính hoặc chu vi bụng < bách phân vị thứ 10 so với tuổi thai, trong khi đó, trẻ mới sinh có cân nặng < bách phân vị thứ 10 so với tuổi thai sẽ được gọi với thuật ngữ thai nhỏ so với tuổi thai (SGA)
2.2 Tỷ lệ hiện mắc
Tỷ lệ thai nhi bị giới hạn tăng trưởng phụ thuộc vào định nghĩa được sử dụng. Như đã lưu ý trước đó, định nghĩa thai giới hạn tăng trưởng thường được dùng nhất là cân nặng ước tính hoặc chu vi bụng của thai nhi < bách phân vị thứ 10 theo tuổi thai (5). Tuy nhiên, định nghĩa này không tính đến tiềm năng tăng trưởng cá nhân của từng thai nhi và khi sử dụng định nghĩa này có thể không xác định được những thai lớn hơn mà không đạt được tiềm năng tăng trưởng và có thể có nguy cơ bị các kết cục bất lợi. Ngược lại, định nghĩa này sẽ dẫn đến chẩn đoán sai thai giới hạn tăng trưởng đối với một số thai nhi nhỏ về mặt thể chất (6–9). Với nỗ lực đánh giá chính xác hơn liệu trẻ sơ sinh và thai nhi có tăng trưởng phù hợp hay không, các nhà nghiên cứu đã tạo ra công thức cho các tiêu chuẩn tăng trưởng cá nhân (10, 11). Tuy nhiên, khi dùng các công thức như vậy đã không chứng minh được là cải thiện kết cục.
2.3 Nguyên nhân
Nguyên nhân gây thai giới hạn tăng trưởng có thể được phân loại thành các nhóm lớn như các nguyên nhân từ phía mẹ, thai nhi và nhau thai (Hộp 1). Mặc dù các cơ chế sinh lý bệnh nguyên phát của các tình trạng này khác nhau, nhưng chúng thường (nhưng không phải lúc nào cũng vậy) có cùng một con đường chung cuối cùng: tưới máu tử cung-nhau thai và dinh dưỡng cho thai nhi dưới mức tối ưu.
|
Hộp 1. Nguyên nhân gây thai giới hạn tăng trưởng
|
2.3.1 Rối loạn từ mẹ
Các bệnh lý nội khoa của mẹ có thể dẫn đến thai bị giới hạn tăng trưởng hoặc SGA bao gồm bất kỳ rối loạn mạn tính nào có liên quan đến bệnh mạch máu (12–14), chẳng hạn như các bệnh tăng huyết áp liên quan đến thai kỳ (12). Hội chứng kháng phospholipid, thrombophilia mắc phải qua trung gian miễn dịch, có liên quan đến thai giới hạn tăng trưởng (15). Ngược lại, thrombophilia di truyền, bao gồm đột biến yếu tố V Leiden, đột biến prothrombin, hoặc đột biến gen methylenetetrahydrofolate reductase không phải lúc nào cũng liên quan đến thai giới hạn tăng trưởng hoặc SGA (16–18).
2.3.2 Sử dụng và nghiện chất kích thích
Sử dụng thuốc lá trong thai kỳ có liên quan đến nguy cơ mắc SGA cao gấp 3,5 lần, và là một yếu tố nguy cơ có thể thay đổi được (12, 19). Các chất kích thích khác có liên quan đến SGA bao gồm rượu, cocain và ma túy (20–25). Nguy cơ mắc SGA liên quan đến việc uống rượu tăng ngay cả khi chỉ uống 1 đến 2 ly mỗi ngày (21).
2.3.3 Dinh dưỡng cho mẹ
Các nghiên cứu dọc về những phụ nữ mang thai và sinh con trong thời kỳ đói kém đã chỉ ra mối liên quan giữa SGA và tình trạng suy dinh dưỡng của người mẹ (26, 27). Trong các nghiên cứu này, lượng protein nạp vào cực kỳ thấp trước 26 tuần tuổi thai có liên quan đến SGA, và việc hạn chế calo nghiêm trọng (tức là chỉ cung cấp 600–900 kcal mỗi ngày) có liên quan đến tình trạng giảm nhẹ cân nặng khi sinh. Tuy nhiên, không có bằng chứng chất lượng cao nào cho thấy rằng bổ sung thêm dinh dưỡng khi mẹ không bị suy dinh dưỡng thực sự sẽ làm gia tăng cân nặng của thai nhi hoặc cải thiện kết cục trong trường hợp nghi ngờ thai giới hạn tăng trưởng (28).
2.3.4 Đa thai
Mặc dù song thai chỉ chiếm 2–3% số ca sinh sống ở Hoa Kỳ, nhưng chúng chiếm 10–15% kết cục bất lợi ở trẻ sơ sinh và có liên quan đến tăng tần suất sinh non và SGA (29–31). Nguy cơ SGA trong các thai kỳ đa thai đã được báo cáo lên tới 25% đối với song thai và 60% đối với tam thai và tứ thai (32). Ngoài ra, các trường hợp mang song thai một bánh nhau có nguy cơ bị SGA do sự phân chia bánh nhau không đều và hội chứng truyền máu song thai (33).
2.3.5 Phơi nhiễm với tác nhân gây quái thai
Phơi nhiễm với một số loại thuốc của mẹ có liên quan đến thai giới hạn tăng trưởng. Ảnh hưởng của bất kỳ loại thuốc nào cũng phụ thuộc vào khả năng gây quái thai vốn có của thuốc, thời điểm và thời gian phơi nhiễm, liều lượng và khuynh hướng di truyền của từng cá thể đối với quá trình chuyển hóa thuốc. Dùng một số loại thuốc chống ung thư (ví dụ Cyclophosphamide), thuốc chống động kinh (ví dụ acid valproic) và thuốc chống huyết khối (ví dụ warfarin) có liên quan đến tăng nguy cơ thai giới hạn tăng trưởng (34–38).
2.3.6 Bệnh nhiễm trùng
Người ta ước tính rằng nhiễm trùng trong tử cung có thể là nguyên nhân chính của khoảng 5-10% các trường hợp thai giới hạn tăng trưởng (39). Sốt rét là nguyên nhân của hầu hết các trường hợp thai giới hạn tăng trưởng liên quan đến nhiễm trùng trên toàn thế giới (40). Các bệnh nhiễm trùng khác được coi là nguyên nhân gây thai giới hạn tăng trưởng bao gồm cytomegalovirus, rubella, toxoplasmosis, thủy đậu và giang mai (39, 41–44).
2.3.7 Rối loạn di truyền và cấu trúc
Thai giới hạn tăng trưởng có liên quan với một số bất thường nhiễm sắc thể: ít nhất 50% thai nhi mắc trisomy 13 hoặc trisomy 18 bị giới hạn tăng trưởng (45). Khảm khu trú bánh nhau mà được xác định bằng cách sinh thiết gai nhau cũng có liên quan đến thai giới hạn tăng trưởng (46, 47).
Thai nhi có nhiều loại dị tật cấu trúc (nhưng không có bất thường nhiễm sắc thể hoặc di truyền) cũng làm tăng nguy cơ thai nhi bị giới hạn tăng trưởng (48). Ví dụ, thai nhi và trẻ sơ sinh mắc bệnh tim bẩm sinh tương ứng có nguy cơ bị giới hạn tăng trưởng và SGA cao hơn so với thai nhi và trẻ sơ sinh không mắc các dị tật này (49, 50). Hở thành bụng là một dị tật khác thường liên quan với thai giới hạn tăng trưởng, gặp ở 25% các trường hợp hở thành bụng (51).
2.3.8 Rối loạn nhau thai và bất thường dây rốn
Nhau thai bất thường dẫn đến tưới máu nhau thai kém (tức là suy nhau thai) là bệnh lý phổ biến nhất liên quan đến thai giới hạn tăng trưởng (52). Mối liên quan giữa thai giới hạn tăng trưởng và một số rối loạn nhau thai (ví dụ, nhau bong non, nhồi máu bánh nhau, u máu và u máu bánh nhau) và các bất thường ở dây rốn (ví dụ: dây rốn bám mép và bám màng) cũng đã được đề xuất (34, 53–57). Tuy nhiên, các rối loạn nhau thai khác, chẳng hạn như nhau cài răng lược và nhau tiền đạo, không phải lúc nào cũng liên quan với thai giới hạn tăng trưởng (58).
Khoảng 1% tổng số thai kỳ bị phức tạp do dây rốn một động mạch rốn (59). Xác định dây rốn một động mạch, trong trường hợp không có thêm bất thường về giải phẫu hoặc nhiễm sắc thể, có liên quan đến thai giới hạn tăng trưởng trong một số nghiên cứu nhưng ở những nghiên cứu khác cho thấy không có liên quan (60, 61).
2.3.9 Tỷ lệ bệnh tật và tử vong chu sinh
Thai giới hạn tăng trưởng làm tăng nguy cơ tử vong trong tử cung, bệnh tật và tử vong sơ sinh (62). Hơn nữa, các nghiên cứu dịch tễ học cho thấy rằng thai nhi bị giới hạn tăng trưởng dễ dẫn đến chậm phát triển nhận thức ở thời thơ ấu và các bệnh ở tuổi trưởng thành (ví dụ: béo phì, đái tháo đường loại 2, bệnh động mạch vành và đột quỵ) (63, 64).
Thai giới hạn tăng trưởng có liên quan với tăng đáng kể nguy cơ thai chết lưu, trong đó những thai nhi bị ảnh hưởng nghiêm trọng nhất có nguy cơ cao nhất (65). Khi cân nặng thai nhi < bách phân vị thứ 10 so với tuổi thai, nguy cơ tử vong thai nhi khoảng 1,5%, gấp đôi tỷ lệ nền của thai nhi tăng trưởng bình thường. Trong khi đó, nguy cơ tử vong thai nhi tăng lên 2,5% khi cân nặng thai nhi < bách phân vị thứ 5 so với tuổi thai (66, 67). Thai bị giới hạn tăng trưởng mà mất hoặc đảo ngược dòng chảy cuối tâm trương động mạch rốn đặc biệt tăng nguy cơ mắc các kết cục bất lợi và gia tăng tần suất bệnh tật và tử vong sơ sinh (68).
Trẻ sơ sinh nhỏ so với tuổi thai dễ mắc các biến chứng, bao gồm hạ đường huyết, tăng bilirubin máu, hạ thân nhiệt, xuất huyết não thất, viêm ruột hoại tử, co giật, nhiễm trùng huyết, hội chứng suy hô hấp và tử vong sơ sinh (69–73).
3 Sàng lọc thai giới hạn tăng trưởng
3.1 Hỏi bệnh sử hoặc khám lâm sàng
Bề cao tử cung được đo bằng centimet (từ 24–38 tuần tuổi thai) gần đúng bằng tuổi thai và được dùng để sàng lọc thai giới hạn tăng trưởng (74). Đo bề cao tử cung một lần duy nhất ở tuổi thai 32–34 tuần được báo cáo là có độ nhạy khoảng 65–85% và độ đặc hiệu 96% trong việc phát hiện thai giới hạn tăng trưởng (74–78). Mẹ bị béo phì và u xơ cơ tử cung là những yếu tố có thể hạn chế độ chính xác của phép đo bề cao tử cung như một công cụ sàng lọc. Nếu độ chính xác của bề cao tử cung bị ảnh hưởng bởi các yếu tố như vậy, siêu âm có thể là một phương thức sàng lọc tốt hơn.
3.2 Siêu âm đánh giá và chẩn đoán thai giới hạn tăng trưởng
Để đánh giá thai giới hạn tăng trưởng, 4 số đo sinh trắc học thường được sử dụng: 1) đường kính lưỡng đỉnh, 2) chu vi đầu, 3) chu vi bụng và 4) chiều dài xương đùi. Các số đo sinh trắc học có thể được kết hợp với nhau để có được cân nặng thai nhi ước tính (79). Cân nặng ước tính có thể bị sai lệch so với cân nặng khi sinh lên tới 20% trong 95% trường hợp và với 5% trường hợp còn lại, sai lệch thậm chí còn lớn hơn 20% (74, 80–82). Nếu cân nặng thai nhi ước tính hoặc chu vi bụng trên siêu âm < bách phân vị thứ 10 theo tuổi thai, nên cân nhắc đánh giá thêm, chẳng hạn như đánh giá nước ối và Doppler lưu lượng máu của động mạch rốn. Bởi vì thai nhi bị giới hạn tăng trưởng có tỷ lệ bất thường về cấu trúc và di truyền cao, nên cũng khuyến cáo siêu âm khảo sát giải phẫu thai nhi nếu chưa được thực hiện trước đó.
Đánh giá vận tốc Doppler, đặc biệt là động mạch rốn, đã được nghiên cứu và đánh giá kĩ lưỡng trong các trường hợp thai giới hạn tăng trưởng (5). Dòng chảy cuối tâm trương động mạch rốn mất hoặc đảo ngược làm tăng nguy cơ tử vong chu sinh (83–86). Trong trường hợp thai nhi bị giới hạn tăng trưởng, ngoài các xét nghiệm tiêu chuẩn trước sinh, đo thêm vận tốc Doppler động mạch rốn làm giảm tỷ lệ tử vong chu sinh tới 29% (87, 88). Nhằm đánh giá tình trạng thai nhi tốt hơn, nhiều nơi đã đo dòng chảy trong ống tĩnh mạch nhưng không cho thấy cải thiện kết cục (89–92).
4 Cân nhắc và khuyến cáo lâm sàng
4.1 Các thai kỳ nên được sàng lọc thai giới hạn tăng trưởng, và sàng lọc được thực hiện như thế nào?
Tất cả các bệnh nhân mang thai nên được sàng lọc các yếu tố nguy cơ gây thai giới hạn tăng trưởng thông qua việc xem xét tiền sử nội khoa và sản khoa. Nên đo bề cao tử cung ở mỗi lần khám trước sinh sau 24 tuần tuổi thai. Sự khác biệt giữa tuần tuổi thai và số đo bề cao tử cung > 3 đã được đề xuất để xác định thai có thể bị giới hạn tăng trưởng (74). Bác sĩ sản khoa cần lưu ý hạn chế tiềm tàng của việc đánh giá bề cao tử cung khi mẹ béo phì, đa thai hoặc tiền sử u xơ cơ tử cung; hoặc trong trường hợp không sờ thấy đáy tử cung, siêu âm được ưu tiên sử dụng như một công cụ sàng lọc. Sàng lọc dựa vào siêu âm cũng có thể được dùng khi có các yếu tố của mẹ làm tăng nguy cơ thai giới hạn tăng trưởng.
Mặc dù đã nhiều nghiên cứu đánh giá các phương pháp sàng lọc thai giới hạn tăng trưởng khác (bao gồm siêu âm thường quy trong tam cá nguyệt thứ ba, đo vận tốc Doppler động mạch tử cung và định lượng các chất phân tích, chẳng hạn như protein A huyết tương liên quan đến thai kỳ (PAPP-A), nhưng đều không giúp cải thiện kết cục (93–101).
4.2 Đánh giá thai phụ có tiền sử sinh con nhỏ so với tuổi thai như thế nào?
Nguy cơ tái phát sinh con SGA là khoảng 20% (9). Bất kỳ bệnh nhân nào đã từng sinh con SGA đều phải được xem xét tiền sử nội khoa và sản khoa để giúp xác định xem có bất kỳ yếu tố nguy cơ nào khác hay không, đặc biệt là các yếu tố nguy cơ có thể thay đổi được. Ở những thai phụ này, thực hiện siêu âm nối tiếp để đánh giá sự tăng trưởng có thể là hợp lý, mặc dù vẫn chưa rõ phác đồ giám sát tối ưu. Tiền sử mẹ sinh con SGA trước đó với thai nhi tăng trưởng bình thường ở thai kỳ hiện tại không phải là chỉ định để ghi biểu đồ nhịp tim thai nhi, trắc đồ sinh vật lý hoặc đo vận tốc Doppler động mạch rốn trước sinh (102).
Các yếu tố nguy cơ khác của mẹ đối với SGA cũng đã được đánh giá. Một tiêu chí để chẩn đoán hội chứng kháng Phospholipid bao gồm thai kỳ trước đó có thai bị giới hạn tăng trưởng mà bình thường về mặt hình thái và cần phải sinh trước 34 tuần tuổi. Tuy nhiên, không có đủ bằng chứng cho thấy việc sàng lọc và điều trị ở lần mang thai sau đó sẽ giúp cải thiện kết cục (103). Tình trạng dị hợp tử đối với bệnh thrombophilia di truyền (ví dụ, đột biến yếu tố V Leiden và đột biến prothrombin) không phải lúc nào cũng liên quan với thai giới hạn tăng trưởng và không chỉ định xét nghiệm bệnh này cho mẹ (17, 103, 104).
4.3 Dự phòng thai giới hạn tăng trưởng ?
Một loạt các phương pháp đã được áp dụng để dự phòng thai giới hạn tăng trưởng. Nhiều chiến lược bổ sung dinh dưỡng và chế độ ăn uống đã được nghiên cứu để dự phòng thai giới hạn tăng trưởng, mặc dù không có chiến lược nào hiệu quả. Bao gồm tư vấn dinh dưỡng cá thể hóa (105); tăng cường ăn cá, thịt ít mỡ, ngũ cốc, trái cây và rau củ (106); chế độ ăn ít muối (107); và bổ sung Sắt (108), Kẽm (109), Canxi (110), protein (111), Magie (112) và vitamin D (113). Vì các chiến lược bổ sung dinh dưỡng và chế độ ăn uống dự phòng thai giới hạn tăng trưởng không hiệu quả nên không được khuyến cáo.
Tương tự, không có bằng chứng nhất quán nào cho thấy việc nghỉ ngơi tại giường nội trú hoặc ngoại trú giúp dự phòng thai giới hạn tăng trưởng hoặc giảm tỷ lệ sinh con SGA (114). Ở những thai phụ có tiền sử sinh con SGA, một số chuyên gia ủng hộ việc sử dụng Aspirin để ngăn ngừa suy nhau thai; tuy nhiên, không có đủ bằng chứng để chỉ định thường quy liệu pháp như vậy để dự phòng thai giới hạn tăng trưởng (115–118).
4.4 Trường hợp thai bị giới hạn tăng trưởng, khi nào nên tư vấn di truyền và thực hiện xét nghiệm chẩn đoán trước sinh?
Mặc dù thai giới hạn tăng trưởng đơn độc có thể do bất thường nhiễm sắc thể, nhưng nguy cơ sẽ cao hơn nếu thai nhi có thêm bất thường cấu trúc. Do đó, khi thai bị giới hạn tăng trưởng kèm theo bất thường cấu trúc nên tư vấn ngay cho bệnh nhân về loại dị tật và cân nhắc xét nghiệm chẩn đoán trước sinh. Ngoài ra, do thai giới hạn tăng trưởng được phát hiện sớm trong thai kỳ hoặc kèm theo đa ối thường có khả năng cao bị bất thường nhiễm sắc thể (119), chỉ định tư vấn di truyền và xét nghiệm chẩn đoán trước sinh khi thai giới hạn tăng trưởng được chẩn đoán trước 32 tuần tuổi hoặc thai giới hạn tăng trưởng kèm theo đa ối hoặc dị tật thai nhi.
4.5 Thai kỳ phức tạp do thai giới hạn tăng trưởng nên được đánh giá và quản lý như thế nào?
Phương pháp tốt nhất để đánh giá thai giới hạn tăng trưởng vẫn là siêu âm. Theo dõi thai nhi bị giới hạn tăng trưởng bao gồm siêu âm nối tiếp đo các chỉ số sinh trắc học của thai nhi và thể tích nước ối. Giám sát trước sinh (ví dụ: nonstress test hoặc trắc đồ sinh vật lý) không nên thực hiện trước tuổi thai mà việc chấm dứt thai kỳ được xem xét vì lợi ích chu sinh (30, 31, 120–123, 124). Vẫn chưa rõ tần suất đánh giá tăng trưởng thai nhi tối ưu và phác đồ giám sát tối ưu. Hầu hết thai nhi bị giới hạn tăng trưởng có thể được đánh giá đầy đủ với siêu âm nối tiếp mỗi 3–4 tuần; không nên thực hiện thường xuyên hơn mỗi 2 tuần vì sai số cố hữu liên quan đến các phép đo siêu âm có thể cản trở việc đánh giá chính xác tăng trưởng theo từng khoảng thời gian (125, 126).
4.6 Vai trò của đo vận tốc Doppler trong việc đánh giá thai kỳ phức tạp do thai giới hạn tăng trưởng ?
Đo vận tốc Doppler động mạch rốn đóng một vai trò quan trọng trong việc quản lý thai kỳ phức tạp do chẩn đoán thai giới hạn tăng trưởng. Sau khi chẩn đoán thai nhi bị giới hạn tăng trưởng, nên đánh giá động mạch rốn nối tiếp để đánh giá xem tình trạng thai có xấu đi hay không (5). Đo vận tốc Doppler động mạch rốn kết hợp với giám sát thai nhi tiêu chuẩn, chẳng hạn như nonstress test, trắc đồ sinh vật lý, hoặc cả hai, có thể giúp cải thiện kết cục ở thai nhi đã được chẩn đoán bị giới hạn tăng trưởng (88). Đánh giá Doppler có thể đem lại cái nhìn sâu sắc về nguyên nhân gây thai giới hạn tăng trưởng vì sự gia tăng trở kháng trong động mạch rốn gợi ý rằng thai kỳ phức tạp do suy nhau thai. Ngoài ra, trong bối cảnh thai bị giới hạn tăng trưởng, dòng chảy cuối tâm trương động mạch rốn mất hoặc đảo ngược có liên quan với tăng tần suất tử vong chu sinh (84–86, 127) và có thể ảnh hưởng đến các quyết định về thời điểm chấm dứt thai kỳ (5). Khảo sát các mạch máu khác của thai nhi bằng cách đo vận tốc Doppler, bao gồm đánh giá động mạch não giữa và hệ thống tĩnh mạch trước tim, đã được khám phá trong bối cảnh thai giới hạn tăng trưởng. Trong 2 năm theo dõi của nghiên cứu Trial of Umbilical and Fetal Flow in Europe (TRUFFLE), các nhà nghiên cứu đã phát hiện ra rằng chấm dứt thai kỳ dựa vào những thay đổi muộn trong Doppler của ống tĩnh mạch có liên quan đến tình trạng khiếm khuyết phát triển thần kinh ít hơn lúc trẻ 2 tuổi so với việc chấm dứt thai kỳ dựa vào những thay đổi của biểu đồ nhịp tim thai, nhưng tỷ lệ tử vong chu sinh và sơ sinh tăng khi áp dụng chiến lược này (128). Do đó, các số đo dòng chảy này không được chứng minh là cải thiện kết cục chu sinh và vai trò của các phép đo này trong thực hành lâm sàng vẫn chưa chắc chắn (89, 90, 127, 129–131).
4.7 Thời điểm chấm dứt thai kỳ đối với thai bị giới hạn tăng trưởng?
Thời điểm chấm dứt thai kỳ tối ưu đối với thai bị giới hạn tăng trưởng phụ thuộc vào nguyên nhân nền gây ra tình trạng này (nếu biết), tuổi thai ước tính và các dấu hiệu lâm sàng khác khi giám sát thai nhi trước sinh. Ví dụ, thay đổi thời điểm sinh đối với thai bị lệch bội hoặc nhiễm trùng bẩm sinh có thể không cải thiện kết cục. Ngoài ra, một số thai phụ có thể lựa chọn từ bỏ can thiệp. Ví dụ, một số thai phụ có thể lựa chọn từ bỏ việc sinh con khi thai bị giới hạn tăng trưởng nặng ở tuần thứ 25 của thai kỳ ngay cả khi thai nhi có nguy cơ tử vong. Có thể tăng cường mức độ quản lý bằng cách tiếp cận cá thể hóa và đa chuyên khoa. Khi can thiệp vì lợi ích chu sinh là lựa chọn ưu tiên, giám sát thai nhi trước sinh có thể giúp định hướng thời điểm chấm dứt thai kỳ. Thai giới hạn tăng trưởng đơn thuần không phải là chỉ định mổ lấy thai và phương thức sinh nên dựa trên các tình huống lâm sàng khác.

Growth Restriction Intervention Trial đánh giá thời điểm chấm dứt thai kỳ của thai bị giới hạn tăng trưởng sinh non sớm (< 34 tuần tuổi). Trong thử nghiệm này, thai phụ có thai bị giới hạn tăng trưởng mà bác sĩ sản khoa không chắc liệu việc chấm dứt thai kỳ có lợi hay không, được chọn ngẫu nhiên vào nhóm sinh sớm (chấm dứt thai kỳ trong vòng 48 giờ) hoặc nhóm quản lý mong đợi (với theo dõi trước sinh cho đến khi cảm thấy rằng không thể trì hoãn thêm được nữa). Tỷ lệ dùng betamethasone là như nhau ở cả hai nhóm. Tỷ lệ sống sót chu sinh là tương tự nhau, và sau 6–12 năm theo dõi, không có sự khác biệt nào về khả năng nhận thức, ngôn ngữ, hành vi hoặc vận động của những đứa trẻ được sinh ra bởi thai phụ ở nhóm sinh sớm so với những đứa trẻ ở nhóm quản lý mong đợi (132–134). Trong Disproportionate Intrauterine Growth Intervention Trial at Term, phụ nữ mang thai đơn từ 36 tuần trở lên với nghi ngờ thai bị giới hạn tăng trưởng (được định nghĩa là cân nặng ước tính của thai nhi < bách phân vị thứ 10, chu vi bụng < bách phân vị thứ 10 hoặc đường cong tăng trưởng phẳng theo đánh giá của bác sĩ lâm sàng) được chọn ngẫu nhiên để chấm dứt thai kỳ hoặc quản lý mong đợi và chỉ chấm dứt thai kỳ nếu có thêm một số chỉ định khác (135). Không có sự khác biệt về kết cục chung ở trẻ sơ sinh giữa hai nhóm này, mặc dù đoàn hệ nghiên cứu không đủ lớn để xác định liệu các kết cục cá thể, chẳng hạn như tử vong chu sinh có bị ảnh hưởng bởi các cách quản lý khác nhau hay không.
Không có thử nghiệm ngẫu nhiên nào đủ mạnh được thực hiện để xác định thời điểm chấm dứt thai kỳ tối ưu đối với thai chậm tăng trưởng trong khoảng từ 34 tuần đến 36 tuần tuổi. Dựa vào dữ liệu hiện có về thời điểm chất dứt thai kỳ cũng như sự đồng thuận của chuyên gia, năm 2011, một hội nghị chung của Viện Sức khỏe Trẻ em và Phát triển Con người Quốc gia (National Institute of Child Health and Human Development) Eunice Kennedy Shriver, Hội Y Học Bà Mẹ Và Thai Nhi, và Hội Sản Phụ Khoa Hoa Kỳ đã đề xuất hai chiến lược về thời điểm sinh đối với thai bị giới hạn tăng trưởng: 1) chấm dứt thai kỳ lúc 38 0/7–39 6/7 tuần tuổi trong trường hợp thai giới hạn tăng trưởng đơn độc và 2) chấm dứt thai kỳ lúc 34 0/7 đến 37 6/7 tuần tuổi trong trường hợp thai giới hạn tăng trưởng với các yếu tố nguy cơ khác dẫn đến kết cục bất lợi (ví dụ: thiểu ối, siêu âm Doppler bất thường, các yếu tố nguy cơ của mẹ hoặc bệnh kèm theo) (136). Năm 2020, Society for Maternal-Fetal Medicine (SMFM) Consult Series, Chẩn đoán và Quản lý Thai giới hạn tăng trưởng, đã phân loại thêm việc quản lý thai giới hạn tăng trưởng đơn độc dựa vào bách phân vị cân nặng ước tính của thai nhi (5). Đối với cân nặng ước tính của thai nhi từ bách phân vị thứ 3 đến thứ 10 và Doppler động mạch rốn bình thường, đề nghị chấm dứt thai kỳ lúc 38 0/7 và 39 0/7 tuần tuổi. Trong trường hợp thai giới hạn tăng trưởng đơn độc với cân nặng ước tính < bách phân vị thứ 3, khuyến cáo chấm dứt thai kỳ lúc 37 0/7 tuần tuổi hoặc tại thời điểm chẩn đoán nếu được chẩn đoán sớm hơn (137). Chỉ định chấm dứt thai kỳ sớm hơn trong trường hợp mất hoặc đảo ngược dòng chảy động mạch rốn (5, 137). Xem Committee Opinion 818, Medically Indicated Late-Preterm and Early-Term Deliveries, để biết thêm chi tiết về hướng dẫn thời điểm chấm dứt thai kỳ.
Khi dự kiến sinh thai bị giới hạn tăng trưởng trước 34 tuần tuổi, quá trình sinh phải được lên kế hoạch tại một trung tâm có khoa chăm sóc đặc biệt dành cho trẻ sơ sinh và lý tưởng nhất là sau khi tham vấn ý kiến của chuyên gia y học mẹ-bào thai. Corticosteroid trước sinh được khuyến cáo nếu dự kiến sinh thai trước 33 6/7 tuần tuổi vì chúng giúp cải thiện kết cục sơ sinh non tháng. Ngoài ra, corticosteroid trước sinh được khuyến cáo cho sản phụ dự kiến sinh trong khoảng từ 34 0/7 đến 36 6/7 tuần tuổi, có nguy cơ sinh non trong vòng 7 ngày và chưa được dùng liệu trình corticosteroid trước đó (138–142). Đối với những trường hợp dự kiến chấm dứt thai kỳ trước 32 tuần tuổi, nên xem xét dùng magie sulfat để bảo vệ thần kinh thai nhi và trẻ sơ sinh theo một trong các phác đồ đã được công bố và chấp nhận (143–146).
5 Tóm tắt các kết luận và khuyến cáo
Dựa vào bằng chứng khoa học tốt và nhất quán, chúng tôi đưa ra các kết luận sau (Level A):
-
Đo vận tốc Doppler động mạch rốn kết hợp với giám sát thai nhi tiêu chuẩn, chẳng hạn như nonstress test, trắc đồ sinh vật lý, hoặc cả hai, có thể giúp cải thiện kết cục ở thai nhi đã được chẩn đoán bị giới hạn tăng trưởng.
-
Corticosteroid trước sinh được khuyến cáo nếu dự kiến sinh thai trước 33 6/7 tuần tuổi vì chúng giúp cải thiện kết cục sơ sinh non tháng. Ngoài ra, corticosteroid trước sinh được khuyến cáo cho sản phụ dự kiến sinh trong khoảng từ 34 0/7 đến 36 6/7 tuần tuổi, có nguy cơ sinh non trong vòng 7 ngày và chưa được dùng liệu trình corticosteroid trước đó.
-
Đối với những trường hợp dự kiến chấm dứt thai kỳ trước 32 tuần tuổi, nên xem xét dùng magie sulfat để bảo vệ thần kinh thai nhi và trẻ sơ sinh.
-
Vì các chiến lược bổ sung dinh dưỡng và chế độ ăn uống dự phòng thai giới hạn tăng trưởng không hiệu quả nên không được khuyến cáo.
-
Chủ yếu dựa vào sự đồng thuận và ý kiến chuyên gia, chúng tôi đưa ra các khuyến cáo và kết luận sau (Level C):
-
Thai giới hạn tăng trưởng đơn thuần không phải là lý do mổ lấy thai.
-
Thời điểm chấm dứt thai kỳ tối ưu đối với thai bị giới hạn tăng trưởng phụ thuộc vào nguyên nhân nền gây ra tình trạng này (nếu biết), tuổi thai ước tính và các dấu hiệu lâm sàng khác khi giám sát thai nhi trước sinh.
6 Tài liệu tham khảo
1. Dunn PM. The search for perinatal definitions and standards. Acta Paediatr Scand Suppl 1985;319:7–16. (Level III)
2. World Health Organization. Report of a scientific group on health statistics methodology related to perinatal events. Document ICD/PE/74.4:1. Geneva: WHO; 1974. (Level III)
3. Hoffman HJ, Stark CR, Lundin FE Jr, Ashbrook JD. Analysis of birth weight, gestational age, and fetal viability, U. S. births, 1968. Obstet Gynecol Surv 1974;29:651– 81. (Level II-3)
4. Battaglia FC, Lubchenco LO. A practical classification of newborn infants by weight and gestational age. J Pediatr 1967;71:159–63. (Level III)
5. Martins JG, Biggio JR, Abuhamad A. Society for Maternal-Fetal Medicine Consult Series #52: diagnosis and management of fetal growth restriction: (replaces clinical guideline number 3, April 2012). Am J Obstet Gynecol 2020;223:B2-17. (Level III)
6. Galan HL. Timing delivery of the growth-restricted fetus. Semin Perinatol 2011;35:262–9. (Level III)
7. Platz E, Newman R. Diagnosis of IUGR: traditional biometry. Semin Perinatol 2008;32:140–7. (Level III)
8. Xu H, Simonet F, Luo ZC. Optimal birth weight percentile cut-offs in defining small- or large-for-gestational-age. Acta Paediatr 2010;99:550–5. (Level II-3)
9. Ananth CV, Vintzileos AM. Distinguishing pathological from constitutional small for gestational age births in population-based studies. Early Hum Dev 2009;85:653–8. (Level II-3)
10. Bukowski R, Uchida T, Smith GC, Malone FD, Ball RH, Nyberg DA, et al. Individualized norms of optimal fetal growth: fetal growth potential. First and Second Trimester Evaluation of Risk (FASTER) Research Consortium. Obstet Gynecol 2008;111:1065–76. (Level II-2)
11. Gardosi J, Mul T, Mongelli M, Fagan D. Analysis of birthweight and gestational age in antepartum stillbirths. Br J Obstet Gynaecol 1998;105:524–30. (Level III)
12. Ounsted M, Moar VA, Scott A. Risk factors associated with small-for-dates and large-for-dates infants. Br J Obstet Gynaecol 1985;92:226–32. (Level II-3)
13. Cunningham FG, Cox SM, Harstad TW, Mason RA, Pritchard JA. Chronic renal disease and pregnancy outcome. Am J Obstet Gynecol 1990;163:453–9. (Level III)
14. Duvekot JJ, Cheriex EC, Pieters FA, Menheere PP, Schouten HJ, Peeters LL. Maternal volume homeostasis in early pregnancy in relation to fetal growth restriction. Obstet Gynecol 1995;85:361–7. (Level III)
15. Antiphospholipid syndrome. Practice Bulletin No. 132. American College of Obstetricians and Gynecologists. Obstet Gynecol 2012;120:1514–21. (Level III)
16. Facco F, You W, Grobman W. Genetic thrombophilias and intrauterine growth restriction: a meta-analysis. Obstet Gynecol 2009;113:1206–16. (Level III)
17. Said JM, Higgins JR, Moses EK, Walker SP, Borg AJ, Monagle PT, et al. Inherited thrombophilia polymorphisms and pregnancy outcomes in nulliparous women. Obstet Gynecol 2010;115:5–13. (Level II-2)
18. Silver RM, Zhao Y, Spong CY, Sibai B, GJr Wendel, Wenstrom K, et al. Prothrombin gene G20210A mutation and obstetric complications. Eunice Kennedy Shriver National Institute of Child Health and Human Development Maternal–Fetal Medicine Units (NICHD MFMU) Network. Obstet Gynecol 2010;115:14–20. (Level II-2)
19. Bada HS, Das A, Bauer CR, Shankaran S, Lester BM, Gard CC, et al. Low birth weight and preterm births: etiologic fraction attributable to prenatal drug exposure. J Perinatol 2005;25:631–7. (Level II-3)
20. Shu XO, Hatch MC, Mills J, Clemens J, Susser M. Maternal smoking, alcohol drinking, caffeine consumption, and fetal growth: results from a prospective study. Epidemiology 1995;6:115–20. (Level II-2)
21. Mills JL, Graubard BI, Harley EE, Rhoads GG, Berendes HW. Maternal alcohol consumption and birth weight. How much drinking during pregnancy is safe? JAMA 1984;252:1875–9. (Level II-2)
22. Virji SK. The relationship between alcohol consumption during pregnancy and infant birthweight. An epidemiologic study. Acta Obstet Gynecol Scand 1991;70:303–8. (Level II-3)
23. Naeye RL, Blanc W, Leblanc W, Khatamee MA. Fetal complications of maternal heroin addiction: abnormal growth, infections, and episodes of stress. J Pediatr 1973;83:1055–61. (Level III)
24. Fulroth R, Phillips B, Durand DJ. Perinatal outcome of infants exposed to cocaine and/or heroin in utero. Am J Dis Child 1989;143:905–10. (Level II-3)
25. Little BB, Snell LM, Klein VR, Gilstrap LCIII. Cocaine abuse during pregnancy: maternal and fetal implications. Obstet Gynecol 1989;73:157–60. (Level II-3)
26. Antonov AN. Children born during the siege of Leningrad in 1942. J Pediatr 1947;30:250–9. (Level III)
27. Smith CA. Effects of maternal under nutrition upon the newborn infant in Holland (1944–1945). J Pediatr 1947; 30:229–43. (Level III)
28. Say L, Gulmezoglu AM, Hofmeyr GJ. Maternal nutrient supplementation for suspected impaired fetal growth. Cochrane Database of Systematic Reviews 2003, Issue 1. Art. No.: CD000148. DOI: 10.1002/14651858. CD000148. (Meta-analysis)
29. Guyer B, MacDorman MF, Martin JA, Peters KD, Strobino DM. Annual summary of vital statistics-1997. Pediatrics 1998;102:1333–49. (Level III)
30. Powers WF, Kiely JL. The risks confronting twins: a national perspective. Am J Obstet Gynecol 1994;170: 456–61. (Level II-3)
31. Houlton MC, Marivate M, Philpott RH. The prediction of fetal growth retardation in twin pregnancy. Br J Obstet Gynaecol 1981;88:264–73. (Level II-3)
32. Mauldin JG, Newman RB. Neurologic morbidity associated with multiple gestation. Female Patient 1998;23(4): 27–46. (Level III)
33. Denbow ML, Cox P, Taylor M, Hammal DM, Fisk NM. Placental angioarchitecture in monochorionic twin pregnancies: relationship to fetal growth, fetofetal transfusion syndrome, and pregnancy outcome. Am J Obstet Gynecol 2000;182:417–26. (Level III)
34. Maulik D. Fetal growth restriction: the etiology. Clin Obstet Gynecol 2006;49:228–35. (Level III)
35. Battino D, Granata T, Binelli S, Caccamo ML, Canevini MP, Canger R, et al. Intrauterine growth in the offspring of epileptic mothers. Acta Neurol Scand 1992;86:555–7. (Level III)
36. Mastroiacovo P, Bertollini R, Licata D. Fetal growth in the offspring of epileptic women: results of an Italian multicentric cohort study. Acta Neurol Scand 1988;78: 110–4. (Level II-2)
37. Aviles A, Diaz-Maqueo JC, Talavera A, Guzman R, Garcia EL. Growth and development of children of mothers treated with chemotherapy during pregnancy: current status of 43 children. Am J Hematol 1991;36:243–8. (Level III)
38. Hall JG, Pauli RM, Wilson KM. Maternal and fetal sequelae of anticoagulation during pregnancy. Am J Med 1980;68:122–40. (Level III)
39. Creasy RK, Resnik R, Iams JD, Lockwood CJ, Moore TR, editors. Creasy and Resnik’s maternal–fetal medicine: principles and practice. 6th ed. Philadelphia (PA): Saunders Elsevier; 2009. (Level III)
40. Desai M, ter Kuile FO, Nosten F, McGready R, Asamoa K, Brabin B, et al. Epidemiology and burden of malaria in pregnancy. Lancet Infect Dis 2007;7:93–104. (Level III)
41. Donner C, Liesnard C, Content J, Busine A, Aderca J, Rodesch F. Prenatal diagnosis of 52 pregnancies at risk for congenital cytomegalovirus infection. Obstet Gynecol 1993;82:481–6. (Level III)
42. Lambert JS, Watts DH, Mofenson L, Stiehm ER, Harris DR, Bethel J, et al. Risk factors for preterm birth, low birth weight, and intrauterine growth retardation in infants born to HIV-infected pregnant women receiving zidovudine. Pediatric AIDS Clinical Trials Group 185 Team. AIDS 2000;14:1389–99. (Level I)
43. Cailhol J, Jourdain G, Coeur SL, Traisathit P, Boonrod K, Prommas S, et al. Association of low CD4 cell count and intrauterine growth retardation in Thailand. Perinatal HIV Prevention Trial Group. J Acquir Immune Defic Syndr 2009;50:409–13. (Level I)
44. Iqbal SN, Kriebs J, Harman C, Alger L, Kopelman J, Turan O, et al. Predictors of fetal growth in maternal HIV disease. Am J Perinatol 2010;27:517–23. (Level II-3)
45. Eydoux P, Choiset A, Le Porrier N, Thepot F, SzpiroTapia S, Alliet J, et al. Chromosomal prenatal diagnosis: study of 936 cases of intrauterine abnormalities after ultrasound assessment. Prenat Diagn 1989;9:255–69. (Level III)
46. Wolstenholme J, Rooney DE, Davison EV. Confined placental mosaicism, IUGR, and adverse pregnancy outcome: a controlled retrospective U.K. collaborative survey. Prenat Diagn 1994;14:345–61. (Level II-2)
47. Wilkins-Haug L, Roberts DJ, Morton CC. Confined placental mosaicism and intrauterine growth retardation: a case-control analysis of placentas at delivery. Am J Obstet Gynecol 1995;172:44–50. (Level III)
48. Khoury MJ, Erickson JD, Cordero JF, McCarthy BJ. Congenital malformations and intrauterine growth retardation: a population study. Pediatrics 1988;82:83–90. (Level II-3)
49. Wallenstein MB, Harper LM, Odibo AO, Roehl KA, Longman RE, Macones GA, et al. Fetal congenital heart disease and intrauterine growth restriction: a retrospective cohort study. J Matern Fetal Neonatal Med 2012;25:662– 5. (Level II-3)
50. Malik S, Cleves MA, Zhao W, Correa A, Hobbs CA. Association between congenital heart defects and small for gestational age. National Birth Defects Prevention Study. Pediatrics 2007;119:e976–82. (Level II-3)
51. Raynor BD, Richards D. Growth retardation in fetuses with gastroschisis. J Ultrasound Med 1997;16:13–6. (Level III)
52. Salafia CM, Minior VK, Pezzullo JC, Popek EJ, Rosenkrantz TS, Vintzileos AM. Intrauterine growth restriction in infants of less than thirty-two weeks’ gestation: associated placental pathologic features. Am J Obstet Gynecol 1995;173:1049–57. (Level II-3)
53. Laurini R, Laurin J, Marsal K. Placental histology and fetal blood flow in intrauterine growth retardation. Acta Obstet Gynecol Scand 1994;73:529–34. (Level III)
54. Shanklin DR. The influence of placental lesions on the newborn infant. Pediatr Clin North Am 1970;17:25–42. (Level II-3)
55. Ananth CV, Demissie K, Smulian JC, Vintzileos AM. Relationship among placenta previa, fetal growth restriction, and preterm delivery: a population-based study. Obstet Gynecol 2001;98:299–306. (Level II-3)
56. Ananth CV, Wilcox AJ. Placental abruption and perinatal mortality in the United States. Am J Epidemiol 2001;153: 332–7. (Level II-3)
57. Chapman MG, Furness ET, Jones WR, Sheat JH. Significance of the ultrasound location of placental site in early pregnancy. Br J Obstet Gynaecol 1979;86:846–8. (Level III)
58. Harper LM, Odibo AO, Macones GA, Crane JP, Cahill AG. Effect of placenta previa on fetal growth. Am J Obstet Gynecol 2010;203:330.e1–e5. (Level II-2)
59. Pollack RN, Divon MY. Intrauterine growth retardation: definition, classification, and etiology. Clin Obstet Gynecol 1992;35:99–107. (Level III)
60. Thummala MR, Raju TN, Langenberg P. Isolated single umbilical artery anomaly and the risk for congenital malformations: a meta-analysis. J Pediatr Surg 1998;33:580–5. (Meta-Analysis)
61. Heifetz SA. Single umbilical artery. A statistical analysis of 237 autopsy cases and review of the literature. Perspect Pediatr Pathol 1984;8:345–78. (Level III)
62. Resnik R. Intrauterine growth restriction. Obstet Gynecol 2002;99:490–6. (Level III)
63. Pallotto EK, Kilbride HW. Perinatal outcome and later implications of intrauterine growth restriction. Clin Obstet Gynecol 2006;49:257–69. (Level III)
64. Barker DJ. Adult consequences of fetal growth restriction. Clin Obstet Gynecol 2006;49:270–83. (Level III)
65. Clausson B, Cnattingius S, Axelsson O. Outcomes of post-term births: the role of fetal growth restriction and malformations. Obstet Gynecol 1999;94:758–62. (Level II-3)
66. Getahun D, Ananth CV, Kinzler WL. Risk factors for antepartum and intrapartum stillbirth: a population-based study. Am J Obstet Gynecol 2007;196:499–507. (Level II-3)
67. Ego A, Subtil D, Grange G, Thiebaugeorges O, Senat MV, Vayssiere C, et al. Customized versus populationbased birth weight standards for identifying growth restricted infants: a French multicenter study. Am J Obstet Gynecol 2006;194:1042–9. (Level II-3)
68. Vergani P, Roncaglia N, Locatelli A, Andreotti C, Crippa I, Pezzullo JC, et al. Antenatal predictors of neonatal outcome in fetal growth restriction with absent end-diastolic flow in the umbilical artery. Am J Obstet Gynecol 2005; 193:1213–8. (Level II-3)
69. McIntire DD, Bloom SL, Casey BM, Leveno KJ. Birth weight in relation to morbidity and mortality among newborn infants. N Engl J Med 1999;340:1234–8. (Level II-2)
70. Hartung J, Kalache KD, Heyna C, Heling KS, Kuhlig M, Wauer R, et al. Outcome of 60 neonates who had ARED flow prenatally compared with a matched control group of appropriate-for-gestational age preterm neonates. Ultrasound Obstet Gynecol 2005;25:566–72. (Level II-2)
71. Shand AW, Hornbuckle J, Nathan E, Dickinson JE, French NP. Small for gestational age preterm infants and relationship of abnormal umbilical artery Doppler blood flow to perinatal mortality and neurodevelopmental outcomes. Aust N Z J Obstet Gynaecol 2009;49:52–8. (Level II-2)
72. Jones RA, Roberton NR. Problems of the small-for-dates baby. Clin Obstet Gynaecol 1984;11:499–524. (Level III)
73. Alkalay AL, Graham JMJr, Pomerance JJ. Evaluation of neonates born with intrauterine growth retardation: review and practice guidelines. J Perinatol 1998;18:142–51. (Level III)
74. Sparks TN, Cheng YW, McLaughlin B, Esakoff TF, Caughey AB. Fundal height: a useful screening tool for fetal growth? J Matern Fetal Neonatal Med 2011;24:708– 12. (Level II-2)
75. Leeson S, Aziz N. Customised fetal growth assessment. Br J Obstet Gynaecol 1997;104:648–51. (Level III)
76. Jahn A, Razum O, Berle P. Routine screening for intrauterine growth retardation in Germany: low sensitivity and questionable benefit for diagnosed cases. Acta Obstet Gynecol Scand 1998;77:643–8. (Level II-3)
77. Kean LH, Liu DT. Antenatal care as a screening tool for the detection of small for gestational age babies in the low risk population. J Obstet Gynaecol 1996;16:77–82. (Level II-3)
78. Goetzinger KR, Tuuli MG, Odibo AO, Roehl KA, Macones GA, Cahill AG. Screening for fetal growth disorders by clinical exam in the era of obesity. J Perinatol 2012. DOI: 10.1038/jp.2012.130. (Level II-2)
79. Hadlock FP, Harrist RB, Sharman RS, Deter RL, Park SK. Estimation of fetal weight with the use of head, body, and femur measurements––a prospective study. Am J Obstet Gynecol 1985;151:333–7. (Level III)
80. Hadlock FP, Harrist RB, Carpenter RJ, Deter RL, Park SK. Sonographic estimation of fetal weight. The value of femur length in addition to head and abdomen measurements. Radiology 1984;150:535–40. (Level III)
81. Chien PF, Owen P, Khan KS. Validity of ultrasound estimation of fetal weight. Obstet Gynecol 2000;95:856–60. (Level II-2)
82. Dudley NJ. A systematic review of the ultrasound estimation of fetal weight. Ultrasound Obstet Gynecol 2005;25: 80–9. (Level III)
83. Kingdom JC, Burrell SJ, Kaufmann P. Pathology and clinical implications of abnormal umbilical artery Doppler waveforms. Ultrasound Obstet Gynecol 1997;9:271–86. (Level III)
84. Pardi G, Cetin I, Marconi AM, Lanfranchi A, Bozzetti P, Ferrazzi E, et al. Diagnostic value of blood sampling in fetuses with growth retardation. N Engl J Med 1993;328: 692–6. (Level III)
85. Nicolaides KH, Bilardo CM, Soothill PW, Campbell S. Absence of end diastolic frequencies in umbilical artery: a sign of fetal hypoxia and acidosis. BMJ 1988;297:1026–7. (Level III)
86. Bilardo CM, Nicolaides KH, Campbell S. Doppler measurements of fetal and uteroplacental circulations: relationship with umbilical venous blood gases measured at cordocentesis. Am J Obstet Gynecol 1990;162:115–20. (Level III)
87. Giles W, Bisits A. Clinical use of Doppler ultrasound in pregnancy: information from six randomised trials. Fetal Diagn Ther 1993;8:247–55. (Level III)
88. Casanova R, Chuang A, Goepfert AR, Hueppchen NA, Weiss PM, Beckmann CR, et al. Beckmann and Ling’s obstetrics and gynecology. 8th ed. Philadelphia (PA): Wolters Kluwer; 2019. (Level III)
89. Rizzo G, Capponi A, Arduini D, Romanini C. The value of fetal arterial, cardiac and venous flows in predicting pH and blood gases measured in umbilical blood at cordocentesis in growth retarded fetuses. Br J Obstet Gynaecol 1995;102:963–9. (Level III)
90. Hecher K, Snijders R, Campbell S, Nicolaides K. Fetal venous, intracardiac, and arterial blood flow measurements in intrauterine growth retardation: relationship with fetal blood gases. Am J Obstet Gynecol 1995;173:10–5. (Level III)
91. Baschat AA. Doppler application in the delivery timing of the preterm growth-restricted fetus: another step in the right direction. Ultrasound Obstet Gynecol 2004;23: 111–8. (Level III)
92. Ghidini A. Doppler of the ductus venosus in severe preterm fetal growth restriction: a test in search of a purpose? Obstet Gynecol 2007;109:250–2. (Level III)
93. Irwin JC, Suen LF, Martina NA, Mark SP, Giudice LC. Role of the IGF system in trophoblast invasion and preeclampsia. Hum Reprod 1999;14(suppl 2):90–6. (Level III)
94. Spencer K, Cowans NJ, Avgidou K, Molina F, Nicolaides KH. First-trimester biochemical markers of aneuploidy and the prediction of small-for-gestational age fetuses. Ultrasound Obstet Gynecol 2008;31:15–9. (Level II-3)
95. Krantz D, Goetzl L, Simpson JL, Thom E, Zachary J, Hallahan TW, et al. Association of extreme firsttrimester free human Chorionic gonadotropin-beta, pregnancy-associated plasma protein A, and nuchal translucency with intrauterine growth restriction and other adverse pregnancy outcomes. First Trimester Maternal Serum Biochemistry and Fetal Nuchal Translucency Screening (BUN) Study Group. Am J Obstet Gynecol 2004;191:1452–8. (Level II-2)
96. Goetzl L, Krantz D, Simpson JL, Silver RK, Zachary JM, Pergament E, et al. Pregnancy-associated plasma protein A, free beta-hCG, nuchal translucency, and risk of pregnancy loss. Obstet Gynecol 2004;104:30–6. (Level II-2)
97. Dugoff L. First- and second-trimester maternal serum markers for aneuploidy and adverse obstetric outcomes. Society for Maternal-Fetal Medicine. Obstet Gynecol 2010;115:1052–61. (Level II-2)
98. Zhong Y, Tuuli M, Odibo AO. First-trimester assessment of placenta function and the prediction of preeclampsia and intrauterine growth restriction. Prenat Diagn 2010;30: 293–308. (Level III)
99. Poon LC, Stratieva V, Piras S, Piri S, Nicolaides KH. Hypertensive disorders in pregnancy: combined screening by uterine artery Doppler, blood pressure and serum PAPP-A at 11–13 weeks. Prenat Diagn 2010;30:216–23. (Level II-2)
100. Goetzinger KR, Singla A, Gerkowicz S, Dicke JM, Gray DL, Odibo AO. Predicting the risk of pre-eclampsia between 11 and 13 weeks’ gestation by combining maternal characteristics and serum analytes, PAPP-A and free beta-hCG. Prenat Diagn 2010;30:1138–42. (Level II-3)
101. Alfiveric Z, Stampalija T, Medley N. Fetal and umbilical Doppler ultrasound in normal pregnancy. Cochrane Database of Systematic Reviews 2015, Issue 4. Art. No.: CD001450. DOI: 10.1002/14651858.CD001450.pub4. (Systematic Review and Meta-Analysis)
102. Morris RK, Malin G, Robson SC, Kleijnen J, Zamora J, Khan KS. Fetal umbilical artery Doppler to predict compromise of fetal/neonatal wellbeing in a high-risk population: systematic review and bivariate meta-analysis. Ultrasound Obstet Gynecol 2011;37:135–42. (Meta-analysis)
103. Silver RM, Varner MW, Reddy U, Goldenberg R, Pinar H, Conway D, et al. Work-up of stillbirth: a review of the evidence. Am J Obstet Gynecol 2007;196:433–44. (Level III)
104. Inherited thrombophilias in pregnancy. ACOG Practice Bulletin No. 197. American College of Obstetricians and Gynecologists [published erratum appears in Obstet Gynecol 2018;132:1069]. Obstet Gynecol 2018;132:e18–34. (Level III)
105. Kafatos AG, Vlachonikolis IG, Codrington CA. Nutrition during pregnancy: the effects of an educational intervention program in Greece. Am J Clin Nutr 1989;50:970–9. (Level II-1)
106. Khoury J, Henriksen T, Christophersen B, Tonstad S. Effect of a cholesterol-lowering diet on maternal, cord, and neonatal lipids, and pregnancy outcome: a randomized clinical trial. Am J Obstet Gynecol 2005;193:1292– 301. (Level I)
107. Steegers EA, Van Lakwijk HP, Jongsma HW, Fast JH, De Boo T, Eskes TK, et al. (Patho)physiological implications of chronic dietary sodium restriction during pregnancy; a longitudinal prospective randomized study. Br J Obstet Gynaecol 1991;98:980–7. (Level I)
108. Pena-Rosas JP, De-Regil LM, Dowswell T, Viteri FE. Daily oral iron supplementation during pregnancy. Cochrane Database of Systematic Reviews 2012, Issue 12. Art. No.: CD004736. DOI: 10.1002/14651858. CD004736.pub4. (Level III)
109. Mori R, Ota E, Middleton P, Tobe-Gai R, Mahomed K, Bhutta ZA. Zinc supplementation for improving pregnancy and infant outcome. Cochrane Database of Systematic Reviews 2012, Issue 7. Art. No.: CD000230. DOI: 10.1002/14651858.CD000230.pub4. (Meta-analysis)
110. Hofmeyr GJ, Lawrie TA, Atallah AN, Duley L. Calcium supplementation during pregnancy for preventing hypertensive disorders and related problems. Cochrane Database of Systematic Reviews 2010, Issue 8. Art. No.: CD001059. DOI: 10.1002/14651858.CD001059.pub3. (Meta-analysis)
111. Ota E, Tobe-Gai R, Mori R, Farrar D. Antenatal dietary advice and supplementation to increase energy and protein intake. Cochrane Database of Systematic Reviews 2012, Issue 9. Art. No.: CD000032. DOI: 10. 1002/14651858.CD000032.pub2. (Meta-analysis)
112. Makrides M, Crowther CA. Magnesium supplementation in pregnancy. Cochrane Database of Systematic Reviews 2001, Issue 4. Art. No.: CD000937. DOI: 10. 1002/14651858.CD000937. (Meta-analysis)
113. De-Regil LM, Palacios C, Ansary A, Kulier R, Pena-Rosas JP. Vitamin D supplementation for women during pregnancy. Cochrane Database of Systematic Reviews 2012, Issue 2. Art. No.: CD008873. DOI: 10. 1002/14651858.CD008873.pub2. (Meta-analysis)
114. Say L, Gulmezoglu AM, Hofmeyr GJ. Bed rest in hospital for suspected impaired fetal growth. Cochrane Database of Systematic Reviews 1996, Issue 1. Art. No.: CD000034. DOI: 10.1002/14651858.CD000034. (Metaanalysis)
115. Bujold E, Roberge S, Lacasse Y, Bureau M, Audibert F, Marcoux S, et al. Prevention of preeclampsia and intrauterine growth restriction with aspirin started in early pregnancy: a meta-analysis. Obstet Gynecol 2010;116: 402–14. (Meta-analysis)
116. Peleg D, Kennedy CM, Hunter SK. Intrauterine growth restriction: identification and management. Am Fam Physician 1998;58:453–60, 466–7. (Level III)
117. Gulmezolu M, de Onis M, Villar J. Effectiveness of interventions to prevent or treat impaired fetal growth. Obstet Gynecol Surv 1997;52:139–49. (Level III)
118. Leitich H, Egarter C, Husslein P, Kaider A, Schemper M. A meta-analysis of low dose aspirin for the prevention of intrauterine growth retardation. Br J Obstet Gynaecol 1997;104:450–9. (Meta-analysis)
119. Bahado-Singh RO, Lynch L, Deren O, Morroti R, Copel JA, Mahoney MJ, et al. First-trimester growth restriction and fetal aneuploidy: the effect of type of aneuploidy and gestational age. Am J Obstet Gynecol 1997;176:976–80. (Level II-3)
120. Sassoon DA, Castro LC, Davis JL, Hobel CJ. Perinatal outcome in triplet versus twin gestations. Obstet Gynecol 1990;75:817–20. (Level II-2)
121. Alexandr JM, Hammond KR, Steinkampf MP. Multifetal reduction of high-order multiple pregnancy: comparison of obstetrical outcome with nonreduced twin gestations. Fertil Steril 1995;64:1201–3. (Level III)
122. Silver R, Helfand BT, Russell TL, Ragin A, Sholl JS, MacGregor SN. Multifetal reduction increases the risk of preterm delivery and fetal growth restriction in twins: a case-control study. Fertil Steril 1997;67:30–3. (Level II-2)
123. Multifetal gestations: twin, triplet, and higher-order multifetal pregnancies. ACOG Practice Bulletin No. 169. American College of Obstetricians and Gynecologists. Obstet Gynecol 2016;128:e131–46. (Level III)
124. Machin A. Velamentous cord insertion in monochorionic twin gestation. An added risk factor. J Reprod Med 1997; 42:785–9. (Level III)
125. Divon MY, Chamberlain PF, Sipos L, Manning FA, Platt LD. Identification of the small for gestational age fetus with the use of gestational age-independent indices of fetal growth. Am J Obstet Gynecol 1986;155:1197–201. (Level II-3)
126. Mongelli M, Ek S, Tambyrajia R. Screening for fetal growth restriction: a mathematical model of the effect of time interval and ultrasound error. Obstet Gynecol 1998; 92:908–12. (Level II-3)
127. Arabin B, Bergmann PL, Saling E. Simultaneous assessment of blood flow velocity waveforms in uteroplacental vessels, the umbilical artery, the fetal aorta and the fetal common carotid artery. Fetal Ther 1987;2:17–26. (Level III)
128. Lees CC, Marlow N, van Wassenaer-Leemhuis A, Arabin B, Bilardo CM, Brezinka C, et al. 2 year neurodevelopmental and intermediate perinatal outcomes in infants with very preterm fetal growth restriction (TRUFFLE): a randomised trial. TRUFFLE study group [published erratum appears in Lancet 2015;385:2152]. Lancet 2015;385:2162–72. (Level I)
129. Veille JC, Kanaan C. Duplex Doppler ultrasonographic evaluation of the fetal renal artery in normal and abnormal fetuses. Am J Obstet Gynecol 1989;161:1502–7. (Level III)
130. Gramellini D, Folli MC, Raboni S, Vadora E, Merialdi A. Cerebral-umbilical Doppler ratio as a predictor of adverse perinatal outcome. Obstet Gynecol 1992;79:416–20. (Level III)
131. Bahado-Singh RO, Kovanci E, Jeffres A, Oz U, Deren O, Copel J, et al. The Doppler cerebroplacental ratio and perinatal outcome in intrauterine growth restriction. Am J Obstet Gynecol 1999;180:750–6. (Level II-3)
132. A randomised trial of timed delivery for the compromised preterm fetus: short term outcomes and Bayesian interpretation. GRIT Study Group. BJOG 2003;110:27–32. (Level I)
133. Thornton JG, Hornbuckle J, Vail A, Spiegelhalter DJ, Levene M. Infant wellbeing at 2 years of age in the Growth Restriction Intervention Trial (GRIT): multicentred randomised controlled trial. GRIT study group. Lancet 2004;364:513–20. (Level I)
134. Walker DM, Marlow N, Upstone L, Gross H, Hornbuckle J, Vail A, et al. The Growth Restriction Intervention Trial: long-term outcomes in a randomized trial of timing of delivery in fetal growth restriction. Am J Obstet Gynecol 2011;204:34.e1–e9. (Level I)
135. Boers KE, Vijgen SM, Bijlenga D, van der Post JA, Bekedam DJ, Kwee A, et al. Induction versus expectant monitoring for intrauterine growth restriction at term: randomised equivalence trial (DIGITAT). DIGITAT Study Group. BMJ 2010;341:c7087. (Level I)
136. Spong CY, Mercer BM, D’Alton M, Kilpatrick S, Blackwell S, Saade G. Timing of indicated late-preterm and early-term birth. Obstet Gynecol 2011;118:323–33. (Level III)
137. Medically indicated late-preterm and early-term deliveries. ACOG Committee Opinion No. 818. American College of Obstetricians and Gynecologists. Obstet Gynecol 2021;137:e29–33. (Level III)
138. Antenatal corticosteroids revisited: repeat courses. NIH Consensus Statement 2000;17:1–18. (Level III)
139. Roberts D, Dalziel SR. Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth. Cochrane Database of Systematic Reviews 2006, Issue 3. Art. No.: CD004454. DOI: 10. 1002/14651858.CD004454.pub2. (Meta-analysis)
140. Effect of corticosteroids for fetal maturation on perinatal outcomes. NIH Consens Statement 1994;12:1–24. (Level III)
141. Gyamfi-Bannerman C, Thom EA, Blackwell SC, Tita AT, Reddy UM, Saade GR, et al. Antenatal betamethasone for women at risk for late preterm delivery. NICHD Maternal-Fetal Medicine Units Network. N Engl J Med 2016;374:1311–20. (Level I)
142. Antenatal corticosteroid therapy for fetal maturation. Committee Opinion No. 713. American College of Obstetricians and Gynecologists. Obstet Gynecol 2017;130: e102–9. (Level III)
143. Crowther CA, Verkuyl DA, Neilson JP, Bannerman C, Ashurst HM. The effects of hospitalization for rest on fetal growth, neonatal morbidity and length of gestation in twin pregnancy. Br J Obstet Gynaecol 1990;97:872–7. (Level I)
144. Marret S, Marpeau L, Zupan-Simunek V, Eurin D, Leveque C, Hellot MF, et al. Magnesium sulphate given before very-preterm birth to protect infant brain: the randomised controlled PREMAG trial*. PREMAG Trial Group. BJOG 2007;114:310–8. (Level I)
145. Rouse DJ, Hirtz DG, Thom E, Varner MW, Spong CY, Mercer BM, et al. A randomized, controlled trial of magnesium sulfate for the prevention of cerebral palsy. Eunice Kennedy Shriver NICHD Maternal–Fetal Medicine Units Network. N Engl J Med 2008;359:895–905. (Level I)
146. Magnesium sulfate before anticipated preterm birth for neuroprotection. Committee Opinion No. 455. American College of Obstetricians and Gynecologists. Obstet Gynecol 2010;115:669–71. (Level III)

