Điều trị Helicorbacter pylori lý tưởng cho hiện tại và tương lai
Trungtamthuoc.com- Vi khuẩn Helicobacter pylori là một trong những nguyên nhân chính gây ra các bệnh lý về dạ dày hiện nay. Tuy nhiên việc điều trị diệt vi khuẩn H.pylori đang có nhiều "lỗ hổng" trong quá trình điều trị dẫn đến việc kháng kháng sinh, rối loạn hệ vi sinh vật đường ruột. Vì vậy cần tìm ra phương pháp lý tưởng để điều trị diệt vi khuẩn H.pylori ở hiện tại và tương lai.
The Ideal Helicobacter pylori Treatment for the Present and the Future, tải bản gốc tại đây
Dịch bởi bác sĩ Lê Duyên, tải bản dịch PDF tại đây
Thực trạng: Các phương pháp điều trị diệt vi khuẩn Helicobacter pylori được thực hiện rộng rãi để cải thiện tình trạng viêm loét dạ dày, thúc đẩy quá trình lành vết loét và giảm tỷ lệ mắc ung thư dạ dày. Tuy nhiên, có một số vấn đề liên quan đến việc điều trị tiệt trừ H. pylori:
- Đầu tiên, các phác đồ điều trị khác nhau hiện đang được sử dụng trên toàn thế giới và phương pháp điều trị tiêu chuẩn khác nhau tùy theo khu vực và quốc gia.
- Thứ hai, tình trạng kháng kháng sinh của H.pylori ngày càng gia tăng do sử dụng kháng sinh bừa bãi.
- Cuối cùng, rối loạn hệ vi sinh vật đường ruột có khả năng xảy ra do điều trị H. pylori.
Tóm tắt: Dựa trên các hướng dẫn quốc tế hiện hành và phân tích tổng hợp mạng lưới so sánh hiệu quả của các phác đồ điều trị khác nhau:
- Phác đồ 4 thuốc không sử dụng Bismuth trong 10–14 ngày và phác đồ ba thuốc dựa trên vonoprazan trong 7 ngày là các phác đồ điều trị H. pylori được khuyến nghị hiện nay. Các phác đồ này cho thấy tỷ lệ diệt trừ tốt khoảng 90%, ngay cả ở những khu vực mà các chủng kháng kháng sinh rất phổ biến.
- Tuy nhiên, các phác đồ điều trị này vẫn có những hạn chế cố hữu có thể thúc đẩy sự gia tăng hơn nữa tình trạng kháng thuốc kháng sinh và gây ra tình trạng rối loạn hệ vi sinh vật đường ruột do sử dụng nhiều loại kháng sinh theo kinh nghiệm.
Thông điệp chính: Khái niệm lý tưởng cho việc điều trị tiệt trừ H. pylori hiện tại và tương lai liên quan đến “một chiến lược đơn giản, tiết kiệm chi phí nhằm thúc đẩy sự tuân thủ mà không có tác động tiêu cực đến hệ vi sinh vật đường ruột hoặc góp phần gây ra tình trạng kháng kháng sinh trong tương lai”. Một khả năng thú vị có thể đáp ứng khái niệm này là phác đồ kép liên quan đến vonoprazan và amoxicillin. Đây là phác đồ điều trị đơn giản nhất mang lại tỷ lệ diệt trừ ở mức chấp nhận được, cải thiện tính an toàn và khả năng dung nạp, đồng thời giảm thiểu khả năng tăng tình trạng kháng kháng sinh hoặc gây rối loạn hệ vi sinh vật đường ruột.
1 Giới thiệu
Helicobacter pylori là vi khuẩn gram âm, hình roi, xoắn ốc, thường lây nhiễm sang người, với ước tính khoảng 4,4 tỷ người nhiễm bệnh trên toàn thế giới [1]. Nhiễm H. pylori gây viêm dạ dày, bệnh loét dạ dày, u lympho mô bạch huyết liên quan đến niêm mạc và ung thư dạ dày [2]. Các phương pháp điều trị diệt trừ H. pylori được thực hiện rộng rãi để cải thiện tình trạng viêm niêm mạc dạ dày, thúc đẩy quá trình lành vết loét và giảm tỷ lệ mắc ung thư dạ dày và tỷ lệ tử vong liên quan.
Các phác đồ điều trị diệt trừ H. pylori khác nhau được sử dụng trên toàn thế giới, với phác đồ điều trị tiêu chuẩn khác nhau tùy theo khu vực và quốc gia do sự khác biệt về thuốc sẵn có và khả năng kháng kháng sinh của H. pylori. Hơn nữa, việc loại trừ H. pylori ngày càng trở nên khó khăn vì những vấn đề mới bao gồm những thay đổi về trao đổi chất và thay đổi hệ vi sinh vật đường ruột sau khi điều trị. Do đó, chúng tôi xem xét các tài liệu gần đây về phác đồ điều trị H. pylori và xem xét các phác đồ được khuyến nghị hiện tại để đề xuất phác đồ điều trị lý tưởng cho tương lai.
2 Chẩn đoán và điều trị nhiễm H.pylori hiện nay
Chẩn đoán nhiễm H. pylori thường dựa trên sự kết hợp của các xét nghiệm lâm sàng, nội soi và xét nghiệm, chẳng hạn như xét nghiệm urê trong hơi thở, xét nghiệm kháng nguyên phân, huyết thanh học và nội soi bằng sinh thiết .Những tiến bộ gần đây trong chẩn đoán H. pylori bao gồm việc sử dụng giải trình tự thế hệ tiếp theo.
Việc điều trị nhiễm H. pylori bao gồm sự kết hợp của kháng sinh, thuốc ức chế bơm proton (PPI) và đôi khi là hợp chất bismuth. Các loại kháng sinh được sử dụng phổ biến nhất để điều trị nhiễm H. pylori là clarithromycin, amoxicillin, Metronidazole và Tetracycline.
3 Phác đồ điều trị H.pylori chuẩn hiện nay
Hướng dẫn điều trị H. pylori đã được công bố ở nhiều vùng. Phác đồ diệt trừ H. pylori được khuyến nghị là phương pháp điều trị đầu tiên theo hướng dẫn quốc tế hiện hành được trình bày trong Bảng 1. Báo cáo đồng thuận Maastricht V/Florence [3] (Châu Âu), Đồng thuận Toronto [4] và Hướng dẫn lâm sàng của Trường Cao đẳng Tiêu hóa Hoa Kỳ [ 5] (Bắc Mỹ) :
Khuyến cáo điều trị bốn thuốc bismuth hoặc phác đồ bốn thuốc không sử dụng bismuth trong 10–14 ngày như là phương pháp điều trị đầu tiên cho bệnh nhân ở những vùng có tỷ lệ H.pylori kháng Clarithromycin cao.
- Phác đồ bốn thuốc bismuth bao gồm thuốc ức chế bơm proton (PPI), bismuth và 2 loại kháng sinh. Theo truyền thống, các loại kháng sinh được sử dụng là metronidazole và tetracycline; gần đây, các thuốc khác như amoxicillin, clarithromycin và Tinidazole cũng đã được đưa vào sử dụng.
- Phác đồ 4 thuốc gồm một PPI và 3 loại kháng sinh, điển hình là amoxicillin, clarithromycin và metronidazole. Các nghiên cứu quan sát quy mô lớn đã báo cáo kết quả tiêu diệt cao (>90%) với cả hai phác đồ trong thực hành lâm sàng thực tế ở Châu Âu [9, 10].
- Các hướng dẫn tham khảo trước đó khuyến cáo chỉ nên điều trị ba thuốc có chứa clarithromycin ở những vùng có mức độ kháng clarithromycin thấp và chỉ ở những bệnh nhân chưa dùng kháng sinh macrolide.
| Guideline |
Phác đồ |
Thời gian điều trị(ngày) |
| Báo cáo đồng thuận Maastricht V/ Florence [3] |
Ở những vùng có tỷ lệ kháng CLA thấp (<15%) Phác đồ 3 thuốc: (PPI+CLA+AMO) (PPI+CLA+MET) |
14
|
|
Ở những vùng có tỷ lệ kháng CLA cao (>15%): Phác đồ 4 thuốc bismuth: (PPI+bismuth+2 loại kháng sinh) |
||
|
Phác đồ 4 thuốc: PPI+AMO+CLA+MET/ TIN |
14 | |
| Đồng thuận Toronto [4] |
Ở những vùng có tỷ lệ kháng CLA thấp (<15%) Phác đồ 3 thuốc: (PPI+CLA+AMO) (PPI+CLA+ MET) (PPI+AMO+MET) |
14 |
|
Ở những vùng có tỷ lệ kháng CLA cao (>15%) Phác đồ 4 thuốc bismuth: (PPI+bismuth+TET + MET) |
||
|
Điều trị đồng thời 4 thuốc: (PPI+AMO+CLA+MET) |
14 | |
| Hướng dẫn lâm sàng của ACG [5] |
Ở những vùng có tỷ lệ kháng CLA thấp (<15%) và với bệnh nhân không dùng macrolide trước đó: Phác đồ 3 thuốc: (PPI CLA+AMO) (PPI- CLA+MET) |
|
|
Ở những vùng có mức độ kháng CLA cao (15%) hoặc ở những bệnh nhân đã từng tiếp xúc với macrolide trước đó Phác đồ điều trị 4 thuốc Bismuth : (PPI+bismuth+TET- MET) Điều trị đồng thời 4 thuốc: (PPI+AMO+CLA+MET) |
||
| Báo cáo đồng thuận quốc gia lần thứ năm của Trung Quốc [6] |
Phác đồ 4 thuốc bismuth : (PPI + bismuth+2 loại kháng sinh) |
10-14 |
| Hướng dẫn Hàn Quốc 2020 [7] |
Phác đồ 3 thuốc tiêu chuẩn: (PPI+CLA+AMO) |
14
|
|
Điều trị nối tiếp: (PPI+AMO/ 5 ngày tiếp theo là PPI +CLA+ MET/ 5 ngày) Điều trị đồng thời 4 thuốc : (PPI+AMO+CLA + MET) |
10 | |
| Guideline của Nhật Bản 2016 (8) | Phác đồ tiêu chuẩn hoặc phác đồ ba thuốc:vonoprazan (PPI/ P- CAB+AMO+CLA/ MET) | 7 |
| ACG, Đại học Tiêu hóa Hoa Kỳ, AMO, amoxicillin; CLA, clarithromycin; MET, metronidazole: P- CAB, thuốc chẹn axit cạnh tranh Kali (vonoprazan); PPI, chất ức chế bơm proton; TIN, tinidazole, TET, tetracycline. | ||
Ở châu Á, hướng dẫn của Trung Quốc [6] cũng khuyến cáo phác đồ điều trị phác đồ bốn thuốc bismuth trong thời gian 10 đến 14 ngày như một phương pháp điều trị theo kinh nghiệm. Mặt khác, các hướng dẫn của Hàn Quốc [7] và Nhật Bản [8] vẫn khuyến nghị điều trị ba thuốc tiêu chuẩn, chứa clarithromycin, là phương pháp điều trị đầu tiên. Hướng dẫn của Hàn Quốc khuyến cáo thời gian điều trị dài hơn (14 ngày) đối với phác đồ ba thuốc và phác đồ bốn thuốc không bismuth (phác đồ đồng thời và nối tiếp) nên được sử dụng như phương pháp điều trị đầu tay theo kinh nghiệm. Tại Nhật Bản, một loại thuốc ức chế axit dạ dày mới, vonoprazan, đã được ra mắt vào năm 2015; Phác đồ ba thuốc dựa trên vonoprazan kéo dài 7 ngày, bao gồm việc sử dụng vonoprazan, Amoxicillin và clarithromycin, đạt được tỷ lệ diệt trừ thành công đáng kể. Phác đồ điều trị đầu tiên này được báo cáo là mang lại tỷ lệ tiệt trừ 89–93% trong thử nghiệm đối chứng ngẫu nhiên đầu tiên [11] và trong thực hành lâm sàng thực tế [12]; hơn nữa, tỷ lệ thành công là >80% ngay cả đối với các chủng kháng clarithromycin [13, 14]. Một loại thuốc đóng gói dạng vỉ ba loại thuốc (vonoprazan, amoxicillin và clarithromycin/metronidazole) đã được ra mắt vào năm 2016 tại Nhật Bản và cho thấy sự tuân thủ điều trị của bệnh nhân được cải thiện [15]. Do đó, phác đồ ba thuốc dựa trên vonoprazan kéo dài 7 ngày này hiện là phác đồ chính được sử dụng ở Nhật Bản [16].
|
Phác đồ |
PPVP-CAB |
Thuốc kháng sinh |
Thời gian điều trị (ngày) |
Tỷ lệ diệt trừ |
|
| ITT |
PP |
||||
|
4 thuốc Bismuth |
Lansoprazole (30 mg ngày 2 lần) |
MTZ (500 mg mỗi ngày) TET (500 mg mỗi ngày) Bismuth (300 mg mỗi ngày) |
10 |
74% [17] |
93% [17] |
|
Điều trị đồng thời 4 thuốc |
Esomeprazole (20 mg ngày 2 lần) |
AMO (1.000 mg ngày 2 lần) CLA (500 mg ngày 2 lần) MET (ngày 2 lần 500 mg) |
14 87% [18]
|
87% [18] |
94% [18] |
|
Phác đồ nối tiếp |
Rabeprazole (20 mg ngày 2 lần) |
AMO (ngày 2 lần 1.000 mg) trong 5 ngày, sau đó là CLA (ngày 2 lần 500 mg) trong 5 ngày TIN (ngày 2 lần 500 mg) trong 5 ngày |
82% [19] |
95% [19] |
|
|
Phác đồ lai Esomeprazole (40 mg ngày 2 lần) |
Esomeprazole (40 mg ngày 2 lần)
AMO (1.000 mg ngày 2 lần) trong 14 ngày CLA (500 mg ngày 2 lần) trong 7 ngày qua MET (500 mg) trong 7 ngày qua
|
AMO (1.000 mg ngày 2 lần) trong 14 ngày CLA (500 mg ngày 2 lần) trong 7 ngày qua MET (500 mg) trong 7 ngày qua |
83% [20] |
95% [20] |
|
|
Phác đồ lai ngược
|
Dexlansoprazole (60 mg mỗi ngày) |
AMO (1.000 mg ngày 2 lần) trong 14 ngày CLA (500 mg ngày 2 lần) trong 7 ngày đầu MET (500 mg) trong 7 ngày đầu |
95% [21] |
96% [21] | |
|
Phác đồ ba thuốc tiêu chuẩn dựa trên PPI
Phác đồ kép vonoprazan-amoxicillin Vonoprazan (20 mg ngày 2 lần) AMO (750 mg ngày 2 lần)
7 85% [24]
87% [24] |
Lansoprazole (30 mg ngày 2 lần) |
AMO (1.000 mg ngày 2 lần) CLA (500 mg ngày 2 lần) |
14 |
56% [22] |
63% [22] |
|
Phác đồ liều cao kép PPI-amoxicillin |
Esomeprazole (20 mg mỗi ngày) |
AMO (750 mg ngày bốn lần) |
14 |
87% [23] |
92% [23] |
|
Phác đồ ba thuốc dựa trên Vonoprazan
|
Vonoprazan (20 mg ngày 2 lần) |
AMO (750 mg ngày 2 lần) CLA (200 mg ngày 2 lần) |
7 |
89% [24] |
90% [24] |
|
Phác đồ kép vonoprazan-amoxicillin
|
Vonoprazan (20 mg ngày 2 lần) |
AMO (750 mg ngày 2 lần) |
7 |
85% [24] |
87% [24] |
|
AMO, amoxicillin; ngày 2 lần, hai lần mỗi ngày; CLA, clarithromycin; ITT, ý định điều trị; MET, metronidazole; P-CAB, thuốc chẹn kênh kali (vonoprazan); PP, mỗi giao thức; PPI, chất ức chế bơm proton; qd, một lần mỗi ngày; qid, 4 lần mỗi ngày; TET, tetracycline;3 lần mỗi ngày; TIN, tinidazol. |
|||||
Việc so sánh trực tiếp hiệu quả của từng phác đồ để xác định phác đồ “tốt nhất” là rất khó vì các phác đồ thường được sử dụng khác nhau tùy theo vùng/quốc gia do sự khác biệt về bảo hiểm y tế và sự sẵn có của thuốc. Một phân tích tổng hợp mạng lưới, được xuất bản vào năm 2021, đã so sánh tác dụng của các phác đồ điều trị khác nhau hiện đang được sử dụng [25]. Nó đã phân tích 68 thử nghiệm lâm sàng ngẫu nhiên, bao gồm 22.975 bệnh nhân và so sánh tỷ lệ tiệt trừ H. pylori đối với các phương pháp điều trị theo kinh nghiệm đầu tiên bao gồm 8 phác đồ, cụ thể là phác đồ bốn thuốc bismuth, phác đồ bốn thuốc đồng thời, phác đồ nối tiếp, phác đồ lai ngược, phác đồ chứa Levofloxacin, phác đồ kép PPI-amoxicillin liều cao, phác đồ ba thuốc tiêu chuẩn dựa trên PPI và phác đồ ba thuốc dựa trên vonoprazan.
- Nghiên cứu xác định phác đồ điều trị bộ ba dựa trên vonoprazan có hiệu quả diệt trừ bệnh tốt nhất, tiếp theo là phác đồ điều trị bốn lần đồng thời và phác đồ kết hợp ngược, trong kết quả xếp hạng hiệu quả so sánh.
- Dựa trên nghiên cứu đó, phác đồ ba thuốc dựa trên vonoprazan là phác đồ điều trị tốt nhất và nên được sử dụng làm phương pháp điều trị đầu tiên ở những vùng có sẵn vonoprazan. Khi không có vonoprazan, phác đồ bốn thuốc không bismuth bao gồm phác đồ bốn thuốc đồng thời hoặc phác đồ kết hợp ngược được khuyến nghị là phương pháp điều trị đầu tiên.
Các vấn đề với phương pháp điều trị tiêu chuẩn hiện nay
Các phương pháp điều trị diệt trừ H.pylori tiêu chuẩn hiện nay, bao gồm phác đồ ba thuốc dựa trên vonoprazan và phác đồ bốn thuốc không bismuth, có một số hạn chế mặc dù chúng mang lại hiệu quả diệt trừ đầy đủ.
Vấn đề chính liên quan đến điều trị tiệt trừ H. pylori là sự gia tăng tỷ lệ các chủng kháng kháng sinh. Việc sử dụng kháng sinh bừa bãi cho mục đích y tế và thú y đang phổ biến ở nhiều quốc gia và việc tiêu thụ kháng sinh rộng rãi như vậy dẫn đến tình trạng kháng thuốc ở nhiều loài vi khuẩn khác nhau, bao gồm cả H. pylori [26]. Khả năng kháng kháng sinh của H. pylori đã đạt đến mức đáng kinh ngạc trên toàn thế giới và ảnh hưởng đáng kể đến hiệu quả điều trị [27]. WHO gần đây đã công bố danh sách “các mầm bệnh ưu tiên” kháng thuốc kháng sinh, liệt kê 12 họ vi khuẩn gây ra mối đe dọa lớn nhất đối với sức khỏe con người [28]; danh sách được chia thành 3 trạng thái ưu tiên: quan trọng, cao và trung bình. H. pylori kháng Clarithromycin được phân loại là loài ưu tiên cao, cùng nhóm với Enterococcus faecium kháng Vancomycin và Staphylococcus vàng kháng methicillin. Ngoài ra, các chủng H. pylori kháng metronidazole và fluoroquinolones, thường được sử dụng trong điều trị diệt trừ H. pylori, cũng đã gia tăng đến mức báo động (vượt quá 15%) ở nhiều nơi trên thế giới [27]. Như được trình bày trong Bảng 2, tất cả các phác đồ điều trị ba hoặc bốn thuốc hiện đang được sử dụng đều chứa 2 hoặc 3 loại kháng sinh.
Các phác đồ điều trị ba thuốc dựa trên vonoprazan và phác đồ bốn thuốc không bismuth hiện được khuyến nghị cũng chứa clarithromycin và/hoặc metronidazole, những thuốc có vấn đề lớn trong việc tăng khả năng kháng thuốc kháng sinh. Việc sử dụng nhiều loại kháng sinh trong điều trị H. pylori theo kinh nghiệm vẫn có thể làm tăng nguy cơ xuất hiện tình trạng kháng kháng sinh. Vì vậy, sự gia tăng đề kháng của H.pylori với clarithromycin và các họ kháng sinh khác phải được giải quyết thông qua việc sử dụng kháng sinh hợp lý trong điều trị H.pylori.

Xét nghiệm độ nhạy với kháng sinh là phương pháp hiệu quả nhất để tối ưu hóa và giảm sử dụng kháng sinh trong phác đồ điều trị diệt trừ H. pylori, như thường được thực hiện đối với các bệnh nhiễm trùng khác. Hơn nữa, các phác đồ điều trị phù hợp dựa trên xét nghiệm độ nhạy cảm với kháng sinh đã được báo cáo là cải thiện đáng kể tỷ lệ diệt trừ vi khuẩn [29]. Tuy nhiên, xét nghiệm độ nhạy với kháng sinh không phải là một thực hành lâm sàng thông thường do tính xâm lấn của nội soi; hơn nữa, việc này tốn thời gian và đòi hỏi các cơ sở nuôi cấy trong phòng thí nghiệm thích hợp, điều này làm tăng thêm chi phí.
Một vấn đề tiềm ẩn khác là rối loạn hệ vi sinh vật đường ruột do phương pháp điều trị diệt trừ H. pylori gây ra. Hệ vi sinh vật đường ruột của con người đóng một vai trò quan trọng đối với sức khỏe con người do nó góp phần chuyển hóa năng lượng, điều hòa miễn dịch và bảo vệ vật chủ [30]. Điều trị diệt trừ H. pylori liên quan đến việc sử dụng nhiều loại kháng sinh và thuốc ức chế axit dạ dày, chẳng hạn như PPI. Thật không may, cả thuốc kháng sinh và PPI đều có thể có tác động đáng kể đến hệ vi sinh vật đường ruột thông qua tác dụng kháng khuẩn (kháng sinh) và khả năng làm giảm độ axit dạ dày (PPI). Do đó, các phương pháp điều trị diệt trừ H. pylori có thể góp phần gây ra tình trạng rối loạn hệ vi sinh vật đường ruột và có liên quan đến nhiều bệnh tiêu hóa và thay đổi chuyển hóa [31, 32]. Kết quả là sự rối loạn hệ vi sinh vật đường ruột có thể khác nhau tùy theo phác đồ điều trị H. pylori được sử dụng do có sự khác biệt liên quan đến loại và liều lượng kháng sinh cũng như PPI được sử dụng. Một nghiên cứu so sánh những thay đổi lâu dài của hệ vi sinh vật đường ruột liên quan đến 3 phác đồ điều trị H. pylori khác nhau (phác đồ ba thuốc, phác đồ bốn thuốc đồng thời và phác đồ bốn thuốc bismuth) bằng cách sử dụng mẫu phân [33]. Nghiên cứu cho thấy chỉ số đa dạng alpha thấp hơn ở thời điểm 2 tuần sau cả 3 phác đồ điều trị, nhưng chỉ những bệnh nhân được điều trị bằng phác đồ bộ ba mới có mức độ đa dạng alpha cơ bản sau 8 tuần; các giá trị cơ bản ở 2 nhóm còn lại không được phục hồi ngay cả trong năm đầu tiên sau khi điều trị. Ngoài ra, một số nghiên cứu cũng điều tra tác động của phác đồ ba thuốc dựa trên vonoprazan đối với hệ vi sinh vật đường ruột. Một nghiên cứu cho thấy rằng sự đa dạng alpha giảm đáng kể và sự đa dạng beta khác biệt đáng kể lần lượt ở tuần thứ 1 và 8, sau phác đồ điều trị ba thuốc dựa trên vonoprazan so với thời điểm ban đầu [34]. Một nghiên cứu khác cho thấy những thay đổi đáng kể về hệ vi sinh vật đường ruột vẫn tồn tại 2 tháng sau phác đồ ba thuốc dựa trên vonoprazan ở một số bệnh nhân, mặc dù các chỉ số đa dạng đã phục hồi về mức tương tự về mặt thống kê [35]. Cần có những nghiên cứu sâu hơn để xác minh và thiết lập các phác đồ diệt trừ H. pylori có tác động tối thiểu đến hệ vi sinh vật đường ruột trong khi vẫn mang lại hiệu quả diệt trừ đầy đủ.
4 Điều trị lý tưởng trong tương lai là gì?
Trong tương lai, các phác đồ điều trị lý tưởng mới cho nhiễm trùng H. pylori phải được phát triển để khắc phục các vấn đề về kháng thuốc kháng sinh của H. pylori và tác động lên hệ vi sinh vật đường ruột. Để ngăn ngừa tình trạng kháng kháng sinh ngày càng tăng và giảm tác dụng đối với hệ vi sinh vật đường ruột, việc giảm tiêu thụ kháng sinh mà vẫn duy trì hiệu quả diệt trừ là cần thiết.
Về mặt đó, phác đồ kép, kết hợp PPI với amoxicillin, có thể là phác đồ điều trị lý tưởng cho tương lai. Phác đồ kép bao gồm PPI và amoxicillin lần đầu tiên được báo cáo vào những năm 1990 như là phương pháp điều trị diệt trừ H. pylori đầu tay. Phác đồ kép liều cao và tần suất cao, được định nghĩa là sử dụng cả amoxicillin (2,0 g/ngày) và PPI (ít nhất hai lần mỗi ngày) trong 14 ngày, có hiệu quả diệt trừ H. pylori tuyệt vời như phác đồ đầu tay. Tuy nhiên, tác dụng phụ và sự tuân thủ điều trị của bệnh nhân kém do liều cao, tần suất dùng thuốc cao và thời gian điều trị dài là những nhược điểm chính. Vì vậy, phác đồ kép tần số cao, liều cao này đã được sử dụng như một phương pháp điều trị cấp. Một khả năng thú vị là việc thay thế PPI thông thường bằng vonoprazan trong phác đồ kép. Phác đồ kép Vonoprazan và amoxicillin có thể là phương pháp điều trị thay thế để diệt trừ H. pylori. Một số nghiên cứu so sánh đã báo cáo rằng phác đồ kép vonoprazan và amoxicillin trong 7 ngày, bao gồm 20 mg vonoprazan và 750 mg amoxicillin hai lần mỗi ngày trong 7 ngày, đạt tỷ lệ diệt trừ H. pylori là 85–93%, tương tự như kết quả của 7 ngày. phác đồ ba thuốc vonoprazan ở những vùng có tỷ lệ kháng clarithromycin cao [24, 36].
Ngoài ra, phác đồ kép vonoprazan-amoxicillin ít ảnh hưởng đến hệ vi sinh vật đường ruột hơn so với phác đồ ba vonoprazan. Sự đa dạng và phong phú tương đối của các thành phần hệ vi sinh vật đường ruột không thay đổi đáng kể sau 1 và 8 tuần điều trị kép vonoprazan-amoxicillin so với ban đầu [34]. Hơn nữa, hiệu quả diệt trừ của phác đồ kép vonoprazan-amoxicillin có thể được cải thiện bằng cách điều chỉnh liều và/hoặc tần suất sử dụng amoxicillin. Duy trì nồng độ amoxicillin trong huyết tương ổn định trên mức nồng độ ức chế tối thiểu để có tác dụng diệt khuẩn đối với H. pylori là điều quan trọng để có được phác đồ điều trị kép thành công. Liều lượng hoặc tần suất sử dụng amoxicillin và kích thước cơ thể của bệnh nhân là 2 yếu tố tiềm ẩn ảnh hưởng đến nồng độ ức chế tối thiểu. Một nghiên cứu trong đó phác đồ kép bao gồm 20 mg vonoprazan hai lần mỗi ngày và 500 mg amoxicillin 3 lần mỗi ngày trong 7 ngày vì phương pháp điều trị đầu tiên mang lại tỷ lệ diệt trừ cao hơn là 93% [37]. Một nghiên cứu khác báo cáo rằng kích thước cơ thể bệnh nhân nhỏ hơn, bao gồm cân nặng thấp hơn và diện tích bề mặt cơ thể thấp hơn, có liên quan đến tỷ lệ thành công trong điều trị của phác đồ kép vonoprazan-amoxicillin [38]. Những kết quả nghiên cứu này cho thấy rằng phác đồ kép vonoprazan-amoxicillin với việc điều chỉnh liều amoxicillin thích hợp dựa trên kích thước cơ thể bệnh nhân được kỳ vọng sẽ là phương pháp điều trị lý tưởng trong tương lai để giảm thiểu cả sự phát triển kháng kháng sinh H. pylori và rối loạn hệ vi sinh vật đường ruột sau điều trị, đồng thời cung cấp đủ H diệt trừ .pylori. Tuy nhiên, hiện nay có rất ít báo cáo về phác đồ kép này. Các nghiên cứu sâu hơn từ nhiều khu vực được đảm bảo để thiết lập phác đồ kép như là phương pháp điều trị diệt trừ H. pylori hàng đầu mới.
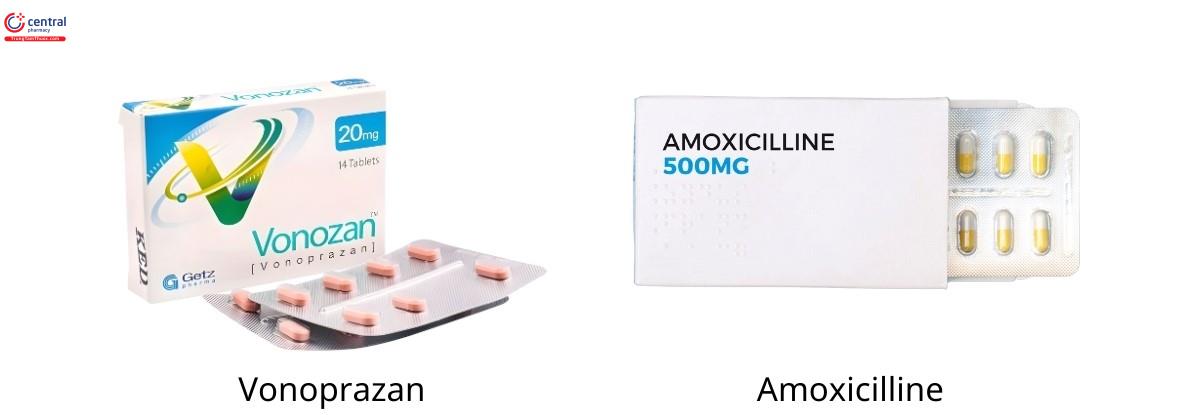
Phác đồ kép vonoprazan-amoxicillin có thể là điều trị lí tưởng trong tương lai
5 Kết luận
Trong bài đánh giá này, chúng tôi đã nêu các tiêu chuẩn hiện hành về điều trị H. pylori, tham khảo các hướng dẫn và dữ liệu nghiên cứu quốc tế mới nhất.
Phác đồ bốn thuốc không bismuth trong 10–14 ngày và phác đồ ba thuốc dựa trên vonoprazan trong 7 ngày là những phác đồ điều trị H. pylori được khuyến nghị hiện nay và được hỗ trợ bởi rất nhiều bằng chứng. Các phác đồ này cho thấy tỷ lệ diệt trừ tốt khoảng 90%, ngay cả ở những khu vực có mức độ kháng thuốc kháng sinh cao.
Tuy nhiên, các phác đồ này đều có những nhược điểm nhất định cần khắc phục. Việc sử dụng clarithromycin và metronidazole theo kinh nghiệm trong các phác đồ này có thể thúc đẩy sự gia tăng hơn nữa tình trạng kháng kháng sinh của H. pylori. Phác đồ điều trị cũng có thể gây rối loạn hệ vi sinh vật đường ruột và có khả năng dẫn đến các bệnh về tiêu hóa và chuyển hóa.
6 Tài liệu tham khảo
1.Hooi JKY, Lai WY, Ng WK, Suen MMY, Underwood FE, Tanyingoh D, Global prevalence of Helicobacter pylori infection: systematic review and meta-analysis. Gastroenterology. 2017;153(2):420–9. https://doi.org/10.1053/j.gastro.2017.04.022.
2.McColl KE. Clinical practice. Helicobacter pylori infection. N Engl J Med. 2010 Apr 29;362(17):1597–604. https://doi.org/10.1056/NEJMcp1001110.
3.Malfertheiner P, Megraud F, O'Morain CA, Gisbert JP, Kuipers EJ, Axon AT, Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut. 2017;66(1):6–30. https://doi.org/10.1136/gutjnl-2016-312288.
4.Fallone CA, Chiba N, van Zanten SV, Fischbach L, Gisbert JP, Hunt RH, The Toronto Consensus for the treatment of Helicobacter pylori infection in adults. Gastroenterology. 2016 Jul;151(1):51–69.e14. https://doi.org/10.1053/j.gastro.2016.04.006.
5.Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG clinical guideline: treatment of Helicobacter pylori infection. Am J Gastroenterol. 2017 Feb;112(2):212–39. https://doi.org/10.1038/ajg.2016.563.
6.Liu WZ, Xie Y, Lu H, Cheng H, Zeng ZR, Zhou LY, Fifth Chinese National Consensus Report on the management of Helicobacter pylori infection. Helicobacter. 2018 Apr;23(2):e12475. https://doi.org/10.1111/hel.12475.
7.Jung HK, Kang SJ, Lee YC, Yang HJ, Park SY, Shin CM, Evidence-based guidelines for the treatment of Helicobacter pylori infection in Korea 2020. Gut Liver. 2021 Mar 15;15(2):168–95. https://doi.org/10.5009/gnl20288.
8.Kato M, Ota H, Okuda M, Kikuchi S, Satoh K, Shimoyama T, Guidelines for the management of Helicobacter pylori infection in Japan: 2016 revised edition. Helicobacter. 2019 Aug;24(4):e12597. https://doi.org/10.1111/hel.12597.
9.Nyssen OP, Bordin D, Tepes B, Pérez-Aisa Á, Vaira D, Caldas M, European Registry on Helicobacter pylori management (Hp-EuReg): patterns and trends in first-line empirical eradication prescription and outcomes of 5 years and 21,533 patients. Gut. 2021;70(1):40–54.
10.Nyssen OP, Perez‐Aisa A, Castro‐Fernandez M, Pellicano R, Huguet JM, Rodrigo L, European Registry on Helicobacter pylori management: single‐capsule bismuth quadruple therapy is effective in real‐world clinical practice. United European Gastroenterol J. 2021;9(1):38–46.
11.Murakami K, Sakurai Y, Shiino M, Funao N, Nishimura A, Asaka M. Vonoprazan, a novel potassium-competitive acid blocker, as a component of first-line and second-line triple therapy for Helicobacter pylori eradication: a phase III, randomised, double-blind study. Gut. 2016 Sep;65(9):1439–46. https://doi.org/10.1136/gutjnl-2015-311304.
12.Suzuki S, Gotoda T, Kusano C, Iwatsuka K, Moriyama M. The efficacy and tolerability of a triple therapy containing a potassium-competitive acid blocker compared with a 7-day PPI-based low-dose clarithromycin triple therapy. Am J Gastroenterol. 2016 Jul;111(7):949–56. https://doi.org/10.1038/ajg.2016.182.
13.Li M, Oshima T, Horikawa T, Tozawa K, Tomita T, Fukui H, Systematic review with meta-analysis: vonoprazan, a potent acid blocker, is superior to proton-pump inhibitors for eradication of clarithromycin-resistant strains of Helicobacter pylori. Helicobacter. 2018 Aug;23(4):e12495. https://doi.org/10.1111/hel.12495.
14.Okubo H, Akiyama J, Kobayakawa M, Kawazoe M, Mishima S, Takasaki Y, Vonoprazan-based triple therapy is effective for Helicobacter pylori eradication irrespective of clarithromycin susceptibility. J Gastroenterol. 2020;55(11):1054–61. https://doi.org/10.1007/s00535-020-01723-6.
15.Nishida T, Tsujii Y, Okamoto A, Tomita R, Higaki Y, Osugi N, A triple-drug blister-packaged drug with vonoprazan improves first-line eradication of Helicobacter pylori in elderly patients: a retrospective propensity score-matched cohort study. Digestion. 2020;101(5):608–14. https://doi.org/10.1159/000501608.
16.Deguchi H, Uda A, Murakami K. Current status of Helicobacter pylori diagnosis and eradication therapy in Japan using a nationwide database. Digestion. 2020;101(4):441–9. https://doi.org/10.1159/000500819.
17.Kim YI, Lee JY, Kim CG, Park B, Park JY, Choi IJ. Ten-day bismuth-containing quadruple therapy versus 7-day proton pump inhibitor-clarithromycin containing triple therapy as first-line empirical therapy for the Helicobacter pylori infection in Korea: a randomized open-label trial. BMC Gastroenterol. 2021;21(1):95. https://doi.org/10.1186/s12876-021-01680-1.
18.Apostolopoulos P, Ekmektzoglou K, Georgopoulos S, Chounta E, Theofanopoulou A, Kalantzis C, 10-day versus 14-day quadruple concomitant nonbismuth therapy for the treatment of Helicobacter pylori infection: results from a randomized prospective study in a high clarithromycin resistance country. J Clin Gastroenterol. 2020 Jul;54(6):522–7. https://doi.org/10.1097/MCG.0000000000001328.
19.Myint NPST, Zaw TT, Sain K, Waiyan S, Danta M, Cooper D, Sequential Helicobacter pylori eradication therapy in Myanmar; a randomized clinical trial of efficacy and tolerability. J Gastroenterol Hepatol. 2020 Apr;35(4):617–23. https://doi.org/10.1111/jgh.14942.
20.Mestrovic A, Perkovic N, Bozic J, Pavicic Ivelja M, Vukovic J, Kardum G, Randomised clinical trial comparing concomitant and hybrid therapy for eradication of Helicobacter pylori infection. PLoS One. 2020;15(12):e0244500. https://doi.org/10.1371/journal.pone.0244500.
21.Hsu PI, Tsay FW, Kao JY, Peng NJ, Tsai KW, Tsai TJ, Equivalent efficacies of reverse hybrid and concomitant therapies in first-line treatment of Helicobacter pylori infection. J Gastroenterol Hepatol. 2020 Oct;35(10):1731–7. https://doi.org/10.1111/jgh.15034.
22.Farhoud NS, Ibrahim OM, Ezzat SE. Efficacy and cost-effectiveness comparison of 10-day, 14-day sequential versus 14-day triple therapies for treating Helicobacter pylori infection in Egyptian patients. J Clin Gastroenterol. 2020 Oct;54(9):806–12. https://doi.org/10.1097/MCG.0000000000001278.
23.Song Z, Zhou L, Xue Y, Suo B, Tian X, Niu Z. A comparative study of 14-day dual therapy (esomeprazole and amoxicillin four times daily) and triple plus bismuth therapy for first-line Helicobacter pylori infection eradication: a randomized trial. Helicobacter. 2020 Dec;25(6):e12762. https://doi.org/10.1111/hel.12762.
24.Suzuki S, Gotoda T, Kusano C, Ikehara H, Ichijima R, Ohyauchi M, Seven-day vonoprazan and low-dose amoxicillin dual therapy as first-line Helicobacter pylori treatment: a multicentre randomised trial in Japan. Gut. 2020;69(6):1019–26. https://doi.org/10.1136/gutjnl-2019-319954.
25.Rokkas T, Gisbert JP, Malfertheiner P, Niv Y, Gasbarrini A, Leja M, Comparative effectiveness of multiple different first-line treatment regimens for Helicobacter pylori infection: a network meta-analysis. Gastroenterology. 2021 Aug;161(2):495–507.e4.
26.Megraud F, Bruyndonckx R, Coenen S, Wittkop L, Huang TD, Hoebeke M, Helicobacter pylori resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut. 2021 Apr 9.
27.Savoldi A, Carrara E, Graham DY, Conti M, Tacconelli E. Prevalence of antibiotic resistance in Helicobacter pylori: a systematic review and meta-analysis in World Health Organization regions. Gastroenterology. 2018 Nov;155(5):1372–82.e17. https://doi.org/10.1053/j.gastro.2018.07.007.
28.World Health Organization (WHO). Global priority list of antibiotic-resistant bacteria to guide research, discovery, and development of new antibiotics. 2017.
29.Horie R, Handa O, Ando T, Ose T, Murakami T, Suzuki N, Helicobacter pylori eradication therapy outcome according to clarithromycin susceptibility testing in Japan. Helicobacter. 2020 Aug;25(4):e12698. https://doi.org/10.1111/hel.12698.
30.Fujimura KE, Slusher NA, Cabana MD, Lynch SV. Role of the gut microbiota in defining human health. Expert Rev Anti Infect Ther. 2010 Apr;8(4):435–54. https://doi.org/10.1586/eri.10.14.
31.Roca-Rodriguez MM, Coin-Araguez L, Cornejo-Pareja I, Alcaide J, Clu-Fernandez C, Munoz-Garach A, Carbohydrate metabolism improvement after Helicobacter pylori eradication. Diabetes Metab. 2016 Apr;42(2):130–4.
32.Guo Y, Zhang Y, Gerhard M, Gao JJ, Mejias-Luque R, Zhang L, Effect of Helicobacter pylori on gastrointestinal microbiota: a population-based study in Linqu, a high-risk area of gastric cancer. Gut. 2020 Sep;69(9):1598–607. https://doi.org/10.1136/gutjnl-2019-319696.
33.Liou JM, Chen CC, Chang CM, Fang YJ, Bair MJ, Chen PY, Long-term changes of gut microbiota, antibiotic resistance, and metabolic parameters after Helicobacter pylori eradication: a multicentre, open-label, randomised trial. Lancet Infect Dis. 2019 Oct;19(10):1109–20. https://doi.org/10.1016/S1473-3099(19)30272-5.
34.Horii T, Suzuki S, Takano C, Shibuya H, Ichijima R, Kusano C, Lower impact of vonoprazan-amoxicillin dual therapy on gut microbiota for Helicobacter pylori eradication. J Gastroenterol Hepatol. 2021 Jun 9.
35.Gotoda T, Takano C, Kusano C, Suzuki S, Ikehara H, Hayakawa S, Gut microbiome can be restored without adverse events after Helicobacter pylori eradication therapy in teenagers. Helicobacter. 2018 Dec;23(6):e12541. https://doi.org/10.1111/hel.12541.
36.Gotoda T, Kusano C, Suzuki S, Horii T, Ichijima R, Ikehara H. Clinical impact of vonoprazan-based dual therapy with amoxicillin for H. pylori infection in a treatment-naïve cohort of junior high school students in Japan. J Gastroenterol. 2020;55(10):969–76.
37.Furuta T, Yamade M, Kagami T, Suzuki T, Higuchi T, Tani S, Influence of clarithromycin on the bactericidal effect of amoxicillin in patients infected with clarithromycin-resistant strains of H. pylori. Gut. 2020;69(11):2056https://doi.org/10.1136/gutjnl-2020-320705.
38.Eto H, Suzuki S, Kusano C, Ikehara H, Ichijima R, Ito H, Impact of body size on first-line Helicobacter pylori eradication success using vonoprazan and amoxicillin dual therapy. Helicobacter. 2021 Apr;26(2):e12788. https://doi.org/10.1111/hel.12788.
39. Godavarthy PK, Puli C. From Antibiotic Resistance to Antibiotic Renaissance: A New Era in Helicobacter pylori Treatment. Cureus. 2023 Mar 12;15(3):e36041. doi: 10.7759/cureus.36041. PMID: 36919111; PMCID: PMC10008461.(The Ideal Helicobacter pylori Treatment for the Present and the Future)
40. Sho Suzuki, Chika Kusano, Toshiki Horii, Ryoji Ichijima, Hisatomo Ikehara; The Ideal Helicobacter pylori Treatment for the Present and the Future. Digestion 4 January 2022; 103 (1): 62–68. https://doi.org/10.1159/000519413 (From Antibiotic Resistance to Antibiotic Renaissance: A New Era in Helicobacter pylori Treatment)

