Hướng dẫn thực hành lâm sàng 'Thuyên tắc huyết khối trong thai kỳ' ACOG 2018

Trungtamthuoc.com - Tháng 7 năm 2018, Ủy ban về thực hành phụ khoa thuộc Hiệp hội sản phụ khoa Hoa Kỳ (ACOG) đã công bố bản Hướng dẫn thực hành lâm sàng "Thuyên tắc huyết khối trong thai kỳ" thay thế cho bản hướng dẫn trước đó (Bản tin Thực hành Số 123, Tháng 8 năm 2011).
AMERICAN COLLEGE OF OBTETRICIANS AND GYNECOLOGISTS (HIỆP HỘI SẢN PHỤ KHOA HOA KỲ ACOG)
ACOG PRACTICE BULLETIN (BẢN TIN THỰC HÀNH ACOG)
Clinical Management Guidelines for Obstetrician–Gynecologists (Hướng dẫn quản lý lâm sàng dành cho bác sĩ sản phụ khoa)
Thromboembolism in Pregnancy (Thuyên tắc huyết khối trong thai kỳ - Xem bài gốc tại đây)
Dịch bởi: Bác sĩ Vũ Văn Tài
1 Thuyên tắc huyết khối trong thai kỳ
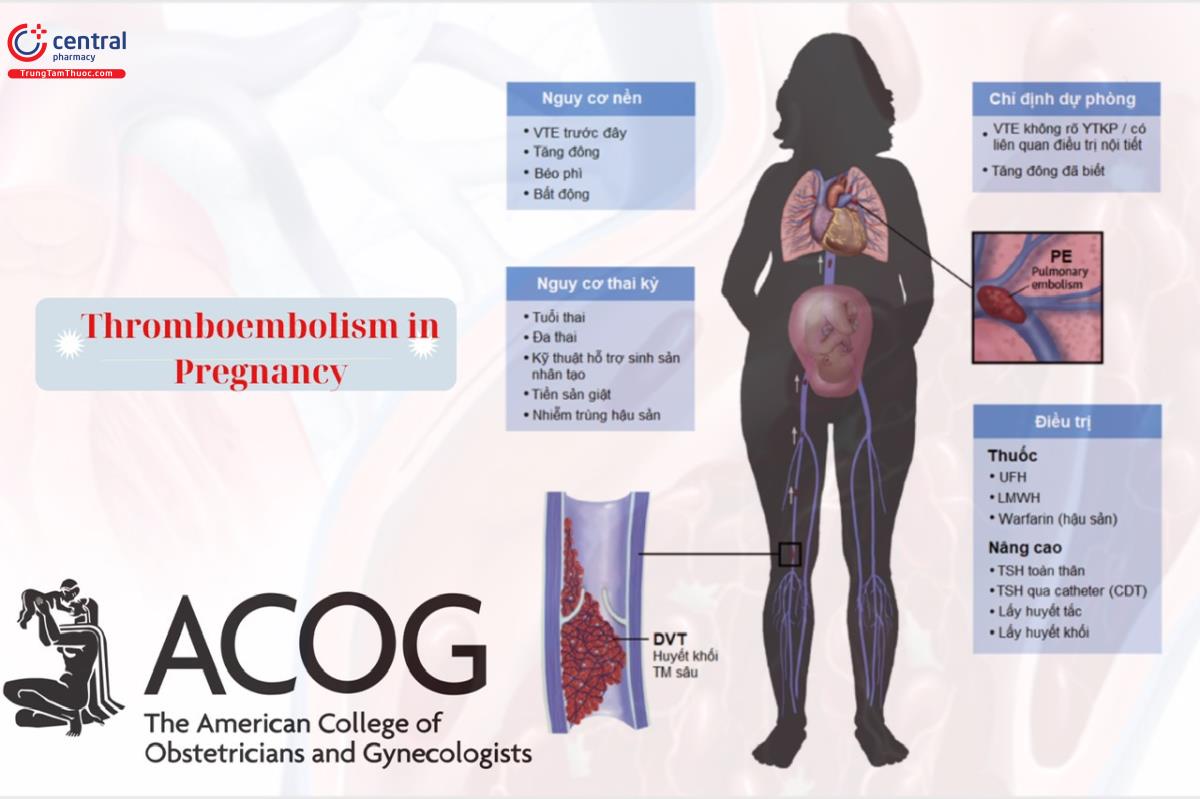
Phụ nữ mang thai hoặc trong thời kỳ hậu sản có nguy cơ mắc thuyên tắc huyết khối cao gấp 4 đến 5 lần so với phụ nữ không mang thai (1, 2). Khoảng 80% các trường hợp thuyên tắc huyết khối trong thai kỳ là tĩnh mạch (3), với tỷ lệ hiện mắc là 0,5–2,0 trên 1.000 thai phụ (4–9). Một trong những nguyên nhân hàng đầu gây tử vong mẹ ở Hoa Kỳ là thuyên tắc huyết khối tĩnh mạch (VTE), chiếm 9,3% tổng số ca tử vong mẹ (10).
Vì sự phổ biến và mức độ nghiêm trọng của tình trạng này trong thai kỳ và giai đoạn chu sinh nên cần được xem xét đặc biệt về cách quản lý và điều trị. Điều trị bao gồm điều trị các biến cố huyết khối cấp tính và dự phòng cho những người có nguy cơ cao bị các biến cố huyết khối. Mục đích của tài liệu này là cung cấp thông tin liên quan về các yếu tố nguy cơ, chẩn đoán, quản lý và dự phòng thuyên tắc huyết khối, đặc biệt là VTE trong thai kỳ. Thông cáo Thực hành này đã được sửa đổi để phản ánh hướng dẫn cập nhật liên quan đến sàng lọc nguy cơ thuyên tắc huyết khối và quản lý chống đông quanh thời điểm sinh.

2 Đại cương
Huyết khối tĩnh mạch sâu (DVT) và thuyên tắc phổi (PE) được gọi chung là VTE. Khoảng 75–80% trường hợp VTE liên quan đến thai kỳ là do DVT và 20–25% trường hợp là do PE (3, 7, 11). Mặc dù khoảng một nửa số trường hợp này xảy ra trong thai kỳ và một nửa xảy ra ở thời kỳ hậu sản, nhưng nguy cơ/ngày lớn nhất trong những tuần ngay sau sinh (3–8, 12).
2.1 Những thay đổi liên quan đến thai kỳ và thuyên tắc huyết khối tĩnh mạch
Mang thai có liên quan đến những thay đổi về sinh lý và giải phẫu làm tăng nguy cơ thuyên tắc huyết khối, bao gồm tăng đông máu, tăng ứ đọng và giảm dòng chảy tĩnh mạch (13, 14), chèn ép tĩnh mạch chủ dưới và tĩnh mạch vùng chậu do tử cung to ra (15) và giảm di động (16-19). Mang thai cũng làm thay đổi nồng độ của các yếu tố đông máu mà bình thường chịu trách nhiệm cầm máu (xem Bảng 1). Tác dụng chung của những thay đổi này là tình trạng tăng hình thành huyết khối. Khi DVT xảy ra trong thai kỳ, hay xảy ra ở chi dưới bên trái và đoạn gần hơn, liên quan đến tĩnh mạch chậu và chậu đùi, so với nhóm không mang thai (20–22). Sự phân bố này được cho là do tăng ứ đọng tĩnh mạch ở chân trái do động mạch chậu phải chèn ép tĩnh mạch chậu trái (giải phẫu May–Thurner), cùng với tử cung mang thai chèn ép tĩnh mạch chủ.
2.2 Các yếu tố nguy cơ
Nguy cơ VTE có thể cao hơn trong tam cá nguyệt thứ ba so với tam cá nguyệt thứ nhất và thứ hai (2), nhưng nguy cơ VTE tăng từ tam cá nguyệt thứ nhất (21, 22), thường trước khi xảy ra nhiều thay đổi về mặt giải phẫu trong thai kỳ. Nguy cơ VTE trong thời kỳ hậu sản cao hơn trong thai kỳ, đặc biệt là trong tuần đầu tiên sau sinh (1).
Yếu tố nguy cơ cá nhân quan trọng nhất đối với VTE trong thai kỳ là tiền sử bản thân bị huyết khối. Nguy cơ VTE tái phát trong thai kỳ tăng gấp 3 đến 4 lần (relative risk, 3.5; 95% CI, 1.6–7.8) và 15–25% trong tất cả các trường hợp VTE trong thai kỳ là các biến cố tái phát (23). Yếu tố nguy cơ cá nhân quan trọng thứ hai đối với VTE trong thai kỳ là mắc thrombophilia (3, 22). Thrombophilia xuất hiện ở 20–50% phụ nữ bị VTE trong thai kỳ và thời kỳ hậu sản (24). Cả thrombophilia mắc phải và di truyền đều làm tăng nguy cơ VTE (25–27).
Bên cạnh tiền sử bản thân bị huyết khối, hoặc thrombophilia, hoặc cả hai, các yếu tố nguy cơ chính đối với sự phát triển VTE liên quan đến thai kỳ là những thay đổi sinh lý kèm theo thai kỳ và sinh đẻ. Mổ lấy thai, đặc biệt khi có biến chứng xuất huyết sau sinh hoặc nhiễm trùng, cũng như các yếu tố nội khoa hoặc các biến chứng thai kỳ như tăng huyết áp, bệnh tim, bệnh hồng cầu hình liềm, béo phì, đa thai và tiền sản giật, bệnh tự miễn cũng làm tăng nguy cơ VTE (3, 6–8, 16, 28–31). Một phân tích tổng hợp về nguy cơ VTE sau mổ lấy thai cho thấy mổ lấy thai là một yếu tố nguy cơ độc lập đối với VTE, với tỷ lệ ước tính khoảng 3 trường hợp trên 1.000 bệnh nhân, nguy cơ tăng gấp 4 lần so với sinh thường (32).
2.3 Thuốc chống đông trong thai kỳ
Cần phải xem xét đặc biệt cho thai phụ và thai nhi khi dùng liệu pháp chống đông trong thai kỳ. Cần thảo luận nguy cơ và lợi ích trước khi bắt đầu liệu pháp chống đông để mà thai phụ có thể tham gia vào việc lựa chọn phác đồ điều trị phù hợp với sở thích và giá trị của họ (30). Hầu hết những phụ nữ cần liệu pháp chống đông trước khi mang thai sẽ tiếp tục cần liệu pháp này trong thai kỳ và thời kỳ hậu sản. Các loại thuốc chống đông phổ biến bao gồm warfarin, heparin không phân đoạn (UFH), và heparin trọng lượng phân tử thấp (LMWH). Nhìn chung, thuốc chống đông được ưu tiên dùng trong thai kỳ là các hợp chất heparin.
2.3.1 Các hợp chất heparin
Cả LMWH và UFH đều không đi qua nhau thai (33, 34) và đều được coi là an toàn trong thai kỳ (35). Cân nhắc duy nhất liên quan đến việc dùng liệu pháp chống đông trong thai kỳ bao gồm thể tích máu mẹ tăng 40–50%; tăng mức lọc cầu thận, dẫn đến tăng bài xuất hợp chất heparin qua thận; và tăng protein gắn với heparin (36). Trong thai kỳ, LMWH và UFH có nồng độ đỉnh trong huyết tương thấp hơn, và thời gian bán thải ngắn hơn do đó để duy trì nồng độ hiệu quả cần dùng thường xuyên hơn và liều cao hơn (37–43). Khi mô tả các phác đồ điều trị LMWH hoặc UFH, LMWH hoặc UFH liều điều chỉnh đề cập đến các liều được điều chỉnh dựa trên cân nặng của mẹ (LMWH) hoặc thời gian thromboplastin hoạt hóa từng phần (aPTT) (đối với UFH), và tùy thuộc vào loại thuốc được dùng mà sẽ có liều dự phòng hoặc trung gian cụ thể (Bảng 2).
Do LMWH có độ tin cậy cao hơn và dễ sử dụng hơn, nên để dự phòng và điều trị VTE trong và ngoài thai kỳ, nó thường hay được khuyến cáo hơn UFH (30). Chỉ có một vài nghiên cứu so sánh việc sử dụng LMWH trong thai kỳ, nhưng ở bệnh nhân không mang thai, dùng LMWH có ít tác dụng phụ hơn UFH (30). Các ưu điểm ngắn hạn và dài hạn tiềm năng của LMWH bao gồm ít đợt chảy máu hơn, đáp ứng điều trị dễ dự đoán hơn, nguy cơ giảm tiểu cầu do heparin thấp hơn, thời gian bán thải dài hơn và mật độ khoáng xương mất ít hơn (35, 44, 45).
Điều quan trọng là cả LMWH hoặc UFH đều không liên quan đến tình trạng mất xương đáng kể khi dùng ở liều dự phòng trong thai kỳ (46–48). UFH, có liên quan đến tăng bầm tím tại vị trí tiêm, cũng có liên quan với các phản ứng da khác và phản ứng dị ứng nghiêm trọng (49). Nhược điểm tương đối của LMWH quanh thời điểm sinh bao gồm thời gian bán thải dài hơn, không thể đánh giá nhanh tác dụng hiện tại bằng các xét nghiệm tiêu chuẩn (ví dụ: aPTT) và không thể đảo ngược tác dụng dược lý của nó, đây là những cân nhắc quan trọng khi gây tê trục thần kinh và nguy cơ chảy máu chu sinh.
2.3.2 Warfarin
Warfarin, một thuốc đối kháng vitamin K thường được dùng trong liệu pháp chống đông lâu dài ngoài thai kỳ, có liên quan đến những tác dụng có hại tiềm tàng cho thai nhi, đặc biệt khi phơi nhiễm với thuốc trong ba tháng đầu thai kỳ (50–56). Bệnh lý phôi thai do warfarin có liên quan đến việc phơi nhiễm lúc 6–12 tuần tuổi thai, nhấn mạnh tầm quan trọng của việc chuẩn bị trước khi mang thai và chăm sóc thai kỳ sớm ở những bệnh nhân sử dụng warfarin (57). Do đó, hầu hết phụ nữ đang dùng liệu pháp chống đông kéo dài mà có thai, khuyến cáo thay thế warfarin bằng LMWH.
Mặc dù hiếm khi được chỉ định trong thai kỳ, thuốc kháng vitamin K như warfarin vẫn được cân nhắc dùng cho thai phụ có van tim cơ học vì nguy cơ huyết khối cao ngay cả với liệu pháp chống đông bằng heparin hoặc LMWH (58). Quản lý những thai phụ này yêu cầu một cách tiếp cận chăm sóc đa chuyên khoa và quyết định về liệu pháp chống đông tối ưu cần được thảo luận chi tiết với bệnh nhân và bác sĩ sản-phụ khoa của họ hoặc các nhà cung cấp dịch vụ chăm sóc sức khỏe khác về lợi ích và nguy cơ của các lựa chọn điều trị khác nhau đối với từng tuổi thai. Phác đồ điều trị bao gồm LMWH hoặc UFH liều điều chỉnh trong suốt thai kỳ hoặc từ tuần thứ 6 đến tuần thứ 13 với sự thay thế bằng thuốc kháng vitamin K cho đến gần ngày sinh thì dùng lại LMWH hoặc UFH (58). Nguy cơ xuất huyết thai nhi ở thai phụ dùng warfarin dường như cao nhất quanh thời điểm sinh; do đó, nếu chuyển dạ sinh xảy ra bất ngờ trong khi sản phụ đang dùng thuốc kháng vitamin K, có thể cần phải mổ lấy thai và trẻ sơ sinh có thể cần dùng vitamin K và huyết tương tươi đông lạnh.
2.3.3 Thuốc ức chế trực tiếp Thrombin và Anti-Xa đường uống
Trong thai kỳ và thời kỳ cho con bú không nên dùng thuốc ức chế trực tiếp thrombin (dabigatran) và Anti-Xa (rivaroxaban, apixaban, edoxaban, betrixaban) đường uống vì không đủ dữ liệu để đánh giá tính an toàn cho thai phụ, thai nhi và trẻ sơ sinh bú mẹ (59). Các nghiên cứu ex vivo nhau thai người đã chứng minh thuốc ức chế trực tiếp thrombin và Anti-Xa đường uống đều đi qua nhau thai, điều này làm dấy lên mối lo ngại về tác động gián tiếp lên quá trình đông máu của thai nhi (60–62). Tương tự như vậy, mẹ uống các thuốc ức chế trực tiếp thrombin và Anti-Xa dẫn đến nồng độ thuốc có thể phát hiện được trong sữa mẹ (63, 64).
Vẫn chưa rõ mối liên quan giữa việc sử dụng thuốc ức chế trực tiếp thrombin (dabigatran) và Anti-Xa đường uống trong ba tháng đầu thai kỳ và dị tật bẩm sinh. Trong một nghiên cứu tiến cứu trên 37 thai phụ vô tình phơi nhiễm với rivaroxaban, 1 bệnh nhân có thai nhi bị dị tật thân nón tim; tuy nhiên, bệnh nhân này cũng có tiền sử trẻ bị dị tật tim mà không hề phơi nhiễm với rivaroxaban (65). Vì vậy, cho đến khi có thêm dữ liệu, phụ nữ nên chuyển sang dùng LMWH ngay khi phát hiện có thai hoặc trước khi mang thai.
3 Cân nhắc và khuyến cáo lâm sàng
3.1 Ai, khi nào và làm thế nào để đánh giá nguy cơ thuyên tắc huyết khối trong thai kỳ?
Mọi bệnh nhân sản khoa nên được hỏi về tiền sử thuyên tắc huyết khối của bản thân và gia đình. Trong một tổng quan gần đây về các hướng dẫn dự phòng VTE trong thai kỳ của Hoa Kỳ và các tổ chức quốc tế khác, 8 trong số 9 hướng dẫn được đánh giá khuyến cáo rằng tất cả thai phụ nên được đánh giá yếu tố nguy cơ VTE sớm trong thai kỳ hoặc trong giai đoạn chuẩn bị mang thai (66). Hội bác sĩ sản phụ khoa Hoàng gia Anh (the Royal College of Obstetricians and Gynaecologists) khuyến cáo rằng đánh giá nên được lặp lại khi nhập viện hoặc nếu xuất hiện biến chứng thai kỳ (chẳng hạn như tiền sản giật) (67). Mỗi cơ sở y tế nên xem xét các quy trình đánh giá nguy cơ VTE sẵn có, đồng thời áp dụng và triển khai một trong số các quy trình đó một cách có hệ thống để giảm tỷ lệ mắc mới VTE trong thai kỳ và thời kỳ hậu sản.
Trong thai kỳ, có thể dùng một số công cụ để đánh giá nguy cơ VTE. Trong hướng dẫn năm 2015 của Hội bác sĩ sản phụ khoa Hoàng gia Anh về Giảm nguy cơ thuyên tắc huyết khối tĩnh mạch trong thai kỳ và thời kỳ hậu sản (67), đã phân tầng bệnh nhân trước và sau sinh thành nguy cơ VTE thấp, trung bình và cao dựa trên các yếu tố nguy cơ sẵn có, các yếu tố nguy cơ sản khoa và các yếu tố nguy cơ thoáng qua. Hướng dẫn năm 2012 của Hội bác sĩ Lồng ngực Hoa Kỳ (American College of Chest Physicians) cũng đưa ra một công cụ đánh giá nguy cơ để xác định thai phụ có nguy cơ cao mắc VTE sau sinh. The National Partnership for Maternal Safety đã hợp nhất và đơn giản hóa các khuyến cáo đánh giá nguy cơ của Hội bác sĩ sản phụ khoa Hoàng gia Anh và Hội bác sĩ Lồng ngực Hoa Kỳ (68) để sử dụng ở lần khám thai đầu tiên.
Không có hệ thống tính điểm nào được chấp nhận rộng rãi được xác nhận tiến cứu trong nhóm sản khoa và hầu hết các hệ thống tính điểm được ngoại suy dựa trên nguy cơ VTE tương đối. Hơn nữa, không rõ liệu các yếu tố nguy cơ là cộng, nhân hay trung tính. Cần thu thập thêm dữ liệu từ các đoàn hệ lớn gồm phụ nữ mang thai và phụ nữ trong thời kỳ hậu sản đã đánh giá nguy cơ VTE, sẽ cần cân nhắc giữa lợi ích, tác hại và hiệu quả chi phí của các biện pháp can thiệp để xác định cách đánh giá nguy cơ tối ưu.
3.2 Bằng chứng về việc dự phòng huyết khối khi mang thai và thời kỳ hậu sản ?
Không có đủ bằng chứng để hướng dẫn ra quyết định lâm sàng về việc dự phòng huyết khối bằng thuốc thường quy trong và sau thai kỳ, điều này làm nổi bật nhu cầu cần có nghiên cứu chất lượng cao quy mô lớn về chủ đề này (69). Bằng chứng sẵn có được ngoại suy từ những bệnh nhân không mang thai. Bằng chứng hiện tại không đủ để khuyến cáo thực hiện dự phòng VTE bằng thuốc thường quy, và dự phòng huyết khối nên được cá thể hóa theo các yếu tố nguy cơ của bệnh nhân. Khi không có bằng chứng rõ ràng từ các thử nghiệm ngẫu nhiên có đối chứng, các bác sĩ có thể dựa vào các hướng dẫn thực hành lâm sàng dựa trên sự đồng thuận hoặc các khuyến cáo từ các hiệp hội trong nước và quốc tế (70).
3.3 Trong thai kỳ và thời kỳ hậu sản, thuyên tắc huyết khối tĩnh mạch được chẩn đoán như thế nào?
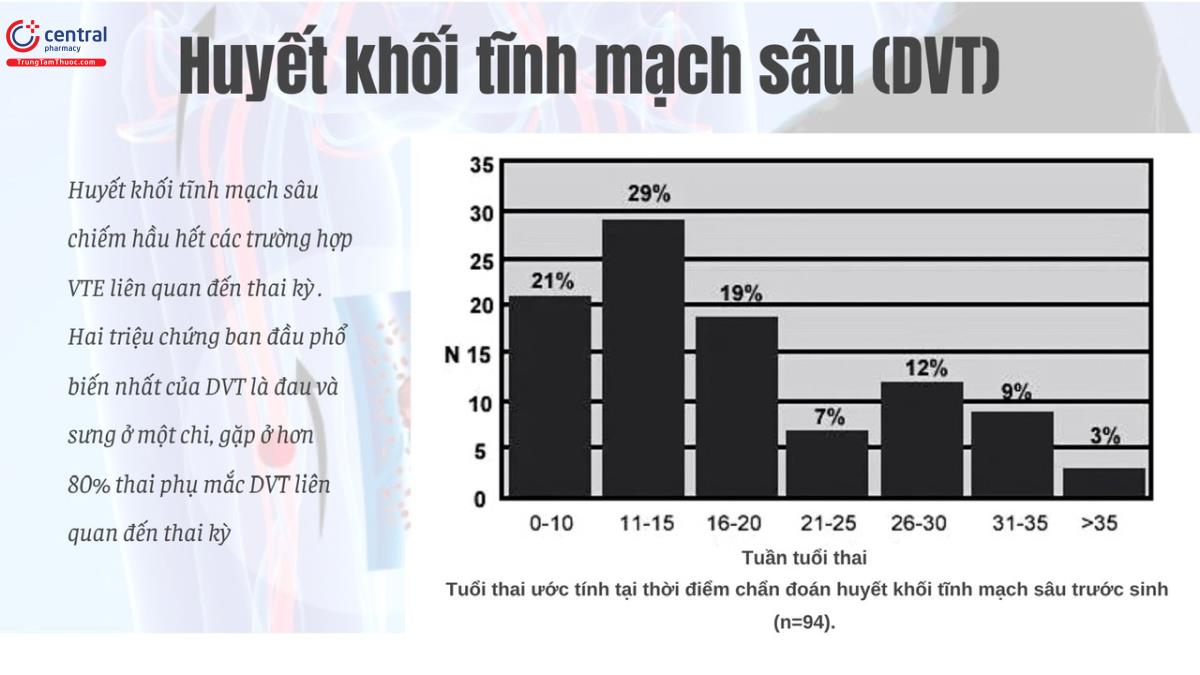
3.3.1 Huyết khối tĩnh mạch sâu (DVT)
Huyết khối tĩnh mạch sâu chiếm hầu hết các trường hợp VTE liên quan đến thai kỳ (3, 7, 11). Hai triệu chứng ban đầu phổ biến nhất của DVT là đau và sưng ở một chi, gặp ở hơn 80% thai phụ mắc DVT liên quan đến thai kỳ (22). Sự khác biệt về chu vi bắp chân từ 2 cm trở lên đặc biệt gợi ý DVT ở chi dưới (71). Khi các dấu hiệu hoặc triệu chứng gợi ý DVT khởi phát mới, xét nghiệm chẩn đoán ban đầu được khuyến cáo là siêu âm các tĩnh mạch đoạn gần có đè ép (30). Ngược lại, ở nhóm không mang thai, DVT thường gặp nhất ở đoạn xa, trong một tổng quan hệ thống cho thấy thai phụ được xác định bị DVT có tần suất cao mắc huyết khối tĩnh mạch chậu-đùi (64%) và chậu (17%) (20).
Khi kết quả âm tính hoặc không rõ ràng và nghi ngờ huyết khối tĩnh mạch chậu (dựa vào dấu hiệu sưng toàn bộ chân, có hoặc không có đau mạn sườn, đau mông, hoặc đau lưng), khuyến cáo thực hiện thêm siêu âm Doppler tĩnh mạch chậu, chụp tĩnh mạch hoặc chụp cộng hưởng từ (72, 73). Ngoài ra, tùy thuộc vào bệnh cảnh lâm sàng, dùng thuốc chống đông theo kinh nghiệm có thể là một lựa chọn hợp lý. Khi kết quả âm tính và không còn nghi ngờ huyết khối tĩnh mạch chậu, nên xem xét siêu âm lại sau 3 ngày và 7 ngày (73).
Mặc dù đo nồng độ D-dimer là một công cụ sàng lọc hữu ích để loại trừ VTE ở những người không mang thai, nhưng mang thai đi kèm với sự gia tăng từ từ nồng độ D-dimer, do đó nồng độ D-dimer cao không giúp dự đoán VTE một cách đáng tin cậy (74–76). D-dimer âm tính giả cũng đã được báo cáo ở thai phụ bị DVT hoặc PE; do đó, với thông tin tối thiểu thu được từ xét nghiệm này, nó không được khuyến cáo là một phần của quy trình đánh giá VTE trong thai kỳ hoặc thời kỳ hậu sản (77, 78).
3.3.2 Thuyên tắc phổi (PE)
Chẩn đoán PE khởi phát mới trong thai kỳ tương tự như ở người không mang thai. Xạ hình thông khí–tưới máu và chụp cắt lớp vi tính (CT) mạch máu có liên quan đến việc thai nhi phơi nhiễm với bức xạ tương đối thấp (79). Mặc dù mức độ thai nhi phơi nhiễm từ xạ hình thông khí-tưới máu thấp (khoảng 0,32–0,64 mGy) (77), nhưng liều bức xạ với thai nhi trung bình từ CT xoắn ốc còn thấp hơn (0,0033–0,02 mGy trong tam cá nguyệt thứ nhất, 0,0079–0,0767 mGy trong tam cá nguyệt thứ hai và 0,0513–0,1308 mGy trong tam cá nguyệt thứ ba). Mặc dù mức độ thai nhi phơi nhiễm với bức xạ của CT thấp hơn, nhưng cả hai xét nghiệm đều liên quan với mức độ thai nhi phơi nhiễm bức xạ thấp và mức độ phơi nhiễm bức xạ của người mẹ (đặc biệt là ở vú) thấp hơn khi xạ hình thông khí-tưới máu. Các hướng dẫn thực hành lâm sàng của the American Thoracic Society và the Society of Thoracic Radiology đánh giá nghi ngờ PE trong thai kỳ gợi ý rằng chụp X-quang ngực được sử dụng như một đánh giá ban đầu, sau đó chuyển sang xạ hình thông khí-tưới máu nếu X-quang ngực bình thường và chụp CT mạch máu nếu X-quang ngực bất thường (77). Khuyến cáo này một phần dựa trên liều bức xạ cao hơn đối với thai phụ khi chụp CT mạch máu.
Tuy nhiên, việc lựa chọn xét nghiệm thích hợp nhất cũng sẽ dựa vào sự sẵn có và chuyên môn tại chỗ. Một tổng quan gần đây của Cochrane đã kết luận rằng xạ hình thông khí-tưới máu và chụp CT mạch máu là phù hợp để loại trừ PE trong thai kỳ, nhưng cảnh báo rằng chất lượng bằng chứng thấp và không rõ xét nghiệm nào chính xác hơn (80).
3.4 Đánh giá phù hợp đối với thai phụ có tiền sử VTE?
Thai phụ có tiền sử huyết khối chưa được đánh giá đầy đủ về các nguyên nhân tiềm ẩn có thể nên được xét nghiệm tìm kháng thể kháng Phospholipid (27) và thrombophilia di truyền (26). Trong thai kỳ, kết quả xét nghiệm thrombophilia ở thai phụ bị VTE trước đó có thể làm thay đổi khuyến cáo dự phòng bằng thuốc hoặc cường độ điều trị từ phác đồ LMWH liều dự phòng sang liều điều chỉnh (81).
3.5 Đối tượng nào cần liệu pháp chống đông trong thai kỳ và ngay sau sinh?
Khuyến cáo liệu pháp chống đông liều điều chỉnh được cho tất cả thai phụ bị VTE cấp tính trong thai kỳ. Mặc dù điều trị liều đủ với cường độ chống đông trung bình trong 3–6 tháng đã được chứng minh là an toàn ở một số nhóm bệnh nhân, nhưng vẫn chưa rõ tính an toàn của cách tiếp cận này trong thai kỳ vì yếu tố thúc đẩy vẫn chưa được giải quyết (82). Tuy nhiên, các hướng dẫn đồng thuận quốc tế gợi ý rằng sau điều trị ban đầu (3-6 tháng tùy thuộc vào loại biến cố VTE), cường độ chống đông có thể giảm xuống liều trung gian hoặc liều dự phòng trong thời gian còn lại của thai kỳ và ít nhất 6 tuần sau sinh (83, 84). Các đối tượng khác cần liệu pháp chống đông trong thai kỳ bao gồm thai phụ có tiền sử huyết khối hoặc những người có nguy cơ VTE cao trong thai kỳ hoặc thời kỳ hậu sản, chẳng hạn như những người mắc thrombophilia.
3.6 Nên dùng liệu pháp chống đông như thế nào?
Không có thử nghiệm lớn nào về liều lượng tối ưu của thuốc chống đông trong thai kỳ và các khuyến cáo sử dụng chúng dựa trên loạt ca bệnh và ý kiến chuyên gia. Thuốc chống đông liều điều chỉnh (điều trị) được khuyến cáo cho thai phụ bị thuyên tắc huyết khối cấp tính trong thai kỳ hiện tại hoặc thai phụ có nguy cơ huyết khối cao, chẳng hạn như thai phụ có tiền sử huyết khối tái phát hoặc van tim cơ học (30). Các quyết định về loại thuốc, liều lượng và thời gian điều trị có thể được điều chỉnh dựa trên các yếu tố nguy cơ khác như mổ lấy thai, bất động kéo dài, béo phì, biến chứng sản khoa và tiền sử bản nhân hoặc gia đình mắc thrombophilia và VTE (xem Bảng 3).
Dựa trên dược động học của các loại heparin trong thai kỳ, nên dùng LMWH 1 hoặc 2 lần/ngày và UFH tiêm dưới da ít nhất 12 giờ/lần (Bảng 2) (38–42). Một nghiên cứu hồi cứu về việc dùng liều 1 lần/ngày so với 2 lần/ngày của các heparin khác nhau đối với VTE trong thai kỳ, không phát hiện trường hợp VTE tái phát nào ở 126 thai phụ, 66% trong số họ được dùng LMWH 1 lần/ngày (85). Một nghiên cứu khác so sánh tinzaparin 1 lần/ngày so với tinzaparin 2 lần/ngày để điều trị VTE trong thai kỳ cho thấy ở những thai phụ chỉ dùng tinzaparin 1 lần/ngày, cần phải dùng liều cao hơn mức khuyến cáo để duy trì hoạt tính anti-Xa trong khoảng mục tiêu (40). Một nghiên cứu hồi cứu khác về phác đồ tinzaparin 1 lần/ngày phát hiện 2 biến chứng huyết khối bất thường trong số 37 thai kỳ (86). Bất kỳ sự điều chỉnh nào đối với bệnh béo phì đều phải được đưa vào phác đồ liều điều chỉnh (điều trị). Mặc dù không có phác đồ điều chỉnh liều dự phòng dựa trên bằng chứng, nhưng khi cân nặng quá cao hoặc quá thấp hoặc khi thai kỳ tiến triển, có thể xem xét LMWH liều trung gian (88). Liều UFH dự phòng cần thiết tăng trong suốt thai kỳ và khi tăng cân và khuyến cáo điều chỉnh liều đối với mỗi tam cá nguyệt (88, 89).
3.7 Trường hợp dị ứng với heparin hoặc giảm tiểu cầu do heparin, nên dùng thuốc chống đông nào?
Nguy cơ giảm tiểu cầu do heparin ở quần thể sản khoa thường được ước tính < 0,1% (90, 91). Các hướng dẫn khuyến cáo xét nghiệm số lượng tiểu cầu lúc bắt đầu dùng thuốc chống đông khi nguy cơ giảm tiểu cầu do heparin > 1%; do đó, trong trường hợp không có các yếu tố nguy cơ khác, hầu hết bệnh nhân sản khoa sẽ không cần theo dõi tiểu cầu (90). Trong trường hợp dị ứng da nghiêm trọng hoặc giảm tiểu cầu do heparin trong thai kỳ, khuyến cáo tham vấn ý kiến bác sĩ huyết học. Fondaparinux (một pentasaccharide tổng hợp) có thể là thuốc chống đông được ưu tiên. Mặc dù một nghiên cứu hồi cứu gần đây so sánh fondaparinux với Enoxaparin (dùng từ ngày thứ 6 của chu kỳ kinh nguyệt và tiếp tục cho đến 12 tuần tuổi thai) không phát hiện tác dụng phụ nào của fondaparinux đối với thai phụ hoặc trẻ sơ sinh (92), hoạt tính chống đông được phát hiện trong máu cuống rốn thai nhi bị phơi nhiễm (93). Việc sử dụng thuốc này và các thuốc ức chế trực tiếp thrombin đường tiêm khác nên được giới hạn ở những bệnh nhân có phản ứng dị ứng nghiêm trọng với heparin. Trong thai kỳ và thời kỳ cho con bú, nên tránh dùng các thuốc ức chế trực tiếp thrombin (dabigatran) và Anti-Xa (rivaroxaban, apixaban, edoxaban, betrixaban) đường uống khác (59).
3.8 Quản lý VTE được chẩn đoán mới trong thai kỳ như thế nào?
Quản lý VTE được chẩn đoán mới bao gồm bắt đầu LMWH liều điều chỉnh (điều trị) tiêm dưới da (30) (Bảng 2). Có thể chỉ định nhập viện để bắt đầu liệu pháp chống đông trong trường hợp huyết động không ổn định, cục máu đông lớn hoặc mẹ có bệnh kèm theo. UFH tiêm tĩnh mạch có thể được xem xét trong điều trị ban đầu của PE và trong các tình huống cần sinh thai, phẫu thuật hoặc tiêu huyết khối (được chỉ định cho thuyên tắc huyết khối đe dọa tính mạng hoặc đe dọa đến chi); khi bệnh nhân có vẻ ổn định về mặt huyết động, khi sắp xuất viện có thể thay thế bằng LMWH. Sau sinh, những bệnh nhân này nên được điều trị ít nhất 6 tuần với tổng thời gian điều trị tối thiểu là 3–6 tháng tùy thuộc vào bệnh cảnh lâm sàng (30).
3.9 Theo dõi liệu pháp chống đông trong thai kỳ như thế nào?
Dữ liệu không rõ ràng về việc giám sát tối ưu liệu pháp chống đông trong thai kỳ. Khi dùng liều điều chỉnh (điều trị) được xác định theo cân nặng để điều trị hoặc dự phòng VTE, không rõ liệu có cần điều chỉnh tăng liều LMWH hay không. Một số nghiên cứu gợi ý rằng nên điều chỉnh liều khi cân nặng của mẹ thay đổi trong thai kỳ (94). Trên cơ sở các nghiên cứu nhỏ cho thấy cần tăng liều LMWH để duy trì nồng độ anti-Xa trong khoảng từ 0,6 đơn vị/mL đến 1,0 đơn vị/mL, một số nghiên cứu ủng hộ việc đo nồng độ anti-Xa định kỳ 4–6 giờ sau tiêm, nhưng các nghiên cứu khác cho thấy có rất ít thai phụ thực sự cần tăng liều khi liều dùng dựa trên cân nặng (30). Nếu bệnh nhân được chuyển từ LMWH liều điều chỉnh sang UFH liều điều chỉnh tiêm dưới da khi chuẩn bị sinh, nên kiểm tra aPTT và liều heparin được điều chỉnh để duy trì aPTT trong khoảng điều trị (mục tiêu aPTT 6 giờ sau tiêm là 1,5–2,5 lần đối chứng).
Bệnh nhân dùng thuốc chống đông dự phòng thường không cần theo dõi vì chưa xác định được nồng độ anti-Xa tối ưu khi dự phòng LMWH trong thai kỳ. Các nghiên cứu hồi cứu gợi ý rằng đo nồng độ anti-Xa có thể được xem xét trong các tình huống mà mức độ dự phòng nằm ngoài phạm vi được khuyến cáo mà nghi ngờ trên lâm sàng, chẳng hạn như trong trường hợp béo phì (43, 95).
3.10 Quản lý liệu pháp chống đông quanh thời điểm sinh như thế nào?
Các quyết định về thời điểm sinh nên dựa trên các chỉ định sản khoa thông thường, kết hợp với mục tiêu duy trì chống đông thỏa đáng trước khi sinh cũng như tránh tác dụng đông máu không mong muốn trong khi sinh, cùng với sở thích của bệnh nhân. The Society for Obstetric Anesthesia and Perinatology đã công bố hướng dẫn đồng thuận về việc dự phòng huyết khối và các cân nhắc khi gây tê trục thần kinh, đặc biệt ở quần thể sản khoa (96). Ngoài việc đưa ra các khuyến cáo quản lý cụ thể, hiệp hội cũng khuyến cáo rằng mỗi đơn vị y tế nên có một phác đồ về thời điểm thai phụ và phụ nữ sau sinh nên ngừng thuốc chống đông và khi nào thai phụ đang dự phòng huyết khối đủ điều kiện gây tê trục thần kinh.
Đối với thai phụ đang dự phòng bằng LMWH, khuyến cáo ngừng thuốc ít nhất 12 giờ trước khi khởi phát chuyển dạ hoặc mổ lấy thai chủ động; và khuyến cáo ngừng thuốc 24 giờ đối với bệnh nhân đang dùng phác đồ liều điều chỉnh (Bảng 4) (96). Đối với UFH liều 7.500 đơn vị tiêm dưới da từ 2 lần/ngày trở lên, khuyến cáo ngừng thuốc 12 giờ cũng như xét nghiệm đánh giá tình trạng đông máu. Khi chuẩn bị sinh, thai phụ đang điều trị chống đông bằng LMWH có thể chuyển sang UFH có thời gian bán hủy ngắn hơn, tùy thuộc vào phác đồ của cơ sở y tế. Một lựa chọn thay thế đó là có thể ngừng thuốc chống đông và khởi phát chuyển dạ trong vòng 24 giờ, nếu lâm sàng phù hợp. Nếu dự định chuyển sang dùng UFH, thời điểm thực hiện việc này nên dựa vào bệnh cảnh lâm sàng, bao gồm kết hợp cả khả năng chuyển dạ tự nhiên và mục tiêu giảm thiểu thời gian không dùng thuốc chống đông thích hợp. Do nhu cầu tiềm tàng đối với các thủ thuật khẩn cấp hoặc cấp cứu trong sản khoa, các hướng dẫn của the Society for Obstetric Anesthesia and Perinatology tích hợp hỗ trợ quyết định giúp hướng dẫn về việc thực hiện gây tê trục thần kinh nếu thời gian được khuyến cáo kể từ liều cuối cùng chưa hết (96).
Mục đích chuyển sang dùng UFH không phải là do ít liên quan đến bất kỳ nguy cơ chảy máu nào của mẹ tại thời điểm sinh, mà là nguy cơ tụ máu ngoài màng cứng hoặc tủy sống khi gây tê vùng; nguy cơ này, có hoặc không có thay đổi cầm máu, và rất khó xác định, mặc dù tỷ lệ mắc mới chỉ thể xấp xỉ 3–4:1,000,000 (96). Cho đến nay, chưa có trường hợp tụ máu tủy sống nào được công bố ở sản phụ liên quan đến điều trị chống huyết khối (có hoặc không có phong bế trục thần kinh) (97). Do đó, khi không có các loạt ca bệnh lớn về kỹ thuật gây tê trục thần kinh ở nhóm phụ thai phụ đang dự phòng hoặc điều trị VTE, các khuyến cáo chủ yếu xuất phát từ bệnh nhân phẫu thuật, và áp dụng cho sản phụ, đã được đưa vào vào hướng dẫn của the American Society of Regional Anesthesia and Pain Medicine cũng như hướng dẫn của the Society for Obstetric Anesthesia and Perinatology.
Có thể dùng Protamine sulfate để đảo ngược tác dụng của UFH hoặc, khó dự đoán hơn với LMWH. Liều protamine sulfat phụ thuộc vào việc bệnh nhân đang dùng UFH hay LMWH và đường dùng của các loại thuốc này. Tuy nhiên, hiếm khi cần đảo ngược tác dụng của heparin và không được chỉ định với liều heparin dự phòng. Đối với thai phụ cần tạm thời ngừng liệu pháp chống đông, khuyến cáo dùng máy bơm hơi áp lực (pneumatic compression devices) .
3.11 Liệu pháp dự phòng VTE nào nên được dùng cho bệnh nhân mổ lấy thai?
Mổ lấy thai làm tăng nguy cơ VTE khoảng 4 lần so với sinh thường, nhưng ở những bệnh nhân bình thường khác, nguy cơ này vẫn thấp (khoảng 3 trên 1.000 bệnh nhân) (32). Do sự gia tăng nguy cơ này và dựa vào việc ngoại suy từ dữ liệu chu phẫu, tất cả sản phụ được khuyến cáo dùng máy bơm hơi áp lực trước khi mổ lấy thai và nên vận động sớm sau mổ (30). Máy bơm hơi áp lực được dùng cho đến khi bệnh nhân có thể đi lại được.
Một tổng quan về các hướng dẫn dự phòng VTE liên quan đến thai kỳ từ Hoa Kỳ và các tổ chức quốc tế cho thấy sự khác biệt đáng kể về khuyến cáo dự phòng VTE sau mổ lấy thai (59). Mỗi cơ sở y tế nên xem xét cẩn thận các quy trình đánh giá nguy cơ sẵn có, áp dụng và thực hiện một trong số chúng một cách có hệ thống để giảm tỷ lệ mắc mới VTE trong thai kỳ và thời kỳ hậu sản (68). Đối với bệnh nhân mổ lấy thai khi có thêm các yếu tố nguy cơ thuyên tắc huyết khối, đánh giá nguy cơ cá nhân có thể ủng hộ dự phòng huyết khối bằng máy bơm hơi áp lực và LMWH (30). Đối với những người có chống chỉ định dùng thuốc chống đông, nên dự phòng bằng biện pháp cơ học sau sinh hơn là không dự phòng (30).
Đối với thai phụ có nguy cơ huyết khối đặc biệt cao tại thời điểm sinh, có thể kết hợp LMWH dự phòng với dự phòng cơ học (30). Đối với một số bệnh nhân nguy cơ cao mà các yếu tố nguy cơ đáng kể vẫn tồn tại sau sinh, khuyến cáo dự phòng (ít nhất 6 tuần sau sinh) sau khi xuất viện (98, 99). Hầu hết bệnh nhân được dự phòng huyết khối trong thai kỳ sẽ được hưởng lợi từ việc dự phòng huyết khối sau sinh, nhưng liều lượng, đường dùng và thời gian dùng sẽ thay đổi tùy theo chỉ định (Bảng 2).
Thai phụ có nguy cơ VTE tái phát rất cao (nghĩa là DVT đoạn gần hoặc PE trong 2–4 tuần trước sinh, đặc biệt nếu đây là VTE tái phát mặc dù đã được điều trị chống đông thỏa đáng) có thể là đối tượng để đặt lưới lọc tĩnh mạch chủ dưới có thể thu hồi (retrievable vena caval filter), và được lấy bỏ sau sinh (100, 101). Tuy nhiên, các chỉ định cho điều này còn hạn chế và phải được cân bằng với nguy cơ biến chứng, bao gồm di chuyển lưới lọc và thủng tĩnh mạch chủ dưới, có thể tăng trong thai kỳ (30).
3.12 Thời điểm tối ưu để bắt đầu lại liệu pháp chống đông sau sinh?
Vẫn chưa rõ thời điểm tối ưu để bắt đầu lại liệu pháp chống đông sau sinh. Một cách tiếp cận hợp lý để giảm thiểu các biến chứng chảy máu sau sinh là bắt đầu lại liệu pháp chống đông không sớm hơn 4-6 giờ sau sinh thường hoặc 6-12 giờ sau mổ lấy thai (Bảng 4). Một nghiên cứu đã so sánh 95 sản phụ được điều trị bằng enoxaparin chu sinh với 303 sản phụ ở nhóm chứng và không thấy có sự gia tăng đáng kể nào về tỷ lệ xuất huyết nặng sau sinh khi dùng lại enoxaparin trong khoảng từ 5 giờ đến 24 giờ sau sinh thường và từ 12 giờ đến 36 giờ sau mổ lấy thai (102 ). Trong tuyên bố đồng thuận của the Society for Obstetric Anesthesia and Perinatology khuyến cáo xem xét trì hoãn việc dùng lại liệu pháp chống đông bằng LMWH trong ít nhất 24 giờ sau khi phong bế trục thần kinh và 4 giờ sau khi rút catheter; nếu muốn đạt được tác dụng chống đông điều trị nhanh hơn sau sinh, heparin tiêm tĩnh mạch có thể là một lựa chọn thay thế (96). Khi dự định bắt đầu lại liệu pháp chống đông sau sinh, nên dùng máy bơm hơi áp lực cho đến khi bệnh nhân đi lại được và liệu pháp chống đông được bắt đầu lại.
3.13 Quản lý chống đông sau sinh như thế nào?
Những phụ nữ cần liệu pháp chống đông sau sinh hơn 6 tuần có thể chuyển sang dùng warfarin (103–105) hoặc thuốc chống đông trực tiếp đường uống nếu không cho con bú. Để tránh huyết khối nghịch lý và hoại tử da do tác dụng kháng protein C sớm của warfarin, những phụ nữ mà sẽ được điều trị bằng warfarin nên được điều trị bắc cầu bằng LMWH hoặc UFH liều điều chỉnh cho đến khi tỷ số bình thường hóa quốc tế (INR) trong khoảng điều trị (2,0 –3.0) đạt được trong 2 ngày liên tiếp. Warfarin có thể được bắt đầu đồng thời với các hợp chất heparin liều điều chỉnh trong thời kỳ hậu sản. Đối với phụ nữ có van tim cơ học, warfarin có thể được dùng lại 24 giờ sau sinh, UFH (hoặc LMWH) tiêm tĩnh mạch được dùng đồng thời cho đến khi đạt được mục tiêu điều trị bằng warfarin. Đối với những bệnh nhân không có van tim cơ học mà cần chống đông > 6 tuần, có thể chuyển sang dùng chống đông đường uống khi nguy cơ chảy máu sau sinh đã giảm (thường là 1-2 tuần). Liều khởi đầu của warfarin là 5 mg/ngày trong 2 ngày, với các liều sau đó được xác định bằng cách theo dõi tỷ số bình thường hóa quốc tế (INR). Đối với những phụ nữ chỉ cần dùng 6 tuần liệu pháp chống đông sau sinh, khi đó việc dùng warfarin bị hạn chế vì thường phải cần 1-2 tuần trước khi đạt được khoảng mục tiêu. Do đó, nhiều bệnh nhân lựa chọn tiếp tục dùng LMWH trong khoảng thời gian 6 tuần. Vì warfarin, LMWH và UFH không tích lũy trong sữa mẹ và không gây tác dụng chống đông ở trẻ, nên những thuốc chống đông này tương thích với việc cho con bú (103, 106, 107).
4 Tóm tắt các kết luận và khuyến cáo
Dựa vào bằng chứng khoa học tốt và nhất quán, chúng tôi đưa ra khuyến cáo sau (Level A):
-
Khi các dấu hiệu hoặc triệu chứng gợi ý DVT khởi phát mới, xét nghiệm chẩn đoán ban đầu được khuyến cáo là siêu âm các tĩnh mạch đoạn gần có đè ép.
Dựa vào bằng chứng khoa học hạn chế và không nhất quán, chúng tôi đưa ra các khuyến cáo và kết luận sau (Level B):
-
Nhìn chung, thuốc chống đông được ưu tiên dùng trong thai kỳ là các hợp chất heparin.
-
Do LMWH có độ tin cậy cao hơn và dễ sử dụng hơn, nên để dự phòng và điều trị VTE trong và ngoài thai kỳ, nó thường hay được khuyến cáo hơn UFH.
-
Một cách tiếp cận hợp lý để giảm thiểu các biến chứng chảy máu sau sinh là bắt đầu lại liệu pháp chống đông không sớm hơn 4-6 giờ sau sinh thường hoặc 6-12 giờ sau mổ lấy thai.
-
Vì warfarin, LMWH và UFH không tích lũy trong sữa mẹ và không gây tác dụng chống đông ở trẻ, nên những thuốc chống đông này tương thích với việc cho con bú.
Chủ yếu dựa vào sự đồng thuận và ý kiến chuyên gia, chúng tôi đưa ra các khuyến cáo sau (Level C):
-
Thai phụ có tiền sử huyết khối chưa được đánh giá đầy đủ về các nguyên nhân tiềm ẩn có thể nên được xét nghiệm tìm kháng thể kháng phospholipid và thrombophilia di truyền.
-
Thuốc chống đông liều điều chỉnh (điều trị) được khuyến cáo cho thai phụ bị thuyên tắc huyết khối cấp tính trong thai kỳ hiện tại hoặc thai phụ có nguy cơ huyết khối cao, chẳng hạn như thai phụ có tiền sử huyết khối tái phát hoặc van tim cơ học.
-
Khi dự định bắt đầu lại liệu pháp chống đông sau sinh, nên dùng máy bơm hơi áp lực cho đến khi bệnh nhân đi lại được và liệu pháp chống đông được bắt đầu lại.
-
Mỗi đơn vị y tế nên có một phác đồ về thời điểm thai phụ và phụ nữ sau sinh nên ngừng thuốc chống đông và khi nào thai phụ đang dự phòng huyết khối đủ điều kiện gây tê trục thần kinh.
-
Khi chuẩn bị sinh, thai phụ đang điều trị chống đông bằng LMWH có thể chuyển sang UFH có thời gian bán hủy ngắn hơn, tùy thuộc vào phác đồ của cơ sở y tế.
-
Đối với thai phụ đang dự phòng bằng LMWH, khuyến cáo ngừng thuốc ít nhất 12 giờ trước khi khởi phát chuyển dạ hoặc mổ lấy thai chủ động; và khuyến cáo ngừng thuốc 24 giờ đối với bệnh nhân đang dùng phác đồ liều điều chỉnh.
-
Tất cả sản phụ được khuyến cáo dùng máy bơm hơi áp lực trước khi mổ lấy thai và nên vận động sớm sau mổ.
-
Mỗi cơ sở y tế nên xem xét cẩn thận các quy trình đánh giá nguy cơ sẵn có, áp dụng và thực hiện một trong số chúng một cách có hệ thống để giảm tỷ lệ mắc mới VTE trong thai kỳ và thời kỳ hậu sản.
|
Các yếu tố đông máu |
Thay đổi trong thai kỳ |
|---|---|
|
Các yếu tố tiền đông |
|
|
Fibrinogen |
Tăng |
|
Yếu tố VIII |
Tăng |
|
Yếu tố VII |
Tăng |
|
Yếu tố X |
Tăng |
|
Yếu tố Von Willebrand |
Tăng |
|
Plasminogen activator inhibitor-2 |
Tăng |
|
Plasminogen activator inhibitor-1 |
Tăng |
|
Yếu tố II |
Không thay đổi |
|
Yếu tố V |
Không thay đổi |
|
Yếu tố IX |
Không thay đổi |
|
Các yếu tố chống đông |
|
|
Protein S tự do |
Giảm |
|
Protein C |
Không thay đổi |
|
Antithrombin |
Không thay đổi |
Data from Bremme KA. Haemostatic changes in pregnancy. Best Pract Res Clin Haematol 2003;16:153–68 and Medcalf RL, Stasinopoulos SJ. The undecided serpin. The ins and outs of plasminogen activator inhibitor type 2. Febs J 2005;272:4858–67.
|
Phác đồ chống đông |
Liều chống đông |
|---|---|
|
LMWH dự phòng* |
Enoxaparin, 40 mg SC 1 lần/ngày Dalteparin, 5,000 đơn vị SC 1 lần/ngày Tinzaparin, 4,500 đơn vị SC 1 lần/ngày Nadroparin, 2,850 đơn vị SC 1 lần/ngày |
|
LMWH liều trung gian |
Enoxaparin, 40 mg SC mỗi 12 giờ Dalteparin, 5,000 đơn vị SC mỗi 12 giờ |
|
LMWH liều điều chỉnh (điều trị) † |
Enoxaparin, 1 mg/kg mỗi 12 giờ Dalteparin, 200 đơn vị/kg 1 lần/ngày Tinzaparin, 175 đơn vị/kg 1 lần/ngày Dalteparin, 100 đơn vị/kg mỗi 12 giờ Mục tiêu nồng độ anti-Xa trong khoảng điều trị là 0,6–1,0 đơn vị/mL 4 giờ sau mũi tiêm cuối cùng đối với phác đồ 2 lần/ngày; có thể cần liều cao hơn một chút đối với phác đồ 1 lần/ngày. |
|
UFH dự phòng |
UFH, 5.000–7.500 đơn vị SC mỗi 12 giờ trong tam cá nguyệt thứ nhất UFH, 7.500–10.000 đơn vị SC mỗi 12 giờ trong tam cá nguyệt thứ hai UFH, 10.000 đơn vị SC mỗi 12 giờ trong tam cá nguyệt thứ ba, trừ khi aPTT tăng cao |
|
UFH liều điều chỉnh (điều trị) † |
UFH, 10.000 đơn vị SC trở lên mỗi 12 giờ với các liều được điều chỉnh để đạt mục tiêu aPTT trong khoảng điều trị (1,5–2,5 lần đối chứng) 6 giờ sau tiêm |
|
Chống đông sau sinh |
LMWH liều dự phòng, trung gian hoặc điều chỉnh trong 6–8 tuần theo chỉ định. Thuốc chống đông đường uống có thể được cân nhắc sau sinh dựa trên thời gian điều trị dự kiến, có cho con bú hay không và sở thích của bệnh nhân |
|
Giám sát |
Theo dõi sát lâm sàng và xét nghiệm khách quan thích hợp đối với phụ nữ có triệu chứng nghi ngờ huyết khối tĩnh mạch sâu hoặc thuyên tắc phổi. Trước khi mang thai hoặc đầu thai kỳ nên đánh giá nguy cơ VTE và lặp lại nếu xuất hiện biến chứng, đặc biệt là những trường hợp cần nhập viện hoặc bất động kéo dài. |
Viết tắt: aPTT thời gian Thromboplastin hoạt hóa từng phần; INR : tỷ số bình thường hóa quốc tế; LMWH : heparin trọng lượng phân tử thấp; UFH : heparin không phân đoạn; SC : tiêm dưới da; VTE : thuyên tắc huyết khối tĩnh mạch.
* Khi cân nặng quá cao hoặc quá thấp, có thể cần phải điều chỉnh liều.
† Còn được gọi là liều điều trị đủ, điều chỉnh theo cân nặng.
|
Bệnh cảnh lâm sàng |
Quản lý trước sinh |
Quản lý sau sinh |
|---|---|---|
|
Không có tiền sử VTE, không mắc thrombophilia |
Giám sát*, không cần liệu pháp chống đông |
Giám sát, không cần liệu pháp chống đông hoặc liệu pháp chống đông dự phòng sau sinh nếu bệnh nhân có nhiều yếu tố nguy cơ.† |
|
VTE được chẩn đoán trong thai kỳ |
LMWH/UFH liều điều chỉnh |
LMWH/UFH liều điều chỉnh tối thiểu 6 tuần sau khi sinh. Thời gian điều trị dài hơn có thể được chỉ định tùy thuộc vào thời điểm xảy ra VTE trong thai kỳ, tiền sử VTE trước đó hoặc có mắc thrombophilia hay không. Thuốc chống đông đường uống có thể được cân nhắc sau sinh dựa trên thời gian điều trị dự kiến, có cho con bú hay không và sở thích của bệnh nhân. |
|
Tiền sử 1 đợt VTE có yếu tố thúc đẩy (được thúc đẩy bởi một sự kiện cụ thể như phẫu thuật, chấn thương hoặc bất động) không liên quan đến estrogen hoặc mang thai do yếu tố nguy cơ thoáng qua (đã thoái triển), không mắc thrombophilia |
Giám sát*, không cần liệu pháp chống đông |
Giám sát, không cần liệu pháp chống đông hoặc liệu pháp chống đông dự phòng sau sinh nếu bệnh nhân có thêm các yếu tố nguy cơ.† |
|
Tiền sử 1 đợt VTE không có yếu tố thúc đẩy (không xác định được yếu tố thúc đẩy; bao gồm VTE trước đó trong thai kỳ hoặc liên quan đến tránh thai nội tiết), không dùng thuốc chống đông lâu dài |
LMWH/UFH liều dự phòng, liều trung gian hoặc liều điều chỉnh |
Phác đồ LMWH/UFH liều dự phòng, liều trung gian hoặc liều điều chỉnh trong 6 tuần sau sinh |
|
Thrombophilia nguy cơ thấp ¥ không có VTE trước đó |
Giám sát*, không cần liệu pháp chống đông |
Giám sát, không cần liệu pháp chống đông hoặc liệu pháp chống đông dự phòng sau sinh nếu bệnh nhân có thêm các yếu tố nguy cơ.† |
|
Thrombophilia nguy cơ thấp ¥ có tiền sử gia đình (người thân trực hệ) bị VTE |
Giám sát*, không cần liệu pháp chống đông hoặc LMWH/UFH dự phòng |
Liệu pháp chống đông dự phòng sau sinh hoặc LMWH/UFH liều trung gian |
|
Thrombophilia nguy cơ thấp¥ với 1 đợt VTE trước đó-Không được điều trị chống đông lâu dài |
LMWH/UFH liều trung gian hoặc dự phòng |
Liệu pháp chống đông dự phòng sau sinh hoặc LMWH/UFH liều trung gian |
|
Thrombophilia nguy cơ cao§ không có VTE trước đó |
LMWH/UFH liều trung gian hoặc dự phòng |
Liệu pháp chống đông dự phòng sau sinh hoặc LMWH/UFH liều trung gian |
|
Huyết khối nguy cơ cao§ với 1 đợt VTE trước đó hoặc người thân trực hệ bị ảnh hưởng - Không được điều trị chống đông lâu dài |
LMWH/UFH liều dự phòng, liều trung gian hoặc liều điều chỉnh |
Liệu pháp chống đông dự phòng sau sinh hoặc LMWH/UFH liều trung gian hoặc liều điều chỉnh trong 6 tuần (mức điều trị phải bằng với mức điều trị trước sinh đã chọn) |
|
Từ 2 đợt VTE trở lên-Không được điều trị chống đông lâu dài (bất kể thrombophilia) |
LMWH/UFH liều trung gian hoặc liều điều chỉnh |
Liệu pháp chống đông sau sinh với LMWH/UFH liều trung gian hoặc liều điều chỉnh trong 6 tuần (mức điều trị phải bằng với mức điều trị trước sinh đã chọn) |
|
Từ 2 đợt VTE trở lên-Được điều trị chống đông lâu dài (bất kể thrombophilia) |
LMWH hoặc UFH liều điều chỉnh |
Tiếp tục liệu pháp chống đông lâu dài. Thuốc chống đông đường uống có thể được cân nhắc sau sinh dựa trên thời gian điều trị dự kiến, có cho con bú hay không và sở thích của bệnh nhân. |
Viết tắt: LMWH, heparin trọng lượng phân tử thấp; UFH, heparin không phân đoạn; VTE, thuyên tắc huyết khối tĩnh mạch.
*Nên đánh giá nguy cơ VTE trước khi mang thai hoặc đầu thai kỳ và lặp lại nếu xuất hiện biến chứng, đặc biệt là những trường hợp cần nhập viện hoặc bất động kéo dài.
†Người thân trực hệ có tiền sử một đợt huyết khối hoặc các yếu tố nguy cơ huyết khối chính khác (ví dụ như béo phì, bất động kéo dài, mổ lấy thai).
¥Thrombophilia nguy cơ thấp: Yếu tố V Leiden dị hợp tử; dị hợp tử đột biến protrombin G20210A; thiếu protein C hoặc protein S, kháng thể kháng phospholipid.
§Thrombophilia nguy cơ cao bao gồm đồng hợp tử yếu tố V Leiden, đồng hợp tử đột biến gen protrombin G20210A, dị hợp tử yếu tố V Leiden và đột biến protrombin G20210A hoặc thiếu antitrombin.
|
Phác đồ liều dùng |
Thủ thuật chủ động, trong chuyển dạ |
Thủ thuật khẩn cấp/cấp cứu, trong chuyển dạ |
Sau sinh |
|---|---|---|---|
|
Dự phòng UFH (7.500 đơn vị SC 2 lần/ngày hoặc 10.000 đơn vị SC 2 lần/ngày) |
Ngừng thuốc 12 giờ và đánh giá tình trạng đông máu trước khi gây tê trục thần kinh |
Ngừng thuốc 12 giờ và đánh giá tình trạng đông máu trước khi gây tê trục thần kinh. Tuy nhiên, trong trường hợp khẩn cấp, nguy cơ gây mê toàn thân lớn hơn nhiều, khi đó gây tê trục thần kinh có thể là phù hợp. |
Đợi ít nhất 1 giờ sau khi phong bế trục thần kinh và rút catheter trước khi bắt đầu lại heparin |
|
UFH liều điều chỉnh (>10.000 đơn vị mỗi liều hoặc >20.000 đơn vị mỗi ngày) |
Ngừng thuốc 24 giờ và đánh giá tình trạng đông máu trước khi gây tê trục thần kinh |
Nếu ít nhất 24 giờ trôi qua kể từ liều cuối cùng và aPTT trong giới hạn bình thường hoặc anti-Xa không phát hiện được, khi đó phong bế trục thần kinh có khả năng nguy cơ thấp |
Đợi ít nhất 1 giờ sau khi phong bế trục thần kinh và rút catheter trước khi bắt đầu lại heparin |
|
Dự phòng LMWH liều thấp |
Đợi 12 giờ sau liều cuối cùng trước khi phong bế trục thần kinh |
Không đủ dữ liệu để đưa ra khuyến cáo về việc phong bế trục thần kinh dưới 12 giờ kể từ liều LMWH cuối cùng. Trong những tình huống nguy cơ cao cần mà can thiệp, nguy cơ của gây mê toàn thân có thể lớn hơn nguy cơ tụ máu ngoài màng cứng cột sống |
Đợi ít nhất 12 giờ sau khi phong bế trục thần kinh và ít nhất 4 giờ sau khi rút catheter để bắt đầu lại dự phòng LMWH |
|
LMWH liều trung gian hoặc liều điều chỉnh |
Đợi 24 giờ sau liều cuối cùng trước khi phong bế trục thần kinh |
Nếu dưới 24 giờ, không đủ bằng chứng để khuyến cáo tiến hành phong bế trục thần kinh |
Cân nhắc chờ ít nhất 24 giờ sau khi phong bế trục thần kinh và ít nhất 4 giờ sau khi rút catheter để bắt đầu lại thuốc chống đông LMWH |
Viết tắt: LMWH, heparin trọng lượng phân tử thấp; SC, tiêm dưới da; UFH, heparin không phân đoạn.
Data from Leffert L, Butwick A, Carvalho B, Arendt K, Bates SM, Friedman A, et al. The Society for Obstetric Anesthesia and Perinatology consensus statement on the anesthetic management of pregnant and postpartum women receiving thromboprophylaxis or higher dose anticoagulants. Members of the SOAP VTE Taskforce. Anesth Analg 2018;126:928–44.
5 Tài liệu tham khảo
1. Heit JA, Kobbervig CE, James AH, Petterson TM, Bailey KR, Melton LJ III. Trends in the incidence of venous thromboembolism during pregnancy or postpartum: a 30- year population-based study. Ann Intern Med 2005;143: 697–706. (Level II-3)
2. Pomp ER, Lenselink AM, Rosendaal FR, Doggen CJ. Pregnancy, the postpartum period and prothrombotic defects: risk of venous thrombosis in the MEGA study. J Thromb Haemost 2008;6:632–7. (Level II-2)
3. James AH, Jamison MG, Brancazio LR, Myers ER. Venous thromboembolism during pregnancy and the postpartum period: incidence, risk factors, and mortality. Am J Obstet Gynecol 2006;194:1311–5. (Level II-3)
4. Andersen BS, Steffensen FH, Sorensen HT, Nielsen GL, Olsen J. The cumulative incidence of venous thromboembolism during pregnancy and puerperium–an 11 year Danish population-based study of 63,300 pregnancies. Acta Obstet Gynecol Scand 1998;77:170–3. (Level II-3)
5. Gherman RB, Goodwin TM, Leung B, Byrne JD, Hethumumi R, Montoro M. Incidence, clinical characteristics, and timing of objectively diagnosed venous thromboembolism during pregnancy. Obstet Gynecol 1999;94:730–4. (Level II-3)
6. Lindqvist P, Dahlback B, Marsal K. Thrombotic risk during pregnancy: a population study. Obstet Gynecol 1999; 94:595–9. (Level II-3)
7. Simpson EL, Lawrenson RA, Nightingale AL, Farmer RD. Venous thromboembolism in pregnancy and the puerperium: incidence and additional risk factors from a London perinatal database. BJOG 2001;108:56–60. (Level II-2)
8. Jacobsen AF, Skjeldestad FE, Sandset PM. Incidence and risk patterns of venous thromboembolism in pregnancy and puerperium–a register-based case-control study. Am J Obstet Gynecol 2008;198:233.e1–7. (Level II-3)
9. Liu S, Rouleau J, Joseph KS, Sauve R, Liston RM, Young D, et al. Epidemiology of pregnancy-associated venous thromboembolism: a population-based study in Canada. J Obstet Gynaecol Can 2009;31:611–20. (Level II-3)
10. Creanga AA, Syverson C, Seed K, Callaghan WM. Pregnancy-related mortality in the United States, 2011–2013. Obstet Gynecol 2017;130:366–73. (Level II-3)
11. Blanco-Molina A, Rota LL, Di Micco P, Brenner B, Trujillo-Santos J, Ruiz-Gamietea A, et al. Venous thromboembolism during pregnancy, postpartum or during contraceptive use. RIETE Investigators. Thromb Haemost 2010;103:306–11. (Level II-3)
12. Galambosi PJ, Gissler M, Kaaja RJ, Ulander V. Incidence and risk factors of venous thromboembolism during postpartum period: a population-based cohort-study. Acta Obstet Gynecol Scand 2017;96:852–61. (Level II-2)
13. Antony KM, Racusin DA, Aagaard K, Dildy GA III. Maternal physiology. In: Gabbe SG, Niebyl JR, Simpson JL, Landon MB, Galan HL, Jauniaux ER, et al, editors. Obstetrics: normal and problem pregnancies. 7th ed. Philadelphia (PA): Elsevier; 2017. p. 38–63. (Level III)
14. Macklon NS, Greer IA. Venous thromboembolic disease in obstetrics and gynaecology: the Scottish experience. Scott Med J 1996;41:83–6. (Level III)
15. Whitty JE, Dombrowski MP. Respiratory disease in pregnancy. In: Gabbe SG, Niebyl JR, Simpson JL, Landon MB, Galan HL, Jauniaux ER, et al, editors. Obstetrics: normal and problem pregnancies. 7th ed. Philadelphia (PA): Elsevier; 2017. p. 828–49. (Level III)
16. Danilenko-Dixon DR, Heit JA, Silverstein MD, Yawn BP, Petterson TM, Lohse CM, et al. Risk factors for deep vein thrombosis and pulmonary embolism during pregnancy or post partum: a population-based, case-control study. Am J Obstet Gynecol 2001;184:104–10. (Level II-3)
17. Carr MH, Towers CV, Eastenson AR, Pircon RA, Iriye BK, Adashek JA. Prolonged bedrest during pregnancy: does the risk of deep vein thrombosis warrant the use of routine heparin prophylaxis? J Matern Fetal Med 1997;6: 264–7. (Level II-3)
18. Kovacevich GJ, Gaich SA, Lavin JP, Hopkins MP, Crane SS, Stewart J, et al. The prevalence of thromboembolic events among women with extended bed rest prescribed as part of the treatment for premature labor or preterm premature rupture of membranes. Am J Obstet Gynecol 2000;182:1089–92. (Level II-3)
19. Sikovanyecz J, Orvos H, Pal A, Katona M, Endreffy E, Horvath E, et al. Leiden mutation, bed rest and infection: simultaneous triggers for maternal deep-vein thrombosis and neonatal intracranial hemorrhage? Fetal Diagn Ther 2004;19:275–7. (Level III)
20. Chan WS, Spencer FA, Ginsberg JS. Anatomic distribution of deep vein thrombosis in pregnancy. CMAJ 2010; 182:657–60. (Level III)
21. Ray JG, Chan WS. Deep vein thrombosis during pregnancy and the puerperium: a meta-analysis of the period of risk and the leg of presentation. Obstet Gynecol Surv 1999;54:265–71. (Meta-analysis)
22. James AH, Tapson VF, Goldhaber SZ. Thrombosis during pregnancy and the postpartum period. Am J Obstet Gynecol 2005;193:216–9. (Level III)
23. Pabinger I, Grafenhofer H, Kyrle PA, Quehenberger P, Mannhalter C, Lechner K, et al. Temporary increase in the risk for recurrence during pregnancy in women with a history of venous thromboembolism. Blood 2002;100: 1060–2. (Level II-3)
24. James AH. Venous thromboembolism in pregnancy. Arterioscler Thromb Vasc Biol 2009;29:326–31. (Level III)
25. Robertson L, Wu O, Langhorne P, Twaddle S, Clark P, Lowe GD, et al. Thrombophilia in pregnancy: a systematic review. Thrombosis: Risk and economic Assessment of Thrombophilia Screening (TREATS) Study. Br J Haematol 2006;132:171–96. (Systematic Review and Meta-analysis)
26. Inherited thrombophilias in pregnancy. Practice Bulletin No. 197. American College of Obstetricians and Gynecologists. Obstet Gynecol 2018;132:e18–34. (Level III)
27. Antiphospholipid syndrome. Practice Bulletin No. 132. American College of Obstetricians and Gynecologists. Obstet Gynecol 2012;120:1514–21. (Level III)
28. Larsen TB, Sorensen HT, Gislum M, Johnsen SP. Maternal smoking, obesity, and risk of venous thromboembolism during pregnancy and the puerperium: a population-based nested case-control study. Thromb Res 2007; 120:505–9. (Level II-3)
29. Knight M. Antenatal pulmonary embolism: risk factors, management and outcomes. UKOSS. BJOG 2008;115: 453–61. (Level II-3)
30. Bates SM, Greer IA, Middeldorp S, Veenstra DL, Prabulos AM, Vandvik PO. VTE, thrombophilia, antithrombotic therapy, and pregnancy: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2012;141:e691S–736S. (Level III)
31. Suematsu Y, Obi Y, Shimomura A, Alizadeh RF, Vaziri ND, Nguyen NT, et al. Risk of postoperative venous thromboembolism among pregnant women. Am J Cardiol 2017;120:479–83. (Level II-2)
32. Blondon M, Casini A, Hoppe KK, Boehlen F, Righini M, Smith NL. Risks of venous thromboembolism after cesarean sections: a meta-analysis. Chest 2016;150:572–96. (Meta-analysis)
33. Flessa HC, Kapstrom AB, Glueck HI, Will JJ. Placental transport of heparin. Am J Obstet Gynecol 1965;93: 570–3. (Level III)
34. Harenberg J, Schneider D, Heilmann L, Wolf H. Lack of anti-factor Xa activity in umbilical cord vein samples after subcutaneous administration of heparin or low molecular mass heparin in pregnant women. Haemostasis 1993;23: 314–20. (Level I)
35. Greer IA, Nelson-Piercy C. Low-molecular-weight heparins for thromboprophylaxis and treatment of venous thromboembolism in pregnancy: a systematic review of safety and efficacy. Blood 2005;106:401–7. (Systematic Review)
36. James AH, Abel DE, Brancazio LR. Anticoagulants in pregnancy. Obstet Gynecol Surv 2006;61:59–69; quiz 70–72. (Level III)
37. Brancazio LR, Roperti KA, Stierer R, Laifer SA. Pharmacokinetics and pharmacodynamics of subcutaneous heparin during the early third trimester of pregnancy. Am J Obstet Gynecol 1995;173:1240–5. (Level II-2)
38. Casele HL, Laifer SA, Woelkers DA, Venkataramanan R. Changes in the pharmacokinetics of the low-molecularweight heparin enoxaparin sodium during pregnancy. Am J Obstet Gynecol 1999;181:1113–7. (Level III)
39. Barbour LA, Oja JL, Schultz LK. A prospective trial that demonstrates that dalteparin requirements increase in pregnancy to maintain therapeutic levels of anticoagulation. Am J Obstet Gynecol 2004;191:1024–9. (Level III)
40. Lykke JA, Gronlykke T, Langhoff-Roos J. Treatment of deep venous thrombosis in pregnant women. Acta Obstet Gynecol Scand 2008;87:1248–51. (Level III)
41. Norris LA, Bonnar J, Smith MP, Steer PJ, Savidge G. Low molecular weight heparin (tinzaparin) therapy for moderate risk thromboprophylaxis during pregnancy. A pharmacokinetic study. Thromb Haemost 2004;92: 791–6. (Level III)
42. Lebaudy C, Hulot JS, Amoura Z, Costedoat-Chalumeau N, Serreau R, Ankri A, et al. Changes in enoxaparin pharmacokinetics during pregnancy and implications for antithrombotic therapeutic strategy. Clin Pharmacol Ther 2008;84:370–7. (Level II-3)
43. Fox NS, Laughon SK, Bender SD, Saltzman DH, Rebarber A. Anti-factor Xa plasma levels in pregnant women receiving low molecular weight heparin thromboprophylaxis [published erratum appears in Obstet Gynecol 2009; 113:742]. Obstet Gynecol 2008;112:884–9. (Level II-3)
44. Sanson BJ, Lensing AW, Prins MH, Ginsberg JS, Barkagan ZS, Lavenne-Pardonge E, et al. Safety of lowmolecular-weight heparin in pregnancy: a systematic review. Thromb Haemost 1999;81:668–72. (Systematic Review)
45. Pettila V, Leinonen P, Markkola A, Hiilesmaa V, Kaaja R. Postpartum bone mineral density in women treated for thromboprophylaxis with unfractionated heparin or LMW heparin. Thromb Haemost 2002;87:182–6. (Level I)
46. Carlin AJ, Farquharson RG, Quenby SM, Topping J, Fraser WD. Prospective observational study of bone mineral density during pregnancy: low molecular weight heparin versus control. Hum Reprod 2004;19: 1211–4. (Level II-2)
47. Casele H, Haney EI, James A, Rosene-Montella K, Carson M. Bone density changes in women who receive thromboprophylaxis in pregnancy. Am J Obstet Gynecol 2006;195:1109–13. (Level I)
48. Rodger MA, Kahn SR, Cranney A, Hodsman A, Kovacs MJ, Clement AM, et al. Long-term dalteparin in pregnancy not associated with a decrease in bone mineral density: substudy of a randomized controlled trial. TIPPS investigators. J Thromb Haemost 2007;5:1600–6. (Level I)
49. Blossom DB, Kallen AJ, Patel PR, Elward A, Robinson L, Gao G, et al. Outbreak of adverse reactions associated with contaminated heparin [published erratum appears in N Engl J Med 2010;362:1056]. N Engl J Med 2008;359: 2674–84. (Level II-2)
50. Cotrufo M, De Feo M, De Santo LS, Romano G, Della Corte A, Renzulli A, et al. Risk of warfarin during pregnancy with mechanical valve prostheses. Obstet Gynecol 2002;99:35–40. (Level III)
51. Blickstein D, Blickstein I. The risk of fetal loss associated with Warfarin anticoagulation. Int J Gynaecol Obstet 2002;78:221–5. (Level III)
52. Nassar AH, Hobeika EM, Abd Essamad HM, Taher A, Khalil AM, Usta IM. Pregnancy outcome in women with prosthetic heart valves. Am J Obstet Gynecol 2004;191: 1009–13. (Level III)
53. Sadler L, McCowan L, White H, Stewart A, Bracken M, North R. Pregnancy outcomes and cardiac complications in women with mechanical, bioprosthetic and homograft valves. BJOG 2000;107:245–53. (Level III)
54. Meschengieser SS, Fondevila CG, Santarelli MT, Lazzari MA. Anticoagulation in pregnant women with mechanical heart valve prostheses. Heart 1999;82:23–6. (Level III)
55. Chen WW, Chan CS, Lee PK, Wang RY, Wong VC. Pregnancy in patients with prosthetic heart valves: an experience with 45 pregnancies. Q J Med 1982;51: 358–65. (Level III)
56. Wesseling J, Van Driel D, Heymans HS, Rosendaal FR, Geven-Boere LM, Smrkovsky M, et al. Coumarins during pregnancy: long-term effects on growth and development of school-age children. Thromb Haemost 2001;85: 609–13. (Level II-2)
57. Iturbe-Alessio I, Fonseca MC, Mutchinik O, Santos MA, Zajarias A, Salazar E. Risks of anticoagulant therapy in pregnant women with artificial heart valves. N Engl J Med 1986;315:1390–3. (Level II-2)
58. van Hagen IM, Roos-Hesselink JW, Ruys TP, Merz WM, Goland S, Gabriel H, et al. Pregnancy in women with a mechanical heart valve: Data of the European Society of Cardiology Registry of Pregnancy and Cardiac Disease (ROPAC). ROPAC Investigators and the EURObservational Research Programme (EORP) Team. Circulation 2015;132:132–42. (Level II-3)
59. Bates SM, Middeldorp S, Rodger M, James AH, Greer I. Guidance for the treatment and prevention of obstetricassociated venous thromboembolism. J Thromb Thrombolysis 2016;41:92–128. (Level III)
60. Bapat P, Kedar R, Lubetsky A, Matlow JN, Aleksa K, Berger H, et al. Transfer of dabigatran and Dabigatran etexilate mesylate across the dually perfused human placenta. Obstet Gynecol 2014;123:1256–61. (Level II-3)
61. Bapat P, Pinto LS, Lubetsky A, Berger H, Koren G. Rivaroxaban transfer across the dually perfused isolated human placental cotyledon. Am J Obstet Gynecol 2015; 213: 710.e1–6. (Level II-2)
62. Bapat P, Pinto LS, Lubetsky A, Aleksa K, Berger H, Koren G, et al. Examining the transplacental passage of apixaban using the dually perfused human placenta. J Thromb Haemost 2016;14:1436–41. (Level II-2)
63. Wiesen MH, Blaich C, Muller C, Streichert T, Pfister R, Michels G. The direct factor Xa inhibitor rivaroxaban passes into human breast milk. Chest 2016;150: e1–4. (Level III)
64. Hellgren M, Johansson S, Eriksson UG, Wahlander K. The oral direct thrombin inhibitor, ximelagatran, an alternative for anticoagulant treatment during the puerperium and lactation. BJOG 2005;112:579–83. (Level II-2)
65. Hoeltzenbein M, Beck E, Meixner K, Schaefer C, Kreutz R. Pregnancy outcome after exposure to the novel oral anticoagulant rivaroxaban in women at suspected risk for thromboembolic events: a case series from the German Embryotox Pharmacovigilance Centre. Clin Res Cardiol 2016;105:117–26. (Level III).
66. Okoroh EM, Azonobi IC, Grosse SD, Grant AM, Atrash HK, James AH. Prevention of venous thromboembolism in pregnancy: a review of guidelines, 2000–2011. J Womens Health (Larchmt) 2012;21:611–5. (Level III)
67. Royal College of Obstetricians and Gynaecologists. Reducing the risk of venous thromboembolism during pregnancy and the puerperium. Green Top Guideline No. 37a. London (UK): RCOG; 2015. (Level III)
68. D’Alton ME, Friedman AM, Smiley RM, Montgomery DM, Paidas MJ, D’Oria R, et al. National Partnership for Maternal Safety: consensus bundle on venous thromboembolism. Obstet Gynecol 2016;128:688–98. (Level III)
69. Sibai BM, Rouse DJ. Pharmacologic thromboprophylaxis in obstetrics: broader use demands better data [commentary]. Obstet Gynecol 2016;128:681–4. (Level III)
70. Bain E, Wilson A, Tooher R, Gates S, Davis LJ, Middleton P. Prophylaxis for venous thromboembolic disease in pregnancy and the early postnatal period. Cochrane Database of Systematic Reviews 2014, Issue 2. Art. No.: CD001689. (Systematic Review)
71. Chan WS, Lee A, Spencer FA, Crowther M, Rodger M, Ramsay T, et al. Predicting deep venous thrombosis in pregnancy: out in “LEFt” field? [published erratum appears in Ann Intern Med 2009;151:516]. Ann Intern Med 2009;151:85–92. (Level II-3)
72. Nijkeuter M, Ginsberg JS, Huisman MV. Diagnosis of deep vein thrombosis and pulmonary embolism in pregnancy: a systematic review. J Thromb Haemost 2006;4: 496–500. (Systematic Review)
73. Bates SM, Jaeschke R, Stevens SM, Goodacre S, Wells PS, Stevenson MD, et al. Diagnosis of DVT: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2012;141: e351S–418S. (Level III)
74. Kovac M, Mikovic Z, Rakicevic L, Srzentic S, Mandic V, Djordjevic V, et al. The use of D-dimer with new cutoff can be useful in diagnosis of venous thromboembolism in pregnancy. Eur J Obstet Gynecol Reprod Biol 2010;148: 27–30. (Level III)
75. To MS, Hunt BJ, Nelson-Piercy C. A negative D-dimer does not exclude venous thromboembolism (VTE) in pregnancy. J Obstet Gynaecol 2008;28:222–3. (Level III)
76. Damodaram M, Kaladindi M, Luckit J, Yoong W. Ddimers as a screening test for venous thromboembolism in pregnancy: is it of any use? J Obstet Gynaecol 2009;29: 101–3. (Level III)
77. Leung AN, Bull TM, Jaeschke R, Lockwood CJ, Boiselle PM, Hurwitz LM, et al. American Thoracic Society documents: an official American Thoracic Society/Society of Thoracic Radiology Clinical Practice Guideline– evaluation of suspected pulmonary embolism in pregnancy. ATS/STR Committee on Pulmonary Embolism in Pregnancy. Radiology 2012;262:635–46. (Level III)
78. Van der Pol LM, Mairuhu ATA, Tromeur C, Couturaud F, Huisman MV, Klok FA. Use of clinical prediction rules and D-dimer tests in the diagnostic management of pregnant patients with suspected acute pulmonary embolism. Blood Rev 2017;31:31–6. (Systematic Review)
79. Chunilal SD, Bates SM. Venous thromboembolism in pregnancy: diagnosis, management and prevention. Thromb Haemost 2009;101:428–38. (Level III)
80. van Mens TE, Scheres LJ, de Jong PG, Leeflang MM, Nijkeuter M, Middeldorp S. Imaging for the exclusion of pulmonary embolism in pregnancy. Cochrane Database of Systematic Reviews 2017, Issue 1. Art. No.: CD011053. (Systematic Review)
81. Brill-Edwards P, Ginsberg JS, Gent M, Hirsh J, Burrows R, Kearon C, et al. Safety of withholding heparin in pregnant women with a history of venous thromboembolism. Recurrence of Clot in This Pregnancy Study Group. N Engl J Med 2000;343:1439–44. (Level II-2)
82. Lee AY, Levine MN, Baker RI, Bowden C, Kakkar AK, Prins M, et al. Low-molecular-weight heparin versus a coumarin for the prevention of recurrent venous thromboembolism in patients with cancer. Randomized Comparison of Low-Molecular-Weight Heparin versus Oral Anticoagulant Therapy for the Prevention of Recurrent Venous Thromboembolism in Patients with Cancer (CLOT) Investigators. N Engl J Med 2003;349:146–53. (Level I)
83. McLintock C, Brighton T, Chunilal S, Dekker G, McDonnell N, McRae S, et al. Recommendations for the diagnosis and treatment of deep venous thrombosis and pulmonary embolism in pregnancy and the postpartum period. Councils of the Society of Obstetric Medicine of Australia and New Zealand, Australasian Society of Thrombosis and Haemostasis. Aust N Z J Obstet Gynaecol 2012;52:14–22. (Level III)
84. Chan W, Rey E, Kent NE, Chan W, Kent NE, Rey E, et al. Venous thromboembolism and antithrombotic therapy in pregnancy. VTE in Pregnancy Guideline Working Group, Society of Obstetricians and Gynecologists of Canada. J Obstet Gynaecol Can 2014;36:527–53. (Level III)
85. Voke J, Keidan J, Pavord S, Spencer NH, Hunt BJ. The management of antenatal venous thromboembolism in the UK and Ireland: a prospective multicentre observational survey. British Society for Haematology Obstetric Haematology Group. Br J Haematol 2007;139:545–58. (Level III)
86. Ni Ainle F, Wong A, Appleby N, Byrne B, Regan C, Hassan T, et al. Efficacy and safety of once daily low molecular weight heparin (tinzaparin sodium) in high risk pregnancy. Blood Coagul Fibrinolysis 2008;19:689–92. (Level III)
87. Hunt BJ, Doughty HA, Majumdar G, Copplestone A, Kerslake S, Buchanan N, et al. Thromboprophylaxis with low molecular weight heparin (Fragmin) in high risk pregnancies. Thromb Haemost 1997;77:39–43. (Level II-2)
88. Barbour LA, Smith JM, Marlar RA. Heparin levels to guide thromboembolism prophylaxis during pregnancy. Am J Obstet Gynecol 1995;173:1869–73. (Level III)
89. Ensom MH, Stephenson MD. Pharmacokinetics of low molecular weight heparin and unfractionated heparin in pregnancy. J Soc Gynecol Investig 2004;11:377–83. (Level I)
90. Linkins LA, Dans AL, Moores LK, Bona R, Davidson BL, Schulman S, et al. Treatment and prevention of heparin-induced thrombocytopenia: antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines [published erratum appears in Chest 2015; 148:1529]. Chest 2012;141: e495S–530S. (Level III)
91. Sagaram D, Siddiq Z, Eisenberger AB, Ananth CV, Wright JD, D’Alton ME, et al. Heparin-induced thrombocytopenia during obstetric hospital admissions [preprint]. Am J Perinatol 2018. DOI: 10.1055/s-0038-1627096. (Level II-2)
92. Widmer M, Blum J, Hofmeyr GJ, Carroli G, AbdelAleem H, Lumbiganon P, et al. Misoprostol as an adjunct to standard uterotonics for treatment of post-partum haemorrhage: a multicentre, double-blind randomised trial. Lancet 2010;375:1808–13. (Level I)
93. De Carolis S, di Pasquo E, Rossi E, Del Sordo G, Buonomo A, Schiavino D, et al. Fondaparinux in pregnancy: could it be a safe option? A review of the literature. Thromb Res 2015;135:1049–51. (Level III)
94. Crowther MA, Spitzer K, Julian J, Ginsberg J, Johnston M, Crowther R, et al. Pharmacokinetic profile of a lowmolecular weight heparin (reviparin) in pregnant patients. A prospective cohort study. Thromb Res 2000;98:133–8. (Level II-2)
95. Boban A, Paulus S, Lambert C, Hermans C. The value and impact of anti-Xa activity monitoring for prophylactic dose adjustment of low-molecular-weight heparin during pregnancy: a retrospective study. Blood Coagul Fibrinolysis 2017;28:199–204. (Level II-2)
96. Leffert L, Butwick A, Carvalho B, Arendt K, Bates SM, Friedman A, et al. The Society for Obstetric Anesthesia and Perinatology consensus statement on the anesthetic management of pregnant and postpartum women receiving thromboprophylaxis or higher dose anticoagulants. Members of the SOAP VTE Taskforce. Anesth Analg 2018;126:928–44. (Level III)
97. Leffert LR, Dubois HM, Butwick AJ, Carvalho B, Houle TT, Landau R. Neuraxial anesthesia in obstetric patients receiving thromboprophylaxis with unfractionated or lowmolecular-weight heparin: a systematic review of spinal epidural hematoma. Anesth Analg 2017;125:223–31. (Systematic Review)
98. Tepper NK, Boulet SL, Whiteman MK, Monsour M, Marchbanks PA, Hooper WC, et al. Postpartum venous thromboembolism: incidence and risk factors. Obstet Gynecol 2014;123:987–96. (Level II-3)
99. Kamel H, Navi BB, Sriram N, Hovsepian DA, Devereux RB, Elkind MS. Risk of a thrombotic event after the 6-week postpartum period. N Engl J Med 2014;370: 1307–15. (Level II-3)
100. Imberti D, Prisco D. Retrievable vena cava filters: key considerations. Thromb Res 2008;122:442–9. (Level III)
101. Gupta JK, Chien PF, Voit D, Clark TJ, Khan KS. Ultrasonographic endometrial thickness for diagnosing endometrial pathology in women with postmenopausal bleeding: a meta-analysis. Acta Obstet Gynecol Scand 2002;81:799–816. (Meta-analysis)
102. Freedman RA, Bauer KA, Neuberg DS, Zwicker JI. Timing of postpartum enoxaparin administration and severe postpartum hemorrhage. Blood Coagul Fibrinolysis 2008; 19:55–9. (Level II-3)
103. Orme ML, Lewis PJ, de Swiet M, Serlin MJ, Sibeon R, Baty JD, et al. May mothers given warfarin breast-feed their infants? Br Med J 1977;1:1564–5. (Level III)
104. Sachs HC. The transfer of drugs and therapeutics into human breast milk: an update on selected topics. Committee on Drugs. Pediatrics 2013;132:e796–809. (Level III)
105. McKenna R, Cole ER, Vasan U. Is warfarin sodium contraindicated in the lactating mother? J Pediatr 1983;103: 325–7. (Level III)
106. Clark SL, Porter TF, West FG. Coumarin derivatives and breast-feeding. Obstet Gynecol 2000;95:938–40. (Level III)
107. Richter C, Sitzmann J, Lang P, Weitzel H, Huch A, Huch R. Excretion of low molecular weight heparin in human milk. Br J Clin Pharmacol 2001;52:708–10. (Level III)

