'Dùng Thuốc Theo Cá Thể' đối với thuốc điều trị ung thư trong gen dược học

Trungtamthuoc.com - Chương 14: 'Dùng Thuốc Theo Cá Thể' đối với thuốc điều trị ung thư sẽ phân tích được khả năng ứng dụng của gen được trong dùng thuốc theo cá thể đối với các thuốc điều trị ung thư.
Trường Đại học Dược Hà Nội, Bộ môn Hóa Sinh - Khoa Công Nghệ Sinh Học
CHƯƠNG 14, Trang 180-195, Giáo trình GEN DƯỢC HỌC - ẢNH HƯỞNG CỦA GEN ĐẾN ĐÁP ỨNG THUỐC, Tải PDF sách TẠI ĐÂY
CHỦ BIÊN
PGS.TS. Phùng Thanh Hương
PGS.TS. Đỗ Hồng Quảng
CÁC TÁC GIẢ THAM GIA BIÊN SOẠN
PGS.TS. Phùng Thanh Hương
PGS.TS. Đỗ Hồng Quảng
PGS.TS. Nguyễn Văn Rư
PGS.TS. Nguyễn Thị Lập
TS. Nguyễn Quốc Bình
Trong lĩnh vực điều trị ung thư, một trong những khó khăn lớn nhất khi hướng tới mục tiêu kéo dài và cải thiện chất lượng cuộc sống cho bệnh nhân là vấn đề hiệu quả và độc tính của thuốc. Phần lớn các thuốc ung thư chỉ có hiệu quả đối với một nhóm nhỏ bệnh nhân, tỷ lệ đáp ứng trung bình của thuốc ung thư là 25%. Mặt khác, đây đều là những thuốc có phạm vi điều trị hẹp, độc tính cao, do đó, luôn đi kèm với nguy cơ tai biến nghiêm trọng, làm suy giảm chất lượng cuộc sống của người bệnh và có thể gây tử vong. Thực tế đó đặt ra nhu cầu cấp thiết phải có các chiến lược điều trị mới giúp cải thiện hiệu quả điều trị và giảm thiểu độc tính. Một trong những chiến lược đang trở thành một xu hướng mới trên thế giới là dùng thuốc theo cá thể hay cá thể hóa điều trị.
Theo định nghĩa của Viện Ung thư Hoa Kỳ, thuốc cá thể hóa là “Thuốc sử dụng thông tin của cá nhân về gen, protein và môi trường để phòng, chẩn đoán và điều trị một bệnh”. Mục đích của cá thể hóa điều trị là đưa ra những phác đồ trị liệu phù hợp với đặc điểm của từng cá thể bệnh nhân nhằm đạt được đáp ứng điều trị tốt nhất. Không phải ngẫu nhiên mà khái niệm Y học chính xác (Precision Medicines) được đồng nhất với khái niệm Y học cá thể hóa (Personalized Medicines) trong điều trị ung thư. Cơ sở của cá thể hóa điều trị chính là dựa trên những chỉ dấu sinh học đặc trưng cho phép dự đoán đáp ứng với thuốc của từng bệnh nhân. Một ý nghĩa quan trọng của cá thể hóa trong điều trị ung thư chính là việc cung cấp những chỉ dấu sinh học cho phép dự đoán đáp ứng và lựa chọn các thuốc hướng đích, một trong những chiến lược điều trị ung thư tiên tiến và hiệu quả hiện nay.
1 Các chỉ dấu sinh học giúp dự đoán đáp ứng điều trị ung thư
Chỉ dấu sinh học (biomarker) được định nghĩa là một đặc tính ở mức độ tế bào hoặc phân tử giúp đo lường và đánh giá một quá trình sinh học bình thường của cơ thể hoặc một quá trình bệnh lý hoặc đáp ứng được học với các can thiệp điều trị. Trong điều trị ung thư, chỉ dấu sinh học được ứng dụng trong nhiều khâu khác nhau bao gồm: Sàng lọc, chẩn đoán sớm, theo dõi tiên lượng bệnh và dự đoán đáp ứng điều trị. Trong số đó, các chỉ dấu sinh học dự đoán (predictive biomarker) chính là cơ sở của cá thể hóa trong điều trị ung thư. Các chỉ dấu sinh học dự đoán được nghiên cứu và ứng dụng trong điều trị ung thư có thể rất đa dạng, từ đặc điểm về số lượng tiểu cầu, tỷ số tiểu cầu/ bạch cầu đa nhân trung tính đến mật độ, số lượng các vi túi ngoại bào (extracellular microvesicle) lưu hành trong máu và phổ biến nhất là các chỉ dấu protein và ADN. Các chỉ dấu này giúp tiên lượng được người bệnh có đáp ứng tốt hay không tốt với một phác đồ điều trị từ đó có thể quyết định nên dùng phác đồ nào, với liều thích hợp như thế nào để người bệnh có thể thu được những lợi ích tốt nhất từ điều trị và đồng thời không phải chịu các tác dụng không mong muốn nặng nề của thuốc.
Khác với nhiều bệnh khác, chỉ dấu sinh học dự đoán đáp ứng thuốc trong điều trị ung thư có thể có hai nguồn gốc: Từ tế bào mầm - germline cells (tế bào bình thường mà người bệnh mang từ lúc sinh ra, có thể di truyền sang thế hệ sau) và từ tế bào ung thư (đã có những biến đổi so với tế bào bình thường ban đầu - somatic mutation).
Các chỉ dấu sinh học dự đoán đáp ứng thuốc có nguồn gốc tế bào mầm thường liên quan chủ yếu đến các quá trình dược động học của thuốc và thường giúp dự đoán độc tính của thuốc. Bên cạnh đó, một số chỉ dấu loại này có thể giúp dự đoán hiệu quả điều trị, đặc biệt đối với các dược chất là tiền thuốc, bắt buộc phải qua chuyển hóa pha I để trở thành dạng có hoạt tính. Bên cạnh các gen mã hóa enzym chuyển hóa thuốc, sự đa hình của các gen mã hóa protein vận chuyển đóng vai trò quan trọng trong các quá trình hấp thu, phân bố, thải trừ thuốc cũng có thể ảnh hưởng đến đáp ứng điều trị ung thư.
Các chỉ dấu sinh học dự đoán đáp ứng thuốc có nguồn gốc tế bào ung thư còn được gọi là chỉ dấu sinh học dược lực học. Phần lớn các chỉ dấu sinh học này đều liên quan đến những thay đổi đặc trưng cho khối u, hay nói cách khác, đều có nguồn gốc từ tế bào ung thư. Điều này phản ánh thực tế là mức độ nhạy cảm với một thuốc điều trị ung thư chịu ảnh hưởng đáng kể bởi những khác biệt về protein đích của thuốc hoặc các protein liên có mặt ở tế bào ung thư. Các thuốc gắn liền với loại chỉ dấu sinh học này thường là các thuốc hướng đích phân tử, một nhóm quan trọng hàng đầu trong trị liệu ung thư. Bằng việc tác động vào đích phân tử trên tế bào ung thư, các thuốc này ngăn chặn con đường truyền tín hiệu tăng sinh và do đó ngăn chặn sự phát triển của khối u. Chỉ dấu sinh học về dược lực học của thuốc không chỉ bao gồm sự biến đổi của các gen mã hóa cho protein đích, mà còn bao gồm sự biến đổi của gen mã hóa cho một số protein gián tiếp tham gia vào quá trình truyền tín hiệu để đích phát huy tác dụng.
2 Ứng dụng trong lâm sàng của các chỉ dấu sinh học dự đoán đáp ứng thuốc
Cho đến nay, khoảng 50% số thuốc ung thư đã được lưu hành có thông tin về chỉ dấu sinh học dự đoán kèm theo. Một số tổ chức như Ủy ban Thực hành gen dược, Ủy ban Gen dược Hà Lan, Trung tâm Ung thư quốc gia Hoa Kỳ đã ban hành nhiều hướng dẫn điều trị dựa trên các chỉ dấu sinh học này. Một số tổ chức khác như Trung tâm Ngăn ngừa và Kiểm soát bệnh tật (CDC) cũng đưa ra những khuyến cáo về ứng dụng, độ tin cậy của nhiều xét nghiệm di truyền trong thực hành lâm sàng. Cơ quan Dược phẩm và Thực phẩm Hoa Kỳ (FDA) và Cơ quan Dược phẩm châu u (EMA) đã đưa ra khuyến cáo về thông tin trên nhãn thuốc liên quan tới kiểu gen bệnh nhân. Trong số 155 loại nhãn thuốc mà FDA khuyến cáo về bổ sung thông tin kiểu gen, có 52 nhãn thuốc (của 41 thuốc) liên quan đến điều trị ung thư. Những thông tin nói trên cho thấy dùng thuốc theo cá thể điều trị ung thư là lĩnh vực phát triển nhanh nhất trong các lĩnh vực điều trị.
| Bảng 14.1. Một số thuốc hướng đích kèm theo chỉ dấu sinh học được FDA phê duyệt | |||
| Phân tử đích | Thuốc | Loại ung thư | Các đột biến gen được dùng làm biomarker |
| ALK (Anaplastic lymphoma kinase) |
Alectinib Brigatinib Ceritinib |
Ung thư phổi không tế bào nhỏ | Đột biến ALK |
| ALK, MET (mesenchymal- epithelial transition), ROSI (round spermatid nuclei into non- n-fertilized mouse oocytes) | Crizotinib | Ung thư phổi không tế bào nhỏ | Đột biến chuyển đoạn ALK hoặc ROSI |
| BCR (breakpoint cluster region) -ABL1 (Abelson murine leukemia viral oncogene homolog 1) |
Bosutinib Dasatinib Imatinib Nilotinib Ponatinib |
Bạch cầu tủy mạn | Đột biến chuyển đoạn BCR-ABL1 |
| BRAF (v-Raf murine sarcoma viral oncogene homolog B) |
Dubrafenib Trametinib |
Ung thư phổi không tế bào nhỏ, u sắc tố, ung thư giáp | BRAF V600K |
|
MEK (Mitogen-activated protein kinase kinase) |
|||
| PDGFR (Platelet-derived growth factor receptors) | Imatinib | Ung thư tủy | PDGFR |
| VEGF (Vascular endothelial growth factor) | Bevacizumab | Ung thư phổi không tế bào nhỏ, đại trực tràng, cổ tử cung, biểu mô buồng trứng, vòi trứng, tế bào thận | VEGF |
Ngay tại Việt Nam, nơi mà ứng dụng cá thể hóa điều trị vẫn còn ở những bước đi đầu tiên, một số chỉ dấu sinh học dự đoán đáp ứng thuốc đã được đưa vào điều trị ung thư để lựa chọn những bệnh nhân có đáp ứng tốt với hiệu quả điều trị cao và giảm thiểu tác dụng không mong muốn.
Dưới đây là ứng dụng của cá thể hóa điều trị trong một số loại ung thư phổ biến nhất.
3 Cá thể hóa trong điều trị ung thư phổi
Mỗi năm thế giới có khoảng trên 1,6 triệu ca mắc mới ung thư phổi, trong đó, khoảng 85% là ung thư phổi không tế bào nhỏ, loại ung thư tiến triển nhanh và thường có tiên lượng sống thấp. Một trong những giải pháp quan trọng để tăng hiệu quả trong điều trị ung thư phổi không tế bào nhỏ là điều trị hướng đích, với đích phân tử được biết đến nhiều nhất là thụ thể yếu tố tăng trưởng biểu bì (epidermal growth factor receptor - EGFR).
EGFR là một thụ thể trên màng tế bào, khi gắn với receptor đặc hiệu, sẽ khởi động chuỗi truyền tín hiệu nội bào dẫn đến sự tăng trưởng tế bào. Những đột biến gen EGFR được coi là đột biến gây ung thư (oncogene) do dẫn tới sự tăng biểu hiện và tăng hoạt động của thụ thể EGFR chính là một cơ chế bệnh sinh quan trọng dẫn tới tăng sinh tế bào, tạo thành khối u. Do đó, thụ thể EGFR là một protein đích quan trọng trong điều trị ung thư, với nhóm thuốc hướng đích ức chế tyrosin kinase TKI (tyrosin kinase inhibitor), giúp ức chế chuỗi truyền tín hiệu tăng sinh tế bào. Các nghiên cứu cho thấy khoảng 15% bệnh nhân ung thư phổi không tế bào nhỏ ở châu u và khoảng 30 - 50% ở châu Á có mang đột biến gen EGFR dạng hoạt hóa, làm tăng nhạy cảm của khối u với các thuốc TKI. Ngược lại, cũng có những loại đột biến gen EGFR dẫn đến tình trạng kháng thuốc TKI, mặc dù xuất hiện với tần suất nhỏ hơn các đột biến dạng hoạt hóa. Nhiều nghiên cứu đã chứng minh có sự khác biệt về đáp ứng thuốc giữa các bệnh nhân mang các kiểu gen EGFR khác nhau. Một tổng quan của Riely dựa trên một loạt các nghiên cứu hồi cứu cho thấy bệnh nhân có các đột biến hoạt hóa của gen EGFR đáp ứng tốt hơn với thuốc TKI so với nhóm bệnh nhân có kiểu gen EGFR bình thường. Kết quả của một thử nghiệm lâm sàng pha III cũng khẳng định bệnh nhân ung thư phổi không tế bào nhỏ giai đoạn muộn mang đột biến hoạt hóa gen EGFR khi được điều trị với các thuốc TKI (erlotinib hoặc gefitinib) có thể trì hoãn tiến triển bệnh và cải thiện chất lượng sống tốt hơn so với hóa trị. Chính vì vậy, đột biến gen EGFR được coi là một chỉ dấu sinh học quan trọng đối với việc điều trị ung thư phổi, đặc biệt ở châu Á, nơi có tần suất đột biến gen EGFR cao. Hiện nay, xét nghiệm gen EGFR đã được khuyến cáo bởi nhiều tổ chức quốc tế. Mạng lưới giáo dục về ung thư quốc gia Mỹ, Hiệp hội Ung thư lâm sàng châu u đều khuyến cáo xét nghiệm EGFR nên được làm thường quy ở bệnh nhân ung thư phổi không tế bào nhỏ tiến triển hoặc di căn có kiểu mô học dạng tuyến trước khi quyết định lựa chọn phác đồ điều trị. Tại Việt Nam, theo Thông tư số 40 của Bảo hiểm Y tế Việt Nam và Thông tư số 30/2018/TT-BYT, bệnh nhân ung thư phổi không tế bào nhỏ sẽ được chi trả 50% khi sử dụng các thuốc Erlotinib hoặc gefitinib có xét nghiệm đột biến EGFR hoạt hóa.
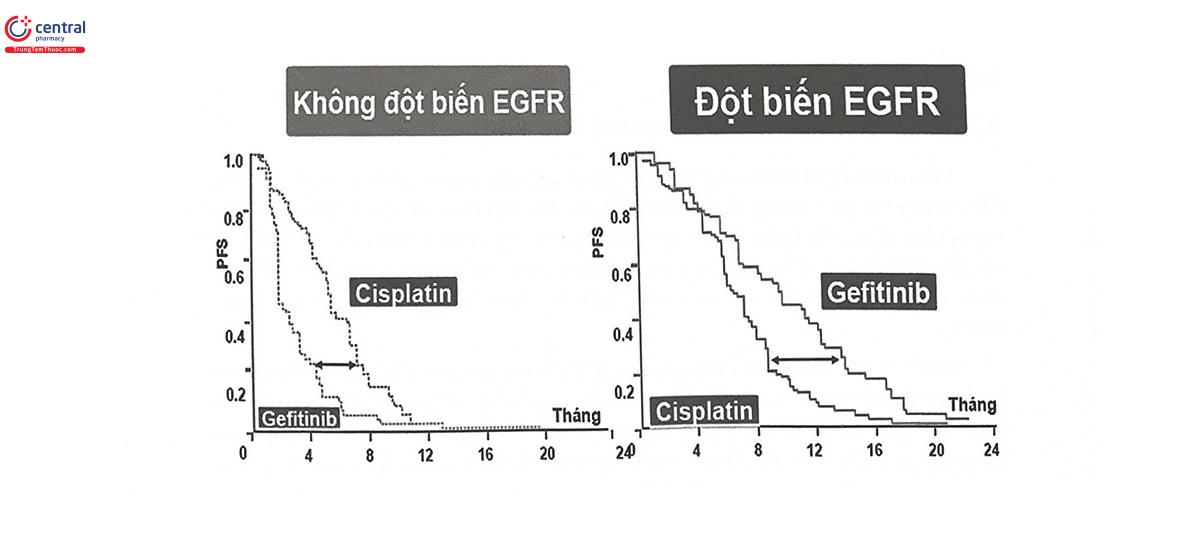
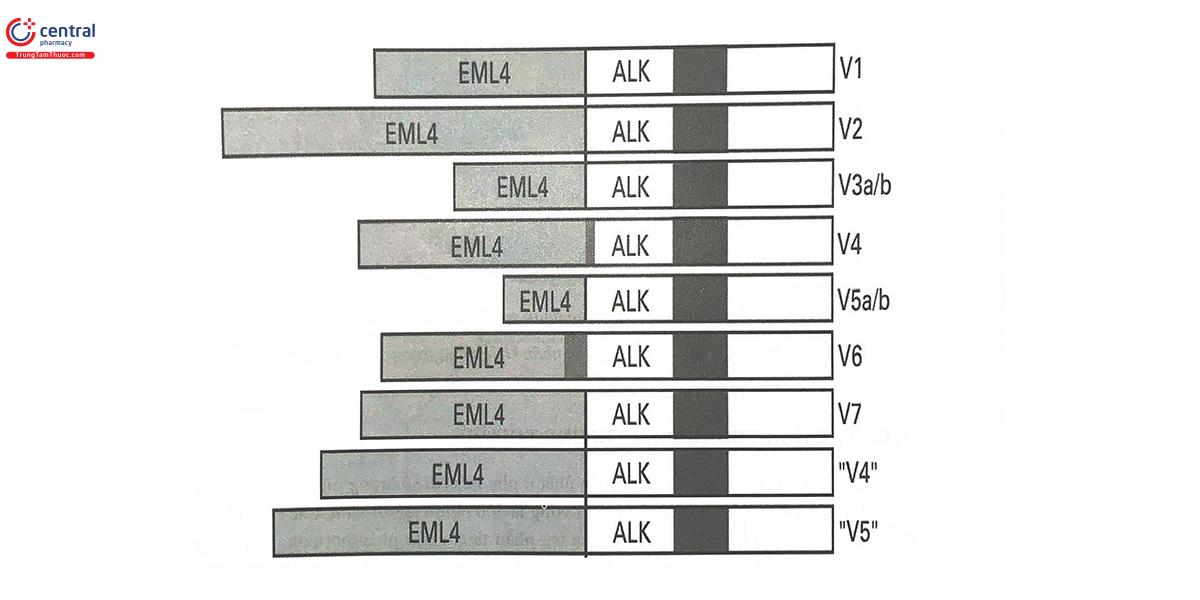
Trong ung thư phổi không tế bào nhỏ tiến triển, không có tế bào vảy, một nhóm thuốc hướng đích mới ra đời nhưng đã có những đóng góp quan trọng về hiệu quả điều trị là các chất ức chế ALK-TKI (anaplastic lymphoma kinase - tyrosin kinase inhibitor), với đại diện điển hình là crizotinib. ALK bình thường chỉ là một receptor loại tyrosin kinase biểu hiện chủ yếu ở tế bào thần kinh, đóng vai trò đối với sự phát triển của hệ thần kinh. Đột biến chuyển đoạn nhỏ xảy ra với gen ALK trên nhiễm sắc thể số 2 thường dẫn đến tạo thành phức hợp với gen echinoderm microtubule-associated protein-like 4 (EML4). Cho đến nay, người ta đã biết đến hơn 20 loại đột biến EML4-ALK (Hình 14.2).
Kết quả của đột biến là làm thay đổi biểu hiện gen, dẫn đến hoạt hóa liên tục ALK kinase và các protein hạ nguồn của nó, gây tăng sinh tế bào không kiểm soát được. Khoảng 4% bệnh nhân ung thư phổi không tế bào nhỏ mang đột biến này, nghĩa là khoảng 40.000 ca mắc mới mỗi năm trên toàn thế giới. Phát hiện về đột biến gây ung thư EML4-ALK đã dẫn đến sự ra đời của crizotinib, chất ức chế hoạt tính tyrosin kinase của ALK. Hiện nay, crizotinib đã được dùng phổ biến ở nhiều nước, cho những bệnh nhân ung thư phổi không tế bào nhỏ dương tính với xét nghiệm tìm đột biến ALK. Tuy nhiên, cũng có một tỷ lệ nhất định bệnh nhân này kháng với crizotinib. Các nguyên nhân được tìm thấy chủ yếu liên quan đến các đột biến khác của gen ALK hoặc bệnh nhân đồng thời mang đột biến EGFR (Hình 14.3).
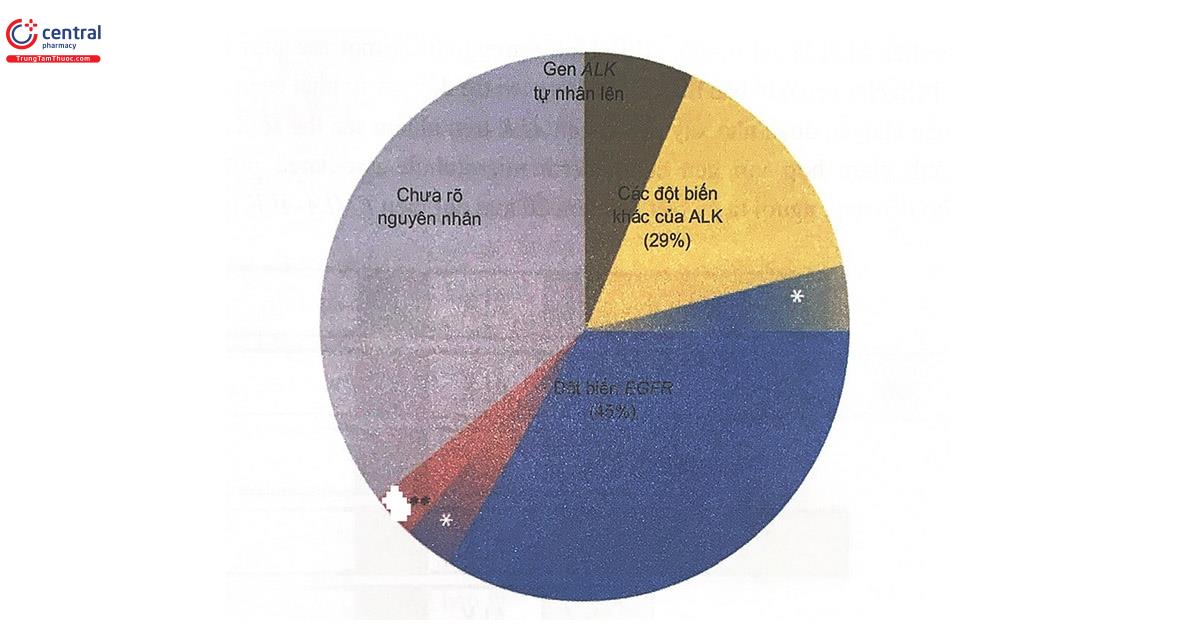
(*): Sự kết hợp nhiều nguyên nhân khác nhau trong 1 bệnh nhân
(**): Đột biến gen khác
4 Cá thể hóa trong điều trị ung thư vú
Ung thư vú là loại ung thư phổ biến nhất ở phụ nữ, với số lượng mắc mới ước tính trung bình là 1,6 triệu người/năm, tỷ lệ tử vong là 500 nghìn người/năm. Các chiến lược điều trị ung thư vú bao gồm: Hóa trị, xạ trị, phẫu thuật, liệu pháp hormon, liệu pháp hướng đích và liệu pháp miễn dịch, trong số đó, nhiều liệu pháp đã được áp dụng gen dược để cá thể hóa điều trị, góp phần cải thiện hiệu quả điều trị, kéo dài thời gian sống cho người bệnh.
Tamoxifen là một chất kháng estrogen chọn lọc được sử dụng để điều trị ung thư vú di căn trên những phụ nữ tiền mãn kinh và sau mãn kinh. Tamoxifen được coi là một tiền thuốc bởi thông qua chuyển hóa ở gan bởi enzym CYP2D6, nó chuyển thành 4 hydroxytamoxifen và endoxifen, với hoạt tính kháng estrogen cao hơn hàng chục lần so với tamoxifen. Do đó, về lý thuyết, tác dụng của tamoxifen trên những bệnh nhân mang kiểu hình CYP2D6 chuyển hóa kém sẽ giảm đi do giảm sự tạo thành endoxifen và 4-hydroxytamoxifen. Gen CYP2D6 có tính đa hình di truyền cao. Đã có hơn 71 kiểu alen khác nhau của gen CYP2D6 được miêu tả, trong đó có những alen gây giảm hoặc mất hẳn hoạt tính của enzym CYP2D6, ví dụ như CYP2D6*4, CYP2D6*5, CYP2D6*6, CYP2D6*10.... Một số thử nghiệm lâm sàng đã được tiến hành để đánh giá ảnh hưởng của sự đa hình gen CYP2D6 và tác dụng của tamoxifen trên lâm sàng. Trong một thử nghiệm lâm sàng ngẫu nhiên pha III trên những bệnh nhân ung thư vú sau mãn kinh có ER+, kết quả cho thấy khi điều trị với tamoxifen, những bệnh nhân mang CYP2D6 kiểu hình chuyển hóa trung bình hoặc kém có thời gian sống thêm (không tiến triển bệnh) ngắn hơn so với những bệnh nhân mang kiểu hình bình thường.
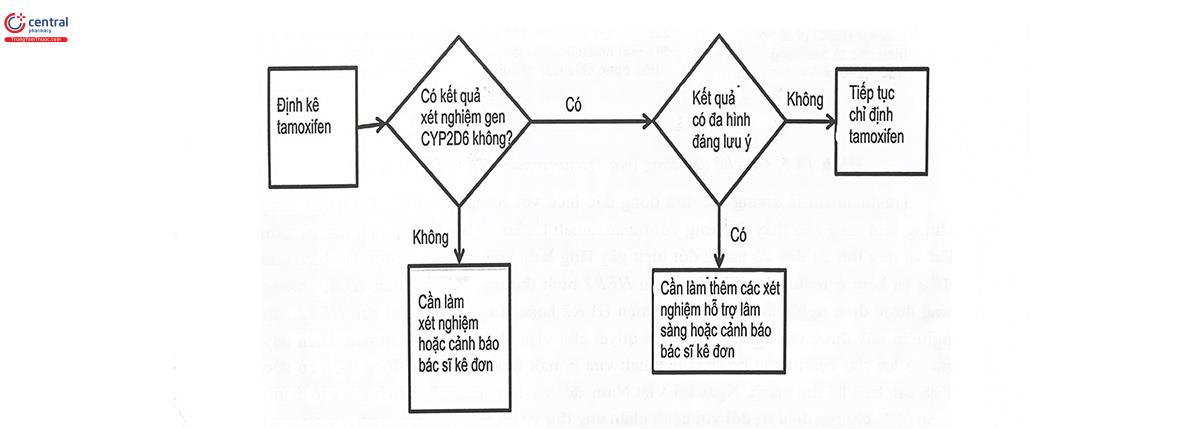
Từ những kết quả đó, Ủy ban Gen dược Hà Lan (Dutch Pharmacogenetics Working Group) đã đưa ra khuyến cáo điều trị đối với tamoxifen, theo đó, những người mang kiêu gen tương ứng với kiểu hình giảm chuyển hóa của CYP2D6 có nguy cơ tái phát cao khi dùng tamoxifen, cần tránh dùng đồng thời với các chất ức chế CYP2D6, đối với bệnh nhân sau mãn kinh, nên cân nhắc thay thế bằng các thuốc ức chế aromatase. CPIC cũng đưa ra khuyến cáo tương tự và đưa ra quy trình lâm sàng liên quan đến xét nghiệm CYP2D6 và chỉ định tamoxifen (Hình 14.4).
Một ví dụ kinh điển về cá thể hóa trong điều trị ung thư vú là vai trò của Human epidermal growth factor receptor 2 (HER2) trong sử dụng trastuzumab. HER2 thuộc họ receptor của yếu tố tăng trưởng tyrosin kinase typ 1, đóng vai trò quan trọng trong sự biệt hóa và tăng sinh của tế bào. Khoảng 25 - 30% các ca ung thư vú và 20% các ca ung thư dạ dày - thực quản có sự tăng biểu hiện HER2, 90% trong số đó có nguyên nhân từ đột biến gen HER2. Nhiều nghiên cứu đã chứng minh sự tăng biểu hiện HER2 đi kèm với tiên lượng xấu như tăng kích thước u, có hạch bạch huyết, giảm thời gian sống không bệnh và thời gian sống thêm toàn bộ.

Trastuzumab là kháng thể đơn dòng đặc hiệu với receptor HER2. Có nhiều bằng chứng lâm sàng cho thấy đáp ứng với trastuzumab tốt hơn ở bệnh nhân ung thư vú xâm lấn và ung thư dạ dày có mang đột biến gây tăng biểu hiện HER2, ngược lại, hiệu quả điều trị kém ở những người mang gen HER2 bình thường. Xét nghiệm HER2 dương tính được định nghĩa là có tăng biểu hiện HER2 hoặc tăng khuếch đại gen HER2, xét nghiệm này được coi là điều kiện tiên quyết cho việc chỉ định trastuzumab. Điều này rất có lợi cho bệnh nhân bởi trastuzumab vừa là một thuốc đắt tiền, đồng thời, có độc tính cao trên hệ tim mạch. Ngay tại Việt Nam, đối với trastuzumab, bảo hiểm y tế thanh toán 60% chi phí điều trị đối với bệnh nhân ung thư vú có HER2 dương tính; thanh toán 50% đối với bệnh nhân ung thư dạ dày tiến triển hoặc di căn có HER2 dương tính.
5 Cá thể hóa trong điều trị ung thư đại trực tràng
Ung thư đại trực tràng là một trong những loại ung thư phổ biến nhất và có tỷ lệ tử vong cao nhất. Hiện nay, các chiến lược chính trong điều trị ung thư đại trực tràng bao gồm phẫu thuật, xạ trị, hóa trị liệu và dùng thuốc hướng đích. Trong đó, cá thể hóa trong dùng thuốc được ứng dụng trong lâm sàng với cả hóa trị liệu và thuốc hướng đích.
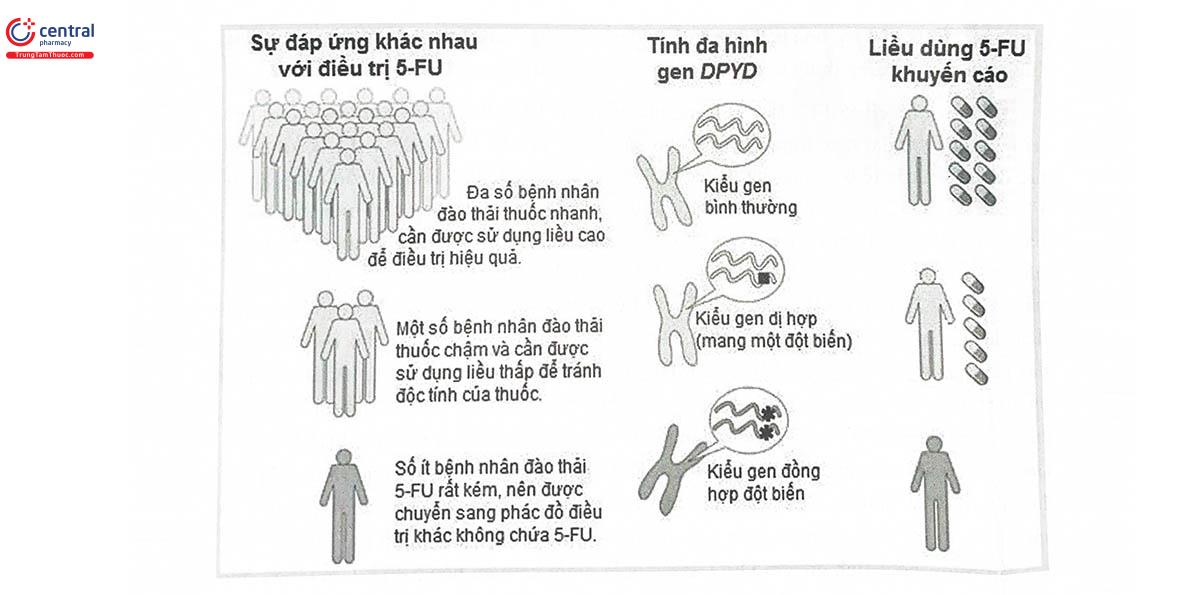
5-fluorouracil (5-FU) là một trong những thuốc hàng đầu được sử dụng trong hóa trị liệu ung thư đại trực tràng. Giống như các thuốc hóa trị liệu khác, 5-FU không chỉ tác động đến các tế bào ung thư mà còn tác động đến các tế bào lành, do đó nồng độ 5- FU cao có thể gây độc cho cơ thể. Các tác dụng không mong muốn phổ biến của 5-FU bao gồm viêm loét đường tiêu hóa, khó thở, rụng tóc, giảm bạch cầu làm tăng nguy cơ nhiễm trùng, giảm tiểu cầu dẫn đến xuất huyết, có thể khiến bệnh nhân phải dừng điều trị với 5-FU. Trong cơ thể, enzym có vai trò chuyển hóa 5-FU là dihydropyrimidine dehydrogenase (DPD), có nhiều nhất trong gan. Một số nghiên cứu cho thấy, enzym này giáng hóa 80% lượng 5-FU khi sử dụng ở liều tiêu chuẩn trong các phác đồ điều trị ung thư. Cho đến nay, người ta đã phát hiện hơn 50 loại biến thể của gen mã hóa cho enzym này (gen DPYD). Trong đó, đáng chú ý nhất là đột biến ở intron 14 (IVS 14 +1 G> A), với alen tương ứng là DPYD*24. Đột biến này xảy ra trên vùng ranh giới của đoạn exon 14 và intron 14, kết quả tạo ra protein mất chức năng. Khoảng 3 - 5% dân số nói chung được phát hiện có kiểu gen dị hợp tử (mang một alen biến thể DPYD*24), dẫn đến giảm hoạt tính enzym DPD, kết quả là giảm chuyển hóa 5-FU, làm tăng nồng độ thuốc trong máu. Những người mang kiểu gen này sẽ tăng nguy cơ gặp các tác dụng không mong muốn nghiêm trọng của 5-FU. Từ thực tế đó, Ủy ban Thực hành gen dược trong lâm sàng (Clinical Pharmacogenetics Implementation Consortium - CPIC) đã khuyến cáo xét nghiệm đa hình gen DPYD cho các bệnh nhân ung thư trước khi chỉ định phác đồ chứa 5-FU. Những bệnh nhân mang kiểu gen dị hợp nên được điều trị bằng 5-FU với liều khởi đầu thấp hơn ít nhất 50% so với liều khởi đầu tiêu chuẩn, trong khi đó những người mang kiểu gen đồng hợp đa hình nên được chuyển sang các phác đồ điều trị khác không có 5-FU (Hình 14.6).
Irinotecan, một chất ức chế topoisomerase I, được sử dụng rộng rãi trong các phác đồ phối hợp để điều trị ung thư đại trực tràng giai đoạn muộn. Tuy nhiên, Irinotecan thường có các tác dụng không mong muốn như giảm bạch cầu nghiêm trọng hoặc gây tiêu chảy. Một trong những enzym quan trọng giúp bất hoạt và thải trừ irinotecan là enzym chuyển hóa pha 2 UDP-glucuronosyltransferase (UGT), mã hóa bởi gen UGT1A1. Nhiều nghiên cứu cho thấy nguy cơ độc tính khi dùng irinotecan tăng lên ở người mang biến thể gen gây giảm hoạt tính UGT, đặc biệt là alen biến thể UGT1A1*28. FDA yêu cầu nhãn thuốc irinotecan phải ghi rõ: “Khi dùng đơn trị liệu, cần cân nhắc giảm liều irinotecan hydrochlorid ở bệnh nhân có kiểu gen đồng hợp tử UGT1A1*28. Tuy nhiên, việc điều chỉnh liều tiếp theo cần xem xét dựa trên đáp ứng của từng bệnh nhân”. Trong khi đó, Ủy ban Gen dược Hà Lan (Dutch Pharmacogenetics Working Group) khuyến cáo giảm 70% liều khởi đầu ở bệnh nhân có kiểu gen đồng hợp tử UGT1A1*28. Mặt khác, mạng lưới Gen dược Pháp (RNPGx) đưa ra một bảng hướng dẫn điều chỉnh liều irinotecan dựa trên kiểu gen UGT1A1 (Bảng 14.2).
| Bảng 14.2. Hướng dẫn điều chỉnh liều irinotecan dựa trên kiểu gen UGT1A1 | |
| Liều Irinotecan | Khuyến cáo |
| Liều thấp (< 180 mg/m2/tuần) |
Sự có mặt alen UGT1A1*28 không phải là yếu tố nguy cơ chính |
| 180 - 130 mg/m2, các chu kỳ cách nhau 2 - 3 tuần | Bệnh nhân có kiểu gen đồng hợp tử UGT1A1*28 có nguy cơ cao gặp các độc tính trên hệ tạo máu và/ hoặc hệ tiêu hóa so với người mang kiểu gen dị hợp tử hoặc wildtype. Khuyến cáo giảm liều 25 - 30% ở người mang kiểu gen đồng hợp tử, đặc biệt ở những người mang thêm các yếu tố nguy cơ khác. Có thể điều chỉnh liều sau mỗi chu kỳ, dựa trên đáp ứng. |
| 240 mg/m2 trở lên, các chu kỳ cách nhau 2 - 3 tuần | Bệnh nhân có kiểu gen đồng hợp tử UGT1A1*28 có nguy cơ cao gặp các độc tính trên hệ tạo máu (giảm bạch cầu) so với người mang kiểu gen dị hợp tử hoặc wildtype. Cần chống chỉ định dùng với liều cao này và cần hội chẩn chọn liều dựa trên các yếu tố nguy cơ liên quan. Chỉ dùng liều cao này ở người mang kiểu gen wildtype hoặc dị hợp tử không mang thêm các yếu tố nguy cơ khác và có lợi ích khi dùng liều cao. |
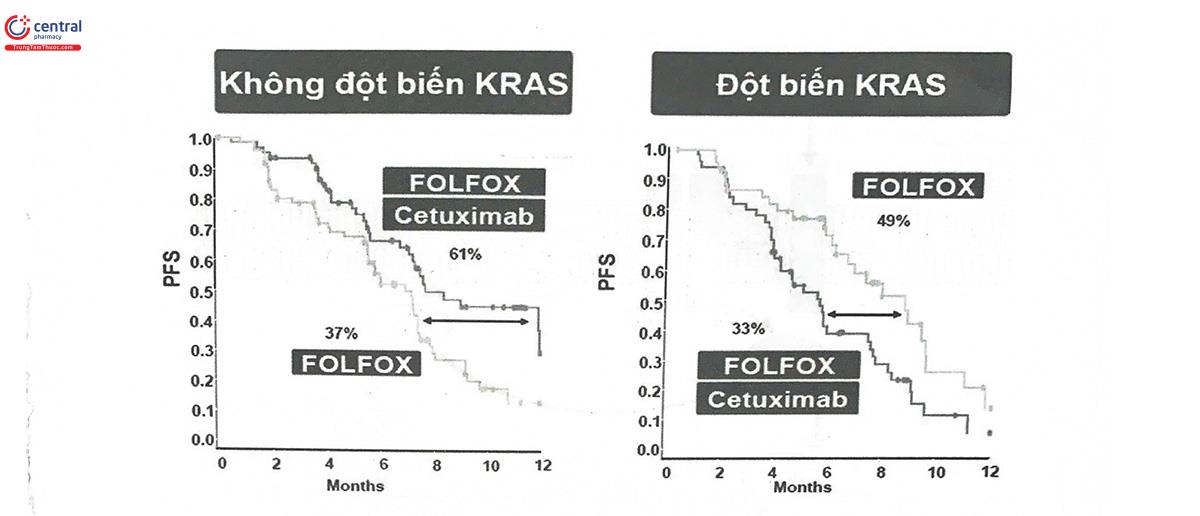
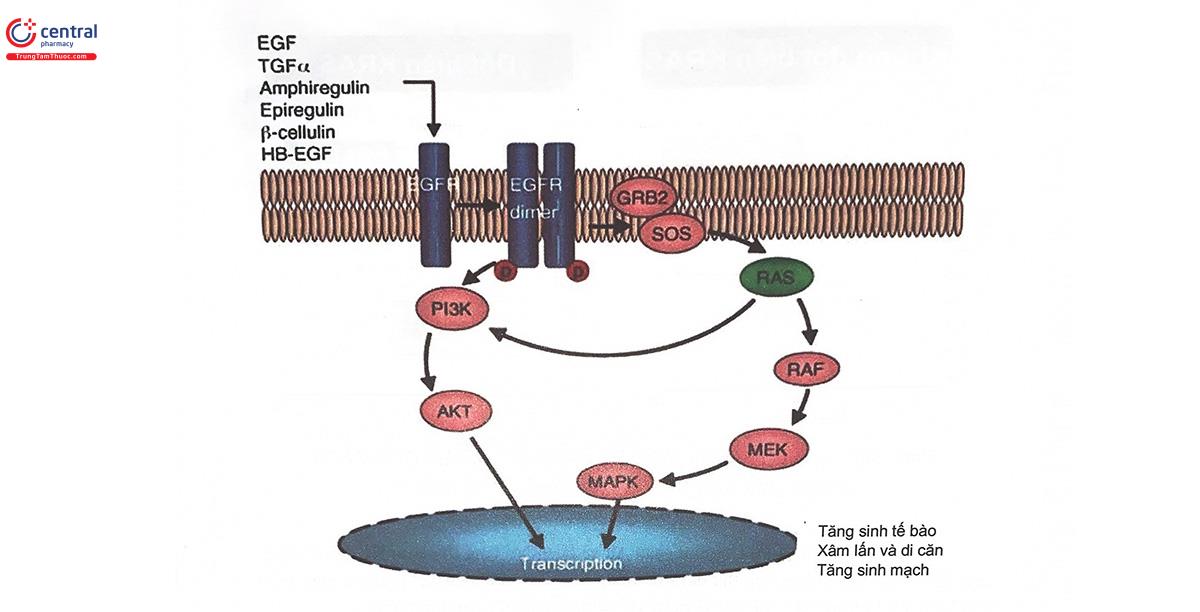
Trong điều trị ung thư đại trực tràng, các thuốc điều trị hướng đích góp phần quan trọng trong hiệu quả điều trị, kéo dài thời gian sống cho người bệnh. Một trong những nhóm thuốc hướng đích được ứng dụng rộng rãi trong điều trị ung thư đại trực tràng là cetuximab và panitumumab, các kháng thể đơn dòng kháng EGFR khiến cho yếu tố tăng trưởng không thế tiếp cận được thụ thể đặc hiệu, từ đó, ngăn chặn được sự tăng sinh khối u. Tuy nhiên, đáp ứng điều trị với cetuximab và panitumumab phụ thuộc rất nhiều vào Kirsten Rat Sarcoma Viral (KRAS) - một protein tham gia vào quá trình truyền tín hiệu xuôi dòng từ thụ thể EGFR. KRAS được gắn vào bên trong màng tế bào và là cầu nối cho các yếu tố hoạt hóa thượng nguồn (tín hiệu từ các yếu tố tăng trưởng) và các đích hạ nguồn (tín hiệu tăng sinh, sống sót và biệt hóa). Là một chất truyền tin hạ nguồn của EGFR, KRAS có vai trò quan trọng trong việc khởi phát và tiến triển của một số ung thư như ung thư phổi và ung thư đại trực tràng. Gen KRAS là một thành viên của họ gen RAS (Rat Sarcoma Viral), mã hóa cho protein KRAS. Khi đột biến KRAS xảy ra, phân tử protein KRAS ở trạng thái hoạt hóa liên tục, dẫn đến hậu quả là các phân tử truyền tin hạ nguồn luôn hoạt động để duy trì tín hiệu tăng sinh tế bào. Đột biến KRAS được coi là một oncogen đóng vai trò quan trọng cả trong hình thành ung thư cũng như sự đề kháng với điều trị ung thư. Hiện nay, khoảng 5000 đột biến gen KRAS đã được công bố, trong đó phổ biến nhất là đột biến thay thế nucleotid ở codon 12 và codon 13. Tần suất xuất hiện đột biến KRAS trong ung thư đại trực tràng dao động trong khoảng 27 - 43%. Sự hiện diện của đột biến gen KRAS là một yếu tố tiên lượng xấu độc lập và giúp dự đoán hiện tượng kháng với phác đồ điều trị ức chế EGFR. Khi đột biến gen KRAS xảy ra, KRAS có khả năng tự phát ra tín hiệu nội bào để kích hoạt trở lại các con đường tín hiệu mà không phụ thuộc tín hiệu từ EGFR (Hình 14.7), do đó, dẫn đến vô hiệu hóa tác dụng của các kháng thể đơn dòng.

Một nghiên cứu trên 30 bệnh nhân ung thư đại trực tràng di căn dùng cetuximab cho thấy: 100% nhóm bệnh nhân có đáp ứng tốt không mang đột biến gen KRAS, trong khi đó 68% nhóm bệnh nhân không đáp ứng mang đột biến KRAS. Nhiều nghiên cứu khác, bao gồm cả những phân tích meta cũng đã chỉ ra rằng những bệnh nhân ung thư đại trực tràng mang đột biến gen KRAS có đáp ứng điều trị kém và do đó không được hưởng lợi ích điều trị khi dùng cetuximab hoặc panitumumab, ngay cả khi kết hợp với hóa trị liệu (Hình 14.8).
Từ thực tế đó, Hiệp hội Ung thư châu Âu và Hiệp hội Ung thư Hoa Kỳ đều khuyến cáo tất cả các bệnh nhân ung thư đại trực tràng đều cần thực hiện xét nghiệm phát hiện đột biến KRAS trước khi chỉ định điều trị với cetuximab hoặc panitumumab.
Ngay tại Việt Nam, xét nghiệm đột biến gen KR4S cũng đã được thực hiện ở một số bệnh viện lớn và quỹ bảo hiểm y tế chấp nhận thanh toán 50% với các trường hợp điều trị ung thư đại trực tràng di căn thuộc type KRAS tự nhiên (wildtype) khi chỉ định điều trị với cetuximab.
Bên cạnh KRAS, một số đột biến gen họ RAS khác (ví dụ như: đột biến gen Neuroblastoma Rat Sarcoma Viral (NRAS)) cũng đã được chứng minh có ảnh hưởng đáng kể tới đáp ứng điều trị kháng EGFR. Hiệp hội Ung thư lâm sàng Mỹ khuyến cáo trước khi chỉ định phác đồ ức chế EGFR, cần làm thêm các xét nghiệm đột biến gen RAS mở rộng, bao gồm KRAS and NR4S codon 12, 13 thuộc exon 2, codon 59, 61 thuộc exon 3, codon 117, 146 thuộc exon 4. Mới đây, FDA cũng đã phê duyệt 1 bộ kit thương mại cho phép xét nghiệm 56 đột biến đặc hiệu ở exon 2, 3, 4 của cả gen KRAS và NRAS.
Ngoài họ gen RAS, một họ gen tương tự khác cũng liên quan đến đáp ứng ức chế thụ thể EGFR với cơ chế tương tự, đó là họ gen RAF, một họ gen mã hóa cho protein hạ nguồn trong con đường truyền tín hiệu qua thụ thể EGFR (con đường MAPK) (Hình 14.9). Trong họ này, gen BRAF là gen thường xuất hiện đột biến nhất và protein BRAF cũng là yếu tố hoạt hóa quan trọng nhất của MEK trong con đường MAPK. Đột biến BRAF được tìm thấy ở 7 - 10% bệnh nhân ung thư đại trực tràng di căn.
Cho đến nay, đã có hơn 30 đột biến BRAF được phát hiện, với tần suất rất khác nhau. Trong đó, phổ biến nhất là BRAF V600E, xảy ra ở vùng có hoạt tính kinase của BRAF, làm cho hoạt tính kinase tăng 10 lần so với người mang kiểu gen wildtype. Tần suất đột biến BRAF V600E chiếm hơn 90% tổng số đột biến gen BRAF ở bệnh nhân ung thư đại trực tràng.
Đã có nhiều phân tích gộp cho thấy vai trò dự đoán đáp ứng điều trị ức chế EGFR của đột biến gen BRAF. Có sự giảm tỷ lệ đáp ứng toàn thể, giảm PFS, OS ở người mang đột biến BRAF V600E so với người có kiểu gen wildtype. Hiệp hội ung thư lâm sàng Mỹ khuyến cáo cần làm xét nghiệm tìm đột biến BRAF V600E để cá thể hóa điều trị ung thư đại trực tràng. Tại Việt Nam, để hỗ trợ cho bệnh nhân, Thông tư 37 của Bảo hiểm Y tế Việt Nam đã quy định chi trả chi phí xét nghiệm phát hiện đột biến gen BRAF.
6 Kết luận
Trong các nhóm điều trị, thuốc điều trị ung thư là lĩnh vực được ứng dụng dùng thuốc theo cá thể phổ biến nhất do các thuốc ung thư có độc tính cao, chi phí lớn, đáp ứng điều trị rất khác biệt giữa các bệnh nhân khác nhau. Nhiều xét nghiệm gen đã ra đời song hành với thuốc điều trị ung thư, đặc biệt là các thuốc hướng đích, giúp lựa chọn những bệnh nhân có đáp ứng tốt, cải thiện đáng kể thời gian sống và chất lượng cuộc sống của bệnh nhân. Bên cạnh đó, việc xét nghiệm gen liên quan đến dược động học cũng đã giúp cá thể hóa điều trị, làm giảm độc tính của các thuốc hóa trị. Ngay tại Việt Nam, nơi nghiên cứu gen dược còn đang ở những bước đi đầu tiên thì việc dùng xét nghiệm gen để cá thể hóa điều trị đối với các thuốc hướng đích cũng đã được áp dụng trong lâm sàng, đem lại lợi ích đáng kể cho người bệnh.
7 Tài liệu tham khảo
1. Bộ Y tế (2018), Thông tư số 30 - Thông tư ban hành danh mục và tỷ lệ, điều kiện thanh toán đối với thuốc hóa dược, sinh phẩm, thuốc phóng xạ và chất đánh dấu thuộc phạm vi được hưởng của người tham gia bảo hiểm y tế.
2. Bộ Y tế - Bộ Tài chính (2015), Thông tư liên tịch quy định thống nhất giá dịch vụ khám bệnh, chữa bệnh bảo hiểm y tế giữa các bệnh viện cùng hạng trên toàn quốc.
3. Phùng Thanh Hương, Phạm Thùy Linh, Nguyễn Thị Mai Hương, Nguyễn Thanh Huyền (2017), Tổng quan về dùng thuốc theo cá thể trong điều trị ung thư, Tạp chí Dược học, vol 57(499).
4. K. E. Caudle, C. F. Thorn, T. E. Klein (2013), Clinical Pharmacogenetics Implementation Consortium Guidelines for Dihydropyrimidine Dehydrogenase Genotype and Fluoropyrimidine Dosing, Clin Pharmacol Ther. 94(6): 640-645.
5. Annotation of Dutch Pharmacogenetics Working Group (DPWG) guideline information tamoxifen and CYP2D6, Retrieved from <https://www.pharmgkb.org/guideline/PA166104966>, accessed 21/6/2017.
6. Ettinger D.S., Wood D.E. (2017). Non-Small Cell Lung Cancer, Version 5.2017, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw, 15(4), 504-535.
7. C. Rodriguez-Antona, M. Taron (2015), Pharmacogenomic biomarkers for personalized cancer treatment, Journal of Internal Medicine, 2015, 277; 201-217.
8. Paulina Krzyszczyk et. Al. (2018), The growing role of precision and personalized medicine for cancer treatment, Technology Vol. 06, No. 03n04, pp. 79-100 (2018).
9. Marzia Del Re, Implications of KRAS mutations in acquired resistance to treatment in NSCLC, Oncotarget, 2018, Vol. 9, (No. 5), pp: 6630-6643.
10. Hiu Ting Chan. Yoon Ming Chin. Siew-Kee Low (2019), The Roles of Common Variation and Somatic Mutation in Cancer Pharmacogenomics, Oncol Ther (2019) 7:1-32.

