Irinotecan
9 sản phẩm
 Dược sĩ Nguyễn Trang Dược sĩ lâm sàng - Đại học Dược Hà Nội
Dược sĩ Nguyễn Trang Dược sĩ lâm sàng - Đại học Dược Hà Nội
Ước tính: 3 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
Bài viết biên soạn dựa theo
Dược thư quốc gia Việt Nam, lần xuất bản thứ ba
Đây là phiên bản mới nhất của Dược thư Việt Nam do Bộ Y tế ban hành Quyết định số 3445/QĐ-BYT ngày 23 tháng 12 năm 2022
Trang 934-936, tải PDF TẠI ĐÂY
IRINOTECAN
Tên chung quốc tế: Irinotecan.
Mã ATC: L01XX19.
Loại thuốc: Thuốc chống ung thư, thuốc ức chế topoisomerase.
1 Dạng thuốc và hàm lượng
Dạng thuốc thông thường: Dung dịch tiêm truyền rinotecan hydroclorid 20 mg/ml, lọ hoặc ống 2 ml, 5 ml, 15 ml, 25 ml; 5 mg/ml, lọ 10 ml.
Dạng thuốc liposom: 43 mg/10 ml.
2 Dược lực học
Irinotecan là một dẫn chất bán tổng hợp của camptothecin, là alcaloid được chiết xuất từ cây Campthotheca acuminata. Irinotecan là chất ức chế topoisomerase I. Topoisomerase 1 có vai trò tháo xoắn sợi DNA để chuẩn bị cho quá trình nhân đôi, sửa chữa hoặc sao mã. Quá trình này bắt đầu bằng việc topoisomerase I tạo phức hợp với DNA bằng liên kết ester, sau đó một trong hai sợi đơn trong chuỗi DNA bị cắt đứt rồi được nối lại bởi chính enzym này. Khi vào cơ thể dưới tác dụng của carboxylesterase, irinotencan sẽ chuyển thành chất chuyển hóa có hoạt tính mạnh hơn irinotecan nhiều là SN-38 (7-ethyl-10-hydroxy-camptothecin). Irinotencan và SN-38 gắn với phức hợp topoisomerase I - DNA, tuy không làm ảnh hưởng đến phản ứng cắt đứt sợi đơn trong DNA nhưng lại ức chế phản ứng nối sợi DNA bị đứt, do đó tạo ra một vị trí tổn thương trên DNA. Tổn thương trên một sợi đơn này không gây độc tế bào nhưng tổn thương này trong quá trình nhân đôi của DNA sẽ tạo ra DNA mới có vị trí tổn thương trên cả hai sợi đơn và không thể sửa chữa được. Sự tích lũy các DNA có vị trí tổn thương trên cả hai sợi đơn sẽ dẫn đến các phản ứng gây chết tế bào.

3 Dược động học
3.1 Phân bố
Tỷ lệ gắn với protein huyết tương (chủ yếu là Albumin) Irinotecan khoảng 30 - 68% và chất chuyển hóa còn hoạt tính SN-38 khoảng 95%. Vd là 33 - 150 lit/m2 ở người lớn và 15,2 - 77 lít/m2 ở trẻ em. Dạng thuốc liposom gắn với protein huyết tương < 1% và có Vd là 4,1 lít.
3.2 Chuyển hóa
Thuốc được chuyển hóa ban đầu ở gan thành SN-38 bởi carboxylesterase, SN-38 bị liên hợp bởi UGT1A1(UDP- glucuronosyl transferase 1A1) thành dạng chuyển hóa glucuronid. Ở người hút thuốc lá, chuyển hóa irinotecan thành SN-38 bị giảm đi và dạng glucuronid hóa của SN-38 tăng lên, dẫn tới nồng độ chất chuyển hóa có hoạt tính trong máu thấp và giảm chung tổng lượng chất có hoạt tính trong cơ thể, Irinotecan và SN-38 còn bị thủy phân thành chất chuyển hóa không hoạt tính dạng hydroxy acid. Irinotecan cũng bị oxy hóa thành 1 chất chuyển hóa không hoạt tính bởi cytochrom P450.
3.3 Thái trừ
Nửa đời thải trừ của irinotecan và SN-38 tương ứng là 6 -12 giờ và 10 - 20 giờ ở người lớn; 1,82 - 4,47 giờ và 0,29 - 8,28 giờ ở trẻ em. Với dạng thuốc liposom, irinotecan và SN-38 có nửa đời thải trừ lần lượt khoảng 26 giờ và 68 giờ. Irinotecan được bài tiết qua nước tiểu 11 - 20%, các chất chuyển hóa khác thải tiểu: SN-38 là < 1%, SN-38 glucoronid là 3%.
4 Chỉ định
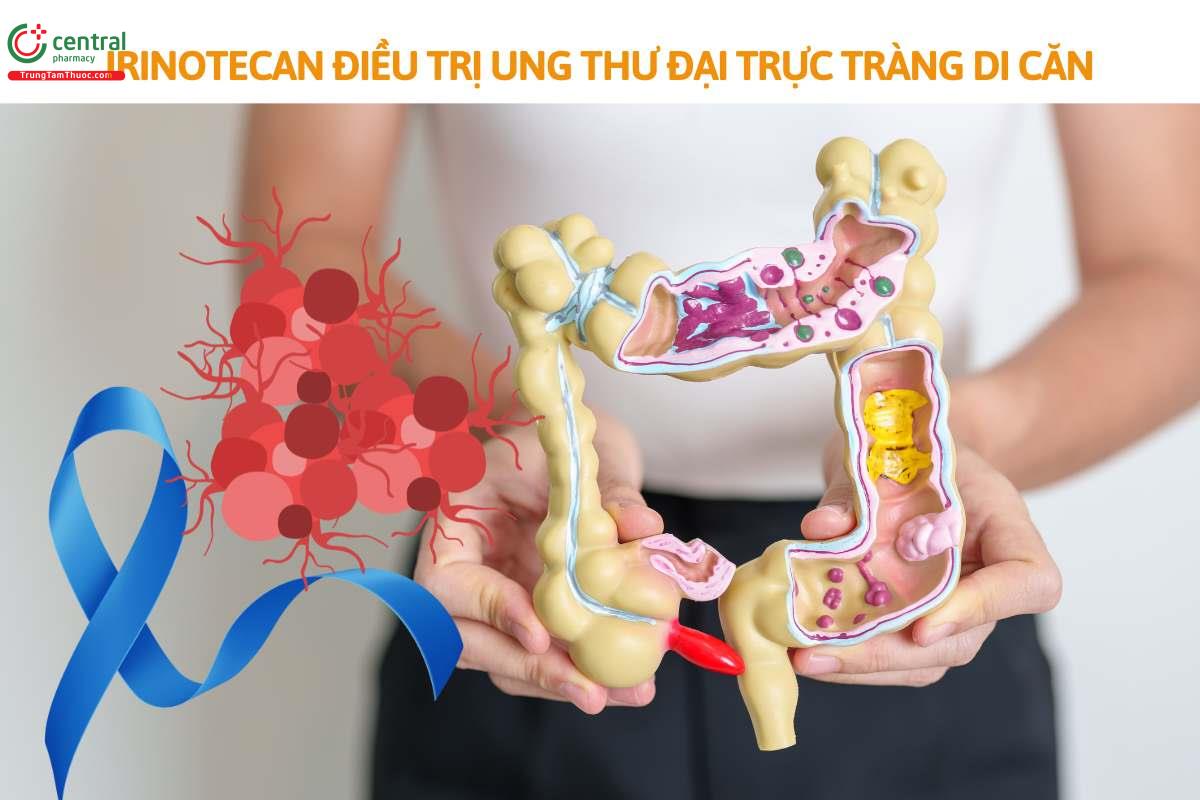
Ung thư đại trực tràng di căn (sử dụng dụng thuốc thông thường).
Ung thư biểu mô tuyến tụy di căn tiến triển sau hóa chất nền tảng gemcitabin (sử dụng dạng thuốc liposom).
5 Chống chỉ định
Mẫn cảm với irinotecan.
Tắc ruột.
Viêm ruột mạn tính.
6 Thận trọng
Irinotecan là chất độc, cần tuân thủ quy định về bảo quản, vận chuyển, sử dụng và tiêu hủy độc chất, có thể gây ra những phản ứng quá mẫn trầm trọng.
Irinotecan có thể gây tiêu chảy trầm trọng biểu hiện sớm trong vòng 24 giờ đầu hoặc muộn hơn nhưng có thể gây ra nhiều biến chứng khác như mất nước, rối loạn cân bằng nước, điện giải, suy thận thứ phát do mất nước, do đó cần theo dõi chặt chẽ và điều trị tích cực nếu có tiêu chảy.
Các thông số cần theo dõi trong quá trình điều trị: công thức máu, số lượng tiểu cầu, hemoglobin huyết (với mỗi liều); bilirubin, điện giải đồ (nếu có tiêu chảy nặng).
Nguy cơ nhiễm khuẩn huyết gây ra do ức chế tủy xương của irinotecan, do đó cần theo dõi số lượng bạch cầu trung tính, nếu < 1 000/mm3 máu cần phải tạm ngừng thuốc, giảm liều nếu số lượng bạch cầu trung tính < 1 500/mm3 số lượng tiểu cầu < 100 000 mm3 hoặc hemoglobin < 8 g/dl. Những bệnh nhân đồng hợp tử với alen 28 của UGT1A1* có nguy cơ cao bị giảm bạch cầu trung tính, do đó liều ban đầu nên giảm một mức liều cả trong trường hợp sử dụng irinotecan đơn thuần hoặc phối hợp. Những bệnh nhân dị hợp tử với alen 28 của UGTIA1* vẫn có nguy cơ giảm bạch cầu trung tỉnh nhưng đa số bệnh nhân nhóm này dung nạp với liều thông thường. Những bệnh nhân bất thường về glucuronid hóa bilirubin như hội chứng Gilbert's có nguy cơ cao hơn về suy giảm tủy xương do irinotecan. Cần giảm liều hoặc tạm ngừng irinotecan nếu có triệu chứng giảm bạch cầu trung tính. Sử dụng thận trọng và xem xét giảm liều ở bệnh nhân rối loạn chức năng gan hoặc tăng bilirubin huyết.
Sử dụng thận trọng ở những bệnh nhân đã từng điều trị tia xạ vùng bụng và khung chậu. Đối với người già có bệnh phối hợp cần sử dụng thận trọng, theo dõi chặt chẽ các thông số xét nghiệm cơ bản và xem xét giảm liều.
7 Thời kỳ mang thai
Irinotecan có thể gây độc cho thai nhi hoặc gây quái thai nếu sử dụng ở phụ nữ mang thai.
8 Thời kỳ cho con bú
Cho đến nay chưa có thông tin về irinotecan có qua sữa mẹ hay không. Do nguy cơ gây ra các phản ứng bất lợi trầm trọng ở trẻ nhỏ, vì vậy không nên cho trẻ bú mẹ ở người mẹ dùng irinotecan.
9 Tác dụng không mong muốn (ADR)
9.1 Rất thường gặp
Tim mạch: giãn mạch (9 - 11%).
TKTW: Gây độc hệ cholinergic (47%) (bao gồm; viêm mũi, tăng tiết nước bọt, co đồng tử, tăng tiết nước mắt, vã mồ hôi, tăng nhu động ruột), sốt (45%), đau (24%), chóng mặt (21%), mất ngủ (19%), đau đầu (17%), ớn lạnh (14%).
Da: rụng tóc (72%), ban da (14%).
Nội tiết và chuyển hóa: mất nước (15%).
Tiêu hóa: tiêu chảy biểu hiện muộn (sau 24 giờ) (88%), trong đó mức độ 3 chiếm khoảng 5 - 31%, tiêu chảy biểu hiện sớm (trong vòng 24 giờ) (51%) trong đó mức độ 3 khoảng 6 - 22%, buồn nôn (86%), đau bụng (68%), nôn (67%), chuột rút (57%), chán ăn (55%), táo bón (32%), viêm loét niêm mạc (30%), giảm cân (30%), loét niêm mạc miệng (12%).
Huyết học: thiếu máu (97%), giảm bạch cầu (96%), giảm tiểu cầu (96%), giảm bạch cầu trung tính (96%).
Gan: tăng bilirubin (84%), tăng phosphatase kiềm (13%).
Cơ - xương: yếu cơ (76%), đau lưng (14%).
Hô hấp: khó thở (22%), họ (20%), viêm mũi (16%), viêm phổi (4%).
Biểu hiện khác: vã mồ hôi (16%), nhiễm khuẩn (14%).
9.2 Thường gặp
Tim mạch: phù mạch (10%); giảm huyết áp (6%), tắc mạch do huyết khối (5%).
TKTW: ngủ gà (9%), lẫn lộn (3%).
Tiêu hóa: đầy bụng (10%), khó tiêu (10%).
Huyết học: sốt giảm bạch cầu trung tính (2 - 6%), chảy máu (1 - 5%), nhiễm trùng giảm bạch cầu trung tính ( 1 - 2%).
Gan: tăng AST (10%), cổ trướng và/hoặc vàng da (9%). Hô hấp: viêm phổi (4%).
9.3 Ít gặp và hiếm gặp
Tăng Amylase, phản ứng phản vệ, sốc phản vệ, đau thắt ngực, tắc nghẽn động mạch, chảy máu, nhịp chậm, nhồi máu não, thiếu máu cơ tim, suy tuần hoàn, viêm loét đại tràng, viêm tắc tĩnh mạch, tăng Glucose huyết, giảm natri huyết, giảm bạch cầu lympho, chuột rút, viêm tụy, bệnh mạch ngoại biên, nhồi máu phổi; suy thận cấp, rối loạn chức năng thận.
Chú ý: Các dữ liệu về ADR ở trẻ em rất ít, mất nước (kèm theo giảm natri và Kali huyết mức độ 3/4 gặp tới 29%; nhiễm khuẩn (24%).
10 Hướng dẫn cách xử trí ADR
Hay gặp nhất là ỉa chảy, dạng ỉa chảy sớm (biểu hiện trong vòng 24 giờ sau khi dùng thuốc) với các triệu chứng thể hiện tăng cholinergic thường đáp ứng với atropin. Ỉa chảy muộn (biểu hiện sau ≥ 24 giờ dùng thuốc) thường dẫn tới mất nước, rối loạn điện giải, nên điều trị bằng loperamid. Loperamid 4 mg/lần, uống ngay khi có ỉa chảy, sau đó 2 mg cho mỗi 2 giờ (hoặc 4 mg cho mỗi 4 giờ vào ban đêm) cho đến 12 giờ sau khi hết dấu hiệu tăng nhu động đại tràng. Không dùng loperamid liên tục trong vòng 48 giờ. Nếu ỉa chảy đã được điều trị hồi phục, có thể dùng irinotecan tiếp tục. Nhiễm khuẩn huyết thường là hậu quả của ức chế tủy xương, nếu bạch cầu trung tính giảm < 1 000/mm3 hoặc sốt kèm theo cần phải tạm ngừng irinotecan. Giảm liều irinotecan nếu thấy số lượng bạch cầu, số lượng bạch cầu trung tính, hồng cầu, tiểu cầu giảm đến mức có ý nghĩa lâm sàng.
11 Liều lượng và cách dùng
11.1 Cách dùng
Thuốc dùng đường tĩnh mạch. Pha liều thuốc chỉ định với 250 - 500 ml dung dịch glucose 5% hoặc dung dịch Natri clorid 0,9%. Truyền tĩnh mạch chậm trong khoảng thời gian > 90 phút. Nếu truyền càng nhanh nguy cơ các triệu chứng tăng cholinergic càng cao, Chú ý vị trí tiêm truyền, tránh nhiễm khuẩn và vỡ mạch. Chú ý giảm liều đầu tiên của mỗi mức liều cho các bệnh nhân > 65 tuổi, bệnh nhân trước khi xạ trị vùng bụng hoặc khung chậu, những người đồng hợp tử UTG1A1*28, tăng bilirubin huyết.
Đối với những bệnh nhân có bilirubin huyết > 2 mg/dl, hiện nay chưa có khuyến cáo về liều điều trị.
11.2 Liều dùng
11.2.1 Ung thư đại trực tràng di căn (dạng thuốc thông thường)
Liều đơn trị liệu
- 125 mg/m2 vào các ngày 1, 8, 15 và 22 của chu kỳ trị liệu 6 tuần. Nghỉ 2 tuần, tùy theo đáp ứng của bệnh và độc tính của thuốc, có thể phải hiệu chỉnh liều:
- Liều hiệu chỉnh mức - 1: 100 mg/m 2
- Liều hiệu chỉnh mức - 2: 75 mg/m2
- Có thể hiệu chỉnh đến 50 mg/m2
- Phác đồ 3 tuần 1 lần: 350 mg/m2 truyền trong thời gian từ 90 phút trở lên. Sau 3 tuần, tùy theo đáp ứng của bệnh và độc tính của thuốc, có thể phải hiệu chỉnh liều:
- Liều hiệu chỉnh mức - 1: 300 mg/m2
- Liều hiệu chỉnh mức - 2: 250 mg/m2
- Có thể hiệu chỉnh đến 200 mg/m2
Liều phối hợp với fluorouracil và leucovorin:
Chu kỳ trị liệu 6 tuần (42 ngày):
Phác đồ 1: 125 mg/m2 truyền trong thời gian từ 90 phút trở lên vào các ngày 1, 8, 15 và 22 của chu kỳ trị liệu 6 tuần; phối hợp với leucovorin 20 mg/mẻ và fluorouracil 500 mg/m2 (leucovorin dùng ngay sau khi truyền irinotecan; tiếp ngay sau leucovorin là dùng fluorouracil).
Nếu phải hiệu chỉnh liều irinotecan thì liều leucovorin vẫn giữ ở mức 20 mg/m2 còn fluorouracil thì tùy liều hiệu chính của irinotecan:
Liều hiệu chỉnh mức - 1: 100 mg/m2, fluorouracil 400 mg/m2
Liều hiệu chỉnh mức - 2: 75 mg/m2 fluorouracil 300 mg/m2
Phác đồ 2; Truyền irinotecan trong thời gian từ 90 phút trở lên vào các ngày 1, 15 và 29 của chu kỳ trị liệu 6 tuần; phối hợp điều trị với leucovorin và fluorouracil (leucovorin dùng ngay sau khi truyền irinotecan; tiếp ngay sau leucovorin là dùng fluorouracil).
Liều khởi đầu và liều hiệu chỉnh như sau:
| Phác đồ 2 (liều mg/m2) | Liều khởi đầu | Liều hiệu chỉnh mức- 1 | Liều hiệu chỉnh mức - 2 |
|---|---|---|---|
| Irinotecan | 180 | 150 | 120 |
| Leucovorin | 200 | 200 | 200 |
| Fluorouracil tiêm 1 lúc | 400 | 320 | 240 |
| Fluorouracil truyền tĩnh mạch | 600 | 480 | 360 |
Chú ý: Đối với tất cả các phác đồ, mỗi chu kỳ điều trị mới được chỉ định khi số lượng bạch cầu trung tính > 1 500/mm3 số lượng tiểu cầu > 100 000/mm3 và tiêu chảy liên quan với thuốc trị liệu đã được điều trị hồi phục hoàn toàn. Có thể bắt đầu chu kỳ trị liệu mới chậm hơn dự kiến 1 - 2 tuần để bệnh nhân hồi phục do độc tính liên quan đến trị liệu. Nếu thời gian bắt đầu chu kỳ trị liệu mới chậm hơn dự kiến > 2 tuần mà bệnh nhân chưa hồi phục đủ điều kiện chỉ định chu kỳ điều trị mới, thì cần xem xét ngừng irinotecan.
Người suy thận: Cho đến nay chưa có dữ liệu đánh giá về hiệu quả điều trị ở nhóm bệnh nhân này, không khuyến cáo điều trị cho bệnh nhân lọc máu ngoài thận.
Người suy gan: Không có sự thay đổi về liều và cách dùng ở bệnh nhân ung thư di căn gan và chức năng gan bình thường.
Trong trường hợp bilirubin huyết 1 - 2 mg/dl, có thể bắt đầu bằng liều thấp hơn (100 mg/m2). Cơ quan quản lý thực phẩm và dược phẩm Hoa Kỳ (FDA) không khuyến cáo sử dụng irinotecan nếu bilirubin huyết > 2 mg/m2; một số hướng dẫn khác (Floyd, 2006) khuyến cáo nếu bilirubin huyết 1,5 - 3 mg/dl có thể dùng 75% liều điều trị thông thường.
Hiệu chỉnh liều ở bệnh nhân có độc tính do irinotecan: Nếu có độc tính, chỉ bắt đầu chu kỳ trị liệu mới khi bệnh nhân có các thông số huyết học đủ điều kiện chỉ định. Tùy theo sự dung nạp của mỗi bệnh nhân có thể dùng liều thấp với mức tăng liều ở mức 25 - 50 mg/m2 mỗi lần. Nếu các dấu hiệu độc tính không hồi phục chậm hơn quá 2 tuần thời điểm bắt đầu chu kỳ trị liệu mới có thể xem xét ngừng irinotecan.
Liều điều trị ở trẻ em:
11.2.2 Khối u đặc không đáp ứng với điều trị khác
Dùng liều thấp kéo dài, chu kỳ trị liệu 3 tuần: 20 mg/m2/ngày, 5 ngày/tuần trong 2 tuần liên tục, tuần tiếp theo không dùng thuốc, sau đó tiếp tục chu kỳ trị liệu khác.
11.2.3 Khối u đặc không đáp ứng điều trị hoặc u não
Chu kỳ trị liệu 21 ngày: 50 mg/m2/ngày trong 5 ngày đầu của chu kỳ. Chu kỳ trị liệu tiếp theo dùng liều như chu kỳ trị liệu trước. Hoặc có thể dùng chu kỳ trị liệu 6 tuần: Trong 4 tuần đầu, mỗi tuần 1 lần với liều 125 - 160 mg/m2/ngày, nhắc lại liều như trên mỗi 6 tuần.
11.2.4 Ung thư tế bào tuyến tụy di căn sau khi đã sử dụng liệu pháp gemcitabin (dạng thuốc liposom)
Tiêm tĩnh mạch 70 mg/m/lần, 2 tuần 1 lần (kết hợp với fluorouracil và leucovorin). Giảm liều khởi đầu xuống 50 mg/m/lần ở bệnh nhân có đồng hợp tử UTG1A1*28, sau đó có thể tăng lên tới 70 mg/m2/lần trong các chu kỳ sau nếu dung nạp tốt.
11.2.5 Các thông số cần theo dõi trong quá trình điều trị
Số lượng tế bào máu các loại, số lượng tiểu cầu và hemoglobin, bilirubin huyết, điện giải đồ (nếu có tiêu chảy), nhu động đại tràng, tình trạng mất nước, theo dõi vị trí truyền dịch, tránh tình trạng viêm hoặc vỡ mạch.
12 Tương tác thuốc
12.1 Tránh phối hợp irinotecan với các thuốc
Atazanavir, natalizumab, cỏ St. John, các vắc xin sống giảm độc lực.
12.2 Tăng tác dụng/độc tính
Irinotecan có thể làm tăng nồng độ hoặc tác dụng của natalizumab, các vắc xin sống giảm độc lực.
Các thuốc làm tăng tác dụng/nồng độ của irinotecan bao gồm
Thuốc chống nấm dẫn chất azol tác dụng toàn thân, Atazanavir, Bevacizumab, chất ức chế CYP2B6, CYP3A4, Dasatinib, eltrombopag; chất ức chế P-glycoprotein, sorafenib, Trastuzumab. Giảm tác dụng: Irinotecan có thể làm giảm tác dụng của các vắc xin bất hoạt.
Các thuốc làm giảm nồng độ/tác dụng của irinotecan bao gồm: các chất có tác dụng kích hoạt CYP2B6, CYP3A4, deferacirox, echinacea, Phenytoin, chất chiết xuất từ cỏ St. John, chất kích hoạt P-glycoprotein.
Cập nhật lần cuối: 2019.