Can thiệp tổn thương tắc hoàn toàn mạn tính động mạch vành
Nguồn: Sách tim mạch can thiệp
Chủ biên: PGS.TS.BS. Phạm Mạnh Hùng
Tham gia biên soạn
ThS.BSNT Phạm Nhật Minh
ThS.BSNT Nguyễn Công Thành
PGS.TS.BS Phạm Mạnh Hùng
1 Giới thiệu
Mạch vành tắc hoàn toàn mạn tính (CTO), được định nghĩa là mạch vành tắc hoàn toàn (dòng chảy TIMI 0) trong thời gian hơn 3 tháng. Can thiệp CTO là một trong những kỹ thuật có độ khó cao nhất trong can thiệp động mạch vành qua da. Thủ thuật can thiệp CTO thường tỷ lệ thành công thấp và tỷ lệ biến chứng cao nếu bác sĩ can thiệp chưa đủ kinh nghiệm. Thông thường, thủ thuật can thiệp CTO thường được thực hiện bởi các bác sĩ đã có kinh nghiệm về can thiệp, ít nhất từ 3-5 năm trở lên, tỷ lệ thành công của thủ thuật có thể đạt khoảng 85-90% với bác sĩ can thiệp đã thành thạo các kỹ thuật can thiệp CTO.
Một dạng tổn thương thường gặp dù vẫn gọi là CTO nhưng trên phim chụp ĐMV cản quang vẫn còn thấy vệt dòng chảy xuôi dòng rất nhỏ. Những tổn thương này thường được gọi CTO chức năng (functional CTO), không phải “thật sự” tắc hoàn toàn và có xác suất thành công cao hơn khi can thiệp xuôi dòng nhờ việc vẫn còn dòng chảy nhỏ. Các bác sĩ mới can thiệp CTO cũng có thể dựa trên dấu hiệu này để quyết định có nên tiến hành can thiệp, hay có thể can thiệp được dễ dàng được tổn thương này hay không.
Chỉ định can thiệp động mạch vành qua da (PCI) trong CTO nên dựa vào tình trạng lâm sàng cụ thể của bệnh nhân hơn là do ý muốn chủ quan của bác sĩ can thiệp (mạch tắc luôn cần phải thông ra không phải lúc nào cũng chính xác) mục tiêu hàng đầu nên là cải thiện được tiên lượng và triệu chứng của người bệnh, nếu cần nên có hội chẩn đầy đủ nhóm Heart-team để đưa ra được chỉ định tốt nhất. Nếu bác sĩ can thiệp không thành thạo kỹ thuật can thiệp CTO, cũng không cần thiết chuyển ngay sang phẫu thuật bắc cầu hoặc chỉ định bệnh nhân điều trị nội khoa; trong trường hợp đó, có thể hội với bác sĩ can thiệp có kinh nghiệm trong can thiệp CTO, hoặc chuyển đến trung tâm có kinh nghiệm can thiệp CTO.
Về dịch tễ học, tổn thương CTO không phải là hiếm gặp, tỷ lệ dao động trong khoảng 15-35% các ca chụp động mạch vành qua da. Tỷ lệ này cao hơn ở bệnh nhân có tiền sử phẫu thuật bắc cầu nối chủ vành (CABG) hoặc bệnh nhân nhồi máu cơ tim (NMCT cấp có ST chênh lên. Bảng dưới đây cho thấy tỷ lệ CTO theo một số tổng kết từ các nước trên thế giới. Tại Việt Nam chưa có tổng kết nào tương tự, tuy nhiên trong những năm gần đây, tỷ lệ CTO tăng lên nhanh chóng và các trung tâm tim mạch can thiệp có thể tiến hành thủ thuật can thiệp CTO cũng tăng lên nhanh chóng.
Bảng 21.1. Tỷ lệ CTO theo một số tổng kết trên thế giới
| TÁC GIẢ | QUỐC GIA | NĂM | SỐ TRUNG TÂM THEO DÕI | N | TỶ LỆ CAO | BỆNH NHÂN ĐÃ TỪNG CABG |
|---|---|---|---|---|---|---|
| Kahn | Mỹ | 1993 | 1 | 287 | 35% | - |
| Christofferson | Mỹ | 2005 | 1 | 8.004 | 52% | - |
| Werner | Đức | 2009 | 64 | 2.002 | 35% | - |
| Fefer | Canada | 2012 | 3 | 14.439 | 18% | 54% |
| Jeroudi | Mỹ | 2013 | 1 | 1.669 | 31% | 89% |
| Azzalini | Canada | 2015 | 1 | 2.514 | 20% | 87% |
| Tomasello | Italy | 2015 | 12 | 13.423 | 13% | - |
| Ramundal | Thụy Điển | 2015 | 30 | 89.876 | 16% | - |
TO: Mạch vành tắc hoàn toàn mạn tính. CABG: Bắc cầu nối chủ vành.
Bệnh cảnh CTO nằm trong bệnh cảnh chung của bệnh nhân bệnh lý động mạch vành. Do đó việc tiến hành điều trị bao gồm cả việc điều trị nội khoa tối ưu (Optimal Medical Therapy – OMT) bao gồm các loại thuốc kháng tiểu cầu, statin, chẹn beta giao cảm, ức chế ARNI…và lên chiến lược tái thông mạch bằng PCI hoặc CABG.
Tái thông mạch thường được chỉ định khi bệnh nhân có triệu chứng liên quan đến thiếu máu cơ tim như đau ngực, khó thở…và các bệnh nhân có các biểu hiện thiếu máu cơ tim thông qua các test gắng sức không xâm lấn hoặc rối loạn chức năng thất trái. Can thiệp qua da được chỉ định ưu tiên ở bệnh nhân bệnh 1 nhánh động mạch vành duy nhất hoặc bệnh nhân được CABG trước đó. Tuy nhiên việc đưa ra quyết định cần được thảo luận kỹ lưỡng giữa nhóm Heart team và gia đình/bệnh nhân thông qua đánh giá kỹ lợi ích/nguy cơ của thủ thuật can thiệp.
2 Chuẩn bị trước can thiệp
2.1 Khuyến cáo can thiệp CTO động mạch vành
Cả Hiệp hội Tim mạch Hoa Kỳ (AHA/ACC) và Hiệp hội Tim mạch châu Âu (ESC) đều có khuyến cáo cho các thủ thuật can thiệp CTO. Mặc dù vậy, việc tiến hành thủ thuật vẫn có khá nhiều “trường phái” hay “quan điểm” điều trị tùy thuộc vào trung tâm/bác sĩ can thiệp. Điểm cần lưu ý là mặc dù là một thủ thuật khó khăn hơn các thủ thuật PCI thông thường khác, các chỉ định can thiệp vẫn chủ yếu giống như các can thiệp không-CTO, tuy nhiên bệnh nhân thường sẽ phải chịu đựng thời gian chiếu tia dài hơn, lượng cản quang lớn hơn và tỷ lệ biến chứng cao hơn các thủ thuật thông thường. Khuyến cáo của ESC và AHA/ACC được tóm tắt theo bảng dưới đây, tuy nhiên thực hành lâm sàng thường tùy thuộc vào tình huống cụ thể.
Bảng 21.2. Khuyến cáo can thiệp CTO động mạch vành theo AHA/ACC và ESC
| HIỆP HỘI | MỨC KHUYẾN CÁO VÀ BẰNG CHỨNG | KHUYẾN CÁO |
|---|---|---|
| AHA/ACC (2011) | IIa-B | Can thiệp (PCI) tổn thương CTO ở bệnh nhân có chỉ định lâm sàng phù hợp và giải phẫu phù hợp được khuyến cáo khi được thực hiện bởi bác sĩ can thiệp có đủ kinh nghiệm |
| ESC (2014) | IIa-B | Can thiệp (PCI) tổn thương CTO có thể được cân nhắc trên người bệnh để làm giảm mức độ thiếu máu cơ tim trên vùng tổn thương cơ tim phù hợp và/hoặc để làm giảm triệu chứng đau thắt ngực |
| IIb-C | Can thiệp CTO ngược dòng có thể cân nhắc sau khi can thiệp xuôi dòng thất bại, hoặc ở những bệnh nhân có tổn thương phù hợp với can thiệp ngược dòng ngay từ đầu |
CI: Can thiệp động mạch vành qua da; CTO: Mạch vành tắc hoàn toàn mạn tính.
2.2 Các chỉ định can thiệp CTO động mạch vành thường gặp trên thực hành lâm sàng
Đau thắt ngực hoặc khó thở, gây khó khăn cho sinh hoạt hàng ngày, hoặc với mục đích tăng khả năng gắng sức, cải thiện chất lượng cuộc sống.
Người bệnh không có triệu chứng hoặc triệu chứng ít nhưng có hình ảnh thiếu máu cơ tim trên các thăm dò không xâm lấn, với mục tiêu làm giảm vùng thiếu máu cơ tim, làm giảm sự tiến triển của thiếu máu.
Người bệnh có giảm chức năng tâm thu thất trái, nhưng cơ tim vẫn có thể hồi phục thông qua siêu âm tim Dobutamine hoặc chụp xạ hình hoặc chụp cộng hưởng từ tim, với mục tiêu làm giảm triệu chứng khó thở hoặc dấu hiệu suy tim mất bù.
Cải thiện tiên lượng với bệnh nhân bệnh nhiều thân động mạch vành.
Làm giảm nguy cơ phải phẫu thuật bắc cầu nối chủ vành hoặc ở bệnh nhân khó có khả năng
Cải thiện khả năng dung nạp với các biến cố mạch vành về lâu dài.
2.3 Các chống chỉ định với can thiệp CTO
Chống chỉ định tuyệt đối:
– Không có khả năng sử dụng thuốc kháng thụ thể P2Y12 (chẳng hạn như bệnh nhân có nguy cơ chảy máu cao) hoặc chống chỉ định dùng P2Y12 (các bệnh nhân này nên phẫu thuật CABG).
Chống chỉ định tương đối:
– Không có khả năng sử dụng kháng tiểu cầu kép lâu dài sau can thiệp đặt stent DES, do không dung nạp hoặc nguy cơ chảy máu cao.
– Không dung nạp với tia xạ (ví dụ: gây tổn thương da…).
– bệnh thận mạn, nguy cơ tổn thương thận do cản quang.
– HIT (xuất huyết giảm tiểu cầu do Heparin), trong trường hợp này có thể thay thế bằng bivalirudin.
– Phản vệ với thuốc cản quang.
2.4 Lượng giá khả năng thành công – nguy cơ biến chứng của thủ thuật
Tỷ lệ thành công với can thiệp CTO đã tăng từ 70-80% trước đây lên khoảng 85-90% trong thời gian gần đây tại các trung tâm can thiệp CTO, tại các trung tâm ít kinh nghiệm hơn, tỷ lệ này khoảng 60%.
Tuy vậy, khả năng thành công của một can thiệp CTO cũng phụ thuộc vào cả kinh nghiệm của bác sĩ can thiệp và mức độ phức tạp của tổn thương. Để lượng giá khả năng thành công của thủ thuật dựa trên mức độ phức tạp của tổn thương, một số công cụ lượng giá dựa trên những sổ bộ về CTO lớn đã được đề xuất, chẳng hạn thang điểm J-CTO (Bảng 21.5) hoặc thang điểm PROGRESS-CTO (Bảng 21.3).
Bảng 21.3. Thang điểm PROGRESS-CTO (đánh giá tỉ lệ thành công của thủ thuật)
| Không rõ điểm vào ở đầu gần (poor proximal cap) – 1 điểm | Không nhìn rõ “đầu gần” của CTO hay “Stump” có thể can thiệp |
|---|---|
| Không có các bàng hệ “có thể can thiệp” (Absence of “interventional collaterals”) – 1 điểm | Bàng hệ “có thể can thiệp” được nhìn rõ (hay nói cách khác là bàng hệ có thể lái được ngược dòng) |
| Không nhìn rõ bàng hệ | |
| Xoắn vặn từ vừa – nhiều – 1 điểm | 2 góc gập >700 hoặc 1 góc gập >900 |
| CTO LCx – 1 điểm | ; |
|
Tỷ lệ thành công của thủ thuật theo điểm PROGRESS CTO: 0 điểm: 98,2% 1 điểm: 97,5% 2 điểm: 91,6% 3 điểm: 76,7% |
Bảng 21.4. Thang điểm PROGRESS-CTO Complication (Lượng giá biến chứng của thủ thuật can thiệp CTO)
| ĐIỂM | NGUY CƠ BIẾN CHỨNG |
|---|---|
| Tuổi >65 tuổi: +3 điểm | ≥ 5 điểm: nguy cơ 6,6% |
| Chiều dài tổn thương CTO ≥ 23mm: +2 điểm | 3-4 điểm: nguy cơ 2,0% |
| Cần sử dụng can thiệp ngược dòng: +1 điểm | 0-2 điểm: nguy cơ 0,2% |
Bảng 21.5. Thang điểm RECHARGE, CL, CASTLE đánh giá tỷ lệ thành công của thủ thuật can thiệp CTO
| THANG ĐIỂM RECHARGE | THANG ĐIỂM CL | THANG ĐIỂM CASTLE |
|---|---|---|
|
– Đầu gần tù (1 điểm) – Chiều dài tổn thương > 20 mm (1 điểm) – Góc gập tại tổn thương > 45 độ (1 điểm) – Vôi hóa có thể nhìn thấy trong đoạn CTO (1 điểm) – Cầu nối chủ vành trong đoạn CTO (1 điểm) – Tổn thương đầu xa của CTO (1 điểm) |
– Đầu gần tù (1 điểm) – Chiều dài tổn thương > 20 mm (1 điểm) – RCA hoặc LCX CTO (1 điểm) – Vôi hóa nặng (2 điểm) – NMCT cũ hoặc CABG cũ (1,5 điểm) |
– Đầu gần tù hoặc không có mấu (stump) (1 điểm) – Chiều dài tổn thương > 20 mm (1 điểm) – Tổn thương xoắn vặn (1 điểm) – Vôi hóa nặng (1 điểm) – CABG cũ (1 điểm) |
|
Tỷ lệ thành công: 0-1 điểm: 98% 2 điểm: 90% 3 điểm: 73% 4 điểm: 69% 5 điểm: 44% 6 điểm: 14% |
Tỷ lệ thành công 0-1 điểm: 88,3% 1,5-2,5 điểm: 73,1% 3-4,5 điểm: 59,4% 5 điểm: 46,2% |
Tỷ lệ thất bại: 0 điểm: 5,8% 1 điểm: 9,3% 2 điểm: 14,5% 3 điểm: 22,1% 4 điểm: 32,3% 5 điểm: 44,7% 6 điểm: 56,5% |
Chú thích: CABG: Bắc cầu nối chủ vành; RCA: Động mạch vành phải; LCX: Động mạch mũ; NMCT: Nhồi máu cơ tim; CTO: Động mạch vành tắc mạn tính.
Lên chiến lược can thiệp CTO
Lên chiến lược can thiệp là bước quan trọng nhất đối với sự thành công của thủ thuật can thiệp CTO. Việc lên kế hoạch cẩn thận trước khi làm thủ thuật có thể làm tăng tỷ lệ thành công lên đáng kể và giảm thiểu việc kéo dài thủ thuật hay can thiệp CTO không cần thiết. Việc lên chiến lược bắt đầu bằng việc quyết định liệu CTO có gây ra các triệu chứng và/hoặc thiếu máu cục bộ hay không, và nếu vậy, liệu có cần phải tái thông mạch hay không. Đôi khi cần đến các thăm dò chẩn đoán hình ảnh công nghệ cao như MRI tim hoặc chụp SPECT để đánh giá đầy đủ về vùng tổn thương thiếu máu cơ tim.
Nếu chọn tái thông mạch vành, cũng nên bàn bạc với gia đình bệnh nhân để quyết định liệu phẫu thuật bắc cầu chủ vành hay PCI là ưu thế hơn vì CTO thường xảy ra ở bệnh nhân mắc bệnh nhiều thân mạch vành. Nếu lựa chọn PCI, quyết định tiếp theo là liệu độ phức tạp có nằm trong khả năng chuyên môn của bác sĩ can thiệp tại trung tâm hay nên mời chuyên gia CTO. Trong trường hợp đó, các vấn đề chính cần quan tâm bao gồm:
Thời gian:Khuyến cáo chỉ nên can thiệp CTO như một thủ thuật độc lập thay vì can thiệp ngay sau khi chụp chẩn đoán động mạch vành và phát hiện tổn thương CTO. Sau khi phát hiện tổn thương CTO, nên dừng thủ thuật lại, giải thích kỹ cho bệnh nhân và người nhà bệnh nhân về thủ thuật, lên kế hoạch chu đáo và có thể sẽ can thiệp CTO vào một ngày khác. Điều này sẽ cho phép giảm lượng thuốc cản quang và liều bức xạ; tạo điều kiện cho việc chuẩn bị và lên kế hoạch PCI, bao gồm chụp đánh giá kỹ phim chụp mạch và lên kế hoạch các kỹ thuật sẽ dùng. Về logistic của đơn vị can thiệp, nên có một ngày dành riêng cho can thiệp CTO để đề phòng trường hợp thủ thuật kéo dài có thể ảnh hưởng đến các ca thường quy khác, điều này còn phụ thuộc vào quy mô và khả năng của từng đơn vị can thiệp..
Đánh giá phim chụp mạch:Giúp lên kế hoạch can thiệp chi tiết, tốt nhất có thể tổ chức hội chẩn, lên chiến lược phù hợp
Chụp MSCT động mạch vành trước thủ thuật can thiệp:Trong nhiều trường hợp là cần thiết để xác định chiều dài tổn thương, mức độ vôi hóa, tuần hoàn bàng hệ… giúp cho việc lên chiến lược can thiệp.
Đường vào mạch máu:Hầu hết các bác sĩ chuyên gia can thiệp CTO sử dụng đường vào động mạch đùi hai bên và dùng guiding catheter 7-8Fr để tối ưu hoá không gian cho dụng cụ. Nhiều bác sĩ sử dụng Sheath dài (Long Sheath 8Fr (45 cm)) để tăng cường hỗ trợ cho guiding catheter. Đường vào mạch quay có thể sử dụng được, tuy nhiên đường kính guiding sẽ bị hạn chế hơn. Mặc dù vậy, trong quá trình lên chiến lược can thiệp, nếu xác định không có kế hoạch can thiệp ngược dòng, hoặc can thiệp ngược dòng không khả thi, thì động mạch quay là một đường vào hợp lý để chụp đánh giá tuần hoàn bàng hệ. Hiện nay bên cạnh các Sheath quay 6rF truyền thống, cũng có một vài loại Sheath quay có thể nâng cấp cỡ guiding lên 7Fr giúp tạo thuận hơn nếu bác sĩ can thiệp quyết định can thiệp qua đường động mạch
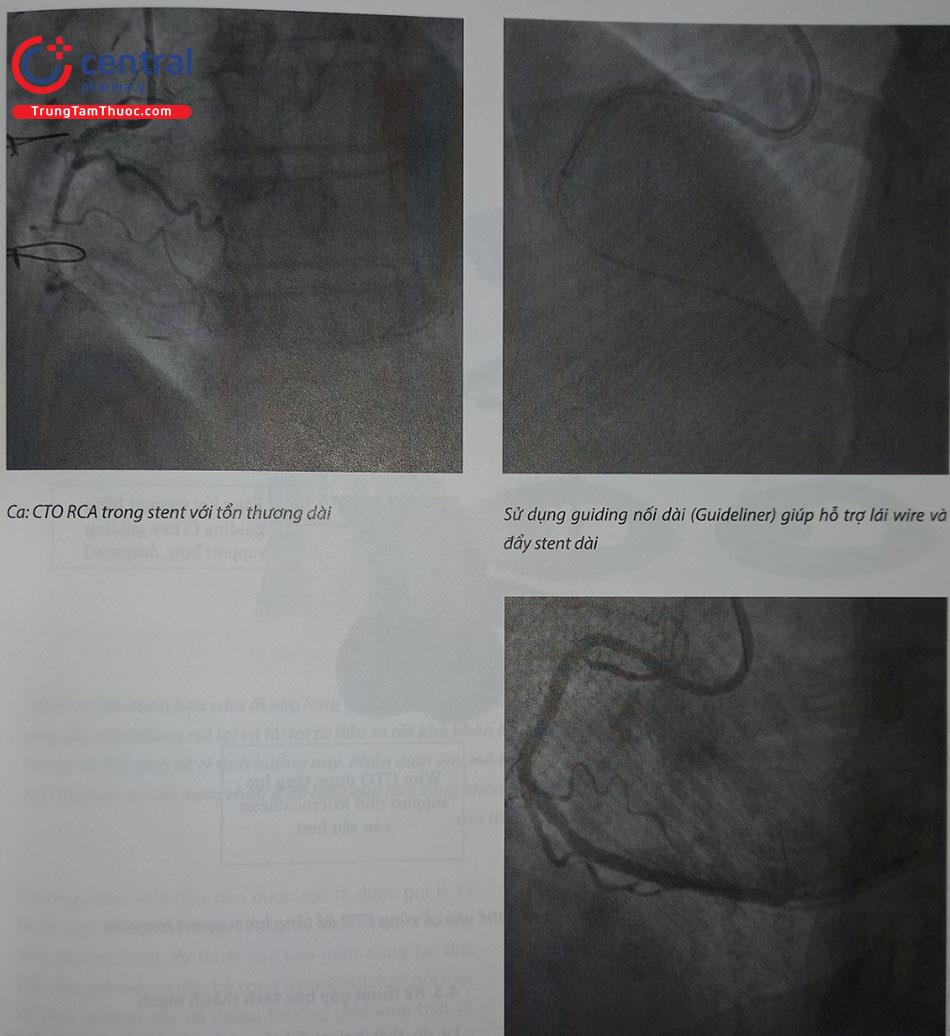
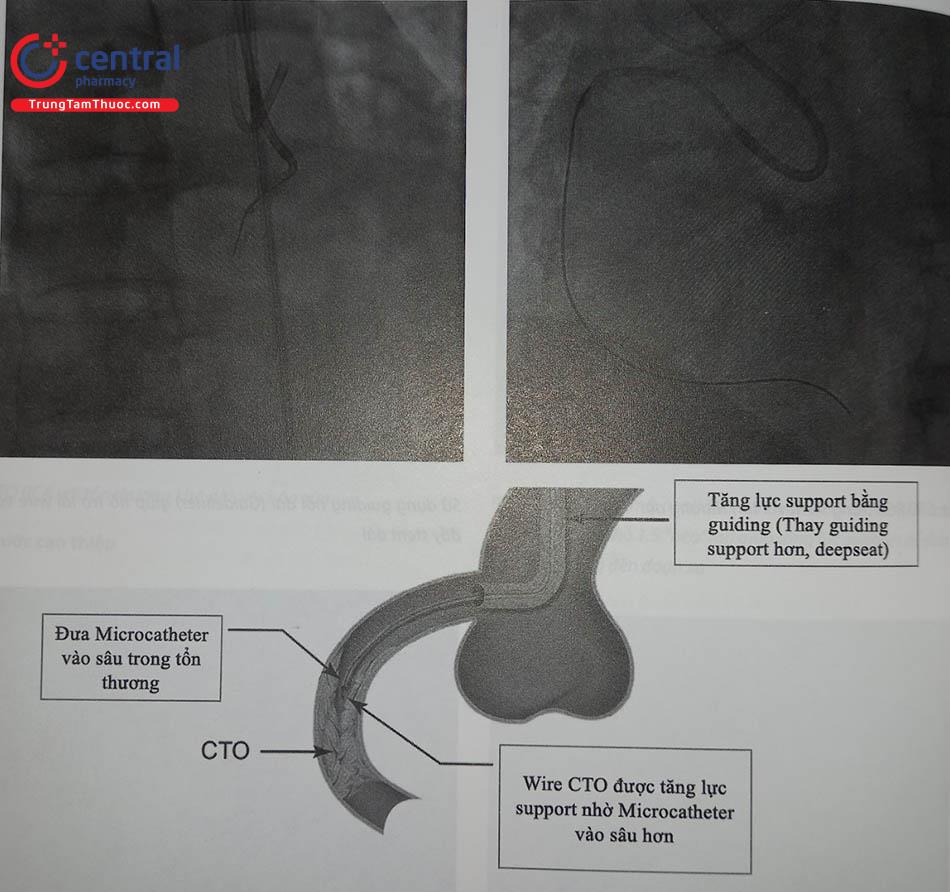
Guiding catheter:Guiding lớn (ví dụ: 7Fr và 8Fr) hỗ trợ tốt hơn và cho phép đưa vào gần như tất cả các loại dụng cụ can thiệp CTO. Các loại guiding được sử dụng nên có lực hỗ trợ tốt, phổ biến nhất là AL0.75 và AL1.0 cho động mạch vành phải (RCA), XB 5 hoặc EBU 3.5; 3.75 cho động mạch vành trái. Trong một số trường hợp, sẽ cần phải sử dụng guiding có lỗ bên (chẳng hạn LM hoặc tổn thương lỗ vào) guiding có lỗ bên có thể giúp áp lực không tụt trong quá trình can thiệp, nhưng thực tế có thể gây cảm giác an toàn giả tạo khi đưa vào động mạch vành do đôi khi dòng chảy qua các lỗ bên là không đủ để tưới máu động mạch vành. Luôn cần nhớ là đục lỗ bên không phải biện pháp ngăn ngừa được lóc tách lỗ vào động mạch vành, đục lỗ bên cũng cần bác sĩ can thiệp phải có kinh nghiệm, nếu không có thể dễ dàng gây hỏng guiding hoặc làm ảnh hưởng đến việc đưa đẩy dụng cụ về sau. Các kỹ thuật để tăng cường hỗ trợ cho guiding, chẳng hạn như dùng guiding kéo dài (Guideliner [5-8Fr] hoặc Guidezilla 6Fr) hoặc neo nhánh bên (side-branch anchoring), cũng là các kỹ thuật bác sĩ can thiệp cần thành thạo trong PCI CTO
Chống đông:Thuốc kháng tiểu cầu kép, Statin và các thuốc điều trị nội khoa khác giống với các can thiệp thông thường khác. Heparin không phân đoạn nên được sử dụng cho can thiệp CTO vì nó có thể đảo ngược nếu xảy ra biến chứng. Nên sử dụng thuốc ức chế thụ thể Glycoprotein IIb/IIIa một cách dè dặt trong và sau PCI CTO vì nguy cơ thủng mạch vành do can thiệp.
Hạn chế thuốc cản quang/bức xạ:Các tham số này cần được xem xét trước khi thực hiện thủ thuật. Lượng thuốc cản quang chấp nhận được liên quan cụ thể đến nguy cơ bệnh thận do thuốc cản quang. Kinh nghiệm cho thấy là có thể theo dõi liều chiếu xạ và giới hạn tương đối cần được thiết lập trước khi thủ thuật được bắt đầu, và thủ thuật nên được dừng lại khi liều phát xạ đã vượt quá kế hoạch ban đầu để hạn chế nguy cơ cho cả bác sĩ và bệnh nhân.
3 Chụp động mạch vành và chuẩn bị dụng cụ trước can thiệp
3.1 Chụp động mạch vành trước can thiệp
Nên tách riêng thủ thuật chụp động mạch vành để chẩn đoán trước và lên kế hoạch cho PCI CTO (tiến hành can thiệp thường quy vào một ngày khác):
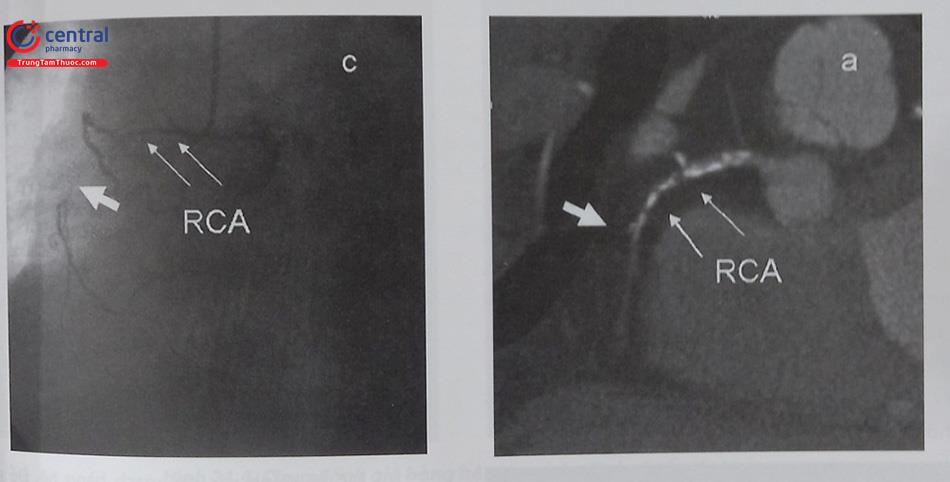
- Cần các góc chụp mô tả rõ ràng nhất đầu gần và xa cũng như hướng đi tốt nhất của CTO qua nhiều góc chụp khác nhau. Độ phóng đại cần cho thấy toàn bộ bóng tim, không bao gồm các cấu trúc ngoài tim và không di chuyển bàn trong cúp chụp. Thông thường, đầu gần của CTO nhánh liên thất trước (LAD) và nhánh mũ (LCX) quan sát tốt nhất khi chụp chếch chân nghiêng phải, chếch đầu, Spiderview. Đầu gần CTO của RCA quan sát tốt nhất ở cúp chụp nghiêng trái, bốn buồng và nghiêng phải (xin xem thêm chương chụp động mạch vành qua da).
- Mạch máu đoạn xa cấp máu bởi tuần hoàn bàng hệ cũng cần được quan sát cẩn thận dưới góc độ phù hợp. Ví dụ, khi chụp RCA để đánh giá bàng hệ trong CTO nhánh LAD, cần chụp bổ sung nghiêng phải chếch đầu hoặc nghiêng phải để quan sát bàng hệ của LAD, các góc chụp này là cần thiết để đánh giá kỹ bàng hệ, đề phòng trường hợp cần can thiệp ngược dòng.
- Mô tả chính xác các mạch bàng hệ. Để rõ ràng nhất, cúp chụp mạch vành nên được thực hiện bằng cách sử dụng một trường đủ lớn để quan sát đầy đủ các mạch máu bàng hệ mà không cần di chuyển bàn. Chọn góc độ phù hợp để hiển thị mạch bàng hệ cũng rất quan trọng. Đối với các nhánh vách bất kể chúng đi từ LAD đến PDA hay ngược lại, cúp chụp nghiêng phải hoặc nghiêng phải chếch đầu 30 độ sẽ cho hình ảnh rõ nhất về đường đi của bàng hệ và các góc của mạch máu.
(Nguồn: Viện Tim mạch Việt Nam)
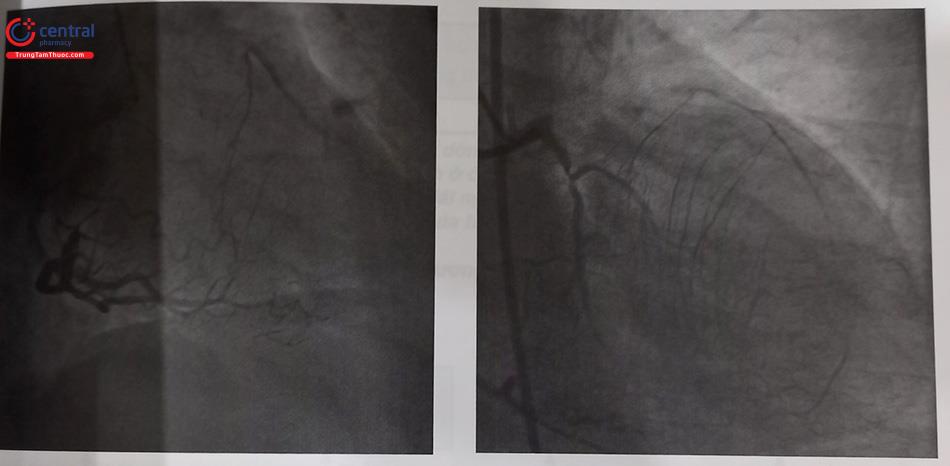
(Nguồn: Viện Tim mạch Việt Nam)
3.2 Chụp mạch vành khi bắt đầu thủ thuật PCI CTO
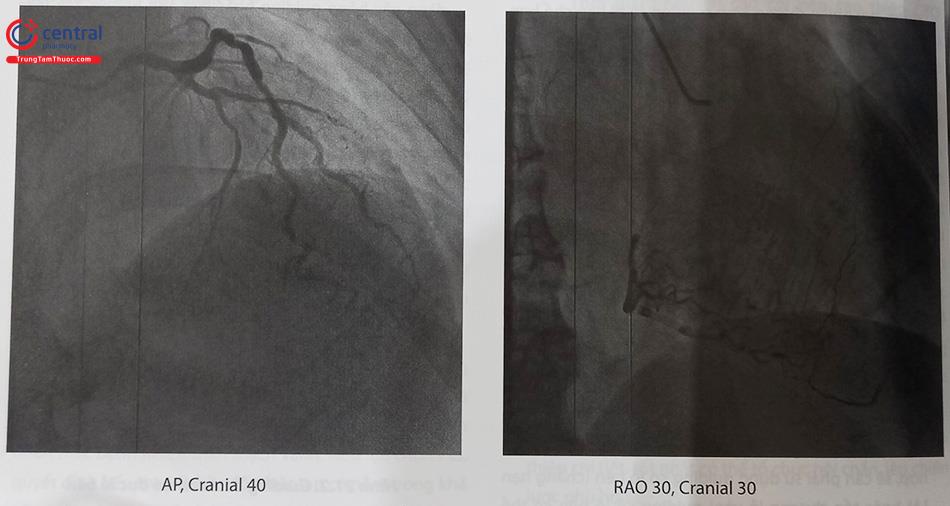
Nên chụp cả hai bên khi bắt đầu can thiệp CTO. Chụp hai bên nên được áp dụng trong hầu hết các trường hợp can thiệp CTO trừ khi bàng hệ tự thân là chính. Nên tiêm cản quang hai lần, tiêm ngược dòng trước sau đó 2-3 giây tiêm xuôi dòng. Những cúp chụp này sẽ khẳng định lại chiến lược được chọn khi lên kế hoạch trước đó có phù hợp với giải phẫu CTO hay không. Thông thường, chiều dài CTO sẽ ngắn hơn so với đánh giá ban đầu khi chụp mạch vành đơn thuần và không hiếm trường hợp tìm thấy một kênh rất nhỏ khi chụp cả hai bên, điều này tạo thuận lợi cho việc lái wire qua và can thiệp đặt stent.
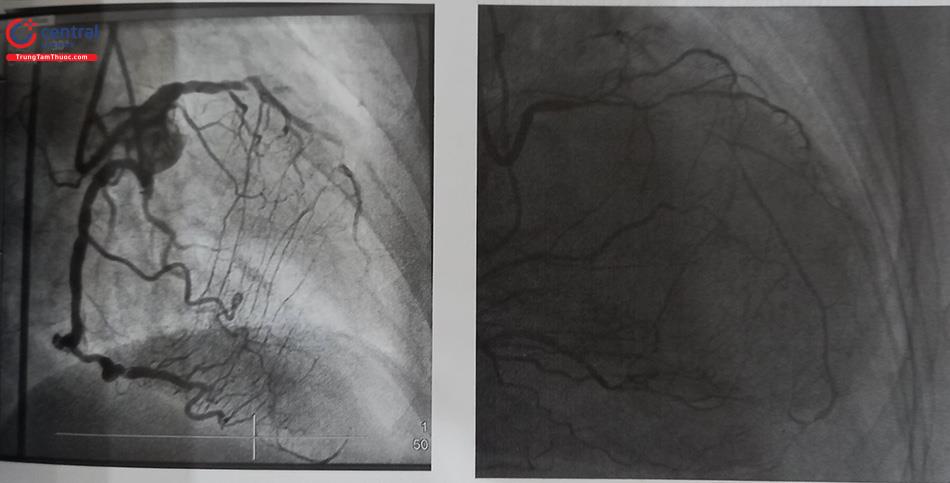
(Nguồn: Viện Tim mạch Việt Nam)
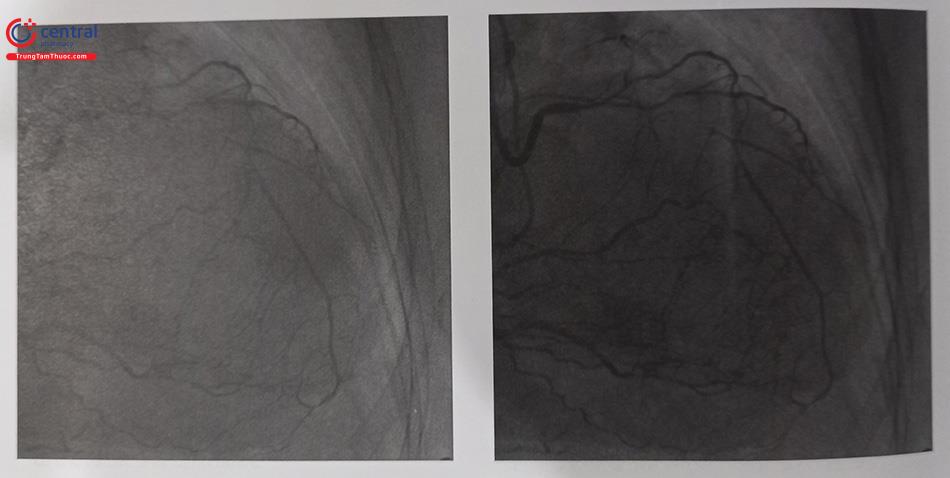
(Nguồn: Viện Tim mạch Việt Nam)
3.3 Tiếp cận một tổn thương CTO sau khi quyết định can thiệp
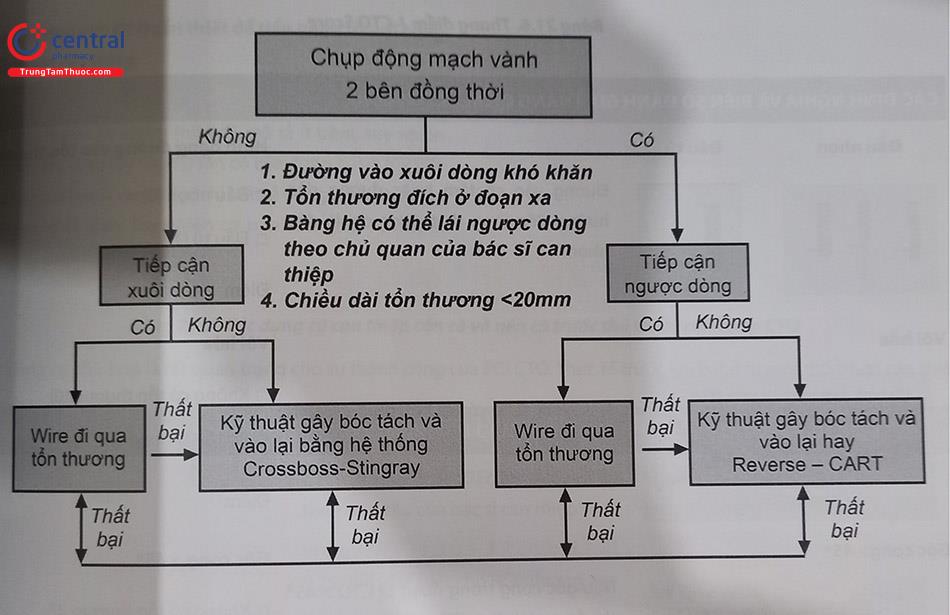
Có nhiều cách tiếp cận một tổn thương CTO để can thiệp, trong đó tiếp cận “hybrid” là phổ biến nhất hiện nay để can thiệp CTO một cách an toàn và hiệu quả nhất dựa trên đặc điểm của phim chụp mạch vành. Đây là phương pháp tiếp cận thường được sử dụng tại các nước châu Âu và Hoa Kỳ. Các bác sĩ Nhật Bản thường có nhiều cách tiếp cận mang tính cá nhân hóa cao hơn.
Để có thể thực hiện phương pháp này đòi hỏi bác sĩ can thiệp đã có kinh nghiệm với tất cả các kỹ thuật can thiệp CTO, trường hợp bác sĩ chưa đủ kinh nghiệm, nên hội chẩn và đôi khi cần tham vấn các bác sĩ có kinh nghiệm hơn về can thiệp CTO. Dựa trên cách tiếp cận hybrid (Hình 21.7), can thiệp xuôi dòng (Antegrade) được lựa chọn là cách tiếp cận ban đầu trong các đoạn tắc ngắn (< 20 mm). Cách tiếp cận bóc tách/vào lại được ưu tiên đối với các tổn thương dài (>20 mm) nếu có đoạn xa tương đối tốt, lòng mạch ít tổn thương và đầu xa không nằm ở chỗ chia nhánh. Cuối cùng, cách tiếp cận ngược dòng được ưu tiên đối với các tổn thương đầu gần không rõ mấu, mạch đoạn xa kém, hoặc đầu gần ở vị trí chia nhánh lớn và các mạch bàng hệ tốt. Khuyến cáo thay đổi chiến lược sớm nếu chiến lược ban đầu không tiến triển trong một khoảng thời gian nhất định.
Tại Việt Nam, các bác sĩ can thiệp thường có xu hướng tiếp cận theo hướng xuôi dòng, nếu không thành công sẽ tiếp cận theo hướng ngược dòng, phù hợp với lược đồ “hybrid” như trên. Do sự thiếu hụt của nhiều trang bị (chẳng hạn như hệ thống Crossboss-Stingray), việc can thiệp ngược dòng hay kỹ thuật bóc tách, vào lại còn chưa thực sự phổ biến tại Việt Nam.
Trong thời gian gần đây, để đánh giá một thương tổn CTO là dễ thực hiện hay khó thực hiện, bên cạnh thang điểm PROGRESS CTO như đã mô tả ở trên. Các bác sĩ người Nhật đã đề xuất thang điểm J-CTO score. Là một công cụ lượng giá trực quan và dễ áp dụng trên lâm sàng để giúp đánh giá tổn thương CTO là dễ hay khó. Trong đó J-CTO 0 điểm là dễ, 1 điểm là mức độ khó trung bình, 2 điểm là mức độ khó và 3 điểm là mức độ rất khó.
Bảng 21.6. Thang điểm J-CTO Score

Chú thích: CTO: Mạch vành tắc hoàn toàn mạn tính
3.4 Các dụng cụ CTO cần thiết để tiến hành thành công thủ thuật can thiệp
Dụng cụ can thiệp động mạch vành tắc mạn tính (CTO) có thể chia thành 10 nhóm (như đã mô tả ở trên), tuy nhiên thực tế lâm sàng tùy vào sự sẵn có của dụng cụ và tùy vào yêu cầu của bác sĩ can thiệp, chi tiết về dụng cụ có thể thay đổi theo thời gian. Tuy nhiên cơ bản bao gồm 10 nhóm dụng cụ dưới đây:
Bảng 21.7. Các dụng cụ can thiệp cần có và nên có trước thủ thuật can thiệp CTO
Các công cụ phù hợp là rất quan trọng cho sự thành công của PCI CTO. Thực tế trước khi bắt đầu một thủ thuật can thiệp
| NHÓM | DỤNG CỤ | DỤNG CỤ CẦN CÓ | DỤNG CỤ NÊN CÓ |
|---|---|---|---|
| 1 | Sheath | Các loại Sheath 6Fr, 7Fr, 8Fr quay và đùi theo nhu cầu của bác sĩ can thiệp |
Sheath dài (45cm) Slender Sheath 7Fr để đi quay 7Fr |
| 2 | Guiding và các phụ kiện liên quan đến guiding |
Ví dụ: XB/EBU 3.0, 3.5, 3.75, 4.0; AL1, AL.75; JR4 (đặc biệt cho RCA đường vào mạch quay) Phụ kiện: Đầu nối chữ Y kèm van huyết động guiding nối dài (Guideliner, Guidezilla) |
Guiding có lỗ bên (side-holes) Sheathless guiding |
| 3 | Microcatheter |
Ví dụ: Caravelle; Finecross (150cm cho ngược dòng, 135 cm cho xuôi dòng); Corsair hoặc Turnpike (150 cm cho ngược dòng, 135 cm cho xuôi dòng); bóng OTW nhỏ (đường kính 1.2-1.25-1.5 mm) và dài (≥145 cm); Twinpass, Crusade, Sasuke(microcatheter 2 lòng) |
Các loại khác (Venture, Turnpike spiral, SuperCross, MultiCross, CenterCross, Prodigy, NovaCross) |
| 4 | Dây dẫn (guide wire) CTO |
Wire CTO phủ polymer, lực đầu wire (tipload) thấp, đầu thuôn nhỏ. Ví dụ: Fielder XT-A, Fielder XT-R, Fielder XT, Fielder FC Wire CTO đâm xuyên tốt. Ví dụ: Confianza pro 12, Conquest Pro 20 Wire CTO tipload trung bình, ngậm nước. Ví dụ: Pilot 200 Wire CTO linh hoạt. Ví dụ: Gaia 1st, 2nd, 3rd, Gaia Next 1st, 2nd, 3rd Wire ngược dòng. Ví dụ: Asahi, Sion Blue, Fielder XT-R, SUOHO3. Wire dài 300mm để can thiệp ngược dòng. Ví dụ: RG3, R350 |
Wire CTO khác như Ultimate 3, Hornet 14 và 10, Asato 20, Miracle 6 và 12… |
| 5 | Dụng cụ bóc tách, vào lại Dissection/Reentry |
Các loại wire (như trên) để tạo Knuckled khi cần Bóng Crossboss (bóc tách có kiểm soát) Bóng Stingray (tạo bàn đạp để vào lại lòng mạch) Dây Stingray (để vào lại lòng mạch) |
|
| 6 | Thòng lọng (snare) |
Ví dụ: Ensnare, Atrieve 18-30 mm hoặc 27-45 mm |
Thòng lọng Amplatz Gooseneck |
| 7 | Dụng cụ cho tổn thương không xuyên qua hoặc không nong được bằng bóng |
Bóng OTW nhỏ dài 20 mm, catheter RX, catheter bóng Catheter Threader, catheter Tornus Laser Dụng cụ khoan cắt mảng xơ vữa (Rotablator) Turnpike Spiral |
Angiosculpt |
| 8 | Chẩn đoán hình ảnh nội mạch | Siêu âm trong lòng mạch (IVUS) | IVUS (solid state) OCT |
| 9 | Dụng cụ xử lý biến chứng |
Stent có màng bọc (covered stent) Bộ dụng cụ chọc dịch màng ngoài tim Các loại coil hoặc vi hạt để xử lý thủng IABP, ECMO, Impella |
|
| 10 | Thiết bị bảo hộ chiếu xạ | Áo chì, kính chắn tia để đảm bảo an toàn khi thủ thuật kéo dài |
Khiên chắn tia xạ Máy x-quang giảm thiểu tia xạ. |
CTO, câu hỏi đặt ra trong đầu bác sĩ can thiệp luôn là: “Can thiệp này dễ hay khó?”; “Cần những dụng cụ gì cho can thiệp này?”. Đối với can thiệp CTO, các câu hỏi này thường là rất khó khăn để trả lời do không thể biết chắc chắn một can thiệp CTO sẽ diễn ra như thế nào, ngay cả với các bác sĩ can thiệp kinh nghiệm nhất.
Một cách trực quan, đơn giản và dễ nhớ thiết bị có thể được chia thành 10 nhóm: (1) (sheath), (2) Guiding, (3) microcatheter, (4) Guidewire, (5) thiết bị bóc tách/vào lại, thòng lọng (snare), (7) dụng cụ cho tổn thương không xuyên qua được hoặc không nong được bằng bóng, (8) thiết bị thăm dò hình ảnh nội mạch (như IVUS), (9) thiết bị để kiểm soát các biến chứng và (10) Thiết bị để giảm thiểu phơi nhiễm bức xạ của người can thiệp. Đây chỉ là một số trang thiết bị “gợi ý” cho một thủ thuật can thiệp CTO thành công, việc chuẩn bị dụng cụ trên thực tế cần có sự phối hợp nhịp nhàng giữa bác sĩ và nhân viên đơn vị tim mạch can thiệp, cũng như phụ thuộc tình hinh phân phối thực tế của dụng cụ can thiệp tại cơ sở thực hành và kinh nghiệm cá nhân của bác sĩ can thiệp 10 nhóm này đã bao gồm các thiết bị cần thiết cho lái wire xuôi dòng và kỹ thuật gây bóc tách/vào lại xuôi dòng và phương pháp tiếp cận ngược dòng. Guiding hỗ trợ rất quan trọng và được sử dụng thường xuyên để tiếp cận xuôi dòng và khi cần phải can thiệp ngược dòng. Các bác sĩ CTO có kinh nghiệm đều chia sẻ về guiding hỗ trợ tốt là “chìa khóa” giúp can thiệp CTO thành công.
Tuy nhiên, dây dẫn (guidewire) CTO lại là thiết bị được quan tâm nhất trước thủ thuật CTO. Có rất nhiều guidewire CTO của các hãng khác nhau. Bên cạnh dây dẫn để can thiệp các ca thông thường, cần thiết với mọi thủ thuật can thiệp. Dây dẫn can thiệp CTO có những đặc trưng riêng như có thể chia thành ưa nước (có phủ bôi trơn) và không ưa nước (không phủ bôi trơn). Mỗi dây có đặc tính riêng về tính linh hoạt, khả năng dẫn đường, khả năng truyền mô-men xoắn (hoặc khả năng điều khiển), độ bôi trơn (hoặc tính ưa nước), hỗ trợ trục, tipload hoặc sức mạnh của đầu dây, khả năng co giãn của đầu wire, khả năng cản quang trên màn tăng sáng, khả năng uốn và nhớ hình của đầu wire, độ nhọn và độ dày của đầu, và phản hồi khi đi qua tổn thương. Bác sĩ can thiệp nên làm quen với các thuộc tính của từng wire áp dụng trên một tổn thương để có thể lên kế hoạch dùng wire. Nhìn chung, dù có rất nhiều loại wire CTO khác nhau, thủ thuật viên có thể chỉ cần quen thuộc và thành thạo với khoảng 3 đến 4 loại wire thường dùng nhất. Cần lưu ý là nhiều khi wire CTO sẽ không sẵn có nếu không được bác sĩ can thiệp yêu cầu.
Các kỹ thuật xuôi dòng và ngược dòng thường sử dụng một microcatheter cho phép thay dây dẫn dễ dàng, tăng cường hỗ trợ guidewire, giúp điều chỉnh được tipload cho phù hợp và tạo điều kiện cho chuyển động của đầu wire. Có thể bóc tách xuôi dòng bằng một wire knucked hoặc với catheter CrossBoss, và có thể tạo điều kiện cho vào lại xuôi dòng bằng cách sử dụng hệ thống Stingray (Boston Scientific, Natick, MA) được mô tả dưới đây. Các guidewire và microcatheter khác nhau cần cho phương pháp ngược dòng, trong khi bóng nhỏ, laser và kĩ thuật khoan cắt mảng xơ vữa (atherectomy) thường rất cần cho tổn thương không xuyên qua hoặc không nong được bằng bóng. Siêu âm trong lòng mạch có thể hỗ trợ quá trình đi qua CTO và tối ưu hóa stent. Cần chuẩn bị sẵn stent có màng bọc và coil (covered) để xử lí nếu có biến chứng trong quá trình can thiệp. Trên thực tế, dễ nhất là đặt tất cả các thiết bị PCI CTO vào một khu vực duy nhất giúp tiếp cận các thiết bị này một cách thông suốt trong suốt quy trình, do chúng hiếm khi được sử dụng cho tổn thương không phải CTO.
4 Kỹ thuật tiếp cận cơ bản
4.1 Cách tiếp cận lái wire xuôi dòng trong lòng mạch (Antegrade Approach)
Phương pháp lái wire nội mạch (trong lòng mạch, xuyên qua CTO) là kỹ thuật xuyên qua CTO được sử dụng phổ biến nhất và tốt nhất cho các đoạn CTO ngắn (<20 mm) hoặc đoạn tắc có các microchannel nhỏ (CTO chức năng). Lái wire xuôi dòng có thể được chia thành bảy bước chính như sau:
Bước một, một microcatheter được chọn để đưa dây dẫn. Hiện nay microcatheter được sử dụng nhiều hơn so với bóng OTW (over-the-wire balloon) (bóng OTW hầu như không còn được sử dụng cho mục đích hỗ trợ dây dẫn CTO). Microcatheter đa số linh hoạt hơn, ít bị xoắn hơn, đặc biệt là khi thay dây dẫn, và có khả năng cản quang rõ trên màn tăng sáng.
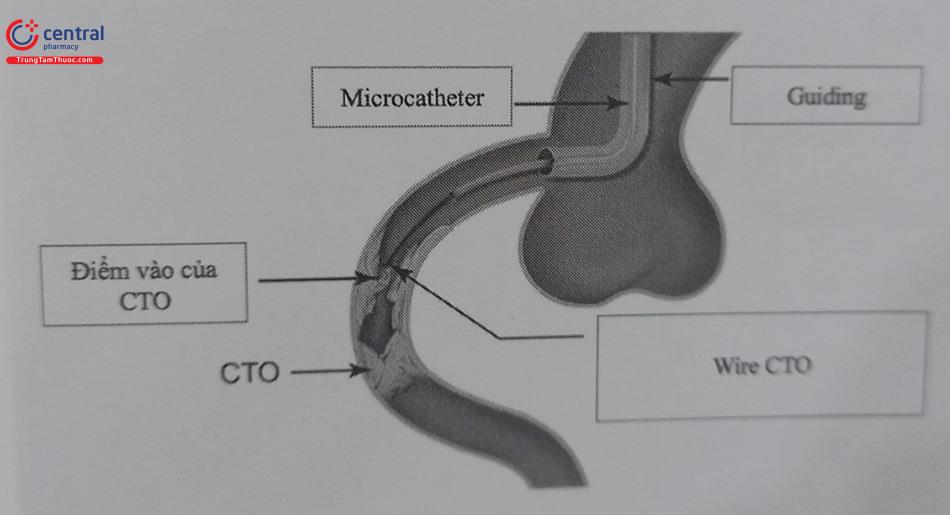
Bước thứ hai, microcatheter được đưa tới đầu gần của CTO bằng một dây guidewire thông thường (workhorse guidewire, như runthrough, sion, BMW…) để giảm nguy cơ tổn thương mạch máu mục tiêu phía gần của đoạn tắc.
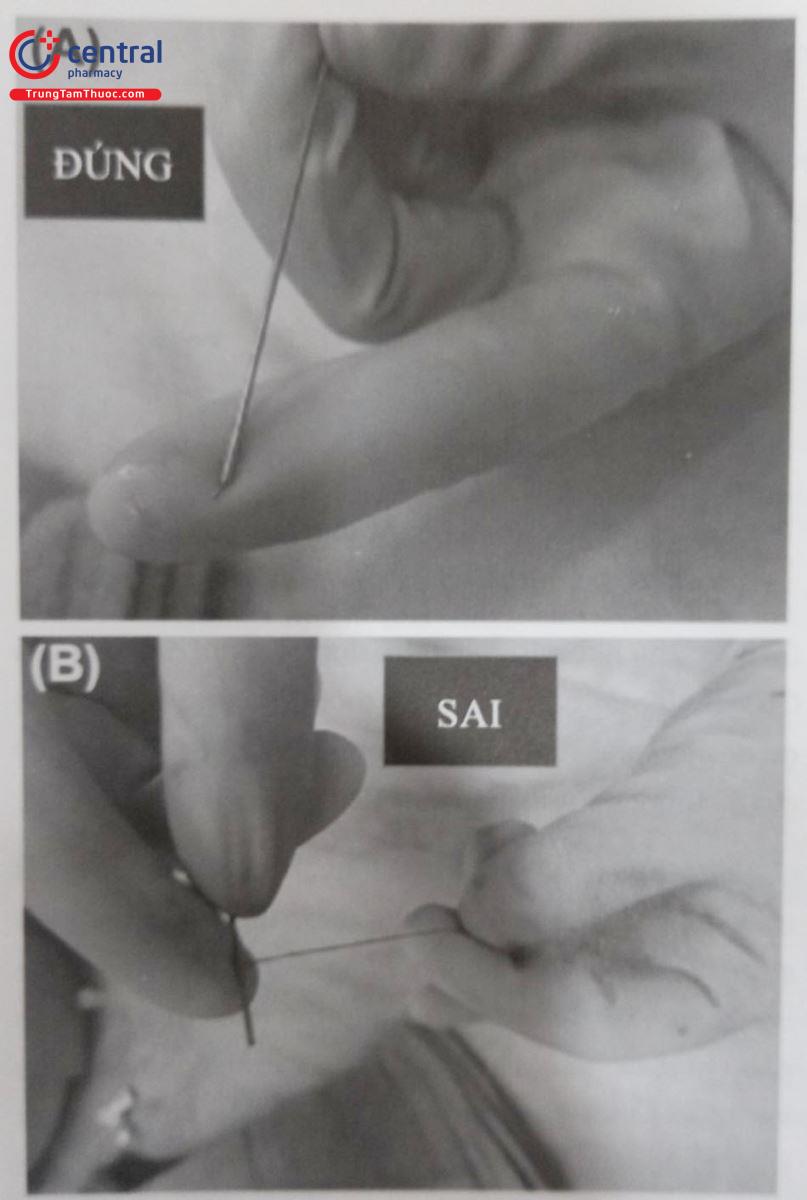
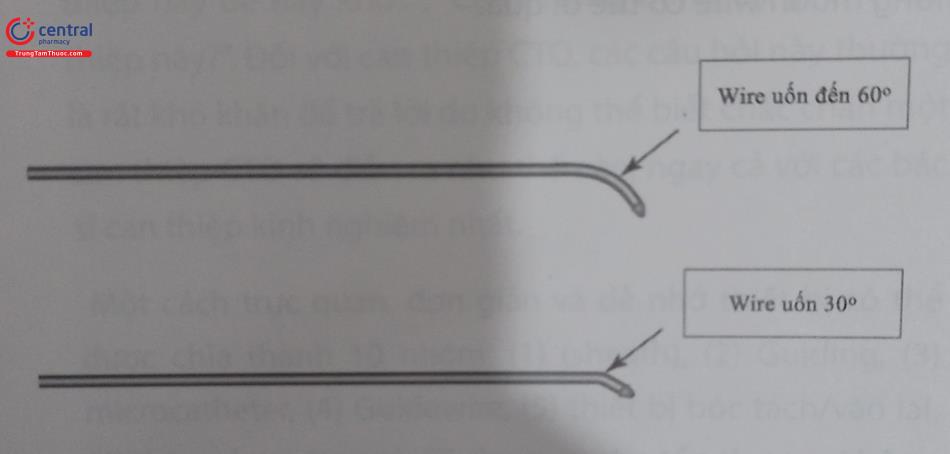
Bước thứ ba, uốn wire CTO (ngoại trừ một số wire như Gaia được uốn sẵn). Guidewire được uốn cong tùy theo định hình của tổn thương bằng introducer hoặc que uốn wire. Việc uốn wire CTO như thế nào cũng dựa vào phần nhiều kinh nghiệm của bác sĩ can thiệp, thông qua introducer thông thường wire có thể uốn khá dễ dàng theo hình dạng mà bác sĩ can thiệp mong muốn. Điểm uốn thứ nhất (curve 1) của wire là tương đối quan trọng vì khác với những suy nghĩ thông thường là wire sẽ “đâm xuyên” qua tổn thương, curve số 1 sẽ giúp wire “lách” được qua tổn thương và đây sẽ là cách mà đa số bác sĩ can thiệp mong muốn wire có thể đi
Bước thứ tư, Guidewire CTO đã được uốn được chọn để xuyên qua CTO thay thế cho dây dẫn chính. Nhiều trường phái can thiệp thường bắt đầu bằng guidewire bọc polymer mềm, đầu thuôn (như Fielder XT, Asahi Intecc, Tokyo). Nếu wire này không xuyên qua được và đường đi của đoạn mạch CTO đã rõ, cần thay một dây dẫn cứng hơn, có khả năng xoay tốt, đầu thuôn (như Gaia 2nd, Asa- hi Intecc), trong khi nếu tính chất đoạn tắc không rõ ràng thì dùng wire có vỏ bọc polymer cứng hơn (như Pilot 200, Asahi Intecc). Đối với đầu đoạn tắc bị vôi hóa nặng, dây dẫn có khả năng đâm xuyên cao, chẳng hạn như Confianza Pro 12 (Asahi Intecc) hoặc Hornet 14 (Boston Scientific, Minneapolis, MN) có thể cho phép đi vào đoạn tắc sau đó có giảm độ cứng dây dẫn (“xuống thang”, dùng dây dẫn mềm hơn, có độ “lách” tốt hơn như Fielder XT-R, Fielder XT-A) để đi qua tổn thương.
Bước thứ năm, guidewire tiến dần đến đầu xa bằng các kỹ thuật như trượt, khoan hoặc đâm xuyên hoặc kết hợp các kĩ thuật trên. Trượt nghĩa là chuyển động về phía trước của đầu wire với kết cấu thuôn và bọc polymer, kết cấu này của wire giúp dò các kênh dẫn nhỏ trong CTO (Wire thường sử dụng như hệ Fielder XT, Fielder XT-R, Fielder XT-A). Khoan được thực hiện bằng cách xoay thông qua điều khiển theo cả hai hướng (giới hạn < 90° theo mỗi hướng). Đâm xuyên là đưa dây dẫn về phía trước có chủ đích (có điều hướng theo ý muốn của bác sĩ can thiệp), thường bằng một guidewire cứng (như Gaia 3 hoặc Confianza Pro2) nhằm mục đích đâm xuyên qua tổn thương. Động tác “trượt” wire và “khoan” thường được sử dụng hơn do ít có khả năng nguy hiểm so với động tác đâm xuyên bằng wire cứng.
(Nguồn: Viện Tim mạch Việt Nam)
Bước thứ sáu, vị trí guidewire được đánh giá bằng chụp mạch vành để xác định thao tác tối ưu tiếp theo, thường sử dụng catheter để chụp cản quang đối bên hoặc đôi khi tiêm hai bên. Tiêm cản quang đối bên được ưu tiên để lái dây dẫn xuôi dòng khi đầu gần của tổn thương CTO đã được xuyên Nên tránh bơm cản quang xuôi dòng quá mạnh khi can thiệp xuôi dòng vì nó có thể gây tách thành mạch máu dọc theo đường đi dây dẫn và khiến thủ thuật thất bại. Bơm cản quang xuôi dòng có thể gây thủng lành tính do dây dẫn, thành biến chứng thủng không kiểm soát được, nếu thao tác kiểm soát không tốt. Nếu dùng bơm tiêm cản quang tự động (thường gặp ở các nước phát triển hơn là Việt Nam) thì chỉ nên dùng đối với bơm ngược dòng. Nhìn chung nên có chiến lược kiểm soát cả lực chụp cản quang và lượng cản quang chụp một cách tối thiểu nhất có thể được.
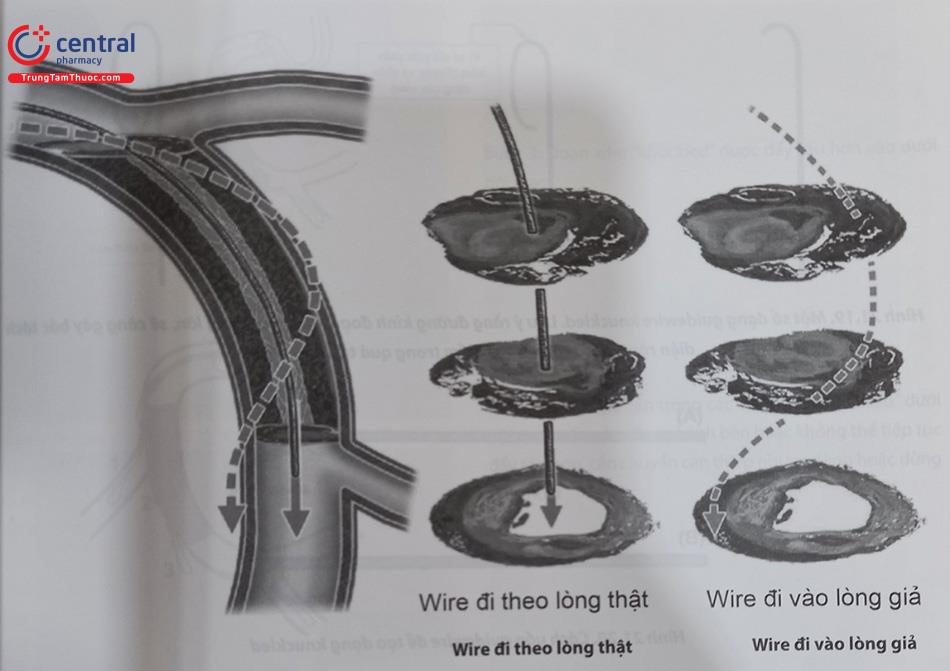
Đến đây có 3 trường hợp xảy ra về vị trí của wire: (a) thực sự đi vào lòng mạch đầu xa, (b) đi vào dưới nội mạc (c) đi chệch đường (đây là trường hợp có thể gây thủng mạch). Vị trí wire được đánh giá dễ dàng nhất bằng cách chụp bàng hệ. Đánh giá vị trí chính xác rất quan trọng bởi vì guidewire chọc thủng mạch hầu như không gây nguy hiểm, nhưng khi microcatheter hoặc bóng lớn hơn đi qua có thể dẫn đến thủng lớn và chèn ép tim cấp.
Bước thứ bảy, nếu dây dẫn thực sự đi vào lòng mạch đầu xa, nong mạch vành và đặt stent được thực hiện giống can thiệp tổn thương không CTO. Nếu wire đi vào dưới lớp áo trong, nó có thể được chuyển hướng vào lòng mạch thực sự ở đầu xa hoặc có thể đưa vào một dây dẫn thứ hai bằng cách sử dụng kỹ thuật “wire song song” (Hình 14A),hoặc đôi khi bằng một catheter hai nòng, như TwinPass (Vascular Solutions, Minneapolis, MN)(Hình 21.14B).Ngoài ra có thể sử dụng hệ thống vào lại chuyên dụng (hiện đang được ưa dùng bởi hầu hết các bác sĩ can thiệp nơi sản phẩm có sẵn) (Dây dẫn và bóng Stingray; Boston Scientific).
Nếu phát hiện wire đi chệch đường (nguy cơ thủng mạch), cần rút lại một cách từ từ , không nên đưa microcatheter đi theo dây dẫn và bắt đầu lái lại từ đầu, chú ý biến chứng tràn dịch màng tim.
Lái wire xuôi dòng đòi hỏi nhiều kinh nghiệm của bác sĩ can thiệp. Đôi khi, một bóng không thể đi qua CTO sau khi wire đã đi qua đoạn tắc hoàn toàn (tiếp cận nội mảng xơ vữa). Nhiều phương pháp và thiết bị khắc phục vấn đề này đã được mô tả. Một vài thiết bị là Tornus (Asahi Intec, Tokyo, Nhật Bản), Turnpike Spiral (Vessel Solutions, Minneapolis, MN), phẫu thuật khoan phá mảng xơ vữa hoặc laser. Tuy nhiên, phẫu thuật khoan phá mảng xơ vữa đòi hỏi phải đổi wire CTO bằng Rotawire, điều này có thể đặc biệt khó khăn và đôi khi không thể đi qua được đoạn tắc. Người đọc tham khảo các văn bản được liệt kê ở cuối chương để được mô tả đầy đủ hơn.
J-CTO Score được sử dụng để ước tính độ khó của việc đưa guidewire đến lòng thật phía đầu xa trong vòng 30 phút. Năm yếu tố dự đoán việc đưa dây qua trong vòng 30 phút và có thể hữu ích cho bác sĩ can thiệp chưa kinh nghiệm trong việc ước lượng khó khăn về mặt kĩ thuật. Năm yếu tố (mỗi yếu tố tính 1 điểm) theo thang điểm J-CTO score (đã được mô tả ở trên) là (1) chiều dài tổn thương trên 20 mm; (2) độ gấp khúc (góc gập> 45O), (3) đầu gần tù, (4) vôi hóa dọc theo đoạn tắc và (5) số lần thử PCI thất bại trước đó. Một tổn thương loại dễ 0 điểm, khó vừa phải: 1-2 và khó >2.
Để exchange wire và microcatheter, đôi khi cần các loại bóng “trapping” để giữ nếu không muốn dùng wire can thiệp “dài” (VD: 300 mm). Ví dụ với guiding 7Fr, 8Fr sẽ cần bóng “trapping” 3.0 hoặc với guiding 6Fr là bóng 2.5. Không thể dùng kỹ thuật “trapping”đối với bóng OTW cho guiding 6Fr, bóng CrossBoss hay Stingray.
.jpg)
4.2 Một số vấn đề thường gặp khi lái wire xuôi dòng và cách xử trí
Không thể lái wire đến đoạn xa
4.2.1 Xử trí:
- Sử dụng Guiding support tốt hơn (chẳng hạn đổi từ JR sang AL, JL sang EBU…)
- Đưa microcatheter sát đầu gần tổn thương hơn để tăng lực wire support
- Sử dụng wire “cứng” hay “đâm xuyên” tốt hơn (nên hạn chế hoặc chỉ sử dụng nếu có kinh nghiệm do dễ có nguy cơ thủng mạch)
- Sử dụng kỹ thuật mỏ neo (“anchoring”).
- Kỹ thuật nong nhánh bên trước tổn thương (“open sesame technique”).
- Dùng guiding “mother – and – child” hoặc guiding nối dài.
- Sử dụng Crossboss-Stingray.
- Lái ngược dòng.
.jpg)
Wire đi vào dưới nội mạc
Xử trí:
- Dùng Stingray để đi vào lòng thật.
- Kỹ thuật STAR/LAST.
Wire không đi được qua tổn thương CTO
Xử trí:
- Thay wire khác.
- Tăng lực support (các biện pháp như trên).
4.3 Kỹ thuật gây bóc tách thành mạch
Lý do thất bại phổ biến nhất của kỹ thuật xuôi dòng (antegrade wire escalation) là dây đi vào dưới nội mạc. Ở những tổn thương phức tạp, đặc biệt là các tổn thương dài (>20 mm), xoắn vặn, vôi hóa, xác suất dây đi vào dưới nội mạc sẽ tăng theo. Kỹ thuật gây bóc tách và vào lại xuôi dòng (Antegrade dissection/reentry-ADR) có thể giải quyết tình huống này.
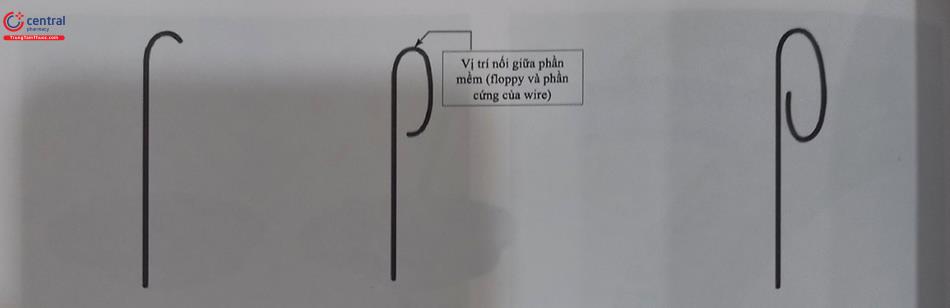
Phương pháp ADR đầu tiên được mô tả được gọi là kỹ thuật wire đi dưới nội mạc và vào lại (subintimal tracking and reentry-STAR). Kỹ thuật này bao gồm dùng lực đưa dây dẫn polymer có đầu bẻ cong (knuckled) dưới nội mạc về phía xa đoạn tắc để thông thương giữa lòng thật và lòng giả. Một biến thể của kỹ thuật STAR được gọi là kỹ thuật Carlino bao gồm việc bơm một lượng nhỏ chất cản quang trong quá trình thực hiện để bác sĩ can thiệp nhìn rõ đường. Hai kỹ thuật ADR khác là mini-STAR và gây bóc tách hạn chế và vào lại xuôi dòng (LAST) với mục đích đưa wire vào lại lòng mạch đầu xa đoạn tắc ở vị trí gần nhất. Trong kĩ thuật mini-STAR, vào lại bằng cách đưa đoạn knuckled dây ngậm nước (ví dụ, dây Fielder FC hoặc XT; Asahi Intecc) ngay sát đầu xa tổn thương và cố gắng vào lại, trong khi đó đối với LAST, vào lại bằng cách sử dụng một đầu dây cứng hơn như Pilot 200 (Abbott Vein) hoặc Confianza Pro 12 (Asahi Intecc) được uốn cong (45 đến 600) để đâm từ vị trí dưới lớp áo trong vào lòng mạch. Tuy nhiên tất cả các kỹ thuật này đều có hạn chế vì khó đoán được bản chất vùng vào lại đầu xa tổn thương. Kỹ thuật gây bóc tách và vào lại này có các outcome lâu dài tương đối hạn chế và được sử dụng như một kỹ thuật “cứu vãn’ nếu các kỹ thuật khác thất bại và bác sĩ can thiệp vẫn bảo lưu ý định can thiệp “xuôi dòng”.

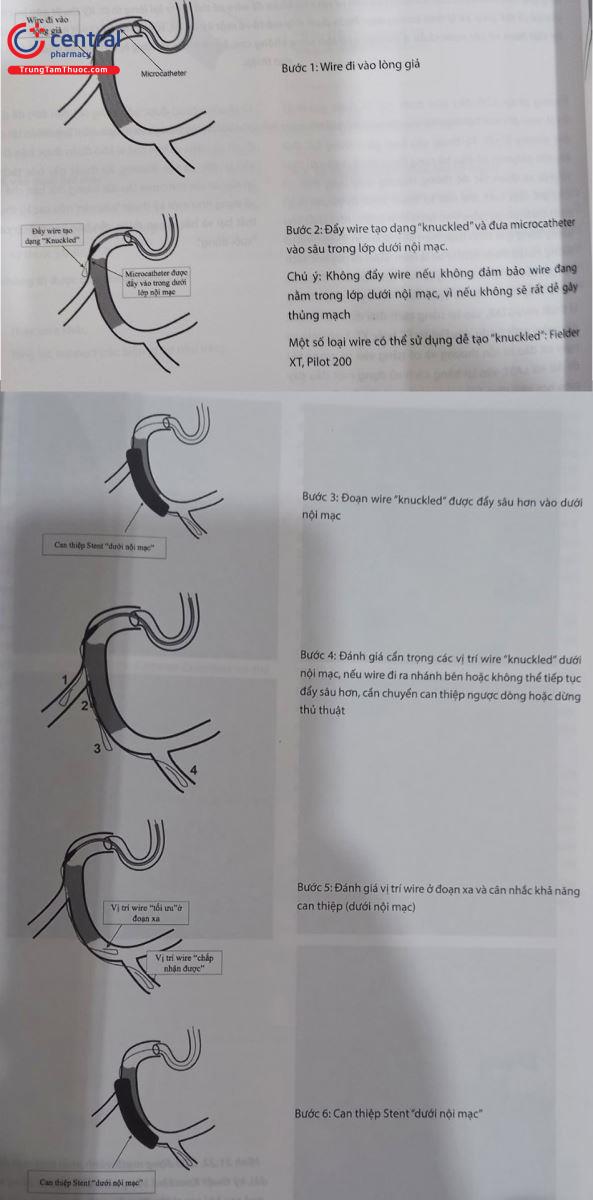
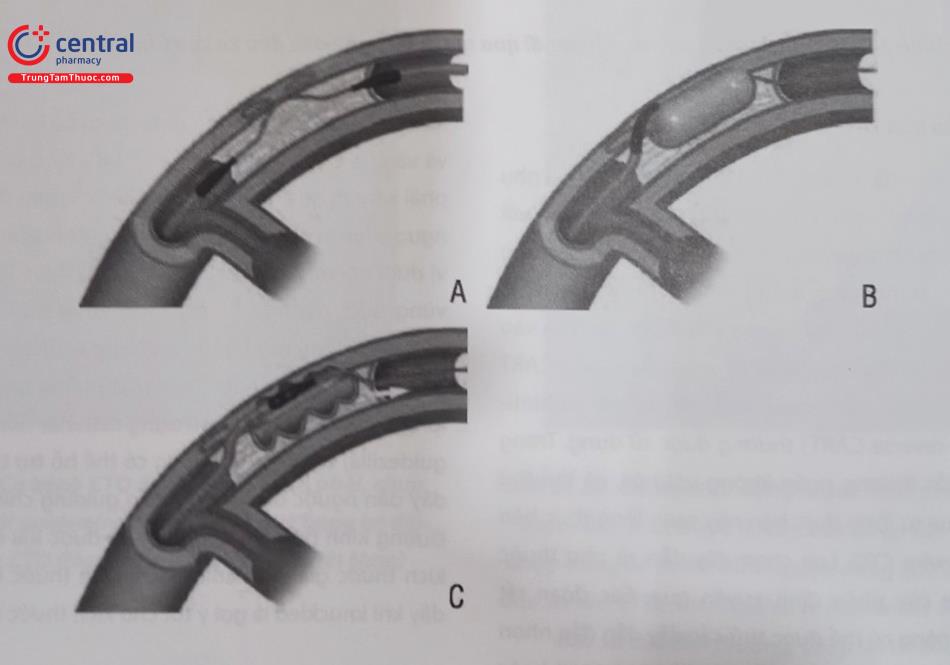
Hệ thống chuyên dụng cho kỹ thuật bóc tách và vào lại, đã được phê duyệt bởi Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ – FDA, đó là hệ thống StingRay (Boston Science, Minneapolis, MN). Với thiết bị này, điểm vào lại được kiểm soát chặt chẽ. Hệ thống này bao gồm catheter CrossBoss, được thiết kế để bóc tách có kiểm soát dưới lớp áo trong; bóng LP Stingray được đặt tại vị trí vào lại; và dây StingRay để vào lại lòng thật.
Catheter CrossBoss là một thiết bị bóc tách với đầu xa tròn làm bằng kim loại ngậm nước kích thước 1 mm. Khi catheter CrossBoss được quay nhanh (được gọi là kỹ thuật quay nhanh-fast spin), nó sẽ đi dọc dưới nội mạc và tự vào lại lòng mạch hoặc, thay vào đó, tạo ra một mặt phẳng bóc tách dưới nội mạc một cách có kiểm soát cho phép bóng Stingray đi qua (Hình 21.23). Catheter CrossBoss có thể xoay trong hầu hết các trường hợp mà không cần dây dẫn. Nếu đường đi của nó bị cản trở bởi lớp áo trong bị vôi hóa hoặc khúc cua gấp, một wire polymer mềm đầu thuôn có thể được đưa vào, knuckled và đẩy mạnh qua đoạn cản trở, sau đó có thể rút wire và tiếp tục đẩy catheter CrossBoss. Bóng Stingray có đường kính 2,5 mm, dài 10 mm, dẹt với hai lỗ thoát hai bên đối diện cách nhau 180 độ, và khi bơm căng (2-4 atm), một cổng thoát quay về phía lòng thật và một cổng quay ra xa lòng thật. Sự sắp xếp này cho phép một dây chuyên dụng (dây dẫn StingRay) đâm vào lòng thật đầu xa khi định hướng đến lỗ thoát thích hợp. Dây dẫn StingRay 0,014 inch có một ngạnh ở đầu để tạo điều kiện cho việc đâm thủng lòng giả để vào lòng thật. Sau khi dây dẫn “có vẻ’ được đưa vào lòng thật, dây StingRay có thể được đưa vào sau khi tiêm thuốc cản quang đối bên để xác nhận rằng dây nằm trong lòng thật. Sau đó, bóng StingRay được làm xẹp, rút ra và thay bằng catheter OTW để thực hiện nong và đặt stent cho tổn thương CTO. Ngoài ra, dây StingRay có thể được thu hồi sau khi đi từ lòng giả sang lòng thật và thay bằng một dây dễ điều khiển và ít gây tổn thương mạch máu, thường bọc polymer như Pilot 200 để đi dọc theo mạch máu (kĩ thuật “stick-and -swap). Do đó, một thủ thuật đích có thể được thực hiện để chọn vùng vào lại.
Tổn thương phù hợp để làm ADR là các đoạn tắc dài(> 20 mm) có mạch đoạn xa tốt để vào lại nằm cách xa các nhánh bên lớn; điều này rất quan trọng để tránh mất nhánh bên gây nhồi máu cơ tim đoạn xa trong quá trình can thiệp. Kỹ thuật ADR sẽ rất quan trọng khi kinh nghiệm làm CTO càng tăng lên, tuy nhiên việc sử dụng nên được cân nhắc kỹ lưỡng, do có nhiều nguy cơ và hiệu quả lâm sàng không cao.
Các kỹ thuật ADR tương đối an toàn, mặc dù chúng vẫn có nguy cơ gây thủng mạch 0,4% − 5,0%. Tắc nhánh bên làm tăng nguy cơ nhồi máu cơ tim do can thiệp với ST chênh lên nếu không có tuần hoàn bàng hệ phát triển tốt đến vùng tưới máu cơ tim. Bóc tách/vào lại đặc biệt khó khăn ở bệnh nhân khi đầu xa ở vị trí chia nhánh vì thường chỉ có thể vào lại một nhánh. Trong trường hợp này, cách tiếp cận ngược dòng (nếu có mạch bàng hệ can thiệp được) nên được sử dụng.

4.4 Kỹ thuật tiếp cận ngược dòng (Retrograde)
Khi lái ngược dòng, có thể đi qua CTO một cách thông thường trong một số ít trường hợp (10%-20%) hoặc bằng kỹ thuật bóc tách/vào lại trong hầu hết các trường hợp khác. Định nghĩa một nhánh bàng hệ có thể can thiệp được ngược dòng (interventional collateral) khác nhau phụ thuộc phần lớn vào kinh nghiệm và quan điểm của bác sĩ can thiệp.
Có hai loại đường ngược dòng chính: bàng hệ hoặc cầu nối. Chọn lọc bàng hệ septal (nhánh vách)/hoặc thượng tâm mạc hay cầu nối tùy trường hợp để xác định nhánh bàng hệ phù hợp cho lái ngược dòng. Bàng hệ Septal nên được sử dụng hơn bàng hệ thượng tâm mạc vì nếu xảy ra thủng mạch thường ít để lại biến chứng nặng trong khi thủng mạch thượng tâm mạc có thể dễ dàng dẫn đến chèn ép tim cấp.
Một trường hợp cần lưu ý là khi sử dụng bàng hệ thông qua cầu nối động mạch vú trong. Khi đó Microcatheter có thể gây co thắt cầu nối và gây thiếu máu cục bộ cơ tim, do đó khi cần đưa wire qua bàng hệ nhánh vách trong trường hợp này, chụp chọn lọc nhánh vách qua microcatheter thông qua cầu nối vú trong cần được thực hiện trước khi lái wire để đảm bảo dòng chảy tốt không gây thiếu máu trong quá trình can thiệp.
Cầu nối cũng có thể sử dụng để lái ngược dòng nếu có hẹp tại cầu nối, tốt hơn hết vẫn là tái thông mạch nguyên thủy của bệnh nhân khi cầu nối đã bị thoái hóa. Kể cả khi cầu nối mới bị tắc cũng có thể dùng để lái ngược dòng được đặc biệt nếu mới tắc và đầu gần của đoạn tắc có dạng thuôn dài, trong các trường hợp đó đi qua được cầu nối tĩnh mạch hiển sẽ khá dễ dàng với sự hỗ trợ của MicroCatheter và lái ngược dòng tương tự như các bàng hệ khác.
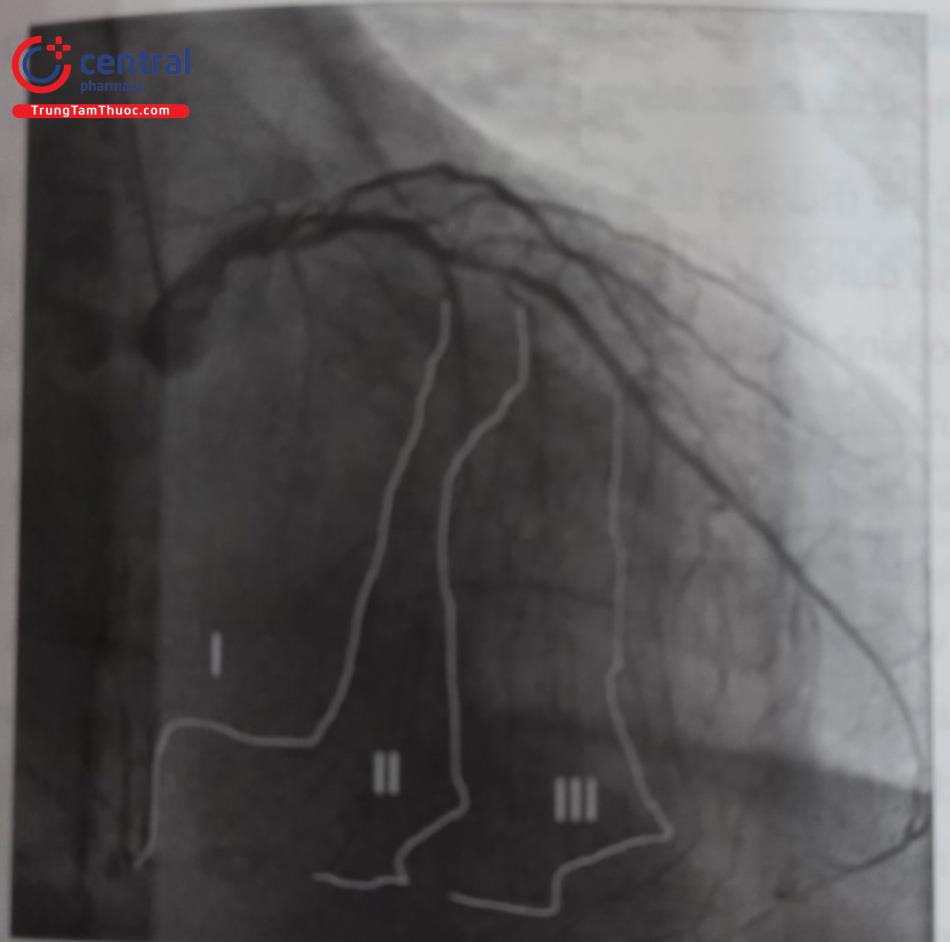
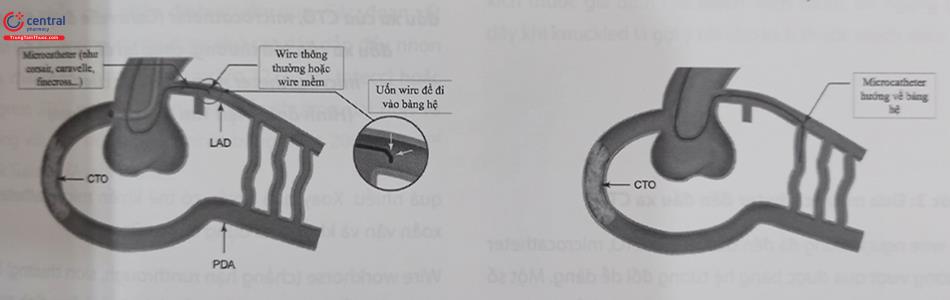
4.4.1 Các bước của kỹ thuật ngược dòng:
4.4.2 Bước 1: Tiếp cận mạch bàng hệ
4.4.3 Thường cần một đường áp lực số 2 với guiding riêng biệt để lái ngược dòng. Sau khi lựa chọn mạch bàng hệ để đi qua, một microcatheter cùng với một wire workhorse được sử dụng để tiếp cận nhánh bàng hệ được lựa chọn và sau đó nếu thuận lợi thì có thể lái luôn wire này qua bàng hệ cũng được. Nếu khó khăn, có thể thay bằng wire chuyên dụng cho lái qua bàng hệ. Luôn ghi nhớ rằng mặc dù có nhiều dạng bàng hệ có thể sử dụng (như mô tả ở dưới), nên chọn bàng hệ nhánh vách (septal) nếu có thể do chúng tương đối an toàn cho việc can thiệp ngược dòng. Khi lựa chọn được bàng hệ để lái qua, có thể chọn lọc mi- crocatheter vào nhánh đó và chụp thật chọn lọc bằng bơm nhỏ để xác định đường đi.
.jpg)
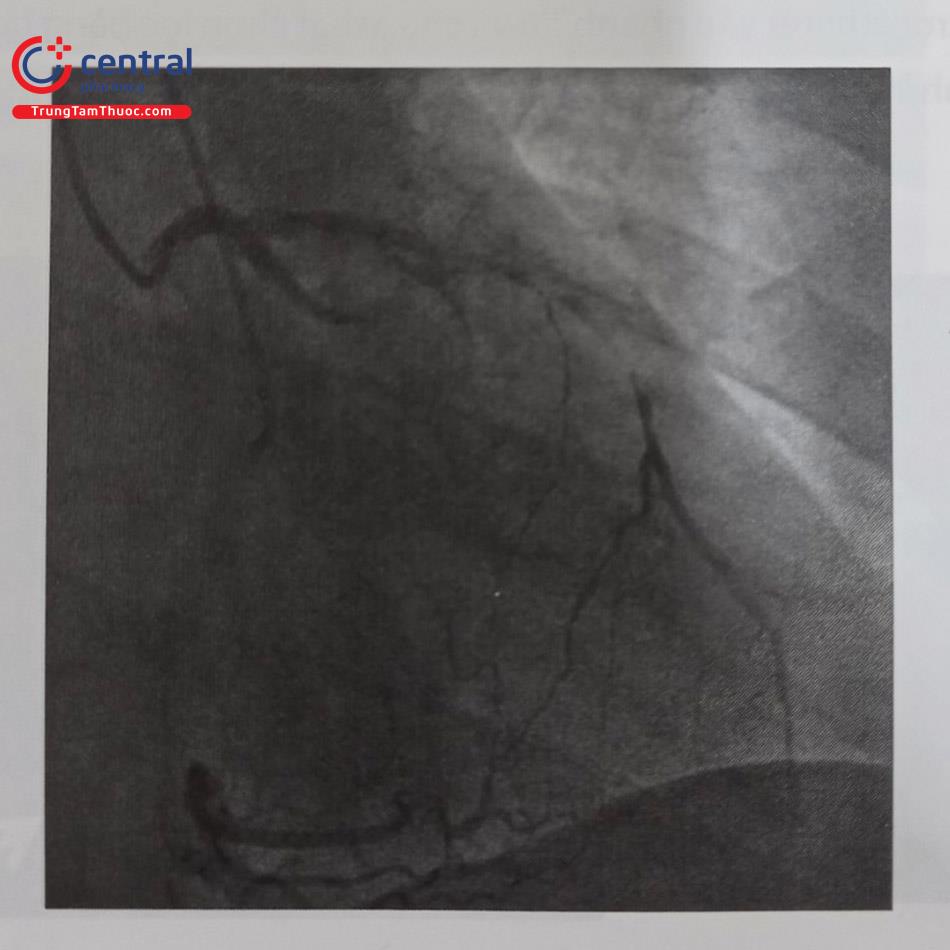
Bước 2: Đi qua mạch bàng hệ
Một số wire chuyên dụng có thể được sử dụng để đi qua bàng hệ do chúng khá “mềm mại” và dễ điều khiển (đầu mềm do đó ít có nguy cơ gây thủng bàng hệ). Một số wire có thể sử dụng chẳng hạn hệ wire Sion hoặc Fielder FC của Asahi Intecc, Nhật Bản. Khi lái wire qua mạch bàng hệ có thể sử dụng kỹ thuật “lướt wire” (“surfing”) khi thử một hoặc một vài mạch bàng hệ nhất định để tìm xem nhánh nào dễ qua nhất, kỹ thuật “lướt wire” này đôi khi không đòi hỏi phải nhìn rõ đường đi của mạch máu bàng hệ mà quan trọng là bằng cảm nhận của tay bác sĩ can thiệp.
Kỹ thuật nên sử dụng để lái qua bàng hệ nên là xoay wire chứ không đẩy do nếu đẩy sẽ dễ vỡ mạch bàng hệ. Kỹ thuật lướt này có thể sử dụng kể cả khi một số bàng hệ không thấy được bằng mắt thường.
Bàng hệ thượng tâm mạc thường đặc biệt xoắn, nên hạn chế sử dụng các mạch bàng hệ này trừ khi bác sĩ can thiệp rất có kinh nghiệm do nếu thủng mạch sẽ rất dễ gây chèn ép tim cấp và trong một số trường hợp như khi bệnh nhân sau bắc cầu nối chủ vành mà tràn dịch màng tim sẽ rất khó chọc hút mà phải phẫu thuật mới có thể xử lý được. Cần đưa wire và microcatheter rất nhẹ nhàng và hiểu rõ giải phẫu của mạch bàng hệ mới có thể tránh được nguy cơ tổn thương mạch. Nếu có ý định lái qua bàng hệ thượng tâm mạc, cần chuẩn bị sẵn sàng nguy cơ tràn dịch màng tim và sẵn sàng xử trí biến chứng.
(Hình ảnh: Viện Tim mạch Việt Nam)
Bước 3: Đưa microcatheter đến đầu xa CTO
Khi wire ngược dòng đã đến đầu xa của CTO, microcatheter thường vượt qua được bàng hệ tương đối dễ dàng. Một số trường hợp còn lại, có một vài kỹ thuật có thể tạo thuận cho microcatheter đi qua được bàng hệ bao gồm tăng hỗ trợ bằng catheter nối dài (như guidezilla) hoặc nong bóng bàng hệ. Đưa microcatheter bằng cách xoay xuôi và ngược chiều kim đồng hồ một cách nhịp nhàng và tránh quay quá nhiều. Xoay quá nhiều có thể khiến microcatheter bị xoắn vặn và không sử dụng được nữa.
Wire workhorse (chẳng hạn runthrough, sion thường) hầu như có thể qua được cầu nối chủ vành bằng tĩnh mạch hiển còn thông. Các cầu nối bị tắc thì khó qua hơn. Khi đó cần dùng các loại wire hỗ trợ tốt hơn chẳng hạn như PILOT 200 (wire phủ polymer, đầu wire có khả năng đâm xuyên tốt hơn). Cần lưu ý các cấu trúc trên đường đi chẳng hạn như các clip mổ hoặc mối nối. Nếu không chắc về đường đi của wire, nên rút wire và chụp qua microcatheter để nhìn kỹ đường đi. Khi guidewire đã đi được đến đầu xa của CTO (khẳng định bằng cúp chụp ngược dòng), microcatheter cần được đưa đến đầu xa của tổn thương CTO.

Bước 4: Xuyên qua CTO
Khi microcatheter đã ở đầu xa của CTO, chiến lược sẽ phụ thuộc một phần vào chiều dài tổn thương và mức độ vôi hóa. Các tổn thương dài, đặc biệt vôi hóa nặng, thường không thể đi qua một cách thông thường qua lòng chính. Với tính chất giải phẫu như vậy, kỹ thuật bóc tách và vào lại ngược dòng, còn được gọi là kỹ thuật Reverse – CART (reverse controlled antegrade and retrograde subinti- mal tracking -reverse CART) thường được sử dụng. Trong trường hợp tổn thương ngắn không vôi hóa, có thể thử đâm xuyên qua từ lòng thực bên này sang lòng thực bên kia bằng các wire CTO. Lựa chọn dây dẫn sẽ phụ thuộc vào giải phẫu của phần định xuyên qua. Các đoạn rất ngắn vôi hóa nặng có thể được thử các dây dẫn đầu nhọn hơn, chẳng hạn như Confianza Pro 12 (Asahi Intecc) hoặc Progress 200T (Abbott Vein). Các tổn thương dài hơn và không vôi hóa tiếp cận tốt nhất bằng Pilot 200, Gaia 2nd hoặc Gaia 3rd (Asahi Intecc).
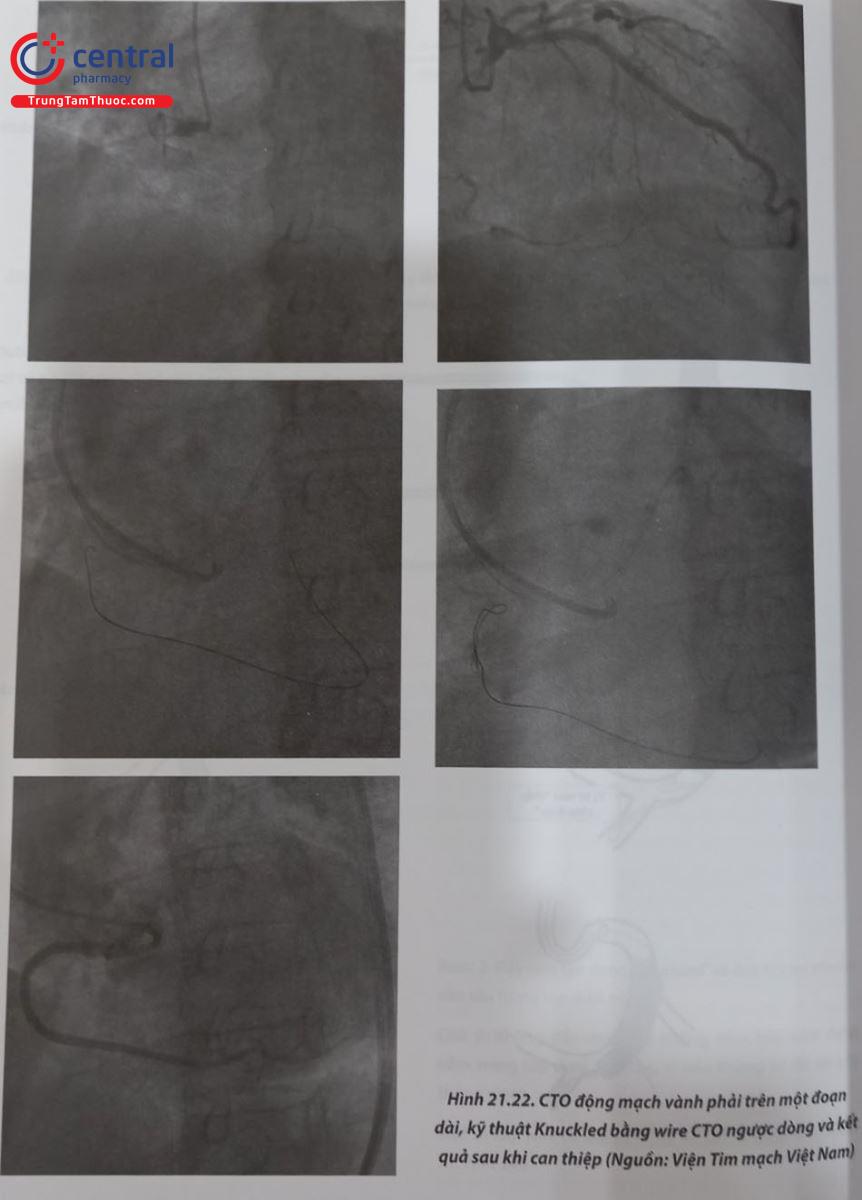
Nếu CTO dài hơn, thường phải dùng có kỹ thuật bóc tách và vào lại, thường là Reverse – CART. Kỹ thuật này đòi hỏi phải wire đi qua CTO dưới nội mạc cả theo đường xuôi và ngược dòng& (Hình 21.29). Khi wire ngược dòng đã nằm yên vị dưới nội mạc, một wire xuôi dòng được lái hướng theo vùng dưới nội mạc. Nong rộng vùng dưới nội mạc của wire xuôi dòng này bằng một bóng xuôi dòng sẽ giúp dây dẫn ngược dòng đi dọc theo mặt phẳng bóc tách về phía lòng thật đầu gần. Việc sử dụng catheter nối dài (kiểu như guidezilla) từ phía xuôi dòng có thể hỗ trợ trong việc đưa dây dẫn ngược dòng vào trong guiding chính xuôi dòng. Đường kính bóng xuôi dòng nên được lựa chọn dựa trên kích thước giả định của mạch. Kích thước bề ngang của dây khi knuckled là gợi ý tốt cho kích thước mạch máu.

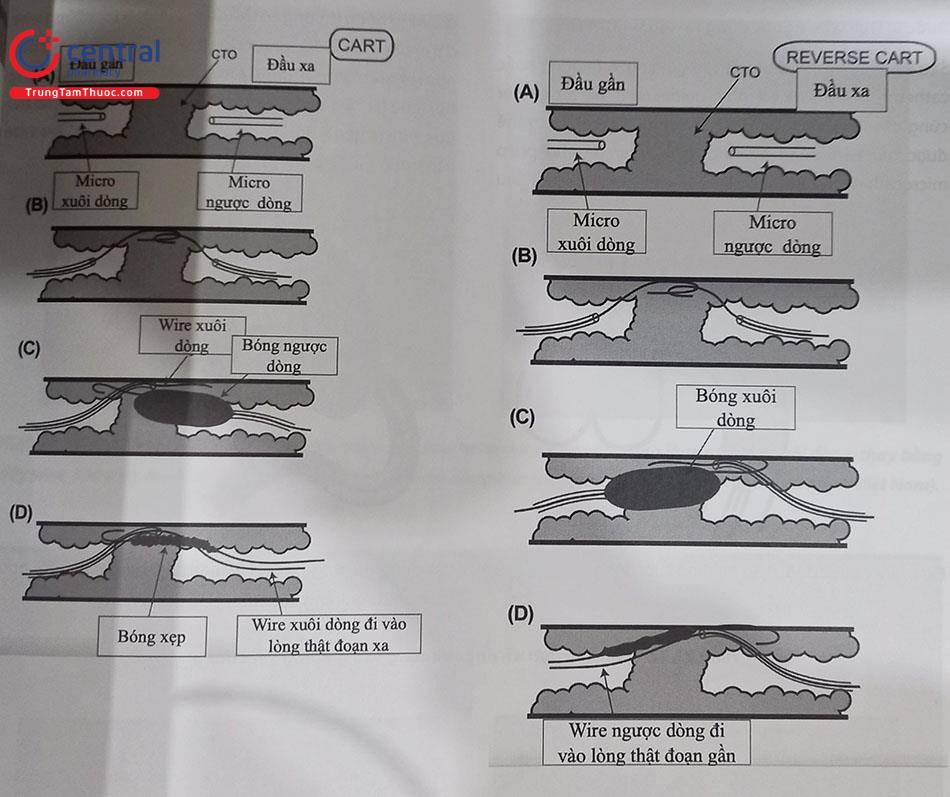
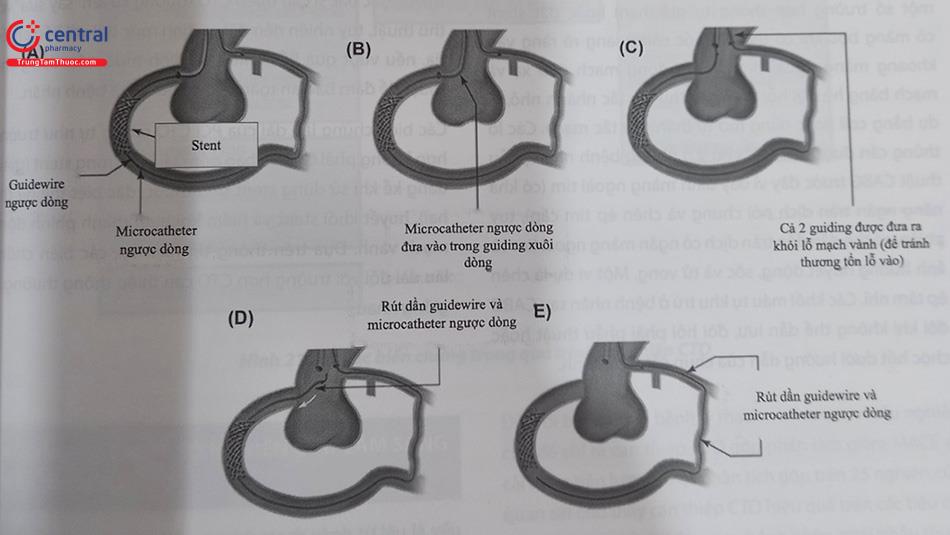
Bước 5: Đưa wire ngược dòng ra ngoài
Sau khi wire ngược dòng đi vào guiding xuôi dòng hoặc catheter nối dài (kiểu như guideliner), microcatheter cũng cần được đẩy vào guiding chính. Wire ngắn có thể được giữ bên trong guiding xuôi dòng để cho phép microcatheter ngược dòng đi vào trong guiding dòng. Sau đó, wire thông thường có thể được rút ra và thay bằng wire dài chuyên cho CTO ngược dòng (> 300 cm) và đưa ra bên ngoài (externalized). (như là RG3 hoặc R350). Trong trường hợp khó lái wire ngược dòng vào guiding chính, thì có thể đưa wire ra ngoài động mạch chủ và bắt snare để đưa wire vào trong guiding chính xuôi dòng.

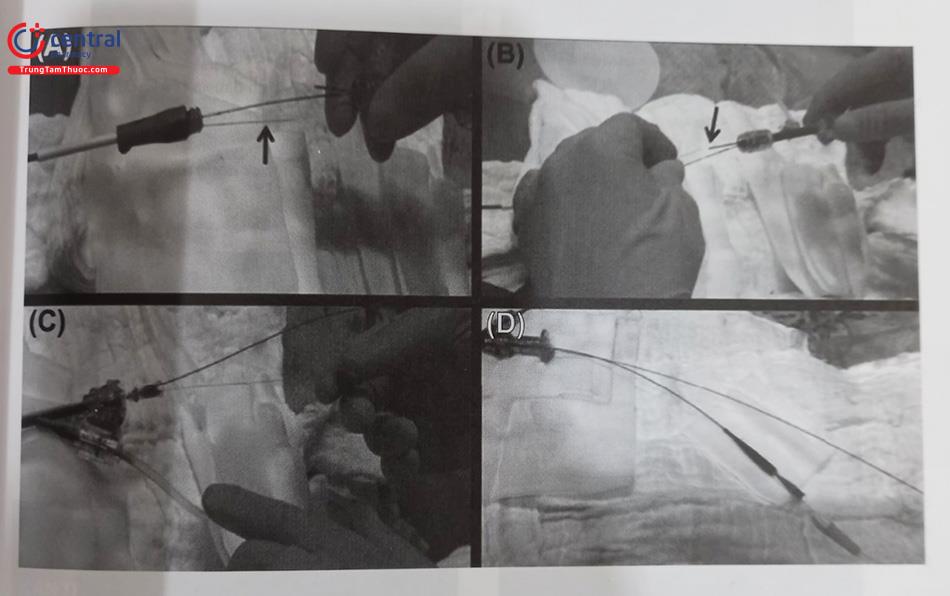
Bước 6: PCI xuôi dòng bằng wire đã đưa ra ngoài
Khi đưa bóng và stent xuôi dòng, cần cẩn thận vì nếu kéo mạnh wire sẽ kéo lại dây ngược dòng và do đó làm guiding ngược dòng bị kéo vào mạch máu ngược dòng gây tổn thương lỗ vào. Nên giữ catheter ngược dòng trong mạch
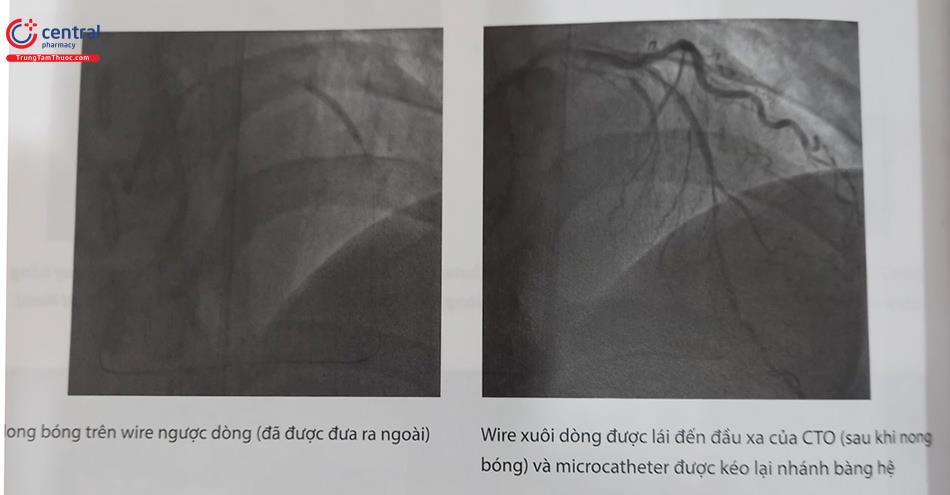
Nong bóng trên wire ngược dòng (đã được đưa ra ngoài)bàng hệ trong quá trình PCI để bảo vệ mạch máu khỏi bị ma sát bởi đoạn wire không được phủ bởi microcatheter. Cũng nên kéo guiding ngược dòng vào trong động mạch chủ để giúp bảo vệ mạch ngược dòng khỏi bị tổn thương qua các thao tác can thiệp xuôi dòng.
Wire xuôi dòng được lái đến đầu xa của CTO (sau khi nong bóng) và microcatheter được kéo lại nhánh bàng hệ
Bước 7: Đưa wire ngược dòng ra ngoài
Đây là bước rất quan trọng và các bác sĩ can thiệp cần lưu ý sau khi đặt stent xong, để tránh gây sang chấn cho đầu xa của mạch CTO và mạch máu cung cấp bàng hệ ngược dòng, nếu động tác thô bạo khi kéo microcatheter và wire ngược dòng ra ngoài có thể dễ dẫn đến biến chứng hoặc mạch co thắt, xoắn vặn lại hoặc nghiêm trọng hơn là gây tổn thương lỗ vào của mạch máu.
Sau khi can thiệp đặt stent xong, microcatheter ngược dòng nên được đẩy về phía wire xuôi dòng, ít nhất trong đoạn có stent và guidewire được kéo lại vào trong microcatheter. Giữ guiding ngược dòng bên ngoài động mạch chủ để giảm thiểu sang chấn cho lỗ vào mạch ngược dòng. Microcatheter được rút ra bằng cách xoay theo chiều kim đồng hồ liên tục để quay lại mạch ngược dòng (không ra ngoài hoàn toàn). Sau đó, chụp lại mạch ngược dòng để đảm bảo không có bóc tách mạch; trong thực tế, nếu bóc tách xảy ra, có thể dễ dàng đưa một dây dẫn vào trong microcatheter, hướng về phía xa của mạch ngược dòng ban đầu để xử lý biến chứng này.
5 Tiêu chí thành công của thủ thuật và hạn chế biến chứng trong quá trình can thiệp
Tiêu chí thành công của thủ thuật can thiệp CTO giống với tiêu chí thành công của một thủ thuật can thiệp động mạch vành thông thường khác, đó là tái thông được thành công (nong bóng và/hoặc đặt stent) cho mạch máu dự định can thiệp với dòng chảy TIMI III, và không có biến chứng, hoặc biến chứng chỉ ở mức độ tối thiểu.
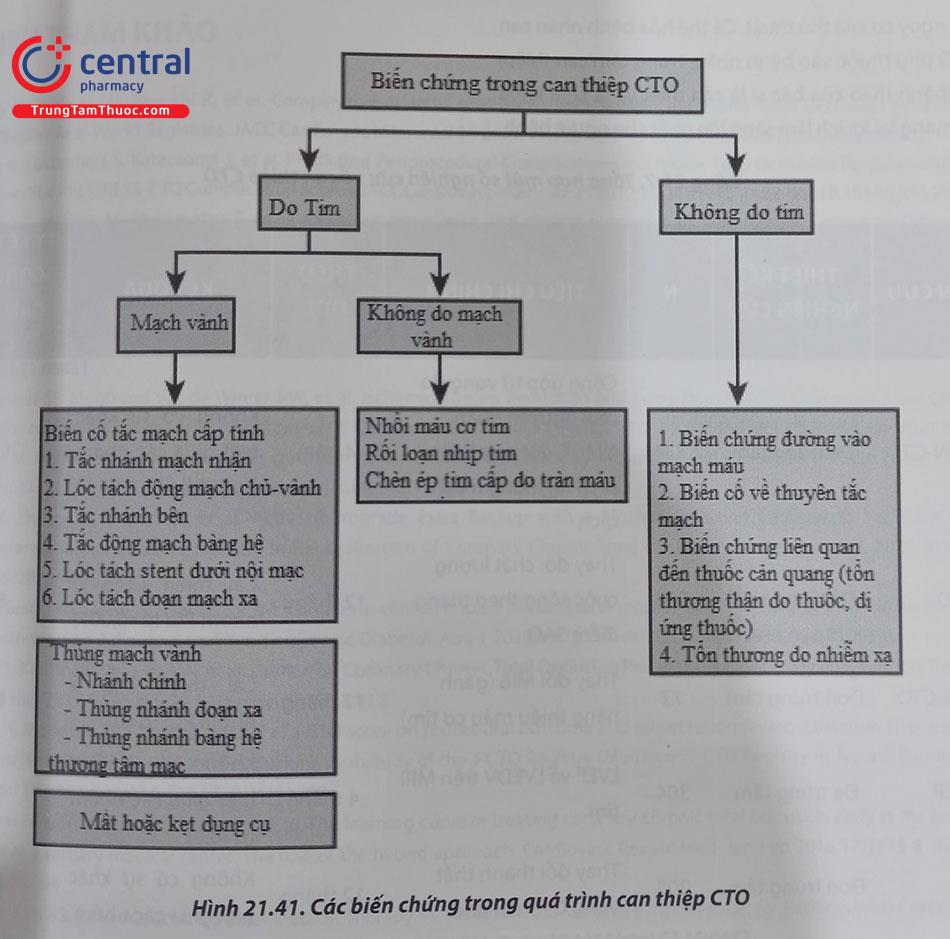
Các biến chứng của PCI CTO có thể được phân loại theo thời điểm (cấp tính và lâu dài) và vị trí (biến chứng liên quan đến mạch vành, biến chứng tim ngoài mạch vành và biến chứng không liên quan đến tim) (Hình 21.40).
Các biến chứng mạch vành cấp tính bao gồm tắc mạch cấp tính, thủng và mất hoặc kẹt dụng cụ. Mặc dù mạch CTO theo định nghĩa bị tắc từ lâu, cố gắng quá để tái thông CTO có thể làm giảm tưới máu cơ tim (ví dụ do tổn thương mạch không bị CTO, có thể tác động xấu lên huyết động). Ví dụ điển hình nhất là mạch ngược dòng bị tổn thương khi đi cố gắng lái ngược dòng có thể gây suy sụp huyết động nhanh chóng. Tách thành động mạch chủ sát lỗ vào động mạch vành cũng có thể xảy ra trong PCI CTO và thường được phòng ngừa bằng cách ngừng không bơm cản quang và trong những trường hợp nặng phải đặt stent vào vị trí lóc tách. Đôi khi suy giảm dòng chảy qua một mạch bàng hệ lớn và đơn độc có thể gây thiếu máu cục bộ dẫn tới loạn nhịp hoặc tụt huyết áp.
Có ba loại thủng mạch vành liên quan đến PCI CTO: (a) thủng mạch nhánh chính; (b) thủng động mạch phía xa, thường thứ phát sau thủng do wire; và (c) thủng mạch bàng hệ vách hoặc thủng nhánh thượng tâm mạc. Thủng mạch chính có thể điều trị bằng bơm bóng kéo dài (trong một số trường hợp thủng tự giới hạn) hoặc đặt stent có màng bọc khi có thoát thuốc cản quang rõ ràng vào khoang màng ngoài tim. Thủng động mạch đầu xa và mạch bàng hệ đòi hỏi phải gây thuyên tắc nhánh nhỏ, ví dụ bằng coil hoặc dùng mỡ tự thân gây tắc mạch. Các lỗ thủng cần được đặc biệt chú ý ở những bệnh nhân phẫu thuật CABG trước đây vì dày dính màng ngoài tim (có khả năng ngăn tràn dịch nói chung và chèn ép tim cấp), tuy nhiên, có thể dẫn đến tràn dịch có ngăn màng ngoài tim và ảnh hưởng huyết động, sốc và tử vong. Một ví dụ là chèn ép tâm nhĩ. Các khối máu tụ khu trú ở bệnh nhân sau CABG đôi khi không thể dẫn lưu, đòi hỏi phải phẫu thuật hoặc chọc hút dưới hướng dẫn của chụp cắt lớp vi tính.
Các biến chứng tim ngoài mạch vành bao gồm nhồi máu cơ tim, rối loạn nhịp tim và chèn ép tim cấp (do biến chứng thủng mạch vành). Các biến chứng cấp tính chung khác bao gồm các biến chứng của đường vào mạch máu (có thể giảm thiểu bằng cách sử dụng siêu âm, kim nhỏ hoặc chọn đường vào mạch quay), biến chứng huyết khối hệ thống (ít xảy ra nếu duy trì thời gian đông máu hoạt hóa-ACT 300 giây), dị ứng thuốc cản quang và tổn thương da do chiếu xạ. Sử dụng màn huỳnh quang có số khung hình trên giây thấp (thường là 7,5 khung hình/giây hoặc thấp hơn), giảm thiểu chụp mạch và chú ý đến vị trí của màn tăng sáng so với bệnh nhân (càng gần chạm bệnh nhân càng tốt) để giảm liều chiếu xạ của bệnh nhân (và bác sĩ can thiệp). Các bác sĩ can thiệp CTO thường xuyên “say sưa” với thủ thuật, tuy nhiên nên đặt ra định mức đối với liều chiếu tia, nếu vượt quá liều chiếu tia định mức, nên dừng thủ thuật để đảm bảo an toàn cho cả bác sĩ và bệnh nhân.
Các biến chứng lâu dài của PCI CTO tương tự như trường hợp không phải CTO và bao gồm tái hẹp trong stent (giảm đáng kể khi sử dụng stent phủ thuốc, đặc biệt thế hệ thứ hai), huyết khối stent và hiếm khi hình thành phình động mạch vành. Dựa trên thông tin hiện tại, các biến chứng lâu dài đối với trường hợp CTO can thiệp thông thường là giống nhau.
6 Tổng kết một số nghiên cứu lâm sàng về can thiệp CTO
Chưa tái thông được toàn bộ hệ mạch vành từ lâu là yếu tố nguy cơ của các biến cố tim mạch qua theo dõi, đặc biệt nếu còn tổn thương CTO-chưa được can thiệp. Theo nghiên cứu PL-ACS, CTO các nhánh mạch vành là yếu tố tiên lượng độc lập có thể làm tăng nguy cơ tử vong do hội chứng mạch vành cấp. Trong thử nghiệm Horizon-AMI, CTO cũng được chỉ ra là yếu tố tiên lượng độc lập làm tăng nguy cơ tử vong ở bệnh nhân nhồi máu cơ tim (NMCT) cấp có đoạn ST chênh lên (STEMI). Theo nhiều tác giả, việc can thiệp CTO có chương trình có thể làm giảm tỷ lệ tử vong cũng như biến cố tim mạch trong khoảng thời gian theo dõi khoảng 2 năm. Cũng có một vài thử nghiệm, như thử nghiệm EXPLORER, không cho thấy cải thiện EF và cải thiện thể tích thất trái sau can thiệp nhánh CTO-không phải thủ phạm ở bệnh nhân sau can thiệp thì đầu STEMI.
Đối với bệnh nhân bệnh lý mạch vành mạn, nhiều nghiên cứu đã chỉ ra can thiệp CTO góp phần làm giảm MACE và cải thiện tiên lượng. Một phân tích gộp trên 25 nghiên cứu quan sát cho thấy can thiệp CTO hiệu quả trên các tiêu chí như sống còn, đau thắt ngực, bệnh nhân phải phẫu thuật bắc cầu CABG trong khoảng thời gian 3 năm theo dõi. Sổ bộ của Thụy Điển (SCAAR) và Italia (IRCTO) đều cho thấy việc can thiệp CTO thành công làm giảm tỷ lệ tử vong, nhồi máu cơ tim và tái nhập viện khi so sánh với chỉ điều trị nội khoa tối ưu. Do vậy, xu hướng trong thời gian tới đây, với sự phát triển của Tim mạch can thiệp nói chung và can thiệp mạch vành nói riêng, can thiệp tổn thương CTO có lẽ sẽ ngày càng phát triển cả về kỹ thuật và số lượng bệnh nhân tiến hành thủ thuật cũng như tỷ lệ thành công của thủ thuật ngày càng cao. Bảng dưới đây tổng hợp một số nghiên cứu chính về can thiệp CTO, mặc dù kết quả can thiệp (nếu thành công) thường là hứa hẹn, tuy nhiên các bác sĩ can thiệp cũng nên cân nhắc kỹ lưỡng cả về chỉ định, lợi ích và nguy cơ của thủ thuật. Cá thể hóa bệnh nhân can thiệp CTO phụ thuộc vào bệnh nhân, trung tâm can thiệp, mức độ thành thạo của bác sĩ là cần thiết và là chìa khóa của việc mang lại lợi ích lâm sàng lớn nhất cho người bệnh.
Bảng 21.7. Tổng hợp một số nghiên cứu về can thiệp CTO
| NGHIÊN CỨU | THIẾT KẾ | N | TIÊU CHÍ CHÍNH | THEO DÕI | KẾT QUẢ | TỶ LỆ THÀNH CÔNG CTO |
|---|---|---|---|---|---|---|
| DECISION-CTO | Đa trung tâm | 834 | Cộng gộp tử vong do mọi nguyên nhân, NMCT, đột quỵ hoặc phải tái thông mạch đích | 4 năm | Không có sự khác biệt giữa các nhóm (p=0,86) | 91% |
| Euro-CTO | Đa trung tâm | 396 | Thay đổi chất lượng cuộc sống theo thang điểm SAQ | 12 tháng | Cải thiện CLCS ở nhóm PCI (p=0,007) | 87% |
| IMPATOR-CTO | Đơn trung tâm | 72 | Thay đổi MIB (gánh nặng thiếu máu cơ tim) | 12 tháng | Cải thiện MIB ở nhóm PCI (p<0,01) | 83% |
| EXPLORER | Đa trung tâm | 304 | LVEF và LVEDV trên MRI tim | 4 tháng |
Không có sự khác biệt giữa các nhóm (p=0,6) |
73% |
| REVASC | Đơn trung tâm | 205 | Thay đổi thành thất vùng CTO chi phối | 12 tháng | Không có sự khác biệt giữa các nhóm | 97 |
7 Các điểm chính của can thiệp CTO
Quan trọng nhất là lên chiến lược trước quá trình can thiệp, bao gồm checklist giới hạn về liều cản quang, bức xạ, thời gian trên bàn can thiệp và kỹ thuật, guiding, guidewire và chiến lược chi tiết đến từng bước, lập kế hoạch càng chu đáo, khả năng thủ thuật có thể thành công càng cao.
Sử dụng chụp động mạch vành hai bên trong hầu hết các trường hợp để xác định đặc điểm của CTO, đặc biệt là chiều dài và đường đi.
Xem xét tất cả các phương pháp để tái thông CTO, chuyển nhanh chóng từ kỹ thuật này sang kỹ thuật khác nếu một phương pháp thất bại.
Dừng sớm thủ thuật nếu xảy ra biến chứng chẳng hạn thủng mạch thoát thuốc cản quang ra cơ tim, xảy ra lóc tách type II hoặc type III, và điều trị thủng như mô tả để kiểm soát biến chứng. Đảo ngược chống đông, chèn bóng (balloon tamponade) và đặt stent có màng bọc nếu cần thiết. Nhìn chung, các khi chuẩn bị can thiệp CTO luôn cần phải sẵn sàng để xử lý biến chứng do can thiệp CTO có tỷ lệ biến chứng cao hơn nhiều các can thiệp thông thường.
Nếu can thiệp không thành công, cân nhắc thử lại nếu các kỹ thuật khác hoặc mời các bác sĩ có kinh nghiệm hơn để có cơ hội thành công cao hơn.
8 Tài liệu tham khảo
- Megaly M, Buda K, Mashayekhi K, et al. Comparative Analysis of Patient Characteristics in Chronic Total Occlusion Revascularization Studies: Trials vs Real-World JACC Cardiovasc Interv. Jul 25 2022;15(14):1441-1449. doi:10.1016/j.jcin.2022.05.023.
- Simsek B, Kostantinis S, Karacsonyi J, et al. Predicting Periprocedural Complications in Chronic Total Occlusion Percutaneous Coronary Intervention:The PROGRESS-CTO Complication JACC Cardiovasc Interv. Jul 25 2022;15(14):1413-1422. doi:10.1016/j.jcin.2022.06.007.
- Matsuno S, Habara M, Muramatsu T, et al. Operator experience and clinical outcomes of percutaneous coronary intervention for chronic total occlusion: insights from a pooled analysis of the Japanese CTO PCI Expert Registry and the Retrograde Summit General Registry. Cardiovasc Interv Feb 2 2022;doi:10.1007/s12928-022-00840-8.
- Moroni F, Santiago R, R DIP, Calcagno S, Azzalini L. Complications during chronic total occlusion percutaneous coronary intervention:;a sign- and symptom-based approach to early diagnosis and treatment. Minerva Cardiol Angiol. Dec 2021;69(6):773-786. doi:10.23736/ S2724-5683.21.05831-2.
- Schumacher SP, Stuijfzand WJ, de Winter RW, et al. Ischemic Burden Reduction and Long-Term Clinical Outcomes After Chronic Total Occlusion Percutaneous Coronary Intervention. JACC Cardiovasc Interv. Jul 12 2021;14(13):1407-1418. doi:10.1016/j.jcin.2021.04.044.
- Menozzi M, Piovaccari G. Procedures for chronic total occlusion: when are they recommended and when not. Eur Heart J Suppl. Nov 2020;22(Suppl L):L114-L116. doi:10.1093/eurheartj/suaa148.
- Wang Y, Zhang XJ, Zhao HW, et al. Active Retrograde Extra Backup with a Mother-and-Child Catheter to Facilitate Retrograde Microcatheter Collateral Channel Tracking in Recanalization of Coronary Chronic Total J Interv Cardiol. 2020;2020:4245191. doi:10.1155/2020/4245191.
- Tsai CT, Huang WC, Teng HI, Tsai YL, Lu TM. Long term clinical impact of successful recanalization of chronic total occlusion in patients with and without type 2 diabetes mellitus. Cardiovasc Diabetol. Aug 1 2020;19(1):119. doi:10.1186/s12933-020-01093-6.
- Brilakis ES, Karmpaliotis D, Vo MN, et al. Update on Coronary Chronic Total Occlusion Percutaneous Coronary Intervention. Interv Cardiol Clin. Apr 2016;5(2):177-186. doi:10.1016/j.iccl.2015.12.012.
- Tanaka H, Morino Y, Abe M, et al. Impact of J-CTO score on procedural outcome and target lesion revascularisation after percutaneous coronary intervention for chronic total occlusion: a substudy of the J-CTO Registry (Multicentre CTO Registry in Japan). EuroIntervention. Jan 22 2016;11(9):981-8. doi:10.4244/EIJV11I9A202.
- Shammas NW, Shammas GA, Robken J, et al. The learning curve in treating coronary chronic total occlusion early in the experience of an operator at a tertiary medical center: The role of the hybrid approach. Cardiovasc Revasc Med. Jan-Feb 2016;17(1):15-8. doi:10.1016/j. carrev.2015.09.004.
- Yang JH, Kim BS, Jang WJ, et al. Optimal Medical Therapy vs. Percutaneous Coronary Intervention for Patients With Coronary Chronic Total Occlusion – A Propensity-Matched Analysis. Circ J. 2016;80(1):211-7. doi:10.1253/circj.CJ-15-0673.
- Kalyanasundaram A, Lombardi WL. Complications of Recanalization of Chronic Total Curr Cardiol Rev. Nov 6 2015;11(4): 305-313. doi:10.2174/1573403X11666150909105725.
- Jang WJ, Yang JH, Choi SH, et al. Long-term survival benefit of revascularization compared with medical therapy in patients with coronary chronic total occlusion and well-developed collateral JACC Cardiovasc Interv. Feb 2015;8(2):271-279. doi:10.1016/j. jcin.2014.10.010.
- Rinfret S, Ribeiro HB, Nguyen CM, Nombela-Franco L, Urena M, Rodes-Cabau J. Dissection and re-entry techniques and longer-term outcomes following successful percutaneous coronary intervention of chronic total occlusion. Am J Cardiol. Nov 1 2014;114(9):1354-60. doi:10.1016/j.amjcard.2014.07.067.
- Galassi A, Grantham A, Kandzari D, et Percutaneous Treatment of Coronary Chronic Total Occlusion Part 2: Technical Approach. Interv Cardiol. Aug 2014;9(3):201-207. doi:10.15420/icr.2014.9.3.201.
- Carlino M, Demir OM, Colombo A, Azzalini L. Microcatheter knuckle technique: A novel technique for negotiating the subintimal space during chronic total occlusion recanalization. Catheter Cardiovasc Interv. Dec 1 2018;92(7):1256-1260. doi:10.1002/ccd.27682.
- Chi WK, Gong M, Bazoukis G, et al. Impact of Coronary Artery Chronic Total Occlusion on Arrhythmic and Mortality Outcomes: A Systematic Review and Meta-Analysis. JACC Clin Electrophysiol. Sep 2018;4(9):1214-1223. doi:10.1016/j.jacep.2018.06.011.
- Sudhakaran S, Choi Coronary Chronic Total Occlusion Antegrade Wire Technique to Successfully Cross a Common Iliac Chronic Total Occlusion from Retrograde Access. Am J Cardiol. Aug 15 2020;129:118-119. doi:10.1016/j.amjcard.2020.05.036.
- Reddy SA, Pillai AA, Reddy B, Rao V, Deshpande A. Knuckle wire technique in percutaneous coronary intervention of chronic total occlusion: Knuckle wire technique. AsiaIntervention. Dec 2020;6(2):91-101. doi:10.4244/AIJ-D-19-00028.
- Galassi AR, Boukhris M, Tomasello SD, et al. Long-term clinical and angiographic outcomes of the mini-STAR technique as a bailout strategy for percutaneous coronary intervention of chronic total occlusion. Can J Cardiol. Nov 2014;30(11):1400-6. doi:10.1016/j. cjca.2014.07.016.
- Kim MH, Yu LH, Tanaka H, Mitsudo K. Experience with a novel retrograde wiring technique for coronary chronic total occlusion. J Interv Cardiol. Jun 2013;26(3):254-8. doi:10.1111/joic.12031

