Physicochemical Analytical Procedures For Insulins
If you find any inaccurate information, please let us know by providing your feedback here

Tóm tắt nội dung
Bài viết này được biên soạn dựa trên Dược điển Hoa Kỳ (USP) – Phiên bản 2025
do Hội nghị Dược điển Hoa Kỳ (USP) ban hành và duy trì.
TẢI XUỐNG PDF TẠI ĐÂY
1 GIỚI THIỆU
Có nhiều quy trình hóa lý được sử dụng để đánh giá các thuộc tính chất lượng của Insulin người, các chất tương tự insulin khác nhau và insulin có nguồn gốc từ động vật, sau đây gọi chung là insulin. Trong số các quy trình này, việc lập bản đồ peptide và xác định protein có trọng lượng phân tử cao là tương tự nhau đối với các dược chất và sản phẩm thuốc insulin khác nhau. Chương này mô tả các xét nghiệm lập bản đồ peptide và phân tích định lượng protein có trọng lượng phân tử cao có thể được sử dụng cho các loại insulin khác nhau.
Các hướng dẫn cụ thể khác với quy trình chung được nêu ở đây được trình bày trong các chuyên luận về dược chất hoặc sản phẩm thuốc tương ứng của từng loại insulin khác nhau.
2 LẬP BẢN ĐỒ PEPTIDE
Quá trình phân giải insulin được thực hiện bằng cách sử dụng protease của chủng Staphylococcus aureus V8 (S. aureus V8) (còn được gọi là Endoproteinase Glu-C), một endoproteinase serine cắt ở phía đầu C của các gốc glutamyl và aspartyl trong Dung dịch đệm phosphat ở pH 7,8. Protease này đặc hiệu cho quá trình phân giải Glu-C trong amoni bicacbonat hoặc các dung dịch đệm không chứa phosphat khác ở pH 7,8. Sự hiện diện của proline ở phía carboxyl của liên kết peptide ức chế sự cắt. Hệ thống đệm được sử dụng phải cắt tất cả các liên kết glutamyl trong insulin mà không cắt các liên kết aspartyl. Nói chung, insulin được phân giải thành bốn peptide trong hệ thống đệm được mô tả trong phần Dung dịch mẫu bên dưới.
Các hình ảnh sau đây cho thấy sự khác biệt về axit amin của các chất tương tự insulin so với Insulin người và sự khác biệt trên máy tính trong các mảnh thu được sau khi tiêu hóa bằng protease S. aureus V8.
Hình 1 cho thấy bốn mảnh của Insulin người sau khi được tiêu hóa bằng protease V8 của S. aureus.
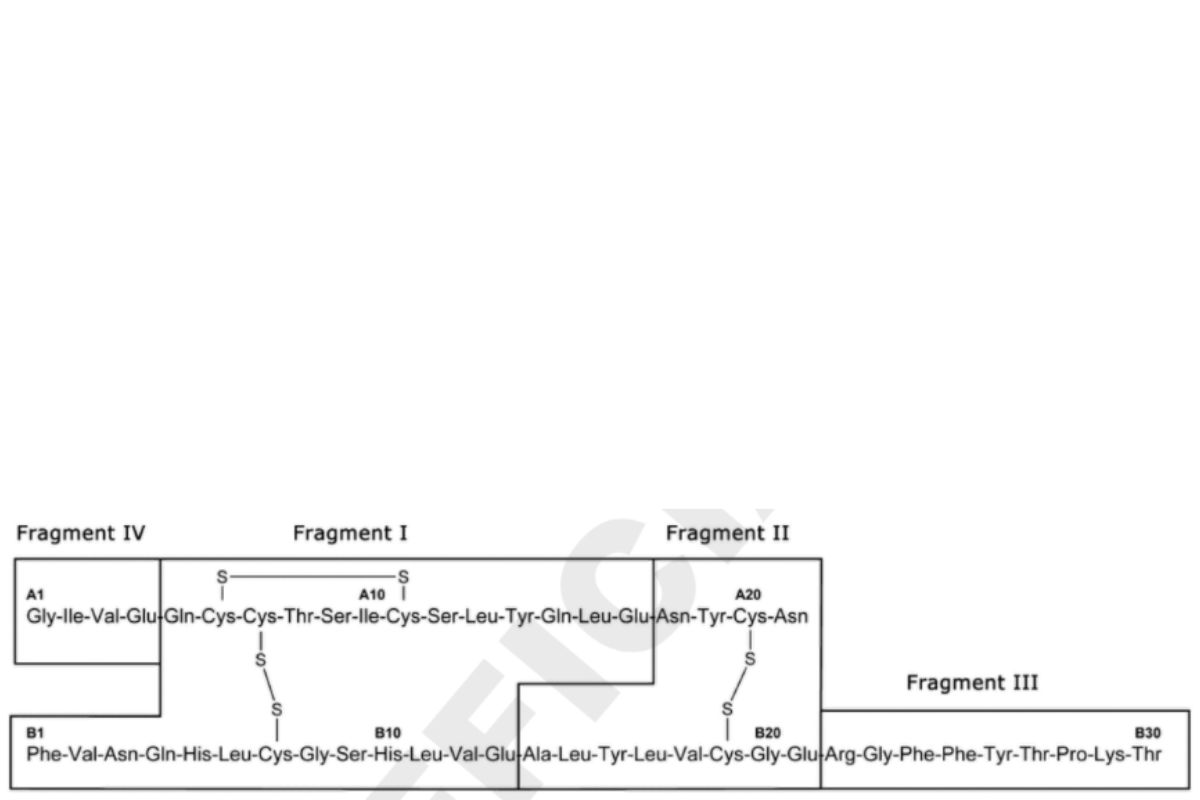
Hình 1. Insulin người: Các mảnh phân giải bởi protease V8 của S. aureus.
Bảng 1 cho thấy sự khác biệt về axit amin giữa các chất tương tự insulin, insulin có nguồn gốc từ động vật và Insulin người.
Bảng 1. Sự khác biệt về axit amin giữa các chất tương tự insulin, insulin có nguồn gốc từ động vật và insulin người.
| Insulin | Sự khác biệt về axit amin so với insulin người |
| Insulin aspart | B28 Asp |
| Insulin glargine | A21 Gly, hai Arg được thêm vào đầu C của chuỗi B |
| Insulin glulisine | B3 Lys, B29 Glu |
| Insulin lispro | B28 Lys, B29 Pro |
| Insulin lợn | B30 Ala |
| Insulin bò | A8 Ala, A10 Val, B30 Ala |
Bảng 2 trình bày các mảnh phân giải cụ thể của các chất tương tự insulin và insulin có nguồn gốc từ động vật sau khi tiêu hóa bằng protease V8 của S. aureus. Sự khác biệt về axit amin so với Insulin người được làm nổi bật.
Bảng 2. Sự khác biệt về axit amin: Insulin người, các chất tương tự insulin và insulin có nguồn gốc từ động vật (Những điểm khác biệt so với insulin người được in đậm)
| Insulin | Sự khác biệt về axit amin so với insulin ở người | |
| Insulin aspart | Mảnh III | (B22) Arg-Gly-Phe-Phe-Tyr-Thr- Asp -Lys-Thr (B30) |
| Insulin glargine | Đoạn II | (A18) Asn-Tyr-Cys- Gly (A21) |
| Mảnh III | (B22) Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys-Thr- Arg-Arg (B32) | |
| Insulin glulisine | Đoạn I | (B1) Phe-Val- Lys -Gln-His-Leu-Cys-Gly-Ser- His-Leu (B11) |
| Mảnh III | (B22) Arg-Gly-Phe-Phe-Tyr-Thr-Pro- Glu -Thr (B30) | |
| Insulin lispro | Mảnh III | (B22) Arg-Gly-Phe-Phe-Tyr-Thr- Lys-Pro -Thr (B30) |
| Insulin lợn | Mảnh III | (B22) Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys- Ala (B30) |
| Insulin bò | Đoạn I | (A5) Gln-Cys-Cys- Ala -Ser- Val -Cys-Ser-Leu- Tyr-Gln-Leu-Glu (A17) |
| Mảnh III | (B22) Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys- Ala (B30) | |
A và B lần lượt biểu thị chuỗi A và chuỗi B của insulin; các số biểu thị vị trí của axit amin trong chuỗi.
QUY TRÌNH LẬP BẢN ĐỒ PEPTIDE
Quy trình sau đây áp dụng cho việc lập bản đồ peptide của insulin người, các chất tương tự insulin và insulin có nguồn gốc từ động vật.
Dung dịch đệm HEPES: Hòa tan 2,38 g HEPES (axit N-2-hydroxyethylpiperazine-N-2-ethanesulfonic) trong khoảng 90 mL nước trong bình định mức 100 mL. Điều chỉnh pH đến 7,5 bằng dung dịch natri hydroxit 5 M, pha loãng với nước đến vạch và trộn đều.
Dung dịch đệm sulfat: 2,0 M amoni sulfat và 0,5 M axit sulfuric (tỷ lệ 1:1). Trộn đều và lọc.
TIÊU HÓA INSULIN
Quy trình sau đây giúp phân cắt hiệu quả các liên kết glutamyl của insulin. [LƯU Ý - Có thể sử dụng thể tích gấp 20 lần miễn là tỷ lệ các dung dịch vẫn giữ nguyên. Nếu quan sát thấy các sản phẩm phụ tự phân hủy gây nhiễu trong sắc ký đồ khi chỉ thực hiện quá trình thủy phân enzyme, thì phải giảm tỷ lệ enzyme/insulin và tăng thời gian thủy phân.]
Dung dịch enzyme: Chuẩn bị dung dịch protease S. aureus V8 nồng độ 1 mg/mL trong nước (khoảng 500 đơn vị/mg khi sử dụng Casein làm chất nền).
Dung dịch mẫu: Chuẩn bị dung dịch insulin cần kiểm tra với nồng độ 2,0 mg/mL trong axit clohydric 0,01 N. Cho vào một lọ sạch 25 µL dung dịch insulin 2,0 mg/mL, 100 µL dung dịch đệm HEPES và 20 µL dung dịch enzyme (tỷ lệ cuối cùng là 25:100:20). Đậy nắp lọ và ủ ở 25°C trong 6 giờ. Dừng phản ứng bằng cách thêm một lượng dung dịch đệm sulfat tương đương. Thời gian ủ lâu hơn có thể cần thiết đối với các chất tương tự có độ hòa tan kém ở pH 7,5.
Dung dịch chuẩn: Chuẩn bị đồng thời và theo cùng một cách thức dung dịch chuẩn insulin USP thích hợp như hướng dẫn trong phần Dung dịch mẫu.
XÁC ĐỊNH MẢNH PEPTIDE
Xác định các đoạn peptide bằng cách sử dụng quy trình lập bản đồ peptide sau đây (xem Bài báo có nguồn gốc từ Công nghệ sinh học - Lập bản đồ peptide (1055)).
Dung dịch A: Acetonitrile, nước và dung dịch đệm sulfat (100:700:200). Lọc và khử khí.
Dung dịch B: Acetonitrile, nước và dung dịch đệm sulfat (400:400:200). Lọc và khử khí.
Pha động: Xem Bảng 3.
Bảng 3
| Thời gian (phút) | Dung dịch A (%) | Dung dịch B (%) |
| 0 | 95 | 5 |
| 3 | 95 | 5 |
| 30 | 41 | 59 |
| 35 | 20 | 80 |
| 40 | 95 | 5 |
| 50 | 95 | 5 |
2.1 Hệ thống sắc ký
(Xem Sắc ký (621), Tính phù hợp của hệ thống.)
Chế độ: LC
Máy dò: UV 214 nm
Cột: 4,6 mm x 10 cm; vật liệu nhồi 5 µm L1
Nhiệt độ cột: 40°
Tốc độ dòng chảy: 1 mL/phút.
Thể tích tiêm: 50-100 µL
Tính phù hợp của hệ thống
Ví dụ: Dung dịch chuẩn
2.2 Yêu cầu về tính phù hợp
So sánh sắc ký đồ: Trong sắc ký đồ thu được từ dung dịch chuẩn, hãy xác định các đỉnh do các mảnh phân giải I, II, III và IV tạo ra. Sắc ký đồ của dung dịch chuẩn tương ứng với sắc ký đồ điển hình được cung cấp kèm theo Chuẩn tham chiếu Insulin USP thích hợp.
Độ phân giải: Phải có sự tách biệt hoàn toàn giữa các đỉnh do mảnh II và III tạo ra. Độ phân giải được định nghĩa trong chuyên luận về insulin hiện hành.
Hệ số đuôi: Không quá 1,5 đối với các mảnh phân giải II và III
2.3 Phân tích
Ví dụ: Dung dịch mẫu và dung dịch chuẩn
Chuẩn bị hệ thống sắc ký bằng cách chạy ở điều kiện ban đầu, t = 0 phút, trong ít nhất 15 phút. Thực hiện chương trình gradient mẫu trắng trước khi tiêm các mẫu đã được phân tích. Tiêm riêng biệt các thể tích bằng nhau của dung dịch chuẩn và dung dịch mẫu, và ghi lại đáp ứng của từng đỉnh.
Tiêu chí chấp nhận: Hồ sơ sắc ký của dung dịch mẫu tương ứng với hồ sơ sắc ký của dung dịch chuẩn.
3 GIỚI HẠN CỦA PROTEIN CÓ KHỐI LƯỢNG PHÂN TỬ CAO
3.1 THỦ TỤC
Dung dịch A: 1 mg/mL L-arginine trong nước
Pha động: Dung dịch A, axetonitril và axit axetic băng (65:20:15). Lọc và khử khí.
Giải pháp: Bảo quản một lượng dược chất insulin thích hợp ở nhiệt độ phòng trong một khoảng thời gian đủ (5-10 ngày, hoặc khi cần) để thu được insulin có hàm lượng protein trọng lượng phân tử cao hơn 0,4%. PHA dung dịch 4 mg/mL trong axit clohydric 0,01 N. Bảo quản dung dịch trong tủ lạnh và sử dụng trong vòng 7 ngày. Hoặc, hòa tan khoảng 4 mg Insulin người trọng lượng phân tử cao USP RS trong 1 mL axit clohydric 0,01 N.
Cách làm mẫu: Trong một lọ nhỏ, pha dung dịch insulin 4 mg/mL trong axit clohydric 0,01 N và khuấy đều cho tan. Bảo quản trong tủ lạnh và sử dụng trong vòng 7 ngày.
3.2 Hệ thống sắc ký
(Xem Sắc ký (621), Tính phù hợp của hệ thống.)
Chế độ: LC
Máy dò: Tia cực tím 276 nm.
Cột: 7,8 mm x 30 cm; vật liệu nhồi 5 đến 10 µm 120
Nhiệt độ
Máy lấy mẫu tự động: Nên sử dụng máy lấy mẫu tự động có hệ thống làm lạnh.
Cột: Môi trường xung quanh
Tốc độ dòng chảy: 0,5 mL/phút
Thể tích tiêm: 50 - 100 µL
3.3 Tính phù hợp của hệ thống
Ví dụ: Giải pháp cho vấn đề này
3.4 Yêu cầu về tính phù hợp
Thời gian lưu: Từ 13 đến 17 phút đối với các phức hợp insulin dạng polymer, khoảng 17,5 phút đối với dimer insulin cộng hóa trị, và từ 18 đến 22 phút đối với monomer insulin, với các muối được rửa giải sau monomer insulin.
Tỷ lệ đỉnh-đáy: Tỷ lệ giữa chiều cao của đỉnh dimer insulin liên kết cộng hóa trị và chiều cao của đáy nằm giữa đỉnh dimer insulin liên kết cộng hóa trị và đỉnh monomer insulin là không nhỏ hơn 2,0.
3.5 Phân tích
Ví dụ: Giải pháp mẫu
Bỏ qua bất kỳ đỉnh nào có thời gian lưu giữ lớn hơn thời gian lưu giữ của monome insulin.
Tính phần trăm protein có trọng lượng phân tử cao trong lượng insulin đã dùng:
Kết quả = Σr H /(Σr H + r M ) × 100
Σr H = tổng các phản hồi của tất cả các đỉnh có thời gian lưu giữ nhỏ hơn thời gian lưu giữ của monome insulin
r M = đáp ứng cực đại của monome insulin
Tiêu chí chấp nhận: Như đã nêu trong chuyên luận về insulin hiện hành.
4 YÊU CẦU BỔ SUNG
4.1 TIÊU CHUẨN THAM CHIẾU USP (11)
Insulin trọng lượng phân tử cao USP Human RS
(lựa chọn thay thế, không bắt buộc)


