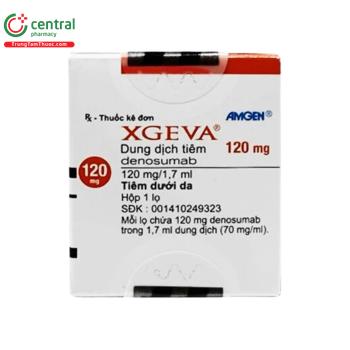
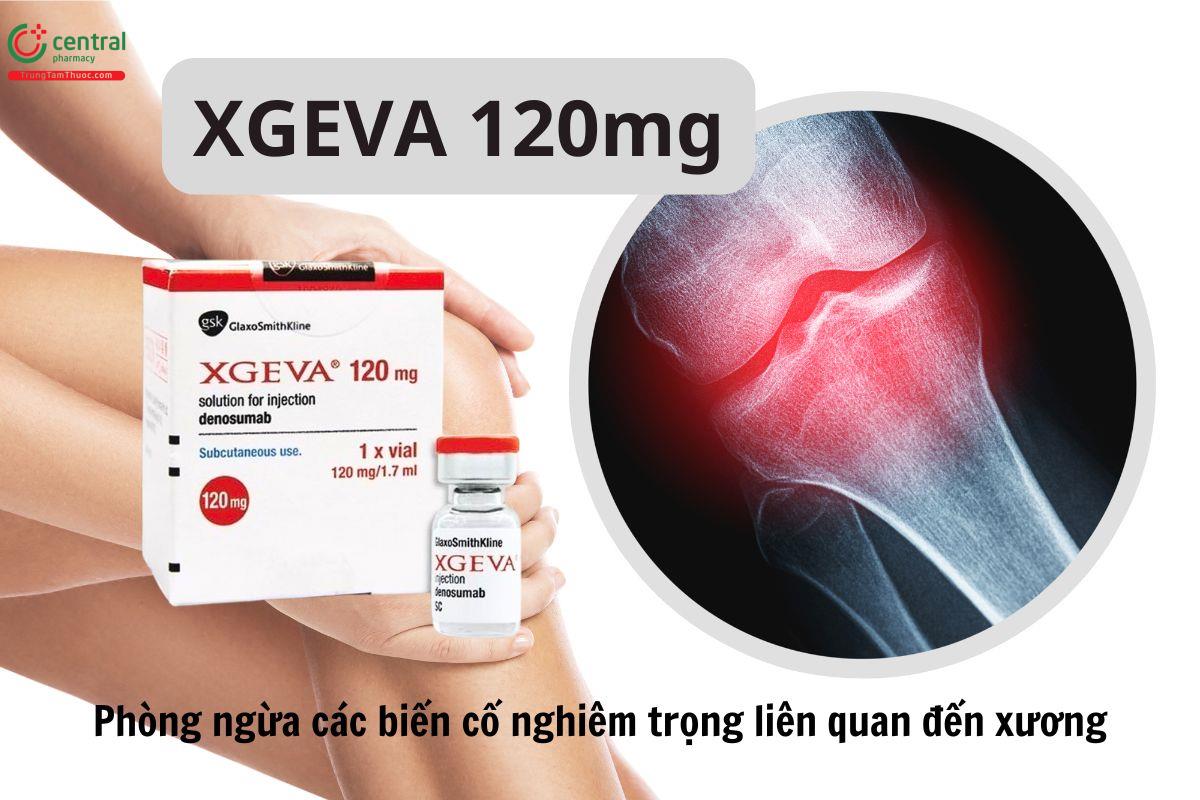
Xgeva 120mg
Thuốc kê đơn
Thuốc kê đơn quý khách vui lòng điền thông tin/ chat vào phần liên hệ này để dược sĩ tư vấn và đặt hàng
| Thương hiệu | Amgen, Amgen Limited |
| Công ty đăng ký | Amgen Limited |
| Số đăng ký | 001410249323 |
| Dạng bào chế | Dung dịch tiêm |
| Quy cách đóng gói | Hộp 1 lọ 1,7ml |
| Hạn sử dụng | 36 tháng |
| Hoạt chất | Denosumab |
| Xuất xứ | Anh |
| Mã sản phẩm | thom594 |
| Chuyên mục | Thuốc Cơ - Xương Khớp |
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
- Chi tiết sản phẩm
- Hỏi & Đáp 0
- Đánh giá 0
1 Thành phần
Thành phần: trong mỗi lọ Xgeva có chứa
Denosumab……120 mg.
Các tá dược khác vừa đủ 1 lọ.
Dạng bào chế: Dung dịch tiêm
2 Tác dụng - Chỉ định của thuốc
Xgeva 120mg là một loại kháng thể đơn dòng IgG2, được sản xuất từ tế bào buồng trứng của chuột đồng Trung Quốc, thông qua công nghệ DNA tái tổ hợp.
Xgeva 120mg được sử dụng để ngăn ngừa các vấn đề về xương, như gãy xương do bệnh lý, xạ trị vào xương, chèn ép tủy sống hoặc phẫu thuật ở những người lớn mắc bệnh ác tính có liên quan đến xương.
Ngoài ra, thuốc cũng được chỉ định cho người lớn và thanh thiếu niên có khối u tế bào khổng lồ ở xương mà không thể phẫu thuật cắt bỏ, nhằm tránh những biến chứng nghiêm trọng. [1]
=>> Xem thêm thuốc có cùng hoạt chất: Thuốc Prolia 60mg: Điều trị loãng xương và mất mô xương ở người lớn
3 Liều dùng - Cách dùng thuốc Xgeva 120mg
Thuốc Xgeva 120mg cần được tiêm dưới sự giám sát của chuyên gia y tế.
Liều lượng:
Tất cả bệnh nhân nên bổ sung ít nhất 500mg calci và 400IU Vitamin D mỗi ngày, trừ khi có tình trạng tăng calci huyết.
Đối với người lớn mắc bệnh ác tính dùng liều khuyến cáo là 120mg tiêm dưới da một lần mỗi 4 tuần vào vùng đùi, bụng hoặc cánh tay trên.
Đối với khối u tế bào khổng lồ ở xương: liều khuyến cáo cũng là 120mg tiêm dưới da mỗi 4 tuần. Thêm vào đó, trong tháng đầu tiên, bệnh nhân cần tiêm thêm 120mg vào ngày thứ 8 và ngày thứ 15. Những bệnh nhân đã phẫu thuật cắt bỏ hoàn toàn khối u cần tiếp tục điều trị trong 6 tháng theo đúng phác đồ. Cần đánh giá định kỳ để xác định lợi ích của việc điều trị cho bệnh nhân.
Cách tiêm: Xgeva 120mg có sẵn dưới dạng dung dịch 120mg/1,7mL trong lọ dùng một lần. Chỉ nên sử dụng dưới sự giám sát của chuyên gia y tế.
Trước khi tiêm, dung dịch cần được kiểm tra bằng mắt, không sử dụng thuốc nếu có dấu hiệu vẩn đục hoặc đổi màu. Không lắc dung dịch và để lọ thuốc ở nhiệt độ phòng trước khi tiêm để giảm cảm giác khó chịu. Sử dụng kim tiêm cỡ 27 và tiêm toàn bộ lượng dung dịch trong lọ.
4 Chống chỉ định
Không nên sử dụng thuốc Xgeva nếu bệnh nhân có:
Dị ứng với hoạt chất hoặc bất kỳ thành phần nào khác.
Hạ calci máu nghiêm trọng mà chưa được điều trị.
Tổn thương chưa lành sau phẫu thuật răng miệng.
==>> Bạn đọc có thể tham khảo thêm thuốc: Thuốc Messi-10 điều trị loãng xương và ngăn ngừa mất xương
5 Tác dụng không mong muốn của thuốc
Hạ calci máu có thể xảy ra phổ biến, đặc biệt trong 2 tuần đầu sau khi tiêm. Triệu chứng của hạ calci máu có thể nghiêm trọng, nhưng thường có thể kiểm soát bằng cách bổ sung calci và vitamin D.
Những tác dụng phụ thường gặp bao gồm đau xương và cơ, cũng như hoại tử xương hàm.
6 Tương tác
Chưa có nghiên cứu nào về tương tác thuốc với Xgeva 120mg. Trong các thử nghiệm lâm sàng, thuốc này đã được sử dụng cùng với các phương pháp điều trị ung thư khác mà không ghi nhận sự thay đổi lâm sàng nào về nồng độ huyết thanh của Denosumab.
7 Lưu ý khi sử dụng và bảo quản thuốc
7.1 Lưu ý và thận trọng
Tất cả bệnh nhân nên bổ sung calci và vitamin D, trừ khi có tình trạng tăng calci huyết.
Trong suốt quá trình điều trị, tình trạng hạ calci có thể xảy ra, vì vậy nồng độ calci cần được theo dõi trước liều đầu tiên, trong vòng hai tuần sau liều đầu tiên, hoặc khi có triệu chứng nghi ngờ hạ calci máu.
Bệnh nhân suy thận nặng hoặc đang thẩm phân máu có nguy cơ cao hơn về hạ calci máu. Cần theo dõi nồng độ calci thường xuyên ở những bệnh nhân này.
Hoại tử xương hàm (ONJ) là một biến chứng có thể xảy ra ở bệnh nhân dùng Xgeva 120mg. Do đó, ta cần trì hoãn điều trị ở những bệnh nhân có tổn thương mô mềm chưa lành trong miệng. Trước khi bắt đầu điều trị, bệnh nhân nên khám răng và đánh giá lợi ích - rủi ro.
Tăng calci máu có thể xảy ra sau khi ngừng điều trị với Xgeva 120mg, đặc biệt ở bệnh nhân có khối u tế bào khổng lồ ở xương.
Bệnh nhân đang điều trị bằng Xgeva 120mg không nên dùng các sản phẩm thuốc khác chứa denosumab hay bisphosphonate đồng thời.
7.2 Lưu ý sử dụng trên phụ nữ mang thai và bà mẹ cho con bú
Chưa có đủ dữ liệu về việc sử dụng thuốc Xgeva 120mg ở phụ nữ mang thai. Thuốc không được khuyến cáo cho nhóm đối tượng này, và phụ nữ nên tránh mang thai trong quá trình điều trị và ít nhất 5 tháng sau.
Hiện chưa biết Denosumab có bài tiết qua sữa mẹ hay không. Do đó cần cân nhắc lợi ích của việc cho con bú và liệu pháp điều trị cho mẹ.
7.3 Ảnh hưởng với quá trình vận hành máy móc, lái xe
Thuốc không có hoặc có ảnh hưởng không đáng kể đến khả năng lái xe và vận hành máy móc.
7.4 Xử trí khi quá liều
Chưa có dữ liệu về quá liều Xgeva 120mg trong các nghiên cứu lâm sàng. Thuốc đã được sử dụng với liều lên đến 180mg mỗi 4 tuần mà không ghi nhận vấn đề nghiêm trọng nào.
7.5 Bảo quản
Bảo quản Xgeva 120mg trong tủ lạnh (2°C - 8°C) và không được đông lạnh thuốc. Sau khi lấy ra khỏi tủ lạnh, thuốc có thể bảo quản ở nhiệt độ phòng (tối đa 25°C) trong 30 ngày nhưng không được để lại trong tủ lạnh.
8 Sản phẩm thay thế
Trong trường hợp thuốc Xgeva 120mg hết hàng, người bệnh có thể tham khảo thuốc có cùng hoạt chất như thuốc Prolia 60mg của Công ty Amgen Inc. giúp điều trị loãng xương ở phụ nữ và tăng khối lượng xương ở nam giới.
9 Cơ chế tác dụng
9.1 Dược lực học
RANKL là một protein quan trọng trong việc điều chỉnh tế bào hủy xương. Denosumab hoạt động bằng cách ngăn chặn tương tác giữa RANKL và RANK, từ đó giảm số lượng và chức năng tế bào hủy xương, làm giảm quá trình tiêu xương.
9.2 Dược động học
Sau khi tiêm dưới da, Sinh khả dụng của denosumab là 62%.
Denosumab chủ yếu được chuyển hóa theo con đường tự nhiên của immunoglobulin, không thông qua gan. Nồng độ denosumab tích lũy trong huyết thanh tăng gấp đôi sau 6 tháng điều trị.
Thời gian bán thải trung bình của denosumab là 28 ngày.
Phân tích dược động học cho thấy không có sự khác biệt lâm sàng đáng kể giữa các nhóm bệnh nhân khác nhau. Sự tăng cân nặng có thể ảnh hưởng đến sự phơi nhiễm nhưng không được coi là có ý nghĩa lâm sàng. [2]
10 Thuốc Xgeva 120mg giá bao nhiêu?
Thuốc Xgeva 120mg hiện nay đang được bán ở nhà thuốc online Trung Tâm Thuốc Central Pharmacy, giá sản phẩm có thể đã được cập nhật ở đầu trang. Hoặc để biết chi tiết về giá sản phẩm cùng các chương trình ưu đãi, bạn có thể liên hệ với dược sĩ đại học của nhà thuốc qua số hotline hoặc nhắn tin trên zalo, facebook.
11 Thuốc Xgeva 120mg mua ở đâu?
Thuốc Xgeva 120mg mua ở đâu chính hãng, uy tín nhất? Bạn có thể mang đơn mà bác sĩ có kê thuốc Xgeva 120mg để mua thuốc trực tiếp tại nhà thuốc Trung Tâm Thuốc Central Pharmacy tại địa chỉ: 85 Vũ Trọng Phụng, Thanh Xuân. Hoặc liên hệ qua số hotline/ nhắn tin trên website để được tư vấn sử dụng thuốc đúng cách.
12 Ưu điểm
- Xgeva 120mg giúp giảm nguy cơ gãy xương ở bệnh nhân có bệnh ác tính liên quan đến xương và ở những người có u tế bào khổng lồ ở xương.
- Thuốc được tiêm dưới da, giúp dễ dàng trong việc sử dụng so với một số thuốc khác cần uống hàng ngày.
- Thuốc không được chuyển hóa qua gan, giúp giảm rủi ro trong những bệnh nhân có vấn đề về gan.
- Giảm thiểu các biến cố liên quan đến xương có thể giúp cải thiện chất lượng cuộc sống cho bệnh nhân.
13 Nhược điểm
- Thuốc có thể xảy ra hạ Canxi máu, hoại tử xương hàm (ONJ), và gãy xương bất thường, điều này đòi hỏi phải theo dõi và quản lý cẩn thận.
- Bệnh nhân cần phải bổ sung calci và vitamin D, điều này có thể gây bất tiện và cần theo dõi thường xuyên.
Tổng 4 hình ảnh

Tài liệu tham khảo
- ^ Tác giả Kristen S Pan, Alison M Boyce (Ngày đăng tháng 04 năm 2021). Denosumab Treatment for Giant Cell Tumors, Aneurysmal Bone Cysts, and Fibrous Dysplasia-Risks and Benefits - PubMed. Truy cập ngày 09 tháng 10 năm 2024
- ^ Tác giả Winnie Sohn, Mary Ann Simiens (Ngày đăng tháng 09 năm 2014). The pharmacokinetics and pharmacodynamics of denosumab in patients with advanced solid tumours and bone metastases: a systematic review - PubMed. Truy cập ngày 09 tháng 10 năm 2024