Tehep-B
Thuốc kê đơn
Thuốc kê đơn quý khách vui lòng điền thông tin/ chat vào phần liên hệ này để dược sĩ tư vấn và đặt hàng
| Thương hiệu | Dược Phẩm Đạt Vi Phú (Davipharm), Công ty Cổ phần Dược phẩm Đạt Vi Phú |
| Công ty đăng ký | Công ty Cổ phần Dược phẩm Đạt Vi Phú |
| Số đăng ký | VD-31637-19 |
| Dạng bào chế | Viên nén bao phim |
| Quy cách đóng gói | Hộp 4 vỉ x 7 viên |
| Hoạt chất | Tenofovir |
| Xuất xứ | Việt Nam |
| Mã sản phẩm | aa6969 |
| Chuyên mục | Thuốc Kháng Virus |
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
 Biên soạn: Dược sĩ Kiều Trang
Biên soạn: Dược sĩ Kiều Trang
Dược sĩ lâm sàng - Đại học Y Dược Thái Bình
Ngày đăng
Cập nhật lần cuối:
- Chi tiết sản phẩm
- Hỏi & Đáp 0
- Đánh giá 0
Thuốc Tehep-B được chỉ định trong điều trị HIV, điều trị viêm gan B mạn tính. Sau đây, Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) xin gửi đến quý bạn đọc những thông tin chi tiết về công dụng, liều dùng, cách dùng của Thuốc Tehep-B.
1 Thành phần
Thành phần: Mỗi viên thuốc Tehep-B chứa:
Hoạt chất: Tenofovir disoproxil fumarate 300mg.
Tá dược (microcrystalline M101, Lactose monohydrate, PVP K30, magnesium stearate, croscarmellose sodium, Silicon dioxyde, hydroxypropylmethylcellulose, talc, titan dioxyd, polyethylen glycol 6000, màu black PN, màu brilliant blue) vừa đủ 1 viên.
Dạng bào chế: Viên nén bao phim
==>> Xin mời bạn đọc tham khảo thuốc có cùng hoạt chất [CHÍNH HÃNG] Thuốc Fovirpoxil 300mg - điều trị viêm gan B và HIV-1
2 Tác dụng - Chỉ định của Thuốc Tehep-B
2.1 Tác dụng của Thuốc Tehep-B
2.1.1 Dược lực học
Thuốc Tehep-B có chứa hoạt chất Tenofovir disoproxil fumarate (TDF) - bị thủy phân bởi các este trong huyết tương và ruột trở thành tenofovir, tenofovir sau đó được kích hoạt thành tenofovir–diphosphate nội bào. Tenofovir–diphosphate ức chế sự nhân lên của HIV bằng cách cạnh tranh với cơ chất deoxyadenosine 5′-triphosphate kết hợp vào DNA trong quá trình phiên mã của HIV và ức chế sự sao chép của HBV bằng cách ức chế HBV polymerase [1].
2.1.2 Dược động học
Hấp thu: Ở bệnh nhân nhiễm HIV, TDF hấp thu nhanh và được chuyển hóa thành tenofovir. Sử dụng TDF trong bữa ăn lặp lại nhiều lần cho kết quả Cmax = 326 ng/ml, AUC = 3324 ng.h/ml, Cmin = 64,4 ng/ml. Cmax đạt được sau khi uống thuốc lúc đói và trong bữa ăn lần lượt là sau 1 giờ, sau 2 giờ. Sinh khả dụng đường uống của TDF ở bệnh nhân sử dụng thuốc lúc đói là khoảng 25%. Dùng TDF với thức ăn giàu chất béo làm tăng AUC xấp xỉ 40% và Cmax xấp xỉ 14%. Đối với liều đầu tiên TDF uống cùng bữa ăn, Cmax trung bình dao động trong khoảng 213-375 ng/ml. Dùng TDF với bữa ăn nhẹ không ảnh hưởng đến sự hấp thu thuốc.
Phân bố: Theo các kết quả nghiên cứu tiền lâm sàng, sau khi sử dụng TDF đường uống, tenofovir phân bố vào hầu hết các mô trong cơ thể, với tỷ lệ cao nhất ở thận, gan, ruột. Với khoảng nồng độ tenofovir trong huyết thanh 0,01-25µg/ml là khoảng dưới 0,7-7,2%.
Chuyển hóa: Cả TDF và tenofovir đều không phải cơ chất của CYP450. Tenofovir không chuyển hóa thông qua bất kì đồng dạng nào của CYP450 liên quan đến chuyển hóa thuốc (CYP3A4, CYP2D6, CYP2C9, CYP2E1 hoặc CYP1A1/2). TDF có tác dụng lên đồng dạng CYP1A1/2 của CYP450 với mức giảm nhẹ 6% có ý nghĩa thống kê. Do đó, không có khả năng xảy ra tương tác có ý nghĩa lâm sàng đáng kể đến TDF với các sản phẩm thuốc chuyển hóa nhờ CYP450.
Thải trừ: Đào thải qua hệ thống vận chuyển tích cực ở ống thận đóng vai trò rất quan trọng trong thải trừ tenofovir. Đối với thuốc sử dụng đường uống, t1/2 trong khoảng 12-18 giờ.
Tenofovir được các chất vận chuyển aninon hữu cơ (hOAT) 1 và 3 đưa từ ống thận vào tế bào ống lượn gần và sau đó được protein đa kháng thuốc 4 (MRP 4) đưa vào nước tiểu
Dược động học của tenofovir không phụ thuộc liều TDF trong khoảng 75-600mg.
Chưa có nghiên cứu về dược động học ở bệnh nhân trên 65 tuổi.
Dược động học của tenofovir không bị ảnh hưởng nhiều bởi giới tính.
Dược động học ở trẻ em:
- Bệnh nhân vị thành niên (12-18 tuổi) nhiễm HIV: Sinh khả dụng của thuốc tương tự đối với người trưởng thành.
- Bệnh nhân vị thành niên nhiễm viêm gan B mạn tính: Sinh khả dụng của thuốc tương tự ở bệnh nhân trưởng thành.
- Chưa thực hiện nghiên cứu dược động học ở trẻ dưới 12 tuổi hoặc trẻ suy thận.
Dược động học ở bệnh nhân suy thận: Ở những đối tượng có độ thanh thải creatinin dưới 50 ml/ph hoặc suy thận giai đoạn cuối cần lọc máu, Cmax, AUC của tenofovir tăng lên
| ClCr (ml/ph) | >80 (N=3) | 50-80 (N=10) | 30-49 (N=8) | 12-29 (N=11) |
Cmax (µg/ml) | 0.34 ± 0.03 | 0.33 ± 0.06 | 0.37 ± 0.16 | 0.60 ± 0.19 |
AUC (µg∙h/ml) | 2.18 ± 0.26 | 3.06 ± 0.93 | 6.01 ± 2.50 | 15.98 ± 7.22 |
Độ thanh thải biểu kiến (Cl/F (mL/ph)) | 1043.7 ± 115.4 | 807.7 ± 279.2 | 444.4 ± 209.8 | 177.0 ± 97.1 |
Độ thanh thải thận (mL/ph) | 243.5 ± 33.3 | 168.6 ± 27.5 | 100.6 ± 27.5 | 43.0 ± 31.2 |
Dược động học ở bệnh nhân suy gan: Không có sự thay đổi đáng kể. Không cần điều chỉnh liều.
2.2 Chỉ định thuốc Tehep-B
2.2.1 Điều trị nhiễm HIV-1
Tehep-B phối hợp với các thuốc kháng retrovirus khác để điều trị nhiễm HIV-1 ở người trưởng thành và thanh thiếu niên 12-18 tuổi có đề kháng với thuốc ức chế men phiên mã ngược buleotid (NRTIs) hoặc không sử dụng được các thuốc này.
Cần định liều dựa trên thử nghiệm đề kháng virus của mỗi cá nhân và quá trình điều tị của bệnh nhân trước đó.
2.2.2 Điều trị nhiễm virus viêm gan B
Tehep-B được chỉ định trong điều trị viêm gan B mạn ở người trưởng thành có:
Bệnh gan còn bù, virus tiếp tục nhân lên, tăng ALT huyết thanh dai dẳng, viêm (có bằng chứng mô học) và/hoặc xơ gan hoạt động.
Virus viêm gan B đề kháng với Lamivudin.
Bệnh viêm gan mất bù.
Tehep-B được chỉ định trong điều trị viêm gan B mạn tính ở trẻ vị thành niên (12-18 tuổi) có bệnh gan còn bù có sự nhân lên của virus viêm gan, ALT huyết thanh tăng cao liên tục, viêm (có bằng chứng mô học) và/hoặc xơ gan hoạt động.
3 Liều dùng - Cách dùng thuốc Tehep-B
3.1 Liều dùng
3.1.1 Liều dùng cho bệnh nhân trưởng thành
Liều khuyến cáo để điều trị HIV/viêm gan B mạn là 1 viên x 1 lần/ngày trong bữa ăn.
Đối với viêm gan B mạn: Chưa có thời gian điều trị tối ưu được khuyến cáo chính thức. Có thể ngừng điều trị nếu cáo các dấu hiệu:
- Bệnh nhân có HBeAg (+) không có xơ gan, nên điều trị trong ít nhất 6-12 tháng sau khi xét nghiệm có biến động mức HBe huyết thanh (giảm HBeAg và HBV DNA khi phát hiện anti-HBe) hoặc đến khi mức HBs có biến động, hoặc giảm hiệu quả điều trị. Mức ALT và HBV DNA huyết thanh cần được theo dõi thường xuyên sau khi dừng điều trị để đề phòng sự tái phát muộn của virus.
- Bệnh nhân có HBeAg (-) không xơ gan, nên điều trị tối thiểu cho đến khi có biến động mức HBs huyết thanh hoặc có bằng chứng cho thấy sự giảm hiệu quả. Khi điều trị kéo dài hơn 2 năm, nên đánh giá lại định kỳ để xác nhận việc điều trị còn phù hợp với bệnh nhân hay không.
3.1.2 Liều dùng cho trẻ em
Bệnh nhân nhiễm HIV-1:
- Đối với thanh thiếu niên 12-18 tuổi, trọng lượng ≥ 35 kg, liều khuyến cáo là 1 viên x 1 lần/ngày trong bữa ăn.
- Đối với bệnh nhi 2-12 tuổi: Cần giảm liều, xem xét điều trị bằng phương pháp khác.
- Bệnh nhi <2 tuổi: Không có dữ liệu về hiệu quả và độ an toàn.
Bệnh nhân viêm gan B mạn tính
- Đối với thanh thiếu niên 12-18 tuổi, trọng lượng ≥ 35 kg, liều khuyến cáo là 1 viên x 1 lần/ngày trong bữa ăn. Chưa có dữ liệu chính thức về thời gian điều trị tối ưu.
- Bệnh nhi <2 tuổi, trọng lượng < 35 kg: Chưa có dữ liệu về độ an toàn và hiệu quả.
3.1.3 Liều dùng cho bệnh nhân cao tuổi
Không có nghiên cứu chính thức để đưa ra khuyến nghị về liều cho đối tượng > 65 tuổi.
3.1.4 Liều dùng cho bệnh nhân suy thận
TDF đào thải qua thận nên đáp ứng thuốc tăng lên ở bệnh nhân có chức năng thận suy giảm.
Bệnh nhân suy thận trưởng thành:
- Suy thận nhẹ (ClCr dao động trong khoảng 50-80 ml/ph): Dữ liệu hạn chế chỉ ra rằng nên dùng liều 1 viên x 1 lần/ngày.
- Suy thận trung bình (ClCr dao động trong khoảng 30-49 ml/ph): Có thể sử dụng mức liều 1 viên mỗi 48 giờ nhưng điều này chưa được chứng minh lâm sàng nên cần theo dõi chặt chẽ đáp ứng điều trị và chức năng thận của bệnh nhân.
- Suy thận nặng (ClCr < 30 ml/ph): Nếu không có phương pháp điều trị thay thế, có thể điều chỉnh bằng cách kéo dài thời gian giữa các liều: Bệnh nhân suy thận nặng - dùng 1 viên x 2 lần/tuần, bệnh nhân chạy thận nhân tạo - dùng 1 viên x 1 lần/tuần sau khi đã hoàn thành chạy thận. Tuy nhiên sự điều chỉnh này chưa được chứng minh hiệu quả bằng các nghiên cứu lâm sàng, việc sử dụng ngắt quãng trong thời gian dài là không tối ưu do nguy cơ tăng độc tính và có thể không đem lại hiệu quả đầy đủ nên cần theo dõi chặt chẽ đáp ứng của bệnh nhân đối với điều trị và chức năng thận.
- Bệnh nhân chạy thận nhân tạo có ClCr < 10 ml/ph: Không có khuyến cáo về liều.
Bệnh nhi suy thận: Không khuyến cáo dùng thuốc cho các đối tượng này [2].
3.2 Cách dùng Thuốc Tehep-B an toàn và hiệu quả
Nên uống thuốc trong bữa ăn. Nếu bệnh nhân có tình trạng gây khó nuốt, có thể hòa tan viên thuốc trong tối thiểu 100 ml nước lọc, nước cam hoặc nho.
4 Chống chỉ định
Tehep-B chống chỉ định trong trường hợp quá mẫn với hoạt chất hoặc bất kì tá dược nào của thuốc.
5 Tác dụng phụ
Các tác dụng không mong muốn rất phổ biến: hạ phosphat huyết, chóng mặt, tiêu chảy, nôn, buồn nôn, phát ban, cơ thể suy nhược.
Các tác dụng không mong muốn phổ biến: đau đầu, đau bụng, chướng bụng, đày hơi, tăng transaminase, mệt mỏi.
Tác dụng không mong muốn ít gặp: hạ Kali máu, viêm tụy, tăng creatinin, bệnh ở ống lượn gần (bao gồm cả hội chứng Fanconi).
6 Tương tác
6.1 Các thuốc không được khuyến cáo sử dụng đồng thời với Tehep-B
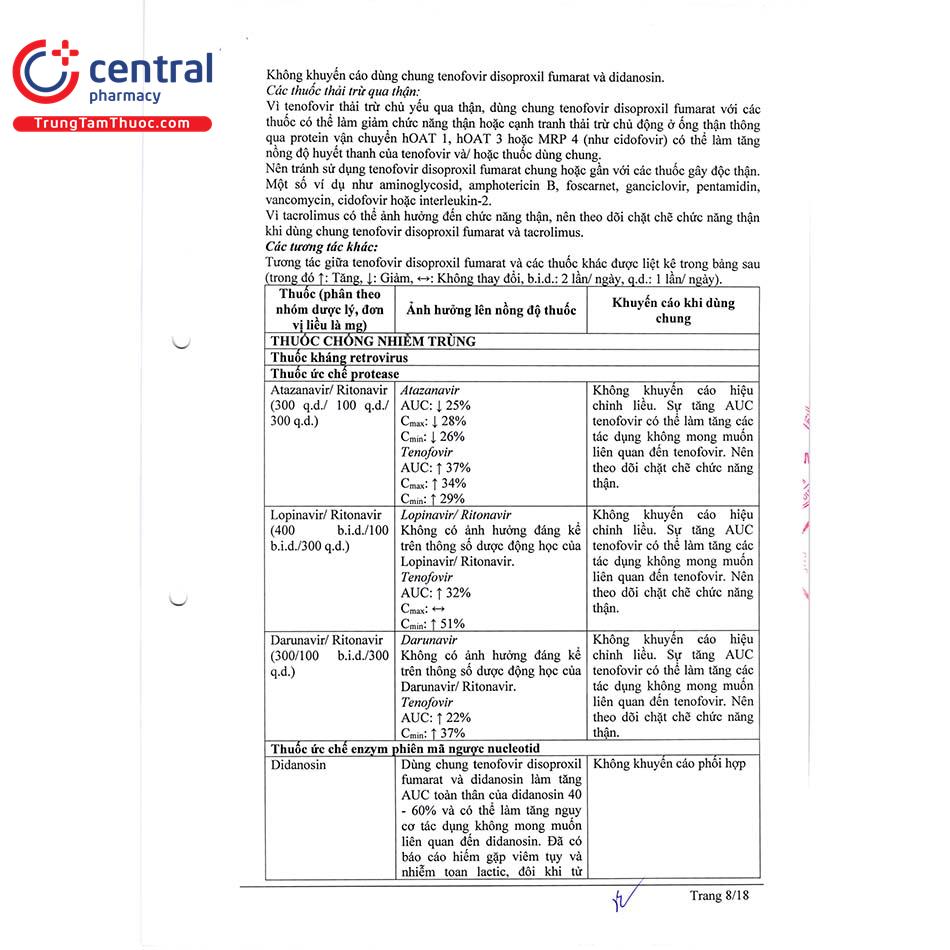
Không nên dùng đồng thời Tehep-B với các sản phẩm thuốc khác chứa TDF hoặc tenofovir alafenamide, thuốc chứa adefovir dipivoxil.
Không khuyến cáo dùng đồng thời Tehep-B với didanosine.
Tehep-B - các thuốc đào thải qua thận (cidofovir): Kết hợp này có thể làm tăng nồng độ của TDF hoặc các thuốc phối hợp trong máu. Nên tránh sử dụng đồng thời hoặc sử dụng gần TDF với sản phẩm gây độc thận (aminoglycosid, amphotericin B, foscarnet, Ganciclovir, pentamidin, Vancomycin, cidofovir, interleukin-2). Tacrolimus có thể làm ảnh hưởng đến chức năng thận, phải theo dõi chặt chẽ bệnh nhân khi sử dụng phối hợp này.
Thuốc | Khuyến cáo |
Atazanavir/Ritonavir (300 qd/100 qd) | Không cần điều chỉnh liều. Sự tăng đáp ứng với tenofovir làm tăng tác dụng phụ, đặc biệt cần chú ý theo dõi chức năng thận. |
Lopinavir/Ritonavir (400 b.i.d./100 b.i.d.) | Không cần điều chỉnh liều. Sự tăng đáp ứng với tenofovir làm tăng tác dụng phụ, đặc biệt cần chú ý theo dõi chức năng thận. |
Darunavir/Ritonavir (300/100 b.i.d.) | Không cần điều chỉnh liều. Sự tăng đáp ứng với tenofovir làm tăng tác dụng phụ, đặc biệt cần chú ý theo dõi chức năng thận. |
Didanosine | Không khuyến cáo sử dụng đồng thời |
Adefovir dipivoxil | Không nên sử dụng đồng thời |
Entecavir | Không có tương tác đáng kể về dược động học |
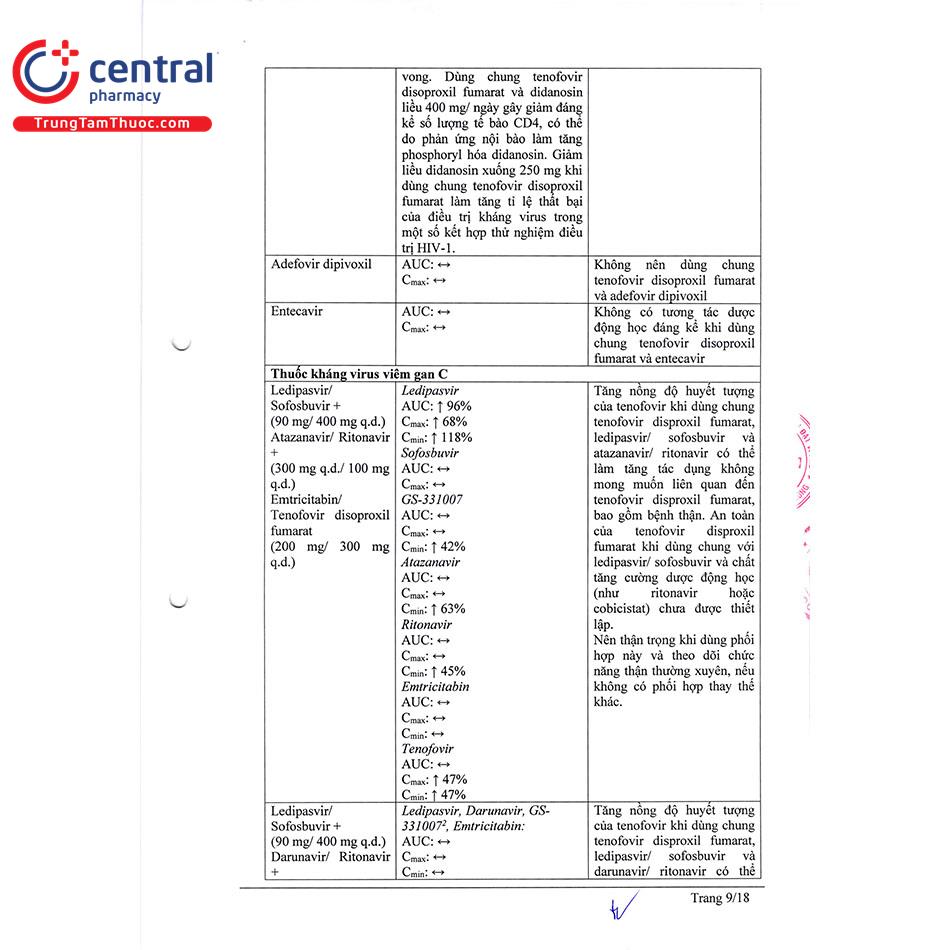
Ledipasvir/Sofosbuvir (90 mg/400 mg q.d.)+ Atazanavir/Ritonavir (300 mg q.d./100 mg q.d.)- + Emtricitabine/Tenofovir disoproxil (200 mg/ 245 mg q.d.) | Cần thận trọng khi sử dụng phối hợp, cần theo dõi chức năng thận thường xuyên nếu không có biện pháp điều trị thay thế. |
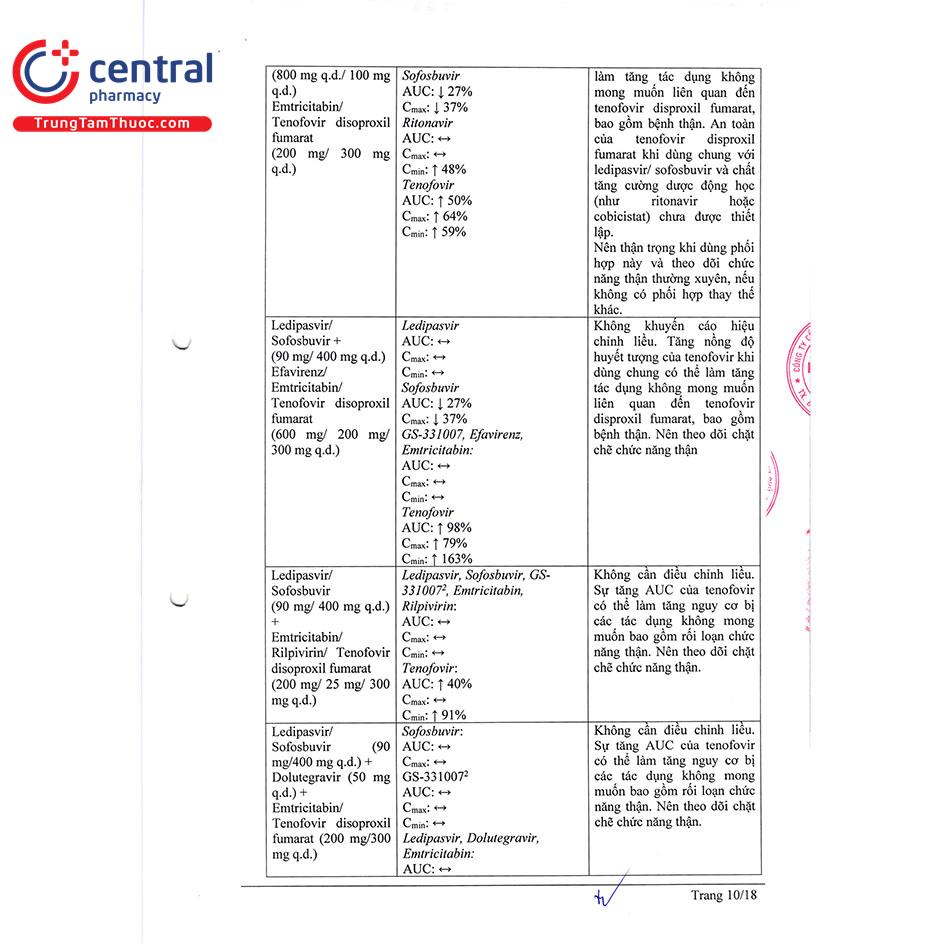
Ledipasvir/Sofosbuvir (90 mg/400 mg q.d.) + Darunavir/Ritonavir (800 mg q.d./100 mg q.d.) + Emtricitabine/Tenofovir disoproxil (200 mg/ 245mg q.d.) | Cần thận trọng khi sử dụng phối hợp, cần theo dõi chức năng thận thường xuyên nếu không có biện pháp điều trị thay thế. |
Ledipasvir/Sofosbuvir (90 mg/400 mg q.d.)- + Efavirenz/Emtricitabine/Tenofovir disoproxil (600 mg/200 mg/ 245 mg q.d.) | Không cần điều chỉnh liều. Sự tăng đáp ứng với tenofovir làm tăng tác dụng phụ, đặc biệt cần chú ý theo dõi chức năng thận. |
Ledipasvir/Sofosbuvir ( 90 mg/400 mg q.d.) + Emtricitabine/Rilpivirine/Tenofovir disoproxil (200 mg/25 mg/ 245 mg q.d.) | Không cần điều chỉnh liều. Sự tăng đáp ứng với tenofovir làm tăng tác dụng phụ, đặc biệt cần chú ý theo dõi chức năng thận. |
Ledipasvir/Sofosbuvir (90 mg/400 mg q.d.) + Dolutegravir (50 mg q.d.) + Emtricitabine/Tenofovir disoproxil (200 mg/ 245 mg q.d.) | Không cần điều chỉnh liều. Sự tăng đáp ứng với tenofovir làm tăng tác dụng phụ, đặc biệt cần chú ý theo dõi chức năng thận. |
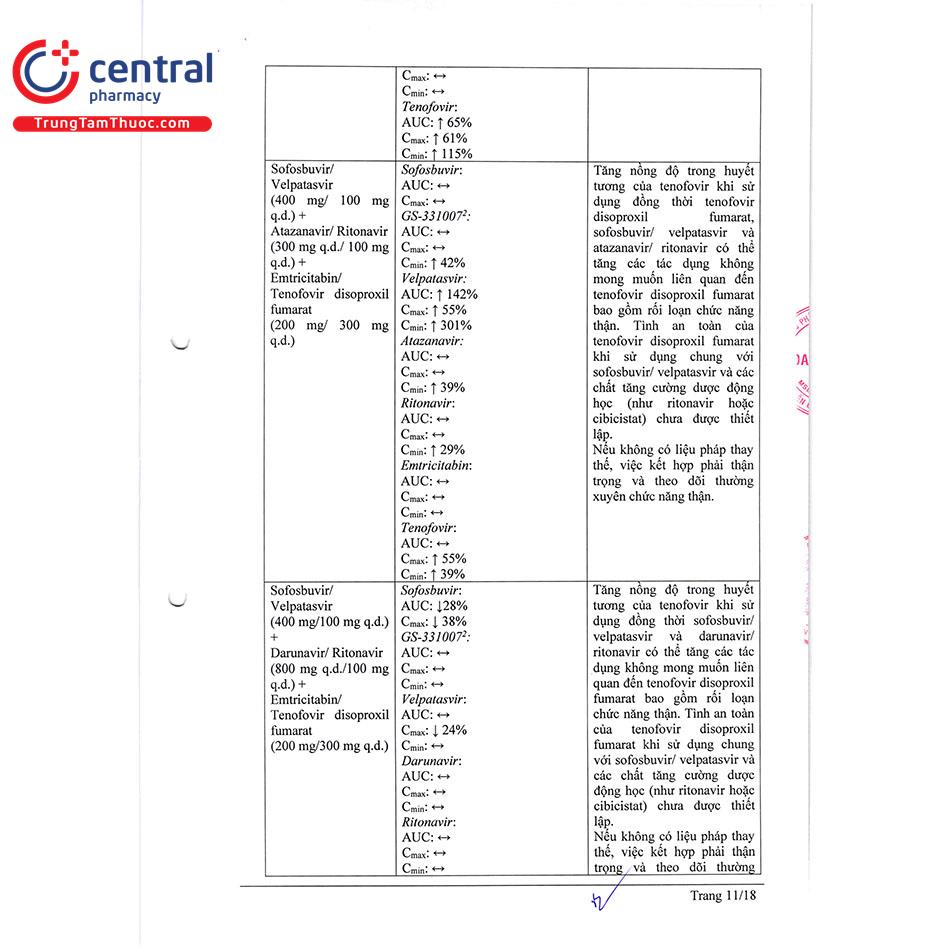
Sofosbuvir/Velpatasvir (400 mg/100 mg q.d.) + Atazanavir/Ritonavir (300 mg q.d./100 mg q.d.) + Emtricitabine/Tenofovir disoproxil (200 mg/ 245 mg q.d.) | Cần thận trọng khi sử dụng phối hợp, cần theo dõi chức năng thận thường xuyên. |
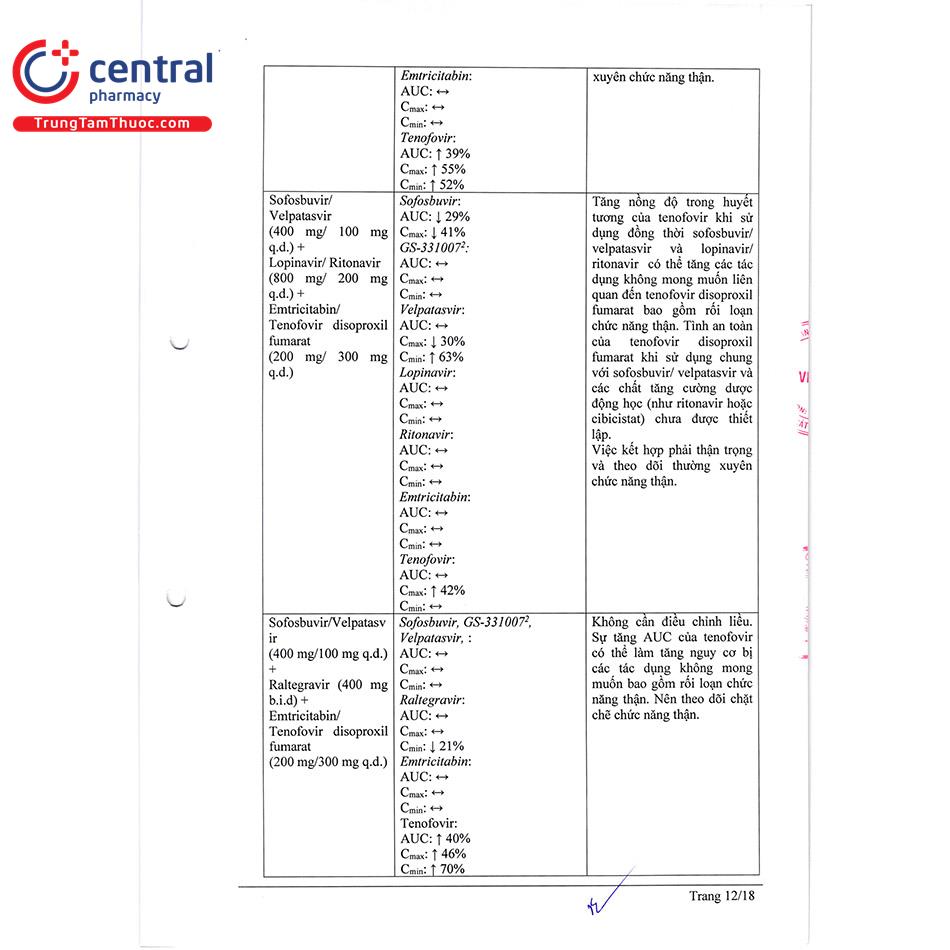
Sofosbuvir/Velpatasvir (400 mg/100 mg q.d.) + Lopinavir/Ritonavir (800 mg/200 mg q.d.) + Emtricitabine/Tenofovir disoproxil (200 mg/ 245 mg q.d.) | Cần thận trọng khi sử dụng phối hợp, cần theo dõi chức năng thận thường xuyên. |
Sofosbuvir/Velpatasvir (400 mg/100 mg q.d.) + Raltegravir (400 mg b.i.d) + Emtricitabine/Tenofovir disoproxil (200 mg/ 245 mg q.d.) | Không cần điều chỉnh liều. Sự tăng đáp ứng với tenofovir làm tăng tác dụng phụ, đặc biệt cần chú ý theo dõi chức năng thận. |
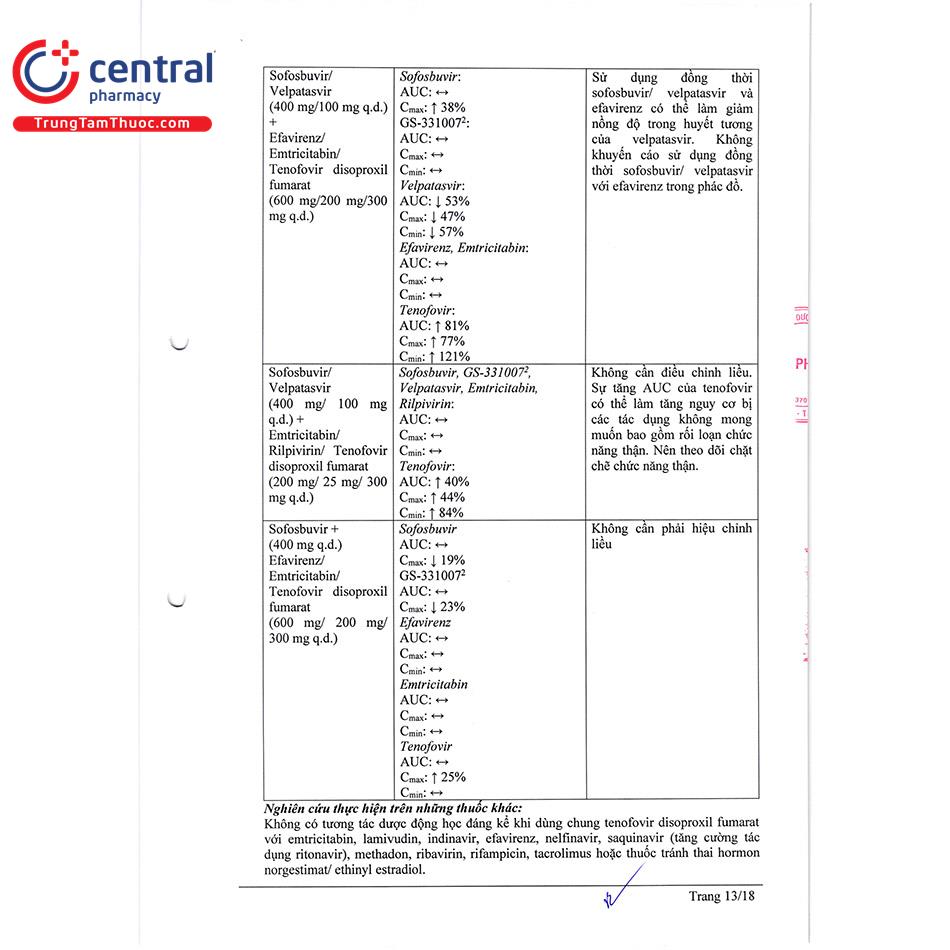
Sofosbuvir/Velpatasvir (400 mg/100 mg q.d.) + Efavirenz/Emtricitabine/Tenofovir Disoproxil (600 mg/200 mg/ 245 mg q.d.) | Sử dụng đồng thời sofosbuvir/velpatasvir và efavirenz có thể làm giảm nồng độ velpatasvir trong máu. Không khuyến cáo sử dụng đồng thời sofosbuvir/velpatasvir efavirenz. |
Sofosbuvir/Velpatasvir (400 mg/100 mg q.d.) + Emtricitabine/Rilpivirine/Tenofovir disoproxil (200 mg/25 mg/ 245 mg q.d.) | Không cần điều chỉnh liều. Sự tăng đáp ứng với tenofovir làm tăng tác dụng phụ, đặc biệt cần chú ý theo dõi chức năng thận. |
Sofosbuvir/Velpatasvir/Voxilaprevir (400 mg/100 mg/100 mg+100 mg q.d.)3 + Darunavir (800 mg q.d.) + Ritonavir (100 mg q.d.) + Emtricitabine/Tenofovir disoproxil (200 mg/245 mg q.d.) | Cần thận trọng khi sử dụng phối hợp, cần theo dõi chức năng thận thường xuyên. |
Sofosbuvir (400 mg q.d.) + Efavirenz/Emtricitabine/Tenofovir disoproxil (600 mg/200 mg/ 245 mg q.d.) | Không cần điều chỉnh liều. |
6.2 Các tương tác khác
Thuốc phải uống trong khi ăn vì thức ăn làm tăng sinh khả dụng của TDF.
==>> Kính mời bạn đọc tham khảo thêm thuốc [CHÍNH HÃNG] Thuốc Teravir-AF 25mg điều trị viêm gan siêu vi B
7 Lưu ý khi sử dụng và bảo quản
7.1 Lưu ý và thận trọng
7.1.1 Đợt viêm gan cấp sau khi kết thúc điều trị
Có thể xảy ra đợt viêm gan cấp nặng khi bệnh nhân kết thúc điều trị bằng TDF nên cần được theo dõi chặt chẽ cả về mặt lâm sàng và chỉ số xét nghiệm trong ít nhất vài tháng sau khi kết thúc điều trị bằng Tehep-B.
7.1.2 Suy thận mới khởi phát hoặc có tình trạng trầm trọng hơn
Do tenofovir chủ yếu được đào thải qua thận nên đã ghi nhận các trường hợp suy thận.
Nên đánh giá chỉ số độ thanh thải creatinin ở bệnh nhân trước khi bắt đầu sử dụng thuốc. Đối với bệnh nhân có nguy cơ cao suy chức năng thận, nên được đánh giá chỉ số ClCr, phospho huyết thanh, Glucose và protein niệu trước khi điều trị và định kỳ trong quá trình điều trị.
Cần điều chỉnh liều đối với các bệnh nhân có chức năng thận suy giảm (xem phần liều dùng).
Nên tránh dùng viên nén Tenofovir disoproxil fumarate khi sử dụng đồng thời hoặc gần đây một tác nhân gây độc cho thận (xem phần Tương tác).
7.1.3 Tăng acid lactic/Gan to, nhiễm mỡ nặng
Tăng acid lactic, gan to nặng có nhiễm mỡ, thậm chí dẫn đến tử vong đã xảy ra khi sử dụng TDF đơn độc hoặc kết hợp với các thuốc kháng retrovirus. Nên ngừng điều trị cho các bệnh nhân có bất kỳ dấu hiệu nào gợi ý tăng Acid Lactic và nhiễm độc gan rõ rệt.
7.1.4 Phối hợp với các sản phẩm thuốc khác
Không nên sử dụng Tehep-B với các thuốc khác chứa các thuốc khác có chứa TDF hoặc tenofovir alafenamid, adefovir dipivoxil, didanosine (Xem phần tương tác).
7.1.5 Bệnh nhân nhiễm đồng thời HIV-1 và HBV
Do nguy cơ đề kháng của HIV-1, cần sử dụng phối hợp với các thuốc kháng virus khác để điều trị cho bệnh nhân đồng nhiễm HIV-1 và HBV.
Nên xét nghiệm kháng thể HIV-1 cho bệnh nhân nhiễm HBV và xét nghiệm viêm gan B mạn tính cho bệnh nhân nhiễm HIV-1 trước khi điều trị bằng Tehep-B.
7.1.6 Ảnh hưởng của thuốc lên xương
TDF có thể làm giảm mật độ khoáng của xương, tuy nhiên ảnh hưởng của những thay đổi mật độ khoáng xương do TDF đối với sức khỏe xương và nguy cơ gãy xương trong thời gian dài là không chắc chắn. Nếu phát hiện dấu hiệu gợi ý bất thường về xương ở bệnh nhi, cần tham khảo ý kiến bác sỹ ngay.
7.1.7 Hội chứng phục hồi miễn dịch
Hội chứng phục hồi miễn dịch đã được quan sát thấy ở bệnh nhân nhiễm HIV được điều trị bằng TDF. Trong giai đoạn đầu điều trị bằng phương pháp kết hợp các thuốc kháng virus, bệnh nhân có hệ thống miễn dịch đáp ứng có thể xuất hiện các phản ứng viêm để chống lại các bệnh nhiễm trùng cơ hội, điều này có thể cần phải đánh giá thêm và được điều trị thích hợp.
Rối loạn tự miễn cũng được cảnh báo rằng có nguy cơ xảy ra trong quá trình phục hồi miễn dịch, tuy nhiên thời gian khởi phát thường muộn (có thể là nhiều tháng sau khi bắt đầu điều trị).
7.1.8 Nguy cơ thất bại khi điều trị nhiễm virus
Một số chế độ điều trị chứa 3 thuốc có cơ chế ức chế men sao chép ngược nucleoside (NRTI) kém hiệu quả hơn so với chế độ 2 NRTI phối hợp với một thuốc ức chế men sao chép ngược không phải nucleoside hoặc chất ức chế Protease của HIV-1, trong một số trường hợp thậm chí dẫn đến thất bại trong điều trị và kháng thuốc. Do đó, chế độ điều trị sử dụng 3 nucleoside cần được cân nhắc kĩ lưỡng. Bệnh nhân đang được điều trị bằng chế độ này cần được theo dõi sát sao để điều chỉnh.
7.2 Lưu ý sử dụng trên phụ nữ mang thai và bà mẹ cho con bú
7.2.1 Sử dụng thuốc trong thời kì mang thai
Không có dị tật hoặc độc tính trên thai nhi/trẻ sơ sinh liên quan đến TDF. Nghiên cứu trên động vật không cho thấy độc tính sinh sản. Việc sử dụng TDF có thể chấp nhận được nếu cần. Trong các tài liệu y văn, sử dụng TDF trong thai kì cho mẹ và phối hợp globulin miễn dịch viêm gan B, vaccin viêm gan B cho trẻ sơ sinh làm giảm nguy cơ lây truyền HBV từ mẹ sang con.
7.2.2 Sử dụng thuốc trong thời kì cho con bú
Trẻ sơ sinh có thể bú mẹ bị viêm gan B nếu đã thực hiện các biện pháp thích hợp để phòng ngừa viêm gan B khi sinh.
Theo nguyên tắc chung, trẻ không nên bú mẹ nhiễm HIV để phòng nguy cơ lây nhiễm.
7.2.3 Ảnh hưởng của thuốc lên khả năng sinh sản
Không có dữ liệu lâm sàng về ảnh hưởng của TDF lên khả năng sinh sản ở người. Nghiên cứu ở động vật không cho thấy ảnh hưởng của TDF đến khả năng sinh sản.
7.3 Ảnh hưởng của thuốc lên khả năng lái xe và vận hành máy móc
Chưa có nghiên cứu về ảnh hưởng của thuốc lên khả năng lái xe hoặc vận hành máy móc tuy nhiên cần được cảnh báo về khả năng chóng mặt.
7.4 Xử trí khi quá liều
Triệu chứng: như tác dụng không mong muốn, cần được điều trị thường quy khi cần.
Xử trí: Do nhân viên y tế thực hiện, có thể thực hiện thẩm tách máu, chưa rõ về hiệu quả của thẩm phân phúc mạc.
7.5 Làm gì khi quên một liều?
Nếu bệnh nhân quên một liều TDF trong vòng 12 giờ kể từ thời điểm thông thường, bệnh nhân nên sử dụng thuốc kèm với thức ăn càng sớm càng tốt và tiếp tục dùng thuốc ở thời điểm như thường lệ. Nếu thời gian quên liều vượt quá 12 giờ, bỏ qua liều đã quên và uống liều tiếp theo như thường lệ.
Nếu nôn trong vòng 1 giờ sau khi uống thuốc, uống bù 1 viên khác. Sau 1 giờ thì không cần.
7.6 Bảo quản
Bảo quản ở nhiệt độ không quá 30°C ở nơi khô ráo, thoáng mát, tránh ánh sáng trực tiếp.
8 Nhà sản xuất
Công ty Cổ phần Dược phẩm Đạt Vi Phú
SĐK: VD-31637-19
Đóng gói: Hộp 4 vỉ x 7 viên
9 Thuốc Tehep-B giá bao nhiêu?
Thuốc Tehep-B hiện nay đang được bán ở nhà thuốc online Trung Tâm Thuốc Central Pharmacy, giá Tehep-B có thể đã được cập nhật ở đầu trang. Hoặc để biết chi tiết về giá sản phẩm cùng các chương trình ưu đãi, bạn có thể liên hệ với nhân viên nhà thuốc qua số hotline 0927426789 để được tư vấn thêm.
10 Thuốc Tehep-B mua ở đâu?
Thuốc Tehep-B mua ở đâu chính hãng, uy tín nhất? Bạn có thể mang đơn mà bác sĩ có kê Thuốc Tehep-B để mua thuốc trực tiếp tại nhà thuốc Trung Tâm Thuốc Central Pharmacy tại địa chỉ: 85 Vũ Trọng Phụng, Thanh Xuân, Hà Nội. Hoặc liên hệ qua số hotline/ nhắn tin trên website để được tư vấn sử dụng thuốc đúng cách.
11 Ưu điểm
- Thuốc được sản xuất bởi Công ty Cổ phần Dược phẩm Đạt Vi Phú - được Bộ Y tế định kỳ đánh giá khả năng đáp ứng tiêu chuẩn WHO-GMP, đảm bảo yêu cầu về chất lượng với giá cả phù hợp với người tiêu dùng Việt Nam.
- Thực hiện nghiên cứu in vivo, Robbins và cộng sự đã chứng minh hoạt tính kháng HIV của TDF tăng hơn 100 lần so với tenofovir. Họ cho rằng sự cải thiện này là do sự hấp thu TDF nội bào nhanh chóng, dẫn đến sự gia tăng tích lũy nội bào của hoạt chất tenofovir–diphosphate [3].
- TDF đã chứng minh khả năng ức chế virus, bình thường hóa mức ALT, cải thiện tình trạng xơ hóa gan và không phát hiện thấy kháng thuốc ở bệnh nhân châu Á và không phải châu Á bất kể tình trạng HBeAg ban đầu [4].
12 Nhược điểm
- Mặc dù dữ liệu hiện có cho thấy rằng việc sử dụng phác đồ điều trị kháng retrovirus có chứa TDF dường như an toàn cho phụ nữ mang thai nhiễm HIV và trẻ sơ sinh con họ, nhưng dữ liệu vẫn còn hạn chế và một số nghiên cứu đề cập đến độc tính lên mẹ hoặc sự phát triển của trẻ sơ sinh và sự ảnh hưởng đến xương. [5].
- Việc sử dụng thuốc phải có đơn của bác sỹ, phải tuân thủ nghiêm ngặt hướng dẫn về chỉ định và cách sử dụng thuốc.
Tổng 22 hình ảnh














Tài liệu tham khảo
- ^ Tác giả Chanie Wassner, ngày đăng: tháng 12 năm 2020, A Review and Clinical Understanding of Tenofovir: Tenofovir Disoproxil Fumarate versus Tenofovir Alafenamide, Pubmed, ngày truy cập: 03/03/2023
- ^ Hướng dẫn sử dụng thuốc do nhà sản xuất cung cấp, tải bản PDF tại đây
- ^ Tác giả B L Robbins, ngày đăng: Tháng 3 năm 1998, Anti-human immunodeficiency virus activity and cellular metabolism of a potential prodrug of the acyclic nucleoside phosphonate 9-R-(2-phosphonomethoxypropyl)adenine (PMPA), Bis(isopropyloxymethylcarbonyl)PMPA, Pubmed, ngày truy cập 03/03/2023
- ^ Tác giả Calvin Q Pan, ngày đăng: ngày 14 tháng 05 năm 2015, Similar efficacy and safety of tenofovir in Asians and non-Asians with chronic hepatitis B, Pubmed, ngày truy cập: 03/03/2023
- ^ Tác giả Jean B. Nachega, ngày đăng: tháng 09 năm 2017, Safety of Tenofovir Disoproxil Fumarate–Based Antiretroviral Therapy Regimens in Pregnancy for HIV-Infected Women and Their Infants: A Systematic Review and Meta-Analysis, Pubmed, ngày truy cập 03/03/2023