Thụ tinh trong ống nghiệm IVF - biện pháp hỗ trợ sinh sản hiệu quả hàng đầu
Đại học Huế - Trường ĐH Y Dược
Đồng chủ biên
GS.TS. Nguyễn Vũ Quốc Huy
GS.TS. Cao Ngọc Thành
PGS.TS. Lê Minh Tâm
PGS.TS. Trương Thành Vinh
Cùng nhiều tác giả tham gia biên soạn
1 GIỚI THIỆU
Sự kiện Louise Brown ra đời 1978 từ kỹ thuật thụ tinh trong ống nghiệm do Steptoe và Edwards thực hiện tại Anh đánh dấu bước ngoặt quan trọng trong lĩnh vực hỗ trợ sinh sản. Ngay sau đó kỹ thuật thụ tinh trong ống nghiệm đã phát triển trong một cách nhanh chóng trong thời gian ngắn như ở Úc (1980), Mỹ (1981), Thụy Điển, Pháp (1981) và cho đến nay được xem là một phương pháp điều trị ưu việt trên toàn thế giới.
Thụ tinh trong ống nghiệm tạo điều kiện cho sự thụ tinh của noãn và tinh trùng trong điều kiện nhân tạo. Một số lượng lớn các tinh trùng được nuôi cấy cùng với một vài noãn trong cùng một đĩa môi trường. Tinh trùng sẽ tự tìm đến noãn, xuyên qua lớp tế bào hạt, bám chặt và xâm nhập vào màng trong suốt (zona pellucida), dung hợp với màng bào tương noãn, giải phóng nhân vào trong tế bào chất của noãn và hiện tượng thụ tinh xảy ra. Quá trình thụ tinh này xảy ra hoàn toàn ngoài cơ thể.
2 CHỈ ĐỊNH THỤ TINH TRONG ỐNG NGHIỆM
2.1 Bệnh lý vòi tử cung
Thụ tinh trong ống nghiệm được chỉ định cho các bệnh nhân bị các bệnh lý về vòi tử cung khi phẫu thuật không phải là lựa chọn ưu tiên.
Những tổn thương chức năng vòi tử cung mà không có tắc nghẽn hay phẫu thuật vòi tử cung nhưng sau 2 năm vẫn chưa có con là một trường hợp chỉ định thụ tinh trong ống nghiệm.
2.2 Lạc nội mạc tử cung
Lạc nội mạc tử cung thể nhẹ có thể xem như vô sinh không rõ nguyên nhân. Nếu lạc nội mạc tử cung thể nặng thì chỉ định tương tự như chỉ định điều trị vô sinh do tắc vòi tử cung.
2.3 Vô sinh do nam
Chỉ định thụ tinh trong ống nghiệm được chỉ định cho các bệnh nhân có tổng số tinh trùng di động từ 1 đến 10 triệu hoặc hơn. Trong các trường hợp có tổng số tinh trùng di động lớn hơn 10 triệu thì được chỉ định giống như vô sinh không rõ nguyên nhân.
2.4 Vô sinh do yếu tố miễn dịch
Trong hệ thống sinh dục nữ có chứa các kháng thể kháng tinh trùng của người chồng, do đó không cho phép tinh trùng di chuyển đến để thụ tinh với noãn. Những trường hợp này thụ tinh trong ống nghiệm tạo điều kiện gặp gỡ trực tiếp giữa noãn và tinh trùng là tối ưu. Thông thường chỉ định thụ tinh trong ống nghiệm đối với trường hợp này là vô sinh 2 năm. Tuy nhiên, người phụ nữ trên 36 tuổi chỉ định thụ tinh trong ống nghiệm sẽ được rút ngắn lại.
2.5 Rối loạn phóng noãn
Chỉ định thụ tinh trong ống nghiệm sau nhiều chu kỳ điều trị gây phóng noãn thất bại
Vô sinh không rõ nguyên nhân
Các trường hợp vô sinh trên 3 năm được xem là một đối tượng cho thụ tinh trong ống nghiệm nếu không tìm thấy bất thường ở cả vợ lẫn chồng. Những trường hợp phụ nữ trên 36 tuổi thì có thể chỉ định thụ tinh trong ống nghiệm sớm hơn.
3 QUY TRÌNH THỤ TINH TRONG ỐNG NGHIỆM
3.1 Kích thích buồng trứng
Thông thường, chu kỳ thụ tinh trong ống nghiệm được chỉ định kích thích buồng trứng bằng các hormone ngoại sinh để có tối đa số lượng noãn thu được và kiểm soát đỉnh LH, tránh gây hoàng thể sớm và rụng noãn trước khi chọc hút noãn
3.1.1 Ngăn chặn sự xuất hiện pha hoàng thể sớm
Sự xuất hiện đỉnh LH sớm có thể được ngăn chặn bằng phác đồ GnRH agonist hoặc GnRH antagonist. Phác đồ với GnRHagonist ban đầu gây kích hoạt tăng tiết LH và FSH. Tiếp theo là giảm sự nhạy cảm của tuyến yên và ức chế sâu của LH và FSH.
Phác đồ với GnRH antagonist ức chế ngay lập tức và nhanh chóng sự tiết gonadotropin. Nguyên tắc chung của GnRH antagonist là cạnh tranh các thụ thể GnRH làm giảm mức LH đến 70% và FSH đến 30% trong máu chỉ sau 6 giờ tiêm.
3.1.2 Sử dụng FSH ngoại sinh
FSH là một phần không thể thiếu cho sự phát triển của nang noãn giai đoạn đầu. Đối với những phụ nữ có mức dự trữ buồng trứng bình thường và không tiên lượng đáp ứng quá mức thì liều FSH ban đầu khoảng 150-225 IU. Những phụ nữ có dự trữ buồng trứng thấp cần liều dùng cao hơn. Những bệnh nhân có buồng trứng đa nang cần liều dùng FSH thấp hơn để hạn chế nguy cơ quá kích buồng trứng.
3.2 Theo dõi sự phát triển nang noãn
Trong quá trình kích thích buồng trứng người phụ nữ được theo dõi kích thước nang noãn bằng đầu dò siêu âm đường âm đạo. Khi có tối thiểu 3 nang noãn đường kính lớn hơn 17 đến 18mm thì sẽ tiêm hCG/ GnRHagonist để gây trưởng thành noãn. Trong một số trường hợp có thể xét nghiệm nồng độ Estradiol trong máu để đánh giá mức độ đáp ứng.
3.3 Chọc hút noãn
Hiện nay là phương pháp chọc hút noãn qua đường âm đạo là thông dụng nhất, dễ nắm bắt, có thể thực hiện cho bệnh nhân ngoại trú, chỉ cần gây tê tại chỗ hoặc an thần đường tĩnh mạch nhẹ.
Bệnh nhân được thay đó vô trùng, nằm tư thế phụ khoa. Kháng sinh dự phòng có thể cho đối với những bệnh nhân có nguy cơ như ở dịch vòi noãn để ngăn viêm nhiễm vùng chậu. Tiền mê bệnh nhân với an thần nhẹ.
Vệ sinh âm hộ, âm đạo, sonde tiểu, lưu ý không dùng dung dịch sát khuẩn. Quan sát hai buồng trứng qua siêu âm đầu dò âm đạo, chọn vị trí chọc. Tiếp cận nang noãn với con đường ngắn nhất. Chọc kim qua túi cùng âm đạo vào các nang noãn. Lưu ý tránh các cơ quan lân cận như mạch máu vùng chậu, ruột, bàng quang, hay vòi noãn ứ dịch...với chất lượng hình ảnh siêu âm tốt cho phép chúng ta phân biệt dễ dàng mạch máu và nang noãn buồng trứng. Nang noãn thuộc cấu trúc buồng trứng, khi xoay đầu dò thì nó có cấu trúc hình tròn hoặc elip ở cả hai mặt cắt vuông góc nhau. Mạch máu có cấu trúc hình ống ở ít nhất 1 trong 2 mặt cắt vuông góc nhau.
Noãn sẽ được thu hồi 35-36 giờ sau khi được tiêm trưởng thành (hCG/ GnRHa). Noãn có thể được hút bằng tay thông qua syringe 10ml hoặc hút bằng máy. Sử dụng máy chọc hút có tính an toàn hơn so với bằng tay do kiểm soát được áp lực hút khi thu hồi noãn và đảm bảo được sự ổn định nhiệt độ của dịch nang khi dịch nang được thu hồi vào 1 tube được đặt trong một bể ổn nhiệt.
.jpg)
Môi trường dùng cho việc chọc hút noãn cũng như rửa noãn trước khi cấy có những yêu cầu nhất định: thoả mãn nhu cầu dinh dưỡng tối thiểu của noãn trong giai đoạn chuyển tiếp, độ pH ổn định, nồng độ thẩm thấu phù hợp và tương thích với hệ thống môi trường nuôi cấy sau này.
Dịch nang được hút lần lượt đến hết. Áp lực hút tối đa thường dùng khoảng –15kPa hay –125mmHg. Khi không kiểm soát được áp lực hút thì dẫn đến tổn thương màng Zona và gây đa thụ tinh. Với hệ thống máy hút sẽ kiểm soát tốt hơn lực hút này. Nói chung nên chọn đường chọc kim sao cho có thể hút được nhiều nang, hạn chế tối đa số lần chọc vào buồng trứng.
Trong trường hợp hút bằng máy, kim sử dụng có thể loại nòng đơn hoặc nòng đôi. Loại kim nòng đôi hữu ích hơn. Loại kim nòng đôi tạo nên dòng chảy một hướng nên tránh được tình trạng thể tích khoảng chết tạo ra trong lòng kim. Nói chung, hút bằng máy có thể kiểm soát áp lực hút tốt hơn, có thể tránh để sót noãn
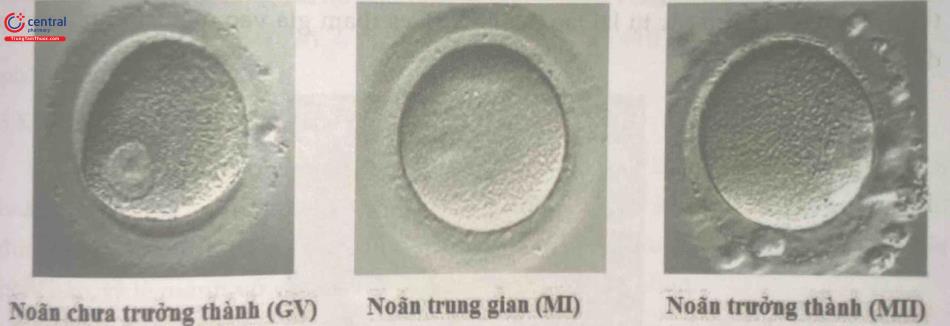
3.4 Tìm và phân độ trưởng thành noãn
Việc tìm noãn được thực hiện trong môi trường ẩm 37/C trong đĩa Petri cỡ lớn (đường kính 100mm) dưới kính hiển vi soi nổi. Các syringe hút dịch nang được trải ra đĩa petri và quan sát dưới kính hiển vi. Nguyên tắc là phải đảm bảo kiểm soát nhiệt độ, độ pH và kỹ thuật vô khuẩn. Người ta nhận thấy với 10 phút tiếp xúc ở nhiệt độ phòng có thể gây rã vi quản và vỡ thoi vô sắc. Môi trường flushing có chứa HEPES giúp ổn định độ pH khi thao tác bên ngoài tủ cấy. Kỹ thuật vô khuẩn không chỉ ngăn nhiễm trùng môi trường cây mà còn bảo vệ cho người thao tác khỏi các bệnh virus do lây chéo.
Rửa noãn được thực hiện ngay để tách máu sau đó cho vào môi trường cấy và để trong tủ cấy CO2.. Cần thực hiện rửa ngay lập tức sau khi hút noãn và không giữ quá lâu ở nhiệt độ 37C sau khi kiểm tra bởi vì hồng cầu và bạch cầu sẽ có khuynh hướng dính chặt vào tế bào vành tia. Môi trường rửa thường dùng là các dung dịch muối cân bằng đơn giản không có huyết thanh như Earle's (EBSS) hoặc dịch với noãn người được bổ sung 2.5 IU/ml Heparin, 10 mM/Herpes, 100 IU/ml penicillin, Streptomycin và phenol red.
Những khối phức hợp noãn - tế bào hạt sau khi được rửa sẽ được phân loại độ trưởng thành và được phân thành từng nhóm cấy trong đĩa môi trường nuôi cấy. Độ trưởng thành của noãn trong giai đoạn này dựa trên hình thái của lớp tế bào hạt quanh noãn.
Grade 1: Chưa trưởng thành (giai đoạn GV): Đây là giai đoạn non nhất. Hầu như tế bào cumulus và corona đều dính chặt vào noãn. Thường thấy một nhân lớn rõ (GV) sau khi tách được tế bào corona. Bào tương có thể sẫm màu. Một tỷ lệ nào đó noãn như thế này đến trưởng thành sau 48 tiếng trong môi trường in-vitro bằng cách thêm hormone vào trong môi trường.
Grade 2: Trung gian (giai đoạn Metaphase I - GVBD): Noãn bào thường được bao quanh bởi một lớp tế bào corona chặt các lớp tế bào cumulus đã trải rộng. Khi tách các tế bào cumulus và corona thấy noãn không có GV và thể cực. Hầu như không có khoang quanh noãn do noãn bào như gắn chặt với lớp trong của ZP. Có một tỷ lệ nào đó những noãn bào giai đoạn này phát triển tự nhiên sau 12-24 giờ trong môi trường nuôi cấy chuẩn, một số có thể phát triển đến trưởng thành sau 24 giờ nhờ bổ sung hormone vào trong môi trường.
Grade 3: Trưởng thành (tiền phóng noãn, Metaphase II): Đây là dạng noãn bào thường gặp nhất, trưởng thành đầy đủ và thích hợp cho việc thụ tinh. Có thể thấy các tế bào vành tia quanh các noãn bào và chúng gắn với một số các lớp tế bào hạt trắng mịn trải rộng. Màng thấu quang và màng bào tương thấy rõ ràng. Khi tách các tế bào hạt và vành tia khỏi noãn bào sẽ thấy thể cực trong khoang quanh noãn.
Grade 4: Quá trưởng thành (metaphase II): Các tế bào vành tia mờ, trải rộng chỉ thấy rất ít các tế bào corona mờ, không đều. Có thể thấy màng thấu quang, bào tương có hạt. Bởi vì không có các tế bào vành tia đậm màu, nên khi quan sát dưới kính hiển vi phải rất cẩn thận để tìm noãn,
Grade 5: Thoái hóa (hoàng thể hoá): Không có tế bào vành tia hoặc có rất ít, do bị phá vỡ và biểu hiện như một khối tế bào nhớt dính. Nếu có vành tia thường không đều, bào tương đậm màu, biến dạng và rất khó nhận thấy.
3.5 Cấy thụ tinh
Với phương pháp cấy thụ tinh cổ điển, đĩa cấy giọt nhỏ được chuẩn bị với nồng độ tinh trùng di động khoảng 100.000 tinh trùng/ml để thụ tinh tối đa với 4 hoàn. Trong khi đĩa cấy lớn 1ml thì tổng số tinh trùng di động từ 300.000-500.000 tinh trùng/ml để tạo điều kiện thụ tinh tốt hơn.
Để đạt hiệu quả cao trong thụ tinh, noãn cần phải trưởng thành hoàn toàn và chuẩn bị đầy đủ cho quá trình tương tác với tinh trùng ở cả nhân và tế bào chất. Việc cấy noãn chưa trưởng thành ảnh hưởng nặng nề đến khoảng thời gian xuất hiện hai tiền nhân, tốc độ phân cắt và mảnh vỡ của phôi, tỷ lệ làm tổ và nguy cơ đa thụ tinh.
3.6 Tiêm tinh trùng vào bào tương noãn
Thủ thuật tiêm tinh trùng vào bào tương noãn (ICSI) sử dụng một tinh trùng chọn tiêm trực tiếp vào trong bào tương của noãn. Nhờ vậy, các rào cản thụ tinh tự nhiên của noãn được loại bỏ hoàn toàn.
Các chỉ định điều trị ICSI cụ thể gồm số lượng tinh trùng di động quá ít, Tinh trùng có dạng đầu tròn, tinh trùng bất động hoàn toàn, tinh trùng có nguồn gốc từ phẫu thuật, các bất thường liên quan đến màng trong suốt, hoặc tiền sử thụ tinh IVF cổ điển thất bại.
3.7 Đánh giá thụ tinh
Đánh giá thụ tinh bình thường dựa vào sự xuất hiện 2 tiền nhân và 2 thể cực khi tách tế bào hạt 16 -18 giờ sau cấy thụ tinh. Sự hòa nhập của tiền nhân có thể quan sát được sau thụ tinh 20 tiếng, đến thời điểm này có thể đánh giá là sự thụ tinh đã diễn ra một cách an toàn. Các tiền nhân nằm gần nhau trong vòng vài giờ, sau đó màng của các tiền nhân vỡ ra và các chất liệu di truyền của hai giao tử hòa nhập với nhau gọi là sự sinh sản hữu tính. Đây là thời điểm kết thúc quá trình thụ tính. Các chất nhiễm sắc tụ lại tạo thành nhiễm sắc thể và tham gia vào quá trình phân chia đầu tiên.
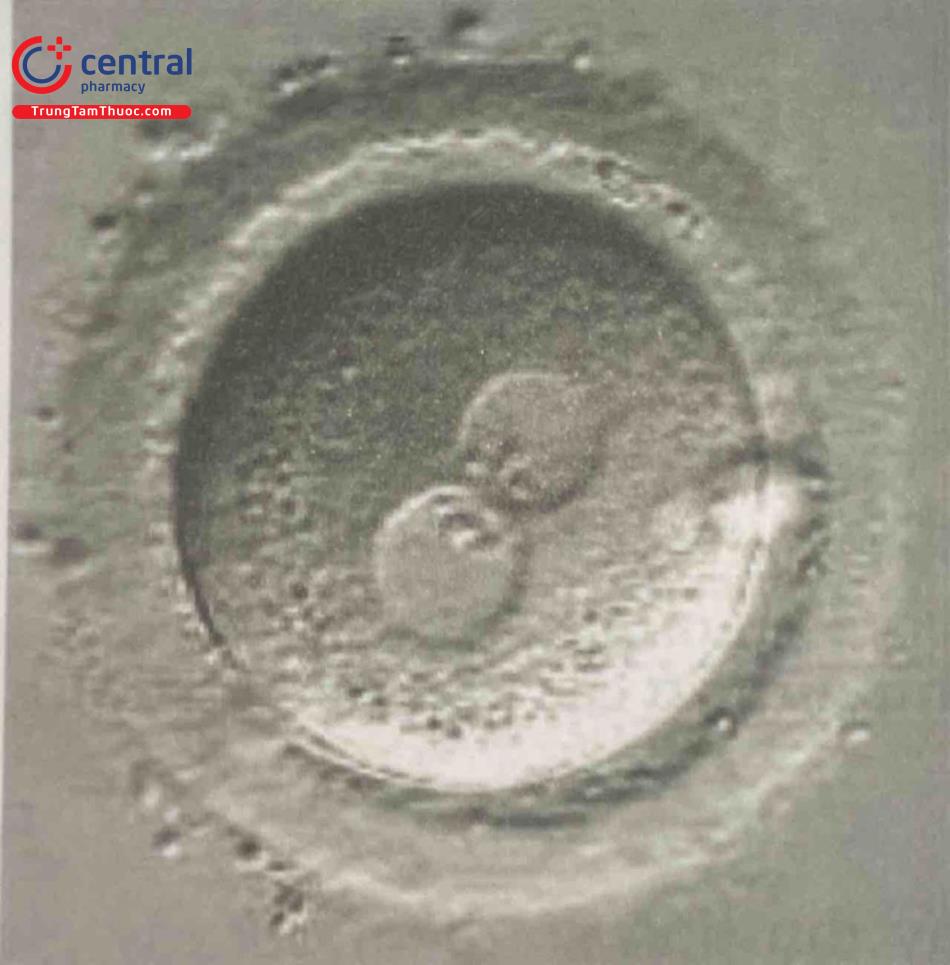
Một tỷ lệ nhỏ noãn thụ tinh trong ống nghiệm có nhiều tiền nhân (> 2). Noãn với 3 tiền nhân thường gặp nhất, khoảng 5-10% noãn thụ tinh. Gần 90% noãn 3 tiền nhân là do tinh trùng xâm nhập thêm. Nếu mật độ tinh trùng > 500.000/ml sẽ tăng tỷ lệ đa thụ tinh đến 20%. Nguyên nhân cũng có thể do noãn quá non hoặc quá già. Các noãn này phát triển bất thường và bất thường nhiễm sắc thể do hình thành thoi vô sắc ba cực. Người ta đề nghị không chuyển những noãn này vào bệnh nhân bởi vì tần suất bất thường nhiễm sắc thể cao khi phối phát triển. Phối tam bội có thể phát triển đến phôi nang và làm tổ nhưng thường gây sẩy thai, hay trong một số trường hợp dẫn đến bệnh lý nguyên bào nuôi như chửa noãn. Những nỗ lực lấy bỏ một trong hai tiền nhân đực vào thời điểm đánh giá thụ tinh vẫn chưa được khuyến khích sử dụng vào lâm sàng để chuyển cho bệnh nhân.
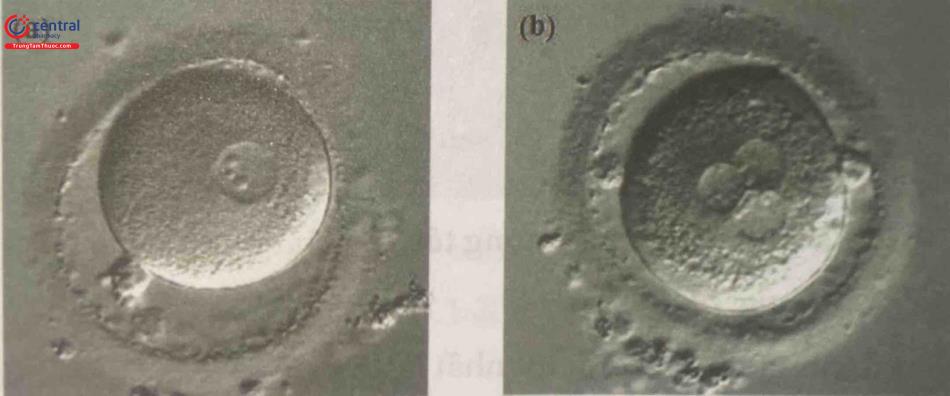
3.8 Đánh giá khả năng phát triển của phôi
Để đánh giá khả năng phát triển của phôi trong TTON tiêu chuẩn hình thái phôi được sử dụng rộng rãi tại hầu hết các trung tâm. Phôi sẽ được đánh giá tại các thời điểm xác định vào ngày 2, ngày 3 (giai đoạn phân cắt) hoặc ngày 5-6 (giai đoạn phôi nang).
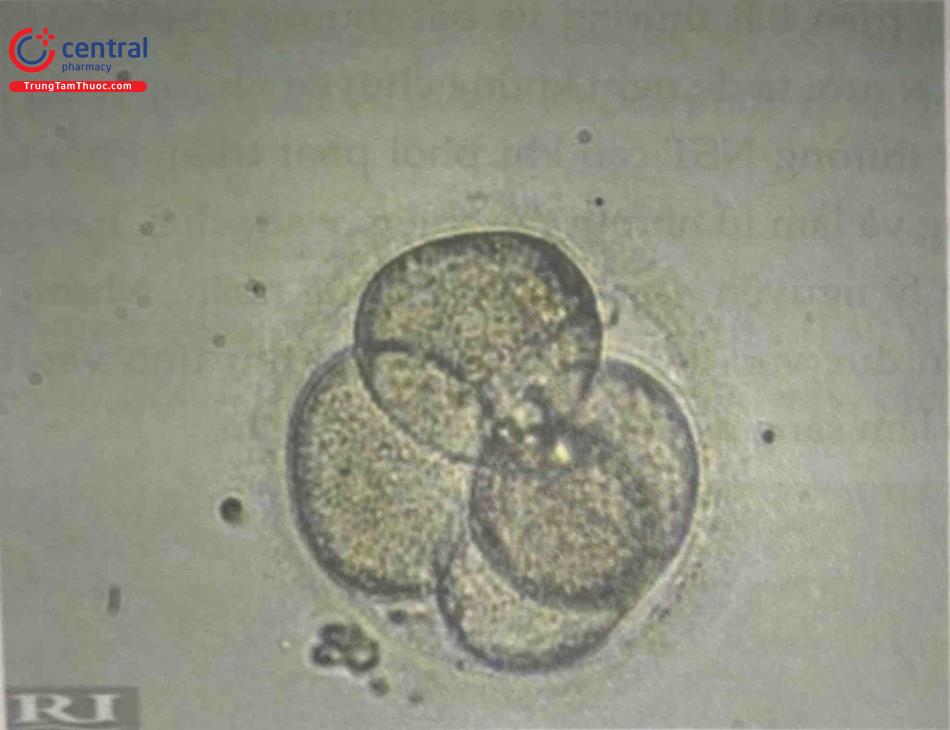
3.8.1 Đánh giá phối giai đoạn phân cắt
Giai đoạn phôi phân cắt được đánh giá vào ngày 2 tại thời điểm 40-44 giờ hoặc vào ngày 3 tại thời điểm 66-68 giờ sau thụ tinh. Tại những thời điểm này phối được đánh giá dựa trên các đặc điểm: số lượng, kích thước, sự đối xứng của các phôi bào, tỷ lệ mảnh vỡ và sự hiện diện của phôi bào đa nhân.
Số lượng phôi bào: Phổi ngày 2 khoảng 4 tế bào, ngày 3 từ 6-8 tế bào.
Kích thước và sự phân bố các phôi bào.
Mảnh vỡ phôi bào.
Sự hiện diện của phôi bào đa nhân.
Dựa vào các đánh giá trên phôi được cho là có chất lượng tốt và được sử dụng chuyển phổi là những phôi có 4-5 phôi bào vào ngày 2 và tối thiểu 7 phối bào vào ngày 3, tỷ lệ mảnh vỡ dưới 20% và không có sự hiện diện của các phôi bào đa nhân.
3.8.2 Đánh giá chất lượng phôi nang
Thời điểm đánh giá phôi nang tốt nhất là 154 giờ sau khi tiêm hCG hoặc 112- 114 giờ sau khi thụ tinh. Chất lượng của phôi nang sẽ được đánh giá thông qua thể tích của khoang thể dịch (độ nở của phôi), độ nén của các khối tế bào trong ICM (inner cell mass) và hình dạng, kích thước của các nguyên bào nuôi TE (trophectoderm cell). Theo Gardner và cộng sự chất lượng phôi nang được đánh giá như sau:
Độ nở của phôi: Độ nở của phôi dựa vào thể tích của khoang thể dịch được hình thái của màng trong suốt và mức độ thoát màng của phôi. Độ nở của phôi nang được chia làm 6 cấp độ:
Độ 1: Những phôi nang có khoang thể dịch nhỏ hơn một nửa thể tích của phôi. Độ 2: Những phôi nang có thể tích khoảng một nửa thể tích của phôi.
Độ 3: Những phôi nang có khoang thể dịch tràn đầy thể tích của phôi.
Độ 4: Những phôi nang có khoang thể dịch lớn hơn cấp độ 3 và màng trong suốt của phôi bị làm mỏng.
Độ 5: Những phôi nang mà các tế bào nuôi TE bắt đầu thoát ra khỏi màng trong suốt hoặc nằm một nửa trong màng trong suốt.
Độ 6: Những phôi nang đã thoát hoàn toàn ra màng trong suốt.
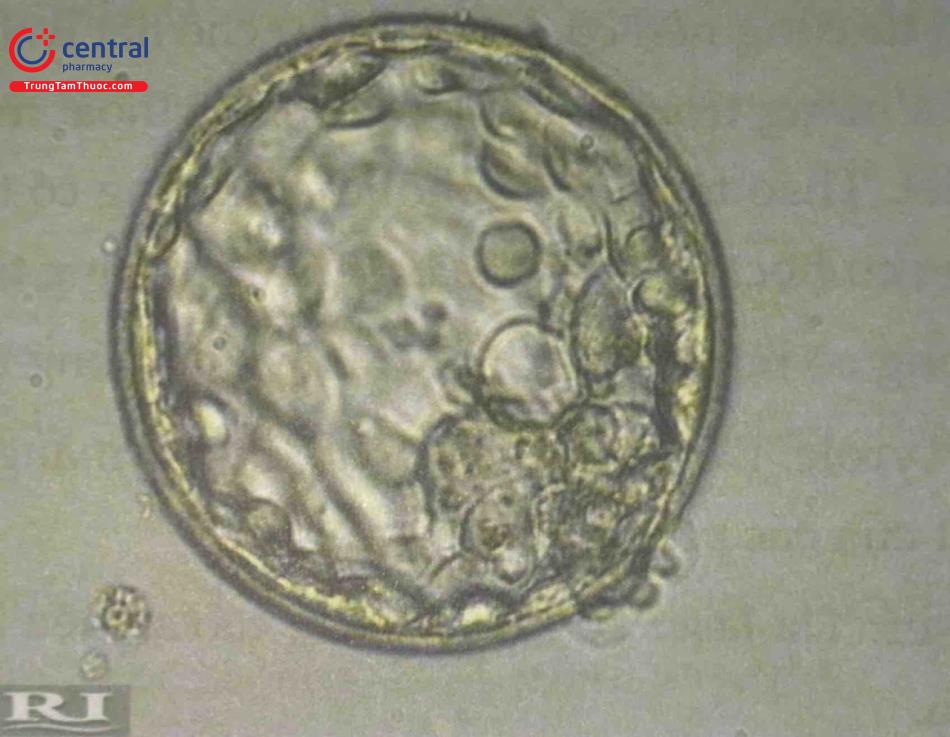
Đánh giá hình thái của các khối tế bào ICM: Chất lượng của khối tế bào ICM được chia thành 3 cấp độ kí hiệu là A, B, C.
Độ A: Khối tế bào ICM được nén chặt và có nhiều tế bào.
Độ B: Những tế bào ICM sắp xếp gần nhau thành một nhóm với vài tế bào.
Độ C: Những phôi bào có rất ít tế bào ICM.
Đánh giá hình thái tế bào nuôi TE: Chất lượng lớp tế bào nuôi TE được chia làm 3 cấp độ như tế bào ICM.
Độ A: Là nhiều tế bào nuôi TE nén chặt và ép sát tạo thành lớp biểu mô.
Độ B: Là những phôi nang có số lượng tế bào nuôi TE ít hơn nhưng vẫn nén chặt tạo thành lớp biểu mô.
Độ C: Là những phôi nang có số lượng rất ít các tế bào nuôi TE có dạng biểu mô.
3.9 Kỹ thuật chuyển phôi
Hầu hết các trung tâm hiện nay đều thực hiện chuyển phối dưới sự hướng dẫn của siêu âm. So với chuyển mù (không có siêu âm hướng dẫn), siêu âm giúp bác sĩ dễ dàng quan sát được bên trong tử cung trong quá trình chuyển phôi, giúp tránh được những tổn thương lên lớp nội mạc tử trong quá trình đưa catheter vào bên trong lòng tử cung, tránh đưa catheter quá sâu và chạm vào đáy tử cung. Các nghiên cứu cho thấy, khi catheter chạm vào đáy tử cung sẽ kích thích các cơn go, gây tống xuất phôi ra ngoài tử cung. Vị trí của đầu catheter khi chuyển phôi nên cách đáy tử cung tối thiểu là 1cm để nâng cao tỷ lệ thai lâm sàng.
3.10 Hỗ trợ phôi thoát màng
Để có thể tiếp xúc trực tiếp với niêm mạc tử cung, xâm nhập và làm tổ, phôi nang phải thoát ra khỏi màng trong suốt (zona pellucida ZP). Trong điều nhân tạo thiếu sự tương tác với tử cung nên có thể thiếu sự chế tiết Lysine hoặc phôi trữ lạnh có thể làm bị cứng hóa màng trong suốt. Hỗ trợ phôi thoát màng trong các trường hợp này là rất cần thiết. Thao tác hỗ trợ phôi thoát màng có thể thực hiện bằng ba cách sử dụng tác động cơ học, sử dụng hóa chất và sử dụng tia laser.
Sử dụng tác động cơ học: Bằng kim ICSI để làm mỏng màng trong suốt. Sử dụng acid Tyroic. Để bào mỏng hoặc đục lỗ màng trong suốt do nó có thể cắt đứt các liên kết của các phân tử glycoprotein.
Sử dụng tia laser: Tia laser có năng lượng cao sẽ tiêu hủy màng trong suốt tại vị trí được chiếu tia.
4 TÀI LIỆU THAM KHẢO
1. Allahbadia GN, Kadam K, Gandhi G, Arora S, Valliappan JB, Joshi A, Allahbadia S, Wolman I. Embryo transfer using the Sure View catheterbeacon in the womb. Fertil Steril. 2010; 93(2): 344-350.
2. Christianson MS, Zhao Y, Shoham G, Granot I, Safran A, Khafagy A, Leong M, Shoham Z. Embryo catheter loading and embryo culture techniques: results of a worldwide Web-based survey. J Assist Reprod Genet. 2014; 31(8): 1029-1036.
3. Nakagawa K, Takahashi C, Nishi Y, Jyuen H, Sugiyama R, Kuribayashi Y. Hyaluronan-enriched transfer medium improves outcome in patients with multiple embryo transfer failures. J Assist Reprod Genet. 2012; 29(7): 679-685.
4. Navarro P, Araujo M, de Araújo C, Rocha M. Relationship between fi rst polar body morphology before intracytoplasmic sperm injec- tion and fertilization rate, cleavage rate, and embryo quality. Int J Gynaecol Obstet. 2009; 104(3): 226-229.
5. Pinborg A, Lidegaard O, Freiesleben NC, Andersen AN. Vanishing twins: a predictor of smallfor-gestational age in IVF singletons. Hum Reprod 2007; 22: 2707-2714.
6. Porat N, Boehnlein LM, Schouweiler CM, Kang J, Lindheim SR. Interim analysis of a randomized clinical trial comparing abdominal versus transvaginal ultrasound-guided embryo transfer. J Obstet Gynaecol Res. 2010; 36(2): 384–392.
7. Porter MB. Ultrasound in assisted reproductive technology. Semin Reprod Med. 2008; 26(3): 266–276.
8. Racowsky C, Ohno-Machado L, Kim J, Biggers J. Is there an advantage in scoring early embryos on more than one day? Hum Reprod. 2009; 24(9): 2104-2113.
9. Söderström-Anttila V, Vilska S. Five years of single embryo transfer with anonymous and non-anonymous oocyte donation. Reprod Biomed Online 2007; 15: 428-433.
10. Terriou P, Giorgetti C, Hans E, Salzmann J, Charles O, Cignetti L, Avon C, Roulier R. Relationship between even early cleavage and day 2 embryo score and assessment of their predictive value for pregnancy. Reprod Biomed Online. 2007;14(3): 294-299.
11. Tiras B, Cenksoy PO. Practice of embryo transfer: recommendations during and after. Semin Reprod Med. 2014; 32(4): 291-296.
12. Tiras B, Polat M, Korucuoglu U, Zeyneloglu HB, Yarali H. Impact of embryo replacement depth on in vitro fertilization and embryo transfer outcomes. Fertil Steril. 2010;94(4):1341-5. Allahbadia GN, Merchant R, Gandhi G. Embryo transfer. In: Jain K, Talwar P, editors. IVF techniques for the beginners. New Delhi: Jaypee Brothers Medical Publishers Pvt. Ltd; 2013. 12-35.

