Tisotumab Vedotin
1 sản phẩm
 Dược sĩ Hoàng Mai Dược sĩ lâm sàng
Dược sĩ Hoàng Mai Dược sĩ lâm sàng
Ước tính: 1 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
Tên chung quốc tế: Tisotumab vedotin
Biệt dược thường gặp: Tivdak
Loại thuốc: Kháng thể đơn dòng và liên hợp thuốc kháng thể.
Mã ATC: L01FX23
1 Dạng thuốc và hàm lượng
Bột pha Dung dịch tiêm chứa hàm lượng 40mg Tisotumab.
2 Dược lực học
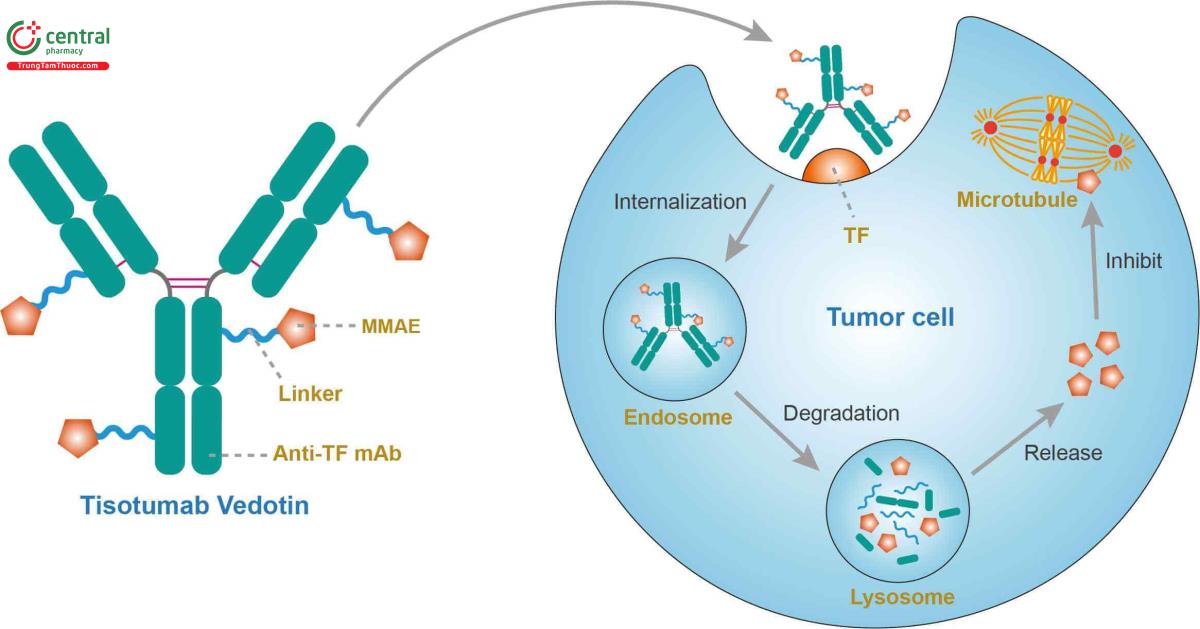
Tisotumab vedotin-tftv là một liên hợp thuốc kháng thể dùng điều trị ung thư. Tisotumab vedotin kháng TF IgG1-kappa hướng đến yếu tố mô TF. các yếu tố nội mô này biểu hiện nhiều trên các khối u cổ tử cung.
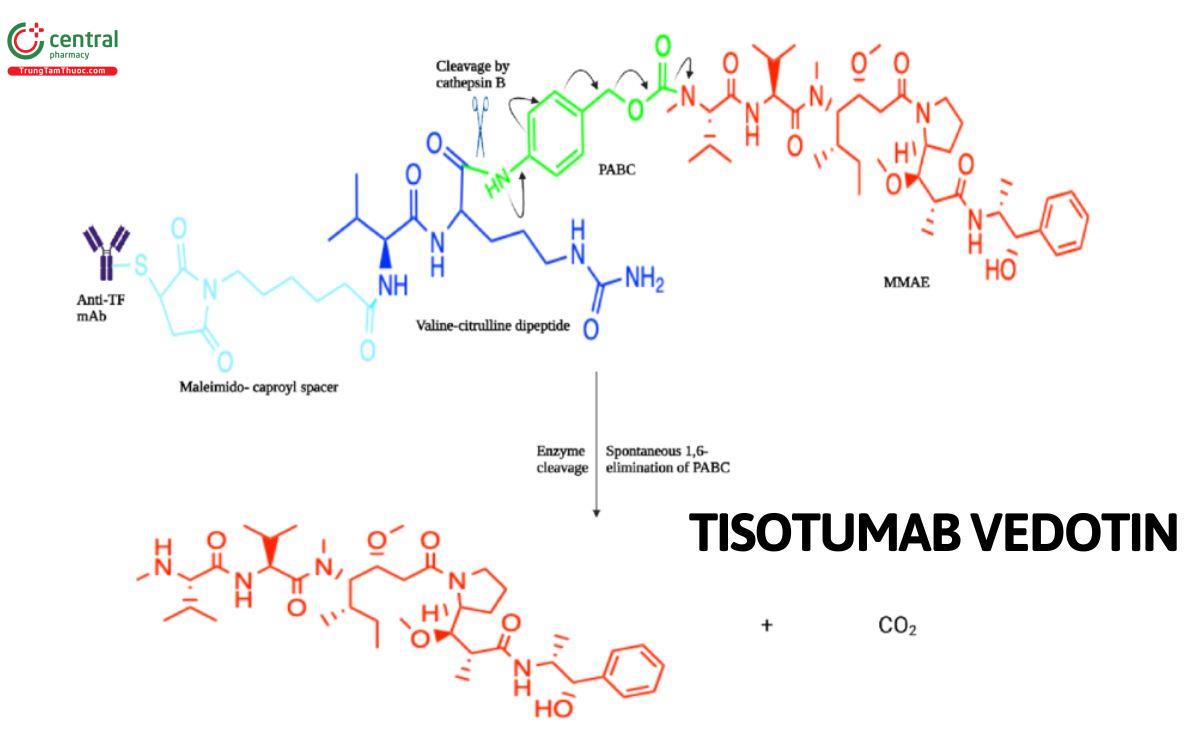
Cơ chế của Tisotumab vedotin-tftv là tạo thành sự liên kết với yếu tố TF và giải phóng MMAE, xâm nhập vào tế bào để trung gian cho hoạt động gây độc tế bào của thuốc. MMAE là một tác nhân phá vỡ vi ống của các tế bào đang phân chia tích cực, làm ngừng và chết tế bào ung thư.
3 Dược động học
Hấp thu: nồng độ đạt đỉnh sau khoảng cuối chu kỳ truyền với nồng độ 40,8 (8,12) μg/mL .
Phân bố: Tỷ lệ liên kết Tisotumab với protein huyết tương khoảng 68% đến 82%. Thể tích phân phối trạng thái ổn định của tisotumab 7,83 L.
Chuyển hoá: con đường chuyển hoá chính của thuốc là CYP3A4, qua quá trình dị hóa để tạo thành các peptide nhỏ, axit amin.
Thải trừ: Con đường đào thải chính của tisotumab khoảng 17% liều được đào thải qua phân, 6% trong nước tiểu trong khoảng thời gian 1 tuần. Thời gian bán hủy trung bình ở trạng thái ổn định khoảng 4,04 ngày.
4 Chỉ định
Tisotumab vedotin-tftv được sử dụng để điều trị ung thư cổ tử cung tái phát hoặc di căn mà trước đó có điều trị bằng nhiều phương pháp nhưng thất bại.
5 Chống chỉ định
Người mẫn cảm với thành phần Tisotumab vedotin.
6 Liều dùng - Cách dùng
6.1 Liều dùng
Liều dùng khuyến cáo là 2 mg/kg (tối đa 200 mg cho bệnh nhân ≥100 kg) được truyền tĩnh mạch. Thuốc phải được truyền chậm, ít nhất 30 phút sau mỗi 3 tuần. Sử dụng thuốc cho đến khi bệnh tiến triển hoặc độc tính không thể chấp nhận được.
6.2 Cách dùng
Thuốc được truyền qua ống thông tĩnh mạch và thuốc phải được truyền chậm, vì vậy ống thông tĩnh mạch sẽ cần phải được giữ nguyên trong ít nhất 30 phút.
Thuốc dùng để điều trị ung thư rất mạnh nên sử dụng kỹ thuật vô trùng thích hợp để pha chế và chuẩn bị dung dịch truyền thuốc phải theo dõi, hợp tác với bác sĩ đảm bảo các rủi ro có thể xử lý.
7 Tác dụng không mong muốn
Bệnh lý thần kinh ngoại biên bao gồm bệnh lý thần kinh cảm giác ngoại biên, dị cảm, yếu cơ, bệnh lý thần kinh vận động cảm giác ngoại biên, bệnh lý thần kinh vận động ngoại biên, độc tính thần kinh, rối loạn dáng đi, đau dây thần kinh, giảm cảm giác…
Phản ứng có hại của giác mạc bao gồm viêm giác mạc, viêm giác mạc chấm, xói mòn giác mạc, viêm giác mạc loét, thoái hóa giác mạc, đục giác mạc và bệnh giác mạc, khô mắt, tiết dịch mắt, ngứa mắt, đau mắt, kích ứng mắt và chảy nước mắt.
- Buồn nôn bao gồm buồn nôn và nôn
- Tiêu chảy bao gồm tiêu chảy và viêm dạ dày ruột
- Xuất huyết bao gồm tiểu máu, xuất huyết âm đạo, xuất huyết trực tràng, ho ra máu, xuất huyết hậu môn, xuất huyết, xuất huyết tiêu hóa,
- Nhiễm trùng đường tiết niệu bao gồm nhiễm trùng đường tiết niệu, viêm bể thận cấp tính, viêm bàng quang.
- Các bất thường xét nghiệm như: Hemoglobin giảm, Giảm bạch cầu trung tính, Aspartate Aminotransferase tăng, creatinin tăng.
8 Tương tác thuốc
Chưa có nghiên cứu về tương tác của Tisotumab vedotin được tiến hành, các phản ứng trên lâm sàng với một ADC khác có chứa MMAE với những tác dụng tương tự đối với tisotumab vedotin-tftv được kết quả như sau:
Chất ức chế CYP3A4 mạnh: làm tăng Cmax của MMAE không liên hợp lên 25% và AUC lên 34%.
Chất gây cảm ứng CYP3A4 mạnh: làm giảm Cmax của MMAE không liên hợp xuống 44% và AUC xuống 46%.
9 Thận trọng
Không dùng thuốc cho người mẫn cảm với thành phần thuốc, và nên thực hiện các xét nghiệm máu thường xuyên kiểm tra tiến triển tình trạng bệnh.
Thuốc này có thể gây ra các vấn đề về mắt hoặc thị lực như viêm kết mạc, khô mắt, viêm bờ mi, bệnh giác mạc. Nếu gặp các biểu hiện trên cần báo ngay với bác sĩ để có hương điều trị kịp thời.
Sử dụng biện pháp tránh thai hiệu quả để tránh thai trong khi bạn đang dùng thuốc này và ít nhất 2 tháng sau liều cuối cùng đối với nữ giới và ít nhất 4 tháng sau liều cuối cùng đối với nam giới.
Cảnh báo bệnh thần kinh ngoại biên khi dùng thuốc nếu bị nóng rát, tê, ngứa ran hoặc cảm giác đau, yếu ở cánh tay, bàn tay, chân hoặc bàn chân hoặc mất thăng bằng cần báo cáo kịp thời với bác sĩ.
Thuốc này có thể gây ra các vấn đề về chảy máu như chảy máu cam, tiểu ra máu và xuất huyết âm đạo
Thuốc này có thể gây viêm phổi ,nếu bị đau ngực, ớn lạnh, ho, sốt, cảm giác khó chịu hoặc ốm cần thông báo với bác sĩ.
Phản ứng da nghiêm trọng, bao gồm hội chứng Stevens-Johnson đã được cảnh báo.
Thông báo các loại thuốc đang sử dụng để tránh tương tác có thể xảy ra.
10 Thời kỳ mang thai
Các nghiên cứu trên động vật cho thấy rằng thuốc gây tử vong phôi thai và xuất hiện những bất thường về cấu trúc ở liều khuyến cáo. Như vậy dù chưa có báo cáo lâm sàng nào nhưng những tính chất cơ chế hoạt động của thuốc và tác dụng phụ ở động vật không nên dùng thuốc cho phụ nữ có thai.
11 Thời kỳ cho con bú
Chưa có dữ liệu về thuốc có qua sữa mẹ hay tác động đến trẻ bú được hay không, nhưng khuyến cáo không sử dụng do những tác dụng phụ nghiêm trọng đến sự phát triển của trẻ. Ngừng bú hoàn toàn trong quá trình điều trị và ít nhất 3 tuần sau liều cuối cùng.
12 Bảo quản
Bảo quản thuốc ở nơi khô ráo, thoáng mát, nhiệt độ dưới 30 độ C.
Tránh xa khu vực vui chơi của trẻ nhỏ.
13 Quá liều
Chưa có báo cáo.
Nếu sử dụng quá liều nên nhanh chóng cấp cứu tại cơ sở y tế gần nhất.
14 Tài liệu tham khảo
Chuyên gia Drugbank. Tisotumab, Drugbank. Truy cập ngày 14 tháng 10 năm 2024.
Chuyên gia FDA, TIVDAK (tisotumab vedotin-tftv) , FDA. Truy cập ngày 14 tháng 10 năm 2024.





