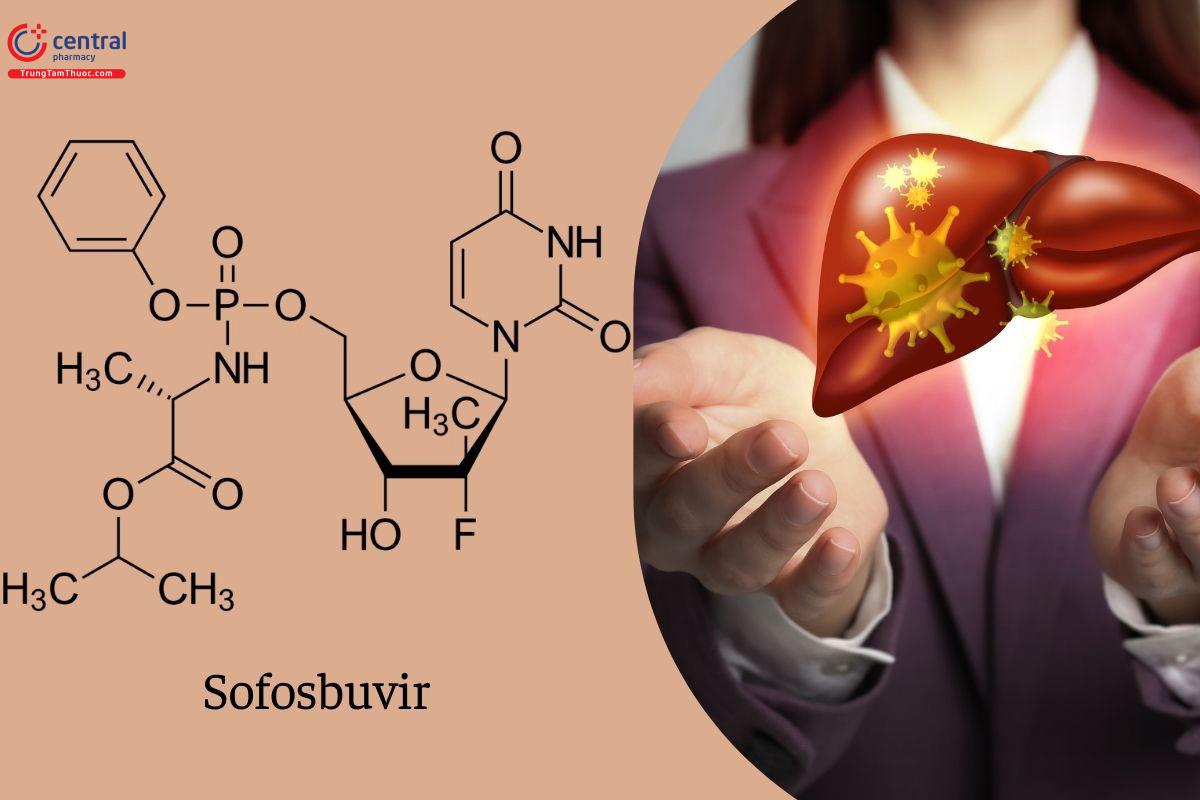
Sofosbuvir
28 sản phẩm
 Dược sĩ Thanh Hương Dược sĩ lâm sàng
Dược sĩ Thanh Hương Dược sĩ lâm sàng
Ước tính: 4 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
Bài viết biên soạn dựa theo
Dược thư quốc gia Việt Nam, lần xuất bản thứ ba
Đây là phiên bản mới nhất của Dược thư Việt Nam do Bộ Y tế ban hành Quyết định số 3445/QĐ-BYT ngày 23 tháng 12 năm 2022
Trang 1490-1492, tải file PDF TẠI ĐÂY
SOFOSBUVIR
Tên chung quốc tế: Sofosbuvir.
Mã ATC: J05AP08.
Loại thuốc: thuốc kháng virus tác dụng trực tiếp.
1 Dạng thuốc và hàm lượng
Viên nén bao phim: 200 mg, 400 mg.
Thuốc cốm: 150 mg, 200 mg.
2 Dược lực học
Sofosbuvir là một chất ức chế pan-genotypic RNA polymerase phụ thuộc NSSB RNA của virus viêm gan C (HCV), chất này cần thiết cho sự sao chép của virus. Sofosbuvir là tiền chất nucleotid, sau khi uống sẽ trải qua quá trình chuyển hóa nội bào để tạo thành triphosphat tương tự uridin có hoạt tính dược lý (GS-461203), chất này có thể được kết hợp vào HCV RNA bởi NS5B polymerase và hoạt động như một chất kết thúc chuỗi. Trong ống nghiệm, GS-461203 ức chế hoạt động polymerase của NS5B tái tổ hợp từ HCV kiểu gen 1b, 2a, 3a và 4a với giá trị nồng độ ức chế 50% (IC50) nằm trong khoảng từ 0,7 - 2,6 KM. GS-461203 (chất chuyển hóa có hoạt tính của sofosbuvir) không phải là chất ức chế DNA và RNA polymerase của người cũng như không phải là chất ức chế RNA polymerase của ty thể.
3 Dược động học
Sofosbuvir là tiền chất nucleotid có phổ chuyển hóa rộng. Chất chuyển hóa có hoạt tính được hình thành trong tế bào gan và không được quan sát thấy trong huyết tương. Chất chuyển hóa chủ yếu là GS-331007, không có hoạt tính.
Hấp thu: Sau khi uống, sofosbuvir được hấp thu nhanh với nồng độ đỉnh trong huyết tương đạt được sau khoảng 0,5 - 2 giờ, không phụ thuộc vào liều lượng. Nồng độ đỉnh trong huyết tương của GS-331007 được quan sát thấy trong khoảng từ 2 - 4 giờ sau khi uống. Sử dụng sofosbuvir với bữa ăn giàu chất béo làm giảm tốc độ hấp thu. Mức độ tiếp xúc của GS-331007 không bị ảnh hưởng bởi bữa ăn giàu chất béo.
Phân bố: Sofosbuvir liên kết khoảng 85% protein huyết tương người (dữ liệu ex vivo) và liên kết độc lập với nồng độ thuốc từ khoảng 1 - 20 microgam/ml. GS-331007 rất ít liên kết với protein huyết tương người. Sau một liều 400 mg duy nhất [ 14 CJ-sofosbuvir ở những người khỏe mạnh, tỷ lệ giữa máu và huyết tương của 14 C-phóng xạ là khoảng 0,7.
Chuyển hóa: Sofosbuvir được chuyển hóa ở gan để tạo thành triphosphat tương tự nucleosid GS-461203 có hoạt tính. Con đường kích hoạt chuyển hóa bao gồm quá trình thủy phân tuần tự của gốc carboxyl ester được xúc tác bởi cathepsin A (CatA) hoặc carboxylesterase I (CESI) và phân cắt phosphoramidat bởi protein liên kết với nucleotid bộ ba histidin 1 (HINTI), tiếp theo là sự phosphoryl hóa bởi con đường sinh tổng hợp pyrimidin nucleotid. Dephosphoryl hóa dẫn đến sự hình thành chất chuyển hóa nucleosid GS-331007 không có hoạt tính kháng HCV in vitro. Sofosbuvir và GS-331007 không phải là cơ chất hoặc chất ức chế các enzym UGT1A1 hoặc CYP3A4, CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19 và CYP2D6. Sau một liều uống 400 mg duy nhất [14 C}-sofosbuvir, sofosbuvir và GS-331007 chiếm tương ứng khoảng 4% và lớn hơn 90% lượng thuốc trong cơ thể (tổng AUC được điều chỉnh theo trọng lượng phân tử của sofosbuvir và các chất chuyển hóa của nó).
Thải trừ: GS-331007 thải trừ chủ yếu qua thận. Phần lớn liều sofosbuvir được thải trừ trong nước tiểu là GS-331007 (78%) trong khi 3,5% được thải trừ dưới dạng sofosbuvir. Nửa đời thải trừ trung bình của sofosbuvir và GS-331007 lần lượt là 0,4 và 27 giờ. Tuyến tính/không tuyến tính: Mức độ tuyến tính về liều lượng của sofosbuvir và chất chuyển hóa chính GS-331007 được đánh giá ở những người khỏe mạnh nhịn ăn. AUC của sofosbuvir và GS-331007 gần tỷ lệ với liều lượng trong phạm vi liều từ 200 mg đến 400 mg.
Đối tượng đặc biệt:
Người già: Tuổi không có ảnh hưởng lâm sàng liên quan đến việc tiếp xúc với sofosbuvir và GS-331007.
Giới tính và chủng tộc: Không có sự khác biệt về dược động học có liên quan đến việc về mặt lâm sàng do giới tính hoặc chủng tộc đã được xác định đối với sofosbuvir và GS-331007.
Suy gan: xơ gan không có ảnh hưởng lâm sàng liên quan đến việc tiếp xúc với sofosbuvir và GS-331007. Không cần điều chỉnh liều sofosbuvir được khuyến cáo cho bệnh nhân suy gan nhẹ, trung bình và nặng.
Suy thận: GS-331007 được loại bỏ hiệu quả bằng thẩm tách máu với hệ số chiết xuất xấp xỉ 53%. Sau một liều sofosbuvir 400 mg duy nhất, thẩm phân máu trong 4 giờ đã loại bỏ 18% liều sofosbuvir được sử dụng.
Trẻ em: Dược động học ở trẻ em > 3 tuổi tương tự người lớn. Dược động học của sofosbuvir và GS-331007 chưa được thiết lập ở trẻ em < 3 tuổi.
4 Chỉ định
Người lớn: Sofosbuvir được chỉ định kết hợp với các thuốc khác để điều trị viêm gan C mạn tính có kiểu gen 1, 2, 3, hoặc 4 ở bệnh nhân người lớn không kèm theo xơ gan hoặc kèm theo xơ gan còn bù.
Trẻ em: Sofosbuvir được chỉ định kết hợp với thuốc khác để điều trị viêm gan C mạn tính kiểu gen 2 hoặc 3 ở bệnh nhân trẻ em từ 3 tuổi trở lên không kèm theo xơ gan hoặc kèm theo xơ gan còn bù.
5 Chống chỉ định
Quá mẫn với sofosbuvir.
Không sử dụng đồng thời sofosbuvir với các chất gây cảm ứng mạnh P-glycoprotein trong ruột như carbamazepin, Phenobarbital, Phenytoin, Rifampicin và cỏ St. John do có thể làm giảm tác dụng của sofosbuvir.
6 Thận trọng
Thận trọng chung: Không nên sử dụng sofosbuvir dạng đơn trị liệu mà cần phối với các thuốc khác để điều trị viêm gan C.
Nhịp tim chậm và nghẽn nhĩ thất: Có thể xảy ra nhịp tim chậm hoặc nghẽn nhĩ thất đe dọa tính mạng khi sử dụng phác đồ chứa sofosbuvir kết hợp với amiodaron. Nhịp tim chậm thường xảy ra trong vòng vài giờ đến vài ngày, nhưng cũng có các trường hợp lên đến 2 tuần sau khi bắt đầu điều trị HCV. Nhịp chậm thường hết sau khi ngừng điều trị HCV. Amiodaron chỉ nên được sử dụng cho bệnh nhân đang dùng sofosbuvir khi các điều trị chống loạn nhịp khác không dung nạp hoặc chống chỉ định. Nên theo dõi nhịp tim ở bệnh nhân trong 48 giờ đầu khi phối hợp thuốc và bệnh nhân tự theo dõi trong ít nhất 2 tuần đầu điều trị. Do amiodaron có nửa đời thải trừ dài, những bệnh nhân đã ngừng amiodaron trong vòng vài tháng trước khi bắt đầu điều trị bằng sofosbuvir cần theo dõi nhịp tim như trên.
Đồng nhiễm HCV/HBV (virus viêm gan B): Đã quan sát thấy bùng phát HBV khi sử dụng các thuốc kháng virus trực tiếp. Nên kiểm tra HBV ở tất cả các bệnh nhân trước khi điều trị bằng sofosbuvir.
Bệnh nhân đã từng điều trị nhiễm HCV kiểu gen 1, 4, 5 và 6: Chưa rõ thời gian tối ưu đối với những quần thể này.
Bệnh nhân nhiễm HCV kiểu gen 5 hoặc 6: Có rất ít dữ liệu về việc sử dụng sofosbuvir cho kiểu gen này.
Phác đồ không có Interferon cho bệnh nhân nhiễm HCV kiểu gen 1, 4, 5 và 6: Các phác đồ không có interferon cho bệnh nhân nhiễm HCV kiểu gen 1, 4, 5 và 6 với sofosbuvir chưa được nghiên cứu trong các nghiên cứu pha 3. Phác đồ và thời gian điều trị tối ưu chưa được thiết lập. Chỉ nên sử dụng các phác đồ không có interferon cho những bệnh nhân không dung nạp hoặc không đủ điều kiện điều trị bằng interferon và đang cần điều trị khẩn cấp.
Dùng chung với các thuốc kháng virus tác dụng trực tiếp khác: Chi nên sử dụng đồng thời với các thuốc kháng virus tác dụng trực tiếp khác nếu lợi ích lớn hơn nguy cơ. Chưa có dữ liệu sử dụng đồng thời sofosbuvir với telaprevir hoặc boceprevir.
Mang thai và sử dụng đồng thời với ribavirin: Nữ giới và bạn tình của họ cần sử dụng biện pháp tránh thai hợp lý khi sử dụng đồng thời sofosbuvir với Ribavirin hoặc Peginterferon alfa/ribavirin.
Phối hợp với chất cảm ứng P-glycoprotein (như Modafinil, oxcarbazepin và rifapentin) có thể làm giảm nồng độ sofosbuvir trong huyết tương. Không khuyến cáo sử dụng đồng thời với các sản phẩm này.
Bệnh nhân đái tháo đường: Khi bắt đầu điều trị bằng thuốc kháng virus trực tiếp, nồng độ đường huyết của bệnh nhân đái tháo đường có thể hạ tới mức có triệu chứng. Cần theo dõi nồng độ đường huyết chặt chẽ, đặc biệt là 3 tháng đầu.
Suy thận: Dữ liệu an toàn còn hạn chế ở bệnh nhân suy thận nặng (eGFR < 30 ml/phút/1,73 m²) và bệnh thận giai đoạn cuối (ESRD) cần chạy thận nhân tạo. Có thể sử dụng sofosbuvir cho bệnh nhân suy thận nặng mà không cần điều chỉnh liều khi không có các lựa chọn điều trị khác.
Ảnh hưởng đến khả năng lái xe và vận hành máy móc: Sofosbuvir có ảnh hưởng vừa phải đến khả năng lái xe và vận hành máy móc. Đã có các báo cáo về tình trạng mệt mỏi và rối loạn chú ý, chóng mặt và nhìn mờ trong thời gian điều trị bằng sofosbuvir kết hợp với peginterferon alfa và ribavirin.
7 Thời kỳ mang thai
Khi sử dụng sofosbuvir kết hợp với ribavirin hoặc peginterferon alfa/ribavirin, phải hết sức thận trọng để tránh mang thai ở bệnh nhân nữ và bạn tình của bệnh nhân nam. Tác dụng gây quái thai và/ hoặc chết phôi đáng kể đã được chứng minh ở tất cả các loài động vật tiếp xúc với ribavirin. Phụ nữ có khả năng sinh con hoặc bạn tình nam của họ phải sử dụng hình thức tránh thai hiệu quả trong khi điều trị và trong một khoảng thời gian sau khi kết thúc điều trị bằng ribavirin.
Không có dữ liệu hoặc dữ liệu còn hạn chế (ít hơn 300 phụ nữ mang thai) về việc sử dụng sofosbuvir ở phụ nữ mang thai. Những nghiên cứu trên động vật không cho thấy ảnh hưởng có hại trực tiếp hay gián tiếp liên quan đến độc tính sinh sản. Không thấy ảnh hưởng nào trên sự phát triển của thai nhi được quan sát thấy trên chuột cống và thỏ khi thử nghiệm với liều cao nhất. Tuy nhiên, vẫn chưa đánh giá đầy đủ giới hạn phơi nhiễm với sofosbuvir ở chuột cống có liên quan đến sự phơi nhiễm ở người ở liều được khuyến cáo. Tránh sử dụng sofosbuvir trong thời gian mang thai.
8 Thời kỳ cho con bú
Chưa biết liệu sofosbuvir và các chất chuyển hóa của nó có được bài tiết vào sữa mẹ hay không. Dữ liệu dược động học ở động vật cho thấy sự bài tiết của các chất chuyển hóa trong sữa. Không nên dùng sofosbuvir trong thời kỳ cho con bú.
9 Tác dụng không mong muốn (ADR)
ADR của sofosbuvir được đánh giá khi sử dụng đồng thời với các thuốc khác. Các ADR thường gặp nhất xảy ra ở những bệnh nhân đang sử dụng sofosbuvir và ribavirin hoặc peginterferon alfa/ ribavirin là mệt mỏi, nhức đầu, buồn nôn và mất ngủ.
Rất thường gặp
Chuyển hóa và dinh dưỡng: giảm cảm giác thèm ăn.
Tâm thần: mất ngủ.
Thần kinh: đau đầu, chóng mặt.
Tiêu hoá: buồn nôn, nôn, tiêu chảy.
Gan mật: tăng bilirubin huyết.
Chung: mệt mỏi, ớn lạnh, khó chịu, bệnh giống cúm
Thường gặp
Nhiễm trùng nhiễm độc: viêm mũi họng.
Máu và hệ lympho: thiếu máu, giảm hemoglobin, giảm bạch cầu, giảm số lượng lympho, giảm số lượng tiểu cầu.
Thần kinh: đau nửa đầu, giảm trí nhớ, rối loạn chú ý.
Chuyển hóa và dinh dưỡng: giảm khối lượng cơ thể.
Tâm thần: trầm cảm, lo lắng, kích động.
Mắt: mở mắt.
Hô hấp, lồng ngực và trung thất: khó thở, ho, khó thở khi gắng sức.
Tiêu hóa: táo bón, khó tiêu, khô miệng, trào ngược dạ dày - thực quản.
Da và mô dưới da: phát ban, ngứa, rụng tóc, da khô.
Cơ xương và mô liên kết: đau khớp, đau lưng, co thắt cơ, đau cơ.
Chung: sốt, đau ngực, suy nhược.
10 Hướng dẫn cách xử trí ADR
Theo dõi sát các ADR để xử trí kịp thời. Xem xét ngừng sofosbuvir và sử dụng các thuốc khác thay thế.
11 Liều lượng và cách dùng
Điều trị bằng sofosbuvir nên được bắt đầu và theo dõi bởi bác sĩ có kinh nghiệm trong việc quản lý bệnh nhân viêm gan C. Sofosbuvir nên được sử dụng cùng với thuốc khác, không khuyến cáo sử dụng đơn độc sofosbuvir.
Thuốc có thể uống cùng hoặc không cùng bữa ăn.
Người lớn: Liều khuyến cáo là 400 mg, uống một lần mỗi ngày.
Trẻ em ≥ 3 tuổi:
≥ 35 kg: Uống 400 mg, một lần mỗi ngày.
17 - < 35 kg: Uống 200 mg, một lần mỗi ngày.
< 17 kg: Uống 150 mg, một lần mỗi ngày.
Đối với trẻ em và người gặp tình trạng khó nuốt, có thể sử dụng dạng cốm.
Thay đổi liều lượng sofosbuvir: Không khuyến cáo thay đổi liều lượng sofosbuvir.
Tham khảo hướng dẫn điều trị và hướng dẫn sử dụng của các thuốc sử dụng đồng thời (như ribavirin, peginterferon alfa) để biết thêm thông tin về liều lượng.
Ngừng sử dụng thuốc: Nếu các thuốc dùng đồng thời bị ngừng sử dụng, không tiếp tục sử dụng sofosbuvir.
Nôn và quên uống thuốc
Nếu bệnh nhân bị nôn trong vòng 2 giờ sau khi uống thuốc, nên uống lại một liều khác. Nếu bệnh nhân bị nôn sau 2 giờ uống thuốc, không cần dùng thêm liều khác.
Nếu bệnh nhân quên uống thuốc trong vòng 18 giờ so với thời gian uống thuốc hàng ngày, nên uống ngay một liều bổ sung và uống liều tiếp theo đúng theo thời gian thông thường hàng ngày. Nếu thời gian quên uống thuốc lớn hơn 18 giờ so với thời gian uống thuốc hàng ngày, bệnh nhân nên chờ và uống liều kế tiếp vào giờ thường lệ. Hướng dẫn bệnh nhân không uống gấp đôi liều.
Đối tượng đặc biệt:
Suy gan: Không cần thay đổi liều ở người suy gan nhẹ, vừa, nặng. Tinh an toàn và hiệu quả của sofosbuvir chưa được thiết lập ở bệnh nhân bị xơ gan mất bù.
Suy thận: Không cần thay đổi liều ở bệnh nhân suy thận nhẹ hoặc vừa. Có ít dữ liệu đối với bệnh nhân suy thận nặng (eGFR < 30 ml/phút/1,73 m²) và bệnh thận giai đoạn cuối cần lọc máu. Đối với những bệnh nhân này có thể không cần thay đổi liều lượng sofosbuvir khi không có các lựa chọn điều trị khác.
Người già: Không cần thay đổi liều.
Bệnh nhân đang chờ ghép gan: Cần đánh giá lợi ích và nguy cơ trên từng bệnh nhân cụ thể để xác định thời gian kéo dài điều trị bằng sofosbuvir.
Trẻ em dưới 3 tuổi: Không có dữ liệu về an toàn và hiệu quả ở độ tuổi này.
12 Tương tác thuốc
Sofosbuvir là cơ chất của chất vận chuyển thuốc P-glycoprotein và protein kháng ung thư vú (BCRP) trong khi chất chuyển hóa lưu hành chủ yếu GS-331007 thì không.
Các thuốc là chất cảm ứng mạnh P-glycoprotein trong ruột (carbamazepin, phenobarbital, phenytoin, rifampicin và cỏ St. John) có thể làm giảm đáng kể nồng độ trong huyết tương của sofosbuvir, dẫn đến giảm hiệu quả điều trị của sofosbuvir, do đó chống chỉ định sử dụng đồng thời với sofosbuvir. Các thuốc là chất cảm ứng trung binh P-glycoprotein trong ruột (ví dụ: modafinil, oxcarbazepin và rifapentin) có thể làm giảm nồng độ trong huyết tương của sofosbuvir dẫn đến giảm tác dụng điều trị của sofosbuvir, do đó không khuyến cáo sử dụng đồng thời với sofosbuvir. Sử dụng đồng thời sofosbuvir với các chất ức chế P-glycoprotein và/hoặc BCRP có thể làm tăng nồng độ trong huyết tương của sofosbuvir mà không làm tăng nồng độ trong huyết tương của GS-331007, do đó, sofosbuvir có thể dùng đồng thời với các chất ức chế P-glycoprotein và/hoặc BCRP. Sofosbuvir và GS-331007 không phải là chất ức chế P-glycoprotein và BCRP và do đó dự kiến sẽ không làm tăng mức tiếp xúc của các thuốc là cơ chất của những chất vận chuyển này.
Loại bỏ nhiễm HCV bằng thuốc kháng virus tác dụng trực tiếp có thể dẫn đến những thay đổi ở chức năng gan, có thể ảnh hưởng đến việc sử dụng an toàn và hiệu quả của các loại thuốc sử dụng đồng thời. Giám sát thường xuyên các thông số xét nghiệm liên quan (ví dụ: Tỷ lệ chuẩn hóa quốc tế INR ở bệnh nhân dùng warfarin, mức đường huyết ở bệnh nhân đái tháo đường) hoặc nồng độ của các loại thuốc dùng đồng thời như cơ chất của cytochrom P450 có chỉ số điều trị hẹp (ví dụ như một số chất ức chế miễn dịch) được khuyến nghị để đảm bảo sử dụng an toàn và hiệu quả sofosbuvir. Điều chỉnh liều của các thuốc dùng đồng thời có thể cần thiết.
Con đường kích hoạt chuyển hóa nội bào của sofosbuvir được trung gian bởi các con đường phosphoryl hóa nucleotid và hydrolase có ái lực thấp và dung lượng cao mà không có khả năng bị ảnh hưởng bởi các sản phẩm thuốc dùng đồng thời.
Amiodaron: Sử dụng đồng thời cùng với liệu pháp điều trị có chứa sofosbuvir có thể dẫn tới nhịp tim chậm có triệu chứng nghiêm trọng. Không nên sử dụng đồng thời 2 thuốc này, nếu sử dụng đồng thời cần theo dõi tim chặt chẽ.
Thuốc ức chế Protease HIV: Sử dụng đồng thời sofosbuvir với tipranavir/ritonavir có thể làm giảm nồng độ sofosbuvir dẫn tới giảm hiệu quả điều trị. Không khuyến cáo sử dụng đồng thời các thuốc này.
13 Quá liều và xử trí
Triệu chứng: Liều cao nhất được ghi nhận của sofosbuvir là một liều duy nhất 1 200 mg được dùng cho 59 đối tượng khỏe mạnh. Trong nghiên cứu đó, không có tác dụng nào được quan sát thấy ở mức liều này, tần suất và mức độ của các phản ứng có hại là tương tự nhau giữa nhóm Placebo và nhóm điều trị với sofosbuvir 400 mg. Tác dụng của liều cao hơn vẫn chưa được biết.
Xử trí: Không có thuốc giải độc đặc hiệu. Nếu quá liều xảy ra, bệnh nhân phải được theo dõi để tìm bằng chứng về độc tính. Điều trị quá liều với sofosbuvir bằng các biện pháp hỗ trợ chung bao gồm theo dõi các dấu hiệu sinh tồn cũng như theo dõi tình trạng lâm sàng của bệnh nhân. Thẩm tách máu có thể loại bỏ hiệu quả (tỷ lệ chiết xuất 53%) chất chuyển hóa chủ yếu trong tuần hoàn GS-331007. Một đợt thẩm tách máu kéo dài 4 giờ loại bỏ 18% liều dùng.
Cập nhật lần cuối: 2021