Sacituzumab govitecan
1 sản phẩm
 Dược sĩ Hoàng Mai Dược sĩ lâm sàng
Dược sĩ Hoàng Mai Dược sĩ lâm sàng
Ước tính: 1 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
Tên chung quốc tế: Pemigatinib
Biệt dược thường gặp: Trodelvy
Loại thuốc: Kháng thể đơn dòng và liên hợp thuốc kháng thể
Mã ATC: L01FX17
1 Dạng thuốc và hàm lượng
Bột pha Dung dịch tiêm truyền tĩnh mạch chứa hàm lượng 200mg, 180mg Sacituzumab govitecan.
2 Dược lực học
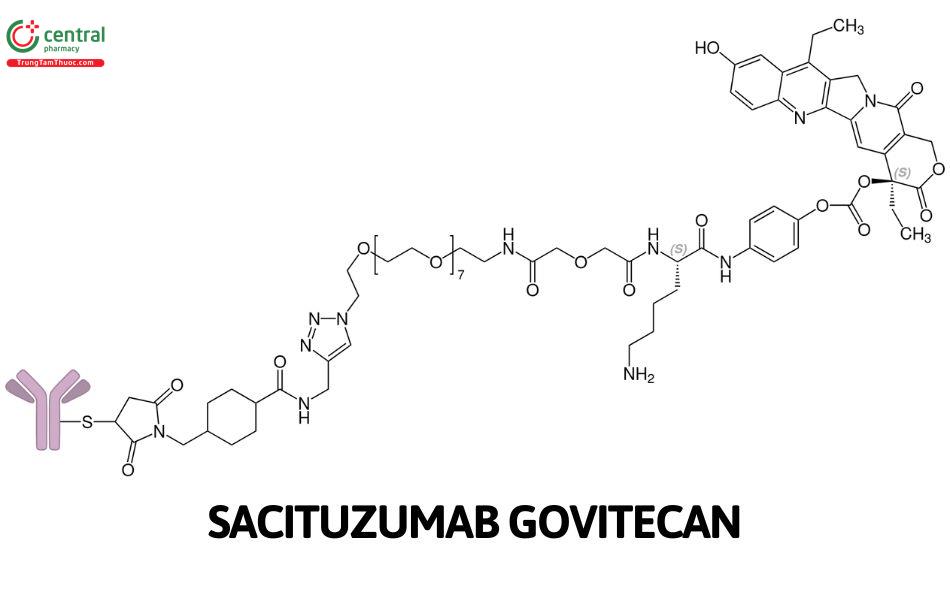
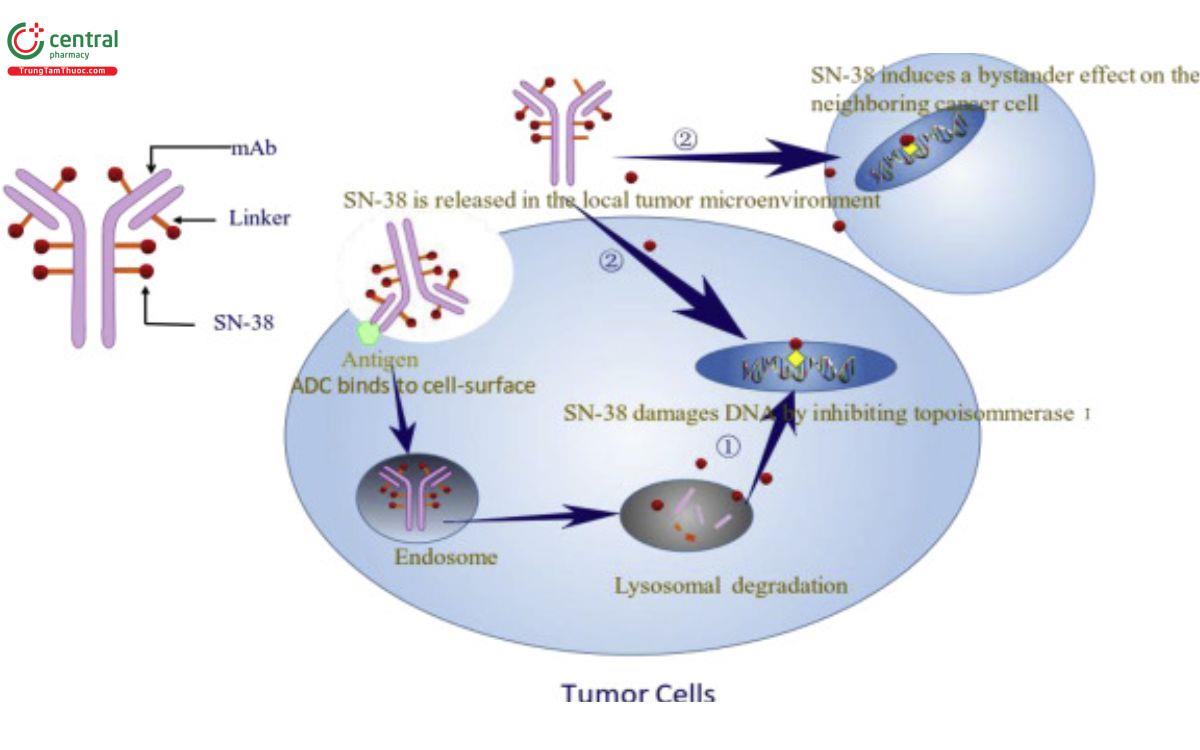
Sacituzumab govitecan là một liên hợp kháng thể đơn dòng/chất ức chế topoisomeras chống lại các tế bào ung thư biểu hiện TROP-2. Cơ chế hoạt động được giải thích nhờ sự liên kết của thành phần RS7 với TROP-2 bằng một liên kết CL2A thủy phân với thuốc gây độc tế bào SN-38. Khi giải phóng SN-38 vào tế bào sẽ ức chế DNA topoisomerase I, gây tổn thương chúng và tế bào chết. Ngoài ra cũng có nghiên cứu chứng minh rằng SN-38 còn có thể phá vỡ sự liên kết của Protein liên kết thượng nguồn xa, giảm sự biểu hiện gen.
3 Dược động học
Hấp thu: sử dụng liều 10 mg/kg, các giá trị Cmax (nồng độ huyết tương tối đa ) và AUC0-168 ( Diện tích dưới đường cong nồng độ huyết tương trong vòng 168 giờ) lần lượt có giá trị tương ứng với sacituzumab govitecan và SN-38 tự do là Cmax của liên hợp là 243.000 ± 45.600 ng/mL, Cmax của SN-38 tự do là 127 ± 60 ng/mL, AUC liên hợp là 5.210.000 ± 1.230.000 và AUC tự do là 3.900 ± 1.830 ng*h/mL.
Phân bố: Thể tích phân bố của thuốc Sacituzumab govitecan là 0,045 L/kgm thuốc có sự liên kết chủ yếu với thành phần IgG trong huyết thanh.
Chuyển hoá: con đường chuyển hoá chính của thuốc chưa được nghiên cứu rộng rãi, có thể qua gan chủ yếu, trong đó SN-38 được biết là trải qua quá trình O-glucuronidation bởi UGT1A1.
Thải trừ: con đường đào thải chính trong phân, phần nhỏ trong nước tiểu. Độ thanh thải của thuốc là 0,002 L/h/kg. Thời gian bán hủy trung bình là 18 giờ.
4 Chỉ định
Sacituzumab govitecan được chỉ định điều trị ở người lớn trưởng thành:
- Ung thư vú di căn hoặc tiến triển tại chỗ không thể cắt bỏ, xét nghiệm có 3 âm tính (mTNBC) và đã thất bại với ít nhất 2 biện pháp điều trị trước đó.
- Ung thư biểu mô tiết niệu di căn hoặc tiến triển tại chỗ đã điều trị bằng liệu pháp platinum trước đó và chất ức chế thụ thể chết theo chương trình-1 (PD-1).

5 Chống chỉ định
Người mẫn cảm với thành phần Sacituzumab govitecan.
6 Liều dùng - Cách dùng
6.1 Liều dùng
Liều dùng khuyến cáo ở người lớn là 10 mg/kg truyền tĩnh mạch/ lần/ tuần, vào ngày 1 và ngày 8 của chu kỳ điều trị 21 ngày. Không dùng liều >10 mg/kg.
Sử dụng đến khi độc tính không thể chấp nhận hoặc bệnh tiếp tục tiến triển, di căn.
6.2 Cách dùng
Chỉ dùng thuốc dưới dạng truyền tĩnh mạch, không tiêm bắp hay tiêm dưới da.
Trong lần đầu truyền dịch, thời gian truyền kéo dài trong vòng 3 giờ, nên quan sát bệnh nhân ít nhất 30 phút sau tiêm để phản ứng kịp.
Trong lần truyền dịch tiếp theo có thể tăng thời gian truyền lên 1-2 giờ.
7 Tác dụng không mong muốn
Các tác dụng không mong muốn thường gặp như:
- Rối loạn hệ thống máu và bạch huyết: thiếu máu, giảm bạch cầu trung tính, giảm bạch cầu lympho.
- Rối loạn tiêu hoá: tiêu chảy, buồn nôn, nôn mửa, táo bón, đau bụng, viêm miệng.
- Rối loạn chung: mệt mỏi, sốt, suy nhược.
- Rối loạn nhiễm trùng: nhiễm trùng tiết niệu, hô hấp
- Rối loạn xét nghiệm: Giảm hemoglobin, giảm bạch cầu, giảm tế bào lympho, giảm tiểu cầu
- Rối loạn chuyển hoá: giảm thèm ăn, hạ Kali máu, hạ Magie máu.
- Rối loạn cơ, xương khớp: đau lưng, đau khớp.
- Rối loạn hệ thần kinh: đau đầu, chóng mặt, mất ngủ
- Rối loạn da: rụng tóc, phát ban, ngứa.
8 Tương tác thuốc
Chất ức chế UGT1A1: làm tăng tỷ lệ phản ứng có hại do khả năng tăng phơi nhiễm toàn thân với Sacituzumab govitecan, nên không sử dụng đồng thời các thuốc này với nhau.
Chất cảm ứng UGT1A1: giảm phơi nhiễm toàn thân với Sacituzumab govitecan, làm giảm tác dụng của thuốc nên tránh dùng đồng thời các thuốc này với nhau.
9 Thận trọng
Sử dụng thuốc gây giảm bạch cầu nghiêm trọng có thể đe doạ tính mạng nên cần xét nghiệm các chỉ số máu thường xuyên để điều chỉnh liều phù hợp.
Thuốc gây tiêu chảy nghiêm trọng, các trường hợp thủng ruột, viêm đại tràng đã được báo cáo. Nếu gặp các triệu chứng tiêu chảy nặng cần thông báo với bác sĩ, có thể dùng thuốc cầm tiêu chảy và hỗ trợ bổ sung điện giải theo chỉ định lâm sàng.
Thuốc gây triệu chứng nôn và buồn nôn xảy ra phổ biến, trong trường hợp nặng có thể sử dụng thuốc chống nôn theo chỉ định lâm sàng.
Thận trọng với phản ứng dị ứng, quá mẫn đe doạ tính mạng, nếu gặp các triệu chứng như hạ huyết áp, phù mạch, thở khò khè, sưng cần thông báo ngay với nhân viên y tế.
10 Thời kỳ mang thai và cho con bú
Không có các dữ liệu về rủi ro của thuốc trên phụ nữ mang thai nhưng dựa trên cơ chế thuốc có thể gây độc cho gan, biến đổi gen, độc với tế bào phân chia nên không dùng thuốc trong khi mang thai.
Các nghiên cứu về thuốc trong sữa mẹ, độc tính với thai nhi chưa có, nhưng do nguy cơ gặp phản ứng phụ nghiêm trọng ở trẻ em nên không dùng thuốc trong thời kỳ này và ít nhất 1 tháng sau liều cuối cùng thì cho con bú lại.
11 Bảo quản
Bảo quản ở nhiệt độ 2-8°C, tránh ánh sáng mặt trời trực tiếp.
Không để tủ đông lạnh.
Tránh khu vực trẻ em có thể tiếp xúc.
12 Quá liều
Chưa có thuốc giải đặc hiệu, nên ngừng thuốc và cấp cứu.
13 Tài liệu tham khảo
Chuyên gia Drugbank .Sacituzumab govitecan. Drugbank. Truy cập ngày 22 tháng 10 năm 2024.
Chuyên gia Pubchem. Sacituzumab govitecan. Pubchem. Truy cập ngày 22 tháng 10 năm 2024.
Tác giả Jennifer Weiss và cộng sự (Ngày đăng 19 tháng 8 năm 2019) Sacituzumab govitecan: breakthrough targeted therapy for triple-negative breast cancer. Pubmed. Truy cập ngày 22 tháng 10 năm 2024.