Ruxolitinib
3 sản phẩm
 Dược sĩ Thu Trang Dược sĩ lâm sàng
Dược sĩ Thu Trang Dược sĩ lâm sàng
Ước tính: 10 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
1 Tổng quan
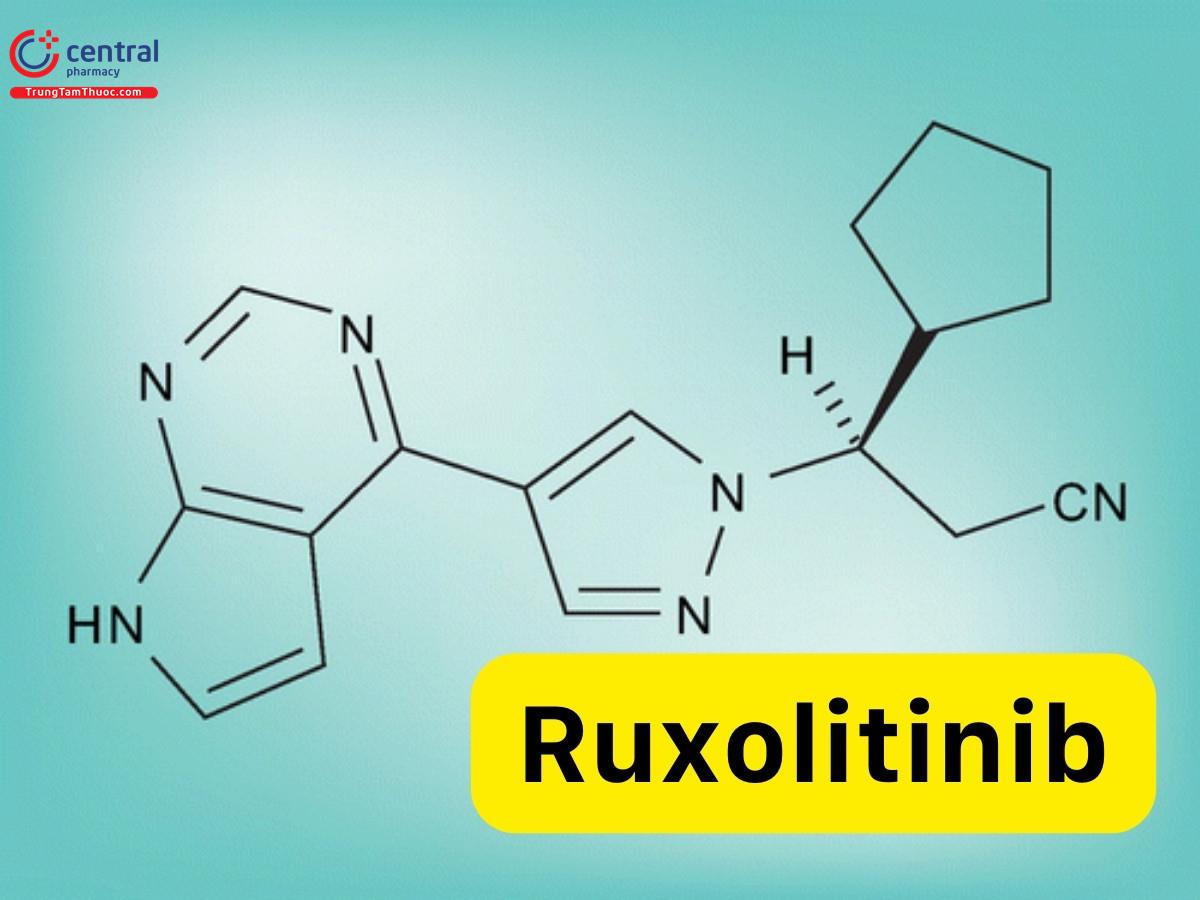
CTCT: C17H18N6
Tên IUPAC: (3R)-3-Cyclopentyl-3-[4-(7H-pyrrolo[2,3-d]pyrimidin-4-yl)pyrazol-1-yl]propanenitril
2 Ruxolitinib là thuốc gì?
Ruxolitinib là một chất ức chế kinase được sử dụng để điều trị nhiều loại bệnh xơ tủy, bệnh đa hồng cầu ở những bệnh nhân không đáp ứng hoặc không thể dung nạp hydroxyurea, bệnh mảnh ghép chống ký chủ trong những trường hợp kháng trị với steroid và điều trị bệnh bạch biến không phân đoạn (dạng dùng tại chỗ).
3 Dược lực học
Ruxolitinib thuộc nhóm thuốc ức chế Janus Kinase (JAK).
- Đối với tác nhân gây ung thư
Ruxolitinib là một chất chống ung thư có tác dụng ức chế sự tăng sinh tế bào, gây ra apoptosis của các tế bào ác tính và làm giảm nồng độ cytokine trong huyết tương gây viêm bằng cách ức chế quá trình phosphoryl hóa, do JAK gây ra, các bộ chuyển đổi tín hiệu và kích hoạt của phiên mã (STAT). Sự ức chế phosphoryl hóa STAT3, được sử dụng làm chất đánh dấu hoạt động JAK, của Ruxolitinib đạt được sau 2 giờ dùng thuốc và trở về mức gần ban đầu sau 10 giờ ở bệnh nhân bị xơ tủy và đa hồng cầu nguyên phát. Trong các thử nghiệm lâm sàng, Ruxolitinib làm giảm lách to và cải thiện các triệu chứng của bệnh xơ tủy. Trong mô hình chuột mắc bệnh tăng sinh tủy, việc sử dụng Ruxolitinib có liên quan đến khả năng kéo dài sự sống. Ruxolitinib ức chế cả JAK2 đột biến và hoang dã, tuy nhiên, đột biến JAK2V617F, thường thấy ở khoảng 50% bệnh nhân mắc bệnh xơ tủy, đã được chứng minh là làm giảm độ nhạy của Ruxolitinib, điều này cũng có thể liên quan đến khả năng kháng thuốc điều trị bằng thuốc ức chế JAK.
- Đối với bệnh bạch biến
Hai nghiên cứu mù đôi, ngẫu nhiên, có đối chứng bằng giả dược có thiết kế giống hệt nhau (TruE-V1 và TRuE-V2) đã thu thập tổng cộng 674 bệnh nhân mắc bệnh bạch biến trên mặt và diện tích bạch biến toàn thân (mặt và những vùng khác) không vượt quá 10% BSA (tổng diện tích bề mặt cơ thể), với mức độ bệnh lúc bắt đầu dao động từ 3,2% đến 10,1% BSA, từ 12 tuổi trở lên (10,7% bệnh nhân từ 12 đến 17 tuổi và 6,7% từ 65 tuổi trở lên). Trong đó, nữ giới chiếm 53,1%, người da trắng chiếm 81,9%, người da đen chiếm 4,7% và người Châu Á chiếm 4,2%. Phần lớn bệnh nhân có phân loại da Fitzpatrick là loại III, IV, V hoặc VI (67,5%).
Trong cả hai nghiên cứu, bệnh nhân được chọn ngẫu nhiên theo tỷ lệ 2:1 để điều trị bằng kem Ruxolitinib hoặc tá dược hai lần mỗi ngày trong 24 tuần với BSA bị ảnh hưởng không vượt quá 10%, sau đó là điều trị thêm 28 tuần bằng kem Ruxolitinib 2 lần một ngày cho tất cả bệnh nhân. Tiêu chí chính về hiệu quả là tỷ lệ bệnh nhân đạt được mức tái tạo sắc tố 75% theo Chỉ số chấm điểm vùng bạch biến trên mặt (F-VASI75) vào tuần 24. Tiêu chí phụ chính bao gồm tỷ lệ bệnh nhân đạt được mức tái sắc tố 90% theo Chỉ số F-VASI (F- VASI90), cải thiện 50% chỉ số chấm điểm vùng bạch biến toàn cơ thể (T-VASI50) và thang điểm mức độ đáng chú ý bệnh bạch biến (VNS) là 4 hoặc 5 (bệnh bạch biến "ít đáng chú ý hơn nhiều" hoặc "không còn đáng chú ý").
Sự tái tạo sắc tố của các tổn thương bạch biến được điều trị và tính ưu việt của kem Ruxolitinib so với kem dưỡng da đã được quan sát trong cả hai nghiên cứu, được chứng minh bằng sự khác biệt có ý nghĩa thống kê về tỷ lệ đáp ứng đối với điểm F-VASI75/90, T-VASI50 và VNS là 4 hoặc 5 ở tuần 24.

Sự khác biệt về hiệu quả điều trị so với giả dược thể hiện rõ ràng về số lượng ngay từ tuần 12. Sự tái tạo sắc tố tiếp tục được đánh giá bằng điểm VASI và VNS được quan sát thấy đến hết tuần 52 đối với những bệnh nhân sử dụng kem Ruxolitinib liên tục hai lần mỗi ngày kể từ lúc ban đầu. Tỷ lệ bệnh nhân đạt được F-VASI75 trong thời gian điều trị 52 tuần trong dữ liệu tổng hợp từ nghiên cứu TRuE-V1 và TRuE-V2 lần lượt là 30,3%, 51,1% và 36,3% đối với dân số gộp ITT. Phản ứng điều trị tương tự ở tuần 52 cũng được thấy ở những người chuyển từ dùng giả dược sang Ruxolitinib.
Một số nghiên cứu về tác dụng của Ruxolitinib trên trẻ em cũng đã được thực hiện. Tổng cộng có 72 thanh thiếu niên (12-18 tuổi; n = 55 kem Ruxolitinib, n = 17 tá dược) được đưa vào các nghiên cứu then chốt. Thanh thiếu niên cho thấy tỷ lệ đáp ứng bằng nhau ở các tiêu chí chính và phụ quan trọng ở tuần thứ 24 khi điều trị bằng Ruxolitinib, so với người lớn từ 18-65 tuổi. Cơ quan quản lý thuốc và sản phẩm chăm sóc sức khỏe đã trì hoãn nghĩa vụ nộp kết quả nghiên cứu với Opzelura ở một hoặc nhiều nhóm trẻ em để điều trị bệnh bạch biến.
4 Cơ chế tác dụng
- Đối với tác nhân gây ung thư
Họ protein tyrosine kinase Janus kinase (JAK) bao gồm JAK1, JAK2, JAK3 và tyrosine kinase 2 không thụ thể (TYK2). JAK đóng vai trò then chốt trong con đường truyền tín hiệu nội bào của nhiều loại cytokine và các yếu tố tăng trưởng cần thiết cho quá trình tạo máu, chẳng hạn như Interleukin, Erythropoietin và Thrombopoietin. JAK có chức năng đa dạng: JAK1 và JAK3 thúc đẩy quá trình biệt hóa, khả năng sống sót và chức năng của tế bào lympho, trong khi JAK2 thúc đẩy sự truyền tín hiệu của erythropoietin và Thrombopoietin. JAK nằm gần vùng tế bào chất của cytokine và thụ thể yếu tố tăng trưởng. Khi liên kết với các cytokine và các yếu tố tăng trưởng, JAK được kích hoạt, trải qua quá trình phosphoryl hóa chéo và phosphoryl tyrosine. Quá trình này cũng tiết lộ các vị trí liên kết chọn lọc cho STAT, là các protein liên kết DNA cũng liên kết với vùng tế bào chất của cytokine hoặc các thụ thể của yếu tố tăng trưởng. JAK và STAT được kích hoạt chuyển vị trí vào nhân dưới dạng yếu tố phiên mã để điều chỉnh biểu hiện gen của các cytokine gây viêm như IL-6, IL-10 và yếu tố hạt nhân κB (NF-κB). Chúng cũng kích hoạt các con đường xuôi dòng thúc đẩy sự phát triển của hồng cầu, tủy và tế bào megakaryocytic. Cơ chế bệnh sinh phân tử của các khối u tăng sinh tủy chưa được hiểu đầy đủ; tuy nhiên, JAK2 được kích hoạt cơ bản và đường truyền tín hiệu JAK-STAT trở nên mất kiểm soát và xuất hiện các bất thường.
Ruxolitinib là chất ức chế chọn lọc và mạnh mẽ JAK2 và JAK1, có ái lực nhất định với JAK3 và TYK2. Tác dụng chống ung thư của Ruxolitinib là do nó ức chế JAK và quá trình phosphoryl hóa STAT3 qua trung gian JAK. Bằng cách điều hòa giảm con đường JAK-STAT, Ruxolitinib ức chế quá trình tăng sinh tủy và ức chế nồng độ các cytokine gây viêm trong huyết tương như IL-6 và TNF-α.
JAK được kích hoạt cũng có liên quan đến bệnh mảnh ghép chống ký chủ đây là một biến chứng miễn dịch nghiêm trọng của ghép tế bào gốc tạo máu đồng loại. GVHD có liên quan đến tỷ lệ mắc bệnh và tử vong đáng kể, đặc biệt đối với những bệnh nhân không đáp ứng tốt với liệu pháp corticosteroid. JAKS được kích hoạt sẽ kích thích phản ứng của tế bào T hỗ trợ , dẫn đến tăng sinh tế bào T hỗ trợ và tăng cường sản xuất các cytokine gây viêm. Bằng cách ngăn chặn JAK1 và JAk2, Ruxolitinib ức chế sự mở rộng tế bào T của người hiến tặng và ngăn chặn các phản ứng gây viêm.
- Đối với bệnh bạch biến
Ruxolitinib là chất ức chế Janus Kinase (JAK) có tính chọn lọc đối với các dạng đồng phân JAK1 và JAK2. Tín hiệu JAK nội bào liên quan đến con đường STAT (con đường truyền tín hiệu và hoạt hóa phiên mã) hoạt hóa các thụ thể cytokine và kích hoạt biểu hiện gen sau đó. Tế bào lympho T gây độc tế bào sản xuất IFNγ tự miễn được cho là nguyên nhân trực tiếp gây ra sự phá hủy tế bào hắc tố ở bệnh bạch biến ở người. Việc tập trung các tế bào Lympho gây độc tế bào vào vùng da bị tổn thương được thực hiện thông qua các chemokine phụ thuộc IFNγ , chẳng hạn như CXCL10. Tín hiệu xuôi dòng của IFNγ phụ thuộc vào JAK1/2 và việc điều trị bằng Ruxolitinib làm giảm nồng độ CXCL10 ở bệnh nhân bạch biến.
5 Dược động học
- Hấp thu
Sau khi uống, Ruxolitinib được hấp thu nhanh chóng và đạt nồng độ đỉnh trong vòng một giờ sau khi dùng. Trong khoảng liều đơn từ 5 mg đến 200 mg, nồng độ tối đa trung bình trong huyết tương (Cmax ) tăng tỷ lệ thuận. C max dao động từ 205 nM đến 7100 nM và AUC dao động từ 862 nM x giờ đến 30700 nM x giờ. T max dao động từ một đến hai giờ sau khi uống. Sinh khả dụng đường uống ít nhất là 95%.
Đối với dạng dùng tại chỗ, nồng độ đáy trong huyết tương ở trạng thái ổn định trung bình ± STD là 56,9 ± 62,6 nM với AUC 0-12 giờ dự kiến ở 683 ± 751 giờ*nM, xấp xỉ 25% AUC trung bình quan sát được 0-12 giờ ở trạng thái ổn định (2716 giờ* nM) sau khi bôi 15mg hai lần mỗi ngày ở những người tham gia khỏe mạnh. Sinh khả dụng trung bình của kem Ruxolitinib ở những người tham gia mắc bệnh bạch biến trong dữ liệu tổng hợp của hai nghiên cứu Giai đoạn 3 là 9,72% (5,78%)
- Phân bố
Sau khi uống Thể tích phân bố trung bình ở trạng thái ổn định là 72L (29%) ở bệnh nhân xơ tủy và 75L (23%) ở bệnh nhân đa hồng cầu nguyên phát. Vẫn chưa xác định được liệu Ruxolitinib có vượt qua hàng rào máu não hay không.
Ruxolitinib liên kết 97% với protein huyết tương người, chủ yếu là Albumin.
- Chuyển hóa
Hơn 99% Ruxolitinib dùng đường uống trải qua quá trình chuyển hóa qua trung gian CYP3A4 và ở mức độ thấp hơn là CYP2C9. Các chất chuyển hóa chính trong huyết tương người là M18 được hình thành bằng quá trình 2-hydroxyl hóa, và M16 và M27 (các đồng phân lập thể) được hình thành bằng quá trình 3-hydroxyl hóa. Các chất chuyển hóa được xác định khác bao gồm M9 và M49, được hình thành bằng cách hydroxyl hóa và hình thành xeton. Không phải tất cả các cấu trúc chất chuyển hóa đều có đặc điểm đầy đủ và người ta suy đoán rằng nhiều chất chuyển hóa tồn tại ở dạng đồng phân lập thể. Các chất chuyển hóa của Ruxolitinib duy trì hoạt động ức chế JAK1 và JAk2 ở mức độ thấp hơn so với thuốc gốc.
- Thải trừ
Sau khi uống một liều Ruxolitinib được đánh dấu phóng xạ, thuốc chủ yếu được đào thải qua quá trình trao đổi chất. Khoảng 74% tổng liều được bài tiết qua nước tiểu và 22% được bài tiết qua phân, chủ yếu ở dạng chất chuyển hóa hydroxyl và oxo của Ruxolitinib. Thuốc gốc không biến đổi chiếm ít hơn 1% tổng lượng phóng xạ được bài tiết.
Thời gian bán hủy trung bình của Ruxolitinib dùng đường uống là khoảng 3 giờ và thời gian bán hủy trung bình của các chất chuyển hóa của nó là khoảng 5,8 giờ. Thời gian bán hủy trung bình ở giai đoạn cuối rõ ràng của Ruxolitinib sau khi bôi tại chỗ được ước tính ở 9 bệnh nhân người lớn và thanh thiếu niên có ≥ 25% BSA liên quan đến viêm da dị ứng và là
khoảng 116 giờ, phản ánh tốc độ hấp thu thuốc chậm hơn là tốc độ đào thải thuốc.
Độ thanh thải Ruxolitinib là 17,7 L/giờ ở phụ nữ và 22,1 L/giờ ở nam giới bị bệnh xơ tủy. Độ thanh thải thuốc là 12,7 L/giờ (42%) ở bệnh nhân mắc bệnh đa hồng cầu nguyên phát và 11,9 L/giờ (43%) ở bệnh nhân mắc bệnh mảnh ghép chống lại vật chủ cấp tính.
6 Độc tính
LD50 (Liều độc gây chết 50% cá thể) của Ruxolitinib đường uống là 250 mg/kg. Liều đơn Ruxolitinib lên tới 200mg được dung nạp tốt. Liều cao hơn liều khuyến cáo lặp lại có liên quan đến ức chế tủy, bao gồm giảm bạch cầu, thiếu máu và giảm tiểu cầu. Không có thuốc giải độc khi dùng quá liều Ruxolitinib, bệnh nhân nên được điều trị hỗ trợ thích hợp. Thẩm tách máu được cho là không làm tăng cường thải trừ Ruxolitinib.
7 Chỉ định
Ruxolitinib là một loại thuốc uống được FDA phê chuẩn để điều trị bệnh xơ tủy có nguy cơ cao, bệnh nhân mắc bệnh đa hồng cầu không dung nạp hoặc kháng hydroxyurea và bệnh mảnh ghép chống lại vật chủ cấp tính kháng steroid.
Vào năm 2011, dựa trên kết quả từ cả hai thử nghiệm COMFORT–I và COMFORT–II, FDA đã phê duyệt Ruxolitinib như một phương pháp điều trị bệnh xơ tủy. Vào thời điểm đó, đây là liệu pháp duy nhất được phê duyệt để điều trị bệnh xơ tủy có nguy cơ trung bình và cao. Năm 2019, FDA đã phê duyệt Ruxolitinib để điều trị bệnh mảnh ghép chống vật chủ cấp tính kháng steroid cho bệnh nhân trên 12 tuổi dựa trên kết quả từ STUDY INCB 18424-271, một thử nghiệm bao gồm 49 bệnh nhân. Sự chấp thuận này đã khiến Ruxolitinib trở thành loại thuốc đầu tiên được FDA chấp thuận dành cho những bệnh nhân mắc bệnh mảnh ghép chống lại vật chủ cấp tính kháng steroid.
Vào tháng 9 năm 2021, FDA (Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ) đã phê duyệt công thức kem Ruxolitinib để điều trị viêm da dị ứng nhẹ đến trung bình, khiến đây trở thành thuốc ức chế janus kinase tại chỗ đầu tiên được phê duyệt sử dụng trên thị trường Hoa Kỳ.
Vào tháng 07 năm 2022 FDA chấp thuận Ruxolitinib (Opzelura) bôi tại chỗ điều trị bệnh bạch biến không đứt đoạn ở bệnh nhân từ 12 tuổi trở lên.
Ruxolitinib gần đây đang được nghiên cứu như một phương pháp điều trị tiềm năng cho bệnh do vi-rút Corona; tuy nhiên, việc này vẫn đang tiếp diễn mà không có sự chấp thuận chắc chắn. Các chỉ định điều trị khác mà Ruxolitinib đang được nghiên cứu bao gồm rụng tóc từng vùng, bệnh vẩy nến mảng bám, u lympho tế bào T ngoại biên và u lympho tế bào T lớn lan tỏa tái phát.
8 Chống chỉ định
Có một số chống chỉ định cụ thể khi kê đơn Ruxolitinib; tuy nhiên, có những loại thuốc và thực phẩm nên thận trọng khi sử dụng cùng với Ruxolitinib. Ví dụ, không nên dùng Bưởi và nước ép bưởi chùm cùng với Ruxolitinib do có thể xảy ra tương tác. Hơn nữa, khi dùng các chất ức chế CYP3A4 mạnh như Clarithromycin, Nelfinavir và Voriconazole cùng với Ruxolitinib, nên giảm liều Ruxolitinib vì tất cả các loại thuốc này đều làm tăng phơi nhiễm với Ruxolitinib. Cần cân nhắc cẩn thận khi dùng Fluconazol cùng với Ruxolitinib vì nó ức chế cả CYP3A4 và CYP2C9 và làm tăng nồng độ Ruxolitinib. Do đó, liều Fluconazol không được vượt quá 200 mg mỗi ngày khi dùng cùng với Ruxolitinib.
Các chống chỉ định thuốc khác bao gồm sử dụng đồng thời Ruxolitinib với vắc xin sống.
Ruxolitinib chống chỉ định ở những bệnh nhân có độ thanh thải creatinin dưới 15 và những người suy thận nhưng không chạy thận nhân tạo. Bệnh nhân không nên cho con bú trong thời gian điều trị và trong hai tuần sau khi ngừng điều trị.
Các bác sĩ lâm sàng cần thận trọng khi kê đơn Ruxolitinib cho những bệnh nhân hút thuốc hoặc đã từng hút thuốc, những người có độ thanh thải creatinin dưới 60, bệnh nhân suy gan và những người có nguy cơ nhiễm trùng, đặc biệt là nguy cơ liên quan đến bệnh lao.
Không sử dụng Ruxolitinib cho người mẫn cảm với thuốc, phụ nữ đang mang thai và cho con bú.
9 Những ứng dụng trong lâm sàng
Ruxolitinib dùng bằng đường uống có sẵn ở dạng viên 5 mg, 10 mg, 15 mg, 20 mg và 25 mg. Phác đồ dùng thuốc dựa trên tình trạng cá nhân của bệnh nhân cũng như kết quả phân tích máu. Ví dụ, khi điều trị bệnh xơ tủy, liều lượng phụ thuộc vào số lượng tiểu cầu ban đầu của bệnh nhân. Bệnh nhân bị xơ tủy có số lượng tiểu cầu trong khoảng từ 50 đến 100 x 10^9/L có thể dùng tối đa 5mg hai lần mỗi ngày, trong khi những bệnh nhân có số lượng tiểu cầu trên 100 x 10^9/L có thể dùng tối đa 15 mg, hai lần mỗi ngày.
Ngược lại, bệnh nhân mắc bệnh đa hồng cầu nên bắt đầu với liều khởi đầu là 10 mg, hai lần mỗi ngày. Ở những người không đáp ứng, liều có thể tăng lên 25 mg hai lần mỗi ngày nếu huyết sắc tố, số lượng bạch cầu trung tính và tiểu cầu bình thường.
Liều dùng cho bệnh mảnh ghép chống lại vật chủ cấp tính là 5 đến 10 mg uống hai lần mỗi ngày, bắt đầu với liều 5mg hai lần mỗi ngày trong 3 ngày, sau đó tăng lên 10 mg hai lần mỗi ngày. Đối với bệnh ghép chống lại vật chủ mãn tính, liều khuyến cáo là 10 mg, hai lần mỗi ngày. Có thể cần phải điều chỉnh liều đối với những bệnh nhân thất bại trong điều trị trước đó dựa trên phản ứng của bilirubin, ANC (Số lượng bạch cầu trung tính) hoặc tiểu cầu.
Ở bệnh nhân chạy thận nhân tạo, nên dùng thuốc sau khi lọc máu vào những ngày lọc máu.
Ở bệnh nhân suy gan hoặc suy thận, bác sĩ lâm sàng cần tham khảo thêm thông tin kê đơn để hiệu chỉnh liều phù hợp. Ruxolitinib cũng có thể được sử dụng ở bệnh nhi mắc bệnh mảnh ghép chống lại vật chủ; liều lượng tương tự như liều dùng cho người lớn và bác sĩ lâm sàng nên tham khảo tờ hướng dẫn sử dụng để biết liều lượng và điều chỉnh chính xác nhất dựa trên tình trạng gan hoặc thận ở bệnh nhi.
10 Liều dùng
10.1 Đối với bệnh bạch biến không phân đoạn
Người lớn: Thoa kem lên vùng da bị mất sắc tố 2 lần/ ngày. Diện tích thoa tối đa là 10% Diện tích bề mặt cơ thể. Khoảng cách tối thiểu giữa 2 lần bôi kem là 8 giờ. Không sử dụng quá 2 tuýp 100g/ tháng. Không cần giảm dần liều khi ngừng điều trị.
Không cần hiệu chỉnh liều ở người suy gan, suy thận, thanh thiếu niên (12-17 tuổi)và bệnh nhân từ 65 tuổi trở lên.
10.2 Đối với bệnh xơ tủy
Liều khởi đầu được khuyến nghị dựa trên số lượng tiểu cầu (xem Bảng 1):
Bảng 1: Liều khởi đầu trong bệnh xơ tủy
| Số lượng tiểu cầu | Liều khởi đầu |
| > 200.000/mm3 | 20 mg uống hai lần mỗi ngày |
| 100.000 - 200.000/ mm3 | 15 mg uống hai lần mỗi ngày |
| 75.000 - dưới 100.000/mm3 | 10 mg uống hai lần mỗi ngày |
| 50.000 - dưới 75.000/mm3 | 5 mg uống hai lần mỗi ngày |
Sau đó, có thể cân nhắc tăng liều tối đa 5 mg hai lần mỗi ngày, tới liều tối đa là 25 mg hai lần mỗi ngày, dựa trên hiệu quả và số lượng máu. Lưu ý, không nên tăng liều khởi đầu trong vòng 4 tuần đầu điều trị và sau đó không nên tăng thường xuyên hơn khoảng thời gian 2 tuần. Nên ngừng điều trị khi số lượng tiểu cầu dưới 50.000/mm3 hoặc số lượng bạch cầu trung tính tuyệt đối dưới 500/ mm3. Sau khi phục hồi số lượng tế bào máu trên các mức này, có thể bắt đầu lại liều ở mức 5 mg hai lần mỗi ngày và tăng dần dựa trên việc theo dõi cẩn thận số lượng tế bào máu hoàn chỉnh, bao gồm cả sự khác biệt về số lượng bạch cầu.
Nên cân nhắc giảm liều nếu số lượng tiểu cầu giảm trong quá trình điều trị (Bảng 2), với mục tiêu tránh gián đoạn liều do giảm tiểu cầu.
Bảng 2 Khuyến cáo về liều dùng cho bệnh giảm tiểu cầu
| Liều dùng tại thời điểm giảm tiểu cầu | |||||
| 25 mg hai lần mỗi ngày | 20 mg hai lần mỗi ngày | 15 mg hai lần mỗi ngày | 10 mg hai lần mỗi ngày | 5 mg hai lần mỗi ngày | |
| Số lượng tiểu cầu | Liều mới | ||||
| 100.000 đến <125.000/mm3 | 20 mg hai lần mỗi ngày | 15 mg hai lần mỗi ngày | Không thay đổi | Không thay đổi | Không thay đổi |
| 75.000 đến <100.000/mm3 | 10 mg hai lần mỗi ngày | 10 mg hai lần mỗi ngày | 10 mg hai lần mỗi ngày | Không thay đổi | Không thay đổi |
| 50.000 đến <75.000/mm3 | 5 mg hai lần mỗi ngày | 5 mg hai lần mỗi ngày | 5 mg hai lần mỗi ngày | 5 mg hai lần mỗi ngày | Không thay đổi |
| Dưới 50.000/mm3 | Giữ nguyên | Giữ nguyên | Giữ nguyên | Giữ nguyên | Giữ nguyên |
10.3 Đối với bệnh đa hồng cầu nguyên phát
Liều khởi đầu được khuyến nghị là 10 mg uống hai lần mỗi ngày. Có thể cân nhắc tăng liều tối đa 5 mg hai lần mỗi ngày, tới liều tối đa là 25 mg hai lần mỗi ngày. Không nên tăng liều khởi đầu trong vòng 4 tuần đầu điều trị và sau đó không nên tăng thường xuyên hơn khoảng thời gian 2 tuần.
Nên ngừng điều trị khi huyết sắc tố dưới 8 g/dl. Nên cân nhắc giảm liều nếu huyết sắc tố giảm xuống dưới 12 g/dl và được khuyến nghị nếu nó giảm xuống dưới 10 g/dl.
10.4 Đối với bệnh mảnh ghép chống lại vật chủ
Liều khởi đầu được khuyến nghị là 10 mg uống hai lần mỗi ngày. Có thể cần giảm liều và gián đoạn điều trị tạm thời ở bệnh nhân
bị giảm tiểu cầu, giảm bạch cầu hoặc tăng bilirubin toàn phần sau khi điều trị hỗ trợ tiêu chuẩn bao gồm các yếu tố tăng trưởng, liệu pháp chống nhiễm trùng và truyền máu. Nên giảm mức liều theo từng giai đoạn (10mg hai lần mỗi ngày đến 5 mg hai lần mỗi ngày hoặc 5 mg hai lần mỗi ngày đến 5 mg một lần mỗi ngày). Ở những bệnh nhân không thể dung nạp với liều 5 mg mỗi ngày một lần, nên ngừng điều trị. Khuyến nghị về liều lượng chi tiết có trong Bảng 3.
Bảng 3 Khuyến nghị về liều dùng cho bệnh nhân mắc bệnh mảnh ghép chống lại vật chủ (GVHD) bị giảm tiểu cầu, giảm bạch cầu hoặc tăng bilirubin toàn phần
| Chỉ số | Khuyến cáo về liều lượng |
| Số lượng tiểu cầu <20.000/mm3 | Giảm xuống một mức liều. Nếu số lượng tiểu cầu ≥20.000/mm3 trong vòng 7 ngày, có thể tăng liều đến mức liều ban đầu, nếu không thì duy trì liều giảm. |
| Số lượng tiểu cầu <15.000/mm3 | Giữ mức liều cho đến khi số lượng tiểu cầu ≥20.000/mm3 , sau đó tiếp tục ở mức liều thấp hơn. |
| Số lượng bạch cầu trung tính tuyệt đối (ANC) ≥500/mm3 đến <750/mm3 | Giảm xuống một mức liều. Tiếp tục ở mức liều ban đầu nếu ANC >1.000/ mm3 . |
| Số lượng bạch cầu trung tính tuyệt đối <500/mm3 | Giữ liều cho đến khi ANC >500/mm3 , sau đó tiếp tục ở mức liều thấp hơn. Nếu ANC >1.000/mm3 , việc dùng thuốc có thể tiếp tục ở mức liều ban đầu. |
| Tăng bilirubin toàn phần, không có GvHD gan | >3,0 đến 5,0 x ULN: Tiếp tục dùng thuốc ở một mức liều thấp hơn cho đến khi 3,0 x ULN. |
| >5,0 đến 10,0 x ULN: Giữ mức liều tối đa 14 ngày cho đến khi tổng lượng bilirubin ≤3,0 x ULN. Nếu tổng lượng bilirubin 3,0 x ULN, liều lượng có thể tiếp tục ở liều hiện tại. Nếu không 3,0 x ULN sau 14 ngày, hãy tiếp tục ở một mức liều thấp hơn. | |
| >10,0 x ULN: Giữ mức liều cho đến khi tổng lượng bilirubin ≤3,0 x ULN, sau đó tiếp tục ở một mức liều thấp hơn. | |
| Tăng bilirubin toàn phần, GvHD gan | >3,0 x ULN: Tiếp tục dùng thuốc ở một mức liều thấp hơn cho đến khi tổng lượng bilirubin ≤3,0 x ULN. |
10.5 Đối với quần thể đặc biệt
Suy thận
Đối với bệnh nhân suy thận nhẹ hoặc trung bình: không cần hiệu chỉnh liều
Đối với bệnh nhân suy thận nặng (CrCl <30 ml/phút), liều khởi đầu khuyến cáo dựa trên số lượng tiểu cầu cho bệnh nhân xơ tủy (MF) nên giảm khoảng 50% và dùng hai lần mỗi ngày. Liều khởi đầu được khuyến nghị cho bệnh nhân mắc bệnh đa hồng cầu nguyên phát (PV) và bệnh mảnh ghép chống lại vật chủ (GvHD) bị suy thận nặng là 5 mg hai lần mỗi ngày. Bệnh nhân cần được theo dõi cẩn thận về tính an toàn và hiệu quả trong quá trình điều trị bằng Ruxolitinib.
Các dữ liệu còn hạn chế để xác định chính xác liều hiệu chỉnh tốt nhất cho bệnh nhân suy thận giai đoạn cuối (ESRD) đang chạy thận nhân tạo. Các thí nghiệm mô phỏng dựa trên dữ liệu dược động học/ dược lực học có sẵn ở nhóm đối tượng này gợi ý liều khởi đầu cho bệnh nhân MF mắc ESRD đang chạy thận nhân tạo là 15-20 mg/ lần/ ngày hoặc hai liều 10 mg cách nhau 12 giờ, được dùng sau khi lọc máu và chỉ trong ngày chạy thận nhân tạo. Khuyến cáo dùng 15 mg/ lần/ ngày cho bệnh nhân MF có số lượng tiểu cầu từ 100.000/mm3 - 200.000/mm3 . Khuyến cáo dùng một liều duy nhất 20mg hoặc hai liều 10 mg cách nhau 12 giờ cho bệnh nhân MF có số lượng tiểu cầu >200.000/ mm3. Các liều tiếp theo (dùng một lần hoặc hai liều 10 mg cách nhau 12 giờ) chỉ nên được dùng vào những ngày chạy thận nhân tạo sau mỗi đợt lọc máu.
Liều khởi đầu được khuyến nghị cho bệnh nhân PV mắc ESRD khi chạy thận nhân tạo là 10 mg/ lần/ ngày hoặc hai liều 5mg cách nhau 12 giờ, được dùng sau khi lọc máu và chỉ vào ngày chạy thận nhân tạo. Những khuyến nghị trên về liều lượng ở bệnh nhân ESRD chạy thận nhân tạo hoàn toàn dựa trên dữ liệu mô phỏng. Vì thế, bất kỳ sự hiệu chỉnh liều nào trên nhóm bệnh nhân này cần thận trọng và theo dõi cẩn thận về tính an toàn và hiệu quả ở từng bệnh nhân. Hiện tại, chưa có dữ liệu về hiệu chỉnh liều trên bệnh nhân đang thẩm phân phúc mạc hoặc lọc máu tĩnh mạch-tĩnh mạch liên tục.
Không có dữ liệu về bệnh nhân GvHD mắc ESRD.
Suy gan
Đối với bệnh nhân MF bị suy gan, liều khởi đầu được khuyến cáo dựa trên số lượng tiểu cầu nên giảm khoảng 50% và dùng hai lần mỗi ngày.Các liều tiếp theo nên được điều chỉnh dựa trên việc theo dõi cẩn thận về tính an toàn và hiệu quả. Liều khởi đầu được khuyến cáo là 5 mg hai lần mỗi ngày cho bệnh nhân PV. Bệnh nhân được chẩn đoán bị suy gan khi dùng Ruxolitinib phải được xét nghiệm công thức máu toàn phần, bao gồm cả sự thay đổi về số lượng bạch cầu, được theo dõi ít nhất một đến hai tuần một lần trong 6 tuần đầu tiên sau khi bắt đầu điều trị bằng Ruxolitinib và được chỉ định sử dụng trên lâm sàng sau đó khi chức năng gan của họ và lượng máu đã ổn định. Liều Ruxolitinib có thể được điều chỉnh để giảm nguy cơ giảm tế bào máu.
Ở những bệnh nhân suy gan nhẹ, trung bình hoặc nặng không liên quan đến GvHD, nên giảm 50% liều khởi đầu của Ruxolitinib. Ở những bệnh nhân mắc bệnh gan có liên quan đến GvHD và tăng tổng lượng bilirubin lên > 3 x ULN, cần theo dõi công thức máu thường xuyên hơn để phát hiện độc tính và có thể xem xét giảm liều một mức liều.
Bệnh nhân cao tuổi (>65 tuổi)
Không khuyến cáo điều chỉnh liều bổ sung cho bệnh nhân cao tuổi.
Đối với trẻ em
Dữ liệu về tính an toàn và hiệu quả của Ruxolitinib ở trẻ em và thanh thiếu niên từ 18 tuổi trở xuống mắc bệnh MF và PV chưa được thiết lập.
Liều dùng ở bệnh nhi trên 12 tuổi mắc GvHD giống như ở người lớn. Tuy nhiên, liều dùng ở nhóm trẻ em dưới 12 tuổi chưa được thiết lập do lo ngại về tính an toàn và hiệu quả.
10.6 Ngừng điều trị
Việc tiếp tục sử dụng Ruxolitinib để điều trị MF và PV có thể được thực hiện dựa trên sự cân nhắc lợi ích - rủi ro. Tuy nhiên, nếu kích thước lá lách không giảm hoặc các triệu chứng không cải thiện, nên ngừng điều trị sau 6 tháng.
Đối với những bệnh nhân có cải thiện trên lâm sàng, khuyến cáo nên ngừng điều trị bằng Ruxolitinib nếu chiều dài lá lách tăng lên 40% so với kích thước ban đầu (tương đương với mức tăng 25% về thể tích) và không còn có sự cải thiện rõ rệt về các triệu chứng liên quan
Đối với bệnh nhân mắc GvHD, có thể xem xét giảm liều ở những bệnh nhân có đáp ứng và sau khi ngừng dùng corticosteroid. Mức giảm khuyến cáo là giảm 50% mỗi 2 tháng. Trong hoặc sau quá trình giảm liều, nếu các triệu chứng của bệnh GvHD tái phát nên cân nhắc việc tái điều trị.
11 Cách dùng
Ruxolitinib được dùng bằng đường uống để điều trị bệnh xơ tủy, bệnh đa hồng cầu nguyên phát, bệnh mảnh ghép chống lại vật chủ, không phụ thuộc vào bữa ăn. Ruxolitinib được dùng tại chỗ trong bệnh bạch biến không đứt đoạn.
Nếu quên một liều, người bệnh không nên dùng liều bổ sung mà tiếp tục sử dụng liều kế tiếp theo đúng liệu trình.
Đối với dạng kem bôi ngoài da, tránh rửa vùng da đã điều trị trong ít nhất 2 giờ sau khi bôi, không nên thoa kem lên môi để tránh nuốt phải, nên rửa tay sau khi thoa kem (trừ khi tay là vùng điều trị).
12 Tác dụng không mong muốn
Trong các thử nghiệm COMFORT, các tác dụng phụ không liên quan đến huyết học phổ biến nhất bao gồm bầm máu, nhức đầu, chóng mặt, đau bụng, mệt mỏi và tiêu chảy. Các tác dụng phụ về huyết học phổ biến nhất được thấy với Ruxolitinib trong các thử nghiệm bao gồm thiếu máu và giảm tiểu cầu do ức chế JAK2, chất này có vai trò trong việc truyền tín hiệu erythropoietin và Thrombopoietin. Các tác dụng phụ về huyết học nghiêm trọng có thể xảy ra khác bao gồm thiếu máu và giảm bạch cầu.
Đã có báo cáo rằng những bệnh nhân dùng Ruxolitinib có tỷ lệ nhiễm herpes zoster và ung thư biểu mô tế bào đáy và tế bào vảy cao hơn. Một nghiên cứu phân tích Ruxolitinib ở những bệnh nhân mắc bệnh mảnh ghép chống lại vật chủ cấp tính kháng steroid đã đề cập đến những bệnh nhân bị thiếu máu, giảm tiểu cầu và nhiễm cytomegalovirus khi dùng Ruxolitinib.
Đối với dạng dùng tại chỗ, tác dụng phụ phổ biến nhất là nổi mụn trứng cá tại chỗ bôi thuốc. Ngoài ra, người bệnh có thể gặp một số tác dụng phụ khác như dễ bị cảm lạnh, tiêu chảy, viêm phế quản, nhiễm trùng tai, phát ban, đau đầu,... Ruxolitinib dùng tại chỗ có thể gây nhiễm trùng nghiêm trọng do ảnh hưởng đến hệ thống miễn dịch. Vì thế, nên thận trọng khi sử dụng Ruxolitinib ở những người bị nhiễm trùng nặng. Một số tác dụng phụ hiếm gặp hơn bao gồm: chảy máu bất thường, xuất hiện vết bầm tím, mệt mỏi, hụt hơi, sốt, tăng Cholesterol,...
13 Tương tác thuốc
13.1 Đối với dạng dùng đường uống
Nghiên cứu về tương tác thuốc của Ruxolitinib chỉ được thực hiện ở người lớn.
Ruxolitinib được chuyển hóa chủ yếu bởi CYP3A4 và CYP2C9. Do đó, các thuốc ức chế hoặc cảm ứng các enzyme này có thể làm tăng hoặc giảm nồng độ của Ruxolitinib.
- Tương tác cần giảm liều Ruxolitinib
Chất ức chế CYP3A4 mạnh
Các chất ức chế CYP3A4 mạnh (như Clarithromycin, Indinavir, Itraconazole, Ketoconazol, Lopinavir/ritonavir, Ritonavir, Mibefradil, Nefazodone, Nelfinavir, Posaconazole, Saquinavir, Telaprevir, Telithromycin, Voriconazole)
Ở bệnh nhân khỏe mạnh, sử dụng đồng thời Ruxolitinib (liều đơn 10 mg) với chất ức chế CYP3A4 mạnh, dẫn đến Cmax của Ruxolitinib và AUC cao hơn lần lượt là 33% và 91% so với chỉ dùng Ruxolitinib. Thời gian bán hủy kéo dài từ 3,7 đến 6,0 giờ khi dùng đồng thời với Ketoconazol.
Khi sử dụng Ruxolitinib cùng với các chất ức chế CYP3A4 mạnh, nên giảm liều Ruxolitinib khoảng 50%, dùng hai lần mỗi ngày, ngoại trừ ở bệnh nhân GvHD. Tác dụng của thuốc ức chế CYP3A4 mạnh ở bệnh nhân mắc GvHD được cho là không ảnh hưởng đáng kể đến các thông số dược động học của Ruxolitinib.
Bệnh nhân cần được theo dõi chặt chẽ (ví dụ hai lần mỗi tuần) về tình trạng giảm tế bào máu và điều chỉnh liều dựa trên độ an toàn và hiệu quả
Chất ức chế kép CYP2C9 và CYP3A4
Ở bệnh nhân khỏe mạnh, sử dụng đồng thời Ruxolitinib (liều đơn 10 mg) với chất ức chế kép CYP2C9 và CYP3A4 (như Fluconazole) dẫn đến Cmax của Ruxolitinib và AUC cao hơn lần lượt là 47% và 232% so với khi dùng Ruxolitinib đơn thuần. Nên cân nhắc giảm 50% liều khi sử dụng cùng các thuốc ức chế kép enzyme CYP2C9 và CYP3A4. Tránh sử dụng đồng thời Ruxolitinib với liều Fluconazole lớn hơn 200 mg mỗi ngày.
Chất ức chế CYP3A4 nhẹ hoặc trung bình
Ở bệnh nhân khỏe mạnh, sử dụng đồng thời Ruxolitinib (liều đơn 10 mg) với Erythromycin 500 mg hai lần mỗi ngày trong 4 ngày dẫn đến Cmax của Ruxolitinib và AUC cao hơn lần lượt là 8% và 27% so với chỉ dùng Ruxolitinib
Không nên điều chỉnh liều khi dùng đồng thời Ruxolitinib với thuốc ức chế CYP3A4 nhẹ hoặc trung bình (như Ciprofloxacin, Erythromycin, Amprenavir, Atazanavir, Diltiazem, Cimetidine). Tuy nhiên, bệnh nhân cần được theo dõi chặt chẽ tình trạng giảm tế bào máu khi bắt đầu điều trị.
- Tương tác cần tăng liều Ruxolitinib
Chất cảm ứng enzyme
Bệnh nhân cần được theo dõi chặt chẽ và điều chỉnh liều dựa trên độ an toàn và hiệu quả khi sử dụng cùng với các thuốc gây cảm ứng CYP3A4 (chẳng hạn như Carbamazepine, Phenobarbital, Phenytoin, Rifabutin, Rifampin,...).
Ở bệnh nhân khỏe mạnh, sử dụng Ruxolitinib (liều đơn 50 mg) sau khi dùng Rifampicin gây cảm ứng CYP3A4 mạnh (liều 600mg mỗi ngày trong 10 ngày), AUC của Ruxolitinib thấp hơn 70% so với sau khi chỉ dùng Ruxolitinib. Tuy nhiên, mức độ ảnh hưởng đến dược lực học của Ruxolitinib vẫn chưa rõ ràng và phụ thuộc vào nhiều yếu tố. Vì thế, bác sĩ lâm sàng cần xem xét trên từng bệnh nhân để đưa ra quyết định tăng liều Ruxolitinib khi bắt đầu điều trị bằng thuốc cảm ứng enzyme mạnh.
- Ảnh hưởng của Ruxolitinib đối với các thuốc khác
Các chất được vận chuyển bằng P-glycoprotein hoặc các chất vận chuyển khác
Ruxolitinib có thể ức chế bơm tống thuốc P-glycoprotein và BCRP trong ruột. Điều này có thể dẫn đến tăng nồng độ của các thuốc là cơ chất của các chất vận chuyển này, chẳng hạn như Dabigatran etexilate, Ciclosporin, Rosuvastatin và có khả năng là Digoxin. Vì thế, cần theo dõi nồng độ thuốc trong trị liệu (TDM) hoặc theo dõi các biểu hiện lâm sàng khi sử dụng Ruxolitinib với các thuốc bị ảnh hưởng.
Có thể giảm thiểu tương tác này bằng cách tạo khoảng cách giữa các lần dùng thuốc.
Một nghiên cứu ở những đối tượng khỏe mạnh chỉ ra rằng Ruxolitinib không ức chế quá trình chuyển hóa của Midazolam cơ chất CYP3A4 qua đường uống. Do đó, dự kiến sẽ không có sự gia tăng phơi nhiễm của các chất nền CYP3A4 khi kết hợp chúng với Ruxolitinib. Một nghiên cứu khác ở những đối tượng khỏe mạnh chỉ ra rằng Ruxolitinib không ảnh hưởng đến dược động học của thuốc tránh thai đường uống có chứa Ethinylestradiol và Levonorgestrel. Do đó, vẫn cần nhiều bằng chứng hơn để xác định về ảnh hưởng của Ruxolitinib đến hiệu quả tránh thai khi sử dụng kết hợp.
13.2 Đối với dạng dùng tại chỗ
Hiện nay chưa có nghiên cứu nào về tương tác của Ruxolitinib dùng tại chỗ. Khả năng tương tác với Ruxolitinib được coi là thấp do phơi nhiễm toàn thân hạn chế sau khi dùng tại chỗ.
Tuy nhiên, nên thận trọng khi dùng chung với các sản phẩm thuốc bôi khác để điều trị bệnh bạch biến hoặc không nên sử dụng đồng thời trên cùng một vùng da. Nếu sử dụng các loại thuốc bôi khác (bao gồm cả kem chống nắng và kem dưỡng da) trên cùng một vùng da, nên đợi ít nhất 2 giờ sau khi bôi kem Ruxolitinib.
14 Thận trọng
Các dữ liệu về việc sử dụng Ruxolitinib trên phụ nữ mang thai hoặc cho con bú vẫn còn hạn chế. Vì thế, khuyến cáo phụ nữ có thai hoặc đang cho con bú không nên sử dụng Ruxolitinib.
Không có dữ liệu trên người về ảnh hưởng của Ruxolitinib đến khả năng sinh sản. Khuyến cáo phụ nữ trong độ tuổi sinh đẻ nên sử dụng biện pháp tránh thai hiệu quả trong quá trình sử dụng Ruxolitinib. Trong trường hợp phát hiện có thai khi đang điều trị bằng Ruxolitinib, cần đánh giá lại rủi ro - lợi ích và cân nhắc kỹ về những rủi ro tiềm ẩn với thai nhi.
Ruxolitinib không có hoặc có tác dụng an thần không đáng kể. Tuy nhiên, một số bệnh nhân bị chóng mặt sau khi uống Ruxolitinib cần hạn chế lái xe hoặc vận hành máy móc.
Quá liều Ruxolitinib có thể xảy ra và kéo theo nguy cơ xuất hiện nhiều tác dụng phụ nghiêm trọng hơn. Hiện nay chưa có thuốc giải độc khi dùng quá liều Ruxolitinib. Liều đơn lên tới 200 mg đã được sử dụng với khả năng dung nạp cấp tính chấp nhận được. Liều lặp lại cao hơn khuyến cáo có liên quan đến việc tăng ức chế tủy bao gồm giảm bạch cầu, thiếu máu và giảm tiểu cầu. Khi sử dụng thuốc quá liều, cần có các biện pháp điều trị hỗ trợ thích hợp. Tuy nhiên, lọc máu tại thận được cho là không làm tăng thải trừ Ruxolitinib.
15 Mua thuốc Ruxolitinib ở đâu?
Hiện nay, các thuốc Ruxolitinib có dạng viên nén 5mg/ 10mg/ 20mg dùng đường uống để điều trị bệnh xơ tủy, bệnh đa hồng cầu nguyên phát, bệnh mảnh ghép chống lại vật chủ và dạng kem bôi điều trị bệnh viêm da mạn tính, bệnh bạch biến. Khi có đơn thuốc của bác sĩ, người bệnh có thể tìm mua Ruxolitinib tại các nhà thuốc trên toàn quốc.
16 Giá thuốc Ruxolitinib là bao nhiêu?
Biệt dược gốc của Ruxolitinib là: Thuốc JAKAVI, thuộc hãng Novartis Pharma.
Các thuốc khác chứa Ruxolitinib bao gồm: Dạng viên nén (Jakafi), dạng kem bôi (Opzelura)
Giá các chế phẩm thuốc có chứa Ruxolitinib hiện nay khá cao, dao động trong khoảng 15-40 triệu VNĐ/ hộp tùy hàm lượng.
Còn đối với chế phẩm Opzelura dạng kem bôi giá dự kiến là 1.950 đô la (khoảng 46.000.000 VNĐ) cho một tuýp Opzelura 60 gram.
17 Tháng 07/2022, FDA chấp thuận Ruxolitinib (Opzelura) bôi tại chỗ điều trị bệnh bạch biến không đứt đoạn
FDA chấp thuận Ruxolitinib (Opzelura) bôi tại chỗ điều trị bệnh bạch biến không đứt đoạn
Tháng 07 năm 2022, cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ đã phê duyệt Ruxolitinib (Opzelura) bôi tại chỗ để điều trị bệnh bạch biến không phân đoạn ở bệnh nhân từ 12 tuổi trở lên. Nhà sản xuất Incyte đã công bố Ruxolitinib vào ngày 18 tháng 07 năm 2022.
Trước đó, phương pháp điều trị đã được phê duyệt để điều trị viêm da dị ứng nhẹ đến trung bình vào tháng 9 năm 2021, là công thức kem chứa Ruxolitinib, một chất ức chế Janus kinase (JAK) 1/JAK2.
17.1 Nhận định của chuyên gia
David Rosmarin, MD, Phó Chủ tịch nghiên cứu và giáo dục tại khoa da liễu tại Trung tâm Y tế Tufts, Boston, cho biết: “Trước đây, không có phương pháp điều trị nào được phê duyệt để phục hồi sắc tố cho bệnh nhân mắc bệnh bạch biến.”
Rosmarin, nhà nghiên cứu chính của thử nghiệm lâm sàng giai đoạn 3 của Ruxolitinib bôi tại chỗ, chia sẻ rằng: “Điều quan trọng là chúng tôi có thể cung cấp cho bệnh nhân những lựa chọn vừa an toàn vừa hiệu quả để mang lại cho họ kết quả điều trị như mong đợi”.
Trên thực tế, bệnh bạch biến là một căn bệnh thực sự có thể ảnh hưởng đến chất lượng cuộc sống. Một số bệnh nhân mắc bệnh bạch biến phải chịu sự kỳ thị của xã hội. Họ cảm thấy như thể họ đang bị nhìn chằm chằm hoặc đang bị bắt nạt và họ không cảm thấy tự tin khi giao tiếp xã hội. Điều này làm ảnh hưởng đến các mối quan hệ trong cuộc sống và công việc của người bệnh.
17.2 Kết quả thử nghiệm
Sự phê duyệt dựa trên kết quả của hai thử nghiệm giai đoạn 3 (TruE-V1 và TruE-V2) ở 674 bệnh nhân mắc bệnh bạch biến không đứt đoạn từ 12 tuổi trở lên. Sau 24 tuần, khoảng 30% bệnh nhân được điều trị, áp dụng hai lần một ngày, đạt được sự cải thiện ít nhất 75% về Chỉ số chấm điểm vùng bạch biến trên khuôn mặt (F-VASI75), so với khoảng 8% và 13% ở những người trong nhóm còn lại.
Sau 52 tuần, khoảng 50% bệnh nhân được điều trị bằng Ruxolitinib tại chỗ đạt được tiêu chí về F-VASI75.
Ngoài ra, các ca tự báo cáo được đo bằng Thang đo mức độ đáng chú ý của bệnh bạch biến, khoảng 30-40% bệnh nhân cho biết các mảng bạch biến của họ đã mờ dần hoặc giảm đi đáng kể ở tuần thứ 52. Rosmarin đã báo cáo kết quả sau 52 tuần tại cuộc họp thường niên của Học viện Da liễu Hoa Kỳ năm 2022.
Để điều trị bệnh bạch biến, bệnh nhân nên bôi một lớp mỏng Ruxolitinib tại chỗ lên vùng bị ảnh hưởng hai lần một ngày. Theo thông tin kê đơn, diện tích thoa thuốc có thể "lên tới 10% diện tích bề mặt cơ thể" và cũng cho biết thêm, việc điều trị cần kéo dài hơn 24 tuần để có được hiệu quả rõ rệt. Nếu sau 24 tuần, bệnh nhân không nhận thấy sự tái tạo sắc tố đáng kể thì cần đánh giá lại quá trình sử dụng.
Theo công ty, các tác dụng phụ phổ biến nhất trong các thử nghiệm có kiểm soát là xuất hiện mụn trứng cá và cảm giác ngứa tại nơi bôi thuốc. Một số tác dụng phụ khác bao gồm đau đầu, nhiễm trùng đường tiết niệu, ban đỏ xuất hiện tại chỗ bôi thuốc và sốt.
Nhãn sản phẩm dùng tại chỗ đã được phê duyệt bao gồm cảnh báo về vấn đề nhiễm trùng nghiêm trọng, tử vong, ung thư, các biến cố tim mạch bất lợi nghiêm trọng và huyết khối - cảnh báo này dựa trên các báo cáo ở những bệnh nhân được điều trị bằng thuốc ức chế JAK đường uống để điều trị tình trạng viêm.
Trong tương lai, Rosmarin tin rằng việc sử dụng loại thuốc này với các liệu pháp khác, có thể mang lại hiệu quả tốt hơn nữa. Dữ liệu hiện có ở những bệnh nhân được điều trị bằng Ruxolitinib dưới dạng đơn trị liệu, không có liệu pháp bổ sung.
William Damsky, MD, PhD, giáo sư da liễu và bệnh lý da liễu tại Trường Y Yale, New Haven, người không tham gia vào các thử nghiệm, cho biết điều thú vị nhất về loại thuốc này là tính mới của nó. Ông nói, mặc dù một số steroid bôi tại chỗ được sử dụng ngoài nhãn hiệu để điều trị bệnh bạch biến, nhưng hiệu quả của chúng khác xa so với những gì đã được quan sát thấy trong các thử nghiệm sử dụng thuốc Ruxolitinib bôi tại chỗ này. Có nhiều lý do để giải thích cho sự khác biệt này, nhưng lý do được cho là chính nhất là việc sử dụng steroid bôi tại chỗ chỉ mang lại một chút hy vọng cho nhiều bệnh nhân mắc bệnh bạch biến, những người mà trong nhiều năm luôn được thông báo rằng “không có phương pháp điều trị cho căn bệnh của họ”.
18 Tài liệu tham khảo
1. EMC. Ngày đăng: Ngày 25 tháng 07 năm 2023. Opzelura 15 mg/g cream, EMC. Ngày truy cập: Ngày 25 tháng 08 năm 2023.
2. Maiya Focht. Ngày đăng: Ngày 19 tháng 07 năm 2022. FDA Approves Topical Ruxolitinib (Opzelura) for Nonsegmental Vitiligo, Medscape. Ngày truy cập: Ngày 25 tháng 08 năm 2023.
3. Drugbank. Ngày đăng: Ngày 13 tháng 05 năm 2013. Ruxolitinib, Drugbank. Ngày truy cập: Ngày 25 tháng 08 năm 2023.
4. Mawiyah Haq, Ghufran Adnan. Ngày đăng: Ngày 05 tháng 06 năm 2023. Ruxolitinib, NIH. Ngày truy cập: Ngày 25 tháng 08 năm 2023.