Pembrolizumab
1 sản phẩm
 Dược sĩ Hương Trà Dược sĩ lâm sàng - Đại học Y Dược Thái Nguyên
Dược sĩ Hương Trà Dược sĩ lâm sàng - Đại học Y Dược Thái Nguyên
Ước tính: 5 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
Hoạt chất Pembrolizumab được biết đến/ sử dụng trong lâm sàng nhằm mục đích điều trị nhiều loại ung thư khác nhau như ung thư biểu mô tế bào vảy ở đầu và cổ, ung thư biểu mô tiết niệu,... Trong bài viết này, Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) xin gửi đến bạn đọc những thông tin về Pembrolizumab.
1 Tổng quan
1.1 Lịch sử ra đời
Pembrolizumab được sự chấp thuận đầu tiên của FDA - như một liệu pháp điều trị khối u ác tính tiến triển hoặc không thể cắt bỏ (một loại ung thư da) - vào ngày 4 tháng 9 năm 2014.
1.2 Mô tả hoạt chất Pembrolizumab
Trạng thái: Bột màu trắng đến trắng nhạt, độ hòa tan là 22,5-27,5 mg/ml.
2 Tác dụng dược lý
2.1 Dược lực học, Cơ chế tác dụng
Pembrolizumab là một kháng thể IgG4 kappa đơn dòng được nhân hóa trực tiếp chống lại bề mặt tế bào người PD-1 (thụ thể chết theo chương trình-1) trên tế bào lympho. Thụ thể PD-1 cung cấp một “điểm kiểm tra miễn dịch” quan trọng, giúp ngăn hệ thống miễn dịch tự tấn công. Một số loại khối u có biểu hiện cao của PD-L1 (phối tử thụ thể tử vong được lập trình-1). Các loại khối u khác sử dụng khả năng kháng miễn dịch thích ứng trong đó chúng sử dụng sinh lý tự nhiên của cảm ứng PD-L1 (bảo vệ các tổn thương qua trung gian miễn dịch khỏi nhiễm trùng) và điều chỉnh nó theo hướng phản ứng chống khối u. Khi PD-L1 tương tác với PD-1, chức năng của tế bào T sẽ bị ức chế; Pembrolizumab ngăn chặn sự hình thành phức hợp PD-1: PDL-1 cho phép cải thiện khả năng tiêu diệt tế bào T qua trung gian.
2.2 Dược động học
Hấp thu: Ngay lập tức, hoàn toàn.
Phân bố: Pembrolizumab có Thể tích phân bố khoảng 6L.
Chuyển hóa: Quá trình dị hóa.
Thải trừ: Pembrolizumab có nửa đời thải trừ khoảng 2 giờ.
3 Chỉ định - Chống chỉ định
3.1 Chỉ định
Pembrolizumab là một kháng thể đơn dòng được FDA phê chuẩn có tác dụng chống lại protein chết tế bào được lập trình 1 (PD-1) và được bán ở Mỹ. Ban đầu nó đã nhận được sự chấp thuận nhanh chóng của FDA đối với khối u ác tính tiến triển, khó chữa vào tháng 9 năm 2014. Sau đó, nó đã nhận được sự chấp thuận để điều trị nhiều tình trạng ung thư khác và nhiều tình trạng khác hiện đang được phát triển lâm sàng.
3.2 Chống chỉ định
Không có chống chỉ định đối với Pembrolizumab.
Hạn chế sử dụng:
- Pembrolizumab không được khuyến cáo ở những bệnh nhân PMBCL (u lympho tế bào B lớn trung thất nguyên phát) cần điều trị tế bào học khẩn cấp.
- Tính an toàn và hiệu quả trong bệnh ung thư hệ thần kinh trung ương ở trẻ em MSI-H chưa được xác định vì đối tượng này đáp ứng các tiêu chí loại trừ khỏi các thử nghiệm lâm sàng.
4 Những ứng dụng trong lâm sàng
4.1 Khối u ác tính
Khối u ác tính không thể cắt bỏ hoặc di căn
- Ở nhóm bệnh nhân u ác tính tiến triển chưa từng điều trị bằng liệu pháp Ipilimumab, tỷ lệ sống sót tổng thể trung bình không đạt được ở hai liều Pembrolizumab khác nhau (liều hai tuần một lần, liều ba tuần một lần) so với dùng Ipilimumab đơn thuần ở thời điểm 16,0 tháng (tỷ lệ rủi ro = 0,68, p<0,001) thời gian theo dõi khoảng 22,9 tháng.
- Trong điều trị trước đây, điều trị bằng Ipilimumab, u ác tính tiến triển, điều trị bằng Pembrolizumab mang lại tỷ lệ sống sót chung là 13,4 tháng (liều 2 mg/kg) và 14,7 tháng (liều 10 mg/kg) so với hóa trị liệu lựa chọn của người nghiên cứu ở thời điểm 11,0 tháng (kết quả không có ý nghĩa thống kê) thời gian theo dõi khoảng là 28 tháng.
Điều trị bổ trợ sau khi cắt bỏ hoàn toàn hạch bạch huyết liên quan đến khối u ác tính
- Ở những bệnh nhân bị u ác tính giai đoạn III được cắt bỏ hoàn toàn, Pembrolizumab cho thấy tỷ lệ sống sót không tái phát là 75,4% so với giả dược là 61,0% (tỷ lệ rủi ro = 0,57, p<0,001) trong thời gian theo dõi trung bình là 15 tháng.
4.2 Ung thư phổi không phải tế bào nhỏ (NSCLC)
NSCLC không vảy di căn đầu tiên không có bất thường khối u EGFR/ALK kết hợp với hóa trị liệu bạch kim và pemeterxed
- Ở những bệnh nhân bị NSCLC không vảy di căn, điều trị đầu tiên bằng Pembrolizumab cộng với hóa trị liệu (pemeterxed và Carboplatin hoặc Cisplatin) cho thấy thời gian sống sót không tiến triển trung bình là 8,8 tháng so với 4,9 tháng chỉ dùng hóa trị liệu (p<0,001) với thời gian sống sót trung bình là 8,8 tháng so với 4,9 tháng chỉ dùng hóa trị liệu (p<0,001). theo dõi 10,5 tháng.
NSCLC vảy di căn đầu tiên với Paclitaxel (hoặc gắn với protein paclitaxel) và carboplatin
- Ở những bệnh nhân mắc NSCLC vảy di căn, điều trị đầu tay bằng Pembrolizumab cộng với hóa trị liệu (carboplatin cộng với paclitaxel hoặc paclitaxel gắn với Albumin hạt nano) cho thấy thời gian sống sót tổng thể trung bình là 15,9 tháng so với 11,3 tháng chỉ dùng hóa trị liệu (p<0,001) với giá trị trung vị theo dõi 7,8 tháng.
Sử dụng tác nhân đơn đầu tiên cho NSCLC không thể cắt bỏ hoặc di căn mà không có bất thường về khối u EGFR/ALK với biểu hiện PD-L1 của khối u lớn hơn 1%
- Ở những bệnh nhân mắc NSCLC tiến triển chưa được điều trị trước đây với điểm PD-1 lớn hơn 50%, điều trị đầu tay bằng Pembrolizumab đơn độc cho thấy thời gian sống sót trung bình là 30,0 tháng so với nhóm đối chứng bằng hóa trị liệu (phác đồ dựa trên bạch kim do nhà nghiên cứu lựa chọn). 14,2 tháng (tỷ lệ rủi ro = 0,63), với thời gian theo dõi trung bình là 25,2 tháng.
Sử dụng một tác nhân cho NSCLC di căn với biểu hiện PD-L1 của khối u lớn hơn 1% đã tiến triển sau hóa trị liệu dựa trên bạch kim. (Bệnh nhân có khối u bất thường EGFR/ALK tiến triển sau khi điều trị bằng liệu pháp nhắm mục tiêu đối với khối u bất thường tương ứng của họ).
- Ở những bệnh nhân đã điều trị trước đó, NSCLC tiến triển với điểm PD-1 lớn hơn 50%, điều trị tiếp theo bằng Pembrolizumab (10mg/kg) cho thấy thời gian sống sót trung bình là 17,3 tháng so với nhóm Docetaxel là 8,2 tháng (p<0,0001).
4.3 Ung thư biểu mô tế bào vảy ở đầu và cổ (HNSCC)
HNSCC di căn bậc một hoặc không thể cắt bỏ/tái phát kết hợp với FU và bạch kim.
- Ở những bệnh nhân trước đây không được điều trị ung thư đầu cổ di căn hoặc tái phát không thể chữa khỏi tại chỗ, điều trị bằng Pembrolizumab cộng với hóa trị liệu (Cisplatin hoặc carboplatin/5-FU) mang lại tỷ lệ sống sót trung bình là 13,0 tháng so với cetuximab cộng với hóa trị liệu (Cisplatin hoặc carboplatin/5- FU) là 10,7 tháng.
Sử dụng thuốc đơn đầu tiên trong HNSCC di căn hoặc không thể cắt bỏ/tái phát với biểu hiện PD-L1 của khối u lớn hơn 1%.
HNSCC tái phát hoặc di căn đơn lẻ với sự tiến triển sau hóa trị liệu dựa trên bạch kim
- Ở những bệnh nhân ung thư biểu mô tế bào vảy ở đầu và cổ đã được điều trị trước đó, một nghiên cứu đơn nhóm cho thấy điều trị bằng Pembrolizumab mang lại tỷ lệ đáp ứng khách quan là 18%; Tỷ lệ sống sót chung là 38% sau 12 tháng (sau thời gian theo dõi trung bình là 9 tháng).
4.4 Ung thư biểu mô tế bào thận (RCC)
RCC tiên tiến đầu tiên kết hợp với Axitinib
- Ở những bệnh nhân trước đây không được điều trị ung thư biểu mô tế bào thận tiến triển, điều trị bằng Pembrolizumab cộng với Axitinib mang lại tỷ lệ sống sót sau 12 tháng là 89,9% so với điều trị bằng sunitinib ở mức 78,3% (p<0,0001) thời gian theo dõi khoảng 12,8 tháng.
4.5 Ung thư hạch Hodgkin cổ điển (cHL)
Bệnh cHL chịu lửa cho bệnh nhân trẻ em và người lớn bị tái phát sau ba lần điều trị trở lên
- Ở những bệnh nhân mắc bệnh ung thư hạch Hodgkin cổ điển tái phát/kháng trị, liệu pháp đơn trị liệu bằng Pembrolizumab mang lại tỷ lệ đáp ứng khách quan là 69,9% và tỷ lệ đáp ứng hoàn toàn là 22,5% khi theo dõi trung bình 13 chu kỳ điều trị.
4.6 U lympho tế bào B lớn trung thất nguyên phát (PMBCL)
Ở những bệnh nhân bị u lympho tế bào B lớn trung thất nguyên phát tái phát/kháng trị, điều trị bằng Pembrolizumab mang lại tỷ lệ đáp ứng khách quan là 41% và tỷ lệ sống sót chung sau 12 tháng là 62% sau thời gian theo dõi trung bình là 6,6 tháng.
4.7 Ung thư biểu mô tiết niệu
Tiến triển cục bộ/di căn có khối u PD-L1 >10%
- Ở những bệnh nhân ung thư biểu mô tiết niệu tiến triển không đủ điều kiện dùng Cisplatin, điều trị bằng Pembrolizumab mang lại tỷ lệ đáp ứng khách quan là 29% và thời gian theo dõi trung bình là 7,8 tháng.
Ung thư biểu mô tiết niệu tiến triển cục bộ hoặc di căn không đủ điều kiện cho bất kỳ hóa trị liệu dựa trên bạch kim nào
4.8 Ung thư có độ không ổn định cao do vệ tinh vi mô (MSI-H)
Các khối u rắn MSI-H ở người lớn và trẻ em đã được điều trị trước đây không thể cắt bỏ hoặc di căn mà không còn phương pháp điều trị thay thế nào.
Ở những bệnh nhân bị ung thư đại trực tràng cao không ổn định qua kính hiển vi đã được điều trị trước đó, điều trị bằng Pembrolizumab mang lại tỷ lệ đáp ứng khách quan là 32%, PFS là 4,1 tháng và tỷ lệ sống sót chung sau 12 tháng là 76% sau thời gian theo dõi trung bình là 12,6 tháng.
4.9 Ung thư dạ dày
Ung thư đoạn nối dạ dày thực quản hoặc tại biểu mô tuyến dạ dày xuất hiện tại chỗ hoặc đang tiến triển di căn với biểu hiện PD-L1 của khối u lớn hơn 1% với bệnh tiến triển sau ít nhất hai đợt điều trị, bao gồm hóa trị liệu bằng bạch kim hoặc fluoropyrimidine (và liệu pháp nhắm mục tiêu HER2/neu, nếu thích hợp)
- Ở những bệnh nhân ung thư chỗ nối dạ dày và thực quản đã được điều trị trước đó, điều trị bằng Pembrolizumab mang lại tỷ lệ đáp ứng khách quan là 11,6% trong thời gian theo dõi trung bình là 5,8 tháng.
4.10 Ung thư cổ tử cung
Ung thư cổ tử cung di căn hoặc tái phát, sau hóa trị liệu, với biểu hiện khối u PD-L1 lớn hơn 1%.
- Ở những bệnh nhân trước đây đã được điều trị ung thư cổ tử cung tiến triển, điều trị bằng Pembrolizumab mang lại tỷ lệ đáp ứng khách quan là 12,2% trong thời gian theo dõi trung bình là 10,2 tháng.
4.11 Ung thư biểu mô tế bào gan (HCC)
Trước kia được dùng sorafenib.
- Người ung thư biểu mô tế bào gan đã được điều trị trước đó, điều trị bằng Pembrolizumab mang lại tỷ lệ đáp ứng khách quan là 18% tại thời điểm dừng dữ liệu vào tháng 2 năm 2018.
4.12 Ung thư tế bào Merkel (MCC)
MCC tái phát ở trẻ em và người lớn hoặc tiến triển cục bộ.
- Ở những bệnh nhân chưa từng điều trị toàn thân đối với ung thư biểu mô tế bào Merkel tiến triển, điều trị bằng Pembrolizumab mang lại tỷ lệ đáp ứng khách quan là 56% và tỷ lệ sống sót chung trong 24 tháng là 68,7% với thời gian theo dõi trung bình là 14,9 tháng.
4.13 Ung thư phổi tế bào nhỏ (SCLC)
Ở những bệnh nhân ung thư phổi tế bào nhỏ tiến triển đã được điều trị trước đó, điều trị bằng Pembrolizumab mang lại tỷ lệ đáp ứng khách quan là 18,7% và thời gian sống sót trung bình là 9,1 tháng.
5 Liều dùng - Cách dùng
5.1 Liều dùng
Chỉ định | Liều dùng |
Ung thư biểu mô nội mạc tử cung tiến triển | Dùng với Lenvatinib truyền tĩnh mạch: 200mg/cách 3 tuần/lần trong 30 phút |
biểu hiện PD-L1 trong ung thư biểu mô tuyến: Dạ dày tiến triển cục bộ Dạ dày di căn đoạn nối dạ dày thực quản tái phát cục bộ đoạn nối dạ dày thực quản di căn | Tiến triển trong, sau khi trước đó sử dụng 2 liệu pháp trở lên, dùng tiêm tĩnh mạch: 200mg/cách 3 tuần/lần hoặc 400mg/cách 6 tuần/lần trong 30 phút Tối đa 2 năm |
biểu hiện PD-L1 trong ung thư: cổ tử cung tái phát cổ tử cung di căn | Tiến triển trong/sau khi trị liệu: 200mg/cách 3 tuần/lần hoặc 400mg/cách 6 tuần/lần trong 30 phút Tối đa 2 năm |
Biểu hiện PD-L1 trong ung thư biểu mô tế bào vảy: tái phát không thể cắt bỏ ở đầu và cổ di căn ở đầu và cổ | 200mg/cách 3 tuần/lần hoặc 400mg/cách 6 tuần/lần trong 30 phút Có thể kết hợp với 5-fluorouracil và hóa trị liệu bằng bạch kim : 200mg/cách 3 tuần/lần trong 30 phút Tối đa 2 năm |
khối u ác tính di căn không thể cắt bỏ | 200mg/cách 3 tuần/lần hoặc 400mg/cách 6 tuần/lần trong 30 phút Ngoài ra, 2mg/kg mỗi 3 tuần
|
Hỗ trợ khối u ác tính | Người liên quan đến hạch bạch huyết được cắt bỏ hoàn toàn: 200mg/cách 3 tuần/lần hoặc 400mg/cách 6 tuần/lần trong 30 phút Tối đa 12 tháng |
Ung thư iểu mô phổi không tế bào nhỏ di căn: âm tính EGFR âm tính ALK âm tính | Kết hợp bạch kim và hóa trị liệu bằng pemetxed: 200mg/cách 3 tuần/lần trong 30 phút Ngoài ra, 400mg/cách 6 tuần/lần trong 30 phút |
Ung thư biểu mô tế bào vảy: tái phát ở đầu và cổ di căn ở đầu và cổ | Người đang hóa trị liệu chứa bạch kim hoặc đang tiến triển: 200mg/cách 3 tuần/lần hoặc 400mg/cách 6 tuần/lần trong 30 phút |
Ung thư biểu mô phổi không phải tế bào nhỏ di căn | 200mg/cách 3 tuần/lần tối đa 2 năm Ngoài ra, 400mg/cách 6 tuần/lần trong 30 phút |
Ung thư hạch Hodgkin cổ điển U lympho tế bào B lớn trung thất nguyên phát Khối u ác tính rắn cao không ổn định kính hiển vi không thể cắt bỏ Khối u ác tính rắn cao | Người lớn: 200mg/cách 3 tuần/lần hoặc 400mg/cách 6 tuần/lần trong 30 phút Tối đa 2 năm Trẻ em: 2mg/kg (tối đa 200mg) cách 3 tuần/lần trong 30 phút Tối đa 2 năm |
Ung thư biểu mô tiết niệu: TIến triển cục bộ Di căn
| 200mg/cách 3 tuần/lần hoặc 400mg/cách 6 tuần/lần trong 30 phút Tối đa 2 năm |
Biểu hiện PD-L1 trong ung thư biểu mô phổi không phải tế bào nhỏ di căn | 200mg/cách 3 tuần/lần hoặc 400mg/cách 6 tuần/lần trong 30 phút Người điều trị trước đó dùng 2mg/kg cách 3 tuần |
Biểu hiện PD-L1 trong ung thư biểu mô tế bào vảy: tiến triển cục bộ tái phát ở thực quản di căn thực quản | 200mg/cách 3 tuần/lần hoặc 400mg/cách 6 tuần/lần trong 30 phút Tối đa 2 năm |
Ung thư biểu mô tế bào thận tiến triển | 200mg/cách 3 tuần/lần hoặc 400mg/cách 6 tuần/lần trong 30 phút Tối đa 2 năm |
Biểu hiện PD-L1 trong ung thư biểu mô phổi không phải tế bào nhỏ tiến triển cục bộ | 200mg/cách 3 tuần/lần hoặc 400mg/cách 6 tuần/lần trong 30 phút Tối đa 2 năm Người điều trị trước đó dùng 2mg/kg cách 3 tuần |
Ung thư biểu mô tế bào vảy: ở da tái phát ở da di căn | 200mg/cách 3 tuần/lần hoặc 400mg/cách 6 tuần/lần trong 30 phút Tối đa 2 năm |
5.2 Cách dùng
Pembrolizumab dùng qua đường tĩnh mạch, pha Dung dịch tiêm bằng cách:
- Pha loãng với Glucose 5%/ NaCl 0,9% để dùng được dung dịch 1-10mg/ml.
- Đảo ngược lọ thuốc, không lắc để tan hết.
- Với bột đông khô thêm 2,3ml nước vô trùng để thu được dung dịch 25mg/ml. Dung xoay từ từ đến khi bong bóng tan hết, khoảng 5 phút.
- Sau đó lấy bơm tiêm rút thể tích dung dịch vừa đủ pha với Glucose 5%/ NaCl 0,9% để thu được 1-10mg/ml, đảo ngược để tan hết.
==>> Xem thêm về hoạt chất: Điều trị ung thư vú với Tamoxifen
6 Tác dụng không mong muốn
Các phản ứng bất lợi có ý nghĩa lâm sàng bao gồm:
- Phản ứng bất lợi trên da qua trung gian miễn dịch (viêm da tróc vảy, pemphigoid bọng nước, hội chứng Stevens-Johnson và hoại tử biểu bì độc hại)
- Bệnh nội tiết qua trung gian miễn dịch (rối loạn tuyến giáp, tiểu đường tuýp 1, viêm tuyến yên)
- Phản ứng liên quan đến truyền dịch (sốc phản vệ và quá mẫn).
- Viêm thận, rối loạn chức năng thận.
- Viêm gan, nhiễm độc gan.
- Viêm phổi qua trung gian miễn dịch.
- Viêm đại tràng.
Các phản ứng bất lợi qua trung gian miễn dịch khác (hội chứng Guillain-Barre, viêm màng bồ đào, nhược cơ, viêm tụy, sarcoidosis, viêm mạch, thiếu máu tán huyết, viêm khớp, viêm cơ và viêm não).
Các tác dụng phụ thường gặp xảy ra ở hơn 10% số người tham gia thử nghiệm lâm sàng bao gồm:
- Hệ thần kinh (đau đầu).
- Cơ xương khớp (đau lưng, đau khớp).
- Da (bạch biến, phát ban, ngứa).
- Chuyển hóa (chán ăn, giảm cân, hạ natri máu).
- Hô hấp (ho, khó thở).
- Toàn thân (mệt mỏi, sốt, suy nhược, bệnh giống cúm, phù ngoại biên.
- Tiêu hóa (tiêu chảy, táo bón, đau bụng, buồn nôn, nôn).
- Nội tiết (suy giáp, cường giáp).
- Nhiễm trùng (viêm phổi, nhiễm trùng đường tiết niệu, nhiễm trùng đường hô hấp trên).
- Tim (loạn nhịp tim).
- Máu/bạch huyết (thiếu máu).
- Gan mật (nhiễm độc gan, xét nghiệm chức năng gan tăng cao).
- Thận và tiết niệu (tiểu máu, tăng creatinin máu).
7 Tương tác thuốc
Pembrolizumab có thể thay đổi dược động học, hiệu quả khi dùng trước khi điều trị dùng:
- Thuốc ức chế miễn dịch.
- Corticosteroid toàn thân.
==>> Mời quý bạn đọc xem thêm: Raloxifen giảm nguy cơ ung thư vú xâm lấn
8 Thận trọng khi sử dụng Pembrolizumab
Theo dõi các dấu hiệu và triệu chứng của viêm đại tràng, viêm phổi, viêm tuyến yên và nghi ngờ có phản ứng da nghiêm trọng.
Theo dõi sự thay đổi chức năng thận như một dấu hiệu của viêm thận qua trung gian miễn dịch.
Theo dõi sự thay đổi chức năng gan như một dấu hiệu của viêm gan qua trung gian miễn dịch.
Theo dõi sự thay đổi chức năng tuyến giáp như một dấu hiệu của rối loạn tuyến giáp.
Theo dõi các phản ứng truyền dịch như ớn lạnh, sốt, đỏ bừng, hạ huyết áp, thiếu oxy máu, ngứa, phát ban, rét run và thở khò khè. Mặc dù các chất ức chế điểm kiểm tra có tỷ lệ phản ứng tiêm truyền thấp hơn so với các kháng thể đơn dòng khác, nhưng điều quan trọng là phải theo dõi.
Theo dõi tình trạng tăng đường huyết như một dấu hiệu của bệnh nhân tiểu đường loại 1.
Theo dõi sự thay đổi chức năng gan khi dùng kết hợp với Axitinib như một dấu hiệu của nhiễm độc gan. Trong một nghiên cứu, alanine aminotransferase và aspartate aminotransferase đã tăng hơn 25% ở số bệnh nhân được điều trị bằng Pembrolizumab cộng với Axitinib.
Pembrolizumab dùng thận trọng cho:
- Người rối loạn miễn dịch.
- Phụ nữ mang thai.
- Người đã được ghép tế bào gốc tạo máu đồng thời.
- Người tiền sử nhiễm trùng tái phát.
- Phụ nữ cho con bú.
- Người nhiễm trùng mạn tính.
- Trẻ em.
- Người tiềm ẩn phát triển nhiễm trùng.
- Người đa u tủy đang dùng Dexamethason hoặc chất tương tự Thalidomide.
9 Pembrolizumab giá bao nhiêu?
Pembrolizumab có nhiều hàm lượng với dạng bào chế, thể tích khác nhau đến từ nhiều thương hiệu nên không thể chỉ ra được mức giá cụ thể . Bạn có thể tìm hiểu kỹ hơn tại Trung Tâm Thuốc Central Pharmacy nhé.
10 Nghiên cứu Atezolizumab và Pembrolizumab trong ung thư vú bộ ba âm tính
Bối cảnh: Việc phê duyệt thuốc kháng PD-L1, bao gồm Atezolizumab/Pembrolizumab trong điều trị ung thư vú bộ ba âm tính (TNBC), phác đồ điều trị có khả năng cải thiện đối với TNBC.
Phương pháp: Chúng tôi đã tiến hành phân tích tổng hợp để xem xét hiệu quả của Atezolizumab/Pembrolizumab trong điều trị TNBC ở cả môi trường bổ trợ và tân bổ trợ. Chúng tôi đã tính toán sự khác biệt trung bình được tiêu chuẩn hóa (SMD) cho các mối liên quan giữa tỷ lệ sống sót không tiến triển (PFS) và tỷ lệ sống sót chung (OS) và tỷ lệ chênh lệch (OR) để ước tính tỷ lệ đáp ứng khách quan (ORR) và đáp ứng hoàn toàn bệnh lý (pCR), sử dụng 95% khoảng tin cậy (CI).
Kết quả: Sáu thử nghiệm lâm sàng bao gồm 3612 bệnh nhân đã được thu nhận. Đối với các liệu pháp bổ trợ, ORR (OR = 1,26, P = 0,04) của Atezolizumab/Pembrolizumab cộng với hóa trị liệu ở các nhánh có ý định điều trị (ITT) cao hơn so với các nhóm giả dược trong TNBC. Đã tìm thấy mức độ ảnh hưởng tích cực đối với PFS trong nhóm ITT (d = 1,55, P < 0,001). Nhóm Atezolizumab cộng với hóa trị liệu có mức độ tác động tích cực đối với hệ điều hành so với nhóm đối chứng (d = 0,52, P < 0,001). Trong bối cảnh tân bổ trợ, bệnh nhân trong nhóm ITT có tỷ lệ pCR cao hơn so với nhóm đối chứng (OR = 1,61, P = 0,001).
Kết luận: Chúng tôi đối chiếu bằng chứng về Atezolizumab/Pembrolizumab là phương pháp điều trị khả thi ở những bệnh nhân mắc TNBC với các phân nhóm PD-L1 mang lại lợi ích cao hơn.
11 Các dạng bào chế phổ biến của thuốc Pembrolizumab
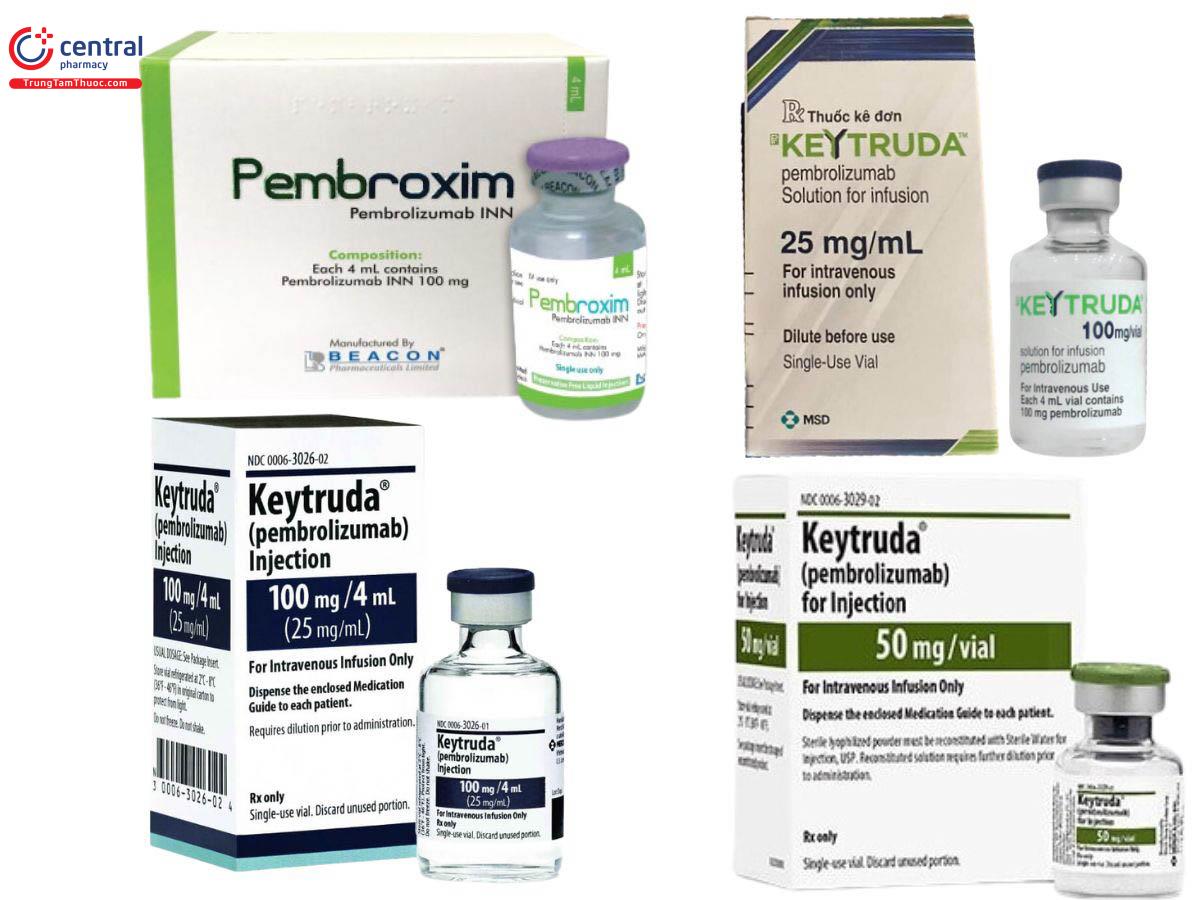
Pembrolizumab dùng tiêm truyền tĩnh mạch dưới dạng:
Bột đông khô 50mg và dung dịch 100mg/4ml. cả 2 dạng đều cần pha loãng với Glucose 5% hoặc NaCl 0,9% để pha được dung dịch tiêm truyền nồng độ 1-10mg/ml và tiêm truyền trong 30 phút với liều lượng chỉ định tùy vào từng trường hợp.
Thuốc biệt dược gốc là: Thuốc Keytruda Pembrolizumab.
Các thuốc khác chứa Pembrolizumab là: Pembroxim,…
12 Tài liệu tham khảo
- Tác giả Farah Latif, Hira Bint Abdul Jabbar, Hamna Malik, Humaira Sadaf, Azza Sarfraz, Zouina Sarfraz, Ivan Cherrez-Ojeda (Ngày đăng 24 tháng 1 năm 2022). Atezolizumab and pembrolizumab in triple-negative breast cancer: a meta-analysis, Pubmed. Truy cập ngày 25 tháng 8 năm 2023
- Tác giả James P. Flynn; Valerie Gerriets (Ngày đăng 26 tháng 6 năm 2023). Pembrolizumab, Pubmed. Truy cập ngày 25 tháng 8 năm 2023
- Chuyên gia của Mims. Pembrolizumab, Mims. Truy cập ngày 25 tháng 8 năm 2023