Liraglutide
2 sản phẩm
 Dược sĩ Nguyễn Trang Dược sĩ lâm sàng - Đại học Dược Hà Nội
Dược sĩ Nguyễn Trang Dược sĩ lâm sàng - Đại học Dược Hà Nội
Ước tính: 7 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
Bài viết biên soạn dựa theo
Dược thư quốc gia Việt Nam, lần xuất bản thứ ba
Đây là phiên bản mới nhất của Dược thư Việt Nam do Bộ Y tế ban hành Quyết định số 3445/QĐ-BYT ngày 23 tháng 12 năm 2022
Trang 1033-1038, tải PDF tại đây
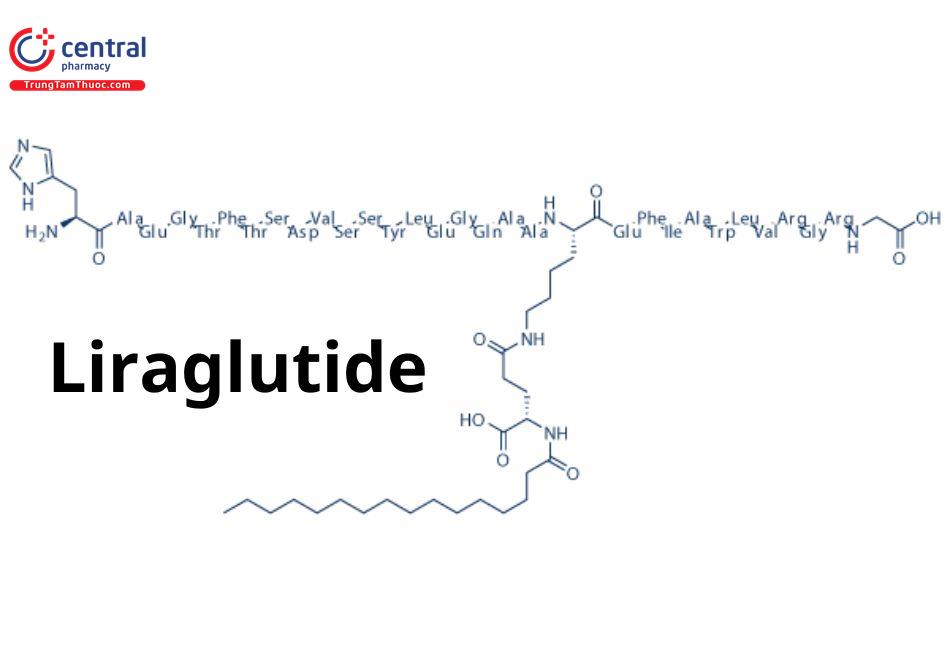
LIRAGLUTID
Tên chung quốc tế: Liraglutide.
Mã ATC: A10BJ02.
Loại thuốc: Thuốc điều trị đái tháo đường, chất tương tự glucagon- like peptid-1 (GLP-1).
1 Dạng thuốc và hàm lượng
Bút tiêm nạp sẵn thuốc: 18 mg/3 ml (mỗi ml Dung dịch có chứa 6 mg liraglutid sản xuất bằng kỹ thuật tái tổ hợp DNA trong tế bào Saccharomyces cerevisiae).
2 Dược lực học
Liraglutid là một chất tương tự GLP-1 có trình tự chuỗi tương đồng 97% với GLP-1 của người. Thuốc gắn kết và hoạt hóa receptor GLP-1. Các receptor GLP-1 là đích đối với GLP-1 tự nhiên, một loại hormon incretin nội sinh có tác dụng làm tăng tiết Insulin phụ thuộc vào Glucose từ các tế bào beta của tuyến tụy. Không giống như GLP-1 tự nhiên, liraglutid có đặc điểm dược động học và dược lực học ở người thích hợp để dùng 1 lần/ngày. Sau khi tiêm dưới da, đặc tính tác dụng kéo dài của liraglutid dựa trên ba cơ chế: tự kết hợp, dẫn đến sự hấp thu chậm; liên kết với albumin; và tính ổn định với enzym cao hơn đối với các enzym dipeptidyl peptidase-4 (DPP-4) và endopeptidase (NEP) trung tính, dẫn đến nửa đời thải trừ trong huyết tương dài.
Hoạt động của liraglutid được thực hiện thông qua tương tác đặc hiệu với các receptor GLP-1, dẫn đến sự gia tăng Adenosin monophosphat vòng (cAMP). Liraglutid kích thích bài tiết insulin phụ thuộc vào glucose. Đồng thời, liraglutid làm giảm bài tiết glucagon cao không thích hợp, cũng theo cách phụ thuộc vào glucose. Do đó, khi glucose trong máu cao sẽ kích thích bài tiết insulin và ức chế bài tiết glucagon. Ngược lại, khi đường huyết hạ, liraglutid làm giảm bài tiết insulin và không làm giảm bài tiết glucagon. Cơ chế hạ đường huyết cũng liên quan đến tác dụng làm chậm rỗng dạ dày.
Liraglutid làm giảm đường huyết lúc đói và sau ăn. Tác dụng hạ đường huyết rõ ràng hơn ở bệnh nhân tiền đái tháo đường và đái tháo đường so với bệnh nhân có nồng độ glucose huyết bình thường. Các thử nghiệm lâm sàng cho thấy liraglutid cải thiện và duy trì chức năng tế bào beta, theo HOMA-B và tỷ lệ proinsulin/insulin. GLP-1 là một chất điều hòa sinh lý của sự thèm ăn và lượng thức ăn đưa vào cơ thể, nhưng cơ chế hoạt động chính xác chưa hoàn toàn rõ ràng. Liraglutid làm giảm trọng lượng và lượng mỡ trong cơ thể (giảm mỡ nội tạng nhiều hơn mỡ dưới da) thông qua các cơ chế làm giảm cảm giác đói và giảm năng lượng nạp vào. Trong các nghiên cứu trên động vật, việc sử dụng liraglutid ở ngoại vi dẫn đến sự hấp thu vào các vùng não cụ thể liên quan đến việc điều chỉnh sự thèm ăn, tại đó liraglutid thông qua hoạt hóa các receptor GLP-1 làm tăng cảm giác no và giảm tín hiệu đói, do đó dẫn đến làm giảm trọng lượng cơ thể. Liraglutid không làm tăng tiêu hao năng lượng so với placebo.
Các receptor GLP-1 cũng được biểu hiện ở tim, hệ thống mạch máu, hệ thống miễn dịch và thận. Trên các mô hình chuột nhất bị xơ vữa động mạch, liraglutid đã ngăn chặn sự tiến triển của mảng xơ vữa động mạch và giảm viêm trong mảng xơ vữa. Ngoài ra, liraglutid còn thể hiện tác dụng có lợi trên lipid huyết tương. Liraglutid không làm giảm kích thước các mảng xơ vữa đã hình thành.
3 Dược động học
3.1 Hấp thu
Sau khi tiêm dưới da, liraglutid hấp thu chậm, đạt nồng độ tối đa sau khi dùng thuốc 8 - 12 giờ. Nồng độ liraglutid tối đa ước tính là 9,4 nanomol/lít (trọng lượng cơ thể trung bình xấp xỉ 73 kg) đối với một liều đơn liraglutid 0,6 mg tiêm dưới da. Với 1,8 mg liraglutid, nồng độ trung bình của liraglutid ở trạng thái ổn định (AUCT/24) đạt được khoảng 34 nanomol/lít (trọng lượng cơ thể trung bình khoảng 76 kg). Phơi nhiễm với liraglutid giảm khi trọng lượng cơ thể tăng. Mức tiếp xúc với liraglutid tăng tỷ lệ thuận với liều dùng. Hệ số biến thiên trên cùng một đối tượng đối với AUC của liraglutid là 11% sau khi dùng liều đơn.
Sinh khả dụng tuyệt đối của liraglutid sau khi tiêm dưới da là khoảng 55%.
3.2 Phân bố
Thể tích phân bố biểu kiến sau khi tiêm dưới da là 11 - 17 lít. Thể tích phân bố trung binh sau khi tiêm tĩnh mạch liraglutid là 0,07 lít/kg. Liraglutid liên kết nhiều với protein huyết tương (>98%).
3.3 Chuyển hóa
Trong 24 giờ sau khi dùng một liều đơn liraglutid có đánh dấu phóng xạ ([3H] -liraglutid) trên người khỏe mạnh, thành phần chính trong huyết tương là liraglutid nguyên vẹn. Lượng nhỏ trong huyết tương của hai chất chuyển hóa được phát hiện (~ 9% và ≤ 5% mức tiếp xúc toàn phần của phóng xạ trong huyết tương). Liraglutid được chuyển hóa theo cách tương tự như các protein phân tử lớn mà chưa xác định được cụ thể cơ quan nào thanh thải chính thuốc.
3.4 Thải trừ
Sau một liều [3H]-liraglutid, liraglutid nguyên vẹn không được phát hiện trong nước tiểu hoặc phân. Chỉ một phần nhỏ phóng xạ đã sử dụng được đảo thái dưới dạng chất chuyển hóa liên quan đến liraglutid trong nước tiểu hoặc phân (lần lượt là 6% và 5%). Phóng xạ trong nước tiểu và phân chủ yếu được bài tiết trong 6 - 8 ngày đầu và thuộc về ba chất chuyển hóa nhỏ tương ứng.
3.5 Đối tượng đặc biệt
Độ thanh thải trung bình sau khi tiêm dưới da một liều đơn Iiraglutid là khoảng 1,2 lít/giờ với nửa đời thải trừ khoảng 13 giờ.
Người cao tuổi: Tuổi tác không có ảnh hưởng có ý nghĩa lâm sàng đối với dược động học của liraplutid dựa trên kết quả từ một nghiên cứu dược động học ở những người khỏe mạnh và phân tích dữ liệu được động học quần thể của bệnh nhân (18 đến 82 tuổi).
Giới: Giới tính không có ảnh hưởng có ý nghĩa lâm sàng đến được động học của liraglutid dựa trên kết quả phân tích dữ liệu được động học quần thể của bệnh nhân nam và nữ và một nghiên cứu dược động học ở những người khỏe mạnh.
Chủng tộc: Chủng tộc không có ảnh hưởng có ý nghĩa lâm sàng đến được động học của liraglutid dựa trên kết quả phân tích dược động học quần thể bao gồm bệnh nhân thuộc các nhóm Da trắng, Da đen, Châu Á và Tây Ban Nha.
Béo phì: Phân tích dược động học quần thể cho thấy chỉ số khối cơ thể (BMI) không có ảnh hưởng đáng kể đến dược động học của liraglutid.
Suy gan. Dược động học của liraglutid được đánh giá ở những bệnh nhân có mức độ suy gan khác nhau trong một thử nghiệm dùng liều đơn. Mức tiếp xúc với liraglutid giảm 13 - 23% ở bệnh nhân suy gan nhẹ đến trung bình so với người khỏe mạnh. Mức tiếp xúc thấp hơn đáng kể (44%) ở bệnh nhân suy gan nặng (điểm Child Pugh>9).
Suy thận: Mức tiếp xúc với liraglutid giảm ở bệnh nhân suy thận so với những người có chức năng thận bình thường. Phơi nhiễm với liraglutid giảm lần lượt là 33%, 14%, 27% và 26% ở những bệnh nhân suy thận nhẹ (Độ thanh thải creatinin, Clcr 50 - 80 ml/phút), trung bình (Clcr 30 - 50 ml/phút) và nặng (Clcr < 30 ml/phút) và bệnh thận giai đoạn cuối cần lọc máu.
Tương tự, trong một thử nghiệm lâm sàng kéo dài 26 tuần, bệnh nhân đái tháo đường typ 2 và suy thận trung bình (Clcr 30 - 59 ml/ phút) có mức phơi nhiễm liraglutid thấp hơn 26% khi so sánh với một thử nghiệm riêng biệt bao gồm bệnh nhân đái tháo đường typ 2 với chức năng thận bình thường hoặc suy thận nhẹ.
Trẻ em: Các đặc tính dược động học đã được đánh giá trong các nghiên cứu lâm sàng ở trẻ em bị đái tháo đường typ 2 từ 10 tuổi trở lên. Mức độ phơi nhiễm liraglutid ở thanh thiếu niên và trẻ em tương đương với mức độ được quan sát thấy ở người lớn.
4 Chỉ định
Kiểm soát đường huyết: Liraglutid được chỉ định nhằm kiểm soát đường huyết ở người lớn (> 18 tuổi), thanh thiếu niên và trẻ em trên 10 tuổi bị đái tháo đường typ 2 không kiểm soát tốt đường huyết bằng chế độ ăn kiêng và luyện tập:
Đơn trị liệu cho những bệnh nhân không thích hợp sử dụng Metformin do không dung nạp hoặc chống chỉ định.
Trị liệu phối hợp với các thuốc làm giảm đường huyết khác kể cả insulin.
Dự phỏng biến cố tim mạch: Liraglutid được chỉ định nhằm làm giảm nguy cơ tim mạch chính (tử vong do tim mạch, nhồi máu cơ tim không gây tử vong hoặc đột quỵ không gây tử vong) ở người lớn bị đái tháo đường typ 2 và có bệnh lý tim mạch đã được xác định. Kiểm soát cân nặng: Liraglutid được chỉ định như một liệu pháp hỗ trợ cho chế độ ăn giảm calo và tăng hoạt động thể chất để kiểm soát cân nặng:
Đối với người lớn có chỉ số khối cơ thể (BMI) ban đầu > 30 kg/m2 (béo phì), hoặc ≥ 27 kg/m2 đến < 30 kg/m2 (thừa cân) khi có ít nhất một bệnh kèm theo liên quan đến cân nặng như rối loạn đường huyết (tiền đái tháo đường hoặc đái tháo đường typ 2), tăng huyết áp, rối loạn lipid máu hoặc ngưng thở khi ngủ;
Đối với trẻ em ≥ 12 tuổi có khối lượng cơ thể > 60 kg và BMI ban đầu tương ứng với giá trị 30 kg/m2 hoặc lớn hơn ở người lớn (béo phì) theo tiêu chỉ Cole.
| Tuổi (năm) | BM1 tương ứng với giá trị 30 kg/m2 ở người lớn (béo phì) theo tiêu chí Cole | |
|---|---|---|
| Nam | Nữ | |
| 12 | 26.02 | 26,67 |
| 12.5 | 26,43 | 27,24 |
| 13 | 26,84 | 27,76 |
| 13,5 | 27,25 | 28,20 |
| 14 | 27,63 | 28.57 |
| 14.5 | 27,98 | 28,87 |
| 15 | 28,30 | 29,11 |
| 15,5 | 28,60 | 29,29 |
| 16 | 28,88 | 29,43 |
| 16,5 | 29,14 | 29,56 |
| 17 | 29,41 | 29,69 |
| 17,5 | 29,70 | 29,84 |
| 18 | 30,00 | 30,00 |
5 Chống chỉ định
Quá mẫn với liraglutid.
Tiền sử bản thân hoặc gia đình bị ung thư biểu mô tuyến giáp thể tủy (medullary thyroid carcinoma, MTC) hoặc hội chứng đa u tuyến nội tiết typ 2 (Multiple Endocrine Neoplasia syndrome typ 2, MEN 2).
Kiểm soát cân nặng ở phụ nữ mang thai.

6 Thận trọng
Liraglutid không được dùng cho bệnh nhân đái tháo đường typ 1 hoặc để điều trị nhiễm toan ceton do đái tháo đường.
Liraglutid không thể thay thế cho insulin. Nhiễm toan ceton do đái tháo đường đã được báo cáo ở những bệnh nhân phụ thuộc insulin sau khi ngừng nhanh hoặc giảm liều insulin.
Không có kinh nghiệm điều trị ở bệnh nhân suy tim sung huyết NYHA IV. Liraglutid không được khuyến cáo sử dụng cho những bệnh nhân này.
Tính an toàn và hiệu quả của liraglutid để kiểm soát cân nặng chưa được xác định ở những bệnh nhân sau: bệnh nhân ≥ 75 tuổi; đang dùng các thuốc khác để kiểm soát cân nặng; bị béo phì thứ phát do nội tiết hoặc rối loạn ăn uống hoặc điều trị bằng các thuốc có thể gây tăng cân; suy gan/thận nặng. Không khuyến cáo sử dụng liraglutid cho những bệnh nhân này.
Sử dụng liraglutid để kiểm soát cân nặng chưa được nghiên cứu ở những bệnh nhân suy gan nhẹ hoặc trung bình. Nên thận trọng khi sử dụng cho những bệnh nhân này.
Có ít kinh nghiệm ở những bệnh nhân bị bệnh viêm ruột và bệnh liệt dạ dày do đái tháo đường. Không khuyến cáo sử dụng liraglutid ở những bệnh nhân này do có liên quan đến các phản ứng có hại thoáng qua trên đường tiêu hóa, bao gồm buồn nôn, nôn và tiêu chảy.
Viêm tụy cấp: Dựa trên các báo cáo tự phát sau khi đưa thuốc ra thị trường, viêm tụy cấp, bao gồm viêm tụy cấp xuất huyết hoặc hoại tử gây tử vong và không tử vong, đã được quan sát thấy ở những bệnh nhân được điều trị bằng liraglutid. Sau khi bắt đầu dùng liraglutid, cần theo dõi bệnh nhân để tìm các dấu hiệu và triệu chứng của viêm tụy (bao gồm đau bụng dữ dội dai dẳng, đôi khi lan ra sau lưng và có thể kèm theo hoặc không kèm theo nôn). Nên ngừng dùng liraglutid nếu nghi ngờ viêm tụy; không nên dùng lại liraglutid nếu chẩn đoán xác định viêm tụy cấp. Liraglutid đã được nghiên cứu trên một số ít bệnh nhân có tiền sử viêm tụy. Không rõ bệnh nhân có tiền sử viêm tụy có nguy cơ cao bị viêm tụy khi điều trị bằng liraglutid hay không.
Bệnh tuyến giáp: Các ADR về tuyến giáp, ví dụ như bướu giáp, đã được báo cáo trong các thử nghiệm lâm sàng và đặc biệt ở những bệnh nhân có bệnh tuyến giáp từ trước. Do đó, nên thận trọng khi sử dụng liraglutid cho những bệnh nhân này.
Nguy cơ khối u tế bào C tuyến giáp: Khi thử nghiệm trên chuột cống và chuột nhắt ở cả hai giống đực và cái, liraglutid gây ra các khối u tế bào C tuyến giáp (u tuyến và/hoặc ung thư biểu mô) phụ thuộc vào liều dùng và thời gian dùng. Ung thư tế bào C tuyến giáp ác tính được phát hiện ở chuột cống và chuột nhất. Không rõ liệu liraglutid có gây ra các khối u tế bào C tuyến giáp, bao gồm cả ung thư biểu mô tuyến giáp thể tủy (MTC), ở người hay không, vì chưa xác định được mối liên quan về khối u tế bào C tuyến giáp gây ra bởi liraglutid trên loài động vật gặm nhấm và trên người.
Các trường hợp MTC ở bệnh nhân được điều trị bằng liraglutid đã được báo cáo trong giai đoạn sau khi đưa thuốc ra thị trường; dữ liệu trong các báo cáo này không đủ để thiết lập hoặc loại trừ mối quan hệ nhân quả giữa việc sử dụng liraglutid và MTC ở người.
Chống chỉ định sử dụng liraglutid ở những bệnh nhân có tiền sử bản thân hoặc gia đình bị ung thư biểu mô tuyến giáp thể tủy hoặc hội chứng đa u tuyến nội tiết typ 2. Tư vấn cho bệnh nhân về nguy cơ ung thư biểu mô tuyến giáp thể tủy khi sử dụng liraglutid và thông báo cho họ biết về các triệu chứng của khối u tuyến giáp (ví dụ, thấy bướu ở cổ, khó nuốt, khó thở, khàn tiếng dai dẳng). Định lượng thường xuyên nồng độ Calcitonin huyết thanh hay siêu âm tuyến giáp có giá trị không chắc chắn để phát hiện sớm MTC ở bệnh nhân được điều trị bằng liraglutid. Do độ đặc hiệu của xét nghiệm calcitonin huyết thanh thấp và tỷ lệ mắc bệnh tuyến giáp cao nên không cần thiết thực hiện việc theo dõi này. Tăng đáng kể calcitonin huyết thanh có thể chỉ ra MTC và bệnh nhân MTC thường có giá trị calcitonin >50 nanogam/lít. Nếu lượng calcitonin huyết thanh được đo và thấy tăng, bệnh nhân nên được đánh giá thêm. Những bệnh nhân có nhân giáp được phát hiện khi khám lâm sàng hoặc trên các xét nghiệm hình ảnh cũng nên được kiểm tra thêm.
Hạ đường huyết: Bệnh nhân dùng liraglutid phối hợp với thuốc kích thích tiết insulin (ví dụ, sulfonylurê) hoặc insulin có thể tăng nguy cơ hạ đường huyết. Đối với trẻ em ≥ 10 tuổi, nguy cơ hạ đường huyết cao hơn khi dùng liraglutid bất kể sử dụng phối hợp với insulin và/hoặc metformin. Có thể giảm nguy cơ hạ đường huyết bằng cách giảm liều sulfonylurea (hoặc các thuốc khác làm tăng tiết insulin) hoặc insulin.
Mất nước: Các dấu hiệu và triệu chứng của mất nước, bao gồm suy giảm chức năng thận và suy thận cấp, đã được báo cáo ở những bệnh nhân được điều trị bằng liraglutid. Một số biến cố xảy ra ở những bệnh nhân bị suy thận từ trước và/hoặc đang dùng thuốc có ảnh hưởng đến chức năng thận. Chức năng thận được cải thiện với điều trị triệu chứng ở hầu hết bệnh nhân, tuy nhiên một số bệnh nhân vẫn cần phải chạy thận nhân tạo. Bệnh nhân được điều trị bằng liraglutid nên được thông báo về nguy cơ mất nước có thể xảy ra liên quan đến các tác dụng phụ trên Đường tiêu hóa và có biện pháp phòng ngừa để tránh mất dịch.
Không dùng chung bút tiêm giữa các bệnh nhân: Bút tiêm liraglutid không được dùng chung giữa các bệnh nhân, ngay cả khi dùng kim riêng. Việc dùng chung có thể dẫn tới nguy cơ lây nhiễm các bệnh qua đường máu.
Phản ứng quá mẫn: Đã có báo cáo sau khi đưa thuốc ra thị trường về các phản ứng quá mẫn nghiêm trọng (ví dụ, phản ứng phản vệ và phù mạch) ở bệnh nhân được điều trị bằng liraglutid. Nếu phản ứng quá mẫn xảy ra, cần ngừng sử dụng liraglutid, có các biện pháp điều trị kịp thời và theo dõi cho đến khi các dấu hiệu và triệu chứng biến mất. Không sử dụng cho những bệnh nhân trước đây đã có phản ứng quá mẫn với liraglutid.
Sốc phản vệ và phù mạch đã được báo cáo với các chất chủ vận receptor GLP-1 khác. Thận trọng khi sử dụng cho bệnh nhân có tiền sử sốc phản vệ hoặc phù mạch với một chất chủ vận receptor GLP-1 khác vì không rõ liệu bệnh nhân này có bị các phản ứng khi dùng linaglotid hay không.
Bệnh túi mật cấp tính: Trong các thử nghiệm lâm sàng về kiểm soát cân nặng, tỷ lệ bệnh nhân dùng liraglutid bị sỏi đường mật và viêm túi mật cao hơn so với bệnh nhân dùng placebo. Giảm cân đáng kể hoặc nhanh chóng có thể làm tăng nguy cơ mắc bệnh túi mật cấp tính; tuy nhiên, tỷ lệ mắc bệnh vẫn cao hơn ở những bệnh nhân được điều trị bằng liraglutid so với nhóm Placebo ngay cả khi đã tính đến mức độ giảm cân. Sỏi mật và viêm túi mật có thể dẫn đến nhập viện và phẫu thuật cắt túi mật. Bệnh nhân nên được thông báo về các triệu chứng đặc trưng của sỏi mật và viêm túi mật.
Tăng nhịp tim: Đã quan sát thấy sự gia tăng nhịp tim khi dùng liraglutid trong các thử nghiệm lâm sàng. Nhịp tim nên được theo dõi định kỳ phù hợp với thực hành lâm sàng thông thường. Bệnh nhân nên được thông báo về các triệu chứng tăng nhịp tim (đánh trống ngực hoặc cảm giác tim đập nhanh khi nghỉ ngơi). Đối với những bệnh nhân gặp phải tình trạng tăng nhịp tim lúc nghỉ liên tục trên lâm sàng, nên ngừng điều trị bằng liraglutid.
Hành vi và ý định tự tử: Trong các thử nghiệm lâm sàng về liraglutid trên người lớn, 0,3% bệnh nhân điều trị bằng liraglutid và 0,1% bệnh nhân dùng placebo có ý định tự tử; một trong số những bệnh nhân được điều trị liraglutid đã cố gắng tự tử.
Bệnh nhân được điều trị bằng liraglutid nên được theo dõi về sự xuất hiện hoặc tình trạng xấu đi của bệnh trầm cảm, suy nghĩ hoặc hành vi tự sát, và/hoặc bất kỳ thay đổi bất thường nào về tâm trạng hoặc hành vi. Ngừng liraglutid ở những bệnh nhân có suy nghĩ hoặc hành vi tự sát. Tránh dùng liraglutid ở những bệnh nhân có tiền sử muốn thực hiện hành vi tự tử.
7 Thời kỳ mang thai
Chưa có đủ dữ liệu về việc sử dụng liraglutid ở phụ nữ mang thai. Các nghiên cứu trên động vật đã cho thấy độc tính sinh sản. Chưa rõ nguy cơ có thể đối với con người.
Liraglutid không nên được sử dụng trong khi mang thai. Nếu bệnh nhân muốn có thai hoặc phát hiện có thai, nên ngừng điều trị bằng liraglutid.
Chống chỉ định dùng liraglutid để kiểm soát cân nặng trong thời kỳ mang thai vì giảm cân không mang lại lợi ích cho phụ nữ mang thai và có thể gây hại cho thai nhi,
8 Thời kỳ cho con bú
Chưa rõ liệu liraglutid có bài tiết vào sữa mẹ hay không. Các nghiên cứu trên động vật cho thấy mức độ phân bố thấp của liraglutid và các chất chuyển hóa có quan hệ gần về cấu trúc vào sữa. Các nghiên cứu tiền lâm sàng cho thấy sự giảm tăng trưởng ở chuột cống con còn bú mẹ liên quan đến điều trị. Do còn thiếu kinh nghiệm, không nên dùng liraglutid trong thời kỳ cho con bú.
9 Tác dụng không mong muốn (ADR)
ADR được báo cáo thường xuyên nhất trong các thử nghiệm lâm sàng là rối loạn tiêu hóa: rất thường gặp buồn nôn và tiêu chảy; trong khi đó nôn, táo bón, đau bụng và khó tiêu là thường gặp, ADR trên đường tiêu hóa này có thể xảy ra thường xuyên hơn khi bắt đầu điều trị. Những phản ứng này thường giảm bớt trong vài ngày hoặc vài tuần điều trị tiếp theo. Đau đầu và viêm mũi họng cũng thường gặp. Hạ đường huyết cũng là ADR thường gặp, đặc biệt có thể gặp hạ đường huyết nghiêm trọng khi sử dụng đồng thời liraglutid và sulfonylurê.
9.1 Rất thường gặp
Tiêu hóa: buồn nôn, tiêu chảy,
9.2 Thường gặp
Nhiễm trùng: viêm mũi họng, viêm phế quản.
Chuyển hóa và dinh dưỡng: hạ đường huyết, chán ăn.
Thần kinh: đau đầu, chóng mặt.
Tim mạch: tăng nhịp tim.
Tiêu hóa: nôn, khó tiêu, đau bụng, táo bón, viêm dạ dày, đầy hơi, chướng bụng, trào ngược dạ dày - thực quản, đau răng,
Da và mô dưới da: phát ban.
Khác: mệt mỏi, phản ứng tại vị trí tiêm, tăng lipase, tăng Amylase.
9.3 Ít gặp
Chuyển hóa và dinh dưỡng; mất nước.
Tiêu hóa: chậm rỗng dạ dày.
Gan mật: sỏi mật, viêm túi mật.
Da và mô dưới da: mày đay, ngứa.
Tiết niệu: suy giảm chức năng thận, suy thận cấp.
9.4 Hiếm gặp
Miễn dịch: phản ứng phản vệ.
Tiêu hóa: tắc ruột.
9.5 Rất hiếm gặp
Tiêu hóa: viêm tụy (bao gồm viêm tụy hoại tử).
10 Hướng dẫn cách xử trí ADR
Không sử dụng cho những bệnh nhân trước đây đã có phản ứng quá mẫn với liraglutid. Thận trọng khi sử dụng cho bệnh nhân có tiền sử sốc phản vệ hoặc phù mạch với một chất chủ vận receptor GLP-1 khác.
Để cải thiện khả năng dung nạp dạ dày - ruột, cần tăng liều liraglutid từ từ với khoảng cách tăng liều tối thiểu là 1 tuần.
Sau khi bắt đầu dùng liraglutid, cần theo dõi bệnh nhân để tìm các dấu hiệu và triệu chứng của viêm tụy (bao gồm đau bụng dữ dội dai dẳng, đôi khi lan ra sau lưng và có thể kèm theo hoặc không kèm theo nôn). Nên ngừng dùng liraglutid nếu nghi ngờ viêm tụy, không nên dùng lại liraglutid nếu chẩn đoán xác định viêm tụy cấp. Không rõ bệnh nhân có tiền sử viêm tụy có nguy cơ cao bị viêm tụy khi điều trị bằng liraglutid hay không.
Tư vấn cho bệnh nhân về các triệu chứng của bệnh tuyến giáp (ví dụ như bướu cổ, khó nuốt, khó thở, khàn tiếng dai dẳng), thận trọng khi sử dụng liraglutid cho những bệnh nhân có bệnh lý tuyến giáp từ trước.
Theo dõi các dấu hiệu và triệu chứng của mất nước, đặc biệt trên những bệnh nhân bị suy thận từ trước và/hoặc đang dùng thuốc có ảnh hưởng đến chức năng thận.
Bệnh nhân nên được theo dõi nhịp tim định kỳ để phát hiện các triệu chứng tăng nhịp tim (đánh trống ngực hoặc cảm giác tim đập nhanh khi nghỉ ngơi). Đối với những bệnh nhân gặp phải tình trạng nhịp tim lúc nghỉ tăng liên tục trên lâm sàng, nên ngừng điều trị bằng liraglutid.
Xem xét giảm liều của insulin hoặc sulfonylurê khi kết hợp cùng liraglutid để tránh nguy cơ hạ đường huyết.
Sỏi mật và viêm túi mật có thể dẫn đến nhập viện và phẫu thuật cắt túi mật. Bệnh nhân nên được thông báo về các triệu chứng đặc trưng của sỏi mật và viêm túi mật.
11 Liều lượng và cách dùng
11.1 Cách dùng
Bút tiêm liraglutid chỉ dùng tiêm dưới da, không được tiêm tĩnh mạch hoặc tiêm bắp.
Liraglutid được dùng 1 lần/ngày bất kỳ thời điểm nào, không phụ thuộc vào bữa ăn và có thể được tiêm dưới da ở bụng, đùi hoặc phần trên cánh tay. Có thể thay đổi vị trí tiêm và thời gian tiêm mà không cần điều chỉnh liều lượng. Tuy nhiên, nên tiêm liraglutid vào cùng một thời điểm trong ngày, khi đã chọn được thời điểm thuận tiện nhất trong ngày.
Nếu quên một liều trong vòng 12 giờ kể từ thời điểm dùng thuốc trước đó, bệnh nhân nên dùng liều đã quên càng sớm càng tốt. Nếu thời gian đến liều tiếp theo < 12 giờ, bệnh nhân không nên dùng liều đã quên và tiếp tục với liều kế tiếp. Không nên dùng thêm hoặc tăng liều để bù cho liều đã quên.
11.2 Liều lượng
11.2.1 Kiểm soát đường huyết và dự phòng biến cố tim mạch
Để cải thiện khả năng dung nạp dạ dày - ruột, liều khởi đầu là 0,6 mg/ngày. Sau ít nhất một tuần, nên tăng liễu lên 1,2 mg. Dựa trên đáp ứng lâm sàng và khả năng dung nạp, có thể tăng liều lên 1,8 mg để đạt được hiệu quả tối đa sau ít nhất một tuần dùng liều 1,2 mg. Không khuyến cáo dùng liều hàng ngày cao hơn 1,8 mg. Khi liraglutid được bổ sung thêm vào trị liệu bằng sulfonylurê hoặc insulin, nên giảm liều sulfonylurea hoặc insulin để giảm nguy cơ hạ đường huyết.
Không cần tự theo dõi đường huyết để điều chỉnh liều liraglutid. Tuy nhiên, khi khởi đầu điều trị bằng liraglutid với một loại sulfonylurê hoặc insulin, việc tự theo dõi đường huyết là cần thiết để điều chỉnh liều sulfonylurê và insulin, đặc biệt khi bắt đầu điều trị bằng liraglutid đồng thời với giảm liều insulin. Nên thực hiện giảm liều insulin từng bước.
11.2.2 Kiểm soát cân nặng
Liều khởi đầu là 0,6 mg × 1 lần/ngày. Liều được tăng lên 3,0 mg x 1 lần/ngày với mức tăng 0,6 mg sau ít nhất mỗi tuần để cải thiện khả năng dung nạp dạ dày - ruột. Liều hàng ngày cao hơn 3,0 mg không được khuyến cáo.
Khi ngừng dùng liraglutid > 3 ngày, bắt đầu dùng lại liraglutid với liều 0,6 mg mỗi ngày và tuân theo lịch trình tăng liều thông thường để giảm sự xuất hiện của các phản ứng có hại trên đường tiêu hóa liên quan đến việc bắt đầu điều trị trở lại.
| Thời gian | Liều dùng |
| Tuần 1 | 0,6 mg |
| Tuần 2 | 1,2 mg |
| Tuần 3 | 1,8 mg |
| Tuần 4 | 2,4 mg |
| Tuần 5 trở đi | 3,0 mg |
Người lớn: Liều duy trì khuyến cáo là 3 mg/ngày, liều thấp hơn chỉ để điều chỉnh liều. Ngừng liraglutid nếu bệnh nhân không dung nạp được liều 3 mg. Trong quá trình tăng liều, nếu bệnh nhân không dung nạp được mức liều tăng, cân nhắc trì hoãn tăng liều thêm khoảng một tuần nữa. Nếu mức liều tăng không được dung nạp trong hai tuần liên tiếp, nên cân nhắc dùng điều trị.
Điều trị với liraglutid nên ngừng sau 12 tuần với liều 3,0 mg/ngày nếu bệnh nhân chưa giảm được ít nhất 5% trọng lượng cơ thể ban đầu, vì không chắc chắn bệnh nhân sẽ đạt được và duy trì giảm cân có ý nghĩa lâm sàng khi tiếp tục điều trị.
Trẻ em: Liều duy trì được khuyến cáo là 3 mg/ngày. Nếu không dung nạp với liều 3 mg/ngày có thể giảm liều duy trì xuống 2,4 mg ngày. Ngừng liraglutid nếu bệnh nhân không dung nạp được liều 2,4 mg. Trong quá trình tăng liều, nếu bệnh nhân không dung nạp được mức liều tăng, có thể dùng lại mức liều trước đó. Thời gian tăng liều ở bệnh nhân trẻ em có thể kéo dài đến 8 tuần.
Nên ngừng điều trị bằng liraglutid và đánh giá lại nếu bệnh nhân không giảm ít nhất 4% chỉ số BMI hoặc BMI Z-score sau 12 tuần với liều 3,0 mg/ngày hoặc liều tối đa có thể dung nạp được, vì không chắc chắn bệnh nhân sẽ đạt được và duy trì giảm cân có ý nghĩa lâm sàng nếu tiếp tục điều trị.
11.2.3 Đối tượng đặc biệt
Người già: Không cần điều chỉnh liều dựa trên tuổi. Kinh nghiệm điều trị ở bệnh nhân ≥ 75 tuổi nhằm kiểm soát cân nặng còn hạn chế và không khuyến cáo sử dụng cho những bệnh nhân này
Suy thận: Không cần điều chỉnh liều cho người suy thận nhẹ hoặc trung bình (Clcr ≥ 30 ml/phút). Liraglutid không được khuyến cáo sử dụng cho bệnh nhân suy thận nặng (Clcr < 30 ml/phút) bao gồm cả bệnh nhân mắc bệnh thận giai đoạn cuối.
Suy gan: Không có khuyến cáo điều chỉnh liều cho người suy gan nhẹ hoặc trung bình, tuy nhiên vẫn cần thận trọng khi dùng liraglutid trên nhóm đối tượng này. Liraglutid không được khuyến cáo sử dụng cho người suy gan nặng.
12 Tương tác thuốc
In vitro, liraglutid cho thấy rất ít khả năng có tương tác dược động học với các hoạt chất khác liên quan đến cytochrom P450 và gắn kết với protein huyết tương.
Tác dụng làm chậm rỗng dạ dày nhẹ của liraglutid có thể ảnh hưởng đến sự hấp thu của các thuốc uống dùng đồng thời. Các nghiên cứu về tương tác không cho thấy bất kỳ sự chậm hấp thu nào có ý nghĩa lâm sàng và do đó không cần điều chỉnh liều. Rất ít bệnh nhân được điều trị bằng liraglutid được báo cáo có ít nhất một đợt tiêu chảy nặng. Tiêu chảy có thể ảnh hưởng đến sự hấp thu của các thuốc uống dùng đồng thời.
Warfarin và các dẫn xuất coumarin khác: Chưa có nghiên cứu tương tác nào được thực hiện. Không thể loại trừ được tương tác có ý nghĩa lâm sàng với các hoạt chất có độ tan kém hoặc có chỉ số điều trị hẹp như warfarin. Khi bắt đầu điều trị bằng liraglutid ở những bệnh nhân đang dùng warfarin hoặc các dẫn xuất coumarin khác, nên theo dõi INR (Tỷ lệ chuẩn hóa quốc tế) thường xuyên hơn.
Paracetamol: Liraglutid không làm thay đổi mức phơi nhiễm tổng thể của Paracetamol sau khi dùng một liều đơn 1 000 mg. Cmax của paracetamol giảm 31% và trung vị tmax bị chậm đến 15 phút. Không cần điều chỉnh liều khi sử dụng đồng thời với paracetamol.
Atorvastatin: Liraglutid không làm thay đổi mức độ phơi nhiễm tổng thể của Atorvastatin có ý nghĩa lâm sàng sau khi dùng một liều đơn atorvastatin 40 mg. Do đó, không cần điều chỉnh liều atorvastatin khi dùng cùng với liraglutid. Cmax của atorvastatin giảm 38% và trung vị tmax chậm lại 1 - 3 giờ khi dùng với liraglutid.
Griseofulvin: Liraglutid không làm thay đổi mức độ phơi nhiễm tổng thể của Griseofulvin sau khi dùng một liều đơn griseofulvin 500 mg. Cmax griseofulvin tăng 37% trong khi trung vị tmax không thay đổi. Không cần điều chỉnh liều của griseofulvin và các hợp chất khác có độ tan thấp và độ thẩm thấu cao.
Digoxin: Dùng một liều đơn Digoxin 1 mg với liraglutid dẫn đến giảm 16% AUC của digoxin, Cmax giảm 31%, trung vị tmax của digoxin chậm lại 1 - 1,5 giờ. Không cần điều chỉnh liều digoxin dựa trên những kết quả này.
Lisinopril: Dùng một liều đơn Lisinopril 20 mg với liraglutid dẫn đến giảm 15% AUC của lisinopril, Cmax giảm 27%, trung vị tmax của lisinopril chậm lại 6 - 8 giờ. Không cần điều chỉnh liều lisinopril dựa trên những kết quả này.
Thuốc tránh thai đường uống: Liraglutid làm giảm Cmax Ethinylestradiol và Levonorgestrel lần lượt là 12% và 13%, sau khi dùng một liều đơn của thuốc tránh thai đường uống. Tmax bị trì hoãn 1,5 giờ khi dùng liraglutid với cả hai hợp chất. Không có ảnh hưởng nào về mặt lâm sàng đối với sự phơi nhiễm tổng thể của ethinyloestradiol hoặc levonorgestrel. Do đó, tác dụng tránh thai được dự đoán là không bị ảnh hưởng khi dùng đồng thời với liraglutid.
Insulin: Không ghi nhận tương tác dược động học hoặc dược lực học nào giữa liraglutid và insulin detemir khi dùng một liều insulin detemir 0,5 đơn vị/kg với liraglutid 1,8 mg ở trạng thái ổn định trên bệnh nhân đái tháo.
13 Tương kỵ
Các chất được thêm vào thuốc tiêm liraglutid có thể gây giáng hóa liraglutid. Trong trường hợp không có các nghiên cứu về tính tương thích, liraglutid không được trộn lẫn với các thuốc khác.
14 Quá liều và xử trí
14.1 Triệu chứng
Từ các thử nghiệm lâm sàng và việc sử dụng khi thuốc lưu hành trên thị trường, đã có báo cáo các trường hợp dùng quá liều lên đến 72 mg (gấp 24 lần liều khuyến cáo để kiểm soát cân nặng). Các biến cố được báo cáo bao gồm: buồn nôn, nôn và hạ đường huyết nghiêm trọng.
14.2 Xử trí
Trong trường hợp quá liều, nên bắt đầu điều trị hỗ trợ thích hợp tùy theo các dấu hiệu và triệu chứng lâm sàng của bệnh nhân. Bệnh nhân cần được quan sát các dấu hiệu lâm sàng của tình trạng mất nước và theo dõi đường huyết.
Cập nhật lần cuối: 2021.