Lenacapavir
0 sản phẩm
 Dược sĩ Hoàng Bích Dược sĩ lâm sàng
Dược sĩ Hoàng Bích Dược sĩ lâm sàng
Ước tính: 2 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
Tên chung: Lenacapavir
Mã ATC: J05AX31
Nhóm thuốc: thuốc kháng virus.
1 Dạng thuốc và hàm lượng
Viên nén dùng đường uống (300 mg).
Thuốc tiêm dưới da trong lọ liều duy nhất (463,5 mg/1,5 mL).
2 Dược lực học
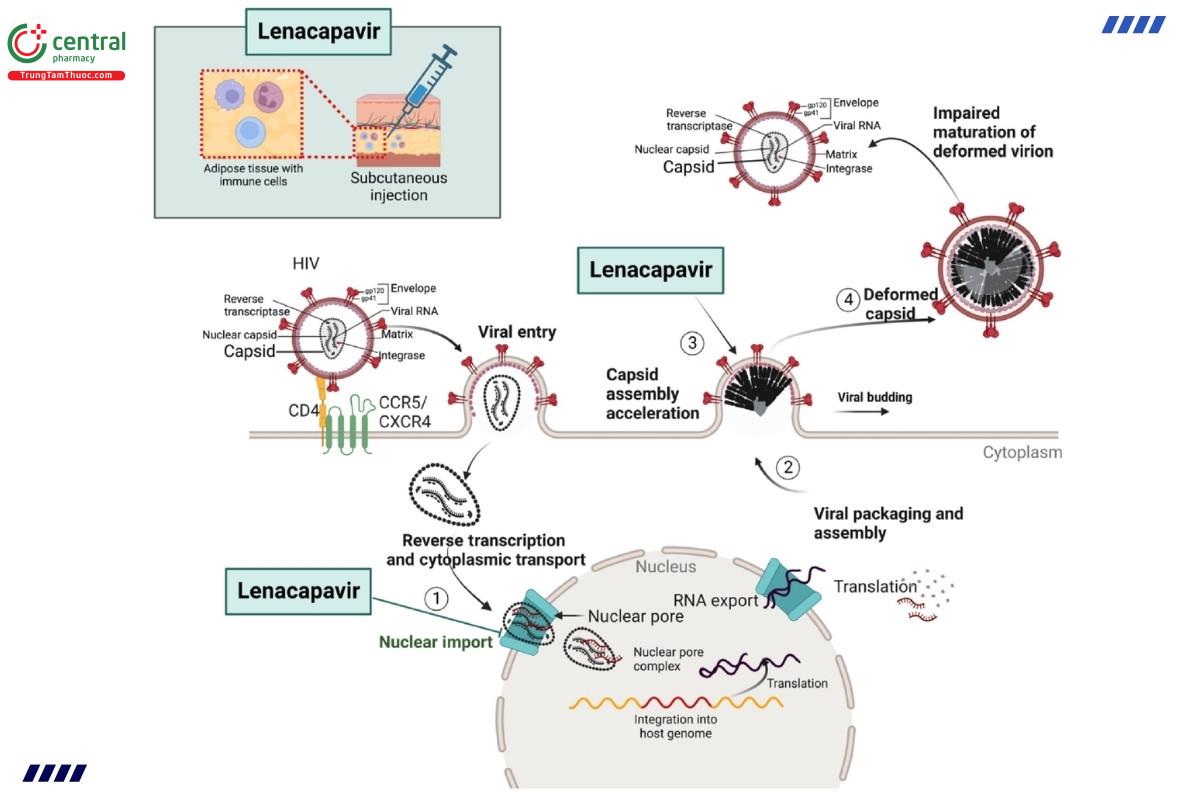
Lenacapavir nhắm vào HIV-1 bằng cách bám vào các vị trí liên kết đặc hiệu trên protein vỏ capsid với ái lực liên kết mạnh (KD=1,4nM). Thuốc hoạt động bằng cách phá vỡ virus tại nhiều điểm: ngăn chặn DNA virus xâm nhập vào nhân tế bào, cản trở quá trình lắp ráp và giải phóng các hạt virus thông qua việc giảm sản xuất protein vỏ capsid, và gây ra các khiếm khuyết trong quá trình hình thành cấu trúc vỏ capsid. Lenacapavir thuộc nhóm thuốc ức chế chọn lọc vỏ capsid HIV-1.
3 Dược động học
3.1 Hấp thu
Sau khi tiêm dưới da, lenacapavir được giải phóng chậm nhưng hấp thu hoàn toàn, với nồng độ đỉnh trong huyết tương đạt được sau 77 - 84 ngày kể từ khi dùng liều.
Sinh khả dụng tuyệt đối khi uống là thấp, khoảng 6% đến 10%. Thời gian đạt nồng độ tối đa (Tmax) sau khi uống là khoảng 4 giờ.
Sinh khả dụng tuyệt đối theo đường tiêm dưới da và đường uống lần lượt là 91 -100% và 4-10%.
Nồng độ đỉnh trung bình ở trạng thái ổn định (Cmax) là 97,2 ng/mL, với độ biến thiên (%CV) là 70,3%.
Bữa ăn ít chất béo không ảnh hưởng đáng kể đến quá trình hấp thu thuốc.
3.2 Phân bố
Thể tích phân bố ở trạng thái ổn định là 1657 (YEZTUGO), 19240 (uống - SUNLENCA) và 9500 đến 11700 ( tiêm dưới da - SUNLENCA)
Lenacapavir gắn với protein huyết tương trên 98,5%.
Tỷ lệ máu/huyết tương khoảng 0.5 - 0.7.
3.3 Chuyển hoá
Lenacapavir ít bị chuyển hoá trong quá trình thải trừ.
Thuốc bị chuyển hoá chủ yếu qua CYP3A4 và UGT1A1, thông qua các phản ứng: oxy hoá, khử alkyl, hydro hoá, thủy phân amide, glucuronid hóa, liên hợp với hexose, pentose và Glutathione.
Các chất chuyển hoá của lenacapavir chưa được đặc trưng đầy đủ. Không có chất chuyển hoá nào chiếm hơn 10% lượng thuốc liên quan trong huyết tương.
3.4 Thải trừ
Sau khi dùng một liều tĩnh mạch lenacapavir đánh dấu phóng xạ ở người khỏe mạnh, 76% phóng xạ được thải qua phân và dưới 1% qua nước tiểu.
Lenacapavir không biến đổi là thành phần chính được tìm thấy trong huyết tương (69%) và trong phân (33%).
Thời gian bán thải sau khi uống là 10 đến 12 ngày, và sau khi tiêm dưới da là 8 đến 12 tuần.
Độ thanh thải là 3,62 L/giờ ở bệnh nhân HIV-1 đã điều trị nhiều.
4 Chỉ định
Lenacapavir được sử dụng để điều trị nhiễm HIV-1 (kết hợp với các thuốc kháng vi-rút khác) hoặc để điều trị dự phòng phơi nhiễm HIV-1 , tùy thuộc vào nhãn hiệu.
Nhãn hiệu Sunlenca được sử dụng kết hợp với các thuốc kháng vi-rút khác để điều trị nhiễm HIV-1 ở những người lớn đã từng điều trị nhiều lần mắc HIV-1 kháng nhiều loại thuốc, những người có phác đồ kháng vi-rút hiện tại không hiệu quả do tình trạng kháng thuốc, không dung nạp hoặc do cân nhắc về độ an toàn.
Nhãn hiệu Yeztugo được sử dụng để dự phòng nguy cơ mắc HIV-1 ( HIV-1 PrEP) ở người lớn và thanh thiếu niên có cân nặng ít nhất 77 pound (ít nhất 35 kg).

5 Chống chỉ định
Mẫn cảm với Lenacapavir.
Đã nhiễm HIV-1 hoặc Không biết tình trạng nhiễm HIV-1 (Yeztugo).
Dùng chung với chất cảm ứng CYP3A mạnh (Sunlenca).
6 Thận trọng
Lenacapavir có thể tồn tại trong cơ thể đến 12 tháng hoặc lâu hơn sau khi ngừng thuốc. Tuy nhiên nên tiêm nhắc lại sau mỗi 6 tháng để đảm bảo hiệu quả tối ưu.
Tiêm dưới da có thể gây phản ứng tại chỗ như sưng, đau, nốt cứng, đôi khi kéo dài và khó hồi phục.
Tiêm sai kỹ thuật (ví dụ: tiêm trong da) có thể gây phản ứng nghiêm trọng tại chỗ tiêm.
Cần quản lý dự phòng toàn diện để giảm nguy cơ nhiễm HIV-1. Nguy cơ kháng lenacapavir nếu người dùng nhiễm HIV-1 trước, trong hoặc sau khi điều trị. Cần xét nghiệm HIV-1 trước mỗi lần tiêm và khi cần thiết (Yeztugo).
Hội chứng phục hồi miễn dịch có thể xảy ra ở những bệnh nhân được điều trị bằng liệu pháp kháng retrovirus phối hợp, gây viêm với các nhiễm trùng cơ hội tiềm ẩn hoặc các bệnh tự miễn (Sunlenca).
7 Thời kỳ mang thai và cho con bú
Thời kỳ mang thai: Chưa rõ về độ an toàn trên thai nhi. Thận trọng và cân nhắc lợi ích và nguy cơ trước khi dùng.
Thời kỳ cho con bú: Một lượng nhỏ lenacapavir sẽ đi vào sữa mẹ. Không nên dùng khi cho con bú.
8 Tác dụng không mong muốn (ADR)
Tiêu hóa
- Thường gặp (1% đến 10%): Buồn nôn
Gan
- Phổ biến (1% đến 10%): Tăng alanine aminotransferase (ALT), tăng aspartate aminotransferase (AST), tăng bilirubin trực tiếp
Tại chỗ
- Rất phổ biến (10% trở lên): Phản ứng tại chỗ tiêm (65%) bao gồm sưng (36%), đau (31%), ban đỏ (31%), nốt sần (25%), cứng (15%), ngứa (6%), thoát mạch (3%), khó chịu (1%), khối u (3%), tụ máu (1%), phù nề (1%) và loét (1%)
- Bốn phần trăm bệnh nhân gặp phải ISR cấp độ 3 (ban đỏ, đau, sưng)
Trao đổi chất
- Thường gặp (1% đến 10%): Đường niệu, tăng đường huyết, protein niệu
Cơ xương khớp
- Rất phổ biến (10% trở lên): Tăng creatinine (13%)
9 Liều dùng - Cách dùng
9.1 Liều dùng
Lenacapavir để điều trị HIV-1 (nhãn hiệu Sunlenca). Có 2 lựa chọn:
Lựa chọn 1:
- Ngày 1: 927 mg tiêm dưới da (2 lần tiêm 1,5 mL) và 600 mg uống (2 viên nén 300 mg)
- Ngày 2 : 600 mg uống (2 viên nén 300 mg)
- Duy trì: 927 mg tiêm dưới da (2 lần tiêm 1,5 mL) mỗi 6 tháng (26 tuần) kể từ ngày tiêm cuối cùng +/-2 tuần.
Lựa chọn 2:
- Ngày 1: 600 mg uống (2 viên nén 300 mg).
- Ngày 2: 600 mg uống (2 viên nén 300 mg)
- Ngày 8: 300 mg uống (1 viên nén 300 mg)
- Ngày 15: 927 mg tiêm dưới da (2 lần tiêm 1,5 mL)
- Duy trì: 927 mg tiêm dưới da (2 lần tiêm 1,5 mL) mỗi 6 tháng (26 tuần) kể từ ngày tiêm cuối cùng +/-2 tuần.
Lenacapavir để phòng ngừa HIV PrEP (thương hiệu Yeztugo)
- Ngày 1: Tiêm dưới da (SC) 927 mg (2 lần tiêm 1,5 mL) và uống 600 mg (2 viên nén 300 mg)
- Ngày 2: Uống 600 mg (2 viên nén 300 mg)
- Duy trì: 6 tháng (26 tuần) sau ngày tiêm mũi cuối cùng (+/-2 tuần): 927 mg tiêm dưới da (2 lần tiêm 1,5 mL).
9.2 Cách dùng
Dùng bằng đường uống và tiêm dưới da.

10 Tương tác thuốc
Lenacapavir là chất nền của P-gp, UGT1A1 và CYP3A.
Chất cảm ứng CYP3A mạnh (như rifampin, Phenytoin hoặc Phenobarbital) hoặc trung bình (như efavirenz, Dexamethasone): giảm đáng kể nồng độ lenacapavir trong huyết tương, làm giảm hiệu quả thuốc.
Kết hợp P-gp, UGT1A1 và chất ức chế CYP3A mạnh: các thuốc này làm tăng đáng kể nồng độ thuốc trong huyết tương. Không khuyến cáo dùng đồng thời .
Chất nền CYP3A và P-gp: Lenacapavir là chất ức chế vừa phải CYP3A và chất ức chế P-gp, làm tăng nồng độ chất nền này.
11 Bảo quản
Bảo quản thuốc ở nhiệt độ phòng 20 °C đến 25 °C.
Chai có chứa gói hút ẩm giúp giữ thuốc luôn khô ráo (bảo vệ thuốc khỏi ẩm ướt).
Giữ nguyên viên thuốc trong vỉ thuốc ban đầu.
Để thuốc xa tầm tay trẻ em và vật nuôi.
12 Quá liều và xử trí
Chưa có dữ liệu về quá liều.
Nếu xảy ra quá liệu, cần theo dõi dấu hiệu ngộ độc và thực hiện các biện pháp hỗ trợ, điều trị triệu chứng.
13 Lịch sử phê duyệt của Lenacapavir
Ngày 22/12/2022, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã chính thức phê duyệt Sunlenca (lenacapavir) của Gilead Sciences để điều trị Virus gây suy giảm miễn dịch ở người (HIV-1) ở những bệnh nhân trưởng thành đã trải qua nhiều lần điều trị nhiễm HIV-1 kháng nhiều loại thuốc và đang không đáp ứng được phác đồ điều trị kháng vi-rút hiện tại do không dung nạp được kháng thuốc hoặc do cân nhắc đến vấn đề an toàn.
Ngày 18/6/2025, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã chính thức phê duyệt thuốc Yeztugo (lenacapavir) – một loại thuốc ức chế vỏ capsid HIV-1 của Gilead Sciences – để sử dụng như một phương pháp dự phòng trước phơi nhiễm (PrEP) để giảm nguy cơ nhiễm HIV mắc phải qua đường tình dục ở người lớn và thanh thiếu niên nặng từ 35kg trở lên. Đây là lựa chọn PrEP đầu tiên và duy nhất tại Mỹ có hiệu quả bảo vệ kéo dài trong 6 tháng, chỉ với 2 mũi tiêm mỗi năm. Tại Hoa Kỳ, giá niêm yết của Gilead cho Yeztugo là hơn 28.000 đô la một năm. Yeztugo được kỳ vọng sẽ phá vỡ những rào cản phổ biến như khó tuân thủ liều dùng hàng ngày, kỳ thị xã hội và nhận thức thấp về PrEP. Điều này đặc biệt quan trọng khi vào năm 2023, vẫn có hơn 100 người được chẩn đoán nhiễm HIV mỗi ngày ở Hoa Kỳ.
Chỉ một tháng sau khi được FDA Hoa Kỳ phê duyệt vào tháng 6/2025, Liên minh Châu Âu (EU) đã chính thức phê duyệt lenacapavir – được bán dưới tên thương mại là Yeytuo tại châu Âu – trở thành thuốc PrEP tiêm 2 lần mỗi năm đầu tiên và duy nhất được chấp thuận tại Liên minh châu Âu (EU), cũng như ở Na Uy, Iceland và Liechtenstein. Quyết định phê duyệt này được đưa ra chỉ một tháng sau khi Cơ quan Dược phẩm Châu Âu (EMA) đề xuất cấp phép cho loại thuốc tiên phong này, đây được xem là một bước tiến quan trọng trong cuộc chiến chống đại dịch HIV. Việc phê duyệt nhanh chóng này diễn ra trong bối cảnh dịch HIV đang có xu hướng gia tăng tại nhiều quốc gia châu Âu. Năm 2023, khu vực EU cùng với Na Uy, Iceland và Liechtenstein ghi nhận hơn 24.700 ca chẩn đoán nhiễm HIV mới, tăng 11,8% so với năm trước đó.
Việc phê duyệt Yeztugo (tên hoạt chất: lenacapavir) tại Hoa Kỳ và châu Âu được dựa trên kết quả từ hai thử nghiệm lâm sàng quy mô lớn mang tên PURPOSE 1 và PURPOSE 2, đều ở Giai đoạn 3 – giai đoạn cuối cùng trước khi thuốc được cấp phép lưu hành.
- Trong thử nghiệm PURPOSE 1, có 2.134 phụ nữ không chuyển giới tham gia tại vùng cận Sahara châu Phi. Kết quả cho thấy, trong nhóm được tiêm lenacapavir dưới da hai lần mỗi năm, không ghi nhận trường hợp nhiễm HIV nào, tương đương với hiệu quả phòng ngừa đạt 100%. Hiệu quả này vượt trội so với nhóm sử dụng PrEP uống hàng ngày bằng thuốc Truvada (emtricitabine 200 mg và Tenofovir disoproxil fumarate 300 mg).
- Trong khi đó, thử nghiệm PURPOSE 2 bao gồm 2.179 người tham gia thuộc nhiều nhóm dân số đa dạng, gồm nam giới quan hệ tình dục đồng giới, người chuyển giới nữ, và nam giới dị tính có nguy cơ cao nhiễm HIV, trải rộng ở nhiều khu vực địa lý khác nhau. Kết quả nghiên cứu cho thấy chỉ có 2 trường hợp nhiễm HIV trong nhóm dùng lenacapavir tiêm dưới da hai lần mỗi năm, tương đương với tỷ lệ phòng ngừa đạt 99,9%. Hiệu quả này cũng vượt trội đáng kể so với nhóm dùng Truvada uống hàng ngày trong thử nghiệm.
Cả hai nghiên cứu đều cho thấy thuốc được dung nạp tốt, không phát hiện lo ngại an toàn mới đáng kể.
14 Tài liệu tham khảo
1. Chuyên gia Drugs. Lenacapavir. Drugs.com. Truy cập ngày 28 tháng 8 năm 2025.
2. Chuyên gia Drugs. Yeztugo. Drugs.com. Truy cập ngày 28 tháng 8 năm 2025.
3. Chuyên gia Drugs. Sunlenca. Drugs.com. Truy cập ngày 28 tháng 8 năm 2025.
2. Chuyên gia Drugbank. Lenacapavir. Drugbank. Truy cập ngày 28 tháng 8 năm 2025.




