Gemcitabine
8 sản phẩm
 Dược sĩ Cẩm Loan Dược sĩ lâm sàng
Dược sĩ Cẩm Loan Dược sĩ lâm sàng
Ước tính: 4 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
Bài viết biên soạn dựa theo
Dược thư quốc gia Việt Nam, lần xuất bản thứ ba
Đây là phiên bản mới nhất của Dược thư Việt Nam do Bộ Y tế ban hành Quyết định số 3445/QĐ-BYT ngày 23 tháng 12 năm 2022
Trang 806-809, tải PDF TẠI ĐÂY
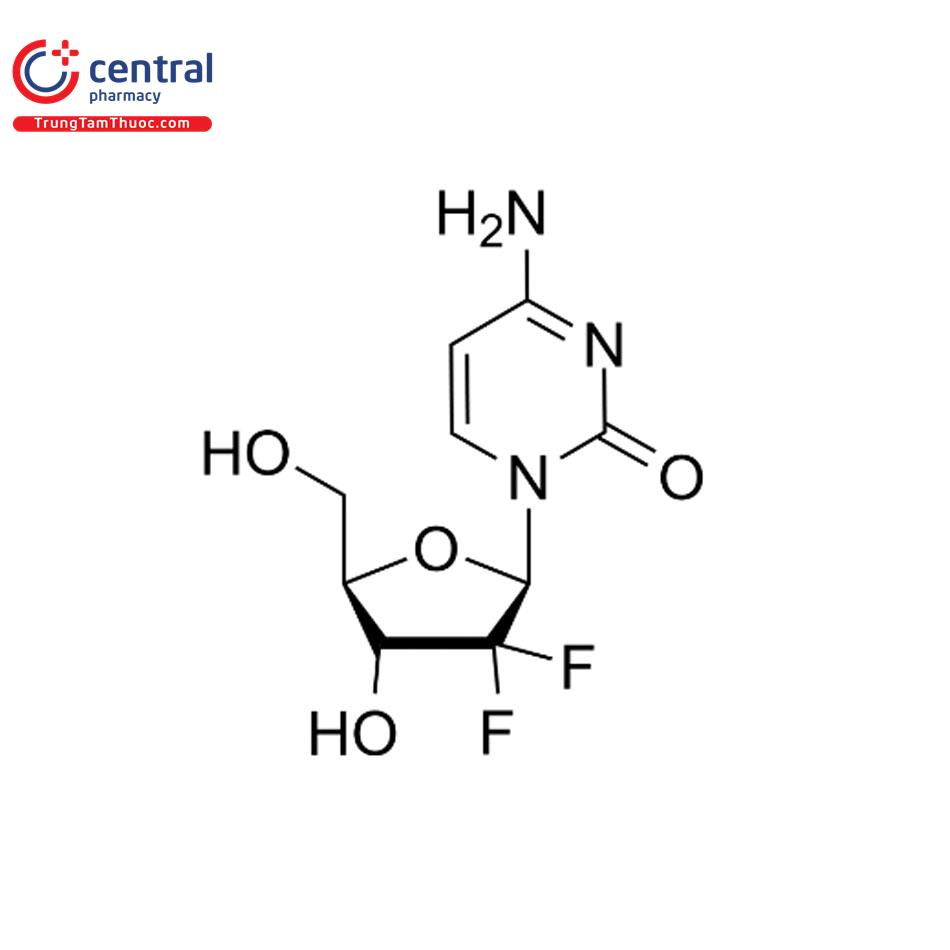
Tên chung quốc tế: Gemcitabine hydrochloride.
Mã ATC: L01BC05.
Loại thuốc: Thuốc chống ung thư, nhóm chống chuyển hóa, nucleosid pyrimidin tổng hợp.
1 Dạng thuốc và hàm lượng
Thuốc bột để pha Dung dịch tiêm truyền tĩnh mạch: Lọ 200 mg; 1 g; 1,5 g; 2 g.
Túi truyền tĩnh mạch: 1,2 g/120 ml; 1,6 g/160 ml; 1,8 g/180 ml; 2 g/200 ml; 2,2 g/220 ml.
2 Dược lực học
Gemcitabine là chất chống chuyển hóa pyrimidin, có tác dụng ức chế tổng hợp DNA do ức chế DNA polymerase và ribonucleotide reductase đặc hiệu cho pha S của chu kỳ phân bào. Trong tế bào, gemcitabine bị phosphoryl hóa bởi deoxycytidine kinase thành gemcitabin monophosphat; chất này lại bị phosphoryl hóa thành các dẫn chất có hoạt tính là gemcitabine diphosphat và gemcitabine triphosphat. Gemcitabine diphosphat ức chế ribonucleotide reductase nên ức chế tổng hợp DNA còn gemcitabine triphosphat gắn vào ADN và ức chế DNA polymerase.
3 Dược động học
Sau khi truyền tĩnh mạch, gemcitabine được chuyển hóa bởi cytidine deaminase ở gan, thận, máu và các mô khác. Thời gian đạt đỉnh huyết tương là 30 phút sau khi truyền xong. Phân bố: Nếu truyền dưới 70 phút: 50 lít/m2; truyền lâu: 370 lít/m2. Thuốc ít gắn vào protein huyết tương. Gemcitabine được chuyển hóa trong tế bào bởi các nucleotide kinase thành các diphosphat và triphosphate nucleotide có hoạt tính. Phụ nữ có Độ thanh thải thuốc thấp hơn 25% so với nam giới. Nửa đời thải trừ của gemcitabine nếu thời gian truyền ≤ 1 giờ: 42 - 94 phút; nếu thời gian truyền 3 - 4 giờ: 4 - 10,5 giờ. Nửa đời thải trừ khỏi tế bào của gemcitabine triphosphat là 0,7 - 12 giờ. Thuốc được đào thải chủ yếu qua nước tiểu (92 - 98%, chủ yếu dưới dạng chất chuyển hóa uracil không có hoạt tính) và qua phân (< 1%).
4 Chỉ định
Kết hợp với carboplatin trong điều trị ung thư buồng trứng tiến triển mà tái phát ít nhất 6 tháng sau liệu pháp hóa trị có platin. Kết hợp với Paclitaxel trong điều trị ban đầu ung thư vú di căn sau thất bại với liệu pháp hóa trị bổ trợ có anthracycline.
Điều trị ban đầu cho ung thư biểu mô tuyến tụy tiến triển tại chỗ (giai đoạn II hoặc III không thể phẫu thuật được), hoặc ung thư biểu mô tuyến tụy di căn (giai đoạn IV). Thuốc được chỉ định cho bệnh nhân đã điều trị 5-FU trước đó.
Kết hợp với cisplatin trong điều trị khởi đầu ung thư phổi không phải tế bào nhỏ không phẫu thuật được, tiến triển tại chỗ (giai đoạn IIIA hoặc IIIB) hoặc có di căn (giai đoạn IV) (đơn trị liệu gemcitabine ở người già và trong điều trị hỗ trợ; cách khác kết hợp với cisplatin).
Điều trị ung thư bàng quang tiến triển hoặc di căn (phối hợp với cisplatin).
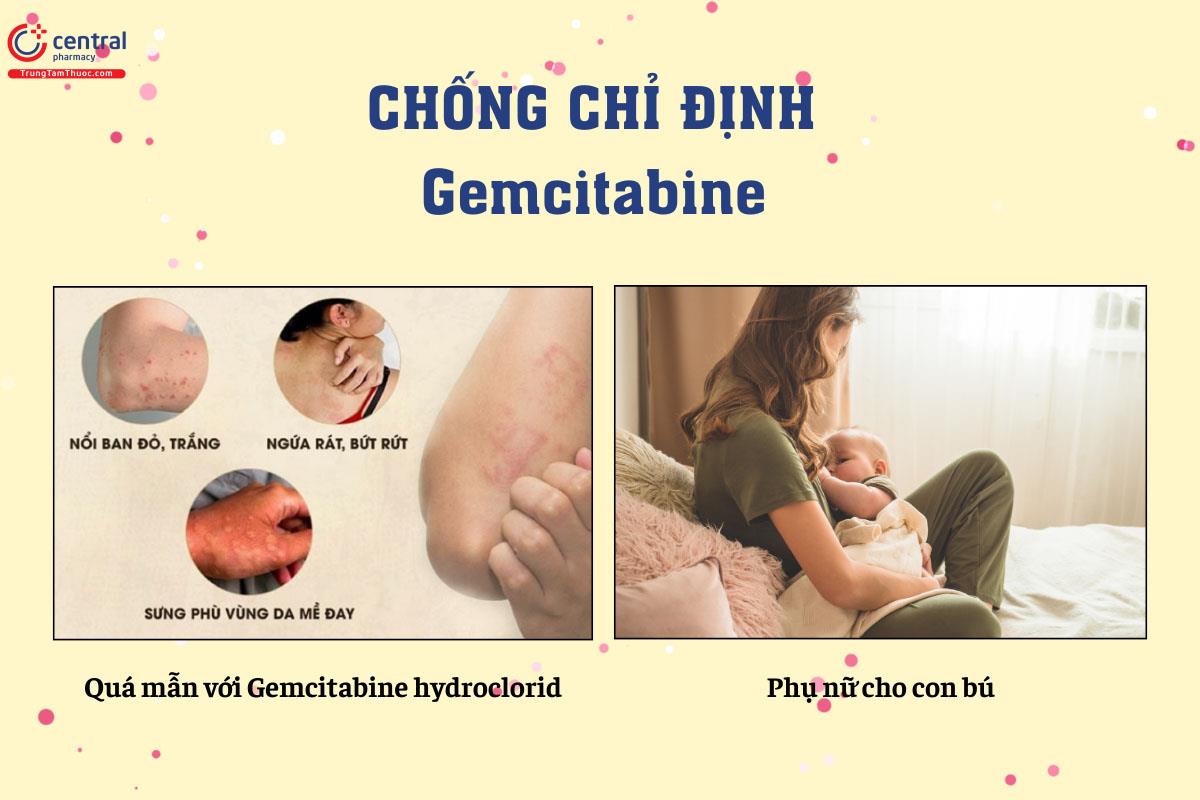
5 Chống chỉ định
Quá mẫn với gemcitabine hydroclorid.
Phụ nữ cho con bú.
6 Thận trọng
Ở người cao tuổi, độ thanh thải thuốc giảm và nửa đời thải trừ của thuốc kéo dài hơn nên có thể phải giảm liều.
Phụ nữ có độ thanh thải thuốc thấp hơn và có nên phải theo dõi để giảm liều nếu cần thiết nửa đời thuốc lâu hơn
Người suy gan, có tiền sử viêm gan, bị di căn ở gan, xơ gan, nghiện rượu vì thuốc có thể làm cho bệnh cũ nặng lên.
Người suy thận.
Phải theo dõi công thức máu, số lượng tiểu cầu trước mỗi lần dùng. Xác định chức năng gan và chức năng thận trước mỗi lần dùng thuốc, định kỳ và sau khi ngừng thuốc.
Theo dõi điện giải bao gồm cả Kali, magnesi, calci khi kết hợp với trị liệu bằng cisplatin.
Thuốc có thể gây buồn ngủ. Bệnh nhân đang dùng gemcitabin không nên lái xe và vận hành máy.
Các ADR nghiêm trọng trên phổi, đôi khi gây tử vong, bao gồm phù phổi, viêm phổi kẽ, xơ hóa phổi và hội chứng suy hô hấp cấp
(ARDS) đã được báo cáo ở những bệnh nhân dùng một hoặc nhiều liều gemcitabine hydroclorid. Nên ngừng dùng thuốc ngay lập tức và can thiệp các biện pháp chăm sóc hỗ trợ thích hợp (ví dụ như sử dụng thuốc lợi tiểu, corticosteroid) ở những bệnh nhân xuất hiện các ADR như vậy.
7 Thời kỳ mang thai
Thuốc độc với thai, có thể gây quái thai, làm thai chết (trên thực nghiệm). Nếu dùng cho bệnh nhân mang thai hoặc có thai trong thời gian trị liệu thì phải thông báo cho bệnh nhân biết nguy cơ đối với thai.

8 Thời kỳ cho con bú
Không rõ thuốc có qua sữa không. Phụ nữ cho con bú dừng cho con bú trong quá trình điều trị gemcitabine và 1 tuần sau khi dùng liều cuối cùng.
9 Tác dụng không mong muốn (ADR)
9.1 Rất thường gặp
Tim mạch: phù ngoại vi (20%), phù (13%).
TKTW: đau (10 - 48%), sốt (30 - 41%), ngủ gà (5 - 11%).
Da: nổi mẩn (24 - 30%), rụng tóc (15 - 18%), ngứa (13%).
Tiêu hóa: buồn nôn/nôn (64 - 71%), táo bón (10 - 31%), ỉa chảy (19 - 30%), viêm miệng (10 - 14%).
Huyết học: thiếu máu (65 - 73%; độ 4: 1 - 3%), giảm bạch cầu (62 - 71%), giảm bạch cầu trung tính (61 - 63%; độ 4: 6 - 7%), giảm tiểu cầu (24 - 47%), xuất huyết (4 - 17%). Ức chế từ nguyên nhân làm hạn chế liều.
Gan: tăng transaminase (67 - 78%), tăng phosphatase kiềm (55 - 77%), tăng bilirubin (13 - 26%).
Thận: protein niệu (10 – 45%), đái ra máu (13 - 35%), tăng nitơ urê huyết (8 - 16%).
Hô hấp: khó thở (6 - 23%).
Khác: hội chứng giống cúm (19%), nhiễm khuẩn (8 - 16%).
9.2 Thường gặp
Tại chỗ: kích ứng tại chỗ tiêm (4%).
Thần kinh - cơ - xương: loạn cảm (2 - 10%).
Thận: tăng creatinin (2 - 8%).
Hô hấp: co thắt phế quản (< 2%).
9.3 Ít gặp
Hội chứng suy hô hấp cấp ở người trưởng thành, phản vệ, chán ăn, loạn nhịp tim, nổi phỏng ở da, viêm mô, tai biến mạch não, suy tim sung huyết, run cơ, ho, viêm họng, đổ mồ hôi, hoại tử, tăng GGT, nhức đầu, hội chứng tăng urê huyết tán, phản ứng độc ở gan, tăng huyết áp, mất ngủ, viêm phổi kẽ, suy gan, mệt mỏi, nhồi máu cơ tim, viêm mạch ngoại vi, điểm xuất huyết dưới da, phù phổi, hội chứng viêm sau chiếu xạ, suy thận, suy hô hấp, viêm mũi, nhiễm khuẩn huyết, loạn nhịp trên thất, mệt mỏi.
10 Hướng dẫn cách xử trí ADR
Phần lớn các ADR hay gặp của gemcitabine là có thể phục hồi và không đòi hỏi phải ngừng hẳn trị liệu dù có thể phải giảm liều hoặc tạm ngừng dùng thuốc.
Cần theo dõi bệnh nhân định kỳ về huyết học (công thức máu, số lượng tiểu cầu), đánh giá chức năng gan, thận, phổi, nhất là những bệnh nhân đã hoặc đang có bệnh ở các cơ quan này.
Nếu bệnh nhân bị ADR thì phải điều trị triệu chứng và điều trị hỗ trợ thích hợp; có thể phải xem xét việc điều chỉnh liều trong chu kỳ hoặc điều chỉnh liều ở chu kỳ kế tiếp.
11 Liều lượng và cách dùng
Thuốc phải do thầy thuốc chuyên khoa có kinh nghiệm về thuốc chống ung thư chỉ định và theo dõi điều trị.
Pha thuốc: Pha thuốc bằng dung dịch Natri clorid 0,9% để đạt nồng độ thuốc trong dung dịch (không có chất bảo quản) là 38 mg/ml (nồng độ tối đa 40 mg/ml; không pha đặc hơn vị thuốc không hòa tan hết). Với lọ chứa 200 mg bột: thêm 5 ml dung dịch natri clorid 0,9%. Với lọ chứa 1 000 mg thêm vào 25 ml dung dịch natri clorid 0,9%. Thể tích toàn phần sau đó là 5,26 ml với lọ chứa 200 mg; là 26,3 ml với lọ chứa 1.000 mg. Nồng độ gemcitabine có trong đó là 38 mg/ml (tính cả thể tích của thuốc bột đã bị choán chỗ). Lắc mạnh để thuốc hòa tan hết. Sau đó pha loãng tiếp bằng natri clorid 0,9% để đạt nồng độ 0,1 mg/ml. Phải mang các phương tiện bảo hộ (áo blouse, găng, khẩu trang, kính) khi pha thuốc trong phòng kín. Nếu bị thuốc dây vào mắt, vào da phải rửa ngay bằng nhiều nước.
Trước khi truyền thuốc phải kiểm tra bằng mắt xem có tủa và bị biến màu không. Nếu có tủa thì không được dùng. Thuốc không sử dụng vả lọ, bơm kim tiêm, dây truyền... phải hủy theo đúng quy trình. Gemcitabine chỉ được dùng mỗi tuần một lần, mỗi lần truyền trong 30 phút. Không truyền lâu quá 60 phút vì làm tăng tích tụ chất chuyển hóa có hoạt tính dẫn đến tăng độc tính của thuốc. Không được dùng quả 1 lần trong tuần. Nếu dùng tuần 5 ngày liên tiếp, bệnh nhân không dung nạp mà biểu hiện là hạ huyết áp và xuất hiện triệu chứng như bị cúm chỉ ở liều 10 mg/m2/ngày. Nếu dùng tuần 2 lần, liều dung nạp tối đa chỉ là 65 mg/m2 khi truyền trên 30 phút và là 150 mg/m2 khi tiêm trên 5 phút. Trong phác đồ này, độc tính xuất hiện là giảm tiểu cầu, triệu chứng như bị cúm và đặc biệt là suy nhược. Nếu thuốc bị thoát mạch thì phải ngừng truyền ngày; chuyển sang truyền ở tĩnh mạch khác.
11.1 Ung thư phổi không phải tế bào nhỏ
Dùng đơn thuần: Liều khuyên dùng là 1 000 mg/m2 mỗi lần; tuần 1 lần trong 3 tuần; nghỉ 1 tuần (chu kỳ 4 tuần). Có thể phải chỉnh liều của chu kỳ hoặc cho một chu kỳ nếu cần thiết.
Dùng kết hợp: Liều khuyên dùng là 1 000 mg/m2, 1 lần vào các ngày 1, 8, 15 của chu kỳ 28 ngày. Cũng có thể theo phác đồ 1 250 mg/m2/ ngày vào các ngày 1 và 8 của chu kỳ 21 ngày. Có thể phải chỉnh liều cho liều tiếp theo trong 1 chu kỳ hoặc cho một chu kỳ nếu cần thiết. Dùng cisplatin với liều từ 75 - 100 mg/m2; 3 tuần 1 lần.
11.2 Ung thư tụy
Liều khuyên dùng là 1 000 mg/m2; tuần 1 lần trong 7 tuần liên tiếp rồi nghỉ 1 tuần. Sau đó theo chu kỳ 4 tuần: Mỗi tuần dùng 1 lần trong 3 tuần liên tiếp rồi nghỉ 1 tuần. Có thể phải chỉnh liều cho lần tiếp theo trong 1 chu kỳ hoặc cho một chu kỳ nếu cần thiết.
11.3 Ung thư bàng quang
Liều khuyên dùng là 1 000 mg/m2; truyền vào các ngày 1, 8, 15 trong chu kỳ 28 ngày, kết hợp với cisplatin. Cisplatin được dùng với liều 70 mg/m2 vào ngày 1 hay ngày 2 của mỗi chu kỳ 28 ngày. Dùng cisplatin sau khi đã truyền gemcitabine. Lặp lại chu kỳ này. Đưa thuốc vào bàng quang: 2 000 mg (pha trong 100 ml nước muối sinh lý), giữ thuốc trong bàng quang 1 giờ; 2 lần mỗi tuần trong 3 tuần. Cứ mỗi 4 tuần lại lặp lại. Dùng ít nhất 2 chu kỳ như vậy.
11.4 Ung thư vú (trị liệu kết hợp với paclitaxel)
Truyền paclitaxel (175 mg/m2) vào ngày 1 trong 3 giờ; sau đó truyền tĩnh mạch gemcitabine (1 250 mg/m2) trong 30 phút vào ngày 1 và ngày 8 của chu kỳ 21 ngày. Có thể phải chỉnh liều trong 1 chu kỳ hoặc cho một chu kỳ nếu cần thiết. Trước khi được tiến hành trị liệu, bệnh nhân phải có số lượng bạch cầu hạt> 1 500/mm3.
11.5 Ung thư buồng trứng (trị liệu kết hợp với carboplatin)
Liều gemcitabine được khuyên dùng là 1 000 mg/m2 vào các ngày 1 và 8 của chu kỳ 21 ngày. Carboplatin được truyền vào ngày 1, sau khi đã truyền xong gemcitabine. Liều carboplatin được tính sao cho đạt được diện tích vùng dưới đường cong nồng độ - thời gian (AUC) là 4,0 mg/ml × phút. Có thể phải chỉnh liều gemcitabine cho liều sau trong 1 chu kỳ hoặc cho một chu kỳ nếu cần thiết.
11.6 Điều chỉnh liều do tác dụng phụ ngoài huyết học
ADR ngoài huyết học: Phải theo dõi hội chứng tăng ure do tan huyết và ngừng ngay gemcitabine ở bệnh nhân bị thiếu máu có tan huyết do bệnh vi mạch, tăng bilirubin huyết thanh hoặc LDH, tăng hồng cầu lưới, giảm tiểu cầu nặng có hoặc không có suy thận. Giảm 50% liều ở bệnh nhân bị ung thư buồng trứng tiến triển bị độc tính không lên huyết học độ 3 hoặc độ 4 (trừ buồn nôn và nôn). Giảm 50% liều hoặc ngừng dùng thuốc ở bệnh nhân bị ung thư vú di căn bị độc tính không lên huyết học độ 3 hoặc độ 4 (trừ buồn nôn, nôn). Phải ngừng hoặc giảm 50% liều gemcitabine ở bệnh nhân bị ung thư phổi không phải tế bào nhỏ bị độc tính không lên huyết học độ 3 hoặc độ 4 (trừ buồn nôn, nôn, rụng tóc).
Ngừng ngay dùng thuốc và điều trị hỗ trợ (lợi niệu, corticosteroid) ở bệnh nhân bị độc nặng ở phổi.
Phải giảm liều hoặc tạm ngừng dùng gemcitabin nếu bị các ADR nặng và giải quyết các ADR (trừ nôn và buồn nôn).
11.7 Điều chỉnh liều do tác dụng phụ tại huyết học
ADR tại huyết học là nguyên nhân chính hạn chế liều dùng gemcitabin trong điều trị. Ung thư buồng trứng tiến triển: Liều trong một chu kỳ được điều chỉnh theo số lượng bạch cầu hạt và tiểu cầu vào ngày thứ 8. Không cần chỉnh liều ở bệnh nhân có số lượng bạch cầu trung tính ≥ 1 500/mm3; số lượng tiểu cầu > 100 000/mm3. Bệnh nhân có bạch cầu hạt 1 000 - 1 499/mm3 và/hoặc tiểu cầu 75 000 - 99 999/mm3: Giảm 50% liều. Bệnh nhân có bạch cầu hạt < 1 000/mm3 và/hoặc tiểu cầu < 75 000/mm3: Ngừng dùng thuốc.
Trong trị liệu kết hợp với carboplatin, liều gemcitabine ở các chu kỳ tiếp theo được điều chỉnh theo mức độ bị độc tính. Liều gemcitabine ở các chu kỳ kế tiếp giảm còn 800 mg/m2 vào ngày 1 và ngày 8 nếu có 1 trong các biểu hiện độc sau: Số lượng bạch cầu hạt < 500 /mm3 trong hơn 5 ngày hoặc < 100/mm3 trong hơn 3 ngày, sốt có giảm bạch cầu trung tính, tiểu cầu<25 000/mm3 hoặc có thể lùi chu kỳ hơn 1 tuần do độc tính. Nếu một trong các độc tính vẫn tái xuất hiện sau khi đã giảm liều ban đầu thì chỉ truyền gemcitabine 800mg/m2 vào ngày 1 cho chu kỳ sau.
Ung thư vú di căn: Liều được điều chỉnh theo số lượng bạch cầu hạt và tiểu cầu vào ngày thứ 8. Bệnh nhân có bạch cầu hạt ≥ 1 200/mm3, tiểu cầu > 75 000/mm3: Không cần chỉnh liều. Bệnh nhân có bạch cầu hạt 1 000 - 1 199/mm3 hoặc tiểu cầu 50.000 - 75 000/mm3: dùng 75% liều. Bệnh nhân có bạch cầu hạt 700 - 999/mm3 và tiểu cầu < 50.000/mm3: Ngừng dùng thuốc.
Ung thư tụy và ung thư phổi không phải tế bào nhỏ: Bệnh nhân có bạch cầu hạt ≥ 1 000/mm3 và tiểu cầu ≥ 100 000/mm3: Không cần chỉnh liều. Bệnh nhân có bạch cầu hạt 500 - 999/mm3 hoặc tiểu cầu 50.000 - 99 999/mm3: Dùng 75% liều. Bệnh nhân có bạch cầu hạt < 500/mm3 hoặc tiểu cầu <50.000/mm3: Ngừng thuốc cho đến khi số lượng các tế bào vượt các mức trên.
12 Tương tác thuốc
Gemcitabine làm tăng nồng độ/tác dụng của bleomycin, fluorouracil, natalizumab, vắc xin (sống).
Gemcitabine làm giảm nồng độ/tác dụng của vắc xin (bất hoạt), thuốc kháng vitamin K.
Trastuzumab làm tăng nồng độ/tác dụng của gemcitabine.
Cây cúc tím châu Âu Echinacea purpurea làm giảm nồng độ/tác dụng của gemcitabine.
Tương tác với chiếu xạ:
Xạ trị đồng thời hoặc cách nhau ≤7 ngày: Độc tính phụ thuộc vào nhiều yếu tố, nhất là vào liều gemcitabine, tần suất dùng, liều chiếu xạ, cách lên kế hoạch xạ trị, mô đích, thể tích bị chiếu xạ. Cần đặc biệt chú ý ở bệnh nhân bị ung thư phổi không phải tế bào nhỏ vì đã thấy gemcitabine làm tăng nhạy cảm với tia xạ dẫn đến các ADR nặng có thể gây nguy hiểm đến tính mạng (viêm thực quản, viêm phổi, nhất là ở bệnh nhân có thể tích bị chiếu xạ lớn). Có thể kết hợp gemcitabine liều thấp với chiếu xạ liều thấp (gemcitabine 600 mg/m2, 4 lần; cisplatin: 80 mg/m2, 2 lần; chiếu xạ 66Gy) trong chu kỳ 6 tuần với độc tính có thể dự đoán được.
Xạ trị không đồng thời hoặc cách nhau > 7 ngày: Không thấy có tăng độc tính nếu gemcitabine được dùng trước chiếu xạ trên 7 ngày, ngoài tái phát phản ứng do chiếu xạ.
13 Tương kỵ
Gemcitabine hydroclorid tương kỵ vật lý với Aciclovir natri, amphotericin B, cefoperazon natri, cefotaxim natri, furosemid, Ganciclovir natri, Imipenem có Cilastatin natri, Irinotecan, methotrexat natri, methylprednisolon natri succinat, mezlocillin natri, Mitomycin, piperacilin natri, Piperacillin có Tazobactam, prochlorperazine edisylate.
Không pha thuốc bằng các dung môi khác ngoài natri clorid 0,9%. Không trộn thuốc với bất kỳ thuốc nào khác.
14 Quả liều và xử trí
Các triệu chứng quá liều là ức chế tủy, loạn cảm, viêm niêm mạc, loét da, nổi mẩn, các triệu chứng nặng của ADR. Không có thuốc đặc trị ngộ độc gemcitabine. Điều trị quá liều là điều trị triệu chứng và hỗ trợ. Nếu sớm thì có thể dùng thuốc chống nôn và thuốc chống ỉa chảy để giảm nhẹ triệu chứng.
Theo dõi cân bằng nước - điện giải ở bệnh nhân bị mất nước, nôn hoặc ỉa chảy nặng.
Với tủy xương bị ức chế: Dùng các yếu tố kích thích tạo bạch cầu (Filgrastim 5 microgam/kg/ngày, tiêm dưới da hoặc truyền tĩnh mạch trong 15 - 30 phút.
Cập nhật lần cuối: 2018.