Gefitinib
10 sản phẩm
 Dược sĩ Cẩm Loan Dược sĩ lâm sàng
Dược sĩ Cẩm Loan Dược sĩ lâm sàng
Ước tính: 3 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
Bài viết biên soạn dựa theo
Dược thư quốc gia Việt Nam, lần xuất bản thứ ba
Đây là phiên bản mới nhất của Dược thư Việt Nam do Bộ Y tế ban hành Quyết định số 3445/QĐ-BYT ngày 23 tháng 12 năm 2022
Trang 804-806, tải PDF TẠI ĐÂY
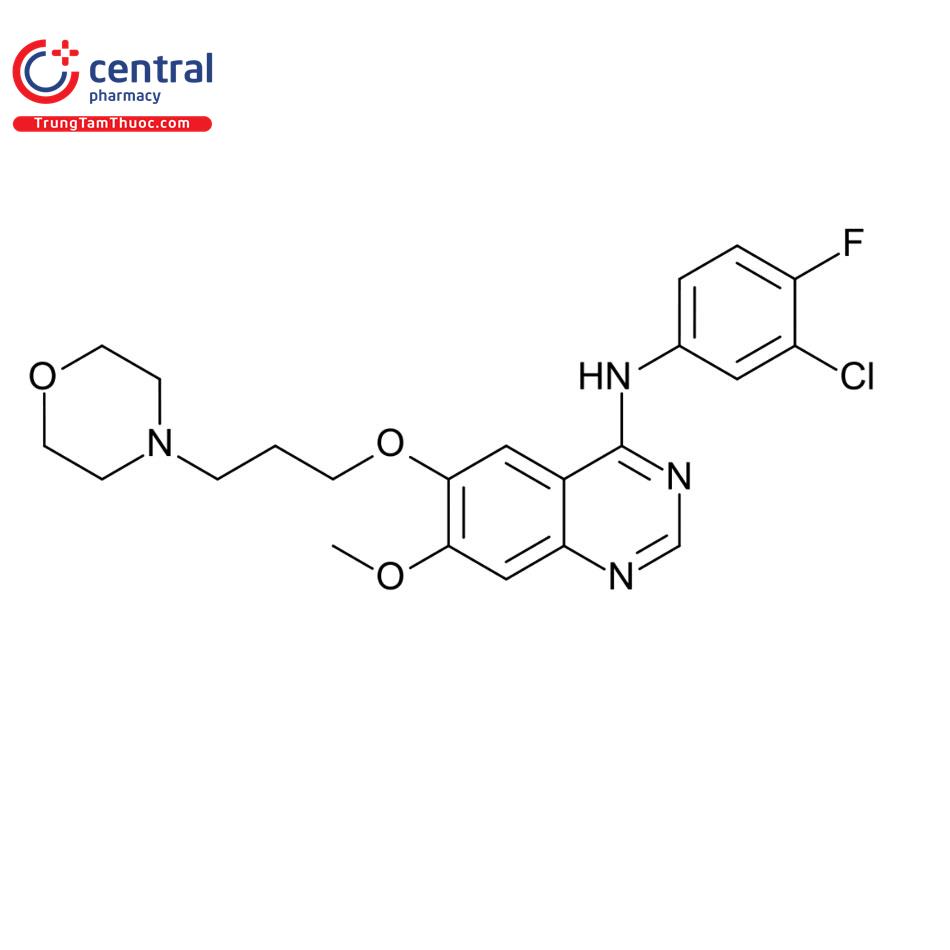
Tên chung quốc tế: Gefitinib.
Mã ATC: L01XE02.
Loại thuốc: Chống ung thư, ức chế tyrosine kinase, ức chế EGFR.
1 Dạng thuốc và hàm lượng
Viên nén bao phim: 250mg.
2 Dược lực học
Gefitinib là một anilinoquinazoline tổng hợp có tác dụng ức chế sự phosphoryl nội bào của một số tyrosine kinase kết hợp với thụ thể bề mặt xuyên màng như tyrosine kinase của thụ thể tăng trưởng biểu bì (EGFR). EGFR được biểu hiện trên bề mặt của cả tế bào thường và tế bào ung thư và đóng một vai trò trong quá trình tăng trưởng và tăng sinh tế bào. Một số đột biến của EGFR (đột biến mất đoạn exon 19 hoặc đột biến điểm L858R trên exon 21) trong tế bào ung thư phổi không tế bào nhỏ (NSCLC: Non-small Cell Lung Cancer) góp phần thúc đẩy sự phát triển của tế bào khối u, ngăn chặn sự tự chết theo chương trình, tăng sản xuất các yếu tố hình thành mạch máu và tạo thuận lợi cho các quá trình di căn. Gefitinib ức chế thuận nghịch hoạt tính kinase của các kiểu hình đột biến EGFR, ngăn chặn sự tự phosphoryl hóa của các gốc (residues) tyrosin gắn với EGFR, do đó ức chế các tín hiệu phát sinh và ngăn chặn sự sản sinh tế bào. Gefitinib có ái lực với EGFR bị đột biến mất đoạn exon 19 hoặc đột biến điểm L858R trên exon 21 cao hơn ái lực với EGFR thể tự nhiên. Gefitinib cũng ức chế sự truyền tín hiệu qua trung gian yếu tố tăng trưởng giống Insulin (IGF: Insulin-Like Growth Factor) và yếu tố tăng trưởng có nguồn gốc từ tiểu cầu, PDGF (Platelet-Derived Growth Factor) ở các nồng độ có ý nghĩa lâm sàng; tuy nhiên sự ức chế các thụ thể tyrosine kinase khác chưa được mô tả đầy đủ.
3 Dược động học
Gefitinib được hấp thu tương đối chậm, nồng độ đỉnh trong huyết tương đạt được sau khi uống 3 - 7 giờ. Sinh khả dụng tuyệt đối khoảng 60% ở những bệnh nhân ung thư và không bị thay đổi đáng kể bởi thức ăn. Tuy nhiên, trong một thử nghiệm trên những người khỏe mạnh, khi pH dạ dày được duy trì pH > 5, sinh khả dụng của gefitinib giảm 47%, nguyên nhân có thể là do gefitinib tan kém ở PH cao. Gefitinib được phân bố sâu vào trong các mô, với Thể tích phân bố ổn định trung bình là 1 400 lít sau khi tiêm tĩnh mạch. Gefitinib liên kết với Albumin huyết tương và glycoprotein acid alpha, ở tỉ lệ khoảng 90% và không phụ thuộc vào nồng độ thuốc. Gefitinib được chuyển hóa mạnh ở gan, chủ yếu là do CYP3A4 và CYP2D6. Ba vị trí chuyển hóa sinh học của quá trình chuyển hóa gefitinib là: Chuyển hóa của nhóm N-propyl morpholino, demethyl hóa nhóm methoxy trên nhân quinazolin và khử fluor oxy hóa nhóm phenyl halogen. Năm chất chuyển hóa đã được nhận biết đầy đủ trong phân, trong đó chất chuyển hóa chính là O-desmethyl gefitinib chiếm 14% liều dùng ban đầu. Trong số 8 chất chuyển hóa trong huyết tương đã được nhận biết, chất chuyển hóa chính O-desmethyl gefitinib có nồng độ tương đương với gefitinib. Chất chuyển hóa này có hiệu lực trên tế bào chỉ bằng 1/14 mức độ hiệu lực của gefitinib, vì vậy được xem như không đóng góp vào tác động lâm sàng của gefitinib.
Việc dùng gefitinib hàng ngày cho bệnh nhân ung thư dẫn đến sự tích tụ nồng độ gấp đôi so với dùng đơn liều. Nồng độ trong huyết tương ở trạng thái ổn định đạt được trong vòng 10 ngày sau khi dùng liều hàng ngày.
Gefitinib được bài tiết chủ yếu qua phân (86%) ở dạng các chất chuyển hóa, việc thải trừ qua thận chỉ chiếm dưới 4% liều dùng. Nửa đời thải trừ của gefitinib từ 41 - 48 giờ. Tuổi bệnh nhân, trọng lượng cơ thể, chủng tộc hoặc Độ thanh thải creatinin (trên 20 ml/ phút) không có ý nghĩa lâm sàng trong dự đoán nồng độ đỉnh ở trạng thái ổn định của gefitinib. Phân tích dược động học quần thể cho thấy phụ nữ hấp thu gefitinib cao hơn nam giới 27%, tuy nhiên sự khác biệt này không được báo cáo trong các nghiên cứu lâm sàng khác.
4 Chỉ định
Điều trị ung thư phổi không tế bào nhỏ tiến triển tại chỗ (chưa rõ bằng chứng) hoặc di căn có đột biến thụ thể yếu tố tăng trưởng biểu bì, EGFR.
5 Chống chỉ định
Quá mẫn với thuốc. Phụ nữ cho con bú.
6 Thận trọng
Khi xem xét sử dụng gefitinib cần đánh giá sự đột biến của EGFR ở mô khối u trên tất cả các bệnh nhân. Nếu mẫu khối u không thể đánh giá, có thể sử dụng DNA khối u (ctDNA) trong máu. Để tránh các kết luận âm tính giả hoặc dương tính giả, chỉ sử dụng những đánh giá mạnh, đáng tin cậy và nhạy cảm đã được chứng minh để xác định tình trạng đột biến của EGFR ở khối u hoặc ctDNA. Không sử dụng gefitinib cho những bệnh nhân âm tính với đột biến EGFR.
Các nghiên cứu đã chỉ ra một số nhóm người có đáp ứng tốt với gefitinib bao gồm: người gốc Á, những người chưa bao giờ hút thuốc, phụ nữ, bệnh nhân ung thư biểu mô phế quản và những bệnh nhân có đột biến EGFR. Dựa trên những dữ liệu thu được, Hội ung thư lâm sàng Hoa Kỳ (ASCO) khuyến cáo nên sử dụng gefitinib như sự lựa chọn hàng đầu cho những bệnh nhân ở giai đoạn IV có đột biến EGFR. Với những bệnh nhân đột biến gen KRAS, liệu pháp EGFR-TKI không nên sử dụng.
6.1 Bệnh phổi mô kẽ (Interstitial Lung Disease, ILD)
Bệnh phổi mô kẽ, có thể xuất hiện đột ngột, tỉ lệ gặp phải ở bệnh nhân dùng gefitinib là 1,3%, trong số đó có một số trường hợp từ vong. Nếu bệnh nhân xuất hiện các triệu chứng nghiêm trọng về hô hấp như khó thở, ho và sốt, nên ngừng gefitinib và điều trị kịp thời. Trong một nghiên cứu dược lý dịch tễ có đối chứng của Nhất Bản trên 3159 bệnh nhân có ung thư phổi không tế bào nhỏ sử dụng gefitinib hoặc hóa trị liệu được theo dõi trong 12 tuần, các yếu tố nguy cơ sau đây giúp phát triển bệnh phổi mô kẽ (không phân biệt bệnh nhân sử dụng gefitinib hay hóa trị liệu) là: Hút thuốc, tình trạng thể chất kém (PS ≥ 2), giảm thể tích phổi phát hiện nhờ chụp cắt lớp CT (≤ 50%), mới được chẩn đoán ung thư phổi không tế bào nhỏ (< 6 tháng), có tiền sử bệnh phổi mô kẽ, người cao tuổi (55 tuổi) có kèm bệnh tim. Trong số bệnh nhân mắc bệnh phổi mô kẽ ở cả 2 nhóm điều trị, nguy cơ tử vong cao ở nhóm bệnh nhân có các yếu tố nguy cơ sau: Hút thuốc, giảm thể tích phổi phát hiện nhờ chụp cắt lớp CT (≤ 50%), có tiền sử bệnh phổi mô kẽ, người cao tuổi (≥ 65 tuổi) và các vùng dính liền quá rộng với màng phổi (≥ 50%). Nguy cơ mắc bệnh phổi mô kẽ khi dùng gefitinib và hóa trị chủ yếu xuất hiện trong 4 tuần đầu điều trị; sau đó nguy cơ mắc phải thấp hơn.
6.2 Nhiễm độc gan và suy gan
Các bất thường về chức năng gan (tăng ALT, AST, bilirubin) đã được quan sát thấy nhưng ít gặp. Đã có báo cáo một số trường hợp tử vong. Do đó, khi sử dụng gefitinib nên kiểm tra chức năng gan định kỳ. Gefitinib nên được sử dụng thận trọng khi có sự thay đổi chức năng gan từ nhẹ đến trung bình. Nếu trầm trọng hơn, nên ngừng thuốc. Chức năng gan bị suy giảm do xơ gan còn làm tăng nồng độ gefitinib trong huyết tương, do đó làm tăng tác dụng phụ của gefitinib.
6.3 Các trường hợp cần thận trọng hơn
Bệnh nhân có biểu hiện và triệu chứng viêm giác mạc cấp tính hoặc bệnh về mắt như: Viêm mắt, chảy nước mắt, nhạy cảm với ánh sáng, mắt mờ, đau mắt và/hoặc mắt đỏ cần được chuyển đến bác sĩ nhãn khoa. Nếu có triệu chứng viêm loét giác mạc, tạm dừng gefitinib, nếu các triệu chứng không thuyên giảm, hoặc tái phát trở lại khi sử dụng lại gefitinib nên ngừng dùng gefitinib vĩnh viễn.
6.4 Trên da
Gần một nửa số người sử dụng gefitinib có những phản ứng ngoài da. Một số tổn thương da khi dùng gefitinib ở liều 250 mg hàng ngày gồm: mụn trứng cá (25%), khô da (13%), hoại tử biểu bì nhiễm độc (hiếm), hội chứng Stevens-Johnson, hồng ban đa dạng (hiếm) và viêm da bóng nước. Tạm ngưng hoặc ngừng sử dụng thuốc khi các triệu chứng này trở nên trầm trọng hơn, như phồng rộp, tróc da.
Trong 1 nghiên cứu pha I/II sử dụng gefitinib và xạ trị trên 45 bệnh nhân nhi mới được chẩn đoán u thần kinh đệm cuống não hoặc u thần kinh đệm ác tính đã không được cắt bỏ hoàn toàn, có 4 trường hợp xuất huyết ở hệ thần kinh trung ương (trong đó có 1 trường hợp tử vong). Một trường hợp xuất huyết ở hệ thần kinh trung ương ở trẻ u màng não thất (ependymoma) cũng được ghi nhận trong thử nghiệm dùng gefitinib đơn thuần. Không thấy tăng nguy cơ xuất huyết não trên bệnh nhân người trưởng thành mắc ung thư phổi không tế bào nhỏ đang dùng gefitinib.
Tiêu chảy xảy ra ở 48% bệnh nhân dùng gefitinib liều 250 mg/ ngày; 13% buồn nôn và 12% nên khi dùng gefitinib.
Thủng Đường tiêu hóa đã được báo cáo ở những bệnh nhân dùng gefitinib. Trong hầu hết các trường hợp, có liên quan đến các yếu tố nguy cơ khác, như: Dùng phối hợp với steroid hoặc NSAID, tiền sử loét dạ dày ruột, tuổi, hút thuốc hoặc ung thư di căn đến ruột. Ảnh hưởng đến khả năng lái xe và vận hành máy. Thuốc có thể gây mệt mỏi, suy nhược, do đó nên thận trọng khi lái xe hoặc vận hành máy.
7 Thời kỳ mang thai
Không có dữ liệu nào về việc sử dụng gefitinib ở phụ nữ mang thai. Các nghiên cứu trên động vật đã cho thấy độc tính sinh sản (tử vong sơ sinh sớm sau khi sinh, giảm số con sinh ra còn sống và giảm khối lượng bào thai ở động vật). Không nên dùng getifinib trong thời gian mang thai trừ khi cần thiết.
8 Thời kỳ cho con bú
Chưa có báo cáo về việc gefitinib có tiết vào sữa mẹ hay không. Tuy nhiên gefitinib và các chất chuyển hóa của gefitinib được chứng minh là tích lũy trong sữa của chuột đang cho con bú. Gefitinib chống chỉ định trong thời gian cho con bú và do đó bệnh nhân phải ngưng cho con bú khi sử dụng gefitinib.
9 Tác dụng không mong muốn (ADR)
9.1 Thường gặp
Toàn thân: sốt, suy nhược.
Da, mỏng: mụn trứng cá, khô da, phản ứng ngoài da, ngứa, phát ban, các bệnh về móng.
Mắt viêm bờ mi, viêm kết mạc, khô mắt.
Tiêu hóa: tiêu chảy, khô miệng, chán ăn.
Gan, thận, phổi: tăng enzym gan. Máu niệu, protein niệu. Bệnh phổi mô kẽ.
Cơ - xương: mệt mỏi, yếu cơ.
Khác: chảy máu cam.
9.2 Ít gặp
Trầy xước giác mạc, viêm tụy.
9.3 Hiếm gặp
Viêm gan, hoại tử thượng bì nhiễm độc.
Chưa xác định được tần suất
Máu: tăng acid uric huyết, nghẽn mạch do huyết khối.
Tiêu hóa: buồn nôn, nôn, viêm niêm mạc miệng.
Khác: hội chứng tiêu khối u, rụng tóc, ức chế tủy xương.
10 Liều lượng và cách dùng
10.1 Cách dùng
Gefitinib được dùng đường uống vào thời gian nhất định trong ngày, không quan tâm đến bữa ăn. Nếu không thể uống cả viên, phân tán viên trong 120 - 240 ml nước (nước không chứa carbonat, không sử dụng chất lỏng khác) khuấy trong khoảng 15 phút. Sau đó, uống hỗn dịch thu được ngay lập tức hoặc dùng qua ống mũi - dạ dày. Tráng cốc với lượng nước tương tự và uống ngay hoặc dùng qua ống mũi - dạ dày.
Sử dụng cho trẻ em: Do chưa được xác định về hiệu quả và an toàn ở trẻ em dưới 18 tuổi, gefitinib không được chỉ định sử dụng cho trẻ em.
10.2 Liều lượng
Uống 250 mg/lần, 1 lần/ngày. Trường hợp bệnh nhân quên uống thuốc và thời gian đến liều tiếp theo lớn hơn 12 giờ, bệnh nhân cần uống ngay liều đã bỏ quên. Không uống liều bỏ quên nếu thời gian còn ít hơn 12 giờ. Không dùng liều gấp đôi (hai liều cùng một lúc) để bù đắp cho một liều bỏ quên.
Suy gan: Bệnh nhân suy gan từ trung bình đến nặng (Child-Pugh B hoặc C) do xơ gan có nồng độ gefitinib trong huyết tương tăng. Những bệnh nhân này nên được theo dõi chặt chẽ các phản ứng phụ. Nồng độ gefitinib huyết tương không tăng ở những bệnh nhân tăng AST, phosphatase kiềm hoặc bilirubin do ung thư di căn vào gan.
Suy thận: Không cần điều chỉnh liều khi Clcr > 20 ml/phút. Hạn chế và thận trọng khi sử dụng ở những bệnh nhân có Clcr ≤ 20 ml/phút.
Người cao tuổi: Không cần điều chỉnh liều,
Chuyển hóa CYP2D6 kém: Không cần điều chỉnh liều, tuy nhiên nên được theo dõi chặt chẽ tác dụng phụ.
Điều chỉnh liều do độc tỉnh: Đối với những bệnh nhân bị tiêu chảy (dung nạp thuốc kém), các bệnh về mắt (viêm giác mạc vừa đến nặng), triệu chứng hô hấp (khó thở, ho, sốt) hoặc gặp phản ứng phụ trên da có thể được điều trị thành công bằng cách sử dụng liệu pháp ngắt đoạn ngắn (lên đến 14 ngày) sau đó dùng lại với liều 250 mg. Đối với bệnh nhân không thể dung nạp gefitinib sau liệu pháp ngắt đoạn, nên ngừng sử dụng gefitinib. Những bệnh nhân bị thủng đường tiêu hóa nên ngừng dùng thuốc.
11 Tương tác thuốc
Thuốc gây cảm ứng CYP3A4 (như Phenytoin, carbamazepin, Rifampicin, các barbiturat hoặc các chế phẩm thảo mộc có chứa có St. John - Hypericum perforatum): Có thể làm tăng chuyển hóa và làm giảm nồng độ trong huyết tương của gefitinib, nên làm giảm hiệu quả điều trị của gefitinib. Cầu. tăng liều gefitinib mới đạt được kết quả điều trị.
Thuốc ức chế CYP3A4: Ở những bệnh nhân có kiểu gen CYP2D6 chuyển hóa kém, khi phối hợp gefitinib với thuốc ức chế CYP3A4 (như itraconazol, ketoconazol, posaconazol, voriconazol, Clarithromycin, telithromycin, thuốc ức chế protease) có thể làm giảm chuyển hóa và làm tăng nồng độ gefitinib trong huyết tương, làm tăng tác dụng phụ.
Warfarin: Tương tác thuốc mạnh có thể xảy ra khi sử dụng đồng thời gefitinib và warfarin, ví dụ như làm tăng tỉ lệ chỉ số bình thường hóa quốc tế hay chảy máu. Những bệnh nhân dùng đồng thời warfarin và gefitinib nên được theo dõi sự thay đổi thời gian prothrombin hoặc INR thường xuyên.
Thuốc ảnh hưởng đến tiết acid dạ dày: Khi sử dụng gefitinib cùng với những thuốc làm tăng kéo dài pH dạ dày ở mức cao (như thuốc ức chế bơm proton hay thuốc đối kháng thụ thể H,) có thể làm giảm nồng độ gefitinib trong huyết tương, từ đó làm giảm hiệu quả điều trị gefitinib.
Thuốc chống ung thư: Sử dụng đồng thời gefitinib có thể làm trầm trọng thêm tình trạng giảm bạch cầu do vinorelbin gây ra.
12 Quá liều và xử trí
Không có trị liệu đặc biệt trong trường hợp quá liều gefitinib và chưa xác định được các triệu chứng quá liều. Tuy nhiên, trong nghiên cứu lâm sàng pha I, một số ít bệnh nhân đã được điều trị bằng liều lên đến 1.000 mg/ngày. Đã ghi nhận sự tăng tần suất và mức độ trầm trọng của một số phản ứng ngoại ý, chủ yếu là tiêu chảy và ban đỏ da. Các phản ứng ngoại ý do dùng quá liều nên được điều trị triệu chứng, đặc biệt tình trạng tiêu chảy nặng nên được kiểm soát thích hợp.
Cập nhật lần cuối: 2017.