Enfortumab Vedotin
1 sản phẩm
 Dược sĩ Hoàng Bích Dược sĩ lâm sàng
Dược sĩ Hoàng Bích Dược sĩ lâm sàng
Ước tính: 1 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
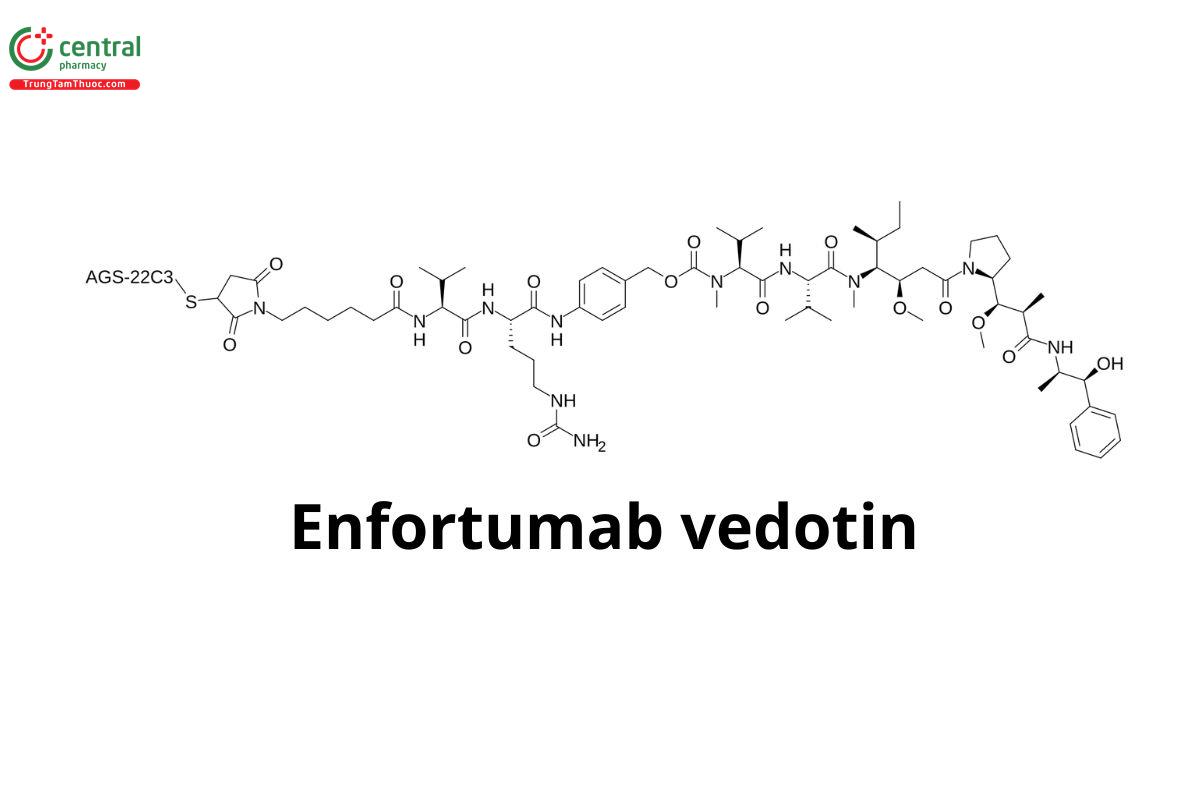
Tên chung quốc tế: Enfortumab Vedotin
Biệt dược thường gặp: Padcev
Phân loại: Các kháng thể đơn dòng khác và các liên hợp thuốc kháng thể
Mã ATC: L01FX13
1 Dạng thuốc và hàm lượng
Bột pha tiêm truyền tĩnh mạch chứa hàm lượng 20 mg, 30mg Enfortumab Vedotin.
2 Dược lực học
Enfortumab Vedotin là một tác nhân chống ung thư phá hủy các tế bào khối u bằng cách ức chế khả năng nhân lên của chúng.
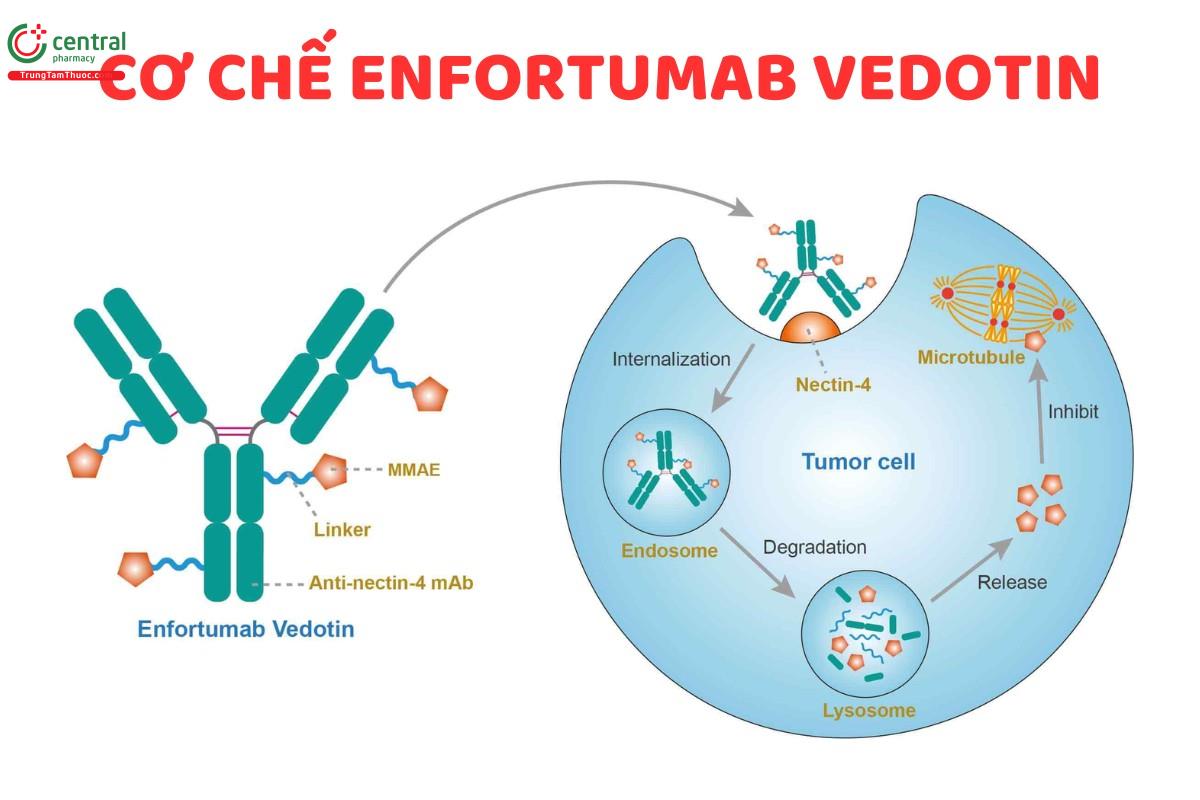
Enfortumab Vedotin là một liên hợp kháng thể-thuốc bao gồm nhiều thành phần, trong đó chứa một kháng thể đơn dòng hoàn toàn của con người hướng đến Nectin-4, một protein kết dính ngoại bào được biểu hiện nhiều trong ung thư biểu mô tiết niệu, gắn với một tác nhân phá vỡ vi ống hóa trị liệu, monomethyl auristatin E (MMAE).
Hai thành phần này được nối với nhau thông qua một liên kết có thể phân cắt bằng protease. Enfortumab Vedotin liên kết với các tế bào biểu hiện Nectin-4 và phức hợp enfortumab-Nectin-4 rồi đưa vào bên trong tế bào. Khi đã vào bên trong tế bào, MMAE được giải phóng khỏi Enfortumab Vedotin thông qua quá trình phân cắt bằng protein và tiếp tục phá vỡ mạng lưới vi ống bên trong tế bào, ngăn chặn chu kỳ tế bào và cuối cùng gây ra apoptosis - gây chết tế bào.
3 Dược động học
3.1 Hấp thu
Sau khi kết thúc truyền dịch: Nồng độ MMAE trong huyết tương đạt đỉnh sau 1-3 ngày .
3.2 Phân bố
Tỷ lệ liên kết MMAE với protein huyết tương đạt 68-82%. Thể tích phân phối trạng thái ổn định ước tính là 11L.
3.3 Chuyển hoá
- Chưa có nghiên cứu quá trình chuyển hoá Enfortumab Vedotin ở người.
- MMAE được giải phóng khỏi Enfortumab Vedotin thông qua quá trình phân cắt bằng protease nội bào và được chuyển hóa chủ yếu bởi CYP3A4.
3.4 Thải trừ
- Chưa được mô tả đầy đủ. Có thể suy ra từ từ một liên hợp thuốc-kháng thể chứa MMAE khác: 7% tổng lượng MMAE được dùng được tìm thấy trong phân và 6% được tìm thấy trong nước tiểu, chủ yếu dưới dạng thuốc không đổi, trong khoảng thời gian 1 tuần.
- Thời gian bán thải của Enfortumab Vedotinvà MMAE lần lượt là 3,4 ngày và 2,4 ngày.
- Độ thanh thải trung bình của Enfortumab Vedotin và MMAE tự do lần lượt là 0,10 L/h và 2,7 L/h.
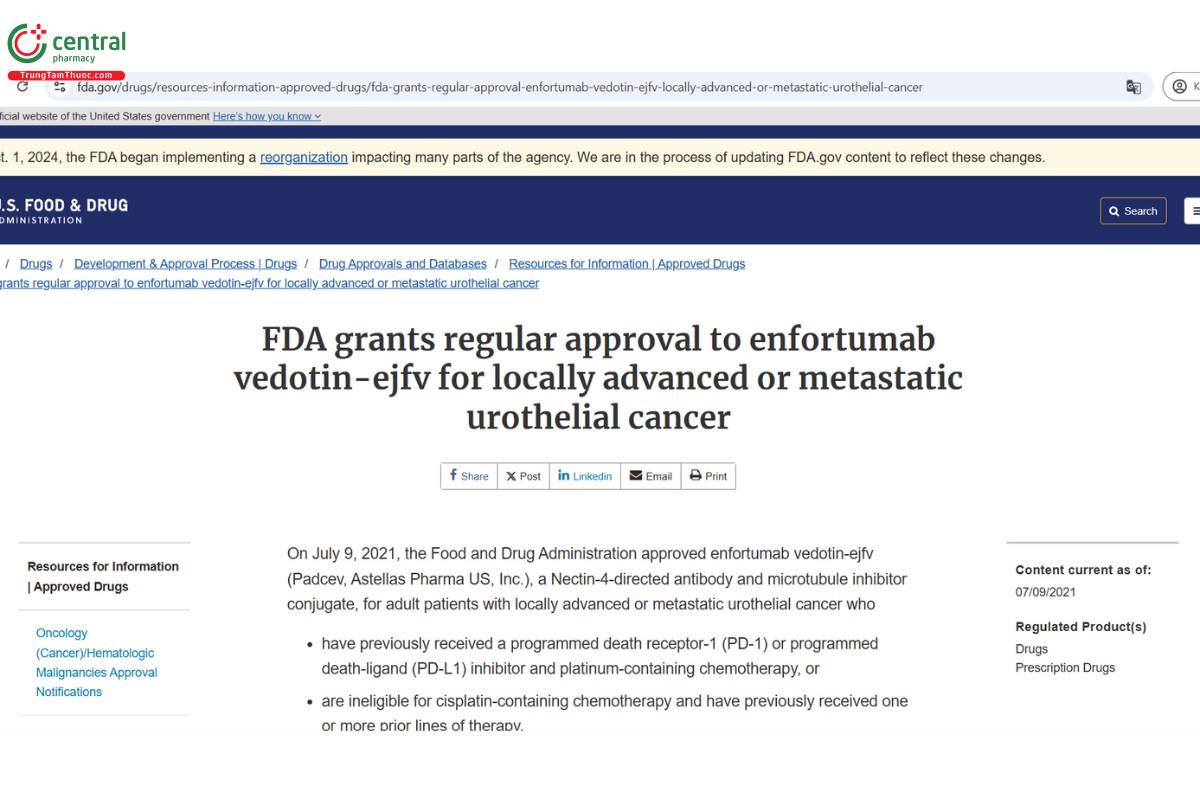
4 Chỉ định
Ngày 9 tháng 7 năm 2021, Cục Quản lý Thực phẩm và Dược phẩm đã phê duyệt enfortumab vedotin-ejfv (Padcev, Astellas Pharma US, Inc.), được phép dùng cho bệnh nhân trưởng thành mắc ung thư biểu mô tiết niệu di căn hoặc tiến triển tại chỗ, bao gồm:
Người đã từng được điều trị bằng chất ức chế thụ thể chết theo chương trình-1 (PD-1) hoặc chất ức chế phối tử chết theo chương trình (PD-L1) và hóa trị liệu có chứa platinum.
Người không đủ điều kiện để điều trị bằng hóa trị liệu có chứa Cisplatin và đã từng được điều trị bằng một hoặc nhiều phương pháp trước đó.
Có thể kết hợp với pembrolizumab, để điều trị cho bệnh nhân trưởng thành bị ung thư biểu mô niệu quản di căn hoặc tiến triển tại chỗ không đủ điều kiện để điều trị bằng hóa trị liệu có chứa cisplatin.
5 Chống chỉ định
Không dùng cho người mẫn cảm với bất kỳ thành phần nào của Enfortumab Vedotin.
6 Liều dùng - Cách dùng
6.1 Liều dùng
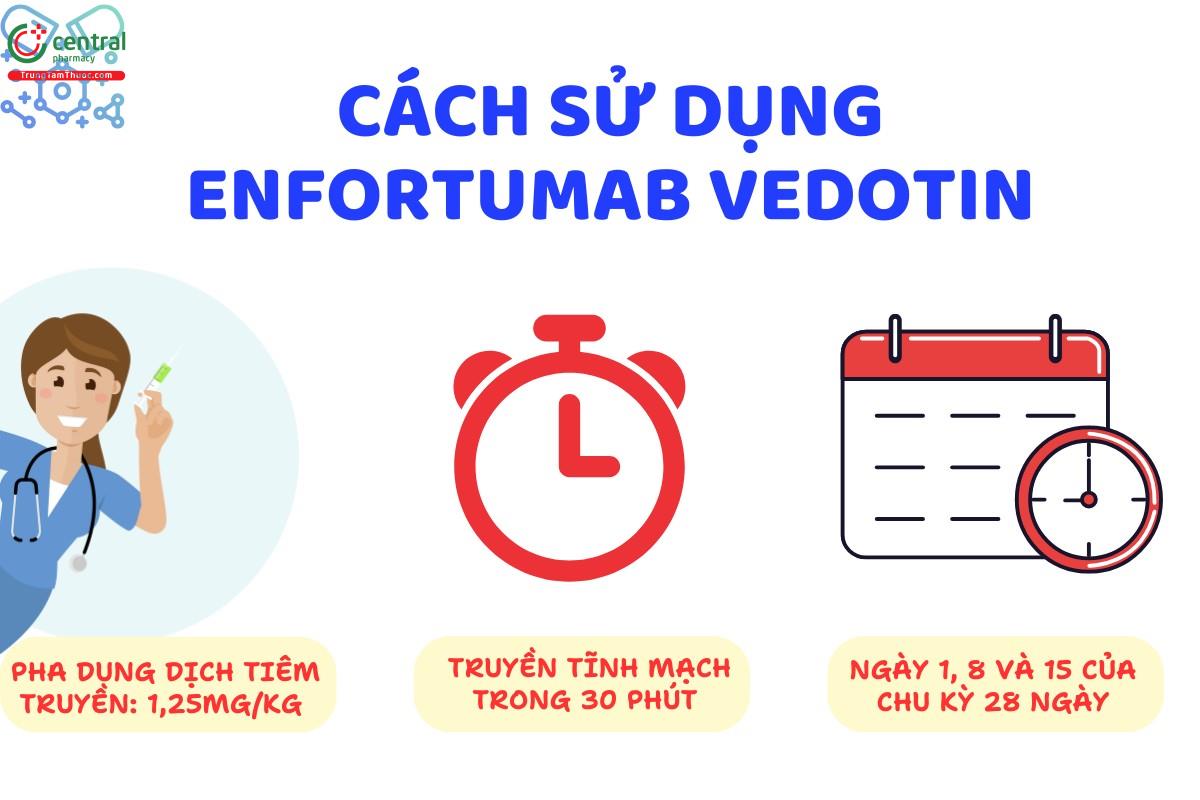
Đối với người lớn mắc bệnh ung thư biểu mô tiết niệu: 1,25 mg/kg.
Liều tối đa bệnh nhân nặng 100 kg trở lên: 125mg.
6.2 Cách dùng
Pha bột để tiêm truyền tĩnh mạch. Pha loãng với các Dung dịch sau:
- Nước vô trùng
- Tiêm Dextrose 5%
- Thuốc tiêm Natri clorid 0,9%
- Thuốc tiêm Lactated Ringer
Truyền tĩnh mạch trong 30 phút vào Ngày 1, Ngày 8 và Ngày 15 của chu kỳ 28 ngày.
7 Tác dụng không mong muốn
Các tác dụng phụ thường gặp của Enfortumab Vedotin có thể bao gồm:
- Lượng đường trong máu cao (khát nước, miệng khô, đi tiểu nhiều…)
- Tê hoặc ngứa ran.
- Yếu cơ ở tay và chân.
- Khó thở, mệt mỏi.
- Buồn nôn, tiêu chảy.
- Chán ăn, sụt cân.
- Phát ban, da khô, ngứa.
- Thay đổi về vị giác.
- Rụng tóc.
- Tình trạng máu bất thường: số lượng tế bào máu thấp, chảy máu bất thường…
- Đau, đỏ và bong tróc da ở tay hoặc chân.
- Khô mắt nghiêm trọng, các vấn đề về thị lực.
- Đỏ, ngứa, sưng hoặc khó chịu ở nơi tiêm thuốc.
8 Tương tác thuốc
Đến hiện nay vẫn chưa có nghiên cứu chính thức về vấn đề tương tác thuốc. Khi muốn dùng chung với sản phẩm khác hoặc nếu thấy dấu hiệu bất thường thì hãy tham khảo ý kiến của bác sĩ.
9 Thận trọng
Không nên sử dụng cho bệnh nhân suy gan từ trung bình đến nặng vì các liên hợp thuốc-kháng thể chứa MMAE khác đã chứng minh tỷ lệ tác dụng phụ tăng lên ở những bệnh nhân suy gan từ trung bình đến nặng.
Padcev có thể gây phát ban da nghiêm trọng hoặc đe dọa tính mạng bao gồm hội chứng Stevens-Johnson (SJS) và hoại tử biểu bì nhiễm độc (TEN). Thông báo ngay cho bác sĩ nếu bạn có những dấu hiệu da bất thường.
Cần kiểm tra lượng đường trong máu thường xuyên vì Enfortumab Vedotin có thể gây ra lượng đường trong máu cao dẫn đến nguy hiểm đến tính mạng. Nếu lượng đường trong máu tăng trên 250 mg/dL thì nên ngừng sử dụng.
Đã có báo cáo về tình trạng bị viêm phổi/bệnh phổi kẽ (ILD) và bệnh thần kinh ngoại biên nghiêm trọng khi sử dụng thuốc
Kiểm tra mắt định kỳ và có thể sử dụng thêm thuốc nhỏ mắt vì Enfortumab Vedotin cũng có thể gây khô mắt, thay đổi thị lực và các rối loạn mắt khác.
Phản ứng tại vị trí truyền như đỏ, ngứa, sưng hoặc khó chịu cũng có thể xảy ra.
Enfortumab Vedotin có thể gây hại cho thai nhi. Vì vậy nên sử dụng biện pháp tránh thai đối với Phụ nữ trong độ tuổi sinh đẻ và nam giới có bạn tình có khả năng mang thai.
Chưa báo cáo Enfortumab Vedotin có an toàn và hiệu quả ở trẻ em hay không, vì vậy không nên sử dụng.
10 Thời kỳ mang thai và cho con bú
10.1 Phụ nữ mang thai
Enfortumab Vedotin có thể gây hại cho thai nhi nên không sử dụng cho phụ nữ mang thai. Thông báo ngay cho bác sĩ nếu bạn có thai trong thời gian dùng thuốc.
Nếu bạn là phụ nữ, bạn có thể cần xét nghiệm thai kỳ để đảm bảo bạn không mang thai. Sử dụng biện pháp tránh thai trong khi sử dụng thuốc này và ít nhất 2 tháng sau liều cuối cùng.
Nếu bạn là nam giới, hãy sử dụng biện pháp tránh thai nếu bạn tình của bạn có khả năng mang thai. Tiếp tục sử dụng biện pháp tránh thai trong ít nhất 4 tháng sau liều cuối cùng.
Khả năng mang thai của phụ nữ sẽ khó hơn khi sử dụng thuốc này.
10.2 Phụ nữ cho con bú
Khi sử dụng thuốc thì không nên cho con bú và ít nhất 3 tuần sau liều cuối cùng.
11 Bảo quản
Enfortumab Vedotin chưa mở hoặc đã pha dung dịch tiêm truyền được bảo quản trong tủ lạnh ở nhiệt độ từ 2ºC đến 8ºC. Không đông lạnh. Không lắc.
Sau khi pha xong, hãy cho Enfortumab Vedotin vào túi truyền ngay lập tức. Các lọ đã pha bảo quản trong tối đa 24 giờ. Vứt bỏ các lọ chưa sử dụng cùng với dung dịch đã pha xong sau thời gian bảo quản khuyến nghị (24 giờ).
Padcev là một loại thuốc nguy hiểm. Thực hiện tất cả các quy trình xử lý và thải bỏ đặc biệt có liên quan.
12 Quá liều
Chưa có báo cáo về tình trạng trên. Nếu quá liều ngay lập tức ngừng thuốc và thông báo cho nhân viên y tế để được xử lý kịp thời.
13 Tài liệu tham khảo
1. Chuyên gia Drugbank. Enfortumab Vedotin. Drugbank. Truy cập ngày 26 tháng 12 năm 2024.
2. Chuyên gia Drugs.com. Enfortumab Vedotin. Drugs.com. Truy cập ngày 26 tháng 12 năm 2024.
3. Chuyên gia Pubchem. Enfortumab Vedotin. Pubchem.Truy cập ngày 26 tháng 12 năm 2024
4. Chuyên gia FDA. FDA grants regular approval to enfortumab vedotin-ejfv for locally advanced or metastatic urothelial cancer. FDA. Truy cập ngày 26 tháng 12 năm 2024.





