dsRNA (RNA sợi kép)
1 sản phẩm
 Dược sĩ Thu Hà Dược sĩ lâm sàng
Dược sĩ Thu Hà Dược sĩ lâm sàng
Ước tính: 5 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
RNA sợi kép hay dsRNA là RNA mà có hai sợi bổ sung, giống với DNA, và là vật liệu di truyền ở một số virus (virus có RNA sợi kép, double-stranded RNA viruses), được ứng dụng trong y học với vai trò kích thích miễn dịch tiềm năng của mình. Trong bài viết này, Trung Tâm Thuốc Central Pharmacy xin gửi đến bạn đọc thông tin về dsRNA.
1 Giới thiệu
1.1 dsRNA là gì? Cấu trúc dsRNA
Kể từ đề xuất ban đầu của thế giới RNA hơn 50 năm trước, trong đó công nhận RNA là loại polyme sinh học duy nhất để duy trì các dạng sống nguyên thủy, sự hiểu biết của chúng ta về chức năng của RNA đã được mở rộng rất nhiều.
dsRNA được xác định là vật liệu di truyền ở một số loài virus (virus có RNA sợi kép, double-stranded RNA viruses).
dsRNA cũng đang được xem xét như một tác nhân làm thay đổi kiểu biểu hiện gen và thay đổi sinh lý tế bào, đồng thời là một tác nhân trị liệu tiềm năng trong việc chống lại bệnh tật.
Vai trò chức năng đa dạng của dsRNA đã thúc đẩy các nghiên cứu chuyên sâu về các quá trình sinh hóa có liên quan đến dsRNA.
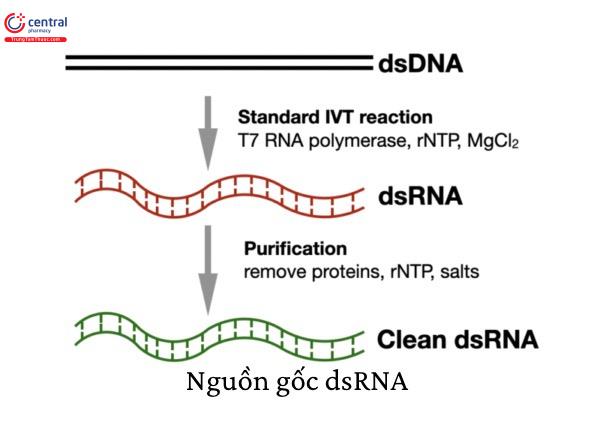
1.2 Nguồn gốc của dsRNA
Chuỗi xoắn kép RNA là mô típ cấu trúc phổ biến ở các sinh vật sống; đã được xác định trong nhiều loại tế bào nhân chuẩn dường như bình thường và có liên quan đến đặc tính 'sát thủ' của một số chủng Saccaromyces cerevisiae.
Các phân tử này được tạo ra bằng một số con đường sinh tổng hợp và sau đó bị phân hủy, biến tính hoặc biến đổi đặc biệt bởi các hoạt động của enzyme.
RNA sợi đôi xuất hiện trong nhiều quá trình sinh học. Nhiều loại virus có nhiễm sắc thể dsRNA, khi nhiễm trùng biểu hiện mã hóa của chúng
Sau khi bị nhiễm virus RNA chuỗi đơn (ss), dsRNA được tạo ra như một sản phẩm phụ có thể xảy ra của quá trình sao chép.
dsRNA cũng có thể phát sinh từ quá trình phiên mã đối xứng của DNA virus, sau đó là quá trình ủ RNA-RNA.
2 Cấu trúc và tính chất
2.1 Cấu trúc của dsRNA
2.1.1 Cấu trúc phân tử
RNA sợi kép (dsRNA) là 1 loại RNA, có cấu trúc chuỗi xoắn kép thuận, phải ngược chiều và song song nhay, trong đó hai cặp bazơ Watson-Crick (G-C và A-U) chiếm ưu thế.
Cấu trúc thứ cấp dsRNA là khuôn để tổng hợp RNA bổ sung, tạo ra các tương tác cấp ba nhằm thiết lập và ổn định hình dạng ba chiều
Nhiều nghiên cứu ban đầu về cấu trúc đã phát hiện dsRNA thường ngắn hơn, có tính không ổn định về cấu trúc do tính không chắc chắn và bị ảnh hưởng nhiều bởi môi trường. Điều này dẫn đến kết luận rằng chuỗi xoắn kép RNA có cấu trúc bảo toàn.
Các phần tử dsRNA nội phân tử hiện diện trong các cấu trúc kẹp tóc cục bộ hoặc được tạo ra thông qua việc ghép cặp bazơ ở khoảng cách xa
Ngoài ra cấu trúc phân tử cũng có thể thay đổi; thông qua việc ghép cặp bazơ giữa các bản phiên mã độc lập, chẳng hạn như sự liên kết của các RNA đối nghĩa với mục tiêu của chúng (Phần VII, B).

2.1.2 Cấu trúc của dsRNA ở cấp độ nguyên tử
dsRNA bao gồm hai chuỗi phản song song tham gia vào một chuỗi xoắn kép thuận tay phải. Ngược lại với các họ DNA xoắn kép khác nhau, dsRNA hiển thị mô-đun xoắn A, thể hiện bước xoắn ốc gấp 11 lần
2.2 Tính chất phân tử của dsRNA
Một số nghiên cứu đã chỉ ra rằng dsRNA tương đối kém linh hoạt so với DNA. Độ cứng lớn hơn phản ánh độ cứng về hình dạng của vòng ribose, được tạo ra bởi nhóm 2'-hydroxyl
Điện di RNA sợi đôi chậm hơn so với DNA tương ứng. Khả năng di chuyển chậm hơn có thể phát sinh do lượng ngưng tụ phản ion lớn hơn với dsRNA so với DNA
Chuỗi RNA bị phá vỡ trong Dung dịch trong điều kiện DNA ổn định. Nhóm 2'-hydroxyl hoạt động như một nucleophile bên trong, tấn công liên kết phosphodiester phụ và thay thế oxy 5' của nucleotide 3' lân cận
3 Nhận biết protein của dsRNA
3.1 Liên kết với các chuỗi axit nucleic khác
dsRNA liên kết với các chuỗi axit nucleic khác thông qua các cơ chế sau:
(i) liên kết hydro qua trung gian nhóm 2'-hydroxyl
(ii) sự phối hợp giữa các phân tử của photphat bằng cầu nối ion kim loại hóa trị hai
(iii) bazơ -các tương tác cơ bản trong rãnh chính
3.2 Sự phân cắt bằng enzyme của dsRNA
Có một số con đường mà qua đó dsRNA có thể bị phân hủy:
(i) Một enzyme có thể thực hiện sự phân cắt kép có phối hợp và không đặc hiệu của chuỗi xoắn kép;
(ii) Một enzyme có thể liên kết trực tiếp và tạo ra các vết cắt ngẫu nhiên ở một trong hai chuỗi, cuối cùng tạo ra các đoạn dsRNA nhỏ, không ổn định;
(iii) Một enzyme đặc hiệu ssRNA có thể liên kết thuận nghịch với các vùng nóng chảy cục bộ, sau đó tách các đoạn chuỗi đơn;
(iv) Một exonuclease (3'5' hoặc 5'→ 3') có thể tấn công các đầu của sợi song công và làm suy giảm từng sợi;
(v) Một helicase RNA có thể chuyển đổi dsRNA thành các loại sợi đơn, sau đó sẽ bị phân hủy bởi các exo- hoặc endocupula đặc hiệu ssRNA
(vi) dsRNA có thể được biến đổi về mặt enzyme do đó làm suy yếu hoặc phá hủy cấu trúc song công hoặc cung cấp tín hiệu nhận dạng cho exo- hoặc cụ thể. end-nuclease.
3.2.1 Ribonuclease III
Ribonuclease III là endoribonuclease đặc hiệu dsRNA đầu tiên được phát hiện
Quá trình thủy phân dsRNA được xúc tác bởi RNase III rõ ràng được tiến hành thông qua sự phân tách kép phối hợp (nhưng có lẽ không được phối hợp). Nhiều chất nền RNase III tự nhiên, còn được gọi là tín hiệu xử lý, biểu hiện những sai lệch cụ thể so với cấu trúc dsRNA thông thường tại hoặc gần vị trí phân cắt
3.2.2 Ribonuclease nọc rắn hổ mang (RNase V1)
RNase V1 là một trong một số hoạt động nuclease có trong nọc độc của rắn hổ mang Trung Á, Naja naja oxiana. RNase V1 ưu tiên làm suy giảm dsRNA nhưng cũng cắt ssRNA xoắn ốc, trong khi DNA không phải là cơ chất
Các nghiên cứu về RNase A liên kết với DNA xoắn kép (cho phép đo liên kết enzyme mà không cần phân tách) đã chứng minh rằng RNase A liên kết và ổn định các vùng chuỗi đơn cục bộ. Do đó, RNase A và các họ hàng của nó có thể được coi là các protein làm tan chảy axit nucleic có thể liên kết với dsRNA
4 Chức năng dsRNA ở Prokaryote
Các chức năng này bao gồm từ một thông điệp đơn giản mang một mảng mã di truyền tuyến tính đến một nhân tố tích cực trong việc điều hòa phiên mã, tổng hợp protein, cảm nhận chất dinh dưỡng và nhiều quá trình sinh học khác
4.1 Điều hòa gen bằng Ribonuclease III
RNase III điều chỉnh sự biểu hiện của các thành phần liên quan đến dòng thông tin di truyền (tức là tổng hợp, trưởng thành, chức năng và phân rã của RNA); tách các RNA được mã hóa bởi phage T7 và họ hàng của nó, cũng như các bản phiên mã của phage T4 và lambda
Hoạt động RNase III có thể được kiểm soát thông qua sửa đổi cộng hóa trị. RNase III được phosphoryl hóa trên serine trong tế bào bị nhiễm T7 bởi protein kinase được mã hóa phage, giúp tăng cường hoạt động xử lý
4.2 Quy định về trình tự "đối nghĩa" (antisense)
Các RNA liên kết với các trình tự đối nghĩa bổ sung trong các RNA mục tiêu, tạo thành các cấu trúc song công RNA RNA cụ thể, có thể làm thay đổi chức năng đích.
RNA antisense có thể được tạo ra thông qua phiên mã toàn bộ hoặc một phần chuỗi bổ sung gen mục tiêu hoặc được biểu hiện từ một locus không liên kết.
RNA antisense prokaryotic hoạt động chủ yếu như các yếu tố điều hòa tiêu cực. Ví dụ, liên kết antisense RNA có thể cô lập trực tiếp vùng khởi đầu dịch mã mRNA hoặc ức chế chức năng RNA đích thông qua cơ chế allosteric.
4.2.1 Kiểm soát sao chép ColEl Plasmid
Việc bắt đầu sao chép plasmid ColE1 đòi hỏi phải hình thành mồi RNA, được kiểm soát âm tính bởi RNA antisense
4.2.2 Điều khiển sao chép plasmid R1
Sự sao chép của plasmid R1 phụ thuộc vào sự tổng hợp protein RepA được mã hóa bằng plasmid, tham gia vào bước khởi đầu
4.2.3 Quy định biểu hiện gen killer-gene plasmid
Một số plasmid được duy trì thông qua sự biểu hiện của các gen tiêu diệt, sản phẩm của chúng tiêu diệt các chất phân tách không có plasmid
Rl plasmid hok mRNA mã hóa protein Hok (tiêu diệt vật chủ), gây chết tế bào bằng cách làm hỏng màng tế bào chất. Một bản phiên mã antisense, được gọi là RNA Sok (chất ức chế tiêu diệt), điều chỉnh giảm sự biểu hiện protein Hok
Việc tiêu diệt các tế bào thiếu plasmid R1 phụ thuộc vào (i) sự tồn tại của các RNA sok và hok/mok trong các chất phân tách và (ii) tốc độ phân rã RNA khác biệt
4.2.4 Kiểm soát biểu hiện Transpose IS10
Chuyển động của transposon Tn10 được điều hòa âm ở cấp độ tịnh tiến bởi bản phiên mã antisense 70-nt, được gọi là RNA-OUT
RNA-OUT bổ sung cho phần cuối 5’ của transposease mRNA (RNA-IN). RNA-OUT liên kết với RNA-IN tạo ra một song công khoảng 35-bp, ngăn chặn sự dịch mã bằng cách cô lập trực tiếp TIR của cistron transposease
4.2.5 Kiểm soát tổng thể ở lambda vi khuẩn
Phage lambda biểu hiện bản phiên mã 77-nt (OOP RNA) bổ sung cho đoạn 55-nt chứa đầu 3’ của gen lambda cII và 22 nucleotide liền kề trong vùng xen kẽ gen cII-O
5 Vai trò miễn dịch
5.1 Miễn dịch tự nhiên
RNA sợi đôi (dsRNA) có liên quan đến hầu hết các trường hợp nhiễm virus - nó cấu thành bộ gen của virus (trong trường hợp virus dsRNA) hoặc được tạo ra trong tế bào chủ trong quá trình nhân lên của virus. Do đó, gần như tất cả các sinh vật đều có khả năng nhận biết dsRNA và tạo ra phản ứng, mục đích chính là giảm thiểu khả năng lây nhiễm
Một trong những cơ chế được bảo toàn nhất mà qua đó các tế bào cảm nhận được sự nhiễm virus là thông qua việc phát hiện các dsRNA bởi một tập hợp các thụ thể trong hệ thống miễn dịch bẩm sinh kích hoạt các phản ứng miễn dịch chống vi rút và viêm
5.1.1 Virus dsRNA
Virus dsRNA thường cô lập bộ gen song công của chúng trong toàn bộ chu kỳ sao chép và sử dụng các cơ chế bổ sung để ngăn chặn sự kích hoạt miễn dịch bẩm sinh. Ví dụ, cả sự sao chép và phiên mã của reovirus đều xảy ra hoàn toàn bên trong lõi virus mà không để bộ gen dsRNA tiếp xúc với khoang tế bào và hệ thống miễn dịch bẩm sinh của vật chủ

5.1.2 Cảm biến dsRNA
Phản ứng miễn dịch đối với nhiễm virus thường bắt đầu khi dsRNA của virus được phát hiện bởi các protein gắn với dsRNA trong vật chủ
Những cảm biến này bao gồm các thụ thể giống RIG-I (RLR), protein kinase R (PKR), oligoadenylate synthase (OASes), thụ thể giống Toll (TLR) và miền NOD-, LRR- và pyrin chứa 1 (NLRP1)
Được thể hiện rộng rãi trong nhiều loại mô, bao gồm các tế bào biểu mô đường thở, ruột và đường sinh sản, là những vị trí xâm nhập chính của nhiều loại virus.
Khi liên kết với dsRNA, các cảm biến này sẽ kích hoạt vô số phản ứng miễn dịch, bao gồm kích hoạt các con đường truyền tín hiệu chống vi-rút và viêm, ức chế tăng trưởng tế bào và trong một số trường hợp tế bào chết, ức chế hoàn toàn sự nhân lên của virus.
5.1.3 Kích hoạt Protein kinase
Protein kinase được kích hoạt bằng dsRNA (PKR) đóng vai trò chính trong phản ứng của tế bào đối với nhiễm virus.
PKR chứa miền liên kết dsRNA đầu cuối N (dsRBD) và miền kinase đầu cuối C, khi liên kết với dsRNA với độ dài tối thiểu ~33 bp, nó sẽ giảm dần và được kích hoạt bằng quá trình tự phosphoryl hóa,
5.1.4 Tín hiệu cảm ứng dsRNA
- Tín hiệu qua trung gian TLR3
TLR là các glycoprotein màng tích hợp loại I có cấu trúc ba mô bao gồm một miền ngoại bào, một miền xuyên màng duy nhất và miền thụ thể Toll/IL-1 (TIR) nội bào
Khi liên kết với dsRNA, vòng BB của miền TLR3 TIR kết hợp với miền TIR của TRIF kích hoạt một số yếu tố phiên mã, bao gồm yếu tố hạt nhân- B (NF- B), yếu tố điều hòa Interferon 3 (IRF3) và kích hoạt protein 1
- Tín hiệu qua trung gian RLR
RLR là các cảm biến RNA virus tế bào chất với ba thành viên được công nhận bao gồm RIG-I, MDA-5 và LGP2
Các chất này thúc đẩy sản xuất IL-12 và IFN loại I cũng như kích hoạt cả tín hiệu IRF3 và NF-B; điều hòa các tín hiệu apoptotic thông qua kích hoạt ERK
- Tín hiệu qua trung gian NLR thông qua Inflammasome
NLR là PRR nội bào cảm nhận PAMP và tín hiệu nguy hiểm hoặc các mẫu phân tử liên quan đến nguy hiểm (DAMP) do các tế bào bị thương giải phóng
Khi NLR nhận ra tín hiệu nguy hiểm; một phức hợp protein lớn NLR, ASC và pro-caspase-1 sẽ được kích hoạt. Phức hợp này kích hoạt pro-caspase-1 thành dạng hoạt động của caspase-1 và thủy phân pro-IL-1 và pro-IL-18 thành dạng hoạt tính sinh học trưởng thành của chúng ; được tiết ra ngoại bào để đóng vai trò trong phản ứng miễn dịch
5.2 Điều hòa miễn dịch thích ứng thông qua dsRNA
5.2.1 Kích hoạt DC
Sự kích hoạt các tế bào đuôi gai (DC) xảy ra khi cảm nhận được dsRNA. DC thể hiện một loạt PRR bao gồm TLR (TLR3 không được biểu hiện trong DC plasmacytoid), RIG-I và MDA-5 (không có trong DC plasmacytoid), cũng như NLR và có thể nhận ra một loạt vi khuẩn gây bệnh
Sự tương tác của PAMP và PRR trên DC tạo ra sự trưởng thành và kích hoạt của DC thông qua phiên mã, dịch mã và bài tiết các cytokine và chemokine gây viêm
Các DC được kích hoạt, được đặc trưng bởi khả năng trình diện kháng nguyên được nâng cao và được gọi là tế bào trình diện kháng nguyên (APC), di chuyển đến các hạch bạch huyết dẫn lưu và tương tác với các tế bào lympho T và/hoặc B bắt đầu quá trình miễn dịch
Các thụ thể dsRNA bao gồm TLR3 và RIG-I/MDA-5 được biểu hiện ở các DC dòng tủy (mDC) và chủ yếu tạo ra IL-12 và IFN- khi xảy ra sự nhận biết dsRNA
5.2.2 Kích hoạt tế bào Th1
Các tế bào T CD4+ mới được mồi được lập trình bởi nhiều cytokine và các yếu tố khác từ DC và các tế bào miễn dịch bẩm sinh khác để biệt hóa thành tế bào tác động Th1 hoặc Th2 hoặc Th17 hoặc tế bào T điều hòa
5.2.3 Kích hoạt tế bào lympho T gây độc tế bào
Khi được kích thích bởi dsRNA cùng với kháng nguyên cụ thể, các DC được kích hoạt có thể tạo ra sự kích hoạt tế bào lympho T gây độc tế bào CD8+ tế bào lympho T (CTL) đặc hiệu của kháng nguyên thông qua cơ chế trình bày chéo và mồi chéo
Dòng siêu nhỏ NLRP3 có liên quan đến việc kích hoạt CTL.
5.2.4 Kích hoạt tế bào Th17
Tế bào Th17 là một tế bào lympho tiền viêm thuộc tập hợp tế bào Th
Tập hợp con này ưu tiên tạo ra IL-17, IL-17F, IL-22 và IL-21 chứ không phải IFN- hoặc IL-4; cần thiết cho sự phát triển của các tế bào sản xuất IL-17 với sự hiện diện của IL -6 và TGF-
Các tế bào Th17 tạo ra các yếu tố tiền viêm như IL-1, IL-6, IL-8, yếu tố hoại tử khối u (TNF) và metallicoproteinase ma trận; do đó chủ yếu tham gia vào quá trình viêm liên quan đến bạch cầu trung tính chống lại nhiễm trùng nấm và một số vi khuẩn ngoại bào
6 Ứng dụng tiềm năng của dsRNA làm chất bổ trợ cho vắc xin
6.1 Các đặc tính bổ trợ của dsRNA
Miễn dịch bẩm sinh hình thành miễn dịch thích nghi. Các tế bào miễn dịch được kích hoạt trình diện epitope kháng nguyên đặc hiệu liên kết ; kích hoạt, biệt hóa và tăng sinh tế bào T có phản ứng miễn dịch
Là một chất kích hoạt mạnh mẽ cả miễn dịch bẩm sinh và miễn dịch thích nghi, dsRNA được sử dụng đồng thời với kháng nguyên ngoại lai có thể hoạt động như một chất bổ trợ miễn dịch để tạo ra miễn dịch thích ứng đặc hiệu chống lại kháng nguyên ngoại lai dưới dạng dsRNA tổng hợp Poly (I:C)
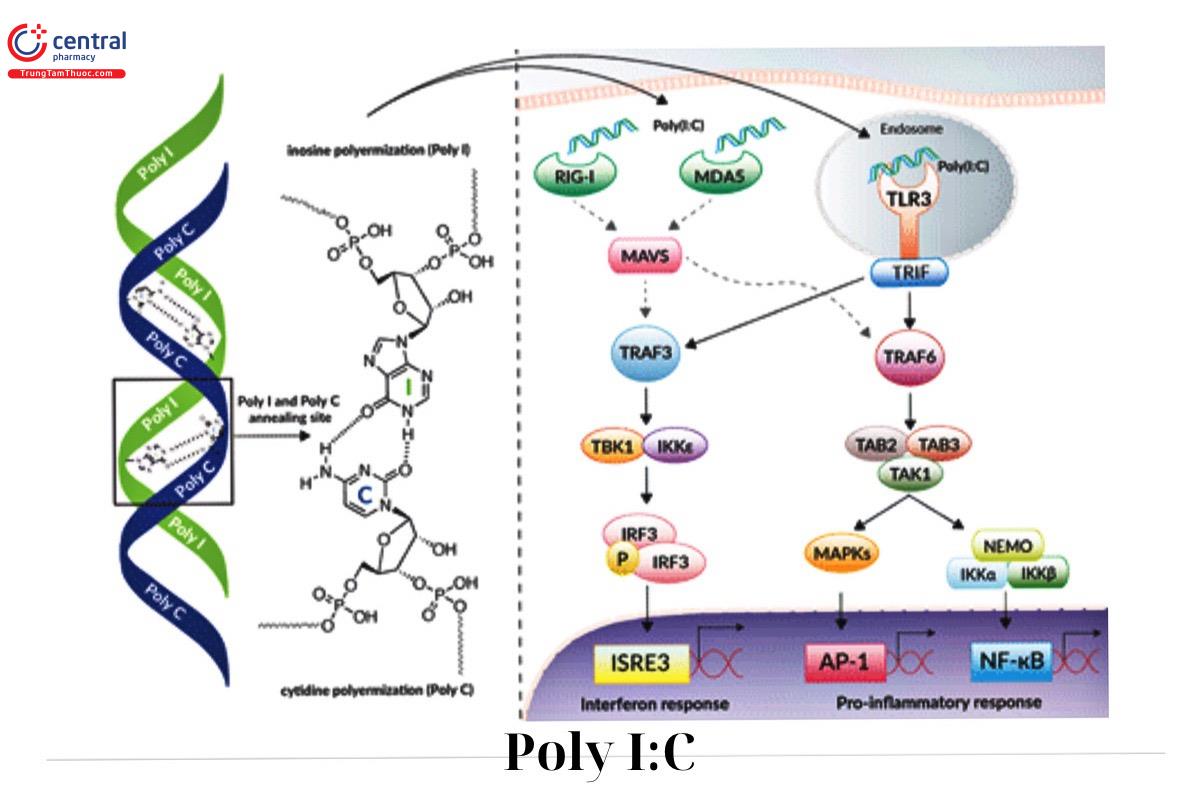
Sau khi kích thích dsRNA, DC sản xuất IFNI; nhân tố chính liên kết khả năng miễn dịch bẩm sinh với khả năng miễn dịch thích ứng
IFN loại 1 có khả năng tạo ra phản ứng tế bào T CD8+ đặc hiệu của kháng nguyên , phản ứng tế bào CD4+ Th1 và tăng cường phản ứng kháng thể chính
Đối với các tế bào T CD8+ của con người , biểu hiện TLR3 mRNA đã được phát hiện trong các tế bào bộ nhớ hiệu ứng và bộ nhớ hiệu ứng của con người nhưng không được phát hiện trong các tế bào T nguyên thủy
Việc bổ sung Poly (I:C) làm tăng đáng kể số lượng IFN- được giải phóng bởi tế bào T CD8+ tác động và/hoặc bộ nhớ tác động để đáp ứng với PHA theo cách phụ thuộc vào liều lượng
6.2 dsRNA là chất bổ trợ cho vắc-xin chống nhiễm vi-rút
Hầu hết các nghiên cứu cho rằng các chất tương tự dsRNA dựa trên Poly (I:C) thể hiện đặc tính bổ trợ Th1 có khả năng kích hoạt các tế bào T CD4+ và CD8+ đặc hiệu của kháng nguyên khi được dùng làm tá dược vắc xin
poly (I:C12U) (Ampligen) có hiệu quả trong việc tạo ra sự trưởng thành của mDC và thúc đẩy sản xuất Th1 cytokine IL-12 đồng thời giảm đáng kể việc sản xuất cytokine IL-10 bị ức chế so với sản xuất do Poly (I:C) gây ra
Quan trọng hơn, việc tạo ra CD4+Th bằng Poly (I:C) cần thiết cho bộ nhớ trong tế bào lympho CD8+ T; cơ chế chính để thiết kế vắc xin để ngăn ngừa nhiễm vi rút.
Các dạng Poly (I:C) riêng biệt có trọng lượng phân tử hoặc Poly (I:C12U) khác nhau không tương đương về hành vi sinh học của chún
6.3 dsRNA là chất bổ trợ vắc xin chống ung thư
Tế bào đuôi gai DC và các đại thực bào là những tế bào cảm biến chính để xâm nhập mầm bệnh và tế bào biến đổi thông qua PRR được mã hóa dòng mầm
Khi cảm nhận được mầm bệnh hoặc tế bào khối u, quá trình kích hoạt liên quan đến việc các tế bào này trở thành APC kích hoạt khả năng miễn dịch bẩm sinh và từ đó hình thành khả năng miễn dịch thích nghi thông qua quá trình mồi chéo để loại bỏ các vi khuẩn xâm nhập và tế bào khối u
Kích hoạt TLR3 bởi dsRNA có khả năng tạo ra phản ứng miễn dịch chống ung thư hoặc làm chết tế bào ung thư thông qua thụ thể TLR3 được biểu hiện trên nhiều loại tế bào ung thư
Kích hoạt TLR3 bởi dsRNA có khả năng tạo ra phản ứng miễn dịch chống ung thư hoặc làm chết tế bào ung thư thông qua thụ thể TLR3 được biểu hiện trên nhiều loại tế bào ung thư
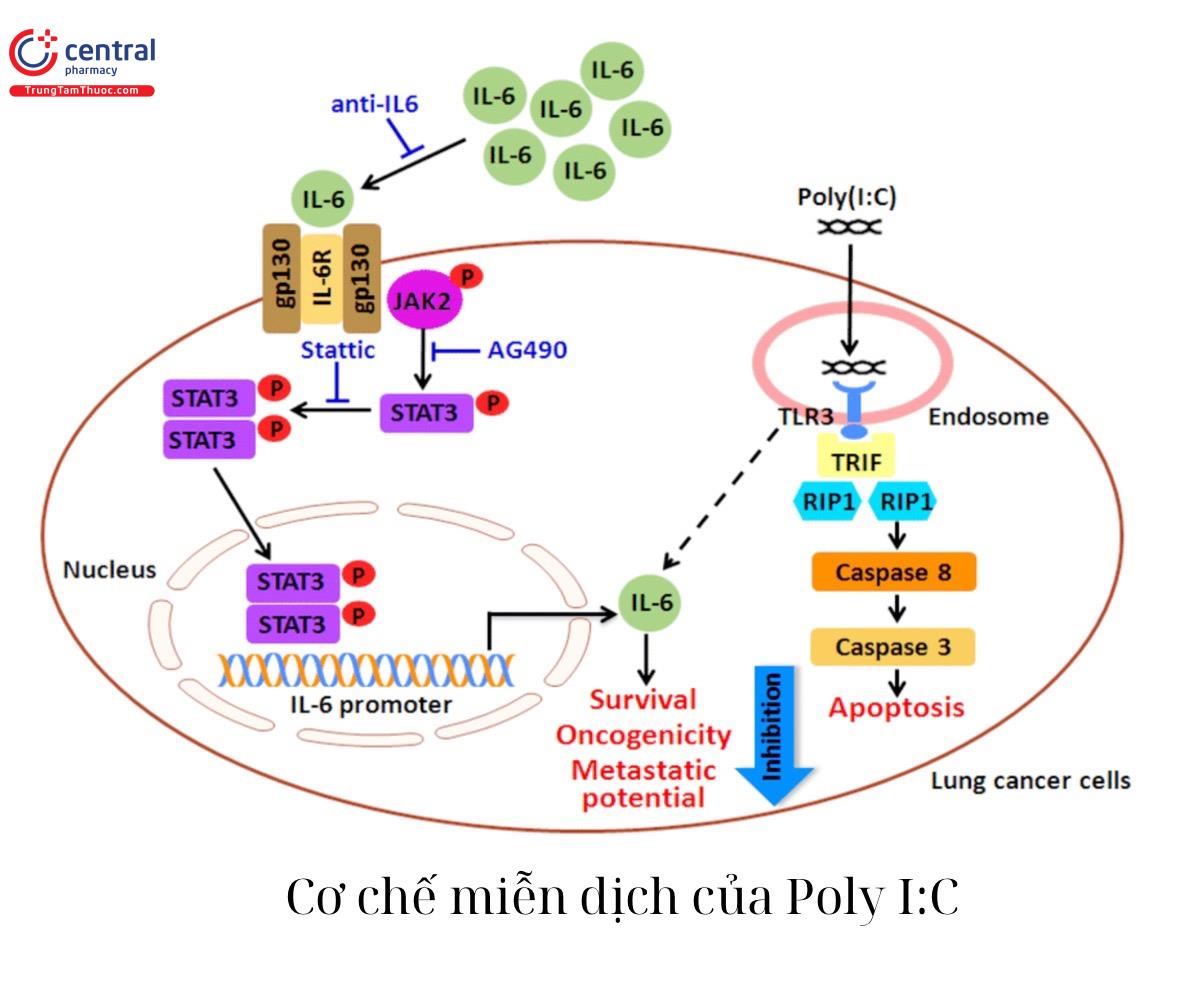
Axit polyuridylic polyadenylic [poly (A:U)] là một loại chất tương tự dsRNA tổng hợp khác đã được sử dụng kết hợp với hóa trị liệu cho bệnh ung thư dạ dày tiến triển. Tác dụng hỗ trợ miễn dịch của poly (A:U) được cho là tín hiệu TLR3 và TLR7
6.4 Thách thức đặt ra trong tương lai
Chất chủ vận TLR3 có thể là con dao hai lưỡi trong điều trị ung thư
TLR3 không chỉ biểu hiện trên các tế bào miễn dịch cảm nhận dsRNA và kích hoạt phản ứng miễn dịch mà còn biểu hiện trên các tế bào khối u biểu hiện các chức năng khác
Việc kích hoạt TLR3 nội sinh có thể gây ra apoptosis ung thư kèm theo sự điều hòa giảm của protein chống ung thư
mRNA thoát ra khỏi mô bị tổn thương hoặc chứa trong các tế bào nội bào có thể đóng vai trò là phối tử nội sinh cho TLR3
Không có đủ thông tin liên quan đến việc kích hoạt TLR3 trong tế bào ung thư; cần phải có sự cân bằng giữa khả năng gây ung thư và đặc tính kích thích miễn dịch của dsRNA khi các chất tương tự dsRNA được coi là chất bổ trợ miễn dịch trong liệu pháp miễn dịch khối u
dsRNA có thể tạo ra cả khả năng miễn dịch bẩm sinh và thích ứng để loại bỏ virus xâm nhập. Tuy nhiên, virus có thể phát triển cơ chế bảo vệ cho phép nó phá hủy tín hiệu do dsRNA gây ra, từ đó tự bảo vệ mình bằng cách trốn tránh phản ứng miễn dịch của vật chủ
Việc khắc phục (các) cơ chế bảo vệ của virus là điều mong muốn.
7 Các chế phẩm trên thị trường

8 Tài liệu tham khảo
Jason W. Ucc và cộng sự (Ngày đăng: Tháng 12 năm 2006). Mechanism of Interaction of the Double-Stranded RNA (dsRNA) Binding Domain of Protein Kinase R with Short dsRNA Sequences, Biochemistry. Truy cập ngày 17 tháng 10 năm 2023.
Bo Jin và cộng sự (Ngày đăng: Tháng 7 năm 2010). Immunomodulatory Effects of dsRNA and Its Potential as Vaccine Adjuvant, BioMed Research International. Truy cập ngày 17 tháng 10 năm 2023.
Adam J Karpala, Tim J Doran, Andrew GD Bean (Ngày đăng: Năm 2005). Immune responses to dsRNA: Implications for gene silencing technologies, Immunol Cell Biol. Truy cập ngày 17 tháng 10 năm 2023.
Marina Caskey và cộng sự (Ngày đăng: Tháng 11 năm 2017). Synthetic double-stranded RNA induces innate immune responses similar to a live viral vaccine in humans, J Exp Med. Truy cập ngày 17 tháng 10 năm 2023.
Y. Grace Chen và Sun Hur (Ngày đăng: Tháng 8 năm 2022). Cellular origins of dsRNA, their recognition and consequences, PMC. Truy cập ngày 17 tháng 10 năm 2023.





