Deferasirox
14 sản phẩm
 Dược sĩ Thu Hà Dược sĩ lâm sàng
Dược sĩ Thu Hà Dược sĩ lâm sàng
Ước tính: 2 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
Bài viết biên soạn dựa theo
Dược thư quốc gia Việt Nam, lần xuất bản thứ ba
Đây là phiên bản mới nhất của Dược thư Việt Nam do Bộ Y tế ban hành Quyết định số 3445/QĐ-BYT ngày 23 tháng 12 năm 2022
Trang 558-560, tải PDF tại đây
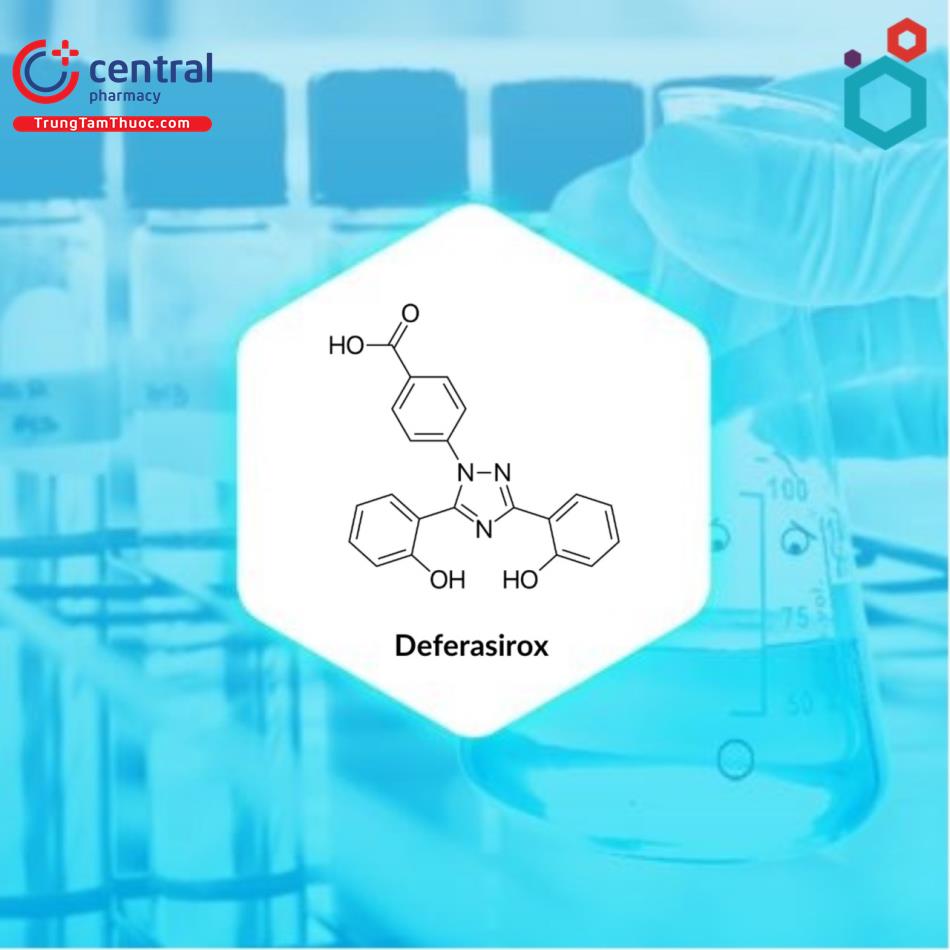
DEFERASIROX
Tên chung quốc tế: Deferasirox.
Mã ATC: V03AC03.
Loại thuốc: Thuốc uống chống thừa Sắt bằng cơ chế chelat hóa.
1 Dạng thuốc và hàm lượng
Viên nén: 90 mg, 180 mg, 360 mg.
Viên nén pha hỗn dịch: 125 mg, 250 mg, 500 mg.
2 Dược lực học
Deferasirox là chất chelat hóa liên kết chọn lọc với ion sắt III tạo thành dạng phức hợp bền vững đào thải chủ yếu qua phân.
3 Dược động học
3.1 Hấp thu
Hấp thu tốt qua đường uống, nồng độ đỉnh trong huyết tương đạt được sau 1,5 - 4 giờ. Sinh khả dụng tuyệt đối đường uống là 70%. Thức ăn có thể làm tăng sinh khả dụng của thuốc.
3.2 Phân bố
Thuốc phân bố 5% trong hồng cầu. Thuốc phân bố vào sữa trong thí nghiệm trên chuột. Chưa biết thuốc có phân bố trong sữa mẹ không. Thuốc liên kết protein huyết tương: Khoảng 99%, chủ yếu là Albumin.
3.3 Chuyển hóa
Chủ yếu qua gan bởi uridin diphosphat glucurono- syltransferase (UGT) 1A1 và một phần bởi UGT1A3. Khoảng 8% được chuyển hóa bởi các enzym CYP450.
3.4 Thải trừ
Deferasirox và các chất chuyển hóa của nó được thải trừ chủ yếu qua phân (84%) và một phần qua nước tiểu (8%). Nửa đời thải trừ 7 - 16 giờ.
4 Chỉ định
Điều trị quá tải sắt mạn tính do truyền máu.
Điều trị quá tải sắt mạn tính ở bệnh nhân thalassemia không phụ thuộc truyền máu.
5 Chống chỉ định
Mẫn cảm với thuốc.
U ác tính tiến triển.
Độ thanh thải creatinin < 40 ml/phút hoặc creatinin huyết thanh > 2 lần giá trị trung bình.
Hội chứng rối loạn sinh tủy nhóm nguy cơ cao.
Tiểu cầu dưới 50 ×109/lít.
Tình trạng yếu mệt.
Bệnh nhân suy gan nặng.
Bệnh nhân xuất huyết tiêu hóa hoặc loét tiêu hóa.
6 Thận trọng
Suy thận cấp (có thể gây tử vong hoặc phải lọc máu) đã được báo cáo khi dùng thuốc. Cần theo dõi chặt chẽ, đặc biệt ở bệnh nhân có bệnh máu ác tính tiến triển. Cần kiểm tra độ thanh thải creatinin trước khi bắt đầu điều trị và ít nhất mỗi tháng 1 lần trong khi điều trị. Với những bệnh nhân tiềm ẩn nguy cơ suy thận, cần theo dõi creatinin hàng tuần trong tháng đầu tiên, sau đó, ít nhất mỗi tháng 1 lần. Khi có tăng creatinin huyết thanh, cần cân nhắc giảm liều hoặc ngừng điều trị.
Có thể xảy ra suy gan và tổn thương gan khi dùng thuốc. Theo dõi transaminase và bilirubin 2 tuần/lần trong 1 tháng, sau đó ít nhất mỗi tháng 1 lần. Tránh dùng thuốc ở bệnh nhân suy gan nặng, cần giảm liều ở bệnh nhân suy gan vừa.
Xuất huyết tiêu hóa có thể xảy ra khi dùng thuốc. Cần theo dõi chặt chẽ ở người cao tuổi có bệnh máu ác tính tiến triển và/hoặc có tiểu cầu thấp. Ngưng dùng thuốc khi có nghi ngờ xuất huyết hoặc loét tiêu hóa.
7 Thời kỳ mang thai
Các nghiên cứu trên chuột và thỏ cho thấy không có tác động xấu lên thai nhi hoặc chức năng sinh sản khi dùng liều deferasirox bằng 0,8 lần liều dùng trên người. Chưa biết rõ thuốc có qua hàng rào nhau thai người không nhưng với trọng lượng phân tử 373 và nửa đời thải trừ dài, có thể thuốc phân bố ở hàng rào nhau thai.
8 Thời kỳ cho con bú
Chưa biết rõ thuốc có bài tiết ra sữa mẹ không nhưng với nửa đời thải trừ dài, việc dùng thuốc thường kéo dài (hàng tháng) nên có thể làm ảnh hưởng đến dự trữ sắt của trẻ. Do đó, những người mẹ dùng deferasirox không nên cho con bú.
9 Tác dụng không mong muốn (ADR)
9.1 Thường gặp
Đau bụng, tức bụng, táo bón, tiêu chảy, khó tiêu, đau đầu, buồn nôn, protein niệu, ngứa, tăng creatinin huyết thanh, tăng transaminase, ban, nôn.
9.2 Ít gặp
Lo âu, đục thủy tinh thể, sỏi mật, giảm thính lực, thị lực, chóng mặt, mệt mỏi, viêm dạ dày, xuất huyết tiêu hóa, loét tiêu hóa, Glucose niệu, viêm gan, đau thanh quản, bệnh hoàng điểm, phù, sốt, bệnh ống thận, đổi màu da, rối loạn giấc ngủ.
9.3 Hiếm gặp
Viêm thực quản, viêm dây thần kinh thị giác.
9.4 Rất hiếm gặp
Viêm tụy cấp, suy thận cấp, rụng tóc, sốc phản vệ, phù mạch, rối loạn huyết học, hồng ban đa dạng, suy gan, phản ứng quá mẫn, viêm mạch do quá mẫn, toan chuyển hóa, viêm cầu thận, hội chứng Stevens-Johnson, hội chứng hoại tử biểu bì nhiễm độc, viêm thận kẽ, mề đay.
9.5 Hướng dẫn cách xử trí ADR
Cần xem xét điều chỉnh liều, tạm ngưng hoặc ngưng hẳn dùng thuốc khi có độc tính trên thận hoặc khi creatinine huyết thanh tăng. Khi creatinin huyết thanh trở về giới hạn bình thường, có thể bắt đầu dùng thuốc trở lại với liều thấp, sau đó tăng dần lên nếu những lợi ích thu được vượt trên các rủi ro có thể xảy ra. Ở trẻ em, nếu creatinine huyết thanh của 2 lần đo liên tiếp vượt quá giá trị bình thường của lứa tuổi, cần giảm đi 10 mg/kg/ngày trong liều dùng. Ở người lớn, nếu creatinin huyết thanh của 2 lần đo liên tiếp vượt quá giá trị trung bình trước khi điều trị từ 33% và không tìm ra nguyên nhân nào khác của sự tăng creatinin này, cần giảm đi 10 mg/kg/ngày trong liều dùng.
Cần cân nhắc giảm liều ở người có tăng enzym gan nghiêm trọng, kéo dài, tiến triển hoặc không rõ nguyên nhân.
Nếu nghi ngờ có ADR nghiêm trọng trên Đường tiêu hóa, cần có các biện pháp kiểm tra và có điều trị phù hợp.
Nếu bệnh nhân có giảm tiểu cầu không rõ nguyên nhân, cần ngừng dùng thuốc cho đến khi đã xác định rõ nguyên nhân gây giảm tiểu cầu.
Nên kiểm tra thị lực và thính lực trước khi điều trị và mỗi 12 tháng trong quá trình điều trị. Nếu có giảm thị lực và/ hoặc thính lực, cần xem xét giảm liều.
Nếu có dấu hiệu quả mẫn nặng, cần ngưng thuốc và có biện pháp điều trị phù hợp.
10 Liều lượng và cách dùng
10.1 Cách dùng
Sinh khả dụng của thuốc dạng viên nén pha hỗn dịch có thể bị tăng lên khi dùng cùng thức ăn. Nên uống cùng 1 thời điểm mỗi ngày, khi đói, trước bữa ăn 30 phút.
Sinh khả dụng của thuốc dạng viên nên giảm nhẹ (không có ý nghĩa lâm sàng) sau bữa ăn ít chất béo và tăng sau bữa ăn nhiều chất béo. Nên uống thuốc khi đói hoặc với bữa ăn nhẹ.
Viên nén pha hỗn dịch không được nhai hoặc nuốt cả viên mà nên phân tán hoàn toàn trong nước, nước cam hoặc nước táo. Liều dưới 1 g nên được phân tán trong 105 ml chất lỏng, liều 1 g trở lên nên được phân tán trong 210 ml chất lỏng.
Hỗn dịch nên được dùng ngay sau khi pha. Cắn còn lại nên được phân tán lại trong 1 lượng nhỏ chất lỏng để uống nốt.
10.2 Liều lượng
10.2.1 Điều trị quá tải sắt do truyền máu
10.2.2 Người lớn và trẻ em ≥ 2 tuổi
Chỉ bắt đầu điều trị khi có bằng chứng về quá tải sắt mạn tính (truyền khối hồng cầu > 100 ml/kg và nồng độ ferritin huyết thanh thường xuyên ≥ 1.000 microgam/lít).
Liều khởi đầu 7 - 20 mg/ kg/ngày. Xem xét ngừng điều trị khi ferritin huyết thanh < 500 microgam/lít.
Điều chỉnh liều sau mỗi 3 - 6 tháng dựa trên nồng độ ferritin huyết thanh, mỗi lần điều chỉnh 5 - 10 mg/kg/ngày.
Ở bệnh nhân không đáp ứng tốt với liều 30 mg/kg/ngày, có thể tăng lên 40 mg/kg/ngày nếu ferritin huyết thanh thường xuyên > 2.500 microgam/lít và không có xu hướng giảm đi. Không dùng quá 40 mg/kg/ngày.
10.2.3 Điều trị quá tải sắt ở bệnh nhân Thalassemia không phụ thuộc truyền máu
10.2.4 Người lớn và trẻ em ≥ 10 tuổi
Chỉ bắt đầu điều trị khi có dấu hiệu quá tải sắt mạn tính (nồng độ sắt ở gan ≥ 5 mg Fe/g và ferritin huyết thanh > 300 microgam/lít).
Liều khởi đầu: 7 - 10 mg/ kg/ngày. Xem xét tăng lên 20 mg/kg/ngày, sau 4 tuần nếu nồng độ sắt ở gan > 15 mg Fe/g. Không nên dùng quá 20 mg/kg/ngày.
10.2.5 Điều chỉnh liều ở đối tượng đặc biệt
10.2.6 Điều chỉnh liều khi có độc tính trên thận
Cần xem xét điều chỉnh liều: tạm ngưng hoặc ngưng hẳn dùng thuốc khi có độc tính trên thận hoặc khi creatinin huyết thanh tăng. Khi creatinin huyết thanh trở về giới hạn bình thường, có thể bắt đầu dùng thuốc trở lại với liều thấp, sau đó tăng dần lên nếu những lợi ích thu được vượt trên các rủi ro có thể xảy ra.
Ở trẻ em, nếu creatinin huyết thanh của 2 lần đo liên tiếp vượt quá giá trị bình thường của lứa tuổi, cần giảm đi 10 mg/kg/ngày trong liều dùng.
Ở người lớn, nếu creatinin huyết thanh của 2 lần đo liên tiếp vượt quá giá trị trung bình trước khi điều trị từ 33% và không tìm ra nguyên nhân nào khác của sự tăng creatinin này, cần giảm đi 10 mg/kg/ngày trong liều dùng.
10.2.7 Điều chỉnh liều khi có độc tính trên gan
Cần cân nhắc giảm liều ở người có tăng enzym gan nghiêm trọng, kéo dài, tiến triển hoặc không rõ nguyên nhân.
10.2.8 Điều chỉnh liều khi dùng cùng với cholestyramin hoặc các chất cảm ứng enzym
Uridin 5'-diphosphat glucuronosyltransferase (UGT): Nên tránh dùng đồng thời với cholestyramin hoặc các chất cảm ứng UGT như Phenobarbital, Phenytoin, Rifampicin, ritonavir. Nếu cần dùng đồng thời, cần tăng liều khởi đầu của deferasirox tới 30 mg/kg/ngày. Sau đó, điều chỉnh liều dựa trên đáp ứng lâm sàng và nồng độ ferritin huyết thanh.
10.2.9 Điều chỉnh liều ở đối tượng đặc biệt
Chưa có nghiên cứu về dùng thuốc này ở người suy gan hoặc suy thận hoặc người cao tuổi. Không có khuyến cáo điều chỉnh liều cụ thể cho các đối tượng này.
11 Tương tác thuốc
Thuốc được chuyển hóa bởi UGT1A1, thuốc ức chế vừa enzym CYP1A2 và CYP2C8.
Tránh dùng đồng thời với: Nhôm Hydroxyd, amodiaquin, theophylin, tizanidin.
Thuốc có thể làm tăng tác dụng/độc tính của: agomelatin, amodiaquin, các cơ chất của CYPIA2 hoặc CYP2C8, pirfenidon, repaglinid, theophylin, tizanidin.
Thuốc có thể bị tăng nồng độ/tác dụng khi dùng đồng thời với: thuốc chống đông máu, dẫn chất biphosphonat, corticosteroid, NSAID.
Thuốc có thể làm giảm nồng độ tác dụng của: Cơ chất của CYP3A4.
Thuốc có thể bị giảm nồng độ/tác dụng khi dùng đồng thời với: nhôm hydroxyd, resin gắn acid mật, fosphenytoin, phenobarbital, phenytoin, rifampicin, ritonavir.
12 Quá liều và xử trí
Đã có báo cáo về quá liều sau khi dùng liều gấp 2 - 3 lần liều được kê trong vòng vài tuần. Trong 1 trường hợp xuất hiện viêm gan cận lâm sàng, các triệu chứng thoái lui sau khi ngưng thuốc.
Một trường hợp khác dùng liều đơn 80 mg/kg viên pha hỗn dịch (tương đương liều 56 mg/kg với viên nén bao film) ở bệnh nhân thalassemia quá tải sắt dẫn đến các triệu chứng buồn nôn nhẹ và tiêu chảy.
Dấu hiệu cấp tính của quá liều bao gồm: Nôn, buồn nôn, đau đầu, tiêu chảy. Có thể điều trị quá liều bằng cách gây nôn hoặc rửa dạ dày kèm theo điều trị triệu chứng.
Cập nhật lần cuối: 2017