Capivasertib
1 sản phẩm
 Dược sĩ Hoàng Mai Dược sĩ lâm sàng
Dược sĩ Hoàng Mai Dược sĩ lâm sàng
Ước tính: 1 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
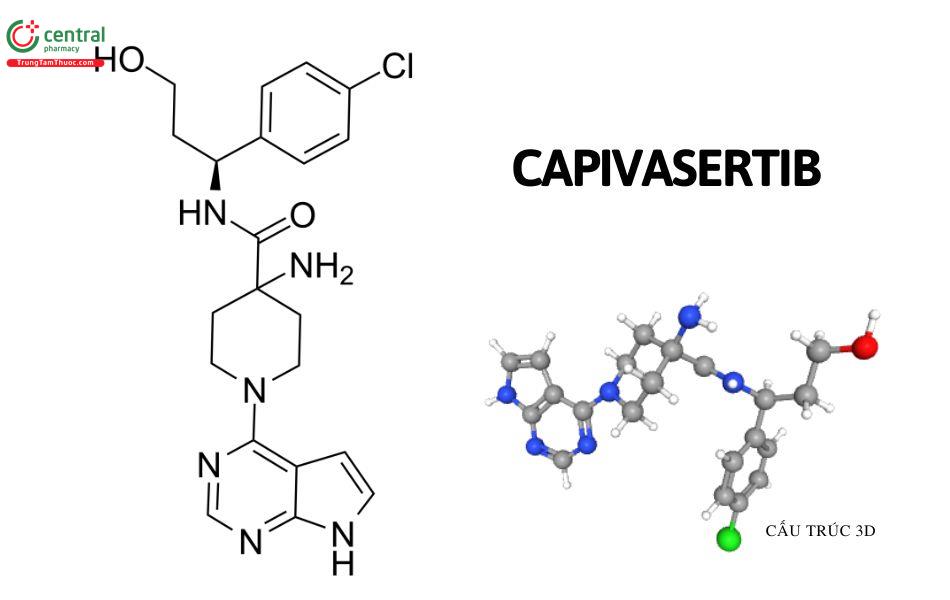
Tên chung quốc tế: Capivasertib
Biệt dược thường gặp: Truqap
Loại thuốc: Các chất ức chế protein kinase.
Mã ATC: L01EX27
1 Dạng thuốc và hàm lượng
Viên nén bao phim chứa hàm lượng 160mg, 200mg capivasertib.
2 Dược lực học
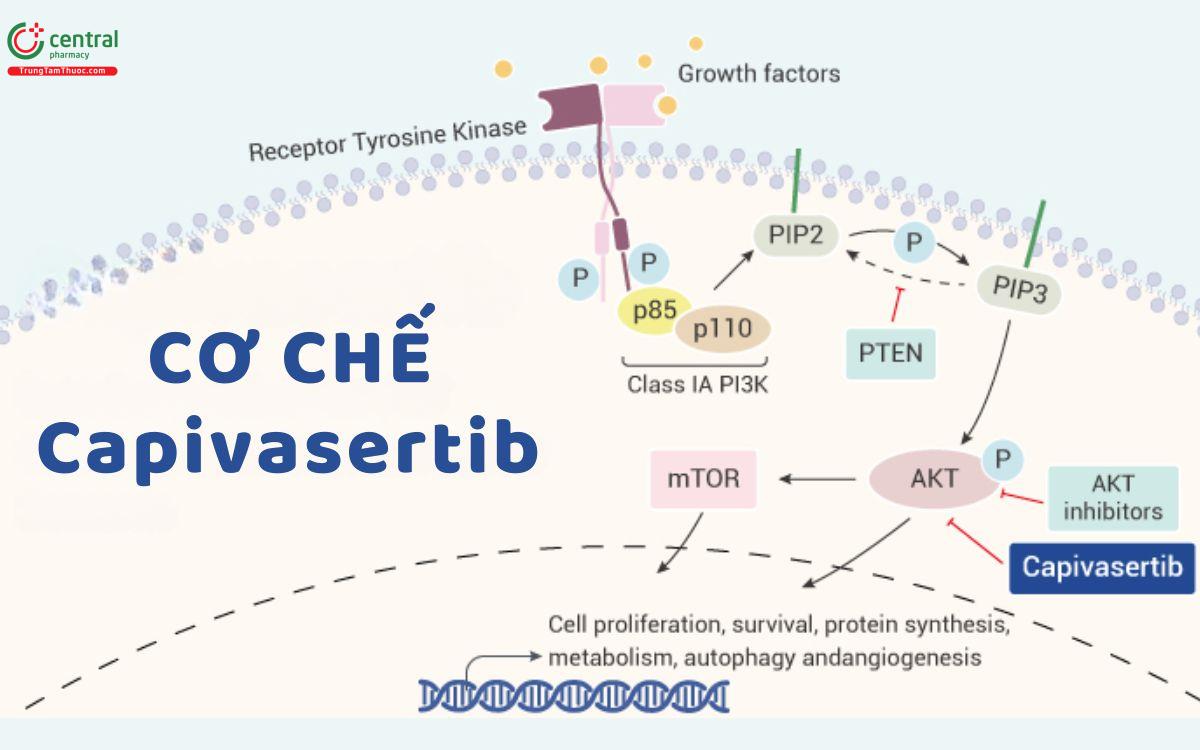
Một trong những đột biến gen gây ung thư vú có đột biến AKT1 khoảng 3%. Capivasertib-một dẫn xuất pyrrolopyrimidine, là một chất ức chế kinase pan-AKT cạnh tranh ATP chọn lọc mới, có hoạt tính tương tự chống lại ba dạng đồng phân AKT là AKT1, AKT2 và AKT3.
Capivasertib liên kết với và ức chế tất cả các dạng đồng phân AKT. Ức chế AKT ngăn chặn quá trình phosphoryl hóa các chất nền AKT làm trung gian cho các quá trình tế bào, chẳng hạn như phân chia tế bào, apoptosis và chuyển hóa Glucose và axit béo. Một loạt các khối u ác tính , trong dó có khối ung thư vú, cho thấy tín hiệu PI3K/AKT/mTOR bị rối loạn do đột biến ở nhiều thành phần tín hiệu. Bằng cách nhắm mục tiêu vào AKT, nút chính trong mạng tín hiệu PIK3/AKT, tác nhân này có thể được sử dụng làm liệu pháp đơn trị hoặc liệu pháp kết hợp cho nhiều loại ung thư ở người.
Capivasertib được chấp thuận điều trị ung thư vú di căn hoặc tiến triển tại chỗ có HR dương tính, HER2 âm tính,đột biến ở gen PIK3CA/AKT1/PTEN, kết hợp với thuốc fulvestrant.
3 Dược động học
Hấp thu: giá trị AUC và Cmax ở trạng thái ổn định của capivasertib là 8.069 h·ng/mL và C max là 1.371 ng/mL với thời gian đạt giá trị cao nhất khoảng 1-2 giờ, sinh khả dụng tuyệt đối khoảng 29%.
Phân bố: thể tích phân bố qua đường uống ở trạng thái ổn định khoảng 1.847L, tỷ lệ liên kết với protein huyết tương khoảng 22%.
Chuyển hoá: thuốc được chuyển hoá ở gan qua con đường CYP3A4 và UGT2B7.
Thải trừ: thời gian bán huỷ của thuốc là 8.3 giờ, thuốc thải trừ qua đường nước tiểu khoảng 45%, qua phân khoảng 50%. Độ thanh thải ổn định là 50 L/h.
4 Chỉ định
Capivasertib chỉ định điều trị cho bệnh nhân trưởng thành mắc ung thư vú tiến triển hoặc di căn sang các bộ phân khác, có thụ thể HR dương tính, HER2 dương tính, có đột biến ở PIK3CA/AKT1/PTEN khi thất bại với ít nhất 1 trong các phác đồ điều trị trước đó hoặc tái phát trong vòng 12 tháng sau điều trị.

5 Chống chỉ định
Người mẫn cảm với thành phần Capivasertib
6 Liều dùng - Cách dùng
6.1 Liều dùng
Liều khuyến cáo ở người trưởng thành là 400mg x 2 lần/ ngày, mỗi lần uống cách nhau 12 giờ, sử dụng trong 4 ngày liên tiếp, và nghỉ 3 ngày không dùng thuốc. Liều có thể điều chỉnh tuỳ theo đáp ứng của từng bệnh nhân, uống thuốc đến khi độc tính không thể chấp nhận được.
Trẻ em chưa được khuyến cáo sử dụng thuốc, nếu cần thiết cần có hướng dẫn từ bác sĩ.
6.2 Cách dùng
Nuốt toàn bộ viên thuốc với lượng nước vừa đủ, không nhai hay nghiền viên thuốc trước uống, đối với viên nén bị nứt vỡ thì không sử dụng.
Với liều thuốc bị nôn hoặc bệnh nhân quên liều trên 4 giờ thì bỏ qua liều thuốc và uống liều tiếp theo vào thời gian như lịch trình thông thường, không uống gấp đôi liều bù lại.
7 Tác dụng không mong muốn
Các phản ứng có hại thường gặp nhất khi sử dụng thuốc:
- Rối loạn tiêu hoá: buồn nôn, viêm miệng, nôn mửa.
- Rối loạn da và mô dưới da: phát ban hình cánh bướm, viêm da, viêm da dị ứng, da khô, chàm, ban đỏ đa dạng, viêm da tay, ngứa…
- Rối loạn chung: mệt mỏi, suy nhược
- Rối loạn dinh dưỡng: tăng đường huyết, giảm thèm ăn, suy giảm glucose, tiểu đường.
- Rối loạn nhiễm trùng: nhiễm trùng đường niệu.
- Rối loạn thần kinh: đau đầu, mất ngủ.
- Các bất thường xét nghiệm: tăng glucose, giảm bạch cầu, giảm tiểu cầu, giảm tế bào lympho…
8 Tương tác thuốc
Chất ức chế CYP3A mạnh: tăng cường tiếp xúc với capivasertib làm tăng nguy cơ gặp các phản ứng có hại của thuốc. Cần giảm liều capivasertib khi kết hợp thuốc đồng thời.
Chất ức chế CYP3A vừa phải: tăng nồng đột capivasertib trong máu, làm tăng nguy cơ gặp các phản ứng có hại của thuốc. Cần giảm liều capivasertib khi kết hợp thuốc đồng thời.
Chất cảm ứng CYP3A mạnh và vừa phải: làm giảm sự tiếp xúc của capivasertib, dẫn đến làm giảm hiệu quả của thuốc.
9 Thận trọng
Thuốc kích thích sinh dục mạnh nên sử dụng thuốc cần có sự theo dõi và giám sát của bác sĩ.
Nên kết hợp với các biện pháp theo dõi việc sử dụng urofollitropin như siêu âm, đo nống độ oestradiol huyết thanh thường xuyên để đảm bảo sử dụng thuốc an toàn và hiệu quả.
Các báo cáo về phì đại buồng trứng, hoặc kích thích quá mức, và với phụ nữ có bệnh ống dẫn trứng có nguy cơ gặp tình trạng mang thai ngoài tử cung, xảy ra khi sử dụng urofollitropin.
Phụ nữ đã sử dụng nhiều phác đồ trị vô sinh trước đó, có thể tăng nguy cơ về khối u buồng trứng cả lành tính và ác tính xuất hiện.
Khi sử dụng thuốc sẽ tăng tỷ lệ đa thai và song thai nhiều hơn so với biện pháp tự nhiên, nếu muốn hạn chế cần theo dõi đáp ứng của thuốc để có hướng xử trí kịp thời.
Thận trọng khi sử dụng cho bệnh nhân có tiền sử bị bệnh về huyết khối.
10 Thời kỳ mang thai
Thuốc kết hợp với fulvestrant có thể gây hại cho thai nhi. Các dữ liệu trên động vật cho thấy thuốc gây ra phát triển bất thường ở phôi, tử vong phôi thai khi sử dụng liều khuyến cáo lâm sàng. Khuyến cáo không dùng thuốc trong thời gian mang thai và cảnh báo về những nguy cơ tiềm ẩn có thể gặp phải cho phụ nữ có thai và phụ nữ có khả năng sinh con.
11 Thời kỳ cho con bú
Các nghiên cứu về thuốc có qua được sữa mẹ hay không chưa có báo cáo nên mẹ cần ngưng thuốc trong thời gian dùng thuốc này, do các phản ứng nghiêm trọng cho trẻ có thể xảy ra.
12 Bảo quản
Bảo quản thuốc ở nơi khô ráo, thoáng mát, nhiệt độ dưới 30 độ C.
Tránh xa khu vực vui chơi của trẻ nhỏ.
13 Quá liều
Chưa có báo cáo
Nên ngừng thuốc và cấp cứu khi có biểu hiện quá liều.
14 Tài liệu tham khảo
Chuyên gia Drugbank. Capivasertib. Drugbank. Truy cập ngày 19 tháng 10 năm 2024.
Chuyên gia FDA. FDA approves capivasertib with fulvestrant for breast cancer .FDA. Truy cập ngày 19 tháng 10 năm 2024.





