Bortezomib
9 sản phẩm
 Dược sĩ Thu Hà Dược sĩ lâm sàng
Dược sĩ Thu Hà Dược sĩ lâm sàng
Ước tính: 5 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
Bài viết biên soạn dựa theo
Dược thư quốc gia Việt Nam, lần xuất bản thứ ba
Đây là phiên bản mới nhất của Dược thư Việt Nam do Bộ Y tế ban hành Quyết định số 3445/QĐ-BYT ngày 23 tháng 12 năm 2022
Trang 308-311, tải file PDF TẠI ĐÂY
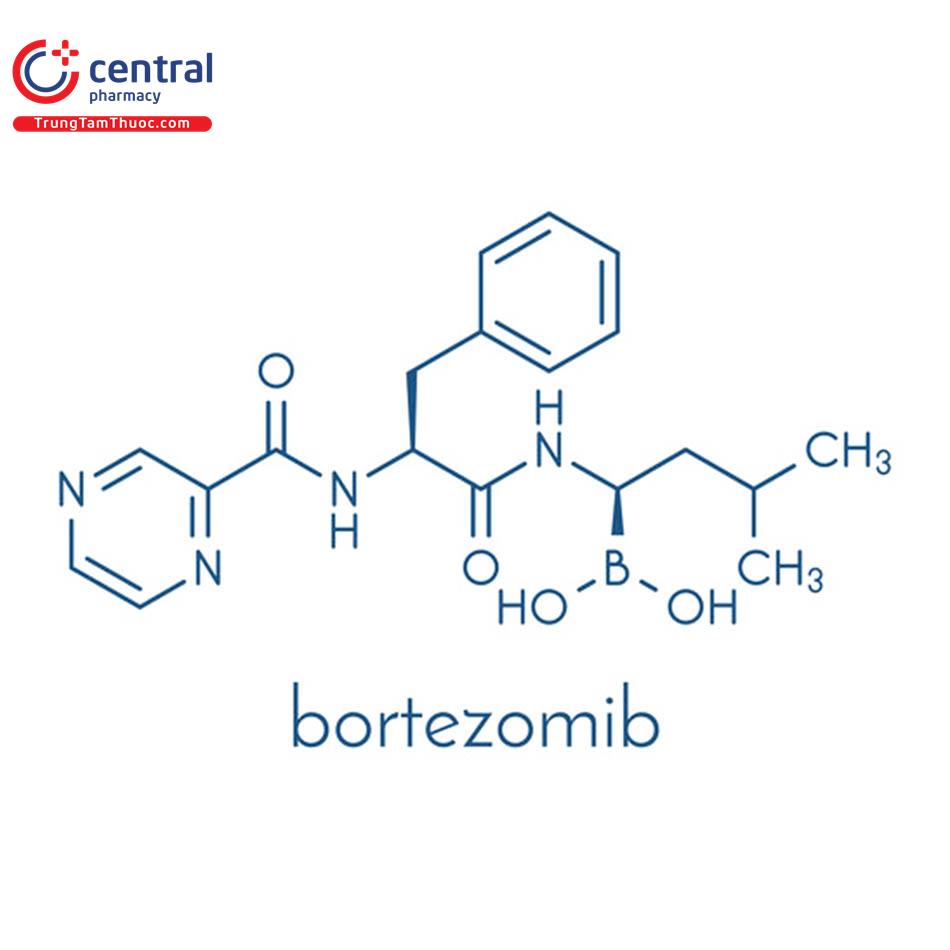
BORTEZOMIB
Tên chung quốc tế: Bortezomib.
Mã ATC: L01XX32.
Loại thuốc: Chống ung thư, nhóm ức chế proteasome.
1 Dạng thuốc và hàm lượng
Thuốc bột pha tiêm dùng một lần: Lọ 1 mg, 2 mg, 3,5 mg.
2 Dược lực học
Bortezomib là một chất chống ung thư ức chế có phục hồi proteasome 26S (một phức hợp protein làm phân giải các protein đã được ubiquitin hóa). Con đường ubiquitin-proteasome đóng vai trò thiết yếu trong điều hòa nồng độ các protein đặc hiệu trong nội bào, do đó duy trì cân bằng nội môi trong tế bào. Sự ức chế proteasome 26S bởi bortezomib ngăn ngừa sự phân giải protein đích và gây rối loạn các cơ chế cân bằng nội mô bình thường, từ đó dẫn tới chết tế bào. Các nghiên cứu in vitro cho thấy bortezomib là chất độc đối với nhiều tế bào ung thư. Trong khi đó, bortezomib đã được chứng minh làm chậm sự phát triển khối u trên mô hình gây u in vivo, kể cả đa u tủy xương.
3 Dược động học
Sau khi tiêm tĩnh mạch đơn liều bortezomib, nồng độ của bortezomib trong huyết tương giảm theo hai pha: pha phân bố (dưới 10 phút); sau đó là pha thải trừ (khoảng 5 đến 15 giờ). Sự thanh thải giảm khi dùng liều lặp lại.
Tỉ lệ liên kết giữa bortezomib với protein huyết tương khoảng 83%. Bortezomib có Thể tích phân bố lớn, gợi ý rằng nó được phân bố rộng đến mô ngoại vi. Khả năng ức chế proteasome cao nhất xảy ra sau khi dùng đơn liều khoảng 1 giờ, với mức độ ức chế trung bình là 61%.
Bortezomib thải trừ nhanh hơn sau khi dùng liều đầu tiên so với sau khi dùng các liều kế tiếp. Nửa đời thải trừ trung bình sau khi dùng liều đầu tiên là 9 - 15 giờ, còn sau khi dùng nhiều lần là 40 - 193 giờ. Độ thanh thải toàn thân trung bình sau khi dùng liều đầu tiên 1 mg/m là 102 lít/giờ và liều 1,3 mg/m2 là 112 lít/giờ; còn sau khi dùng nhiều liều kế tiếp 1 mg/m2 là 15 - 32 lít/giờ và liều 1,3 mg/m2 là 18 - 32 lít/giờ.
Con đường chuyển hóa chính của bortezomib thông qua quá trình loại bỏ nhóm boronic (gốc của Acid Boric) thành những chất chuyển hóa không hoạt tính. Các nghiên cứu in vitro cho thấy bortezomib được chuyển hóa bởi hệ thống enzym cytochrom P450, chủ yếu do các isoenzym 3A4, 2C19, 1A2; sự chuyển hóa qua isoenzym 2D6 và 2C9 là không đáng kể.
Nồng độ bortezomib tăng ở những bệnh nhân suy gan vừa và nặng, nhưng không bị ảnh hưởng trong bệnh nhân suy thận.
4 Chỉ định
Điều trị đa u tủy xương (chưa được điều trị trước đó) ở những bệnh nhân không thể điều trị bằng hóa trị liệu liều cao và cấy ghép tế bào gốc tạo máu (có kết hợp với melphalan và prednisolon).
Điều trị đa u tủy xương tiến triển kể cả trên những bệnh nhân đã được điều trị trước đó, đã hoặc không thể ghép tế bào gốc tạo mẫu (đơn trị, hoặc phối hợp với liposom Doxorubicin polyethylen glycol hoặc dexamethason).
Bortezomib là thuốc được lựa chọn hàng đầu để điều trị đa u tủy xương ở bệnh nhân đủ điều kiện dùng hóa trị liệu liều cao và phương pháp cấy ghép tế bào gốc tạo mẫu (có kết hợp với dexamethason, hoặc dexamethason và thalidomid).
U lympho tế bào Mantle (u lympho vùng vỏ).
5 Chống chỉ định
Mẫn cảm với bortezomib, nguyên tố bor.
Bệnh phổi thâm nhiễm lan tỏa cấp tính và bệnh màng ngoài tim.
6 Thận trọng
Bortezomib nên được dùng dưới sự giám sát của bác sĩ có kinh nghiệm trong sử dụng thuốc điều trị ung thư.
6.1 Trên hệ thần kinh
Điều trị với bortezomib có thể gây ra bệnh thần kinh ngoại vi, mặc dù một số ca mắc bệnh thần kinh vận động - cảm giác kết hợp đã được báo cáo nhưng chủ yếu hay gặp là rối loạn cảm giác. Những triệu chứng xuất hiện trước như tê, đau hoặc cảm giác nóng ở bàn chân hoặc bàn tay và/hoặc các dấu hiệu bệnh lý thần kinh ngoại vi có thể trở nên trầm trọng hơn trong quá trình bệnh nhân điều trị bằng bortezomib. Do vậy bệnh nhân cần được theo dõi các triệu chứng của bệnh thần kinh ngoại vi (như cảm giác bỏng, tăng hoặc giảm cảm giác, dị cảm, khó chịu, đau thần kinh hoặc mệt mỏi) trong suốt thời gian điều trị với bortezomib. Những bệnh nhân xuất hiện mới bệnh lý thần kinh ngoại vi hoặc bệnh trở nên trầm trọng hơn có thể cần phải thay đổi liều và/hoặc tần số sử dụng bortezomib.
6.2 Trên huyết áp
Khoảng 12% bệnh nhân điều trị bằng bortezomib bị hạ huyết áp tư thế. Hạ huyết áp được quan sát thấy trong suốt quá trình điều trị. Cần thận trọng khi điều trị bortezomib cho bệnh nhân có tiền sử ngất, dùng thuốc có liên quan đến hạ huyết áp, hay bệnh nhân mất nước. Theo dõi hạ huyết áp tư thế có thể bao gồm điều chỉnh các thuốc hạ huyết áp, sự mất nước, hoặc dùng các cortiocoid khoáng (mineralocorticoid) và/hoặc các thuốc kích thích thần kinh giao cảm.
6.3 Trên tiêu hóa
Điều trị bằng bortezomib có thể gây buồn nôn, nôn, tiêu chảy, và táo bón. Do vậy đôi khi cần phải sử dụng thuốc chống nôn và thuốc chống tiêu chảy. Trong nhiều trường hợp cần bù dịch và chất điện giải để tránh mất nước.
6.4 Trên huyết học
Giảm tiểu cầu xảy ra trong suốt quá trình điều trị bằng bortezomib (khoảng 40% bệnh nhân). Mức độ tối đa xảy ra vào ngày thứ 11 sau liều đầu tiên và thường được hồi phục trong chu kỳ kế tiếp. Để kiểm soát, cần đếm tổng tế bào máu, đặc biệt là số lượng tiểu cầu trong suốt quá trình điều trị. Sự khởi phát phổ biến nhất ở chu kỳ 1 và 2 nhưng có thể tiếp tục trong suốt quá trình điều trị. Bortezomib có thể gây ra xuất huyết Đường tiêu hóa và xuất huyết nội sọ kết hợp với giảm tiểu cầu. Nếu bệnh nhân giảm tiểu cầu mức độ 4, có thể tạm ngừng điều trị bằng bortezomib. Bortezomib ở liều thấp hơn có thể được sử dụng trở lại sau khi vấn để giảm tiểu cầu được giải quyết.
6.5 Trên gan thận
Bortezomib được chuyển hóa bởi các enzym gan, do đó sự thanh thải bortezomib có thể giảm ở những bệnh nhân bị suy gan. Những bệnh nhân này nên được theo dõi chặt chẽ độc tỉnh khi điều trị bằng bortezomib.
Chưa có nghiên cứu lâm sàng khi sử dụng bortezomib ở bệnh nhân có Độ thanh thải creatinin nhỏ hơn 13 ml/phút và bệnh nhân thẩm tách máu. Những bệnh nhân này nên được theo dõi chặt chẽ về độc tính khi điều trị bằng bortezomib.
Đối tượng đặc biệt: Chụp X-quang ngực trước khi điều trị để theo dõi bệnh phổi - không tiếp tục điều trị với bortezomib nếu bệnh phổi kẽ phát triển.
Theo dõi nồng độ Glucose huyết trên bệnh nhân dùng thuốc hạ glucose huyết dạng uống.
Sự phát triển cấp tính hoặc làm tăng cơn suy tim sung huyết, và hoặc sự giảm phân suất tống máu của thất trái đã được báo cáo trong quá trình điều trị với bortezomib. Việc lưu giữ dịch có thể là dấu hiệu của triệu chứng suy tim. Do đó bệnh nhân có các yếu nguy cơ hoặc đang mắc bệnh tim phải được theo dõi chặt chẽ.
Phụ nữ còn khả năng sinh đẻ nên tránh mang thai trong khi đang điều trị với bortezomib.
Bệnh nhân nam và nữ trong độ tuổi sinh đẻ phải sử dụng các biện pháp tránh thai hiệu quả trong và sau 3 tháng điều trị với bortezomib.
Bortezomib có thể có ảnh hưởng đến khả năng lái xe và vận hành máy móc. Do đó, khi đang sử dụng bortezomib bệnh nhân phải thận trọng khi lái xe hoặc vận hành máy móc và không nên lái xe hoặc vận hành máy móc nếu gặp các triệu chứng như mệt mỏi, chóng mặt, ngất xỉu, hạ huyết áp tư thế, giảm thị lực.
7 Thời kỳ mang thai
Không có dữ liệu lâm sàng về sự thải trừ qua nhau thai của bortezomib trong thai kỳ. Khả năng gây quái thai của bortezomib chưa được điều tra đầy đủ.
Bortezomib không ảnh hưởng đến sự phát triển của phôi/bào thai ở chuột cống và thỏ. Các nghiên cứu trên động vật để xác định ảnh hưởng của bortezomib lên quá trình sinh đẻ và sự phát triển sau khi sinh không được thực hiện.
Không nên dùng bortezomib trong thời gian mang thai trừ khi thực sự cần thiết.
Nếu bortezomib được sử dụng trong thời kỳ mang thai, hoặc nếu bệnh nhân có thai trong khi điều trị với bortezomib, bệnh nhân cần được thông báo về khả năng gây nguy hiểm cho thai nhi.
Bệnh nhân sử dụng bortezomib kết hợp với thalidomid nên tuân theo chương trình phòng ngừa mang thai với thalidomid (Thalidomide Celgene® Pregnancy Prevention Programme).
8 Thời kỳ cho con bú
Mặc dù chưa có dữ liệu về việc bortezomib có bài tiết trong sữa mẹ hay không, tuy nhiên có thể có phản ứng phụ nghiêm trọng ở trẻ bú sữa mẹ khi sử dụng bortezomib, nên ngưng cho con bú trong khi điều trị với bortezomib.
9 Tác dụng không mong muốn (ADR)
9.1 Thường gặp
Toàn thân: mệt mỏi, đau đầu, huyết áp thấp, đau cơ, sốt, phát ban, khó thở.
Tiêu hóa: táo bón, chán ăn, tiêu chảy.
Thần kinh: dị cảm, bệnh lý thần kinh ngoại vi, rối loạn cảm giác, zona thần kinh, zona thần kinh tái phát.
9.2 Ít gặp
Tim mạch: suy tim, hội chứng rối loạn tuần hoàn não sau có khả năng hồi phục khi ngừng điều trị.
Phổi: tăng huyết áp động mạch phổi, bệnh phổi thâm nhiễm tràn lan cấp tính.
Khác: co giật.
9.3 Hiếm gặp
Biến chứng thần kinh tự chủ.
9.4 Rất hiếm gặp
Bệnh lý chất trắng não đa ổ tiến triển.
9.5 Không biết tần số
Rụng tóc, ức chế tủy xương, tràn mạch máu, tăng acid uric, buồn nôn, viêm niêm mạc miệng, nghẽn mạch huyết khối, hội chứng tiêu khối u, nôn.
Hội chứng ly giải khối u: Bệnh nhân có nguy cơ bị hội chứng này thường là những bệnh nhân có tổng khối tế bào ác tính lớn trước điều trị. Những bệnh nhân này cần được giám sát chặt chẽ và cần thận trọng thích hợp.
10 Liều lượng và cách dùng
Dùng bortezomid phải có sự giám sát của bác sĩ có kinh nghiệm sử dụng thuốc điều trị ung thư. Cần phòng ngừa nhiễm virus Herpes, đặc biệt những người có tiền sử bị bệnh Zona rất dễ bị tái phát.
10.1 Cách dùng
Bortezomib được tiêm tĩnh mạch (3 - 5 giây) hoặc tiêm dưới da. Bortezomib không được dùng qua các đường khác. Tiêm vào ống sống có thể dẫn đến tử vong.
Trước khi dùng, bột bortezomib phải được pha (bởi nhân viên y tế) bằng kỹ thuật vô khuẩn thích hợp. Thuốc sau khi pha có thể được bảo quản ở 25 °C trong lọ gốc hoặc bơm tiêm nhưng phải được tiêm trong vòng 8 giờ sau khi pha dung dịch. Dung dịch bortezomib nên được kiểm tra bằng mắt xem có vẩn đục hay biến đổi màu không, nếu xuất hiện bất thường cần được loại bỏ ngay.
Để tiêm tĩnh mạch, pha lọ bột 3,5 mg bortezomib với 3,5 ml Natri clorid 0,9% để được nồng độ thuốc 1 mg/ml.
Để tiêm dưới da, pha lọ bột 3,5 mg bortezomib với 1,4 ml natri clorid 0,9% để được nồng độ thuốc 2,5 mg/ml. Nếu tiêm dưới da nồng độ 2,5 mg/ml mà gây phản ứng tại chỗ, có thể sử dụng dung dịch bortezomib 1 mg/ml để tiêm dưới da hoặc cân nhắc tiêm tĩnh mạch ở các liều tiếp theo.
Khi dùng bortezomib với những thuốc khác, lưu ý tham khảo cách dùng của những thuốc này.
Chú ý: Bortezomib là một chất gây độc tế bào. Do đó, cần thận trọng khi xử lý và pha dung dịch bortezomib. Sử dụng găng tay và quần áo bảo hộ khác để tránh tiếp xúc với da.
Phải tuân thủ nghiêm ngặt kỹ thuật vô khuẩn trong suốt quá trình xử lý bortezomib vì nó không chứa chất bảo quản.
10.2 Liều lượng
10.2.1 Đa u tủy xương chưa điều trị
Khi dùng bortezomib phối hợp với melphalan và prednison như một phần của liệu pháp VMP (bortezomib, melphalan và prednison) ở bệnh nhân bị đa u tủy xương chưa điều trị, liều bortezomib dành cho người lớn trong 4 chu kỳ đầu, mỗi chu kỳ 6 tuần là 1,3 mg/m2 tiêm tĩnh mạch 3 - 5 giây, 2 lần/tuần, trong tuần 1, 2, 4 và 5 (ngày 1, 4, 8, 11, 22, 25, 29 và 32 của chu kỳ 6 tuần) tiếp theo là khoảng thời gian nghi 10 ngày (ngày 33 - 42). Với 5 chu kỳ tiếp theo, liều bortezomib tương tự (1,3 mg/m2 tiêm tĩnh mạch 3 - 5 giây), 1 lần/tuần trong tuần thứ 1, 2, 4 và 5 (tiêm vào ngày 1, 8, 22, và 29), tiếp đó là 13 ngày nghỉ. Trong tất cả 9 chu kỳ, melphalan liều 9 mg/m2 và prednison liều 60 mg/m2 được uống một lần/ngày trong ngày 1 - 4.
10.2.2 Đa u tủy xương và u lympho tế bào vỏ tái phát
Trị liệu trong 8 chu kỳ, mỗi chu kỳ 21 ngày: Điều trị theo phác đồ chuẩn cho người lớn là 1,3 mg/m2 tiêm tĩnh mạch 3 - 5 giây 2 lần/tuần trong 2 tuần (ngày 1, 4, 8, và 11), tiếp theo là 10 ngày nghỉ (ngày 12 - 21).
Trị liệu kéo dài hơn 8 chu kỳ, mỗi chu kỳ 21 ngày: Bortezomib có thể được dùng theo phác đồ chuẩn hoặc theo phác đồ duy trì (1,3 mg/m2 tiêm tĩnh mạch 1 lần/tuần trong 4 tuần (ngày 1, 8, 15 và 22), tiếp theo là 13 ngày nghỉ (ngày 23 - 35).
10.2.3 Điều trị cảm ứng (như liệu pháp đầu tiên) trước khi ghép tế bào gốc
Bệnh nhân cần được điều trị trong 4 chu kỳ, mỗi chu kỳ 21 ngày. Khi sử dụng bortezomib với dexamethason (phác đồ BD) là liệu pháp cảm ứng ở bệnh nhân mới được chẩn đoán bị đa u tủy xương được ghép tế bào gốc tự thân, bortezomib được sử dụng ở liều 1,3 mg/m2 tiêm tĩnh mạch 3 - 5 giây 2 lần/tuần trong 2 tuần (ngày 1, 4, 8, và 11), sau đó là 10 ngày nghỉ (ngày 12 – 21). Trong chu kỳ 1 và 2, dexamethason 40 mg được uống trong các ngày 1. 4 và 9 - 12; trong chu kỳ 3 và 4, dexamethason 40 mg được dùng uống vào ngày 1 -4
Việc sử dụng bortezomib cũng đã được nghiên cứu như là một thành phần của liệu pháp cảm ứng khác ở bệnh nhân mới được chẩn đoán bị đa u tủy xương, sẽ được ghép tế bào gốc tự thân. Tuy nhiên, việc sử dụng những liệu pháp này chưa được thiết lập đầy dù cho đến thời điểm này.
10.2.4 Điều chỉnh liều
Suy gan: Bệnh nhân suy gan nhẹ không cần điều chỉnh liều và nên được điều trị theo liều khuyến cáo. Bệnh nhân suy gan vừa hoặc nặng nên bắt đầu điều trị bằng bortezomib với liều giảm 0,7 mg/m3/ mỗi lần tiêm trong chu kỳ điều trị đầu tiên, và tăng liều sau đó lên 1,0 mg/mẻ hoặc giảm liều tiếp theo xuống 0,5 mg/m dựa trên khả năng dung nạp của bệnh nhân.
Suy thận: Dược động học của bortezomib không ảnh hưởng ở những bệnh nhân suy thận nhẹ đến trung bình (ClCr > 20 ml/phút/1,73 m2); do đó, không cần thiết điều chỉnh liều cho những bệnh nhân này. Hiện chưa biết dược động học của bortezomib bị ảnh hưởng ở bệnh nhân suy thận nặng nhưng không chạy thận (ClCr <20 ml/phút/1,73 m2). Vì chạy thận có thể làm giảm nồng độ bortezomib, nên dùng bortezomib sau khi chạy thận.
Bệnh lý thần kinh ngoại vi: Liều lượng và/hoặc tần suất dùng bortezomib nên được điều chỉnh ở những bệnh nhân bị bệnh lý thần kinh ngoại vi trầm trọng.
Ở những bệnh nhân mắc bệnh thần kinh ngoại vi cấp 1 (dị cảm, phản xạ yếu, và/hoặc mất phản xạ) mà không đau hoặc mất chức năng, không cần điều chỉnh liều. Tuy nhiên, ở những bệnh nhân mắc bệnh thần kinh ngoại vi cấp 1 có đau hoặc bệnh lý thần kinh ngoại vi cấp 2 (ảnh hưởng tới chức năng), nên giảm liều bortezomib xuống còn 1 mg/m2.
Ở những bệnh nhân mắc bệnh thần kinh ngoại vi cấp 2 có đau thần kinh hoặc mắc bệnh thần kinh ngoại vi cấp 3 (ảnh hưởng tới các hoạt động sinh hoạt hằng ngày), nên tạm thời ngừng dùng bortezomib khi hết các biểu hiện độc tính, có thể tái sử dụng bortezomib ở liều 0,7 mg/m2 một tuần/lần.
Ngừng điều trị với bortezomib ở những bệnh nhân mắc bệnh thần kinh ngoại vi cấp 4 (mất thần kinh cảm giác hoặc đau thần kinh vận động đe dọa đến mạng sống hoặc dẫn đến tình trạng tê liệt).
Khuyến cáo rằng bortezomib chỉ nên được sử dụng ở những bệnh nhân đã mắc bệnh thần kinh nặng trước đây sau khi đã đánh giá cẩn thận những rủi ro và lợi ích cho từng bệnh nhân.
Trẻ em: Tính an toàn và hiệu quả của bortezomib chưa được xác định ở trẻ em dưới 18 tuổi.
Người cao tuổi: Không có bằng chứng cho thấy cần điều chỉnh liều ở người trên 65 tuổi bị đa u tủy xương hoặc với u lympho tế bào vỏ. Không có nghiên cứu nào về việc sử dụng bortezomib điều trị đa u tủy xương ở những bệnh nhân cao tuổi chưa được điều trị, nhưng có thể để điều trị hóa chất liều cao với việc cấy ghép tế bào gốc tạo máu. Do đó không có khuyến cáo điều chỉnh liều bortezomib trên những bệnh nhân này.
Một nghiên cứu trên các bệnh nhân u lympho tế bào vỏ không được điều trị trước đó gồm 42,9% bệnh nhân từ 65 - 74 tuổi và 10,4% bệnh nhân ≥ 75 tuổi. Ở bệnh nhân ≥ 75 tuổi, cả hai phác đồ điều trị, VcR-CAP (bortezomib với Rituximab, cyclophosphamid, doxorubicin, và prednison) và R-CHOP (rituximab, cyclophosphamid, doxorubicin, Vincristin, và prednison) đều ít dung nạp.
10.2.5 Hiệu chỉnh liều theo độc tính
Nếu số lượng tiểu cầu > 70 G/lit, bạch cầu trung tính > 1,0 G/lít, giữ nguyên liều điều trị.
Nếu số lượng tiểu cầu < 30 G/lit, bạch cầu trung tính = 0,75 G/lit, , liều điều trị mức độ 1 so với liều ban đầu (ví dụ 1,3 mg/m2/liều sẽ giảm xuống 1 mg/m2/liều, còn nếu liều ban đầu 1 mg/m2/liều giảm xuống 0,7 mg/m2/liều.
Ngưng dùng bortezomib nếu xuất hiện độc tính độ 3 không liên quan huyết học hoặc độc tính huyết học độ 4 (số lượng tiểu cầu < 25000/ mm3). Khi dấu hiệu độc tính hết, có thể bắt đầu dùng lại bortezomib với liều giảm 25% liều ban đầu (ví dụ liều 1,3 mg/m2 giảm xuống 1 mg/m2; liều 1 mg/m2 giảm xuống 0,7 mg/m2).
Đối với những bệnh nhân xuất hiện đau thần kinh và/hoặc đau thần kinh ngoại vi trong chế độ điều trị đơn trị hoặc kết hợp, nên có những điều chỉnh liễu (xem Bệnh lý thần kinh ngoại vi ở trên).
11 Tương tác thuốc
Các nghiên cứu in vitro cho thấy bortezomib là một chất ức chế yếu các enzym cytochrom P450 1A2, 2C9, 2D6 và 3A4. Bortezomib ức chế CYP2C19, do vậy bortezomib có thể làm tăng nồng độ của những thuốc là cơ chất của enzym này.
AUC của bortezomib (tiêm tĩnh mạch) tăng 35% khi sử dùng đồng thời với ketoconazol (một chất ức chế CYP3A4 mạnh). Do đó, bệnh nhân nên được theo dõi chặt chẽ khi dùng bortezomib với các chất ức chế CYP3A4 mạnh (ví dụ ketoconazol, hay ritonavir).
AUC của bortezomib (tiêm tĩnh mạch) giảm 45% khi sử dùng đồng thời với Rifampicin (chất cảm ứng CYP3A4 mạnh). Do đó, việc sử dụng đồng thời bortezomib với các thuốc cảm ứng mạnh CYP3A4 (như rifampicin, carbamazepin, Phenytoin, Phenobarbital và cỏ St. John) không được khuyến cáo vì hiệu quả lâm sàng có thể giảm.
AUC của bortezomib (tiêm tĩnh mạch) tăng 17% khi sử dùng đồng thời với melphalan - prednison.
Không thấy tương tác giữa bortezomib (tiêm tĩnh mạch) và dexamethason (chất cảm ứng CYP3A4 yếu); giữa bortezomib và omeprazol (một chất ức chế CYP2C19 mạnh).
Hạ glucose huyết và tăng glucose huyết được báo cáo bất thường và thông thường trên bệnh nhân đái tháo đường đang dùng thuốc hạ glucose huyết dạng uống với bortezomib. Do đó, khi điều trị đồng thời với bortezomib, cần phải theo dõi chặt chẽ glucose huyết và có thể phải điều chỉnh liều thuốc hạ glucose huyết của bệnh nhân đang điều trị với thuốc hạ glucose huyết.
12 Tương kỵ
Thuốc này không được trộn lẫn với các chất khác trừ natri clorid.
13 Quá liều và xử trí
13.1 Triệu chứng
Sự khởi phát cơn hạ huyết áp cấp tính và giảm tiểu cầu với kết cục tử vong được ghi nhận ở bệnh nhân dùng gấp hai lần liều khuyến cáo.
13.2 Xử trí
Không có thuốc giải độc đặc hiệu. Cần theo dõi các dấu hiệu sống của bệnh nhân và chăm sóc hỗ trợ thích hợp để duy trì huyết áp (như bù dịch, uống thuốc tăng huyết áp, và hoặc thuốc làm tăng trương lực cơ) và nhiệt độ cơ thể.
Cập nhật lần cuối: 2017