Blinatumomab
1 sản phẩm
 Dược sĩ Hoàng Mai Dược sĩ lâm sàng
Dược sĩ Hoàng Mai Dược sĩ lâm sàng
Ước tính: 2 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
Tên chung quốc tế: Blinatumomab
Biệt dược thường gặp: Blincyto
Phân loại: Các kháng thể đơn dòng và liên hợp thuốc kháng thể.
Mã ATC: L01FX07
1 Dạng thuốc và hàm lượng
Bột pha Dung dịch tiêm chứa hàm lượng 38,5 mcg, 12,5 ug/1mL Blinatumomab.
2 Dược lực học
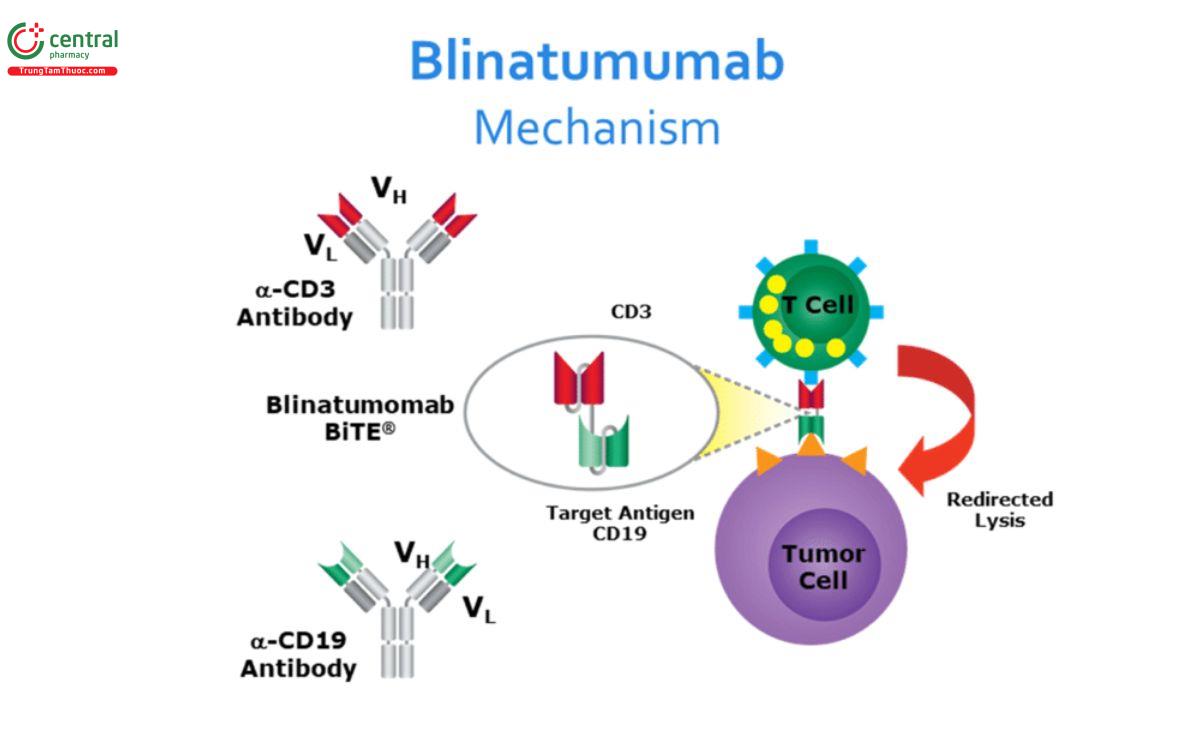
Blinatumomab là một protein hợp nhất bao gồm hai đoạn biến đổi chuỗi đơn được sắp xếp song song: đoạn đầu tiên liên kết với kháng nguyên bề mặt CD19 của tất cả các tế bào B và đoạn thứ hai nhắm vào kháng nguyên CD3 của tế bào T. Thuốc có hiệu quả trong điều trị các bệnh ung thư thể hiện mức CD19 cao như ung thư bạch cầu lympho cấp tính.
Bằng cách đưa các tế bào T và tế bào khối u lại với nhau, gây ra phản ứng miễn dịch, giải phóng các cytokine như TNF-α, IFN-γ, IL-6 và IL-10, tăng sự phân huỷ tế bào gen đột biến.
3 Dược động học
Hấp thu: thời gian thuốc đạt giá trị cao nhất trong huyết tương khoảng từ 1,2 đến 22,8 giờ, có giá trị AUC 11% và C max 42%.
Phân bố: Futibatinib có tỷ lệ liên kết với protein huyết tương là 95%, giá trị thể tích phân bố trung bình khoảng 66 L.
Chuyển hoá: con đường chuyển hoá chính của thuốc là quá trình oxy hóa CYP3A và một phần nhỏ qua CYP2C9 và CYP2D6.
Thải trừ: thuốc được bài tiết chủ yếu qua phân khoảng 91%, nước tiểu khoảng 9% và có thời gian bán huỷ khoảng 2,9 giờ.
4 Chỉ định
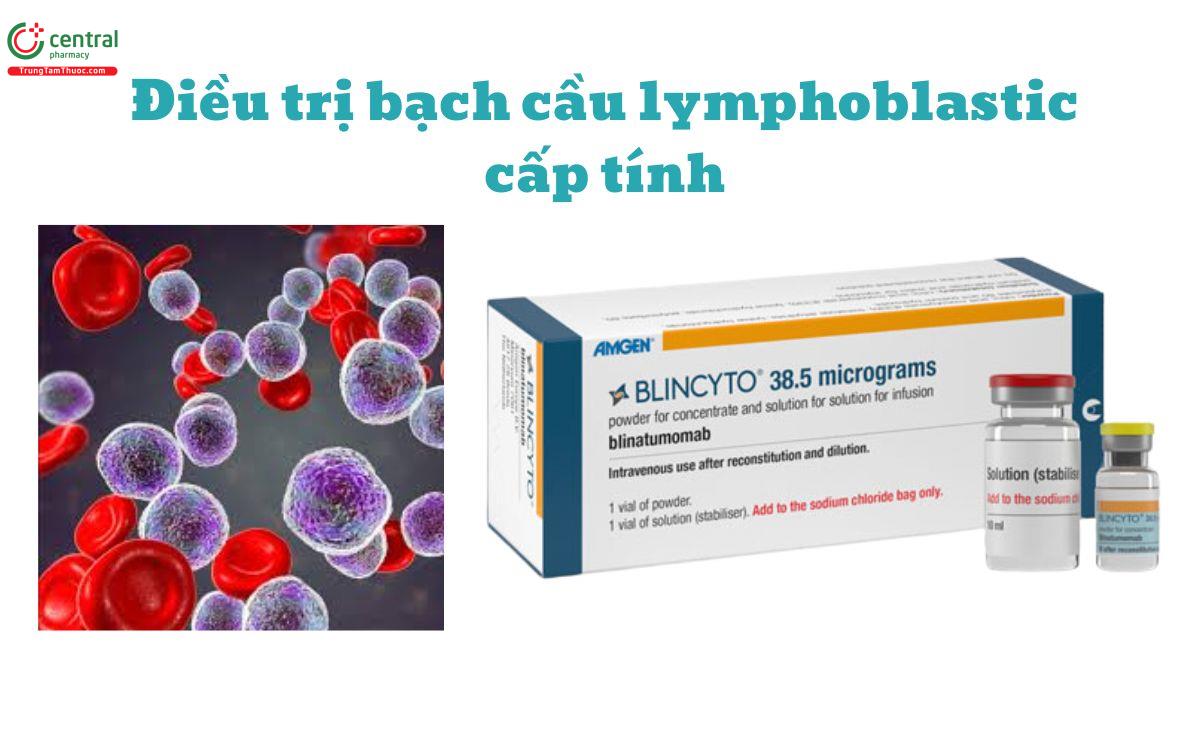
Blinatumomab được chỉ định điều trị:
- Bệnh bạch cầu lymphoblastic cấp tính tiền thân tế bào B (ALL) thuyên giảm với tỷ lệ tối thiểu (MRD) lớn hơn hoặc bằng 0,1%.
- Bệnh bạch cầu lymphoblastic cấp tính tiền thân tế bào B (ALL) tái phát hoặc thất bại với các thuốc trước đó.
- Bệnh bạch cầu lymphoblastic cấp tính tiền thân tế bào B (ALL) âm tính với nhiễm sắc thể Philadelphia, dương tính với CD19.

5 Chống chỉ định
Người mẫn cảm với thành phần của Blinatumomab.
6 Liều dùng - Cách dùng
6.1 Liều dùng
Liều khuyến cáo khi sử dụng thuốc ở người lớn cho từng đối tượng cụ thể như sau:
| Bệnh bạch cầu lymphoblastic cấp tính tiền thân tế bào B (ALL) thuyên giảm với tỷ lệ tối thiểu (MRD) lớn hơn hoặc bằng 0,1% | |
| Cân nặng 45 kg trở lên | Chu kỳ cảm ứng 1: Tiêm tĩnh mạch 28 mcg mỗi ngày từ Ngày 1 đến Ngày 28, sau đó nghỉ điều trị 14 ngày từ Ngày 29 đến Ngày 42 |
| Chu kỳ củng cố 2 đến 4: Tiêm tĩnh mạch 28 mcg mỗi ngày vào Ngày 1 đến Ngày 28, sau đó là khoảng thời gian không điều trị 14 ngày vào Ngày 29 đến Ngày 42 | |
| Cân nặng dưới 45 kg | Chu kỳ cảm ứng 1: Tiêm tĩnh mạch 15 mcg/m2 hàng ngày từ Ngày 1 đến Ngày 28 (tối đa 28 mcg/ngày), sau đó là khoảng thời gian không điều trị 14 ngày từ Ngày 29 đến Ngày 42 |
| Chu kỳ củng cố 2 đến 4: Tiêm tĩnh mạch 15 mcg/m2 hàng ngày vào Ngày 1 đến Ngày 28 (tối đa 28 mcg/ngày), sau đó là khoảng thời gian không điều trị 14 ngày vào Ngày 29 đến Ngày 42 | |
| Bệnh bạch cầu lymphoblastic cấp tính tiền thân tế bào B (ALL) tái phát hoặc thất bại với các thuốc trước đó | |
| Cân nặng 45 kg trở lên | Chu kỳ cảm ứng 1: Tiêm tĩnh mạch 9 mcg hàng ngày vào Ngày 1 đến Ngày 7, tiếp theo là tiêm tĩnh mạch 28 mcg hàng ngày vào Ngày 8 đến Ngày 28, tiếp theo là khoảng thời gian không điều trị 14 ngày vào Ngày 29 đến Ngày 42 |
| Chu kỳ cảm ứng 2: Tiêm tĩnh mạch 28 mcg mỗi ngày vào Ngày 1 đến Ngày 28, sau đó là khoảng thời gian không điều trị 14 ngày vào Ngày 29 đến Ngày 42 | |
| Chu kỳ củng cố 3 đến 5: Tiêm tĩnh mạch 28 mcg mỗi ngày vào Ngày 1 đến Ngày 28, sau đó là khoảng thời gian không điều trị 14 ngày vào Ngày 29 đến Ngày 42 | |
| Chu kỳ điều trị liên tục từ ngày 6 đến ngày 9: Tiêm tĩnh mạch 28 mcg mỗi ngày vào Ngày 1 đến Ngày 28, sau đó là khoảng thời gian không điều trị 56 ngày vào Ngày 29 đến Ngày 84 | |
| Cân nặng dưới 45 kg | Chu kỳ cảm ứng 1: Tiêm tĩnh mạch 5 mcg/m2 hàng ngày (tối đa 9 mcg/ngày) vào Ngày 1 đến Ngày 7, sau đó tiêm tĩnh mạch 15 mcg/m2 hàng ngày (tối đa 28 mcg/ngày) vào Ngày 8 đến Ngày 28, sau đó nghỉ điều trị 14 ngày vào Ngày 29 đến Ngày 42 |
| Chu kỳ cảm ứng 2: Tiêm tĩnh mạch 15 mcg/m2 hàng ngày (tối đa 28 mcg/ngày) vào Ngày 1 đến Ngày 28, sau đó là khoảng thời gian không điều trị 14 ngày vào Ngày 29 đến Ngày 42 | |
| Chu kỳ củng cố 3 đến 5: Tiêm tĩnh mạch 15 mcg/m2 hàng ngày (tối đa 28 mcg/ngày) vào Ngày 1 đến Ngày 28, sau đó là khoảng thời gian không điều trị 14 ngày vào Ngày 29 đến Ngày 42 | |
| Chu kỳ điều trị liên tục từ 6 đến 9: Tiêm tĩnh mạch 15 mcg/m2 hàng ngày (tối đa 28 mcg/ngày) vào Ngày 1 đến Ngày 28, sau đó là khoảng thời gian không điều trị 56 ngày vào Ngày 29 đến Ngày 84 | |
| Bệnh ALL tiền thân tế bào B âm tính với nhiễm sắc thể Philadelphia CD19 dương tính | |
| Cân nặng dưới 45 kg | Ngày 1-28, truyền 15 mcg/m 2 /ngày (không quá 28 mcg/ngày) truyền tĩnh mạch liên tục, không điều trị trong ngày từ 29-42 |
| Cân nặng 45 kg trở lên | Ngày 1-28, truyền tĩnh mạch liên tục 28 mcg/ngày, không điều trị trong ngày từ 29-42 |
6.2 Cách dùng
Thuốc dùng đường tiêm truyền đường tĩnh mạch, thực hiện tại bệnh viện bởi nhân viên y tế.
7 Tác dụng không mong muốn
Tác dụng phụ rất thường gặp như: sốt, giảm bạch cầu trung tính, phản ứng liên quan đến truyền dịch, giảm tiểu cầu, độc tính thần kinh, thiếu máu.
Tác dụng phụ thường gặp như: buồn nôn, đau đầu, nhiễm trùng, giảm bạch cầu trung tính, rung, tiêu chảy, rùng mình, thiếu máu, đau cơ xương, phát ban, giảm tiểu cầu, mất ngủ, phù nề, giảm bạch cầu, rối loạn nhịp tim, hạ huyết áp, nhiễm trùng do vi khuẩn, đau bụng, ho, tăng huyết áp, đau lưng, nhiễm trùng do virus, viêm miệng, xuất huyết.
Tác dụng phụ ít gặp như nhiễm trùng nấm, tăng cân, chóng mặt, bệnh não, đau cơ xương.
Tác dụng phụ hiếm gặp như Viêm phổi không điển hình, đông máu, nhiễm trùng, xuất huyết dưới màng cứng.
8 Tương tác thuốc
Chưa có nghiên cứu chính thức nào về tương tác của thuốc với các thuốc khác. Trong quá trình điều trị nếu dùng bất cứ thuốc nào cũng cần hỏi ý kiến bác sĩ
9 Thận trọng
Nguy cơ mắc hội chứng giải phóng cytokine (CRS) nghiêm trọng, đe doạ đến tính mạng đã được báo cáo khi sử dụng thuốc. Nếu gặp các triệu chứng như sốt, nhức đầu, buồn nôn, hạ huyết áp…cần dừng sử dụng và báo cáo với bác sĩ.
Thuốc có thể làm độc tính thần kinh nghiêm trọng gây tử vong, nên theo dõi các triệu chứng và báo cáo với bác sĩ sớm nhất.
Tăng nguy cơ nhiễm trùng khi sử dụng thuốc, nên hạn chế tiếp xúc với đối tượng nguy cơ nhiễm trùng cao.
Các báo cáo về hội chứng ly giải khối u, giảm bạch cầu trung tính đã được thông báo.
Cần xét nghiệm chức năng gan trước và trong khi dùng thuốc do thuốc gây độc tính cho gan.
Các bệnh nhân mắc bệnh viêm tụy, bệnh não trắng đã được báo cáo khi sử dụng thuốc.
10 Thời kỳ mang thai và cho con bú
Dựa trên cơ chế thuốc có thể sẽ gây độc cho thai nhi, nên không dùng cho phụ nữ mang thai, và phụ nữ có thể mang thai cần phải tránh thai trong thời gian dùng thuốc kéo dài ít nhất 48 giờ sau liều cuối cùng.
Chưa có báo cáo về thuốc có qua được sữa mẹ hay không, nhưng nguy cơ gây độc tính cho trẻ, không cho con bú trong khi sử dụng thuốc và kéo dài ít nhất 48 giờ sau liều điều trị cuối cùng.
11 Bảo quản
Bảo quản ở nhiệt độ phòng dưới 30°C.
Để xa tầm tay của trẻ nhỏ.
12 Quá liều
Chưa có báo cáo, trong trường hợp quá liều nên ngừng thuốc và cấp cứu.
13 Tài liệu tham khảo
Chuyên gia Drugbank. Blinatumomab. Drugbank. Truy cập ngày 12 tháng 11 năm 2024.
Chuyên gia Drugs.com. Blinatumomab . Drugs.com. Truy cập ngày 12 tháng 11 năm 2024.
Chuyên gia Pubchem. Blinatumomab. Pubchem. Truy cập ngày 12 tháng 11 năm 2024