Atezolizumab
1 sản phẩm
 Dược sĩ Cẩm Loan Dược sĩ lâm sàng
Dược sĩ Cẩm Loan Dược sĩ lâm sàng
Ước tính: 3 phút đọc, Ngày đăng:
Cập nhật:
Nếu phát hiện nội dung không chính xác, vui lòng phản hồi thông tin cho chúng tôi tại đây
Atezolizumab là một loại thuốc điều trị ung thư theo cơ chế miễn dịch. Bằng cách giúp tế bào miễn dịch tiêu diệt tế bào ung thư tốt hơn, thuốc Atezolizumab được chỉ định để nhiều loại ung thư khác nhau. Trong bài viết này, Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) xin gửi đến bạn đọc những thông tin về Atezolizumab.
1 Thông tin chung

Tên thuốc gốc (Hoạt chất)
- Atezolizumab.
- Biệt dược gốc: Tecentriq.
Loại thuốc
- Thuốc chống ung thư.
Dạng thuốc và hàm lượng
- Dung dịch đậm đặc để pha dung dịch tiêm truyền: 60mg/ml.
Mã ATC
- L - Chất chống ung thư và điều hòa miễn dịch
- L01 - Thuốc chống ung thư
- L01F - Kháng thể đơn dòng và liên hợp thuốc kháng thể
- L01FF - chất ức chế Pd-1/pdl-1 (protein chết tế bào theo chương trình 1/phối tử chết 1)
- L01FF05 - Atezolizumab
2 Thuốc Atezolizumab có tác dụng gì?
2.1 Dược lực học
Atezolizumab là một kháng thể đơn dòng nhân bản được sử dụng để ngăn chặn sự tương tác giữa PD-L1 và PD-1, loại bỏ sự ức chế phản ứng miễn dịch gặp ở một số bệnh ung thư. Thuốc này có thời gian tác dụng dài vì thường được dùng 3-4 tuần một lần. Atezolizumab không nên được sử dụng ở những bệnh nhân bị viêm phổi qua trung gian miễn dịch, viêm gan, viêm đại tràng và một số bệnh nội tiết.
2.2 Dược động học
Hấp thu: Phân tích dược động học được thực hiện ở những bệnh nhân ung thư biểu mô đường tiết niệu di căn. Ở những bệnh nhân này, AUC là 2,19-2,73ngày\*µg/mL/mg, C max là 0,27-0,35 µg/mL/mg và C min là 0,004-0,008 µg/mL/mg.
Phân bố: Thể tích phân bố của atezolizumab là 6,91L..
Chuyển hóa: Kháng thể đơn dòng được chia thành các polypeptide và axit amin nhỏ hơn.
Thải trừ: Atezolizumab không được bài tiết qua thận. Độ thanh thải của atezolizumab là 0,200L/ngày. Thời gian bán hủy của atezolizumab là 27 ngày.
2.3 Cơ chế hoạt động
Atezolizumab là một kháng thể IgG được nhân bản hóa, liên kết với PD-L1, ngăn chặn sự tương tác của nó với PD-1 và B7-1. Việc ngăn chặn sự tương tác của PD-L1 và PD-1 sẽ loại bỏ sự ức chế các phản ứng miễn dịch như phản ứng miễn dịch chống khối u nhưng không gây độc tế bào phụ thuộc kháng thể.
3 Chỉ định - Chống chỉ định
3.1 Chỉ định
Atezolizumab được chỉ định sử dụng trong các trường hợp:
- Ung thư phổi không phải tế bào nhỏ (NSCLC).
- Ung thư biểu mô tế bào gan (HCC).
- Ung thư phổi không phải tế bào nhỏ đã di căn.
- Khối u ác tính có một số đột biến nhất định trong gen BRAF.
- Ung thư vú có protein PD-L1.
- Ung thư biểu mô tuyến bàng quang tiến triển tại chỗ hoặc đã di căn.
3.2 Chống chỉ định
- Chống chỉ định Atezolizumab trên các bệnh nhân được biết là quá mẫn cảm với atezolizumab hoặc bất kỳ thành phần nào của thuốc.
4 Liều dùng - Cách dùng
5 Liều dùng
Ung thư biểu mô tiết niệu
- Sử dụng atezolizumab dưới dạng đơn độc 840 mg mỗi 2 tuần, 1200 mg mỗi 3 tuần hoặc 1680 mg mỗi 4 tuần.
NSCLC
- Trong môi trường bổ trợ, sử dụng atezolizumab sau khi cắt bỏ và tối đa 4 chu kỳ hóa trị liệu dựa trên bạch kim với liều 840 mg mỗi 2 tuần, 1200 mg mỗi 3 tuần hoặc 1680 mg mỗi 4 tuần trong tối đa 1 năm. Trong trường hợp di căn, dùng atezolizumab ở mức 840 mg mỗi 2 tuần, 1200 mg mỗi 3 tuần hoặc 1680 mg mỗi 4 tuần. Khi dùng hóa trị liệu có hoặc không có bevacizumab, hãy dùng atezolizumab trước khi hóa trị và bevacizumab khi dùng trong cùng một ngày.
Ung thư phổi tế bào nhỏ
- Dùng atezolizumab với liều 840 mg mỗi 2 tuần, 1200 mg mỗi 3 tuần hoặc 1680 mg mỗi 4 tuần. Khi dùng chung với Carboplatin và Etoposide, hãy dùng atezolizumab trước khi hóa trị liệu trong cùng một ngày.
Ung thư biểu mô tế bào gan
- Dùng atezolizumab với liều 840 mg mỗi 2 tuần, 1200 mg mỗi 3 tuần hoặc 1680 mg mỗi 4 tuần. Dùng TECENTRIQ trước bevacizumab khi dùng trong cùng ngày. Bevacizumab được dùng ở liều 15 mg/kg mỗi 3 tuần.
Khối u ác tính
- Sau khi hoàn thành chu kỳ 28 ngày dùng cobimetinib và vemurafenib, dùng atezolizumab 840 mg mỗi 2 tuần, 1200 mg mỗi 3 tuần hoặc 1680 mg mỗi 4 tuần với cobimetinib 60 mg uống một lần mỗi ngày (21 ngày bật / 7 ngày nghỉ) và vemurafenib 720 mg uống hai lần mỗi ngày.
5.1 Cách dùng
Không được tiêm tĩnh mạch nhanh.
Không được lắc.
Chuẩn bị
Kiểm tra bằng mắt thường các tiểu phân và sự đổi màu của bao bì và dung dịch pha tiêm truyền trước khi sử dụng. Dung dịch Atezolizumab không màu hoặc màu vàng nhạt.
Hủy bỏ lọ thuốc nếu dung dịch đục, đổi màu hoặc quan sát thấy các tiểu phân.
Hướng dẫn pha loãng
Atezolizumab cần được pha chế bởi một cán bộ y tế, sử dụng kĩ thuật vô trùng.
Chuẩn bị dung dịch để truyền như sau:
- Lấy 20 mL dung dịch đậm đặc Atezolizumab từ lọ thuốc
- Pha loãng với 250 mL túi polyvinyl clorua (PVC), polyethylene (PE), hoặc polyolefin (PO) có chứa dung dịch Natri clorid 0,9% pha tiêm.
- Chỉ được pha loãng thuốc với dung dịch tiêm truyền natri clorid 0,9%.
- Bảo quản dung dịch sau khi pha loãng
- Atezolizumab không chứa chất bảo quản, do đó, mỗi lọ chỉ được sử dụng một lần.
6 Tác dụng không mong muốn
Vấn đề về phổi: ho, hụt hơi, đau ngực
Vấn đề về đường ruột: tiêu chảy (phân lỏng) hoặc đi tiểu thường xuyên hơn bình thường, phân có màu đen, hắc ín, dính hoặc có máu hoặc chất nhầy, đau hoặc đau vùng bụng (bụng) nghiêm trọng
Vấn đề cuộc sống: vàng da hoặc lòng trắng mắt của bạn, buồn nôn hoặc nôn mửa nghiêm trọng, đau ở bên phải vùng dạ dày của bạn (bụng), nước tiểu sẫm màu (màu trà), chảy máu hoặc bầm tím dễ dàng hơn bình thường
Vấn đề về tuyến nội tiết tố: những cơn đau đầu không biến mất hoặc những cơn đau đầu bất thường, mắt nhạy cảm với ánh sáng, những vấn đề về mắt, tim đập loạn nhịp, tăng tiết mồ hôi, cực kỳ mệt mỏi, tăng cân hoặc giảm cân, cảm thấy đói hoặc khát hơn bình thường, đi tiểu thường xuyên hơn bình thường, rụng tóc, cảm thấy lạnh, táo bón, giọng nói của bạn trở nên trầm hơn, chóng mặt hoặc ngất xỉu, thay đổi tâm trạng hoặc hành vi, chẳng hạn như giảm ham muốn tình dục, cáu kỉnh hoặc hay quên.
Vấn đề về thận: giảm lượng nước tiểu của bạn, máu trong nước tiểu của bạn, sưng mắt cá chân của bạn, ăn mất ngon
Các vấn đề về da: phát ban, ngứa, phồng rộp da hoặc bong tróc vết loét hoặc vết loét đau ở miệng hoặc mũi, cổ họng hoặc vùng sinh dục, sốt hoặc các triệu chứng giống cúm, sưng hạch bạch huyết.
7 Tương tác thuốc
Chưa có nghiên cứu tương tác thuốc-thuốc đặc hiệu với atezolizumab.
8 Thận trọng
Thận trọng khi sử dụng thuốc đối với bệnh nhân bị dị ứng với Atezolizuma.
Trước khi nhận atezolizumab, hãy nói với bác sĩ nếu bạn bị Crohn, viêm loét đại tràng hoặc lupus, đã được ghép tạng, đã nhận được hoặc có kế hoạch nhận cấy ghép tế bào gốc sử dụng tế bào gốc của người hiến tặng (allogeneic), mắc một tình trạng ảnh hưởng đến hệ thần kinh, đã được điều trị bức xạ vào vùng ngực.
Thời kỳ mang thai: Hãy cho bác sĩ của bạn nếu bạn đang mang thai hoặc dự định có thai. atezolizumab có thể gây hại cho thai nhi của bạn.
Thời kỳ cho con bú: Hãy cho bác sĩ của bạn nếu bạn đang cho con bú hoặc dự định cho con bú. Người ta không biết liệu atezolizumab có truyền vào sữa mẹ hay không. Không cho con bú trong thời gian điều trị và ít nhất 5 tháng sau liều atezolizumab cuối cùng.
9 Bảo quản
Bảo quản lọ atezolizumab trong tủ lạnh ở nhiệt độ 2°C đến 8°C (36°F đến 46°F) trong thùng carton ban đầu để tránh ánh sáng.
Đừng đóng băng.
Đừng lắc.
10 Nghiên cứu về Atezolizuma trong Y học
Pembrolizumab và atezolizumab trong ung thư vú bộ ba âm tính
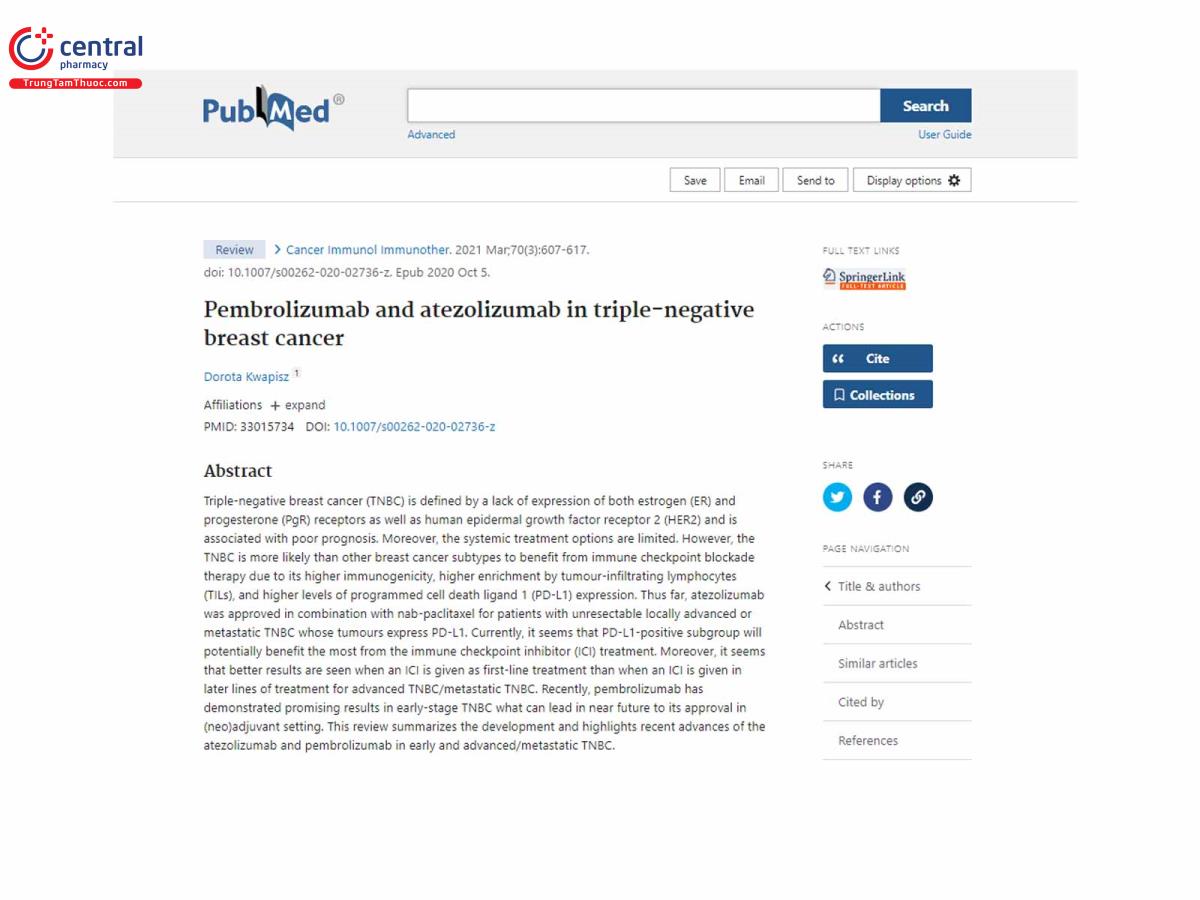
Ung thư vú âm tính bộ ba (TNBC) được xác định là do thiếu biểu hiện của cả thụ thể estrogen (ER) và Progesterone (PgR) cũng như thụ thể yếu tố tăng trưởng biểu bì 2 ở người (HER2) và có liên quan đến tiên lượng xấu. Hơn nữa, các lựa chọn điều trị toàn thân còn hạn chế. Tuy nhiên, TNBC có nhiều khả năng hơn các phân nhóm ung thư vú khác được hưởng lợi từ liệu pháp phong tỏa điểm kiểm tra miễn dịch do khả năng miễn dịch cao hơn, khả năng làm giàu cao hơn nhờ các tế bào lympho thâm nhiễm khối u (TIL) và mức độ phối tử chết tế bào được lập trình 1 (PD-L1) cao hơn sự biểu lộ. Cho đến nay, atezolizumab đã được phê duyệt kết hợp với nab-paclitaxel cho những bệnh nhân mắc TNBC di căn hoặc tiến triển cục bộ không thể cắt bỏ có khối u biểu hiện PD-L1. Hiện nay, có vẻ như phân nhóm dương tính với PD-L1 sẽ có khả năng được hưởng lợi nhiều nhất từ điều trị bằng thuốc ức chế điểm kiểm soát miễn dịch (ICI). Hơn nữa, có vẻ như kết quả tốt hơn khi ICI được sử dụng như điều trị đầu tay so với khi ICI được sử dụng trong các dòng điều trị sau đối với TNBC tiến triển/TNBC di căn. Gần đây, pembrolizumab đã chứng minh những kết quả đầy hứa hẹn trong TNBC giai đoạn đầu, điều có thể dẫn đến việc phê duyệt nó trong môi trường bổ trợ (tân) trong tương lai gần. Đánh giá này tóm tắt sự phát triển và nêu bật những tiến bộ gần đây của atezolizumab và pembrolizumab trong TNBC giai đoạn sớm và tiến triển/di căn. pembrolizumab đã cho thấy những kết quả đầy hứa hẹn trong TNBC giai đoạn đầu, điều có thể dẫn đến việc phê duyệt thuốc này trong môi trường bổ trợ (tân) trong tương lai gần. Đánh giá này tóm tắt sự phát triển và nêu bật những tiến bộ gần đây của atezolizumab và pembrolizumab trong TNBC giai đoạn sớm và tiến triển/di căn. Pembrolizumab đã cho thấy những kết quả đầy hứa hẹn trong TNBC giai đoạn đầu, điều có thể dẫn đến việc phê duyệt thuốc này trong môi trường bổ trợ (tân) trong tương lai gần. Đánh giá này tóm tắt sự phát triển và nêu bật những tiến bộ gần đây của atezolizumab và pembrolizumab trong TNBC giai đoạn sớm và tiến triển/di căn.
Atezolizumab: Kháng thể chặn PD-L1 điều trị ung thư bàng quang
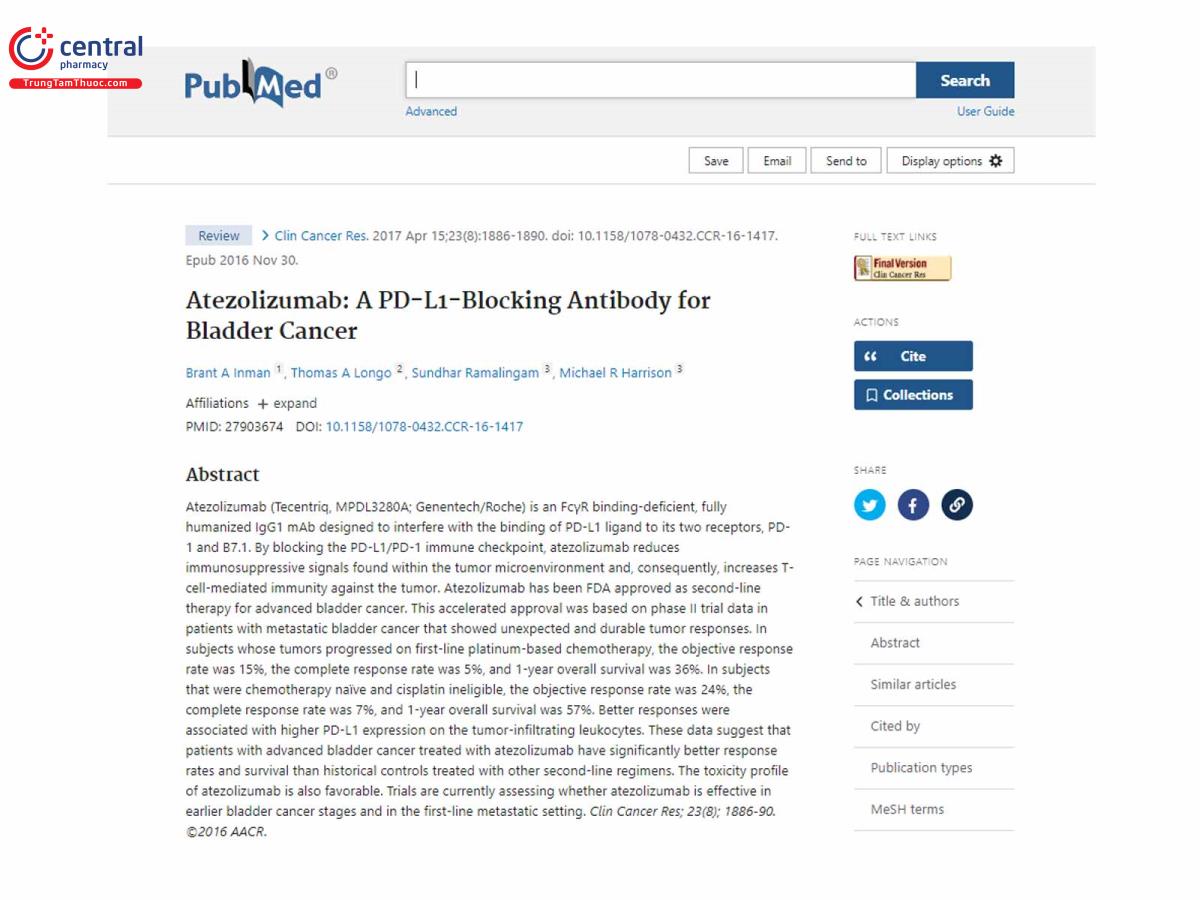
Atezolizumab (Tecentriq, MPDL3280A; Genentech/Roche) là một kháng thể IgG1 mAb được nhân tính hóa hoàn toàn, thiếu liên kết FcγR, được thiết kế để can thiệp vào sự liên kết của phối tử PD-L1 với hai thụ thể của nó là PD-1 và B7.1. Bằng cách chặn điểm kiểm tra miễn dịch PD-L1/PD-1, atezolizumab làm giảm các tín hiệu ức chế miễn dịch được tìm thấy trong môi trường vi mô khối u và do đó, làm tăng khả năng miễn dịch qua trung gian tế bào T chống lại khối u. Atezolizumab đã được FDA chấp thuận là liệu pháp thứ hai cho bệnh ung thư bàng quang tiến triển. Sự phê duyệt nhanh chóng này dựa trên dữ liệu thử nghiệm giai đoạn II ở những bệnh nhân ung thư bàng quang di căn cho thấy phản ứng bất ngờ và lâu dài của khối u. Ở những đối tượng có khối u tiến triển bằng hóa trị liệu đầu tay dựa trên bạch kim, tỷ lệ đáp ứng khách quan là 15%, tỷ lệ đáp ứng hoàn toàn là 5% và tỷ lệ sống sót chung sau 1 năm là 36%. Ở những đối tượng chưa từng dùng hóa trị liệu và không đủ điều kiện dùng Cisplatin, tỷ lệ đáp ứng khách quan là 24%, tỷ lệ đáp ứng hoàn toàn là 7% và tỷ lệ sống sót chung sau 1 năm là 57%. Phản ứng tốt hơn có liên quan đến biểu hiện PD-L1 cao hơn trên bạch cầu xâm nhập khối u. Những dữ liệu này cho thấy những bệnh nhân ung thư bàng quang tiến triển được điều trị bằng atezolizumab có tỷ lệ đáp ứng và khả năng sống sót tốt hơn đáng kể so với các biện pháp kiểm soát trước đây được điều trị bằng các phác đồ bậc hai khác. Đặc tính độc tính của atezolizumab cũng thuận lợi. Các thử nghiệm hiện đang đánh giá liệu atezolizumab có hiệu quả trong giai đoạn ung thư bàng quang sớm hơn và trong bối cảnh di căn bậc một hay không. Phản ứng tốt hơn có liên quan đến biểu hiện PD-L1 cao hơn trên bạch cầu xâm nhập khối u. Những dữ liệu này cho thấy những bệnh nhân ung thư bàng quang tiến triển được điều trị bằng atezolizumab có tỷ lệ đáp ứng và khả năng sống sót tốt hơn đáng kể so với các biện pháp kiểm soát trước đây được điều trị bằng các phác đồ bậc hai khác. Đặc tính độc tính của atezolizumab cũng thuận lợi. Các thử nghiệm hiện đang đánh giá liệu atezolizumab có hiệu quả trong giai đoạn ung thư bàng quang sớm hơn và trong bối cảnh di căn bậc một hay không. Phản ứng tốt hơn có liên quan đến biểu hiện PD-L1 cao hơn trên bạch cầu xâm nhập khối u. Những dữ liệu này cho thấy những bệnh nhân ung thư bàng quang tiến triển được điều trị bằng atezolizumab có tỷ lệ đáp ứng và khả năng sống sót tốt hơn đáng kể so với các biện pháp kiểm soát trước đây được điều trị bằng các phác đồ bậc hai khác. Đặc tính độc tính của atezolizumab cũng thuận lợi. Các thử nghiệm hiện đang đánh giá liệu atezolizumab có hiệu quả trong giai đoạn ung thư bàng quang sớm hơn và trong bối cảnh di căn bậc một hay không.
11 Tài liệu tham khảo
- Tác giả Brant A Inman và cộng sự (Đăng ngày 15 tháng 04 năm 2017). Atezolizumab: A PD-L1-Blocking Antibody for Bladder Cancer, Pubmed. Truy cập ngày 25 tháng 8 năm 2023.
- Tác giả Dorota Kwapisz (Đăng tháng 3 năm 2021). Pembrolizumab and atezolizumab in triple-negative breast cancer, Pubmed. Truy cập ngày 25 tháng 8 năm 2023.
- Chuyên gia Pubchem. Atezolizumab, Pubchem. Truy cập ngày 24 tháng 8 năm 2023.
- Chuyên gia Drugs. Atezolizumab, Drugs. Truy cập ngày 24 tháng 8 năm 2023.