Hình ảnh bất thường phổi kẽ trên chụp CT SCAN ngực và định hướng nghiên cứu chụp định lượng
Tác giả: Hoàng Thị Triều Nghi
*Phòng khám đa khoa Ngọc Minh, TP. Hồ Chí Minh
(Trích từ Tạp chí Lao và Bệnh phổi Việt Nam số 36, tháng 3/2025)
Tải bản PDF bản dịch TẠI ĐÂY
1 ĐẠI CƯƠNG
Bệnh phổi kẽ (Interstitial Lung Disease - ILD) bao gồm một nhóm nhiều bệnh lý với các đặc điểm sinh lý, lâm sàng, hình ảnh học đa dạng, chồng chéo [1]. Các bất thường mô kẽ ở phổi (ILAs) được định nghĩa là sự hiện diện của các dấu hiệu hình ảnh học được phát hiện trên cắt lớp vi tính (CLVT) với trường khảo sát qua toàn bộ hay một phần nhu mô phổi. Vì ILAs có liên quan đến các triệu chứng, suy giảm chức năng hô hấp, nguy cơ tiến triển và tăng tỷ lệ tử vong do mọi nguyên nhân, nên việc ghi nhận và định hướng chẩn đoán các bất thưởng này có ý nghĩa lâm sàng [2].
Thuật ngữ ILAs ngày càng được chú ý hơn trong cộng đồng y khoa lâm sàng cũng như nghiên cứu, một vài khái niệm, thuật ngữ đi kèm được đồng thuận trong Báo cáo của Hội phổi Fleischner 2020 [3]. ILAs không bao gồm điều kiện không hiện diện các triệu chứng hoặc không suy giảm chức năng hô hấp, nhưng khi đi kèm các biểu hiện hô hấp trên lâm sàng, ILAs có khả năng đại diện cho ILD nhẹ hơn là bất thường dưới lâm sàng. Định nghĩa về ILAs hoàn toàn là khái niệm về mặt hình ảnh học, và sự phân biệt giữa ILAs và ILD phải dựa trên đánh giá lâm sàng.
Các nghiên cứu lớn đã cho thấy tỷ lệ ILAs ở người lớn tuổi (>60 tuổi) là 4-9% ở nhóm có hút thuốc và 2-7% ở nhóm người không hút thuốc [4]. Tuy nhiên, sự hiện diện của các bất thường này không được ghi nhận thường quy trên các kết quả đọc CLVT ngay cả tại các bệnh viện trung tâm [5]. Trên thực tế ILAs có khả năng được tìm thấy ngày càng nhiều hơn với việc áp dụng tầm soát ung thư phổi và tăng cường sử dụng CLVT cho các mục đích chẩn đoán khác [6].
2 ĐẶC ĐIỂM VÀ Ý NGHĨA LÂM SÀNG BẤT THƯỜNG MÔ KẼ Ở PHỔI
2.1 Định nghĩa và thuật ngữ được sử dụng để mô tả bất thường mô kẽ ở phổi
Các thuật ngữ từng được sử dụng để mô tả các bất thường mô kẽ trong y văn bao gồm những thay đổi mô kẽ giai đoạn sớm [7], ILD sớm [8], ILD [9], ILD dưới lâm sàng [10], và ILD tiền lâm sàng [11]. Trên thực tế, ILAs không đồng nghĩa với ILD dưới lâm sàng vì một nhóm nhỏ bệnh nhân ILAs có các triệu chứng và suy giảm chức năng hô hấp mà không nghi ngờ ILD. Một nhóm nhỏ bệnh nhân ILAs khác có nguy cơ tiến triển thành bệnh có ý nghĩa lâm sàng. Các bất thường được xác định trong quá trình sàng lọc ILD ở các nhóm bệnh nhân nguy cơ cao (ví dụ: những bệnh nhân bị viêm khớp dạng thấp, xơ cứng bì hệ thống hoặc ILD gia đình) không được coi là ILAs vì các triệu chứng này không còn là ngẫu nhiên và có thể được gọi là ILD tiền lâm sàng.
ILAs được mô tả là các bất thường chiếm hơn 5% vùng phổi bất kỳ (phân vùng phổi trên, giữa và dưới được xác định bằng bờ dưới cung động mạch chủ ngực và bờ dưới tĩnh mạch phổi dưới bên phải) (Hình 4A) [4]. Trong các mô tả ban đầu, ILA bao gồm các bất thường kính mờ hoặc lưới, nốt trung tâm tiểu thùy lan tỏa, giãn phế quản co kéo, tổ ong và kén khí (không bao gồm khí phế
thũng) (Hình 4B, C). Các nốt trung tâm tiểu thùy, là biểu hiện điển hình của viêm tiểu phế quản hô hấp [12] nên không được bao gồm vào ILAs vì đặc điểm này là phổ biến trong các hình chụp sàng lọc ung thư phổi ở bệnh nhân hút thuốc, thường không tiến triển và không liên quan đến xơ hóa. Mặc dù ngưỡng 5% mang tính ước lượng, nhưng được giữ lại để loại trừ các tổn thương tối thiểu và phù hợp với các y văn đã xuất bản trước đây. Bệnh lý xơ phổi màng phổi (pleuropulmonary fibroelastosis), đôi khi được phát hiện ngẫu nhiên trên CLVT, là một khái niệm độc lập không được ghi nhận là ILAs trong y văn [13].
2.2 Quy trình CLVT đánh giá và theo dõi bệnh nhân có ILAs
Khi phát hiện ILA, cần chụp CLVT lồng ngực có thể giúp xác nhận và xác định đặc điểm bất thường, đặc biệt nếu có xẹp phổi thụ động và hình chụp ban đầu không đầy đủ (ví dụ: chụp CLVT bụng), hoặc nếu chụp ngực không có lát cắt mỏng, bằng kỹ thuật liều siêu thấp (ultra low dose CT), hoặc sử dụng các phương pháp tái tạo lặp lại thế hệ ban đầu, có thể che khuất các chi tiết nhỏ trong nhu mô phổi. Khi thực hiện CLVT lồng ngực để đánh giá ILAs, cần lát cắt mỏng (<1,5 mm), kỹ thuật tái tạo tần số cao vừa phải (edge - enhancing) đôi khi hữu ích. Quy trình khảo sát ILAs chuẩn được khuyến nghị theo hướng dẫn năm 2018 [14]. Kỹ thuật chụp nằm sấp đặc biệt quan trọng để phân biệt bất thường kẽ thực sự hay xẹp phổi do tư thế, hình chụp thì thở ra có khả năng xác định bẫy khí là dấu hiệu nhận biết viêm phổi quá mẫn.
2.3 Phân loại ILAs trên chẩn đoán hình ảnh
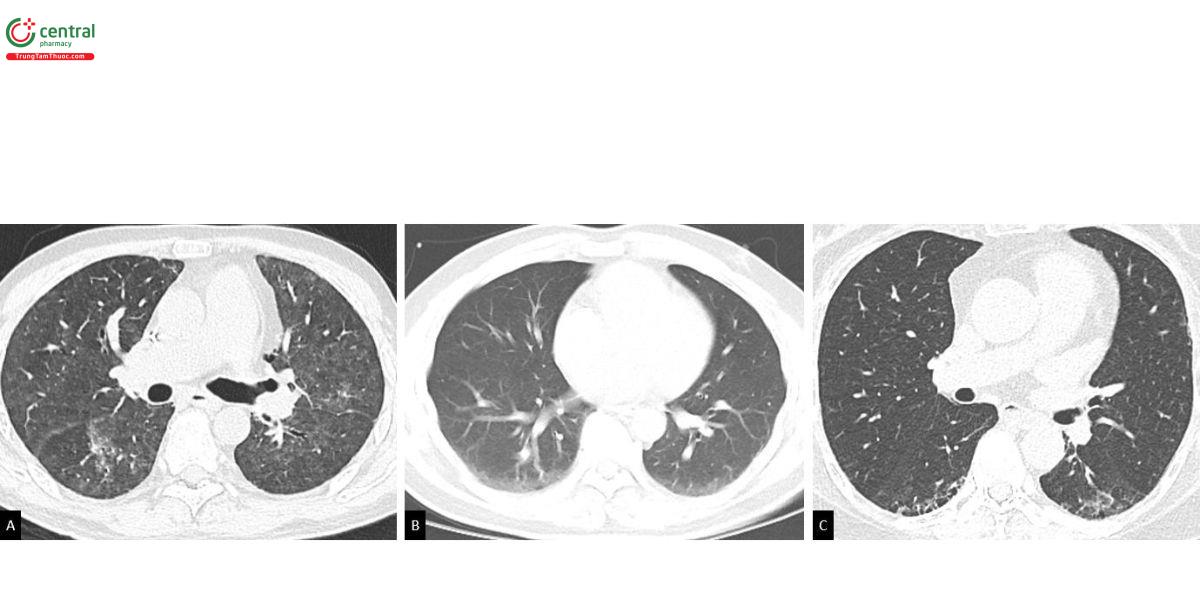
Việc phân loại các đặc điểm ILA sau đây có ý nghĩa tiên lượng: Nhóm một, tổn thương kính mờ và dạng lưới không phân bố ưu thế dưới màng phổi; Nhóm hai, tổn thương kính mờ và dạng lưới phân bố ưu thế dưới màng phổi nhưng không có bằng chứng xơ hóa; Và cuối cùng là dãn phế quản co kéo, biến dạng kiến trúc, tổ ong, kén khí gợi ý tiến trình xơ hóa [15, 16] (Hình 1). Kén khí (không bao gồm khí phế thũng), được định nghĩa là các hình sáng có thành không đều, rõ ràng, thường thấy ở những người hút thuốc lá. Các kén khí này có thể được phân biệt với khí thũng bởi có thành bao quanh rõ ràng và phân biệt với tổ ong bởi hình dạng không đều, kích thước khác nhau và không có ưu thế dưới màng phổi [17].
2.4 Bản chất giải phẫu bệnh ILAs
Hiện có rất ít nghiên cứu được báo cáo tương quan bệnh lý mô học và ILAs trên hình ảnh học. Các bằng chứng ít ỏi cho thấy mô bệnh học của ILAs có thể là xơ hóa mô kẽ liên quan đến hút thuốc (chiếm đa số), kế đến là viêm phổi kẽ thông thường (Usual interstitial pneumonia - UIP), mô tế bào phổi Langerhans, viêm phổi kẽ không đặc hiệu (Nonspecific interstitial pneumonia - NSIP) và bệnh a-mi-ăng. Tuy nhiên, các mô tả này có thể có sai lệch do chủ yếu ghi nhận ở các nhóm nghiên cứu trên người hút thuốc tham gia sàng lọc ung thư hay trên các mẫu mô cắt lọc từ bệnh phẩm u phổi [18].
3 Ý NGHĨA LÂM SÀNG CỦA BẤT THƯỜNG PHỔI KẼ
3.1 Tương quan giữa ILAs và chức năng hô hấp
Sự tiến triển của ILAs và suy giảm chức năng hô hấp đã được báo cáo trong Nghiên cứu tim Framingham [19]. Tiến triển xảy ra ở 6% quần thể bệnh nhân có ILAs mới xuất hiện hoặc sẵn có trong khoảng 6 năm theo dõi. Bệnh nhân ILAs tiến triển trong Nghiên cứu tim Framingham giảm nhanh dung tích sống gắng sức (FVC) so với những bệnh nhân không có ILAs hoặc những người có ILAs không tiến triển. Tuy nhiên, sự suy giảm FVC hàng năm khoảng 60 ml ở những bệnh nhân có ILAs tiến triển và khoảng 30 mL ở những người không có ILAs trong Nghiên cứu tim Framingham, thấp hơn đáng kể so với sự suy giảm FVC hàng năm thường được ghi nhận ở những bệnh nhân xơ phổi vô căn (Idiopathic pulmonary fibrosis - IPF), vào khoảng 200 mL mỗi năm.
3.2 Các yếu tố nguy cơ ILA tiến triển
Ước tính có khoảng 20% ILAs tiến triển sau 2 năm theo dõi trong nghiên cứu NLST (National Lung Screening Trial 7) và 48% sau 5 năm theo dõi AGESReykjavik [15]. Các yếu tố nguy cơ tiến triển trên lâm sàng bao gồm: hút thuốc lá, hít các dị nguyên trong môi trường sinh hoạt, lao động, yếu tố di truyền (MUC5B), thuốc điều trị, xạ trị, phẫu thuật lồng ngực, suy giảm chức năng hô hấp. Về mặt hình thái, ILAs có phân bố không ưu thế dưới màng phổi thường không tiến triển và không tăng tỷ lệ tử vong. ILA dưới màng phổi có nguy cơ tiến triển cao hơn và được phân loại thêm theo sự hiện diện hoặc không có tình trạng xơ hóa [15]. ILA xơ hóa có khả năng tiến triển và tử vong cao hơn khi theo dõi 5 năm. Nếu có biểu hiện xơ hóa, kiểu hình này có thể được phân loại theo Hiệp hội Fleischner và Lồng ngực Hoa Kỳ năm 2018, Các tiêu chí của Hội Hô hấp Hoa kỳ, Hội hô hấp Châu Âu, Hội Hô hấp Nhật Bản (Fleischner, ATS, ERS, JRS) là xơ phổi kẽ thông thường điển hình UIP (typical), UIP có thể xảy (probable) hoặc UIP không xác định (inderminate) [14]. Khoảng 2% bệnh nhân trong nghiên cứu AGES-Reykjavik có kiểu hình UIP có thể hoặc xác định.
Các đặc điểm hình ảnh đặc hiệu giúp xác định khả năng tiến triển ILAs trong khoảng thời gian 5 năm [15] bao gồm các bất thường phân bố dưới màng phổi, ưu thế thùy dưới hoặc giãn phế quản co kéo có tỷ lệ tiến triển gấp sáu lần so với ILA không có các đặc điểm này. Trong số đó, tất cả các trường hợp có hình ảnh tổ ong đều tiến triển trong 5 năm. Ngược lại, sự hiện diện của các nốt trung tâm không liên quan khả năng tiến triển của ILAs.
3.3 Dự hậu ILAs
Một trong những ghi nhận có tính đồng thuận cao giữa các nghiên cứu liên quan đến ILAs là mối liên quan đến việc tăng tỷ lệ tử vong, cả trong các mẫu dân số nói chung và trong quần thể người hút thuốc kèm COPD hoặc quần thể tham gia sàng lọc ung thư phổi [15,19]. Trong Nghiên cứu tim Framingham và các nghiên cứu đoàn hệ AGES Reykjavik, sự gia tăng tỷ lệ tử vong này có liên quan chặt chẽ nhất với sự tiến triển hình ảnh của ILAs. Ngoài việc tăng tỷ lệ tử vong do mọi nguyên nhân, ILAs có liên quan đến tăng tỷ lệ tử vong do hô hấp trong nghiên cứu AGES Reykjavik. Theo báo cáo trên nhóm bệnh nhân có hội chứng đáp ứng viêm toàn thân hoặc nhiễm trùng huyết của Bệnh viện phụ sản Brigham, ILAs có liên quan đến tăng tỷ lệ hội chứng suy hô hấp cấp tính và tăng tỷ lệ tử vong nội viện [20]. ILAs cũng có liên quan đến việc tăng tỷ lệ tử vong ở những người được thay van động mạch chủ qua da [21]. Các quan sát này cho thấy rằng mặc dù một số mối liên hệ giữa ILAs và tử vong có thể là do xơ phổi, nhưng những bệnh nhân ILAs có thể có nguy cơ tử vong tăng do lão hóa sinh lý nhanh chóng hoặc các nguyên nhân tử vong khác không liên quan trực tiếp đến bệnh phổi [2].
3.4 Liên quan ILAs và ung thư phổi
Tỷ lệ ILAs trong quần thể bệnh nhân ung thư phổi dao động từ 2,5% đến 14%. Nguy cơ ung thư phổi ở bệnh nhân có ILAs tăng gấp 7-14 lần so với dân số chung. Một số nghiên cứu đã chỉ ra mối liên quan giữa ILAs trước khi điều trị và tỷ lệ tử vong liên quan đến ung thư, bao gồm bệnh nhân ung thư giai đoạn đầu được điều trị bằng phẫu thuật [22] cũng như bệnh nhân mắc bệnh giai đoạn 4 tiến triển được điều trị bằng liệu pháp toàn thân [23]. Nguyên nhân làm tăng tỷ lệ tử vong vẫn chưa rõ ràng, nhưng các nghiên cứu cho thấy nguy cơ tổn thương phổi ILAs và liệu pháp điều trị ung thư có thể đóng vai trò quan trọng. Chiếu xạ phổi, điều trị toàn thân bằng hóa trị, thuốc ức chế tyrosine kinase nhắm trúng đích, thuốc ức chế điểm kiểm soát miễn dịch và liên hợp kháng thể - thuốc có liên quan đến việc tăng nguy cơ viêm phổi ở những bệnh nhân có ILAs từ trước.
Những năm gần đây, thuốc ức chế điểm kiểm soát miễn dịch đã nổi lên như một liệu pháp đầu tay tiêu chuẩn cho bệnh nhân ung thư phổi không tế bào nhỏ tiến triển và các khối u ác tính khác. Nhìn chung, tỷ lệ viêm phổi liên quan đến liệu pháp miễn dịch là khoảng 5% và độc tính này có thể kiểm soát được khi được phát hiện sớm và điều trị thích hợp [24]. Nakanishi và cs ghi nhận nguy cơ viêm phổi liên quan đến liệu pháp miễn dịch (kháng thể kháng PD-1 Nivolumab hoặc Pembrolizumab) ở mức cao 17% trên bệnh nhân có ILAs trên CLVT ngực trước điều trị với kiểu hình tổn thương kính mờ ưu thế. Với tính chất đe dọa tính mạng của các khối u ác tính, lợi ích của liệu pháp và các nguy cơ không xác định liên quan đến ILAs, các bác sỹ lâm sàng nên thảo luận về nguy cơ viêm phổi khi lựa chọn liệu pháp, theo dõi tích cực các triệu chứng, thay đổi sinh lý và tiến triển hình ảnh học ở những bệnh nhân này khi quyết định điều trị.
3.5 Phân biệt ILAs và tổn thương tồn lưu sau COVID-19
Nghiên cứu của Lee và cs (2024) trên 40 trường hợp ILAs (20 không xơ hoá, 20 xơ hoá) và 20 trường hợp hậu COVID-19 (theo dõi sau mắc trên 6 tháng) cho thấy bác sỹ Chẩn đoán hình ảnh có khả năng chẩn đoán tốt nhưng độ đồng thuận ở mức trung bình trong phân biệt sẹo tồn lưu hậu COVID-19 và ILAs [25]. Nhầm lẫn dễ xảy ra trong phân biệt sẹo COVID-19 và ILAs không xơ hóa và khi đó, thông tin về tiền căn mắc COVID-19 là đặc biệt quan trọng. Ở những bệnh nhân từng mắc COVID-19 nặng hoặc đã có tổn thương phổi trên CLVT sau COVID-19, ILAs không xơ hóa thường được loại trừ.
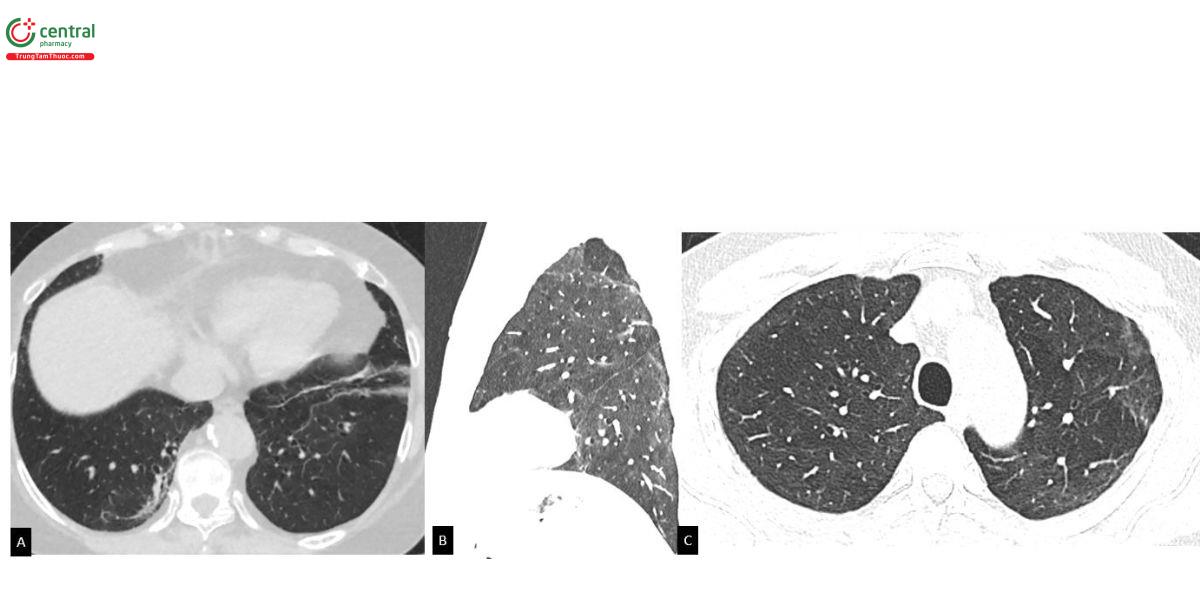
Các đặc điểm hình ảnh phân biệt ILAs và sẹo hậu COVID-19 [25] bao gồm: Cách phân bố ưu thế dưới màng phổi, vùng lưng, đáy phổi và các kén khí (không bao gồm khí phế thũng) thường gặp hơn trong ILAs. Tổn thương quanh phân thùy phổi, quanh cây mạch máu phế quản, các dải xơ xẹp, và tưới máu dạng khảm thường gặp hơn trong hậu COVID-19. Tổn thương chiếm hơn 25% thể tích phổi thường gặp hơn trong hậu COVID-19. Kiểu hình kính mờ ưu thế thường gặp trong hậu COVID-19 và ILAs không xơ hoá hơn các trường hợp ILAs xơ hoá.
3.6 ILAs nên được đánh giá và quản lý như thế nào?
Ở tất cả các bệnh nhân, việc đầu tiên cần đánh giá loại trừ ILD có thể có bằng đánh giá toàn diện các yếu tố giải thích sự hiện diện của ILAs, bao gồm hút thuốc lá hoặc phơi nhiễm hít khác, độc tính của thuốc, bệnh toàn thân (ví dụ: rối loạn mô liên kết tiềm ẩn), hoặc trào ngược thực quản. Những bệnh nhân có triệu chứng lâm sàng, bất thường chức năng hô hấp, hoặc bất thường CLVT lan rộng (tổn thương liên quan đến từ ba phân vùng trở lên trong số sáu vùng nhu mô phổi phân định như trên Hình 4A [4] cần được thăm khám chuyên khoa hô hấp hoặc hội chẩn đa chuyên khoa. Việc quản lý bệnh nhân được chẩn đoán ILD nên tuân theo các hướng dẫn tiêu chuẩn. Sau khi loại trừ ILD, ILAs có thể được tách thành nhóm ILAs có nguy cơ thấp và cao tiến triển thành ILD. Các yếu tố nguy cơ tiến triển bao gồm hút thuốc lá, phơi nhiễm hít phải khác, thuốc, các thay đổi chức năng hô hấp hoặc trao đổi khí không đạt đến ngưỡng có ý nghĩa lâm sàng và các đặc điểm hình ảnh học gợi ý xơ hóa và kiểu phân bố dưới màng phổi, ưu thế đáy phổi. Theo dõi bệnh nhân ILAs có thể dựa trên sự hiện diện của các yếu tố nguy cơ tiến triển. Những người không có yếu tố nguy cơ nên được khuyên quay lại để đánh giá nếu họ có các triệu chứng suy hô hấp, tùy điều kiện thực tế. Ngược lại, ở bệnh nhân có một hoặc nhiều yếu tố nguy cơ, cần xem xét theo dõi chặt chẽ hơn. Khoảng thời gian thích hợp để tái khám và đánh giá tổng thể (bao gồm hỏi bệnh và thăm khám, hình ảnh học, thăm dò chức năng hô hấp) vẫn chưa được thống nhất. Theo kinh nghiệm lâm sàng cho thấy tái khám đầu tiên sau 3-12 tháng để tầm soát triệu chứng tiến triển có thể phù hợp ở hầu hết bệnh nhân có nguy cơ cao.
Tương tự, khoảng thời gian tối ưu cho chụp CLVT theo dõi vẫn chưa được đồng thuận, nhưng có thể chụp theo dõi sau 12-24 tháng hoặc sớm hơn ở những bệnh nhân xuất hiện triệu chứng hoặc suy giảm chức hô hấp. Bệnh lý tiến triển có thể được xác định bởi xuất hiện nặng thêm các triệu chứng hô hấp (ví dụ: hạn chế tập thể dục hoặc tiếng rale nổ đặc trưng khi thăm khám bằng ống nghe), suy giảm chức năng hô hấp và trao đổi khí, hoặc gia tăng của các bất thường ILAs trên CLVT, đặc biệt là với sự xuất hiện các dấu hiệu chỉ điểm xơ hóa. Hướng dẫn điều trị tối ưu ILAs tiến triển vẫn chưa rõ ràng, vì vậy nhóm bệnh nhân này có thể là đối tượng thích hợp cho một thử nghiệm lâm sàng tiến cứu. Ở những bệnh nhân ILAs có bệnh lý cần phẫu thuật hoặc điều trị bệnh lý khác, cần thận trọng và có kế hoạch theo dõi nghiêm ngặt hơn vì họ thường có nguy cơ cao diễn tiến bệnh nhanh chóng hoặc vào đợt cấp. Vì thông khí áp lực dương có thể là yếu tố nguy cơ phát triển suy hô hấp cấp tính ở bệnh nhân ILAs, nên cân nhắc lựa chọn thở máy lưu lượng, áp suất thấp khi cần thở máy. Ngoài ra, nên tránh các loại thuốc được biết là gây ra ILD nếu có thể trên nhóm bệnh nhân này.
4 VAI TRÒ HÌNH ẢNH HỌC ĐỊNH LƯỢNG
Hình ảnh định lượng cung cấp thông tin khách quan về kiểu hình bệnh lý tại phổi có thể làm tăng độ tin cậy trong chẩn đoán và đánh giá mức độ nghiêm trọng của ILAs. Các phương pháp đánh giá định lượng ILAs hiện có bao gồm lượng giá tỷ lệ phần trăm nhu mô phổi đậm độ cao, biểu đồ histrogram khu trú và đánh giá kết cấu nhu mô (texture) dựa trên học sâu (deep-learning) (Hình 3). Định lượng tự động đậm độ CT của phổi được sử dụng để xác định tỷ lệ phần trăm khối thể tích (voxel) nhu mô đậm độ cao, thường là từ -600 đến -250 đơn vị Hounsfield (đậm độ nhu mô phổi bình thường trên CLVT vào khoảng -750 đơn vị Hounsfield) [26]. Theo các kết quả ban đầu, các vùng nhu mô tăng đậm độ có liên quan đến tăng cao nồng độ của các dấu ấn sinh học viêm trong huyết thanh, giảm FVC và khả năng tập luyện thể thao, cũng như tăng tỷ lệ tử vong [26]. Mặc dù có những mối liên hệ dịch tễ học rõ ràng, các vùng nhu mô đậm độ cao có độ nhạy và độ đặc hiệu thấp đối với sự xuất hiện hay tồn tại lâu dài của ILAs [27]. Vì lý do đó, việc sử dụng thuật ngữ ILD cận lâm sàng như một từ đồng nghĩa với tăng vùng nhu mô phổi đậm độ cao không được khuyến khích. Mối tương quan yếu về mặt thống kê của ILAs và vùng mô phổi đậm độ cao khả năng do các hạn chế liên quan đến kỹ thuật bao gồm sự thay đổi của các nhà cung cấp và thế hệ máy CLVT, thì hít hở lúc ghi hình, tình trạng béo phì và xẹp phổi ở người bệnh…
Để hạn chế các sai số trên, các phần mềm định lượng tổn thương phổi (ví dụ Thoracic VCAR, GE Healthcare, Hoa Kỳ; Myrian, Intrasense, Pháp [28]) có tích hợp khả năng hiệu chỉnh các vùng đậm độ tổn thương tùy theo thực tế quan sát của bác sỹ có tiềm năng tăng độ chính xác trong chẩn đoán cũng như loại trừ ILAs (theo định nghĩa là các bất thường nhu mô chiếm tối thiểu 5% của phân vùng nhu mô phổi [4] (Hình 4).
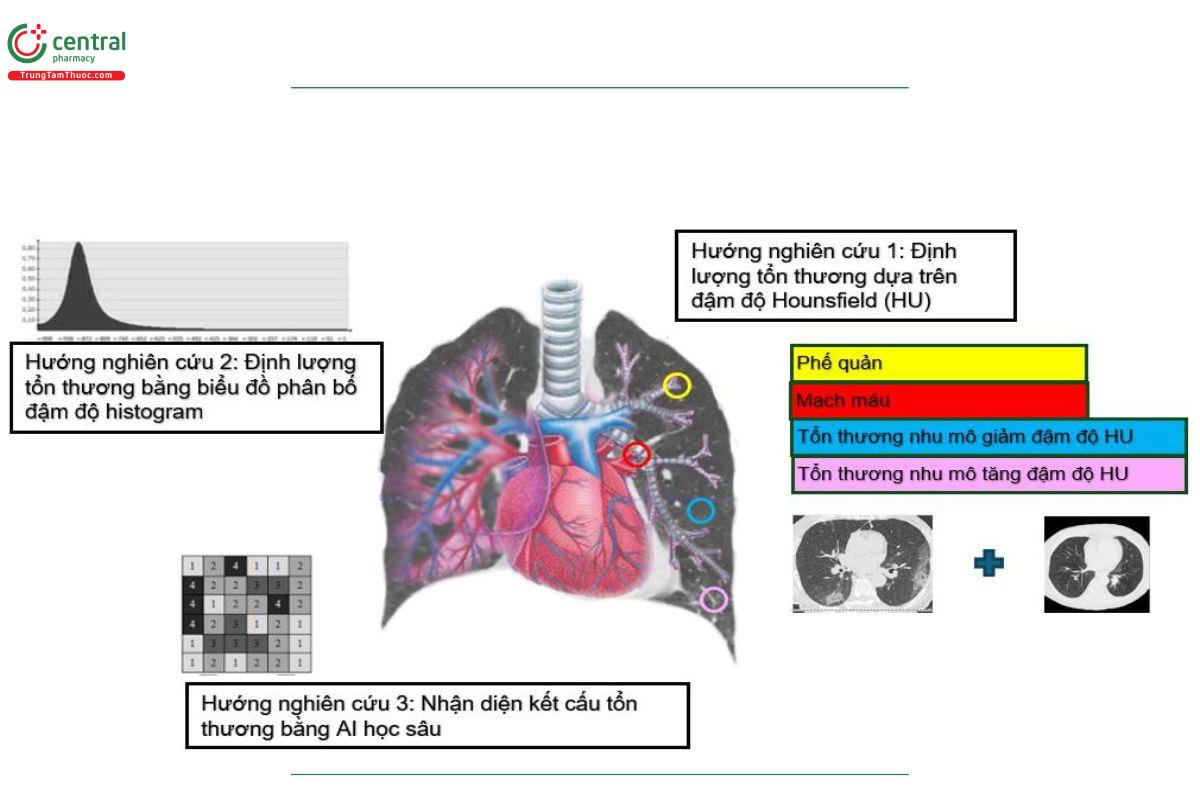
![Hình 4. Bảng định lượng tổn thương phổi ở bệnh nhân bị ILD kiểu hình NSIP xơ hóa bằng ứng dụng Thoracic VCAR GE Healthcare. A: Các phân vùng phổi được giới hạn bởi mặt phẳng ngang qua bờ dưới cung động mạch chủ ngực và bờ dưới tĩnh mạch phổi phải (Hiroto, Lancet Respir Med, 2020,[3]). B: các hình ảnh kén khí dưới màng phổi (mũi tên thẳng), dãn phế quản (mũi tên cong), hình lưới (dấu sao). C: Hình ảnh phân vùng thương tổn nhu mô, gồm: Màu vàng: nhu mô phổi bình thường; Màu hồng: vùng kính mờ; Màu xanh lá: tổn thương xơ; Màu đỏ: các mạch máu; Màu xanh dương: khoảng khí.](/images/item/viem-phoi-ke-4.jpg)
Ở hướng nghiên cứu khác, sử dụng phân tích định lượng dựa trên histogram ở 217 người được cắt bỏ ung thư phổi, điểm xơ hóa tương quan với sự hiện diện của ILAs và là một yếu tố dự báo độc lập về giảm tỷ lệ sống còn [29]. Tương tự, những người có tổng lượng nhu mô phổi bình thường thấp hơn theo các phép đo histogram có khả năng diễn tiến nặng cao hơn, chất lượng cuộc sống kém hơn, nguy cơ tử vong cao hơn và liên quan đến biến thể phổ biến gen MUC5B [30]. Một nghiên cứu ở các thành viên gia đình những người bị xơ phổi gia đình cho thấy phân tích dựa trên dữ liệu kết cấu nhu mô (texture) bằng học sâu có thể phát hiện những thay đổi kẽ sớm với độ nhạy 84% và độ đặc hiệu 86% [31]. Tuy nhiên, vai trò của CLVT định lượng như một công cụ sàng lọc ILAs cần được kiểm chứng, cải thiện và thử nghiệm trong các nghiên cứu lớn hơn. Các sai số tiềm năng trong định lượng ILAs bao gồm sự phụ thuộc vào dữ liệu đầu vào của quá trình học máy (machine learning), sự thay đổi thể tích phổi hít vào, liều tia thu nhận từ máy CT, sự khác biệt của hãng máy và phương pháp tái tạo, cũng như thay đổi trong kỹ thuật phân lập phần nhu mô phổi xơ dưới màng phổi từ thành ngực. Nguồn cơ sở dữ liệu có phân lập (segmentation) trực quan là cần thiết để cung cấp dữ liệu đầu vào quyết định tính chính xác của các mô hình học máy. Những tiến bộ mới trong trí tuệ nhân tạo và học sâu có thể vượt qua một số hạn chế này [31, 32].
5 KẾT LUẬN
Bất thường mô kẽ ở phổi là một khái niệm mới đang thu hút sự quan tâm của các nhà lâm sàng và nghiên cứu trong bối cảnh CLVT lồng ngực ngày càng được sử dụng nhiều với mục đích chẩn đoán cũng như tầm soát trên diện rộng. Đặc biệt bối cảnh những năm đầu sau COVID-19, sự nổi lên của các bệnh lý liên quan đến rối loạn tự miễn, tổn thương tồn lưu sau viêm phổi virus, các yếu tố tiếp xúc đa dạng trong môi trường sống ở các nước đang phát triển, tình huống gặp ILAs trong thực hành y khoa ngày càng phổ biến. Bài viết cung cấp các khái niệm mang tính cập nhật mong giúp ích cho các bác sỹ ở bước tiếp cận ban đầu các bất thường phổi kẽ trên CLVT.
6 Tài liệu tham khảo
- M. I. Schwarz and T. E. King, Interstitial Lung Disease. in Pmph USA Ltd Series. People’s Medical Publishing House, 2011. [Online]. Available: https://books.google.com.vn/books?id=MHfnRWo-WtoC
- R. K. Putman et al., “Association Between Interstitial Lung Abnormalities and All-Cause Mortality.,” JAMA, vol. 315, no. 7, pp. 672-681, Feb. 2016, doi: 10.1001/jama.2016.0518.
- H. Hatabu et al., “Interstitial lung abnormalities detected incidentally on CT: a Position Paper from the Fleischner Society.,” Lancet Respir. Med., vol. 8, no. 7, pp. 726-737, Jul. 2020, doi: 10.1016/S2213-2600(20)30168-5.
- H. Hatabu, G. M. Hunninghake, and D. A. Lynch, “Interstitial Lung Abnormality: Recognition and Perspectives.,” Radiology, vol. 291, no. 1, pp. 1-3, Apr. 2019, doi: 10.1148/radiol.2018181684.
- J. M. Oldham et al., “Underreporting of Interstitial Lung Abnormalities on Lung Cancer Screening Computed Tomography.,” Ann. Am. Thorac. Soc., vol. 15, no. 6, pp. 764-766, Jun. 2018, doi: 10.1513/AnnalsATS.201801- 053RL.
- G. Y. Jin et al., “Interstitial lung abnormalities in a CT lung cancer screening population: prevalence and progression rate.,” Radiology, vol. 268, no. 2, pp. 563-571, Aug. 2013, doi: 10.1148/radiol.13120816.
- K. Tsushima, S. Sone, S. Yoshikawa, T. Yokoyama, T. Suzuki, and K. Kubo, “The radiological patterns of interstitial change at an early phase: over a 4-year follow-up.,” Respir. Med., vol. 104, no. 11, pp. 1712-1721, Nov. 2010, doi: 10.1016/j.rmed.2010.05.014.
- G. R. Washko et al., “Lung Volumes and Emphysema in Smokers with Interstitial Lung Abnormalities,” N. Engl. J. Med., vol. 364, no. 10, pp. 897-906, 2011, doi: 10.1056/NEJMoa1007285.
- N. Sverzellati et al., “Interstitial lung diseases in a lung cancer screening trial,” Eur. Respir. J., vol. 38, no. 2, pp. 392-400, 2011, doi: 10.1183/09031936.00201809.
- T. J. Doyle, G. M. Hunninghake, and I. O. Rosas, “Subclinical interstitial lung disease: why you should care.,” Am. J. Respir. Crit. Care Med., vol. 185, no. 11, pp. 1147-1153, Jun. 2012, doi: 10.1164/rccm.201108-1420PP.
- M. L. Salisbury and D. A. Lynch, “Toward Early Identification of Clinically Relevant Interstitial Lung Disease,” Am. J. Respir. Crit. Care Med., vol. 196, no. 11, pp. 1368-1369, Dec. 2017, doi: 10.1164/rccm.201706-1235ED.
- M. Remy-Jardin, J. Remy, C. Boulenguez, A. Sobaszek, J. L. Edme, and D. Furon, “Morphologic effects of cigarette smoking on airways and pulmonary parenchyma in healthy adult volunteers: CT evaluation and correlation with pulmonary function tests.,” Radiology, vol. 186, no. 1, pp. 107-115, Jan. 1993, doi: 10.1148/radiology.186.1.8416548.
- J. Ricoy et al., “Pleuroparenchymal fibroelastosis: Clinical, radiological and histopathological features,” Respir. Med., vol. 191, p. 106437, Jan. 2022, doi: 10.1016/j.rmed.2021.106437.
- G. Raghu et al., “Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline,” Am. J. Respir. Crit. Care Med., vol. 198, no. 5, pp. e44-e68, Sep. 2018, doi: 10.1164/rccm.201807- 1255ST.
- R. K. Putman et al., “Imaging Patterns Are Associated with Interstitial Lung Abnormality Progression and Mortality.,” Am. J. Respir. Crit. Care Med., vol. 200, no. 2, pp. 175-183, Jul. 2019, doi: 10.1164/rccm.201809-1652OC.
- T. Hida et al., “Traction Bronchiectasis/Bronchiolectasis is Associated with Interstitial Lung Abnormality Mortality.,” Eur. J. Radiol., vol. 129, p. 109073, Aug. 2020, doi: 10.1016/j.ejrad.2020.109073.
- Y. Watanabe et al., “Multiple, thin-walled cysts are one of the HRCT features of airspace enlargement with fibrosis.,” Eur. J. Radiol., vol. 84, no. 5, pp. 986-992, May 2015, doi: 10.1016/j.ejrad.2015.01.015.
- E. R. Miller et al., “Histopathology of Interstitial Lung Abnormalities in the Context of Lung Nodule Resections,” Am. J. Respir. Crit. Care Med., vol. 197, no. 7, pp. 955-958, Apr. 2018, doi: 10.1164/rccm.201708-1679LE.
- T. Araki et al., “Development and Progression of Interstitial Lung Abnormalities in the Framingham Heart Study.,” Am. J. Respir. Crit. Care Med., vol. 194, no. 12, pp. 1514-1522, Dec. 2016, doi: 10.1164/rccm.201512-2523OC.
- R. K. Putman et al., “Interstitial Lung Abnormalities Are Associated with Acute Respiratory Distress Syndrome.,” Am. J. Respir. Crit. Care Med., vol. 195, no. 1, pp. 138-141, Jan. 2017, doi: 10.1164/rccm.201604-0818LE.
- M. Kadoch et al., “Interstitial lung abnormality is prevalent and associated with worse outcome in patients undergoing transcatheter aortic valve replacement.,” Respir. Med., vol. 137, pp. 55-60, Apr. 2018, doi: 10.1016/j.rmed.2018.02.017.
- Y. Im et al., “Prevalence of and risk factors for pulmonary complications after curative resection in otherwise healthy elderly patients with early stage lung cancer.,” Respir. Res., vol. 20, no. 1, p. 136, Jul. 2019, doi: 10.1186/s12931- 019-1087-x.
- T. Araki et al., “Interstitial lung abnormality in stage IV non-small cell lung cancer: A validation study for the association with poor clinical outcome.,” Eur. J. Radiol. Open, vol. 6, pp. 128-131, 2019, doi: 10.1016/j.ejro.2019.03.003.
- B. J. Schneider et al., “Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: ASCO Guideline Update,” J. Clin. Oncol., vol. 39, no. 36, pp. 4073-4126, Dec. 2021, doi: 10.1200/JCO.21.01440.
- J. E. Lee et al., “Diagnostic performance of radiologists in distinguishing post-COVID-19 residual abnormalities from interstitial lung abnormalities,” Eur. Radiol., Sep. 2024, doi: 10.1007/s00330-024-11075-x.
- A. J. Podolanczuk et al., “High attenuation areas on chest computed tomography in community-dwelling adults: the MESA study.,” Eur. Respir. J., vol. 48, no. 5, pp. 1442-1452, Nov. 2016, doi: 10.1183/13993003.00129-2016.
- C. R. Kliment et al., “A comparison of visual and quantitative methods to identify interstitial lung abnormalities.,” BMC Pulm. Med., vol. 15, p. 134, Oct. 2015, doi: 10.1186/s12890-015-0124-x.
- R. Grassi et al., “Chest CT Computerized Aided Quantification of PNEUMONIA Lesions in COVID-19 Infection: A Comparison among Three Commercial Software.,” Int. J. Environ. Res. Public. Health, vol. 17, no. 18, Sep. 2020, doi: 10.3390/ijerph17186914.
- T. Iwasawa et al., “Computer-aided Quantification of Pulmonary Fibrosis in Patients with Lung Cancer: Relationship to Disease-free Survival,” Radiology, vol. 292, no. 2, pp. 489-498, Aug. 2019, doi: 10.1148/radiol.2019182466.
- S. Y. Ash et al., “Clinical and Genetic Associations of Objectively Identified Interstitial Changes in Smokers,” Chest, vol. 152, no. 4, pp. 780-791, Oct. 2017, doi: 10.1016/j.chest.2017.04.185.
- S. Jun, N. Kim, J. B. Seo, Y. K. Lee, and D. A. Lynch, “An Ensemble Method for Classifying Regional Disease Patterns of Diffuse Interstitial Lung Disease Using HRCT Images from Different Vendors.,” J. Digit. Imaging, vol. 30, no. 6, pp. 761-771, Dec. 2017, doi: 10.1007/s10278-017-9957-6.
- D. Bermejo-Peláez, S. Y. Ash, G. R. Washko, R. San José Estépar, and M. J. Ledesma-Carbayo, “Classification of Interstitial Lung Abnormality Patterns with an Ensemble of Deep Convolutional Neural Networks.,” Sci. Rep., vol. 10, no. 1, p. 338, Jan. 2020, doi: 10.1038/s41598-019-56989-5.

