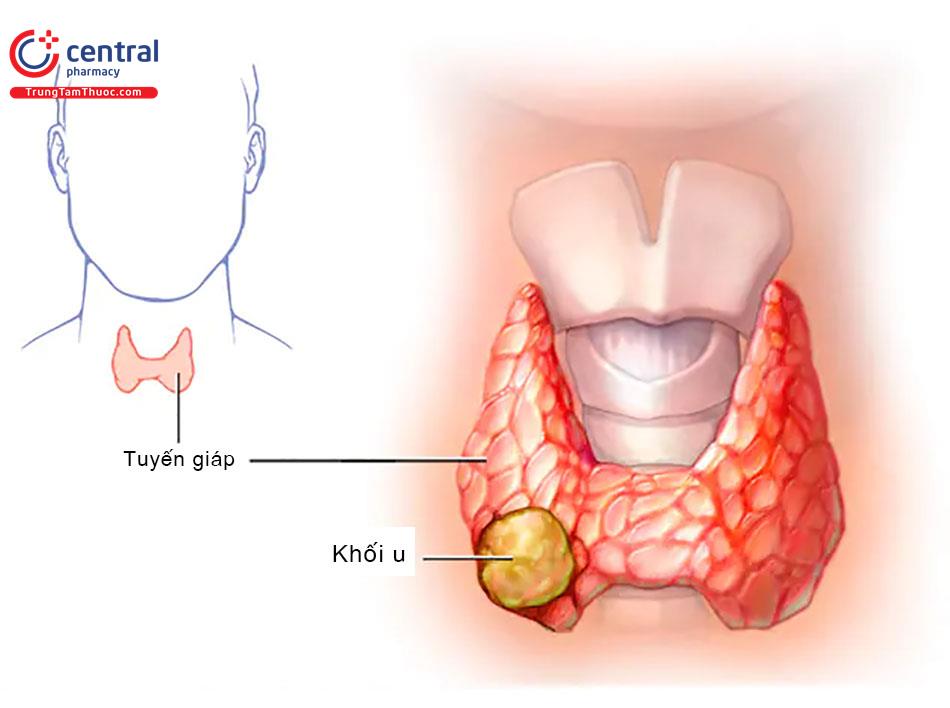
Ung thư tuyến giáp: Sự tăng sinh bất thường các tế bào tuyến giáp
Khoa nội tiết chuyển hóa và nghiên cứu
Đồng chủ biên
Thomas J.Braranski, MD, PhD
Janet B.McGill, MD, MA, FACE
Julie M.Silverstein, MD
Và các tác giả khác tham gia biên soạn
1 NGUYÊN LÝ CHUNG
Khoảng 95% các bệnh lý ác tính của tuyến giáp là carcinoma giáp biệt hóa (differentiated thyroid carcinomas [DTCs]) xuất phát từ các tế bào nang giáp (carcinoma nhú hoặc nang). Các ung thư này vẫn giữ được nhiều đặc điểm của tế bào tuyến giáp bình thường, chúng bắt giữ Iod và tổng hợp thyroglobulin (Tg), mặc dù hiệu quả kém hơn so với mô giáp binh thường. Tình trạng phát triển và chức năng của các tế bào này bị kích thích bởi hormon kích thích tuyến giáp (TSH). Ba đặc điểm nói trên được sử dụng trong điều trị và theo dõi carcinoma giáp [1-3]. Chương này sẽ thảo luận về phân loại, xử trí và theo dõi carcimoma giáp biệt hóa. Cũng có một thảo luận ngắn gọn về các ung thư giáp ít gặp hơn nhiều là ung thư giáp thể tủy và ung thư giáp không biệt hóa (xem phần Các trường hợp đặc biệt).
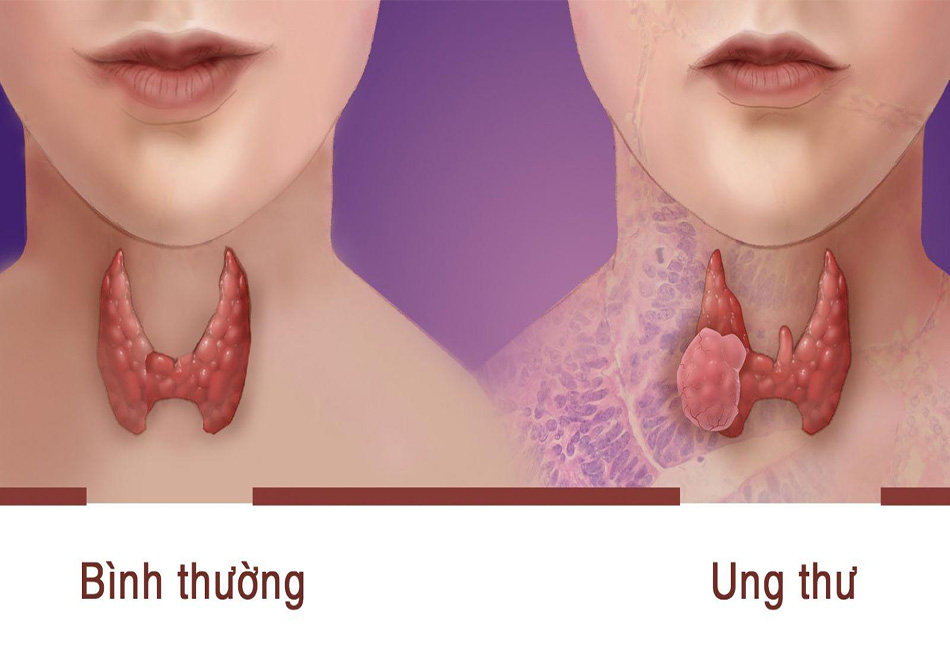
1.1 Phân loại
Carcinoma giáp thể nhú (papillary thyroid carcinoma [PTC]) (84%) là loại thường gặp nhất của carcinoma giáp biệt hóa (DTC). Carcinoma giáp thể nhủ là một loại u phát triển chậm và nó có thể vẫn khu trú tại chỗ trong nhiều năm. Một cách đặc trưng, thể ung thư này di căn trước tiên tới các hạch vùng cổ. Các ổ carcinoma nhú trên vi thể thường gặp khi mổ xác, được cho là xuất hiện ở 30% bệnh nhân người lớn.
Carcinoma giáp thể nang (Follicular thyroid carcinoma [FTC]) (và tập hợp phân nhóm tế bào Hürthle) (12%) có thể có tính chất xâm lấn hơn và có thể di căn sớm tới phổi và xương. Nhiều ung thư tuyến giáp có hình ảnh mô bệnh học pha trộn dạng nhú và dạng nang, các ung thư này có đặc điểm tiến triển gống như carcinoma dạng nhú [13].
Carcinoma giáp biệt hóa kém (poorly differentiated thyroid carcinoma [PDTC]) (< 3%) có tính chất xâm lấn nhiều hơn có ý nghĩa với tỷ lệ di căn cao hơn so với thể biệt hóa tốt. Thể ung thư này được đặc trưng về mặt giải phẫu bệnh lý bằng kiến trúc đặc biệt và có đặc điểm độ ác tính cao (nhân chia búi, hoạt động phân bào cao và/hoặc hoại tử u). Các tổn thương này ít khả năng hơn sẽ chế tiết Tg và tập trung iod có hoạt tính phóng xạ. Về mặt lâm sàng, carcinoma giáp biệt hóa kém rơi vào phổ giữa carcinoma giáp thể nhú và ung thư tuyến giáp không biệt hóa (anaplastic thyroid cancer), cần được can thiệp ban đầu và theo dõi tích cực hơn [3-5].
1.2 Dịch tễ học
Ung thư tuyến giáp chiếm 3,4% các trường hợp ung thư mới được chẩn đoán, nhưng chỉ chiếm 0,3% trường hợp tử vong do ung thư tại Hoa Kỳ. Nguy cơ trọn đời là 1,2%.
Tần suất lưu hành bệnh tăng gấp ba lần trong vòng 40 năm qua,
song phần lớn điều này là kết quả của các sai nhiễu trong phát hiện bệnh do các phương tiện chẩn đoán hình ảnh ngày càng được sử dụng rộng rãi.
Phụ nữ có khả năng bị ung thư tuyến giáp nhiều gấp khoảng 3 lần và tuổi trung bình khi chẩn đoán được bệnh là 51.
Tiên lượng tổng thể cực kỳ tốt, với 98,2% các bệnh nhân sống sót tới 5 năm [1-3].
1.3 Các yếu tố nguy cơ
Nữ giới.
Tuổi (đỉnh 40 - 50 tuổi đối với nữ, 60 - 70 tuổi đối với nam).
Tiền sử gia đình có người bị ung thư tuyến giáp.
Chế độ ăn chứa ít iod.
Các phơi nhiễm tia xạ bao gồm có điều trị y tế (nhất là ở tuổi ấu thơ và/hoặc điều trị ở vùng đầu/cổ) và nhiễm bụi phóng xạ do tai nạn từ nhà máy điện nguyên tử hoặc vũ khí hạt nhân.
Các bệnh lý polyp dạng adenoma có tính gia đình, bệnh Cowden và phức hợp Carney typ 1 làm tăng nguy cơ bị carcinoma giáp biệt hóa (DTC). Carcinoma giáp thể nhú (PTC) đơn lẻ cũng có thể xảy ra ở một số gia đình, mặc dù dạng di truyền của tình trạng này còn chưa được xác định rõ [1-3].
2 CHẨN ĐOÁN
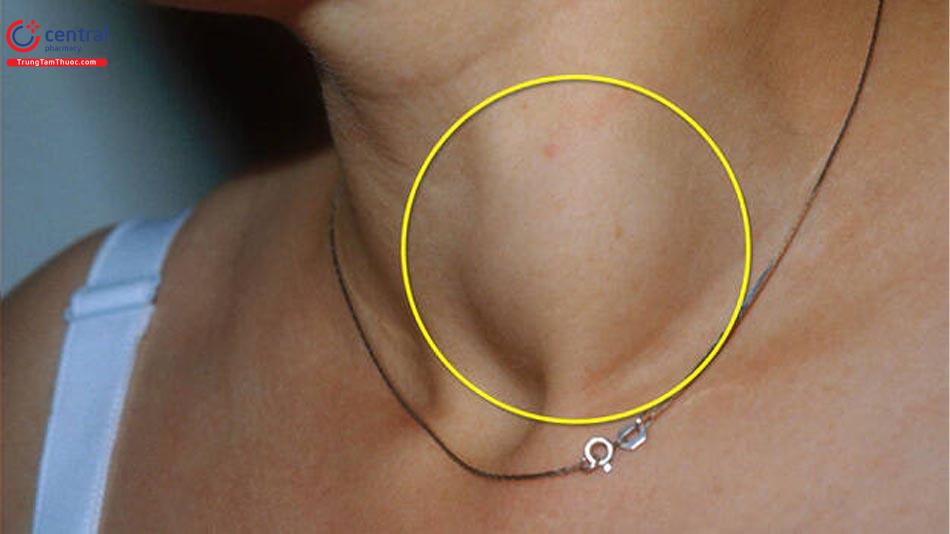
2.1 Biểu hiện lâm sàng
Ung thư tuyến giáp thể biệt hóa thường được biểu hiện như một nhân giáp đơn độc không có triệu chứng. Các nhân này không đau hoặc đau khi được thăm khám và không gây tình trạng cường giáp hoặc suy giáp. Các dấu hiệu lâm sàng làm tăng khả năng nghi ngờ đây là nhân giáp ác tính được liệt kê trong (Chương 7, Bệnh lý nhân tuyến giáp và bướu giáp).
2.2 Chẩn đoán cận lâm sàng
Chọc hút tế bào bằng kim nhỏ và đánh giá tế bào học là xét nghiệm được lựa chọn để chẩn đoán. Siêu âm thường được sử dụng để hướng dẫn việc chọc hút sinh thiết [3]. Xem Chương 7, Bệnh lý nhân tuyến giáp và bướu giáp để biết các tiêu chuẩn siêu âm hướng dẫn lựa chọn kỹ thuật chọc hút tế bào bằng kim nhỏ, tiêu chuẩn tế bào học và chẩn đoán phân tử giúp lựa chọn cách phẫu thuật cắt bỏ tuyến giáp.
3 ĐIỀU TRỊ
3.1 Điều trị ngoại khoa
Siêu âm trước mổ phải được tiến hành ở tất cả các bệnh nhân có kết quả chọc hút tế bào bằng kim nhỏ cho thấy có tổn thương ác tính hoặc nghi ngờ ác tính do thăm dò hình ảnh học này phát hiện được 20% - 31% các hạch nghi ngờ di căn (gặp ở 20 - 25% các bệnh nhân). Nên tiến hành chọc hút hạch bằng kim nhỏ nếu tình trạng xâm lấn hạch bạch huyết không rõ ràng. Có thể xem xét chụp CT nếu siêu âm cho thấy có nhiều hạch to hoặc xâm lấn.
Lên kế hoạch phẫu thuật ban đầu
- Cắt toàn bộ hoặc gần toàn bộ tuyến giáp phải được thực hiện nếu khối u > 4 cm và có tình trạng lan rộng ra ngoài tuyến giáp nhiều, u xâm lấn hạch bạch huyết hoặc di căn xa.
- Có thể xem xét cắt thùy tuyến giáp hoặc cắt toàn bộ/gần toàn bộ tuyến giáp nếu u có kích thước từ 1 - 4 cm và không thấy có tình trạng lan rộng ra ngoài tuyến giáp, xâm lấn hạch bạch huyết hoặc di căn xa. Cũng cần xem xét các yếu tố nguy cơ (tuổi, các nhân ở thuỳ đối diện, tiền sử tia xạ, tiền sử gia đình, v.v..) và mong muốn lựa chọn của bệnh nhân.
- Cắt thùy tuyến giáp được chỉ định như một biện pháp can thiệp ngoại khoa nếu u < 1 cm và không lan rộng ra ngoài tuyến giáp, không thấy có tác động tới hạch bạch huyết hoặc di căn xa [3]. Tuy nhiên, các dữ liệu gần đây gợi ý rằng theo dõi tích cực liên tục là một lựa chọn hợp lý ở bệnh nhân có nguy cơ thấp bị microcarcinoma thể nhú (được định nghĩa là < 1 cm và tế bào học không có đặc điểm ác tính cấp độ cao, không lan rộng ra ngoài tuyến giáp, không có bằng chứng di căn hạch bạch huyết hoặc di căn xa). Ở quần thể bệnh nhân này, một nghiên cứu trên 2.000 bệnh nhân tại Nhật hoặc được tự chọn theo dõi tích cực hoặc được phẫu thuật tức khắc đã không cho thấy có khác biệt về kết cục ung thư sau khoảng 47 tháng theo dõi và không có đối tượng nào trong nhóm theo dõi xuất hiện tình trạng di căn xa hoặc tử vong do ung thư giáp. Tuy nhiên, với đối tượng thuộc nhóm được phẫu thuật ngay, tỷ lệ kết cục bất lợi liên quan với các biến chứng ngoại khoa cao hơn, điều này gợi ý cần xem xét theo dõi tích cực cho nhóm đối tượng này [6].
- Cắt bỏ hạch bạch huyết:
- Không chỉ định cắt bỏ hạch bạch huyết nếu u <4 cm, không xâm lấn, không sờ thấy hạch khi khám lâm sàng và đối với hầu hết các trường hợp ung thư thể nang.
- Nên tiến hành cắt bỏ hạch ở khoang trung tâm nếu có các hạch trung tâm liên quan trên lâm sàng.
- Có thể xem xét cắt bỏ hạch khoang trung tâm dự phòng nếu u > 4 cm, các hạch khoang bên bị tác động hoặc sẽ sử dụng kết quả mô bệnh học để lên kế hoạch điều trị thêm.
- Nên tiến hành cắt bỏ hạch ở khoang bên nếu thấy có di căn vào hạch khoang bên được chứng minh bằng sinh thiết.
Nên đề xuất cắt toàn bộ tuyến giáp cho bệnh nhân được chỉ định cắt thùy tuyến giáp nhưng kết quả mô bệnh học vào thời điểm bắt đầu tiến hành phẫu thuật lại thuộc nhóm được khuyến cáo cắt toàn bộ tuyến giáp. Cũng cần tiến hành cả việc cắt bỏ hạch ở khoang trung tâm nếu hạch bạch huyết bị tác động về phương diện lâm sàng. Cần lưu ý là, cắt bỏ toàn bộ tuyến giáp có thể không cần thiết đối với các tổn thương có nguy cơ thấp hơn.
Cần ghi nhận các thông tin sau đây trong báo cáo mô bệnh học phẫu thuật để phân tầng nguy cơ giúp đưa ra quyết định điều trị thêm cho bệnh nhân:
- Kích thước u.
- Các chỉ giới cắt bỏ.
- Có xâm lấn bao hay không.
- Xâm lấn mạch máu với số lượng mạch bị tác động.
- Số lượng các hạch bạch huyết được kiểm tra và bị tác động.
- Kích thước lớn nhất của các hạch di căn.
- Sự xuất hiện của tình trạng di căn ngoài hạch.
- Các biến thể mô bệnh học với tiên lượng không tốt (carcinoma giáp thể nhú với tế bào cao, tế bào hình trụ tế bào đinh tán đầu to, ung thư tuyến giáp thể nang xâm lấn rộng, thành đảo).
- Các biến thể mô bệnh học với tiên lượng thuận lợi (biến thể nang không xấm lấn của ung thư giáp thể nhú với xâm lấn tối thiểu).
Các điều trị thêm được quyết định chủ yếu dựa trên nguy cơ tái phát
ung thư dựa trên cơ sở kết quả mô bệnh học và hình ảnh học. Trong khi phân giai đoạn TNM của Liên minh Kiểm soát ung thư Quốc tế (UICC) và Ủy ban Ung thư Hoa Kỳ (AJCC) dựa trên tuổi, kích thước u, mô bệnh học và lan rộng của ra ngoài tuyến giáp được xác định đối với carcinoma giáp biệt hóa, hệ thống phân chia giai đoạn này chỉ giải thích cho 5 - 30% các tử vong liên quan với ung thư tuyến giáp. Vì vậy, chúng tôi thường ưu tiên sử dụng phân tầng nguy cơ theo hướng dẫn 2015 của Hiệp hội Tuyến giáp Hoa Kỳ, hướng dẫn này có tích hợp các đặc điểm bổ sung thêm (ví dụ, các đặc điểm mô bệnh học đặc hiệu, đặc điểm phân tử, mức độ lan rộng của xâm lấn mạch máu, kích thước của tổn thương di căn). Hệ thống này chia bệnh nhân thành ba nhóm nguy cơ tái phát: thấp, trung bình và cao (Bảng 10) và có tương quan mạnh với kết cục. Qua nhiều nghiên cứu được xác nhận tính hợp thức chứng cho thấy khả năng bệnh nhân sẽ không có bằng chứng còn bệnh sau khi cắt toàn bộ tuyến giáp và điều trị iod phóng xạ cho phần tuyến giáp còn lại đối với các nhóm nguy cơ nói trên là 78 - 91% đối với nhóm nguy cơ thấp, 52 - 64% đối với nhóm nguy cơ vừa và 31 - 32% đối với nhóm nguy cơ cao [3]. Cần lưu ý rằng, gần đây đã có sự phân biệt đối với kết quả mô bệnh học có nguy cơ rất thấp của u tân sinh tuyến giáp dạng nang không xâm lấn với đặc điểm nhân giống như thể nhú, bệnh nhân có kết quả mô bệnh học này nên được thông báo là tổn thương lành tính. Phân loại mô bệnh học này có thể được sử dụng cho tổn thương ở bất kỳ kích thước nào, nhưng đòi hỏi biến thể nang của ung thư biểu mô tuyến giáp thể nhú còn bao hoàn toàn (quan sát bằng hình ảnh tế bào học) và nên được phẫu thuật cắt thuỷ tuyến giáp mà không cần phải cắt toàn bộ tuyến giáp hoặc điều trị iod phóng xạ [7].
3.2 Các điều trị không dùng thuốc khác
Tiếp sau cắt toàn bộ hoặc gần toàn bộ tuyến giáp, điều trị thay thế hormon giáp thường được ngừng lại trong khi chờ kết quả mô bệnh học, do nhu cầu tiềm ẩn cần điều trị thêm bằng iod phóng xạ yêu cầu có một nồng độ TSH tăng cao để tối ưu hóa khả năng bắt giữ iod và hiệu quả điều trị.
Trong khi quyết định sử dụng điều trị kế tiếp bằng iod phóng xạ sau điều trị phẫu thuật chủ yếu được dựa trên nguy cơ tái phát bệnh (được thảo luận ở dưới), tình trạng bệnh sau mổ cũng cần được xem xét.
Đánh giá tình trạng bệnh sau mổ chủ yếu dựa trên đánh giá về sinh hóa. Tg là một protein được các tế bào nang tuyến giáp bình thường sản xuất với nồng độ có thể thể phát hiện được trong huyết thanh, hầu hết các carcinoma giáp biệt hóa vẫn giữ được khả năng này khiến đây là một chỉ dấu hữu ích để theo dõi sau cắt tuyến giáp. Nồng độ Tg được kích thích bởi TSH hoặc là nội sinh hoặc tái tổ hợp, vì vậy được dự kiến sẽ cao gấp 5 - 10 lần khi kích thích bằng TSH.
Phải định lượng nồng độ Tg huyết thanh ít nhất 3 đến 4 tuần sau mổ khi kết quả xét nghiệm đạt tới giá trị đáy, song vẫn có thể định lượng được ở bệnh nhân còn sót lại nhu mô tuyến giáp lành tính hoặc ác tính. Nồng độ Tg sau mổ rất hữu ích để xác nhận mức nền cho theo dõi sau điều trị phẫu thuật và giúp hướng dẫn cho bệnh nhân xem xét chỉ định điều trị iod phóng xạ. Nguy cơ bệnh tái phát hoặc đang tiếp diễn có tương quan trực tiếp với nồng độ Tg sau mổ. Vì vậy, nồng độ Tg nên được xem xét trong bối cảnh phân tầng nguy cơ để quyết định áp dụng điều trị iod phóng xạ cho bệnh nhân. Nói chung, một nồng độ Tg > 10 ng/mL (được kích thích hoặc không kích thích bằng TSH) gợi ý cho tình trạng bệnh tái phát hoặc đang tiếp diễn và làm gia tăng khả năng thất bại của điều trị ban đầu bằng điều trị iod phóng xạ, có tình trạng di căn xa và tử vong do ung thư giáp. Vì lý do này, có thể xem xét các điều trị bổ sung thêm ở đối tượng với nguy cơ thấp hoặc vừa theo tiêu chuẩn của Hiệp hội tuyến giáp Hoa Kỳ (ATA), có nồng độ Tg sau mổ từ 5 - 10 ng/mL. Ngược lại, một nồng độ Tg được kích thích bằng TSH < 1 - 2 ng/mL là yếu tố dự đoán mạnh cho tình trạng bệnh thoái triển.
Một số yếu tố có thể tác động tới kết quả Tg. Nhiều phòng xét nghiệm sử dụng phương pháp đo miễn dịch, kỹ thuật này phải hiệu chỉnh hay chuẩn độ theo tiêu chuẩn quốc tế, song vẫn còn tình trạng dao động rộng. Vì vậy, nên định lượng nồng độ Tg định kỳ liên tục qua thời gian với cùng một kỹ thuật tại một phòng xét nghiệm. Xét nghiệm bằng kỹ thuật miễn dịch cũng dễ có khuynh hướng bị tác động giao thoa với các kháng thể kháng Tg, điều này có thể khiến nồng độ ng thấp giả tạo. Tất cả các xét nghiệm Tg bằng kỹ thuật miễn dịch thường kèm với một nồng độ kháng thể và nếu có các kháng thể này, không được sử dụng kết quả xét nghiệm nồng độ Tg để quyết định điều trị. Thay vào đó, một số phòng xét nghiệm đang chuyển sang sử dụng kỹ thuật mới hơn là phương pháp sắc ký lỏng - khối phổ (liquid chromatography-tandem mass spectrometry [LC-MS/MS] assays) do kỹ thuật này không phụ thuộc vào tương tác kháng thể Tg mặc dù kỹ thuật có giới hạn định lượng cao hơn (thường 0,5 ng/mL) [3,8].
Iod phóng xạ (RAI) là điều trị đích duy nhất đối với ung thư tuyến giáp, do tuyến giáp là một trong số một vài mô của cơ thể có khả năng bắt giữ iod. Nhìn chung điều trị RAI được dùng với liều giúp loại bỏ phần nhu mô tuyến giáp còn lại (thường là liều 30 mCi) để tạo thuận lợi cho sự phát hiện tình trạng bệnh tái phát hoặc với liều điều trị (thường 100 - 150 mCi) để cải thiện thời gian sống không có bệnh nhờ phá huỷ các mô tuyến giáp bệnh lý vẫn còn sót lại. Trong khi điều trị RAI tương đối an toàn song khi liều tích lũy vượt quá 500 - 600 mCi sẽ gây tăng có ý nghĩa nguy cơ bị một bệnh lý ác tính thứ phát và nên tránh để xảy ra điều này. Cũng nên tránh điều trị RAI đối với phụ nữ có thai và không nên có thai sau khi điều trị RAI một năm. Nam giới khi phải dùng các liều RAI tích lũy > 400 mCi nên được cảnh báo về tiềm ẩn bị vô sinh khi phơi nhiễm với RAI liều cao. Nên ngừng dùng levothyroxin trong vòng 3 đến 4 tuần và xác nhận nồng độ TSH > 30 mIU/L trước khi điều trị RAI cho bệnh nhân. Làm nghiệm pháp kích thích bằng rhTSH (kích tố giáp tái tổ hợp của người) là một lựa chọn thay thế cho các đối tượng với bệnh có nguy cơ thấp hoặc đối tượng với bệnh có nguy cơ vừa nhưng không có hạch tồn tại rõ trước khi cắt bỏ mô giáp còn sót lại. Bệnh nhân cũng nên được sử dụng chế độ ăn chứa ít iod trong 1 - 2 tuần trước điều trị nhằm tăng khả năng thành công trong việc loại bỏ các mô giáp còn sót lại. Để đưa ra quyết định liên quan với điều trị bằng RAI, cần xem xét các yếu tố tác động liên quan tới nguy cơ tái phát bệnh, theo dõi bệnh và ưu tiên lựa chọn của bệnh nhân, tuy nhiên cũng cần tham khảo các hướng dẫn chung sau đây:
- Bệnh nhân có nguy cơ thấp sau cắt tuyến giáp hoặc chỉ cắt bỏ thùy tuyến giáp: Không khuyến cáo điều trị RAI nhưng nếu có chỉ định thì nên sử dụng liều loại bỏ phần tuyến giáp còn lại (ablative dose).
- Bệnh nhân có nguy cơ vừa sau khi cắt bỏ toàn bộ tuyến giáp: Nên xem xét chỉ định điều trị RAI với liều phá huỷ mô giáp cho bệnh nhân có nguy cơ thấp và liều điều trị cho bệnh nhân có nguy cơ cao.
- Bệnh nhân có nguy cơ cao sau khi cắt bỏ hoàn toàn tuyến giáp: khuyến cáo sử dụng RAI với liều điều trị.
Nên tiến hành chụp xạ hình toàn thân sau điều trị RAI từ 3 đến 7 ngày để khẳng định có tình trạng tăng bắt giữ iod phóng xạ tại các cấu trúc bệnh lý (RAl-avid structural disease). Cần lưu ý rằng, không phải là ít gặp khi chụp xạ hình toàn thân sau điều trị cho thấy có tăng bắt iod phóng xạ tại cấu trúc giáp, do phẫu thuật cắt toàn bộ tuyến giáp là một kỹ thuật khó và không nhất thiết phải áp dụng nhất là khi có chỉ định điều trị RAI.
Xử trí ban đầu đối với bệnh lý di căn có tăng bắt giữ iod phóng xạ:
- Khi tổn thương di căn khu trú và tác động tới đoạn chung của đường tiêu hóa và dẫn khí ở khoang miệng và thanh quản: Tổn thương này được xử trí tốt nhất bằng cách phẫu thuật cắt bỏ. Cũng có thể sử dụng RAI như một điều trị bổ sung thêm.
- Các di căn phổi nhỏ (có kích thước < 2 cm): điều trị RAI với liều từ 100 - 200 mCi mỗi 6 đến 12 tháng /lần chừng nào còn thấy có đáp ứng lâm sàng và còn thấy có bắt giữ iod phóng xạ ở vị trí tổn thương. Các di căn phổi với các nhân lớn có thể được điều trị bằng phẫu thuật cắt bỏ (trong trường hợp có một nhân duy nhất) hoặc điều trị RAI, mặc dù điều trị hiếm khi giải quyết triệt để bệnh.
- Các di căn xương có thể được điều trị bằng RAI với liều 100 - 200 mCi, song hiếm khi giải quyết triệt để được tổn thương. Nên xem xét điều trị tia xạ bằng chùm tia bên ngoài, phẫu thuật và dùng thuốc chống hủy xương (xem ở dưới).
- Các di căn não chủ yếu được điều trị bằng phẫu thuật và xạ trị định vị. RAI cũng có thể được áp dụng nhưng trước khi điều trị tia xạ, nên xem xét cho bệnh nhân dùng glucocorticoid để làm mất các tác dụng viêm do RAI hoặc tình trạng tăng kích thước u do TSH gây nên.
- Điều trị toàn thân bằng thuốc ức chế kinase thường được dành cho các đối tượng có bệnh lan rộng không đáp ứng với RAI [3].
Xử trí bệnh lý di căn không đáp ứng với RAI:
- Bệnh lý di căn không đáp ứng với RAI có thể được biểu hiện bằng tình trạng mất bắt giữ iod phóng xạ vào thời điểm chẩn đoán hoặc mất khả năng này theo thời gian. Một điều quan trọng cần biết là một số tổn thương có thể gây tăng bắt giữ iod phóng xạ trong khi các tổn thương khác lại không thấy có dấu hiệu này. Tình trạng không đáp ứng với điều trị bằng iod phóng xạ cũng có thể được định nghĩa là khi tổn thương có tăng bắt giữ iod phóng xạ nhưng vẫn tiến triển theo thời gian mặc dù được điều trị bằng RAI. Không nên tiếp tục điều trị RAI ở những bệnh nhân này.
- Bệnh nhân với tình trạng bệnh ổn định, tiến triển nhẹ và không có triệu chứng có thể theo dõi bằng hình ảnh học định kỳ liên tục mỗi 3 - 12 tháng /lần và tiếp tục điều trị ức chế TSH (xem ở dưới).
- Trước khi xem xét điều trị toàn thân cho bệnh nhân, các tổn thương di căn tới não, phổi, gan hoặc xương hiện đang gây ra các triệu chứng cho bệnh nhân hoặc có nguy cơ cao gây ra các biến chứng tại chỗ có thể được điều trị bằng phẫu thuật, xạ trị định vị hoặc cắt bỏ bằng nhiệt.
- Các điều trị toàn thân bằng thuốc ức chế kinase cần được xem xét ở các bệnh nhân có tình trạng tiến triển bệnh lan tỏa không thể tiến hành điều trị tại chỗ, bệnh gây triệu chứng như hạch to lan tràn toàn thân hoặc khó thở hoặc bệnh gây đe dọa tính mạng được thấy rõ dự kiến cần được can thiệp hoặc gây ra tình trạng tàn phế tử vong trong thời gian < 6 tháng. Một thảo luận ngắn gọn về các thuốc này sẽ được tìm thấy ở phần dưới [3,9,10].
| Bảng 10.1. Phân loại nguy cơ tái phát của Hiệp hội tuyến giáp Hoa Kỳ | |||
| Nguy cơ thấp (phải có tất cả) | Nguy cơ vừa (bất kỳ) | Nguy cơ cao (bất kỳ) | |
| Các di căn tại chỗ hoặc ở xa | Không có hoặc s 5 di căn nhỏ hạch vùng cồ với kích thước lớn nhất < 2 mm (nếu Carcinoma giáp thể nhú). | > 5 di căn hạch vùng cổ với tất cả có kích thước lớn nhất < 3 cm. | Bất kỳ di căn hạch nào ≥ 3 cm hoặc di căn xa. |
| Xâm lấn tại chỗ | Không có (nếu carci- noma giáp thể nhú); không có hoặc chỉ tới bao (nếu là ung thư giáp thể nang). | Xâm lấn vi thể tới các mô mềm quanh tuyến giáp. | Xâm lấn đại thể của u tới các mô mềm quanh tuyến giáp. |
| Xâm lấn mạch máu | Không có (nếu là carcinoma giáp thể nhú); < 4 ổ nếu là ung thư giáp thể nang). | Có (nếu là carcinoma giáp thể nhú). | > 4 ổ (nếu là ung thư tuyến giáp thể nang). |
| Cắt bỏ bằng phẫu thuật | Hoàn toàn | Không được đánh giá | Không hoàn toàn |
| Biến thể mô bệnh học | Không gây xâm lấn. | Gây xâm lấn (ví dụ, tế bào cao hình định đầu to, tế bào trụ). | Không được đánh giá |
| Kết quả chụp xạ hình toàn thân sau điều trị bằng RAI | Không có các ổ di căn ngoài giường giáp trạng. | Các ổ di căn ở vùng cổ. | Không được đánh giá |
| Nồng độ Tg sau mổ | < 10 ng/mL | < 10 ng/mL | Gợi ý có di căn xa (≥ 10 ng/mL). |
3.3 Các thuốc điều trị
Tất cả các bệnh nhân được cắt toàn bộ tuyến giáp và một số bệnh nhân cắt thùy tuyến giáp sẽ cần được điều trị thay thế hormon giáp, thường là bằng levothyroxin. Đối với các bệnh nhân có nguy cơ bị tái phát cao, dùng levothyroxin với liều ức chế TSH huyết tương xuống thấp hơn giới hạn bình thường. Giới hạn nồng độ TSH đích được khuyến cáo theo nhóm nguy cơ như sau:
- Bệnh nhân có nguy cơ cao: < 0,1 mU/L.
- Bệnh nhân có nguy cơ trung bình: 0,1 - 0,5 mU/L.
Bệnh nhân có nguy cơ thấp: 0,5 - 2,0 mU/L đối với đối tượng được cắt thùy giáp hoặc tuyến giáp. Ở nhóm bệnh nhân được cắt tuyến giáp, Phải không phát hiện được Tg huyết tương. Nếu vẫn có thể định lượng được Tg sau phẫu thuật cắt tuyến giáp (có hay không kèm điều trị cắt bỏ phần tuyến giáp tồn dư), cần xem xét ức chế TSH vừa phải (0,1 đến 0,5 mU/L).
Các thuốc ức chế kinase như sorafenib và lenvatinib đã được phê chuẩn để sử dụng cho các trường hợp carcinoma tuyến giáp biệt hóa không đáp ứng với điều trị RAI. Các thuốc này có các tác dụng phụ như: độc tính với gan, tăng huyết áp, độc tính với tim, kéo dài QTc cũng như làm tăng nồng độ TSH đòi hỏi phải điều chỉnh liều điều trị thyroxin để duy trì được nồng độ TSH đích. Trong trường hợp bệnh nhân không đáp ứng với các chất ức chế kinase được chỉ định điều trị bước một, có thể xem xét dùng thuốc ức chế kinase bước hai hoặc hóa trị liệu gây độc tế bào được nghiên cứu trong thử nghiệm lâm sàng.
Cũng nên xem xét sử dụng các thuốc chống hủy xương tác dụng trực tiếp trên xương như denosumab và Acid zoledronic ở bệnh nhân bị di căn xương rộng không đáp ứng với điều trị bằng iod phóng xạ, do các thuốc này đã được chứng minh làm chậm lại những cố không mong muốn trên xương ở bệnh nhân bị các loại u khác. Một điều cũng đã được xác nhận rất rõ là các di căn xương có xu hướng đáp ứng kém với điều trị bằng iod phóng xạ và kinase. Trong trường hợp bị bệnh lý xương tại chỗ hoặc chỉ có một vài tổn thương xương, phẫu thuật cắt bỏ tổn thương bằng nhiệt hoặc tia xạ liên tục là điều trị được ưu tiên áp dụng [3.9,10].
4 KIỂM TRA VÀ THEO DÕI
Cần theo dõi Tg và kháng thể kháng Tg huyết thanh mỗi 6-12 tháng /lần sau khi bắt đầu điều trị và thường xuyên hơn ở bệnh nhân có nguy cơ cao. Nếu không thấy tổn thương nghi ngờ và nồng độ Tg huyết thanh không kích thích (bằng TSH) < 0,2 ng/mL thời gian định lượng Tg có thể được kéo dài tới 1-2 năm/lần đối với bệnh nhân có nguy cơ từ thấp tới vừa. Ở các bệnh nhân không được điều trị bằng cách cắt bỏ phần nhu mô giáp còn sót lại hoặc cắt hoàn toàn tuyến giáp, giá trị điểm cắt tối ưu hiện còn chưa được xác định. Tuy nhiên, Tg tăng dần theo thời gian có thể đặt ra nghi ngờ về khả năng ung thư đang phát triển trở lại.
Cần tiến hành siêu âm vùng cổ sau khi bắt đầu điều trị 6 - 12 tháng để đánh giá giường tuyến giáp và các hạch cổ. Theo dõi bằng siêu âm phải được dựa trên nguy cơ bệnh tái phát và tình trạng Tg của bệnh nhân. Các hạch bạch huyết nghi ngờ với kích thước > 8 - 10 mm có thể được sinh thiết để làm tế bào học và định lượng Tg trong dịch rửa của kim. Các hạch nhỏ hơn có thể được theo dõi theo thời gian.
Phải tiến hành chụp xạ hình toàn thân chẩn đoán bằng iod-123 hoặc I-131 hoạt tính thấp (low-activity I-131) sau khi điều trị RAI bổ sung từ 6 - 12 tháng ở bệnh nhân có nguy cơ cao hoặc vừa với các đặc điểm mô bệnh học có nguy cơ cao hơn. Không cần chụp xạ hình toàn thân chẩn đoán cho các bệnh nhân có nguy cơ thấp hoặc vừa với đặc điểm mô bệnh học có nguy cơ thấp nếu siêu âm cổ không thấy có tổn thương nghi ngờ và nồng độ Tg huyết thanh không định lượng được.
Nên thực hiện chụp PET với fluorodeoxyglucose (FDG-PET) cho bệnh nhân có nồng độ Tg tăng cao, kết quả xạ hình toàn thân âm tính và ở các bệnh nhân bị ung thư tuyến giáp biệt hóa kém do ung thư này có thể mất khả năng bắt giữ RAI hoặc giảm khả năng sản xuất và/hoặc tiết Tg.
Nên điều chỉnh mục tiêu ức chế TSH theo thời gian dựa trên bằng chứng về cấu trúc/chức năng (siêu âm hoặc hình ảnh học khi chụp iod phóng xạ), sinh hóa (nồng độ Tg) chứng tỏ còn bệnh cũng như nguy cơ lâu dài bị cường giáp, bao gồm tình trạng bệnh lý tim mạch tiến triển nặng lên ở nam giới cao tuổi và mất khối xương ở nữ sau tuổi mãn kinh.
- TSH nên được duy trì ở đích < 0,1 mU/L nếu bệnh lý tổn thương tiếp diễn khi đánh giá bằng siêu âm vùng cổ hoặc thăm dò hình ảnh học bằng iod phóng xạ.
- Nên ức chế TSH vừa phải (0,1 đến 0,5 mU/L) nếu có bằng chứng còn bệnh về mặt sinh hóa (Tg > 1 - 2 ng/mL), cũng cần lưu ý tới phân loại nguy cơ của Hội Tuyến giáp Hoa Kỳ cũng như nồng độ và khuynh hướng ban đầu của Tg.
- Nên duy trì TSH ở ngưỡng nửa dưới của giới hạn bình thường đối với bệnh nhân có nguy cơ thấp đến vừa và không có bằng chứng còn bệnh về cấu trúc hoặc sinh hóa.
- Ức chế TSH xuống mức 0,1 - 0,5 mU/L đối với bệnh nhân có nguy cơ cao song không có bằng chứng còn bệnh về cấu trúc hoặc sinh hóa và duy trì mức TSH này tới 5 năm.
Điều trị tình trạng bệnh tái phát
- Cắt bỏ các hạch ở khoang cổ được ưu tiên lựa chọn cho bệnh nhân có kết quả sinh thiết chứng minh có tái phát hạch hoặc bệnh tiến triển với các hạch có đường kính nhỏ nhất > 8 - 10 mm.
- Có thể tiến hành điều trị RAI cho các bệnh nhân có hạch di căn khi chụp xạ hình toàn thân. Phương pháp này có thể được sử dụng như một điều trị thay thế ở bệnh nhân với bệnh lý u tối thiểu, khi không thể can thiệp ngoại khoa, hoặc như một liệu pháp điều trị bổ sung phối hợp với phẫu thuật.
- Cắt bỏ u bằng tiêm cồn Ethanol có thể được xem xét ở bệnh nhân không thể phẫu thuật và có những nhân nhỏ [3].
5 KẾT CỤC VÀ TIÊN LƯỢNG
Carcinoma giáp thể nhú có tiên lượng cực kỳ tốt với tỷ lệ sống sót 10 năm vượt quá 95%. Tỷ lệ tái phát thay đổi có ý nghĩa dựa trên phân tầng nguy cơ ban đầu theo Hiệp hội Tuyến giáp Hoa Kỳ (ATA).
Ung thư tuyến giáp thể nang có tiên lượng rất thay đổi, tùy thuộc vào kích thước của u. Yếu tố dự đoán nguy cơ di căn của bệnh bao gồm tuổi của bệnh nhân và mức độ xâm lấn mạch máu. Cụ thể là ung thu giáp thể nang khi chỉ xâm lấn tới bao hoặc không xâm lấn bao nhưng xâm lấn mạch máu không đáng kể có tỷ lệ tái phát < 7%, trong khi ung thư giáp thể nang với xâm lấn mạch máu lớn hơn gia tăng nguy cơ bị di căn xa tới 30% - 55%.
Carcinoma tuyến giáp biệt hóa kém có tiên lượng ở mức trung bình nằm giữa ung thư tuyến giáp thể biệt hoá và ung thư tuyến giáp thể không biệt hoá, tỷ lệ sống sót 5 năm là 72% và tỷ lệ sống sót tới 10 năm là 46%. Khối u có xu hướng không hoặc đáp ứng kém hơn với iod phóng xạ và thường cần được điều trị toàn thân [1-5].
6 CÁC TRƯỜNG HỢP ĐẶC BIỆT
6.1 Carcinoma tuyến giáp không biệt hóa
- Carcinoma tuyến giáp không biệt hóa (chiếm 1 % các ung thư tuyến giáp) là một loại ung thư tuyến giáp hiếm gặp, tiến triển nhanh với tiên lượng xấu (thời gian sống sót trung bình khoảng 6 tháng. Các khối u này có xu hướng đáp ứng hạn chế với iod phóng xạ cũng như các biện pháp điều trị bằng hóa trị và xạ trị truyền thống.
- Ung thư tuyến giáp không biệt hóa có tính chất xâm lấn đáng kể vào thời điểm được chẩn đoán:
- Khoảng 40% bệnh nhân được biểu hiện bằng tình trạng bệnh lan rộng ra ngoài tuyến giáp và/hoặc di căn tới các hạch.
- Khoảng 50% bệnh nhân có di căn rộng.
- Sinh thiết bằng kim to (core biopsy) hoặc sinh thiết mở thay vì chọc hút bằng kim nhỏ, thường được yêu cầu để chẩn đoán. Do ung thư tuyến giáp không biệt hóa thường phát sinh ở bệnh nhân có tiền sử bị carcinoma thể nhú hoặc có carcinoma thể nhú cùng tồn tại, nó có thể được phân biệt với carcinoma giáp kém biệt hóa dựa trên kết quả nhuộm Tg và yếu tố phiên mã tuyến giáp 1 âm tính. Khoảng 40 - 50% các bệnh nhân có tiền sử carcinoma giáp biệt hóa hoặc carcinoma giáp biệt hóa cùng tồn tại được ghi nhận trên mô bệnh học.
- Tiến hành thăm dò hình ảnh học trước mổ sau khi chẩn đoán để phát hiện bệnh lý di căn và xác định mức độ lan rộng của bệnh ở vùng cổ, bao gồm:
- Siêu âm vùng cổ.
- Chụp CT cổ và ngực.
- FDG-PET/CT.
- Đánh giá các dây thanh bằng ống soi mềm hay gương soi thanh quản.
- Chụp MRI não.
- Nếu không có tổn thương ngoài tuyến giáp nên chỉ định phẫu thuật cắt bỏ tuyến giáp. Ở bệnh nhân với bệnh trong tuyến giáp +/- hạch bạch huyết nên tiến hành cắt thùy tuyến giáp hoặc cắt gần toàn bộ tuyến giáp và cắt bỏ hạch bạch huyết. Nếu có tình trạng lan rộng ra ngoài tuyến giáp nên tiến hành cắt bỏ cả khối.
- Ở bệnh nhân có tình trạng chức năng tốt và tổn thương không thể cắt bỏ hoặc tổn thương còn sót lại sau khi cắt bỏ, nên xem xét xạ trị có hoặc không kết hợp với hoá trị liệu. Xem xét lại chỉ định phẫu thuật cắt bỏ sau đó nếu tổn thương đáp ứng với điều trị cải thiện khả năng thành công khi phẫu thuật cắt bỏ các tổn thương đã khu trú.
- Mở khí quản có thể được thực hiện nhằm tránh ngạt liên quan với những tổn thương nặng, mở dạ dày nhằm mục đích hỗ trợ dinh dưỡng cho bệnh nhân.
- Điều trị tia xạ triệt để có hoặc không kèm hóa trị đồng thời nên được chỉ định cho bệnh nhân có tình trạng chức năng sau phẫu thuật tốt. Các phác đồ trị liệu hóa chất có thể được chấp nhận bao gồm các phác đồ kết hợp taxan, anthracyclin và/hoặc platinum.
- Ở bệnh nhân có bệnh lý di căn rộng, ưu tiên xử trí là làm giảm triệu chứng. Điều trị tia xạ hoặc phẫu thuật có thể cần thiết nếu bệnh lý tại chỗ đang đe dọa rõ tính mạng bệnh nhân. Mặt khác, nếu một liệu trình điều trị tích cực được lựa chọn, có thể thử điều trị toàn thân cho bệnh nhân. Xạ trị có thể đặc biệt hữu ích để làm giảm đau xương ở các bệnh nhân bị di căn xương.
- Điều trị tia xạ giảm đỡ bệnh nên được chỉ định cho bệnh nhân có triệu chứng tại chỗ, tình trạng chức năng không tốt và không thể phẫu thuật.
- Điều trị thay thế bằng levothyroxin nên được điều chỉnh liều để duy trì được tình trạng bình giáp về lâm sàng và xét nghiệm, trừ khi để điều trị carcinoma tuyến giáp biệt hóa đi kèm.
- Trong khi đang điều trị tích cực, bệnh nhân nên được theo dõi sát về tình trạng suy dinh dưỡng, suy giảm nuôi dưỡng qua đường ruột, tổn hại đường thở và giảm bạch cầu đa nhân trung tính.
- Nên tiến hành thăm dò bằng hình ảnh học định kỳ liên tục đối với bệnh nhân có đáp ứng với điều trị ban đầu.
- Xạ hình và điều trị bằng RAI không được khuyến cáo đối với ung thư tuyến giáp thể không biệt hoá, trừ khi thời gian sống của bệnh nhân từ 1 - 2 năm và có bệnh ung thư tuyến giáp thể nhú đồng mắc [11,12).
6.2 Ung thư tuyến giáp thể tủy
- Ung thư tuyến giáp thể tủy (MTC) (chiếm 4% các ung thư tuyến giáp) xuất phát từ các tế bào C thần kinh - nội tiết (tế bào quanh nang). Khoảng 75% các carcinoma thể tủy là thể tản phát. Ung thư tuyến giáp thể tủy là một biểu hiện của hội chứng u tân sinh đa tuyến nội tiết (MEN) 2A và 2B. Cần lưu ý là, hội chứng ung thư tuyến giáp thể tủy có tính gia đình, được đặc trưng bằng ung thư tuyến giáp thể tủy song không có cường cận giáp hoặc u tủy thượng thận, hiện được coi là một biến thể của MEN 2A. Các hội chứng này do đột biến các vùng khác nhau của gen sinh ung thư RET gây nên và được thảo luận chi tiết hơn ở Chương 37, Hội chứng u tân sinh đa tuyến nội tiết. Phần còn lại của thảo luận này sẽ tập trung vào ung thư tuyến giáp thể tuỷ thể tản phát. Tỷ lệ sống sót tới 10 năm của các đối tượng bị ung thư tuyến giáp thể tủy giao động từ 75 – 85%.
- Chẩn đoán bằng kết quả tế bào học khi chọc hút bằng kim nhỏ (với độ nhạy 50 - 80%) hoặc bằng giải phẫu bệnh ngoại khoa mổ cắt thùy tuyến giáp do tế bào học không xác định được. Không khuyến cáo định lượng nồng độ Calcitonin huyết thanh do tình trạng tăng giả tạo nồng độ calcitonin huyết thanh được gặp với tần suất cao.
- Khoảng 75% bệnh nhân có biểu hiện di căn tới hạch, trong đó 5 - 10% có di căn xa.
- Sau khi chẩn đoán, nên tiến hành định lượng nồng độ calcitonin và kháng nguyên carcinogen bào thai (CEA) và phân tích đột biến dòng mầm RET
- Nếu phân tích đột biến RET dương tính hoặc không được biết, nên tiến hành sàng lọc các bệnh lý MEN2A và MEN2B cùng tồn tại. Quy trình sàng lọc này phải bao gồm định lượng nồng độ Canxi huyết thanh để phát hiện tình trạng cường cận giáp nguyên phát và nồng độ phần trăm metanephrin huyết tương để sàng lọc u tủy thượng thận.
- Nếu nồng độ calcitonin huyết thanh vượt hơn 500 pg/mL, nên tiến hành thăm dò hình ảnh học toàn thân trước khi phẫu thuật để đánh giá có di căn hay không. Cắt toàn bộ tuyến giáp với cắt bỏ hạch vùng cổ là điều trị cơ bản. Sau phẫu thuật cắt bỏ u, nên xem xét điều trị tia xạ bằng chùm tia ngoài cho các đối tượng với u còn tồn dư u lan rộng ra ngoài tuyến giáp hoặc bệnh lý hạch lớn. Nên xem xét tuyển chọn các đối tượng với bệnh lý di căn tiến triển tham gia các thử nghiệm lâm sàng hoặc điều trị chất ức chế tyrosine kinase. Nồng độ calcitonin huyết thanh phải được kiểm tra 3 tháng sau phẫu thuật. Nếu nồng độ này bình thường hoặc không thể phát hiện được, cần siêu âm vùng cổ và định lượng calcitonin định kỳ liên tục mỗi 6 - 12 tháng /lần.
- Nếu nồng độ calcitonin <150 pg/mL và không có bằng chứng về bệnh lý cấu trúc khi thăm dò hình ảnh học hoặc thăm khám, nên tăng tần suất đánh giá tình trạng tái phát về sinh hóa và hình ảnh học vùng cổ. Nếu khẳng định có tái phát bệnh lý cấu trúc, xem xét tiến hành phẫu thuật lại tổn thương ở vùng cổ.
- Nếu nồng độ calcitonin>150 pg/mL, nhiều khả năng là đã xảy ra các di căn xa, cần tiến hành thăm dò hình ảnh học vùng cổ và toàn thân.
- Điều trị bệnh tái phát bao gồm theo dõi, phẫu thuật cắt bỏ, xạ trị, điều trị toàn thân hoặc các điều trị tại chỗ khác [13,14].
7 NGƯỜI BỊ U TUYẾN GIÁP CÓ NÊN SỬ DỤNG THỰC PHẨM CHỨC NĂNG KHÔNG?
Những người bị u tuyến giáp chắc hẳn sẽ rất lo lắng cho sức khỏe của mình. Nhiều người đã tìm đến các sản phẩm thực phẩm chức năng mà chưa chắc chắn về công dụng của chúng đối với tình trạng u tuyến giáp của bản thân. Tuy nhiên, các chuyên gia cho biết, nhiều loại thuốc và thực phẩm chức năng không có hiệu quả đối với u tuyến giáp. Vì thế, trước khi sử dụng các thực phẩm chức năng cho tuyến giáp, bạn cần lưu ý một số vấn đề sau:
- Thuốc hoặc thực phẩm chức năng có thể chứa hormone tuyến giáp: Không thể biết liệu chất bổ sung có chứa hormone tuyến giáp hay không khi đọc nhãn, nhưng một nghiên cứu năm 2013 được công bố trên tạp chí Thyroid cho thấy, 9 trong số 10 loại thự phẩm bổ sung được bán trên thị trường với mục tiêu hỗ trợ tuyến giáp có chứa hormon sinh lý. Hầu hết trong số đó là nguồn hormone tuyến giáp từ động vật hoặc nguồn tổng hợp. Điều này khá nguy hiểm vì nồng độ hormone tuyến giáp cao hơn hoặc thấp hơn một chút so với mức bình thường có thể dẫn đến các biến chứng về sức khỏe. Cụ thể, quá nhiều thyroxine có thể khiến loạn nhịp tim và loãng xương. Ngoài ra, chúng ta không thể biết chính xác một sản phẩm bổ sung có thể chứa bao nhiêu hormone tuyến giáp.
- Một số loại có thể chứa iod: Theo Viện Y học Hoa Kỳ, cơ thể chúng ta cần khoảng 150 mcg i-ốt mỗi ngày và có thể được cung cấp đủ từ chế độ ăn uống. Lượng iod nhỏ đó cho phép tuyến giáp sản xuất đúng lượng hormone tuyến giáp thyroxine. Vì thế, nếu bổ sung quá thừa iod, có thể gây ra các vấn đề về sức khỏe gây rối loạn hoạt động của tuyến giáp. Một số ảnh hưởng có thể ngược lại với những gì mà nhiều người hy vọng những chất bổ sung này sẽ mang lại cho họ. Vì thế, hãy xem xét kỹ thành phần của các sản phẩm thực phẩm chức năng, xem chúng có chứa iod không và hàm lượng là bao nhiêu.
- Một số sản phẩm có thể chứa tảo bẹ: Tảo bẹ, một loại rong biển thường được bán trên thị trường và được quảng cáo là có công dụng phục hồi tuyến giáp. Tuy nhiên, chúng có chứa nhiều iod. Hầu hết mọi người đều có đủ iod từ chế độ ăn của họ. Nhưng nếu bạn sử dụng thực phẩm chức năng có chứa tảo bẹ cùng các sản phẩm có chứa iod khác (chẳng hạn như muối iod) tuyến giáp của bạn có thể bị rối loạn.
- Thực phẩm chức năng có thể cản trơe việc điều trị u tuyến giáp: Việc điều trị u tuyến giáp cần được theo dõi dựa trên các kết quả xét nghiệm (chẳng hạn như xét nghiệm máu). Tuy nhiên, việc sử dụng các sản phẩm bổ sung có thể làm thay đổi mức độ hormone tuyến giáp trong máu của bạn và có thể che giấu các biểu hiện bệnh lý của tuyến giáp.
Vì thế, người bị u tuyến giáp không nên vội vàng sử dụng các sản phẩm thực phẩm chức năng bổ sung cho tuyến giáp. Hãy đọc kỹ thành phần của sản phẩm và tham khảo ý kiến bác sĩ.
8 TÀI LIỆU THAM KHẢO
1. Fagin JA, Wells SA. Biologic and clinical perspectives on thyroid cancer. N Engl J Med 2016; 375(11):1054-1067.
2. Jemal A, Ward EM, Johnson CJ, et al. Annual report to the nation on the status of cancer, 1975-2014, Featuring Survival. JNCI J Natl Cancer Inst 2017; 109(9):1–22.
3. Haugen BR, Alexander EA, Bible KC, et al. 2015 American Thyroid Association management guide- lines for adult patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2016; 26:1-33.
4. Burman KD. Is poorly differentiated thyroid cancer poorly characterized? J Clin Endocrinol Metab 2014; 99(4):1167–1169.
5. Roman S, Sosa JA. Aggressive variants of papillary thyroid cancer. Curr Opin Oncol 2013;25(1):33–38.
6. Oda H, Miyauchi A, Ito Y, et al. Incidences of unfavorable events in the management of low-risk papillary microcarcinoma of the thyroid by active surveillance versus immediate surgery. Thyroid 2015 ;26(1):150-155.
7. Nikiforov YE, Sethala RR, Tallini G, et al. Nomenclature revision for encapsulated follicular variant of papillary thyroid carcinoma: a paradigm shift to reduce over treatment of indolent tumors. JAMA Oncol 2016;2(8):1023-1029.
8. Mazzaferri EL, Robbins RJ, Spencer CA, et al. A consensus report of the role of serum thyroglobulin as a monitoring method for low-risk patients with papillary thyroid carcinoma. J Clin Endocrinol Metab 2003;88(4):1433-1441.
9. Pfister DG, Fagin JA. Refractory thyroid cancer: a paradigm shift in điều trị is not far off. J Clin Oncol 2008;26(29):4701-4704.
10. Bible KC, Ryder M. Evolving molecularly targeted therapies for advanced-stage thyroid cancers. Nat Rev Clin Oncol 2016;13(7):403–416.
11. Smallridge RC, Ain KB, Asa SL, et al. American Thyroid Associ- ation guidelines for management of patients with anaplastic thyroid cancer. Thyroid 2012;22(11): 1104-1139.
12. Smallridge RC. Approach to the patient with anaplastic thyroid carcinoma. J Clin Endocrinol Metab 2012;97(8):2566–2572.
13. Wells SA Jr, Asa SL, Dralle H, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid 2015;25(6):567–610.
14. Sippel RS, Kunnimalaiyaan M, Chen H. Current management of medullary thyroid cancer. Oncologist 2008;13(5):539–547.
15. Lauren Cooper (Ngày đăng: Ngày 25 tháng 03 năm 2016). 5 Reasons You Should Never Take Thyroid Supplements, Consumer Reports. Ngày truy cập: Ngày 06 tháng 07 năm 2023)n)

