Tương đương sinh học của thuốc là gì? Danh mục thuốc tương đương sinh học theo Cục Quản Lý Dược
Trungtamthuoc.com- Ngày nay, với tốc độ phát triển của thị trường dược phẩm ngày càng nhanh, nhiều thuốc với các dạng bào chế từ một dược chất được ra đời, đặc biệt là các thuốc generic. Tuy nhiên muốn lựa chọn thuốc nào cho an toàn và hiệu quả, chúng ta cần cân nhắc đến sinh khả dụng và tương đương sinh học của thuốc.
1 Các khái niệm liên quan đến tương đương sinh học
Để đánh giá về hiệu quả điều trị của thuốc thì chúng ta cần phải hiểu rõ về khái niệm của sinh khả dụng và tương đương sinh học.
1.1 Sinh khả dụng (Bioavailability)
Sinh khả dụng đề cập đến mức độ và tốc độ mà một dược phẩm hoặc hợp chất y học hấp thụ và truyền vào hệ tuần hoàn sau khi được sử dụng qua đường uống hoặc một con đường khác. Sinh khả dụng giúp xác định bao nhiêu một liều lượng được hấp thụ và có thể hoạt động trong cơ thể. Điều này quan trọng trong việc đảm bảo rằng một thuốc đủ hiệu quả khi được sử dụng và có thể cung cấp kết quả mong muốn. Sinh khả dụng cũng liên quan đến việc so sánh giữa các biến thể của một loại thuốc hoặc giữa các dạng liều lượng khác nhau.
>>>>Mời bạn đọc xem thêm bài viết về sinh khả dụng: Sinh Khả Dụng Của Thuốc Là Gì? Công Thức, Bài Tập Tính Sinh Khả Dụng
1.2 Tương đương sinh học
Tương đương sinh học trong tiếng Anh là Bioequivalence. Khi hai dược phẩm có sự tương đương về mặt bào chế hoặc thế phẩm bào chế và sinh khả dụng sau khi sử dụng cùng một liều lượng trong cùng một điều kiện thử nghiệm dẫn đến sự tương đương về mặt hiệu quả điều trị, thì hai dược phẩm này được coi là tương đương sinh học.
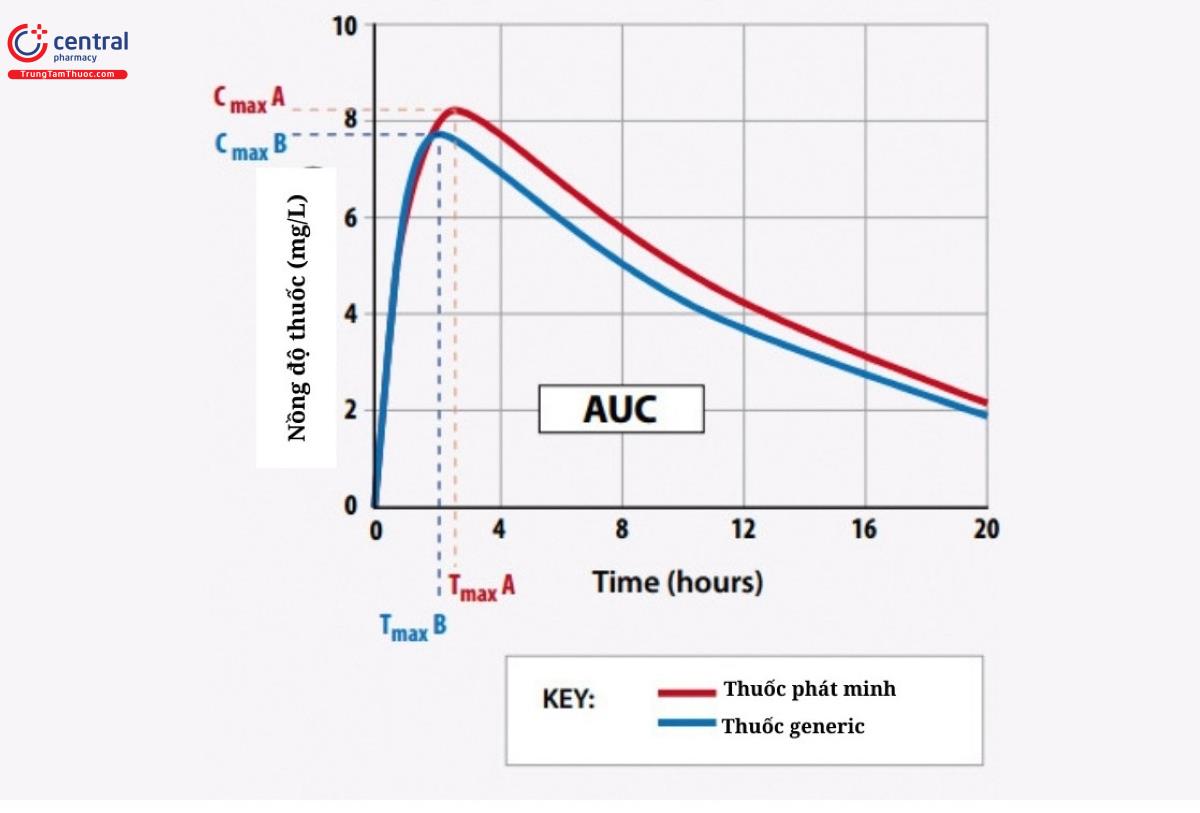
Ta có công thức tính sinh khả dụng tương đối:
F = (FA/FB) *100 = (AUCthử/AUCđối chiếu) * (Dđối chiếu/Dthử)
(Trong đó FB là chuẩn do cục Quản lý dược của Bộ Y tế quy định, thường là nơi đầu tiên nghiên cứu sản xuất. AUCthử, AUCđối chiếu lần lượt là diện tích dưới đường cong của chế phẩm thử và chế phẩm đối chiếu; Dthử, Dđối chiếu là diện tích dưới đường cong và liều dùng ứng với chế phẩm thử và chế phẩm đối chiếu.
Nếu chế phẩm thử có F= 80-125% so với chế phẩm đối chiếu thì được đánh giá là tương đương sinh học so với chế phẩm đối chiếu.
1.3 Thử tương đương sinh học (In vivo Bioequivalence study)
Thiết kế nghiên cứu lâm sàng trên các tình nguyện viên để so sánh sinh khả dụng của thuốc generic với thuốc đối chứng được gọi là nghiên cứu thử tương đương sinh học. Mục tiêu cuối cùng của nghiên cứu này là chứng minh liệu thuốc generic có khả năng thay thế thuốc đối chứng hay không.
2 Phân biệt các dạng thuốc được sử dụng để thử tương đương sinh học
2.1 Các khái niệm
Theo điều 2 thông tư số: 07/2022/TT-BYT ngày 05/09/2022 của Bộ Y Tế quy định về khái niệm các thuốc trong thử tương đương sinh học như sau:
Thuốc thử: Là thuốc generic được sử dụng để chứng minh có cùng hiệu quả điều trị (xét cả về hiệu lực và tính an toàn của thuốc) khi sử dụng trên bệnh nhân ở cùng một mức liều theo cùng một đường dùng với các điều kiện riêng quy định trên nhãn (nếu có) so với thuốc đối chứng thông qua các dữ liệu thử tương đương sinh học (in vivo) hoặc thử tương đương độ hòa tan (in vitro) so với thuốc đối chứng.
Thuốc đối chứng (Comparator product/Reference product): Là thuốc mà thuốc generic sẽ được dùng để thay thế nó trong điều trị. Thông thường, thuốc đối chứng là các thuốc phát minh hoặc các thuốc đã được cấp giấy đăng ký lưu hành với đầy đủ dữ liệu về hiệu quả, an toàn và chất lượng đã được thiết lập.
Thuốc phát minh (Innovator pharmaceutical product): Là thuốc được cấp phép lưu hành đầu tiên trên thế giới, trên cơ sở đã có đầy đủ các dữ liệu về chất lượng, an toàn và hiệu quả, bao gồm thuốc đã được cấp phép hoặc chưa được cấp phép lưu hành tại Việt Nam.
2.2 Phân biệt thuốc biệt dược gốc và thuốc generic
Giống nhau:
- Cùng thành phần, hoạt chất, nồng độ, hàm lượng và công dụng
- Cùng một mục tiêu điều trị
- Tương tự về mức độ hấp thu thuốc vào máu
Khác nhau:
| Tiêu chí | Biệt dược gốc (thuốc phát minh) | Thuốc generic |
Nguồn gốc | Được nghiên cứu và sản xuất có bằng sáng chế, do công ty sở hữu, bảo vệ bằng luật sáng chế trong một khoảng thời gian nhất định | Bản sao của thuốc biệt dược sau khi hết hạn bảo vệ sáng chế. Các công ty khác có thể sản xuất thuốc gốc sau khi kết thúc quyền độc quyền của thuốc biệt dược |
| Quá trình nghiên cứu | Trải qua quá trình nghiên cứu lâm sàng và tiền lâm sàng nghiêm ngặt | Không cần qua quá trình nghiên cứu nghiêm ngặt mà chỉ cần nghiên cứu chứng minh tương đương sinh học với biệt dược gốc |
Giá sản phẩm | Đắt hơn so với thuốc generic do phải bù đắp cho chi phí nghiên cứu và phát triển | Giá rẻ hơn nhiều so với biệt dược gốc do không phải chi trả cho nghiên cứu và phát triển ban đầu |
Tên gọi | Có tên gọi độc quyền | Thường sử dụng tên gắn liền với hoạt chất của thuốc hoặc dựa theo tên của biệt dược gốc |
3 Tầm quan trọng của thử tương đương sinh học
- Đảm bảo hiệu quả và an toàn: Việc đánh giá tương đương sinh học đảm bảo rằng các sản phẩm y tế và thuốc đủ mạnh để điều trị hoặc kiểm soát bệnh cho người dùng.
- Giảm chi phí điều trị: Khi sản phẩm được coi là tương đương sinh học, người bệnh có thể sử dụng sản phẩm thay thế với giá rẻ hơn, giúp giảm chi phí chăm sóc sức khỏe và vẫn đạt được hiệu quả điều trị.
- Hỗ trợ nghiên cứu lâm sàng: Tương đương sinh học đóng vai trò quan trọng trong nghiên cứu lâm sàng, giúp các nhà nghiên cứu xác định tác động và hiệu quả của thuốc trong các thử nghiệm lâm sàng.
- Điều chỉnh liều lượng cá nhân: Hiểu rõ về tương đương sinh học giúp các chuyên gia y tế điều chỉnh liều lượng cho từng bệnh nhân, đảm bảo rằng bệnh nhân nhận được liều tối ưu.
- Quản lý chất lượng sản phẩm: Quy trình kiểm tra tương đương sinh học giúp đảm bảo rằng các sản phẩm đáp ứng tiêu chuẩn chất lượng và an toàn, bảo vệ sức khỏe của người dùng.

4 Danh mục thuốc có chứng minh tương đương sinh học đợt 30 theo Quyết định số 740/QĐ-QLD ngày 14/11/2022 của Cục Quản lý Dược
Bạn đọc có thể tham khảo danh mục thuốc có chứng minh tương đương sinh học đợt 30 theo Quyết định số 740/QĐ-QLD ngày 14/11/2022 của Cục Quản lý Dược tại đây [1]
5 Quy định đối với các nghiên cứu sinh khả dụng/ tương đương sinh học
5.1 Thiết kế nghiên cứu
Việc thiết kế và thực hiện nghiên cứu phải tuân thủ các quy định được nêu trong Hướng dẫn thử nghiệm tương đương sinh học của ASEAN. Ngoài ra, có thể tham khảo các hướng dẫn của các tổ chức khác quy định tại Phụ lục VI ban hành theo thông tư 07/2022/TT-BYT. [2]
Bắt buộc phải tiến hành nghiên cứu các loại thuốc phóng thích biến đổi, có tác dụng toàn thân và được dùng bằng đường uống. Nghiên cứu này phải bao gồm hai nghiên cứu riêng biệt: một nghiên cứu trong đó thuốc được uống trong điều kiện dạ dày trống rỗng và nghiên cứu khác trong đó thuốc được uống sau bữa ăn.
Khi xử lý thuốc ở dạng bào chế có hoạt chất giải phóng tức thì, có tác dụng toàn thân và không thuộc các trường hợp cụ thể nêu tại Điều 5 Thông tư, cần nghiên cứu tác dụng của thuốc khi dùng. Tuy nhiên, nếu đặc tính dược động học của thuốc đối chứng cho thấy thức ăn ảnh hưởng đến sinh khả dụng của nó hoặc nếu thuốc đối chứng có hướng dẫn sử dụng sau bữa ăn thì nghiên cứu có thể được tiến hành khi thuốc được dùng ở trạng thái no. Vì vậy, điều quan trọng là phải tiến hành nghiên cứu tác dụng của thuốc trong các điều kiện khác nhau để đảm bảo kết quả chính xác.
5.2 Tiêu chí về thuốc cần thử tương đương sinh học
Tiêu chí về thuốc generic chứa dược chất phải báo cáo số liệu nghiên cứu tương đương sinh học khi đăng ký lưu hành.
- Thuốc có cửa sổ điều trị hẹp
- Thuốc có sinh khả dụng thấp và/hoặc khác nhau nhiều giữa các cá thể
- Thuốc có trong các thuốc kê đơn, thuộc một trong các nhóm dược lý gồm thuốc tim mạch, thuốc hạ đường huyết, thuốc kháng sinh, thuốc chống rối loạn tâm thần/điều trị động kinh, thuốc kháng virus
- Thuốc trong các thuốc thuộc danh mục các thuốc được sử dụng trong các chương trình Quốc gia gồm: Dự án phòng chống HIV-AIDS; Dự án bảo vệ sức khỏe tâm thần cộng đồng; Dự án phòng chống bệnh lao; Dự án phòng chống bệnh sốt rét.
- Danh mục dược chất chứa trong thuốc generic phải báo cáo số liệu nghiên cứu tương đương sinh học khi đăng ký lưu hành thuốc được quy định theo Bộ Y Tế.
5.3 Tiêu chí về thuốc đối chứng
Thuốc đối chứng được sử dụng trong thử tương đương sinh học sẽ dựa vào các tiêu chí sau:
a) Ưu tiên chọn các thuốc trong danh mục biệt dược gốc đã được Bộ Y tế công bố hoặc các thuốc đã được Bộ Y tế cấp giấy đăng ký lưu hành với đủ thông tin về chất lượng, an toàn, và hiệu quả lâm sàng.
b) Tiếp theo là lựa chọn các thuốc đối chứng là các sản phẩm dược phẩm mới chưa được cấp Giấy đăng ký lưu hành tại Việt Nam, nhưng đã được một trong các cơ quan quản lý dược phẩm theo quy định tại Điều 2 khoản 10 của Thông tư số 32/2018/TT-BYT phê duyệt và đang được lưu hành tại thị trường của các quốc gia có quy định chặt chẽ trong Thông tư trên.
c) Trong trường hợp không thể xác định được thuốc đối chứng đáp ứng quy định tại điểm a hoặc điểm b, thì tiêu chí ưu tiên cho việc lựa chọn thuốc đối chứng là:
Các thuốc đã được một trong các cơ quan quản lý dược phẩm theo quy định tại Điều 2 khoản 10 của Thông tư số 32/2018/TT-BYT phê duyệt và đang được lưu hành tại thị trường của các quốc gia có quy định chặt chẽ theo Thông tư trên.
Các thuốc đã được tổ chức Y tế thế giới tiền thẩm định (prequalified).
Trong số các thuốc đáp ứng các tiêu chí này, ưu tiên lựa chọn được đưa ra cho các thuốc có giấy đăng ký lưu hành đang còn hiệu lực do Bộ Y tế Việt Nam cấp.
Tham khảo thêm trong thông tư 07/2022- TT/BYT về TT 07/2022-TT/BYT quy định thuốc phải thử tương đương sinh học tại đây:
6 Có nên lựa chọn thuốc biệt dược mới khi chưa rõ về sinh khả dụng và tương đương sinh học?

Để đánh giá một thuốc về mặt hiệu quả điều trị an toàn, sinh khả dụng và tương đương sinh học là thông số đánh giá lý tưởng bởi nó phải thông qua các quy trình nghiêm ngặt của Bộ Y Tế hoặc các cơ quan khác có liên quan. Do đó, khi chưa hoàn thiện về các quy trình chứng minh sinh khả dụng và tương đương sinh học, thuốc có thể được lựa chọn theo các tiêu chí: sự hợp lệ và tính đầy đủ về hồ sơ của nhà phân phối, kỹ thuật của nhà sản xuất (giấy chứng nhận GMP, phiếu kiểm nghiệm, giấy phép lưu hành ở Việt Nam và nơi sản xuất, hạn dùng, nhãn thuốc…); đánh giá về uy tín chất lượng của nhà phân phối; thuốc đã được sử dụng tại bệnh viện có phản ánh tốt về chất lượng từ phía lâm sàng; ưu tiên thuốc sản xuất trong nước đã đạt GMP; bệnh nhẹ có thể dùng thuốc sản xuất trong nước đạt GMP.
Đánh giá tương đương sinh học là một quá trình trải qua các quy trình thẩm định nghiêm ngặt và cần có sự phối hợp hiệp đồng chặt chẽ giữa các nhà khoa học, nhà sản xuất, phân phối và từ phía bệnh nhân là điều tiên quyết giúp đỡ ngành y dược thực hiện được tiêu chí sử dụng thuốc an toàn, hợp lý, hiệu quả, kinh tế.
Tài liệu tham khảo
- ^ Cục Quản lý Dược (Ngày đăng: 14 tháng 11 năm 2022), Quyết định Về việc công bố Danh mục thuốc có chứng minh tương đương sinh học Đợt 30, Bộ Y Tế. Truy cập ngày 23 tháng 10 năm 2023
- ^ Bộ Y Tế (Ngày đăng: 05 tháng 09 năm 2022), Thông tư quy định thuốc phải thử tương đương sinh học và các yêu cầu đối với hồ sơ báo cáo số liệu nghiên cứu tương đương sinh học trong đăng ký lưu hành thuốc tại Việt Nam, Bộ Y Tế. Truy cập ngày 23 tháng 10 năm 2023

