Loãng xương: Rối loạn chuyển hóa xương phổ biến nhất
Khoa nội tiết chuyển hóa và nghiên cứu
Đồng chủ biên
Thomas J.Braranski, MD, PhD
Janet B.McGill, MD, MA, FACE
Julie M.Silverstein, MD
Và các tác giả khác tham gia biên soạn
1 NGUYÊN LÝ CHUNG
1.1 Định nghĩa
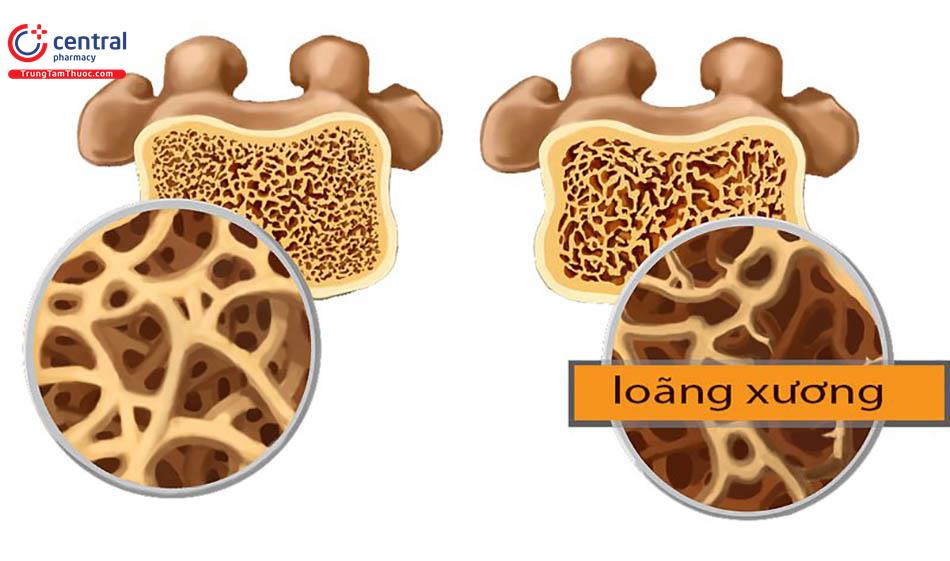
Loãng xương là một rối loạn hệ xương phổ biến được đặc trưng bằng tình trạng giảm mật độ khoáng của xương (BMD) và chất lượng xương, dẫn đến làm suy giảm sức bền (hay sức mạnh) của xương. Mật độ xương là số đo lượng khoáng chất trên một diện tích hoặc thể tích nhất định, là hàm số của khối lượng xương đỉnh và mức độ mất xương theo thời gian. Chất lượng xương được góp phần quyết định bởi cấu trúc vĩ mô và vi mô của xương, quá trình khoáng hóa, tốc độ tái tạo xương và sự tích lũy của các tổn hại xương vi mô. Quá trình loãng xương làm cho khối xương bị giảm đi, cấu trúc xương bị phá hủy dẫn đến xương tăng tính dễ gãy và tăng nguy cơ gãy xương [1].

1.2 Dịch tễ học
Loãng xương là một rối loạn chuyển hóa xương phổ biến nhất. Tình trạng loãng xương và khối lượng xương thấp gây tác động đến hơn 53 triệu người (8 triệu phụ nữ và 2 triệu nam giới bị loãng xương cùng với 43 triệu người có khối lượng xương thấp) ở Hoa Kỳ và 200 triệu người trên toàn thế giới [2]. Tiến triển từ khối lượng xương thấp đến loãng xương tăng theo tuổi [3].
Có sự khác biệt theo sắc tộc/chủng tộc trong tỷ lệ bệnh lưu hành được báo cáo ở các phụ nữ lớn tuổi từ dữ liệu gần đây vào năm 2005 - 2010 của Nghiên cứu Điều tra về Sức khoẻ và Dinh dưỡng Quốc gia (NHANES) với tỷ lệ khối lượng xương thấp và loãng xương lần lượt là 52% và 15% ở phụ nữ da trắng không phải gốc Tây Ban Nha, 36% và 7% ở phụ nữ da đen không phải gốc Tây Ban Nha, 47% và 20% ở các phụ nữ Mỹ gốc Mexico [2].
Gãy xương do loãng xương, đặc biệt là gãy xương chậu hông kết hợp với tăng đáng kể tỷ lệ tàn tật và tử vong trong thời gian ngắn và dài hạn, với phí tổn kinh tế ước tính lên tới 25 tỷ USD vào năm 2025 do hậu quả của già hóa dân số [4].
Để giảm gánh nặng của gãy xương do loãng xương, cần phát hiện sớm và can thiệp thích hợp cho những bệnh nhân có nguy cơ gãy xương cao. Những tiến bộ trong thăm dò chẩn đoán đã giúp việc chẩn đoán loãng xương được thực hiện dễ dàng hơn. Nhiều thuốc điều trị hiện có sẵn trên thị trường để sử dụng ở các cơ sở lâm sàng khác nhau có thể giúp làm tăng mật độ xương và giảm tỷ lệ gãy xương. Không may là vẫn có một tỷ lệ đáng kể bệnh nhân bị loãng xương, kể cả những người đã từng bị gãy xương vẫn không được chẩn đoán và điều trị.
1.3 Sinh lý bệnh
Tổng hàm lượng khoáng chất của xương ở người lớn phụ thuộc vào khối lượng xương đỉnh đạt được trong thời kỳ đầu trưởng thành (25 - 30 tuổi) và tình trạng mất xương liên quan đến lão hóa và thiếu hụt estrogen ở phụ nữ. Khối lượng xương đỉnh chủ yếu được quyết định bởi các yếu tố di truyền, chủng tộc/sắc tộc và giới tính, cùng với sự góp phần của các điều kiện môi trường và chuyển hóa (tình trạng dinh dưỡng, khẩu phần canxi nhập vào cơ thể, hoạt động thể chất, sử dụng thuốc lá, uống rượu, các thiếu hụt hormon và các bệnh lý nội khoa đồng mắc khác). Đàn ông và phụ nữ da đen có khối lượng xương đỉnh cao hơn, điều này có thể giúp giải thích tỷ lệ loãng xương và gãy xương thấp hơn ở những nhóm đối tượng này [5].
Loãng xương có thể do không đạt được khối lượng xương đỉnh được dự kiến trong hai đến ba thập kỷ đầu tiên trong cuộc đời, tăng quá trình tái cấu trúc xương (hủy xương vượt quá trình tạo xương) và mất xương theo tuổi tác [5].
Mất xương do tuổi tác xảy ra ở mức 0,5 - 1%/năm. Thiếu hụt hormon steroid sinh dục dường như là yếu tố chính góp phần gây mất xương ở người lớn tuổi. Gia tăng quá trình mất xương xảy ra trong giai đoạn chuyển tiếp mãn kinh ở phụ nữ do mất ức chế của estrogen đối với các yếu tố tạo xương. Mất xương liên quan với mãn kinh được thấy rõ nhất ở các xương xốp (ví dụ cột sống), nơi có thể xảy ra tỷ lệ mất xương từ 3 - 5%/năm trong vòng 10 năm. Mất xương đặc (đầu gần xương đùi, đầu xa xương trụ và xương quay) diễn ra tử tử hơn. Do nam giới có khối lượng xương đỉnh cao hơn, tiết diện xương đặc lớn hơn và không có quá trình tương ứng với quá trình chuyển đổi thời kỳ mãn kinh như ở nữ giới nên nếu không có rối loạn thứ phát, tình trạng mất xương ở nam giới sẽ không đạt đến mức làm tăng nguy cơ gãy xương cho đến khi họ tới độ tuổi 65 - 70. Mất khối lượng xương và xương dễ bị gãy sẽ gia tăng mức độ trầm trọng hơn do suy giảm chức năng liên quan với tuổi tác dẫn đến tăng nguy cơ bị té ngã và giữ thăng bằng kém, được kết hợp với tăng nguy cơ gãy xương [5].
==> Bạn đọc có thể tham khảo thêm: [Cần biết] Nguyên nhân, chẩn đoán và điều trị hạ canxi máu
1.4 Các yếu tố nguy cơ
Nhiều yếu tố nguy cơ đã được chứng minh là kết hợp một cách độc lập với khối lượng xương thấp (Bảng 26.1). Một số yếu tố nguy cơ này có thể thay đổi được và điều quan trọng là các yếu tố này cần được giải quyết trong một phác đồ toàn diện để ngăn ngừa hoặc điều trị loãng xương [6].
Một loạt các tình trạng bệnh lý nội khoa mạn tính và thuốc gây loãng xương thứ phát (Bảng 26.2).
Gãy xương trong loãng xương thường là hậu quả do té ngã. Do đó, các yếu tố nguy cơ gây té ngã, độc lập với các yếu tố gây khối lượng xương thấp, là những yếu tố góp phần quan trọng vào tình trạng tàn phế liên quan với gãy xương do loãng xương (Bảng 26.3) [6].
1.5 Các bệnh lý kết hợp
Gãy xương do loãng xương:
- Gãy các xương giòn dễ gãy là nguyên nhân chính gây tàn tật và tử vong ở người lớn bị loãng xương. Các vị trí phổ biến nhất của gãy xương do loãng xương là gãy cổ xương đùi, cột sống và đầu xa xương quay. Khoảng 1,5 triệu ca gãy xương do loãng xương xảy ra mỗi năm ở Hoa Kỳ (700.000 đốt sống; 300.000 cổ xương đùi; 200.000 cổ tay và 300.000 các vị trí khác) [5]. Một phụ nữ da trắng 50 tuổi có nguy cơ bị gãy xương do loãng xương trong suốt đời của họ là 40% (so với nguy cơ là 23% ở nam giới). Với sự già hóa của dân số, các gãy xương do loãng xương được dự đoán sẽ tăng lên gấp nhiều lần trên toàn thế giới vào năm 2050 [7].
| Bảng 26.1. Các yếu tố nguy cơ đối với loãng xương và gãy xương |
Giới nữ. Người da trắng. Tuổi cao. Tiền sử cá nhân bị gãy xương. Tiền sử gia đình bị loãng xương/gãy xương ở các người thân thuộc thế hệ F1. Tạng cơ thể thấp bé/ trọng lượng cơ thể thấp. Lối sống tĩnh tại/ít hoạt động thể lực. Hút thuốc lá. Sử dụng rượu cồn quá mức (quá 2 ly/ngày). Lượng canxi và Vitamin D không đủ trong khẩu phần ăn uống. Sử dụng quá mức caffein. Suy buồng trứng hoặc mãn kinh sớm (do nguyên nhân nội khoa hoặc ngoại khoa), (tuổi dưới 45). Thường xuyên bị té ngã. |
- Gãy cô xương đùi là nguyên nhân gây tàn tật và tử vong nghiêm trọng nhất có thể được quy do loãng xương gây nên. Trong năm đầu tiên sau khi bị gãy cổ xương đùi, tỷ lệ tử vong là 20%, 50% mất chức năng hoạt động độc lập hằng ngày và chỉ 30% lấy lại được mức độ hoạt động chức năng của bản thân như trước khi bị gãy xương. Chi phí điều trị cho gãy cổ xương đùi và biến chứng của nó được ước tính vào khoảng 14 tỷ USD vào năm 1995 và 17 tỷ USD vào năm 2001 [6].
- Gãy đốt sống thường không có triệu chứng (chỉ một phần ba các trường hợp có biểu hiện lâm sàng) và có thể do các hoạt động thường ngày gây nên. Gãy đốt sống được kết hợp với tình trạng gây tàn phế có ý nghĩa dẫn đến đau lưng mạn tính, giảm chiều cao, gù vẹo cột sống, bệnh phổi hạn chế hoặc các biến chứng đường tiêu hóa, tình trạng này đã được chứng minh làm giảm chất lượng cuộc sống của bệnh nhân. Các nghiên cứu tiến cứu dài hạn đã chỉ ra rằng, gãy xương đốt sống dù là có triệu chứng hoặc không, kết hợp với gia tăng tỷ lệ tử vong tổng thể lên từ 15 - 30% [8].
- Gãy xương do loãng xương trước đó là yếu tố nguy cơ lớn nhất cho các gãy xương trong tương lai với nguy cơ tương đối dao động từ 1,4 - 4,4 tùy thuộc vào vị trí gãy xương ban đầu [9].
| Bảng 26.2. Các nguyên nhân gây loãng xương thứ phát | |
Các rối loạn nội tiết
Các rối loạn di truyền/ hệ thống collagen
Các rối loạn dạ dày-ruột/gan
Các rối loạn huyết học
Các bệnh nhiễm trùng
| Các rối loạn chuyển hóa/ dinh dưỡng
Các rối loạn thần kinh
Các rối loạn hô hấp
Các rối loạn thận
Các rối loạn thấp/ miễn dịch
Do thuốc |
2 CHẨN ĐOÁN

2.1 Biểu hiện lâm sàng
Tất cả phụ nữ sau tuổi mãn kinh và nam giới từ 50 tuổi trở lên nên được đánh giá về nguy cơ loãng xương.
Hầu hết bệnh nhân loãng xương không có triệu chứng cho đến khi họ bị gãy xương. Do đó, điều quan trọng là phải tiến hành đánh giá đầy đủ về tiền sử của bệnh nhân và các dấu hiệu thực thể để xác định những bệnh nhân có nguy cơ cao bị loãng xương hoặc gãy xương do loãng xương, đây là các đối tượng sẽ có được lợi ích từ các thăm dò chẩn đoán thêm và điều trị. Tìm hiểu các yếu tố nguy cơ gây ra khối lượng xương thấp, gãy xương và té ngã (Bảng 26.1 đến Bảng 26.3). Khi khám thực thể, hãy tìm những dấu hiệu gợi ý gãy xương như giảm đáng kể chiều cao so với trước đó (1,5 inch hoặc 4 cm), các di chứng của gãy xương trước đó và tàn phế hoặc biến dạng góp phần vào nguy cơ gãy xương (giảm chiều cao, gù vẹo, căng cứng cột sống khu trú, biến dạng lồng ngực, gối chồng xương sườn - khung chậu, hô hấp khó khăn, bụng phình to, tư thế, thăng bằng và sức mạnh cơ bắp) hoặc các bất thường gợi ý nguyên nhân loãng xương thứ phát (nhiễm độc giáp, Cushing).
| Bảng 26.3. Các yếu tố nguy cơ khiến bệnh nhân dễ bị té ngã |
Tiền sử bị té ngã. Sa sút trí tuệ. Suy giảm thị lực. Tình trạng thể chất kém/ốm yếu. Các vấn đề về bàn chân hoặc giày dép không thích hợp. Tiền sử bị đột quỵ hoặc bệnh Parkinson. Các yếu tố nguy cơ từ môi trường. Sử dụng benzodiazepin, thuốc chống co giật hoặc thuốc kháng cholinergic. |
Đánh giá nguy cơ gãy xương: Kết hợp giữa mật độ xương và các yếu tố nguy cơ lâm sàng dự đoán gãy xương tốt hơn sử dụng đơn độc một trong hai tiêu chuẩn trên. Tổ chức Y tế Thế giới (WHO) đã phát triển bộ Công cụ đánh giá nguy cơ gãy xương (FRAX), một thuật toán để ước tính xác suất trong 10 năm đối với nguy cơ gãy cổ xương đùi hoặc gãy xương lớn do loãng xương (bao gồm cột sống, cổ xương đùi, đầu gần xương cánh tay và đầu xa xương cẳng tay) bằng cách sử dụng thông tin được thu nhận dễ dàng từ các yếu tố nguy cơ lâm sàng và mật độ khoáng chất xương (BMD) của cổ xương đùi hoặc chỉ số T (T- score), nếu có sẵn để sử dụng. Bộ công cụ FRAX có sẵn trực tuyến tại www. sheffield.ac.uk/FRAX hay www.nof.org hoặc trong phần mềm của các máy DXA thế hệ mới. Bộ công cụ này tích hợp tuổi tác, giới tính, dân tộc, vị trí địa lý, cân nặng, chiều cao, tiền sử gãy xương của cá nhân và gia đình, sử dụng thuốc lá, sử dụng glucocorticoid, chẩn đoán viêm khớp dạng thấp, sử dụng rượu, sự hiện diện của tình trạng loãng xương thứ phát (đái tháo đường typ 1, bệnh xương thủy tinh), cường giáp không được điều trị, suy sinh dục, mãn kinh sớm < 40 tuổi, suy dinh dưỡng mạn tính hoặc kém hấp thu hoặc bệnh gan mạn tính) và mật độ khoáng chát xương ở cổ xương đùi hoặc T-score để đưa ra được ước tính nguy cơ gãy xương. Nếu biết được kết quả BMD của cổ xương đùi, phần dành cho loãng xương thứ phát sẽ không còn là yếu tố được sử dụng trong thuật toán. Nên sử dụng bộ công cụ FRAX cho những bệnh nhân không có tiền sử gãy xương do loãng xương và chỉ số T lớn hơn - 2,5 nhưng nhỏ hơn -1,0 (nhược xương) để cung cấp một ước tính điểm số về nguy cơ gãy xương và có thể nhận diện được những bệnh nhân có thể là ứng viên cho điều trị. Tuy nhiên, bộ công cụ đánh giá này có thể ước tính nguy cơ thấp hơn hoặc cao hơn so với thực thế vì nó không tính đến liều lượng, thời gian hoặc mức độ nghiêm trọng của việc phơi nhiễm (ví dụ, ở người dùng glucocorticoid), các yếu tố nguy cơ đóng góp khác như té ngã, tình trạng xương dễ gãy hoặc mật độ khoáng chất xương của cột sống. FRAX còn chưa được phê chuẩn ở những bệnh nhân đã hoặc đang được điều trị và không thể sử dụng để theo dõi đáp ứng điều trị [10]. Bệnh nhân có thể được coi là “chưa được điều trị” nếu họ đã ngừng sử dụng thuốc điều trị loãng xương từ 1 đến 2 năm [6].
2.2 Tiêu chuẩn chẩn đoán
Tổ chức Y tế Thế giới (WHO) đã thiết lập các tiêu chuẩn loãng xương dựa trên BMD và chỉ số T của cột sống thắt lưng, cổ xương đùi hoặc vùng khớp háng. Chỉ số T được sử dụng cho phụ nữ tuổi tiền mãn kinh hoặc sau mãn kinh và nam giới ≥ 50 tuổi [10,11].
- Bình thường: BMD trong khoảng 1SD của giá trị tham chiếu trung bình của người lớn trẻ tuổi (T ≥ − 1,0).
- Khối lượng xương thấp (nhược xương ”): BMD từ 1 đến 2,5 SD giá trị tham chiếu trung bình của người lớn trẻ tuổi (2,5<T<–1,0).
- Loãng xương: BMD > 2,5 SD dưới giá trị tham chiếu trung bình của người trẻ tuổi (T≤−2,5).
- Loãng xương đã hình thành hoặc nặng: BMD > 2,5 SD dưới giá trị tham chiếu trung bình của người trẻ tuổi (T ≤ – 2,5) và có một hoặc nhiều lần gãy xương do loãng xương.
Một số hiệp hội chuyên ngành đã thiết lập các tiêu chuẩn để chẩn đoán loãng xương. Đồng thuận chung là khi có các gãy xương do loãng xương hoặc sau một chấn thương nhẹ (ngã từ độ cao khi đứng hoặc không có chấn thương nặng), T ≤ − 2,5 hoặc kết hợp khối lượng xương thấp (chỉ số T trong khoảng từ –1 đến –2,5) cộng thêm điểm FRAX tăng cao phù hợp với loãng xương. Tất cả bệnh nhân được chẩn đoán loãng xương nên được đánh giá tìm nguyên nhân thứ phát (Bảng 26.2 và 26.4) [6,12,13].
Ở các phụ nữ tiền mãn kinh và nam giới dưới 50 tuổi, Hiệp hội Quốc tế về Đo mật độ xương lâm sàng (International Society for Clinical Densitometry [ISCD]) khuyến nghị sử dụng chỉ số Z (Z-score) [14].
- “Trong khoảng giới hạn dự kiến cho độ tuổi: BMD trong khoảng 2,0 SD của giá trị trung bình tham chiếu (Z > – 2,0).
- “Dưới khoảng giới hạn dự kiến cho tuổi”: BMD ≥ 2,0 SD dưới giá trị trung bình tham chiếu (Z ≤ − 2,0).
| Bảng 26.4. Chẩn đoán loãng xương | |
| Tổ chức Loãng xương Quốc gia Hoa Kỳ | Gãy cổ xương đùi hoặc đốt sống do chấn thương nhẹ ở tuổi trưởng thành (≥ 50 tuổi). Cột sống thắt lưng, cổ xương đùi hoặc vùng khớp háng: BMD ≥ 2,5 SD dưới mức trung bình tham chiếu của thanh niên (Tscore ≤ - 2,5). |
| Hiệp hội bác sĩ Nội tiết lâm sàng và Liên minh Sức khỏe xương Quốc gia Hoa Kỳ | Gãy cổ xương đùi hoặc đốt sống do chấn thương nhẹ. Cột sống thắt lưng, vùng khớp háng, cổ xương đùi hoặc 33% xương quay: BMD = 2,5 SD dưới mức trung bình tham chiếu của thanh niên (Ts ≤ - 2,5). Khối lượng xương thấp (-1 < T <- 2,5) cộng với gãy xương do loãng xương của đầu gần xương cánh tay, xương chậu hoặc cẳng tay xa. Khối lượng xương thấp (-1 < T < - 2,5) cộng với FRAX cao dựa trên ngưỡng cụ thể của quốc gia đối với nguy cơ thích ứng với Hoa Kỳ, ≥ 3% xác suất gãy cổ xương đùi trong 10 năm và ≥ 20% xác suất 10 năm của bất kỳ chứng gãy xương do loãng xương. |
2.3 Chẩn đoán cận lâm sàng
2.3.1 Cận lâm sàng
Các đánh giá cận lâm sàng cho nam giới và phụ nữ sau tuổi mãn kinh không có triệu chứng bị loãng xương xác định được căn nguyên thứ phát lần lượt là 32% ở nam [15] và 75% ở nữ [16].
Các thăm dò cơ bản nên bao gồm: bộ xét nghiệm hóa sinh (canxi, phospho, creatinin), bộ xét nghiệm chức năng gan (gồm transaminase gan, phosphatase kiềm, protein toàn phần, Albumin máu), 25-OH vitamin D (25[OH]D), công thức máu, nồng độ testosteron ở nam giới [6,12].
Các xét nghiệm cần kiểm tra thêm tùy thuộc vào chỉ định lâm sàng: PTH nguyên vẹn (iPTH), nồng độ canxi và creatinin nước tiểu 24 giờ, xét nghiệm chức năng tuyến giáp, điện di protein huyết thanh hoặc nước tiểu, nồng độ cortisol nước tiểu 24 giờ, các kháng thể để đánh giá bệnh không dung nạp với gluten [6,12].
Các chỉ dấu đánh giá chu chuyển xương (BTM) là các enzym tham gia với quá trình tạo xương và hủy xương hoặc là các sản phẩm phụ của quá trình sản xuất, thoái giáng Collagen type 1. Các chỉ dấu tạo xương bao gồm phosphatase kiềm nguồn gốc xương trong huyết thanh, osteocalcin và propeptid với gốc N tận tiền collagen typ 1 (P1NP). Các chỉ dấu hủy xương bao gồm C-telopeptide (CTX) và N-telopeptide (NTX).
Các chỉ dấu đánh giá BTM không được sử dụng để chẩn đoán loãng xương. Chúng cung cấp các thông tin động về hoạt động của hệ cơ xương và có thể giúp hiểu rõ hơn cơ chế gây mất xương. Tính thay đổi cao khi tiến hành phân tích và các biến đổi sinh học gây hạn chế ứng dụng các thăm dò này trong thực hành lâm sàng. Gần đây, Tổ chức Loãng xương Quốc tế (IOF) và Nhóm Hoạt động Tiêu chuẩn hoá các chỉ dấu về xương của Liên đoàn Quốc tế về Hóa học Lâm sàng đã xác định PINP và CTX huyết thanh như là những chỉ dấu đánh giá BTM tham chiếu, các thông số này có thể hữu ích trong dự đoán nguy cơ gãy xương và trong theo dõi điều trị loãng xương [17]. Liên minh Sức khỏe Xương đã đồng ý thông qua các bước tiêu chuẩn hóa việc thu thập và xử lý mẫu cũng như chuẩn bị bệnh nhân để làm giảm tính biến thiên, bao gồm việc thu thập mẫu C-telopeptide (CTX) vào buổi sáng lúc đói [18].
| Bảng 26.5. Hướng dẫn sàng lọc mật độ khoáng chất của xương (BMD) được đề xuất đối với loãng xương | ||
| Nhóm | Các khuyến cáo cho phụ nữ | Các khuyến cáo cho nam giới |
| Tổ chức Loãng xương Quốc gia Hoa Kỳ, Hiệp hội Quốc tế về Đo mật độ xương lâm sàng | Tất cả phụ nữ ≥ 65 tuổi. Các phụ nữ trẻ hơn quanh hoặc sau tuổi mãn kinh bị gãy xương do xương dễ gãy sau tuổi 50 hoặc có các yếu tố nguy cơ lâm sàng về gãy xương hoặc khối lượng xương thấp. Người lớn ở bất kỳ tuổi nào có tình trạng nguy cơ cao hoặc dùng thuốc kết hợp với mất xương.
| Tất cả nam giới ≥ 70 tuổi. Nam giới 50 - 69 tuổi bị gãy xương do xương dễ gãy sau tuổi 50 hoặc có các yếu tố nguy cơ lâm sàng về gãy xương hoặc khối lượng xương thấp. Bất kỳ lứa tuổi nào có tình trạng nguy cơ cao hoặc dùng thuốc gây nên tình trạng mất xương. |
| Hiệp hội bác sĩ Nội tiết lâm sàng Hoa Kỳ | Tất cả phụ nữ ≥ 65 tuổi. Tất cả phụ nữ sau mãn kinh bị gãy xương dễ gãy, loãng xương trên phim chụp Xquang hoặc dùng glucocorticoid toàn thân trong 3 tháng. Phụ nữ tiền mãn kinh hoặc sau mãn kinh có các yếu tố nguy cơ loãng xương (cân nặng < 127 lbs [57,6 kg] hoặc BMI < 20, tiền sử gia đình bị gãy xương do loãng xương, mãn kinh sớm < 40 tuổi, hút thuốc hoặc uống quá nhiều rượu. Loãng xương thứ phát. | Không |
| Hội Nội tiết Hoa Kỳ | Không | Tất cả nam giới ≥ 70 tuổi. Người 50 - 69 tuổi bị gãy xương do xương dễ gãy sau tuổi 50 hoặc có các yếu tố nguy cơ cộng thêm gây gãy xương hoặc khối lượng xương thấp hoặc bị loãng xương thứ phát. |
| Nhóm Đặc nhiệm về Dịch vụ phòng bệnh của Hoa Kỳ. | Tất cả phụ nữ ≥ 65 tuổi. Phụ nữ trẻ nếu nguy cơ gãy xương bằng hoặc lớn hơn yếu tố nguy cơ của tuổi 65. | Không |
2.3.2 Hình ảnh học
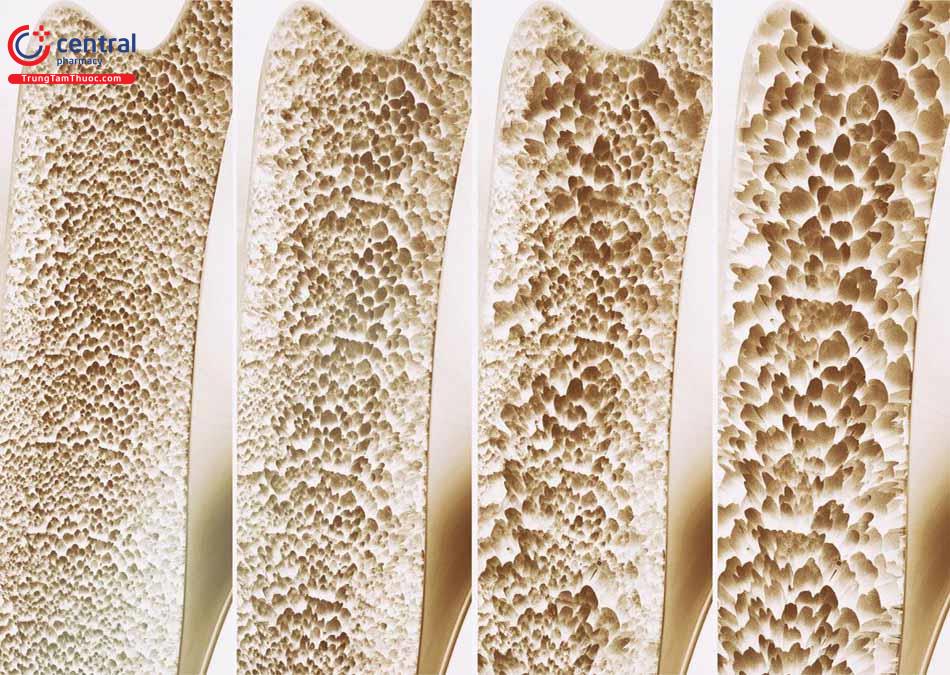
Thăm dò mật độ khoáng chất của xương (BMD) là tiêu chuẩn để chẩn đoán và đánh giá loãng xương ở người lớn. Một số thăm dò Xquang hiện có sẵn để sử dụng giúp đo BMD bao gồm DXA (đo hấp thụ tia X năng lượng kép) trung ương và ngoại biên, chụp CT định lượng (QCT) trung tâm và ngoại biên và siêu âm định lượng (QUS).
- Mật độ khoáng chất xương (BMD) tương quan với sức mạnh của xương, nguy cơ bị gãy xương tăng khoảng gấp đôi cho mỗi mức giảm 1 SD của chỉ số T. BMD thấp tại một vị trí kết hợp với gia tăng nguy cơ gãy xương ở tất cả các vị trí. Tuy nhiên, yếu tố dự báo gãy xương tốt nhất tại một vị trí cụ thể là mật độ xương tại vị trí đó. BMD quan trọng nhất là tại vị trí khớp háng khi mà cho mỗi mức giảm 1SD đối với BMD của vùng khớp háng, nguy cơ gãy cổ xương đùi tăng gấp 2,6 lần, gãy đốt sống tăng gấp 1,8 lần, gãy xương cổ tay tăng gấp 1,4 lần và nguy cơ gãy xương nói chung tăng gấp 1,5 lần. Nguy cơ bị gãy cổ xương đùi sau đó kết hợp với BMD giảm ở các vị trí khác có phần thấp hơn [19,20].
Sử dụng DXA để đo BMD vùng là phương pháp chuẩn hiện nay để đánh giá mật độ xương. Thông số này được sử dụng để phân loại chẩn đoán, đánh giá nguy cơ gãy xương và theo dõi các thay đổi BMD theo thời gian. Phương pháp này có mức phơi nhiễm bức xạ thấp (khoảng 1/10 so với tia X truyền thống), có độ chính xác và khả năng lập lại kết quả tốt [14].
- Nên đo BMD của cột sống thắt lưng và đầu gần xương đùi. Có thể sử dụng việc đo BMD ở đầu xa xương quay của tay không thuận (33%) đối với các bệnh nhân bị béo phì bệnh lý, cường cận giáp hoặc nếu không thể đo hoặc phiên giải kết quả BMD của khớp háng hoặc cột sống. BMD phản ánh hàm lượng khoáng chất của
- Ở xương chia cho diện tích xương đo được (g/cm). Ở cột sống thắt lưng, việc đo đạc được thực hiện tại các đốt sống L1, L2, L3 và L4, các dữ liệu về BMD đối với toàn bộ cột sống L1- L4 và chuyên biệt cho từng đốt sống được cung cấp. BMD ở cổ xương đùi có thành phần xương đặc và xương xốp gần như bằng nhau, đây là một yếu tố dự báo tuyệt vời cho nguy cơ gãy xương và được sử dụng trong bộ công cụ đánh giá FRAX, trong khi BMD vùng khớp háng được sử dụng để theo dõi các thay đổi trong mật độ khoáng chất xương [14].
- Các kết quả BMD được báo cáo so sánh với khoảng tham chiếu và được bình thường hóa theo độ lệch chuẩn của quần thể tham chiếu. Chỉ số T sử dụng giá trị BMD đỉnh trung bình của các phụ nữ da trắng trẻ tuổi khỏe mạnh như giá trị tham chiếu, trong khi điểm Z sử dụng BMD trung bình của nhóm tham chiếu tương ứng về tuổi, giới tính và chủng tộc. Đánh giá chỉ số T (và điểm Z) là một kỹ thuật chuyên biệt và kết quả thu được từ các phương pháp đánh giá mật độ xương khác nhau nên không thể so sánh được. Các đo đạc DXA nên được thực hiện trên các máy móc được bào trì và hiệu chỉnh thích hợp bởi kỹ thuật viên được đào tạo bài bản [14].
- Một số Hiệp hội Quốc tế đã ban hành hướng dẫn để sàng lọc loãng xương bằng cách sử dụng DXA (Bảng 26.5). Nói chung, những phụ nữ bị gãy xương do loãng xương nên được kiểm tra. Hầu hết các hướng dẫn tại Hoa Kỳ ủng hộ việc kiểm tra mật độ xương cho tất cả phụ nữ trên 65 tuổi, một số hướng dẫn ủng hộ việc kiểm tra cho tất cả nam giới trên 70 tuổi, bất kể có hay không yếu tố nguy cơ. Ở người trưởng thành trẻ tuổi, thăm dò sàng lọc thường được khuyến cáo khi có tình trạng gãy xương trước đó hoặc có các yếu tố nguy cơ gây loãng xương. Mặc dù phần lớn dữ liệu về chẩn đoán và điều trị loãng xương là cho các phụ nữ da trắng nhưng các khuyến cáo về sàng lọc đối với loãng xương không phân biệt chủng tộc [6,12,14,21].
Chụp CT định lượng (QCT) và chụp CT định lượng ngoại biên (pQCT]) đo BMD trên đơn vị thể tích (đơn vị tính là g/cm3) ở các vị trí trục trung tâm (khớp háng và cột sống) và ngoại biên (xương quay và xương chày). Ngoài ra, chụp QCT có thể khảo sát tách biệt hàm lượng xương của các khu vực xương xốp, xương đặc và các khoang dưới vỏ xương. Chụp pQCT độ phân giải cao cung cấp chi tiết hình ảnh kiến trúc vi thể của xương trên in vivo, chẳng hạn như độ xốp của xương đặc và cấu trúc xương xốp [22]. Ở phụ nữ sau tuổi mãn kinh, đo BMD xương đùi bằng QCT có thể dự đoán nguy cơ gãy cơ gãy cổ xương và theo dõi điều trị cũng như các thay đổi liên quan với điều trị. Tuy nhiên, giá thành của QCT đắt hơn, có liều bức xạ lớn hơn và đối với chụp CT định lượng ngoại biên độ phân giải cao (HRpQCT), không phải lúc nào cũng có sẵn để sử dụng trên thực hành lâm sàng. Do đó, DXA vẫn là phương pháp sàng lọc được ưu tiên áp dụng [23].
Điểm của xương xốp (Trabecular bone score [TBS]) là một điểm số không phải là BMD có nguồn gốc từ hình ảnh DXA của cột sống thắt lưng thu được từ một số máy đo mật độ xương. Chỉ số này liên quan với gãy xương đốt sống, khớp háng và gãy các xương lớn do loãng xương ở phụ nữ sau tuổi mãn kinh, gãy cổ xương đùi và các gãy xương lớn ở nam giới trên 50 tuổi. Nguy cơ gãy xương độc lập một phần với BMD khi được đo bằng DXA và các nguy cơ lâm sàng. TBS được FDA và Tổ chức Y tế châu u phê duyệt như một chỉ số bổ sung cho DXA và FRAX, không nên sử dụng đơn độc thông số này để hướng dẫn các quyết định điều trị [24].
Kiểm tra mật độ xương ngoại biên (các xương chi ngoại trừ đầu xương đùi) có thể được thực hiện bằng DXA, QCT hoặc siêu âm định lượng (QUS). Các vị trí được đo đạc bao gồm cẳng tay, ngón tay và gót chân. Lợi ích của các kỹ thuật đo mật độ xương ngoại biên là máy có thể di chuyển dễ dàng và có thể thực hiện kỹ thuật tại phòng khám sức khỏe ban đầu nếu sử dụng QUS. Mặc dù những phương thức thăm dò này đã chứng minh là có thể dự đoán được nguy cơ gãy xương nhưng không có tiêu chuẩn chẩn đoán chung được chấp nhận cho rất nhiều loại máy hiện có bán trên thị trường. Kiểm tra mật độ xương ngoại biên không được khuyến cáo để chẩn đoán loãng xương. Nếu thấy kết quả bất thường phải kiểm tra lại bằng một kết quả đo DXA trung tâm để xác nhận kết quả và khẳng định chẩn đoán [14,21,23].
Chụp Xquang thường quy (phim thẳng thường) là một phương pháp không đáng tin cậy để đánh giá khối lượng xương, vì phải mất tới 30% khối lượng xương mới thấy có những thay đổi rõ ràng trên Xquang. Nếu hình ảnh Xquang gợi ý có tình trạng nhược xương nên tiến hành đo mật độ xương để khẳng định khối lượng xương thấp [25].
Thăm dò hình ảnh học cột sống bằng cách sử dụng phim chụp Xquang thường quy hoặc bằng quy trình đánh giá nguy cơ gãy đốt sống (vertebral fracture assessment (VFA)) từ DXA sẽ cung cấp các đánh giá chính xác cho tình trạng gãy đốt sống hoàn toàn có thể không có triệu chứng. Nghiên cứu hình ảnh học cột sống nên được xem xét ở những đối tượng sau đây: Phụ nữ ≥ 70 tuổi và nam giới 2 80 tuổi nếu BMD chỉ số T-score ≤ – 1,0 tại cột sống thắt lưng, vùng khớp háng và cổ xương đùi; phụ nữ từ 65 - 69 tuổi và nam từ 70 - 79 tuổi nếu BMD T-score ≤ – 1,5 ở cột sống thắt lưng, vùng khớp háng, cổ xương đùi; Phụ nữ sau tuổi mãn kinh và nam giới ≥ 50 tuổi bị gãy xương sau chấn thương nhẹ sau tuổi 50, giảm chiều cao 1,5 in (4 cm) so với chiều cao trước đó, giảm chiều cao kỳ vọng 0,8 in (2 cm) hoặc sử dụng glucocorticoid dài hạn gần đây (6,12,14].
3 ĐIỀU TRỊ

Mục tiêu của can thiệp là ngăn ngừa gãy xương. Các quyết định điều trị nên được cá thể hóa trên cơ sở xem xét các bệnh lý đồng mắc của bệnh nhân, các yếu tố nguy cơ lâm sàng và ưu tiên lựa chọn của bệnh nhân. Quyết định tiến hành điều trị trong một trường hợp cụ thể phải được thực hiện với sự hợp tác của bệnh nhân.
Các khuyến cáo về lối sống và can thiệp không dùng thuốc (xem phần
Thay đổi lối sống/nguy cơ), bổ sung thêm điều trị bằng thuốc nên được khuyến cáo cho tất cả các đối tượng người lớn, kể cả những người không đạt tiêu chuẩn để chỉ định điều trị thuốc chống loãng xương đặc hiệu.
3.1 Các thuốc điều trị
Các chỉ định điều trị bằng thuốc (6,12]: Các điều trị được FDA chấp thuận nên được cân nhắc ở phụ nữ sau tuổi mãn kinh hoặc nam giới từ 50 tuổi trở lên khi có:
Gãy cổ xương đùi hoặc gãy đốt sống sau chấn thương nhẹ.
Chỉ số T-score khi kiểm tra DXA ≤ − 2,5 (loãng xương) ở cột sống thắt lưng, vùng khớp háng hoặc cổ xương đùi.
Chỉ số T-score khi kiểm tra bằng DXA từ -1,0 đến - 2,5 (khối lượng xương thấp) với FRAX đánh giá nguy cơ 10 năm đối với gãy cổ xương đùi > 3% hoặc gãy xương nặng do loãng xương > 20% ở Hoa Kỳ hoặc dựa trên ngưỡng cụ thể của từng quốc gia.
3.1.1 Thuốc được chọn bước một
Để biết thông tin về các loại thuốc điều trị loãng xương được FDA Hoa Kỳ chấp thuận, xem Bảng 26.6 và Bảng 27.7.
- Các aminobisphosphonat bao gồm alendronat, risedronat, ibandronat và Acid zoledronic là nhóm thuốc được sử dụng rộng rãi nhất để điều trị loãng xương. Các thuốc này hiện tại có bán trên thị trường dưới dạng generic. Cấu trúc hóa học của bisphosphonat giống pyrophosphat, nó liên kết với tinh thể hydroxyapatit tại các vị trí có hoạt động tái cấu trúc xương tích cực, do đó thuốc ức chế mạnh quá trình tiêu xương qua trung gian hủy cốt bào. Điều này giúp cải thiện mật độ xương sau 3 năm, giảm tỷ lệ gãy cổ xương đùi và gãy đốt sống (ngoại trừ ibandronat chỉ được chứng minh là làm giảm gãy xương đốt sống) [26-34].
- Bisphosphonat dùng đường uống bao gồm alendronat, risedronat và ibandronat. Alendronat có bán trên thị trường với vitamin D bổ sung và risedronat có trên thị trường với canxi bổ sung. Bisphosphonat dùng đường uống được hấp thu kém nên uống vào buổi sáng sớm với một cốc nước sau khi nhịn ăn qua đêm, sau đó không được nằm, ăn hoặc uống thuốc khác trong ít nhất 30 phút. Atelvia dạng phóng thích chậm phải uống sau ăn sáng nhưng vẫn yêu cầu không được nằm trong vòng 30 phút sau uống thuốc. Trong các thử nghiệm ngẫu nhiên có đối chứng với giả dược, không thấy khác biệt có ý nghĩa về tác dụng phụ trên Đường tiêu hóa giữa điều trị và giả dược, các phác đồ điều trị dùng liều 1 tháng/lần và gần đây hơn là 1 tuần/lần đã cải thiện sự tuân thủ điều trị của bệnh nhân. Tuy nhiên, trong thực hành lâm sàng, khoảng 10% bệnh nhân có tác dụng phụ trên đường tiêu hóa và biểu hiện viêm thực quản ăn mòn nặng liên quan đến “trào ngược” của thuốc. Đây là một biến chứng hiếm gặp nhưng nghiêm trọng.
- Bisphosphonat dùng đường tĩnh mạch, bao gồm ibandronat và acid zoledronic được ưu tiên sử dụng cho các bệnh nhân bị kém hấp thu, không dung nạp với thuốc uống hoặc không thể nhớ để sử dụng bisphosphonat theo đường uống. Các phản ứng “giả cúm” giai đoạn cấp trong khi truyền thuốc đã được quan sát và có thể làm giảm bớt bằng cách điều trị trước với Paracetamol [35]. Suy thận đã được báo cáo gặp khi dùng thuốc theo đường tĩnh mạch, vì vậy cần kiểm tra nồng độ creatinin máu trước mỗi lần truyền thuốc [36]. Rung nhĩ đã được báo cáo trong một thử nghiệm sử dụng acid zoledronic nhưng chưa được khẳng định trong các thử nghiệm khác với cùng loại thuốc hoặc với một bisphosphonat khác [27].
- Các chống chỉ định sử dụng bisphosphonat đường uống hoặc đường tĩnh mạch bao gồm tình trạng tăng mẫn cảm, hạ canxi máu và suy thận (mức lọc cầu thận [GFR] < 30 mL/phút đối với risedronat và ibandronat hoặc <35 mL/phút đối với alendronat và acid zoledronic).
- Hoại tử xương hàm (ONJ) là một biến chứng hiếm gặp khi sử dụng thuốc chống tiêu xương, xảy ra ở 1/10.000 - 1/100.000 bệnh nhân. Tình trạng hoại tử này có đặc điểm là không lành sẹo, xương hoại tử bị lộ ra ở vùng răng hàm mặt, được nhân viên chăm sóc y tế phát hiện trong thời gian 8 tuần ở bệnh nhân dùng thuốc ức chế hủy xương (bisphophonat hoặc denosumab) và không có tiền sử được tia xạ ở vùng hàm mặt. Các yếu tố nguy cơ bao gồm dùng các liều tích lũy cao thuốc chống hủy xương đường tiêm thường gặp trong điều trị ung thư (ít phổ biến hơn nhiều trong bệnh loãng xương), phẫu thuật xâm lấn vùng miệng, nhiễm trùng và vệ sinh răng miệng kém. Ở những đối tượng có nguy cơ cao, cần cân nhắc việc trì hoãn hoặc ngừng điều trị bằng thuốc ức chế hủy xương đến sau khi tiến hành phẫu thuật vùng miệng và đến khi niêm mạc lành hoàn toàn hoặc tránh phẫu thuật vùng miệng, nếu có thể, khi đang điều trị bằng các thuốc này. Do có nguy cơ thấp hơn nhiều ở những bệnh nhân loãng xương, Hiệp hội Nha khoa Hoa Kỳ ghi nhận là không cần thiết phải ngừng uống bisphosphonat trước khi làm các thủ thuật nha khoa. Điều trị bằng cách xúc rửa miệng với nước kháng sinh tại chỗ, kháng sinh toàn thân và phẫu thuật cắt lọc mô hoại tử trong một số trường hợp hãn hữu [37].
- Gãy xương đùi không điển hình (AFF) đã được báo cáo xảy ra khi điều trị bằng thuốc ức chế hủy xương (bisphosphonat và denosumab) và cũng được gặp ở những người không dùng thuốc trước đó. Đây là những gãy xương không do chấn thương nằm dọc thân xương đùi (giữa mấu chuyển bé và mỏm trên lồi cầu), được đặc trưng bởi nguồn gốc vỏ xương phía bên, hướng ngang hoặc hơi xiên, với bản chất gãy nhẹ, không bị tách rời và có dày màng xương bên ngoài hoặc màng xương bên trong khu trú tại vị trí gãy. Các đặc điểm đáng chú ý khác là dày ở thân xương đùi, các triệu chứng báo trước (đau ở vùng háng hoặc đùi), ở cả hai bên và chậm lành gãy xương. Cơ chế bệnh sinh vẫn chưa được biết rõ, có thể có liên quan đến biến đổi chất lượng xương và tình trạng ức chế kéo dài quá trình chu chuyển xương. Mặc dù có nguy cơ tương đối khá cao khi sử dụng bisphosphonat (OR 2,1 - 66), nguy cơ tuyệt đối vẫn rất thấp. Một số nghiên cứu dịch tễ gợi ý là nguy cơ sẽ cao hơn khi dùng thuốc lâu hơn, trong đó tần suất mắc được điều chỉnh theo tuổi tăng từ 1,8/100.000 trường hợp mỗi năm với thời gian dùng thuốc là 2 năm lên 113/100.000 trường hợp mỗi năm sau 8 đến 9 năm dùng thuốc. Ngược lại, gãy xương do loãng xương phổ biến hơn nhiều và lợi ích của việc làm giảm tần suất bị gãy xương sau 5 năm sử dụng bisphosphonat lớn hơn nguy cơ tiềm ẩn của gãy xương đùi không điển hình. Ước tính cho thấy là điều trị bisphosphonat trong 5 năm đã ngăn ngừa được 2,590/100.000 ca gãy xương (cột sống, cổ xương đùi hoặc cẳng tay) so với 16/100.000 gãy xương đùi không điển hình liên quan đến điều trị, nó tương ứng với việc ngăn ngừa được 162 ca gãy xương so với mỗi ca gãy xương đùi không điển hình có nguy cơ bị gây ra. Nếu xảy ra gãy xương đùi không điển hình nên ngừng sử dụng thuốc ức chế hủy xương và xem xét đổi thuốc khác [38,39].
- Các chất điều biến thụ thể estrogen chọn lọc (SERM) thể hiện tác dụng đối kháng hoặc chủ vận có chọn lọc trên các mô đích khác nhau, vì vậy có ưu điểm là giữ lại các tác dụng có lợi và giảm thiểu tác dụng phụ của estrogen.
- Raloxifene (Evista) có các tác dụng của estrogen, kháng estrogen và tác dụng trung tính lên xương, vú và nội mạc tử cung. Thuốc được FDA chấp thuận để chống loãng xương và làm giảm nguy cơ ung thư vú. Điều trị trong 3 năm đã được chứng minh là thuốc làm cải thiện BMD (cột sống và khớp háng) và giảm tỷ lệ bị gãy mới đốt sống song không làm giảm được gãy đầu trên xương đùi hoặc các gãy xương ngoài đốt sống [40]. Điều trị trong 5 năm ở phụ nữ mãn kinh bị bệnh mạch vành hoặc có các yếu tố nguy cơ của bệnh mạch vành không làm tăng nguy cơ bị các biến cố mạch vành nguyên phát nhưng làm tăng nguy cơ thuyên tắc mạch do huyết khối từ tĩnh mạch và đột quỵ gây tử vong (cả hai biến cố này đều được đưa vào cảnh báo hộp đen), mặc dù tổng tỷ lệ tử vong do tất cả các nguyên nhân tương tự với giả dược [41]. Các tác dụng phụ được báo cáo là nóng bừng, chuột rút chân và phù ngoại biên [40,41]. Có thể xem xét sử dụng raloxifene cho phụ nữ sau mãn kinh có BMD thấp ưu thế ở cột sống song BMD của khớp háng còn bảo tồn và nguy cơ cao bị ung thư vú, khi các đối tượng này không thể dung nạp được với bisphosphonat. Nên ngừng dùng Raloxifene ít nhất 72 giờ trước khi phẫu thuật ở những bệnh nhân có nguy cơ thuyên tắc huyết khối tĩnh mạch.
- Bazedoxifene/estrogen liên hợp (Duavee) là một phức chất estrogen chọn lọc mô (tissue-selective estrogen complex [TSEC]), chất này tham gia vào ghép cặp của SERM với estrogen. Thuốc có hoạt tính estrogen trên xương, hoạt động kháng estrogen trên vú và tử cung, đã được FDA chấp thuận để ngăn ngừa loãng xương sau mãn kinh và điều trị các triệu chứng rối loạn vận mạch thời kỳ mãn kinh. Các thử nghiệm giai đoạn 3 cho thấy BMD tăng ở cột sống thắt lưng và hông, giảm các chỉ dấu đánh giá chu chuyển xương (BTM) và cải thiện các triệu chứng vận mạch. Tỷ lệ tăng sản nội mạc tử cung thấp khi so sánh với liệu pháp thay thế hormon (HRT), mật độ vú khi chụp vú và tình trạng căng đau vú ít gặp hơn. Các tác dụng phụ được báo cáo bao gồm co thắt cơ, tiêu chảy, buồn nôn và chóng mặt [42,43]. Do thuốc chứa estrogen, sử dụng Duavee cần tuân thủ tất cả các thận trọng và cảnh báo hộp đen tương tự như estrogen. Tuy nhiên, hiện không có các dữ liệu về gãy xương liên quan với sử dụng Duavee, bazedoxifene (Conbriza) là thuốc được chấp thuận ở châu u để điều trị loãng xương sau mãn kinh đã cho thấy làm giảm có ý nghĩa ( 42%) tình trạng gãy xương đốt sống ở các phụ nữ sau mãn kinh bị loãng xương [44].
- Teriparatid (Forteo) là một peptid PTH tái tổ hợp của người với 34-aminoacid với nhóm tận N có tác dụng kích thích sự hình thành xương. Một điều nghịch lý là, tiếp xúc kéo dài với cường cận giáp nguyên phát làm tăng quá trình hủy xương, song tiếp xúc gián đoạn với PTH lại kích thích sự hình thành xương. Thuốc được dùng dưới dạng tiêm dưới da hằng ngày với liều 20 pg [45].
- Điều trị trong thời gian 18 tháng ở phụ nữ sau mãn kinh dễ có nguy cơ gãy đốt sống làm tăng BMD (cột sống và háng), giảm gãy đốt sống và gãy xương không phải đốt sống. Tuy nhiên, nghiên cứu không đủ mạnh để điều tra về khả năng làm giảm gãy cổ xương đùi [46]. Sử dụng teriparatide thường được dành cho những bệnh nhân bị loãng xương nặng và những người không thể dung nạp hoặc không đáp ứng với bisphosphonat.
- Các tác dụng phụ được báo cáo là buồn nôn, đau đầu, chóng mặt, chuột rút ở chân và tăng nồng độ canxi máu thoáng qua [46]. Liều rất cao ở chuột gây tăng tỷ lệ bị sarcom xương, song điều này chưa được thấy trong các thử nghiệm ở người. Do đó, teriparatid có cảnh báo hộp đen về nguy cơ gây sarcom xương và bị chống chỉ định ở những bệnh nhân có tăng canxi máu từ trước, bệnh xương di căn hoặc ở đối tượng tăng nguy cơ bị sarcom xương (bệnh Paget, tiền sử tia xạ xương, vết thương hở đầu xương hoặc tăng phosphatase kiềm không rõ nguyên nhân). Không khuyến cáo điều trị thuốc quá 2 năm [45].
- Tỷ trọng khoáng chất xương (BMD) ở khớp háng và cột sống giảm xuống sau khi ngừng dùng teriparatid 6 tháng, tuy nhiên giảm nguy cơ gãy xương đốt sống và ngoài đốt sống vẫn tiếp tục tồn tại trong 18 tháng (đối với nguy cơ gãy đốt sống) và 30 tháng (đối với nguy cơ ngoài đốt sống). Sử dụng bisphosphonat sau khi dùng teriparatid giúp duy trì hoặc làm tăng thêm BMD thu được nhờ điều trị bằng teriparatid (47,48]. Như vậy, các thuốc ức chế hủy xương, thường là bisphosphonat được bắt đầu tiếp sau teriparatide để duy trì BMD.
- Denosumab (Prolia) là một kháng thể đơn dòng của người chống lại chất hoạt hóa thụ thể của yếu tố hạt nhân phối tử kappa B (receptor activator of nuclear factor kappa B ligand [RANKL]), chất này được tạo cốt bào giải phóng để kích thích sự biệt hóa, hoạt động và sống sót của các hủy cốt bào, do đó ức chế quá trình hủy xương qua trung gian hủy cốt bào. Giống như các bisphosphonat, denosumab cũng ức chế quá trình hình thành xương qua trung gian tạo cốt bào do cả hai quá trình tạo xương và hủy xương kết hợp chặt chẽ với nhau. Denosumab được phê chuẩn để điều trị cho phụ nữ sau mãn kinh, nam giới bị loãng xương có nguy cơ gãy xương cao và ở những bệnh nhân có nguy cơ cao đang được điều trị bằng liệu pháp triệt bỏ androgen đối với ung thư tuyến tiền liệt hoặc chất ức chế aromatase đối với ung thư vú. Denosumab được dùng bằng cách tiêm dưới da 60 mg 6 tháng/lần [49].
- Ở phụ nữ sau mãn kinh bị loãng xương (23% bị gãy đốt sống trước đó và điểm T-score trung bình tại cột sống là –2,8), 3 năm dùng denosumab đã cải thiện BMD (cột sống và vùng khớp háng), ức chế các chỉ dấu đánh giá chu chuyển xương (BTMs), làm giảm nguy cơ gãy đốt sống, gãy cổ xương đùi và các gãy xương ngoài đốt sống. Giảm nguy cơ gãy xương cũng tương tự như khi dùng acid zoledronic và teriparatid [48]. Kéo dài nghiên cứu trong 10 năm cho thấy duy trì được tình trạng giảm nguy cơ gãy xương, ức chế BTMs dai dẳng và tiếp tục duy trì BMD khớp háng, cột sống [50].
- Cũng như các thuốc chống hủy xương khác, hạ canxi máu và quá mẫn là các chống chỉ định với thuốc. Các tác dụng phụ được báo cáo bao gồm nhiễm trùng da, chàm và viêm tụy [49]. Không cần điều chỉnh liều khi suy thận. Tuy nhiên, tần suất bị hạ canxi máu đòi hỏi phải bổ sung vitamin D và canxi cao hơn. Điều trị 10 năm thường được dung nạp tốt và tỷ lệ tác dụng phụ vẫn ổn định theo thời gian. Tuy nhiên, 2 trường hợp gãy xương đùi không điển hình (AFF) (vào năm thứ 3, 7) và 13 trường hợp hoại tử xương hàm (ONJ) đã được báo cáo (11 trường hợp thuyên giảm trong khi 2 trường hợp phải ngừng nghiên cứu và kết cục không được báo cáo) [50]. Tần suất bị gãy xương đùi không điển hình (AFF) và hoại tử xương hàm (ONJ) được cho là có liên quan đến liều và thời gian điều trị. Thời gian sử dụng denosumab tối ưu chưa được biết. Một số trường hợp bị gãy đốt sống tự phát xảy ra từ 9 đến 16 tháng sau khi ngừng dùng denosumabsong không được sử dụng các điều trị khác đã được báo cáo [51]. Khi denosumab được ngừng lại sau 2 năm sử dụng, BTMs tăng đến giá trị trên mức cơ sở và tình trạng mất xương nhanh được thấy, trong khi mật độ xương đạt được ở cột sống và khớp háng qua 2 năm điều trị bị mất đi sau 12 tháng [52]. Vì vậy, không khuyến cáo có các thời gian nghỉ thuốc hoặc có khoảng thời gian dài hơn 6 tháng giữa các liều denosumab nên xem xét sử dụng các thuốc thay thế nếu ngừng denosumab.
| Bảng 26.6. Các thuốc hiện có trên thị trường để sử dụng và liều dùng đối với loãng xương | ||||
| Thuốc | FDA chấpthuận để dự phòng | Liều để dự phòng | FDA chấp thuận để điều trị | Liều điều trị |
| Alendronate (Fosamax) | Có | 5 mg/ngày đường uống 35 mg/tuần đường uống | Có (Nữ/ nam/nữ mãn kinh) | 10 mg/ngày đường uống 70 mg/tuần đường uống |
Risedronate (Actonel, Atelvia) | Có | 5 mg/ngày đường uống 35 mg/tuần đường uống 75 mg đường uống x 2 ngày liên tiếp hằng tháng 150 mg đường uống x 1 lần/tháng | Có( Nữ/ nam/ nữ mãn kinh) | 5 mg/ngày đường uống 35 mg/tuần đường uống 75 mg đường uống trong 2 ngày liên tiếp mỗi tháng /lần 150 mg đường uống hằng tháng |
| Ibandronate (Boniva) | Có | 150 mg/tháng đường uống hằng tháng | Có (Nữ) | 150 mg đường uống x 1 lần/tháng 4 mg TM mỗi 3 tháng/lần |
| Zoledronate (Reclast) | Có | 5 mg TM mỗi 2 năm/lần | Có (Nữ/ nam/nữ mãn kinh) | 5 mg TM mỗi năm/lần |
| Raloxifene (Evista) | Có | 60 mg/ngày đường uống | Có (Nữ) | 60 mg/ngày đường uống |
| Bazedoxifen/ estrogen liên hợp (Duavee) | Có | 20 mg/0,45 mg đường uống mỗi ngày | Không | Không áp dụng |
| Estrogen +/- progesteron; multiple combination available | Có | Có thể thay đổi, thông thường 0,625 mg đường uống mỗi ngày estrogen liên hợp. | Không | Không áp dụng |
| Calcitonin (Miacanxin) | Không | Không áp dụng | Có ( Nữ) | 200 IU/ngày qua niêm mạc mũi |
| Teriparatide (Forteo) | Không | Không áp dụng | Có (Nữ/ nam/nữ mãn kinh) | 20 kg/ngày tiêm dưới da |
| Denosumab (Prolia) | Không | Không áp dụng | Có (Nữ/ nam) | 60 mg tiêm dưới da mỗi 6 tháng/lần |
| Abaloparatide (Tymlos) | Không | Không áp dụng | Có (Nữ) | 80 ug/ngày tiêm dưới da |
| Bảng 26.7. Các thuốc hiện có trên thị trường điều trị loãng xương: tác động của thuốc lên mật độ khoáng chất xương (BMD) và gãy xương | |||||
| Thuốc | Tăng BMD của cột sống | Tăng BMD của khớp háng | Giảm tỷ lệ gây đốt sống | Giảm tỷ lệ gãy cổ xương đùi | Giảm tỷ lệ gãy xương không phải đốt sống |
| Alendronate (Fosamax) | 6-13% | 4-7% | 40-55% | 50-55% | 20-47% |
| Risedronate (Actonel, Atelvia) | 5-11% | 2-5% | 40-60% | 40-60% | 20-40% |
| Ibandronate (Boniva) | 3-5% | 2-5% | 50-60% | Nghiên cứu không đủ mạnh | Nghiên cứu không đủ mạnh |
| Zoledronate (Zometa, Reclast) | 4-7% | 3-6% | 70% | 41% | 25% |
| Raloxifene (Evista) | 3% | 2% | 30-50% | Không có ý nghĩa | Không có ý nghĩa |
| Bazedoxifene/ conjugated doxifene estrogen (Duavee) | 1,5% | 1,2% | 42% (baze-đơn độc) | Không có ý nghĩa | Không có ý nghĩa |
| Teriparatide (Forteo) | 8-14% | 3-5% | 65-70% | 53% | Nghiên cứu chưa đủ mạnh |
| Denosumab (Prolia) | 9% | 6% | 68% | 40% | 20% |
| Abaloparatide (Tymlos) | 9% | 4% | 86% | Không có báo cáo gãy xương hông | 46% |
| Estrogen/điều trị thay thế hormon * | 4-7% | 2-4% | 35% | 33% | 23% |
| Calcitonin (Miacanxin) | 1-2% | Không thay đổi | 33% | Không có ý nghĩa | Không có ý nghĩa |
| Strontium ranelate | 14% | 8% | 40% | 36% | Chưa nghiên cứu |
| *Dữ liệu về liệu pháp thay thế estrogen/hormon là từ các nghiên cứu ở phụ nữ sau mãn kinh, không phải ở phụ nữ bị loãng xương đã biết. | |||||
Abaloparatide (Tymlos) là loại thuốc gần đây nhất được FDA chấp thuận để điều trị loãng xương sau mãn kinh. Thuốc là một chất tương đồng với 34 – aminoacid và gốc N mới của PTHrP có tác dụng hoạt hóa thụ thể PTH typ 1, đã được chứng minh là có hoạt tính đồng hóa xương mạnh và làm giảm tiêu xương [53]. Thuốc được sử dụng bằng bút tiêm 80 μg tiêm dưới da hằng ngày.
- Ở phụ nữ sau tuổi mãn kinh bị loãng xương (24% trong số đó đã từng bị gãy đốt sống từ trước) so sánh abaloparatid, giả dược và teriparatid, dùng abaloparatid 18 tháng cải thiện BMD của cột sống, cổ xương đùi, vùng khớp háng, tăng các chỉ dấu của cả quá trình tạo xương và tiêu xương, giảm nguy cơ gãy xương đốt sống, xương ngoài đốt sống và các gãy xương do loãng xương nặng có biểu hiện lâm sàng. Cải thiện BMD của vùng háng được thấy là lớn hơn và gia tăng BTMs được thấy ít hơn khi so sánh với nhóm điều trị bằng teriparatid. Các tác dụng phụ được báo cáo là buồn nôn, chóng mặt, đau đầu và đánh trống ngực. Khi so sánh với teriparatid, tần suất tăng nồng độ canxi máu thấp hơn, điều này có thể được giải thích là do có tăng ít hơn các chỉ dấu của tình trạng tiêu xương [53].
- Giống như teriparatid, abaloparatid mang theo cảnh báo hộp đen về nguy cơ gây sarcom xương và có các chống chỉ định tương tự. Với liều lượng gấp 4 - 28 lần mức phơi nhiễm ở người dùng liều 80 kg, bệnh sarcom xương được quan sát thấy ở chuột [54]. Tuy nhiên, nguy cơ ở người vẫn chưa được biết rõ. Không khuyến cáo sử dụng tích lũy abaloparatid và các chất tương đồng hormon cận giáp khác trong thời gian kéo dài trên 2 năm.
3.1.2 Thuốc điều trị lựa chọn bước 2
Estrogen/ Điều trị hormon thay thế giúp cải thiện mật độ xương bằng cách ức chế hoạt động của hủy cốt bào.
- Trong Sáng kiến Sức khỏe Phụ nữ (Women’s Health Initiative [WHI]), kết hợp giữa estrogen-progesteron cải thiện BMD (cột sống, khớp háng) và giảm gãy xương (toàn bộ, đốt sống, háng và phần dưới cánh tay) [54,55]. Cũng theo WHI, tỷ lệ bị bệnh động mạch vành tăng 29%, đột quỵ tăng 41%, thuyên tắc huyết khối từ tĩnh mạch tăng 111% và ung thư vú gây xâm lấn tăng 26% ở nhóm được điều trị hormon thay thế (HRT). Nguy cơ vượt quá lợi ích của việc làm giảm gãy xương [56].
- Hiện trên thị trường có sẵn các thuốc với hiệu quả điều trị tốt hơn, tính an toàn cao hơn, vì thế sử dụng HRT để phòng ngừa và điều trị loãng xương đã không còn được ưa chuộng như trước. Ở phụ nữ đang xem xét HRT để giảm các triệu chứng mãn kinh (sử dụng liều thấp nhất có hiệu quả trong thời gian ngắn nhất) có thể mang lại lợi ích đối với BMD và nguy cơ gãy xương. Tuy nhiên, các phương pháp điều trị khác nên được cân nhắc trước tiên để phòng ngừa loãng xương ở các phụ nữ không có chỉ định khác đối với sử dụng liệu pháp hormon thay thế (HRT).
Calcitonin (Miacalcin) là một peptid nội sinh gây ức chế hoạt động của hủy cốt. Dạng thuốc bào chế dùng qua niêm mạc mũi được FDA chấp thuận để điều trị loãng xương ở phụ nữ sau mãn kinh ít nhất 5 năm nếu họ bị chống chỉ định hoặc không thể dung nạp với các thuốc được chọn bước một.
- Các cải thiện đối với BMD của cột sống ít hơn nhiều so với những cải thiện được thấy khi dùng các thuốc khác và cải thiện rất ít ở khớp háng. Liều 200 IU/ngày làm giảm gãy xương đốt sống sau 5 năm nhưng không giảm có ý nghĩa đối với gãy cổ xương đùi hoặc các gãy xương ngoài đốt sống [56,57]. Thuốc hãn hữu có thể gây kích ứng mũi và chảy máu cam. Calcitonin dạng xịt qua mũi có tác dụng giảm đau và có thể làm giảm đau liên quan với gãy ép đốt sống cấp tính [58].
3.1.3 Các thuốc không được FDA chấp thuận
Strontiranelate, một muối stronti của acid ranelic được chấp thuận ở một số nước châu u để điều trị loãng xương. Các nghiên cứu cho thấy thuốc làm giảm 40% gãy xương đốt sống và giảm 36% gãy cổ xương đùi ở một phân nhóm bệnh nhân lớn tuổi. Cơ chế tác dụng của thuốc vẫn chưa được biết rõ, sự kết hợp của thuốc vào giai đoạn tạo khoáng chất của xương có thể giải thích cho sự gia tăng mật độ xương được quan sát thấy [58]. Nói chung là thuốc được dung nạp tốt. Tuy nhiên, vào năm 2013, Cơ quan Dược phẩm châu u (EMA) đã đưa ra cảnh báo về tăng nguy cơ bị nhồi máu cơ tim liên quan đến strontium ranelate dựa trên đánh giá của họ đối với dữ liệu của các thử nghiệm lâm sàng ban đầu. Strontium ranelate không được FDA Hoa Kỳ chấp thuận nhưng strontium citrat có bán tại Hoa Kỳ dưới dạng không cần kê đơn, chế phẩm này không có dữ liệu lâm sàng về gãy xương.
Hydrochlorothiazid (HCTZ) là thuốc lợi tiểu thiazid được sử dụng điều trị tăng huyết áp. Thuốc không được chấp thuận để điều trị loãng xương. Trong một quần thể thuần tập lớn được điều trị > 1 năm, bằng hydrochlorothiazid kết hợp với tăng BMD và giảm gãy cổ xương đùi [59,60]. Bằng cách ức chế chất đồng vận chuyển natri-clorua nhạy cảm với thiazid (NCC) trong ống thận và thúc đẩy tái hấp thu canxi, hydrochlorothiazid- một điều trị hữu hiệu đối với tăng canxi niệu là tình trạng có thể đóng góp làm giảm khối lượng xương. Thiazid đã được chứng minh là gây kích thích sự biệt hóa tạo cốt bào ở các tạo cốt bào người có biểu lộ chất đồng vận chuyển natri- clorua nhạy cảm với thiazid, gợi ý cho tác dụng tạo xương trực tiếp [61]. Các rối loạn điện giải bao gồm tăng canxi máu, là tác dụng phụ quan trọng nhất của hydrochlorothiazid và cần được theo dõi ở người cao tuổi.
3.1.4 Điều trị kết hợp
Các kết hợp khác nhau của các thuốc chống hủy xương kép đã được nghiên cứu. Thêm alendronat hoặc risedronat vào liệu pháp điều trị thay thế hormon (HRT) đã cho thấy tác dụng cộng thêm lên mật độ xương tương tự như kết hợp raloxifen và alendronat [62]. Kết hợp hormon cận giáp và alendronat ít hiệu quả hơn teriparatid đơn thuần trong việc cải thiện BMD và làm tăng hình thành xương mới [63]. Tuy nhiên, điều trị tuần tự cho thấy các cải thiện của BMD sau 1 năm điều trị PTH (1 - 84) sẽ được duy trì hoặc cải thiện khi dùng tiếp theo bằng alendronat nhưng sẽ mất nếu không được điều trị tiếp theo bằng bisphosphonat [64].
Kết hợp denosumab và teriparatid trong 2 năm ở phụ nữ sau mãn kinh làm tăng BMD cột sống và khớp háng nhiều hơn so với khi chỉ dùng một thuốc đơn độc [65]. Hơn nữa, điều trị kết hợp trong 2 năm và tiếp theo bằng denosumab trong 2 năm, cũng như chuyển từ 2 năm dùng teriparatid sang dùng denosumab 2 năm tiếp theo dẫn đến làm tăng dần BMD của cột sống, xương đùi và xương quay. Mặt khác, điều trị denosumab trong 2 năm, sau đó tiếp theo bằng teriparatide 2 năm nữa cho thấy tình trạng mất xương tiến triển hoặc tạm thời [66]. Khi ngừng sử dụng teriparatid và denosumab sau 4 năm điều trị, có cải thiện đi nhanh chóng về mật độ xương bị mất đi. Tuy nhiên, tình trạng mất xương này được ngăn ngừa ở những bệnh nhân được điều trị thuốc ức chế hủy xương kịp thời, điều này cho thấy tầm quan trọng của việc chuyển đổi thuốc đúng thời điểm [67]. Do đó, cách tiếp cận điển hình hiện nay là bắt đầu ngay bisphosphonat sau khi ngừng điều trị bằng teriparatid hoặc denosumab để duy trì được mật độ xương đã đạt được, trong trường hợp dùng denosumab là để ngăn ngừa gãy đốt sống dội lại sau khi ngừng dùng thuốc. Không khuyến cáo sử dụng thường quy các điều trị kết hợp.
3.1.5 Thời gian điều trị
Thời gian điều trị nên được cá nhân hóa. Nghiên cứu FLEX cho thấy nguy cơ bị gãy đốt sống trên lâm sàng thấp hơn nhưng không thấy đối với gãy xương ngoài cột sống hoặc gãy đốt sống làm thay đổi hình thái cơ thể, sau 10 năm dùng alendronat (so với 5 năm) [68]. Phân tích dưới nhóm cho thấy điều trị này làm giảm gãy xương ngoài đốt sống ở những bệnh nhân có T-score của cổ xương đùi ≤ - 2,5 và không có gãy đốt sống ở thời điểm cơ sở lúc đưa vào nghiên cứu FLEX [69]. Tuy nhiên, những bệnh nhân lớn tuổi hơn có BMD của cổ xương đùi và vùng khớp háng ở phần ba thấp nhất (T-score lần lượt là –2,5 đến – 4,1 và –2,3 đến – 4,2) là những đối tượng ngừng sử dụng alendronat sau 5 năm, có gia tăng nguy cơ gãy xương [70]. Trong nghiên cứu HORIZON-PFT, điều trị bằng acid zoledronic trong 6 năm (so với 3 năm) có liên quan với giảm có ý nghĩa đối với gãy mới đốt sống làm thay đổi hình thái cơ thể nhưng không phải là đối với gãy xương ngoài cột sống hoặc gãy cổ xương đùi [71]. Phân tích thêm cho thấy rằng ở những người tham gia ngừng sử dụng acid zoledronic sau 3 năm, T-score ở cổ xương đùi và vùng khớp háng ≤ − 2,5, tần suất hiện mắc gãy đốt sống làm thay đổi hình thái cơ thể dự đoán sự xuất hiện các gãy mới đốt sống gây thay đổi hình thái cơ thể, trong khi điểm T-score của khớp háng thấp, tần suất hiện mắc các gãy xương ngoài đốt sống và tần suất mắc mới của gãy đốt sống dự báo xảy ra các gãy xương mới ngoài cột sống. Ở những bệnh nhân có nguy cơ thấp (T- score của vùng khớp háng > – 2,5, tần suất mắc mới gãy xương bằng 0) đã ngừng sử dụng acid zoledronic 3 năm, nguy cơ bị gãy xương theo trong 3 năm tiếp theo vẫn thấp [72]. Các dữ liệu này gợi ý tác dụng tồn dư do lưu giữ lâu dài trong xương, lợi ích tiếp tục kéo dài sau 5 năm dùng alendronat và 3 năm dùng acid zoledronic ở nhóm đối tượng có nguy cơ thấp.
Do lo ngại về tính an toàn khi sử dụng bisphosphonate lâu dài, nhóm chuyên trách của Hiệp hội Nghiên cứu Xương và Khoáng chất Hoa Kỳ (American Society for Bone and Mineral Research [ASBMR]) goi sử dụng liên tục bisphosphonat (uống) trong 5 năm, bisphosphonat (tĩnh mạch) trong 3 năm và đánh giá lại nguy cơ. Ở bệnh nhân vẫn có nguy cơ gãy xương cao (lớn tuổi hơn, T-score của hông thấp, điểm gãy xương cao, gãy xương nặng do loãng xương trước đó hoặc gãy xương khi đang điều trị), xem xét tiếp tục điều trị thêm 5 năm (uống) hoặc 3 năm nữa (tĩnh mạch) với đánh giá định kỳ bệnh nhân. Đối với những đối tượng có nguy cơ thấp, có thể cân nhắc ngừng bisphosphonat sau khi điều trị 2 đến 3 năm và đánh giá lại định kỳ bệnh nhân [39].
Như đã được đề cập trước đó, tình trạng mất xương nhanh chóng và gãy xương đốt sống tự phát đã được quan sát thấy sau khi ngừng dùng denosumab. Vì vậy, phải thận trọng để không làm gián đoạn điều trị bằng denosumab và nên bắt đầu dùng thuốc bisphosphonat hoặc thuốc tăng đồng hóa ngay sau khi ngừng điều trị. Các điều trị dựa trên PTH đã khuyến cáo thời gian điều trị tích lũy là 24 tháng.
Một lần nữa, các quyết định điều trị nên được cá thể hóa, dựa trên việc suy đoán lâm sàng sau khi cân bằng giữa nguy cơ và lợi ích và được thảo luận với bệnh nhân.
3.2 Thay đổi lối sống/nguy cơ
Thay đổi lối sống là rất quan trọng để điều trị và phòng ngừa loãng xương. Người trưởng thành bị loãng xương nên được khuyến khích ngừng hút thuốc và tránh uống quá nhiều rượu.
3.2.1 Chế độ ăn
Cung cấp chế độ ăn uống đầy đủ canxi và vitamin D là điều cần thiết để đạt được khối lượng xương đỉnh và duy trì khối lượng xương trong suốt cuộc đời sau tuổi mãn kinh [73]. Giảm gãy cổ xương đùi và gãy xương ngoài cột sống bằng dùng canxi cộng với vitamin D [74] so với chỉ dùng 700 - 800 IU vitamin D đơn độc đã được báo cáo ở người cao tuổi [75]. Bổ sung thêm canxi và vitamin D được đưa ra trong hầu hết các thử nghiệm về loãng xương.
Canxi
- Khẩu phần canxi nguyên tố nhập vào được khuyến cáo là 1.000 mg/ ngày ở phụ nữ < 50 tuổi và nam giới < 70 tuổi, 1.200 mg/ngày ở phụ nữ trên 50 tuổi và nam giới trên 70 tuổi. Các thực phẩm giàu canxi bao gồm sữa, sữa chua, pho mát, cá mòi và nước trái cây tăng cường. Trung bình, 240 mL sữa, 180 mL sữa chua hoặc 45 gam pho mát chứa 300 mg canxi nguyên tố. Khẩu phần nhập canxi trung bình hằng ngày của người lớn từ các nguồn thực phẩm ngoài sữa là 250 - 300 mg/ngày, do đó hầu hết cần được hướng dẫn để tối ưu hóa lượng hấp thu [5,6,12].
- Có nhiều dạng bào chế để bổ sung canxi dưới dạng sử dụng không cần phải kê đơn và bệnh nhân nên đọc hướng dẫn sử dụng để biết rõ lượng canxi nguyên tố trong mỗi viên thuốc. Canxi carbonat có 40% canxi nguyên tố, trong khi canxi citrat có 21% canxi nguyên tố. Các muối canxi được hấp thụ tốt nhất trong bữa ăn, tuy nhiên có thể uống citrat canxi ngoài bữa ăn, thuốc ít gây táo bón hơn.
- Một phân tích gộp cho thấy bổ sung canxi ở người cao tuổi được kết hợp với tăng nguy cơ nhồi máu cơ tim [76]. Kể từ đó, các nghiên cứu khác cho các kết quả trái ngược nhau với một số nghiên cứu gợi ý nguy cơ tim mạch tăng lên trong khi những nghiên cứu khác cho thấy là không có hoặc giảm nguy cơ tim mạch. Liên quan đến tính an toàn tim mạch, lượng canxi trong chế độ ăn và tổng lượng canxi nhập vào không được vượt quá 1.500 mg/ngày.
Vitamin D:
- Nồng độ 25 (OH)D gợi ý được cho là từ 30 đến 50 ng/mL [6,12). Trong khoảng giới hạn này, hằng định nội môi về khoáng chất phải cân bằng với việc tối ưu hóa hấp thụ canxi và khoáng hóa ở ruột. Khẩu phần nhập được khuyến nghị cho người lớn ≥ 50 tuổi là 800 đến 1.000 IU/ngày. Tuy nhiên, tình trạng thiếu vitamin D rất phổ biến và cần tiến hành đo đạc nồng độ 25(OH) D ở tất cả bệnh nhân khi họ được đánh giá về sức khỏe của xương. Nếu có tình trạng thiếu hụt nên cho tiêm ergocanxiferol (vitamin D,) 50.000 IU mỗi tuần trong 8 -12 tuần hoặc liều Cholecalciferol (vitamin D,) tương đương để đạt được nồng độ 25(OH) D vào khoảng 30 ng/mL. Sau đó, duy trì hằng ngày bằng cholecalciferol 1.000 đến 2.000 IU hoặc các chế phẩm với liều tương đương để duy trì được nồng độ 25(OH)D như ở người khỏe mạnh [6,12].
Hoạt động thể chất
Nên khuyến khích bệnh nhân tập luyện các bài tập thể dục chịu sức nặng đều đặn trong suốt đời, điều này đã được chứng minh là giúp tối đa hóa khối lượng xương đỉnh ở phụ nữ trẻ, làm giảm tình trạng mất xương liên quan với tuổi tác, cải thiện BMD trong một số trường hợp và giúp duy trì sự cân bằng và sức mạnh của cơ bắp. Cải thiện sự nhanh nhẹn, tư thế và thăng bằng có thể làm giảm nguy cơ ngã. Nghiên cứu về Sức khỏe của các Điều dưỡng chứng minh rằng các phụ nữ mãn kinh không bị loãng xương thực hiện ba hoạt động thể chất tương đương nhau về trao đổi chất mỗi tuần ở sẽ làm giảm 6% gãy cổ xương đùi [76]. Các nguyên nhân gây ngã có thể đảo ngược được (chẳng hạn dùng quá nhiều thuốc, các vấn đề về thần kinh hoặc thị lực, giày dép đi không tốt và môi trường trong nhà kém) cần được đánh giá và giải quyết [77].
4 CÁC TRƯỜNG HỢP ĐẶC BIỆT
Loãng xương do glucocorticoid gây nên là nguyên nhân phổ biến nhất của loãng xương thứ phát. Mất xương xảy ra sớm và nhanh (khoảng 6 - 12% /năm) trong năm đầu tiên và nguy cơ gãy xương tăng 75% trong vòng 3 tháng đầu sử dụng thuốc. Tốc độ mất xương là hàm số của liều lượng và thời gian sử dụng glucocorticoid. Gãy xương do loãng xương xảy ra ngay cả ở mức mật độ xương có nguy cơ gây gãy xương thấp. Glucocorticoid ức chế chức năng của tạo cốt bào, gây chết theo chương trình tế bào tạo xương và kéo dài tuổi thọ của hủy cốt bào, do đó đẩy sự cân bằng theo hướng gây mất xương thực và tăng tình trạng dễ gãy của xương [78]. Năm 2017, Hội Thấp khớp học Mỹ (American College of Rheumatology [ACR]) đã ban hành hướng dẫn về phòng ngừa và xử lý loãng xương do glucocorticoid gây nên. Đánh giá nguy cơ gãy xương (bệnh lý đồng mắc, gãy xương, ngã, liều glucocorticoid) và kiểm tra BMD được khuyến cáo cho bệnh nhân khi bắt đầu điều trị glucocorticoid với liều tương đương với liều prednison là > 2,5 mg/ngày trong>3 tháng. Điểm FRAX phải được điều chỉnh đối với bệnh nhân dùng prednison với liều > 7,5 mg/ngày bằng cách nhân nguy cơ 10 năm đối với gãy xương nặng và gãy cổ xương đùi do loãng xương lần lượt với 1,15 (gãy xương nặng do loãng xương) và 1,2 (gãy cổ xương đùi). Bệnh nhân đang dùng glucocorticoid với liều ở trên là đối tượng có nguy cơ gãy xương từ trung bình đến cao (gãy xương trước đó, T-score khớp háng hoặc cột sống ≤ - 2,5 hoặc Z-score < - 3, nguy cơ loãng xương chính tính theo điểm FRAX > 10% và nguy cơ gãy cổ xương đùi > 1%, mất xương≥ 10%/năm, liều dùng prednison ≥ 7,5 mg/ ngày trong ≥ 6 tháng) nên được xem xét điều trị bằng bisphosphonat đường uống. Các lựa chọn thay thế bao gồm bisphosphonat đường tĩnh mạch, teriparatid và denosumab. Phụ nữ trong độ tuổi có thể sinh đẻ có nguy cơ gãy xương trung bình - cao có thể được điều trị như trên nếu không có kế hoạch có thai và thực hiện biện pháp tránh thai hiệu quả. Bổ sung đầy đủ canxi và vitamin D, duy trì lối sống lành mạnh được khuyến cáo cho tất cả các đối tượng. Có thể ngừng điều trị khi ngừng sử dụng glucocorticoid trừ khi bệnh nhân vẫn có nguy cơ cao bị gãy xương. Quyết định điều trị nên được cá thể hóa và nguy cơ gãy xương phải được đánh giá lại một cách đều đặn [79].
Đái tháo đường ngày càng được ghi nhận là một yếu tố nguy cơ của gãy xương do loãng xương. BMD thường bị giảm ở bệnh nhân đái tháo đường typ 1, bình thường hoặc thậm chí tăng nhẹ ở bệnh nhân đái tháo đường typ 2 [80]. Tuy nhiên, cả hai nhóm đều tăng nguy cơ gãy xương so với người không bị đái tháo đường. Đo BMD và đánh giá nguy cơ gãy xương bằng bộ công cụ FRAX ước tính thấp hơn thực tế nguy cơ ở bệnh nhân đái tháo đường typ 2, các thầy thuốc lâm sàng cần nhận biết được điều này [81]. Cơ chế dẫn đến tình trạng xương dễ bị gãy là do nhiều yếu tố và bao gồm stress oxy hóa, viêm mạn tính, tăng đường máu, tích tụ sản phẩm tận bậc cao của quá trình glycosyl hóa làm biến đổi đặc tính của collagen và làm tăng mô mỡ của tủy xương. Một số thuốc điều trị bệnh đái tháo đường, như thiazolidinedion, chất ức chế SGLT-2 và Insulin, được kết hợp với tần suất gãy xương cao hơn [80]. Hiện nay, quản lý tình trạng dễ gãy xương ở bệnh nhân đái tháo đường cũng được theo đuổi tương tự như quản lý tình trạng loãng xương sau mãn kinh.
5 KIỂM TRA VÀ THEO DÕI
Bệnh nhân đang điều trị bằng thuốc cần được theo dõi để phát hiện các biến chứng, tác dụng phụ, khẩu phần nhập canxi và vitamin D có thỏa đáng hay không, các yếu tố nguy cơ đang tiếp diễn và mới xuất hiện, cũng như tuân thủ và đáp ứng với điều trị. Đánh giá thường xuyên các yếu tố nguy cơ có thể thay đổi được và xử lý những yếu tố đó (xem Bảng 26.1, 26.2 và 26.3). Đo chiều cao hằng năm để tầm soát tình trạng gãy xương đốt sống không triệu chứng.
Đáp ứng điều trị có thể được theo dõi bằng cách sử dụng đo mật độ khoáng chất của xương (BMD) bằng DXA hoặc các chỉ dấu đánh giá chu chuyển xương (BTMs). Để theo dõi những thay đổi BMD ở cột sống và háng nên đánh giá lại bằng DXA mỗi 2 năm/lần ở cùng một cơ sở y tế, bằng cách sử dụng cùng một máy đã được hiệu chỉnh và nếu có thể được, bởi cùng một kỹ thuật viên thực hiện kỹ thuật đo. Cuối cùng có thể thực hiện việc theo dõi bằng DXA tùy thuộc vào tình trạng lâm sàng của từng bệnh nhân nên tiến hành so sánh kết quả đo BMD bằng cách sử dụng cùng một thiết bị đo đạc. Do tính biến đổi cố hữu trong kết quả đo mật độ khoáng chất xương bằng DXA, phân tích tính chính xác và thay đổi có ý nghĩa ít nhất (the least significant change [LSC]) phải được tính toán cho từng cơ sở y tế theo khuyến nghị của ISCD [14]. LSC chuyên biệt cho từng cơ sở y tế thường được đặt ở khoảng tin cậy 95%, xác lập thay đổi BMD nhỏ nhất (không phải T-score) đạt ý nghĩa thống kê và cần được đưa vào báo cáo kết quả đo DXA [6,14]. Xác nhận giá trị của những thay đổi lớn của BMD bằng cách kiểm tra lại ROI (một kỹ thuật dựng hình 3D) tư thế của bệnh nhân hoặc có thể là do có các hiện tượng nhiễu. Kết quả đo BMD ổn định hoặc tăng được kết hợp với giảm nguy cơ gãy xương qua các thử nghiệm lâm sàng.
Các xu hướng diễn biến đối với các dấu ấn đánh giá chu chuyển xương (BTMs) (ức chế với điều trị bằng thuốc chống hủy xương và tăng lên khi điều trị tăng đồng hóa) đã được dự báo về cải thiện mật độ xương và có thể có một số lợi ích trong đánh giá đáp ứng điều trị. Tuy nhiên, ở thời điểm hiện tại, BTMs không phải là tiêu chuẩn chăm sóc cho bệnh nhân. Gãy xương trong khi điều trị không đồng nghĩa với việc điều trị thất bại. Mặc dù gãy xương đã giảm đáng kể, song vẫn xảy ra ở nhóm được điều trị, số lượng biến chứng này có thể nhiều hơn và nghiêm trọng hơn nếu bệnh nhân không được điều trị dự phòng loãng xương.
Mất BMD vượt quá LSC, thay đổi các dấu ấn đánh giá chu chuyển xương (BTMs) không như mong đợi, các gãy xương mới cần được điều tra ngay các yếu tố nguy cơ thêm vào (bệnh lý đi kèm, tuân thủ điều trị, khẩu phần nhập vitamin D và canxi, tình trạng kém hấp thu) và xem xét điều chỉnh điều trị.
Bạn đọc có thể tham khảo thêm Hướng dẫn chẩn đoán và điều trị loãng xương theo AACE - ACE 2020 như sau:
6 TÀI LIỆU THAM KHẢO
1. NIH Consensus Development Panel on Osteoporosis Prevention, Diag- nosis, and Therapy. Osteoporosis prevention, diagnosis, and thera- py. JAMA 2001;285(6):785-795.
2. Wright NC, Looker AC, Saag KG, et al. The recent prevalence of osteoporosis and low bone mass in the United States based on bone mineral density at the femoral neck or lumbar spine. J Bone Miner Res 2014;29(11):2520-2526.
3. Looker AC, Johnston CC Jr, Wahner HW, et al. Prevalence of low femoral bone density in older U.S. women from NHANES III. J Bone Miner Res 1995;10(5):796–802.
4. Burge R, Dawson-Hughes B, Solomon DH, Wong JB, King A, Tosteson A. Incidence and econom- ic burden of osteoporosis-related fractures in the United States, 2005-2025. J Bone Miner Res 2007; 22 (3): 465–475.
5. Bone Health and Osteoporosis: A Report of the Surgeon General. Rockville, MD: U.S. Department of Health and Human Services, Office of the Surgeon General; 2004.
6. Cosman F, de Beur SJ, LeBoff MS, et al. Clinician's guide to prevention and điều trị of oste- oporosis. National Osteoporosis Foundation. Osteoporosis Int
2014;25(10):2359-2381.
7. Cummings SR, Melton LJ. Epide- miology and outcomes of osteo- porotic fractures. Lancet 2002; 359(9319):1761-1767.
8. Kado DM, Browner WS, Pal- ermo L, Nevitt MC, Genant HK, Cummings SR. Vertebral fractures and mortality in old- er women: A prospective study. Study of Osteoporotic Fractures Research Group. Arch Intern Med 1999;159(11):1215-1220.
9. Klotzbuecher CM, Ross PD, Lands- man PB, Abbott TA 3rd, Berger M. Patients with prior fractures have an increased risk of future frac- tures: A summary of the literature and statistical synthesis. J Bone Miner Res 2000;15(4):721-739.
10. Kanis JA, McCloskey EV, Johans- son H, Oden A, Ström O, Borgström F. Development and use of FRAX in osteoporosis. Osteoporosis Int 2010; 21 (Suppl 2):S407-S413.
11. Assessment of fracture risk and its application to screening for postmenopausal osteopo- rosis. Report of a WHO Study Group. World Health Organ Tech Rep Ser 1994;843:1-129.
12. Camacho PM, Petak SM, Binkley N, et al. American Association of Clinical Endocrinologists and American College of Endocri- nology clinical practice guide- lines for the diagnosis and điều tri of post-menopausal osteo- porosis-2016. Endocr Pract 2016;22(Suppl 4):1-42.
13. Siris ES, Adler R, Bilezikian J, et al. The clinical diagnosis of osteo- porosis: A position statement from the National Bone Health Alliance Working Group. Osteoporosis Int 2014;25(5):1439-1443.
14. Schousboe JT, Shepherd JA, Bilezekian JP, Baim S. Executive summary of the 2013 International Society for Clinical Densitometry Position Development Conference on bone densitometry. J Clin Den- sitom 2013:16(4):455–466.
15. Tannenbaum C, Clark J, Schwartz- man K, et al. Yield of laboratory testing to identify secondary contrib- utors to osteoporosis in otherwise healthy women. J Clin Endocrinol Metab 2002;87(10):4431-4437.
16. Ryan CS, Petkov VI, Adler RA. Osteoporosis in men: The value of laboratory testing. Osteoporos Int 2011;22(6):1845-1853.
17. Vasikaran S. Eastell R, Bruyere O, et al. Markers of bone turnover for the prediction of fracture risk and monitoring of osteoporosis điều trị : A need for international refer- ence standards. Osteoporosis Int 2011;22(2):391-420.
18. Szulc P, Naylor K, Hoyle NR, East- ell R, Leary ET. Use of CTX-1 and PINP as bone turnover markers: National Bone Health Alliance recommendations to standard- ize sample handling and patient preparation to reduce pre-ana- lytical variability. Osteoporosis Int 2017;28(9):2541-2556.
19. Cummings SR, Black DM, Nevitt MC, et al. Bone density at various sites for prediction of hip frac- tures. The Study of Osteoporotic Fractures Research Group. Lancet 1993;341(8837):72-75.
20. Marshall D, Johnell O, Wedel H. Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. BMJ 1996; 312(7041):1254-1259.
21. Colange N, Bibbins-Domingo K, Cantu AG, et al. Screening for osteoporosis: A U.S. preventive service task force recommen- dation statement. Ann Intern Med 2011;155:356–364.
22. Engelke K, Libanati C, Fuerst T, Zysset P, Genant HK. Advanced CT based in vivo methods for the as- sessment of bone density, structure and strength. Current Osteoporosis Reports 2013; 11 (3):246–255.
23. Shepherd JA, Schousboe JT, Broy SB, Engelke K, Leslie WD. Exec- utive summary of the 2015 ISCD position development conference on advanced measures from DXA and QCT: Fracture prediction beyond BMD. J Clin Densi- tom 2015;18(3):274–286.
24. Silva BC, Broy SB, Boutroy S, Schousboe JT, Shepherd JA, Leslie WD. Fracture risk prediction by non-BMD DXA measures: The 2015 ISCD official positions part 2: Trabecular bone score. J Clin Densitom 2015;18(3):309–330.
25. Haller J, Andre MP, Resnick D, et al. Detection of thoracolumbar vertebral body destruction with lateral spine radiography. Part II: Clinical investigation with com- puted tomography. Invest Radi- ol 1990;25(5):523-532.
26. Black DM, Cummings SR, Karpf DB, et al. Randomised trial of effect of Alendronate on risk of fracture in women with existing vertebral fractures. Fracture Intervention Trial Research Group. Lancet 1996;348(9041):1535-1541.
27. Black DM, Delmas PD, Eastell R, et al. Once-yearly Zoledronic acid for điều trị of postmenopausal os- teoporosis. N Engl J Med 2007;356 (18): 1809-1822
28. Chesnut IC, Skag A, Christiansen C, et al. Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopaus- al osteoporosis. J Bone Miner Res 2004;19(8):1241–1249.
29. Cummings SR, Black DM, Thomp- son DE, et al. Effect of alendro- nate on risk of fracture in women with low bone density but without vertebral fractures: Results from the Fracture Intervention Tri- al. JAMA 1998;280(24):2077-2082.
30. Harris ST, Watts NB, Genant HK, et al. Effects of risedronate điều trị on vertebral and nonver- tebral fractures in women with postmenopausal osteoporosis: A randomized controlled trial. Ver- tebral Efficacy with Risedronate Therapy (VERT) Study Group. JAMA 1999;282(14):1344-1352.
31. Liberman UA, Weiss SR, Broll J, et al. Effect of oral alendronate on bone mineral density and the incidence of fractures in post- menopausal osteoporosis. The Alendronate Phase III Osteoporosis Treatment Study Group. N Engl J Med 1995;333(22):1437-1443.
32. McClung MR, Geusens P, Miller PD, et al. Effect of risedronate on the risk of hip fracture in elderly women. Hip Intervention Program Study Group. N Engl J Med 2001;344(5):333–340.
33. Reginster J, Minne HW, Sorensen OH, et al. Randomized trial of the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis. Vertebral Efficacy with Risedronate Therapy (VERT) Study Group. Os- teoporos Int 2000;11(1):83–91.
34. Reid IR, Brown JP, Burckhardt P, et al. Intravenous zoledronic acid in postmenopausal women with low bone mineral density. N Engl J Med 2002; 346(9):653–661.
35. A once-yearly IV bisphosphonate for osteoporosis. Med Lett Drugs Ther 2007; 49 (1273):89–90.
36. Perazella MA, Markowitz GS. Bis- phosphonate nephrotoxicity. Kidney Int 2008;74(11):1385-1393.
37. Khan AA, Morrison A, Hanley D, et al. Diagnosis and manage- ment of osteonecrosis of the jaw: A systematic review and interna- tional consensus. J Bone Miner Res 2015;30(1):3–23.
38. Shane E, Burr D, Abrahamsen B, et al. Atypical subtrochanteric and diaphyseal femoral fractures: Second report of a task force of the American Society for Bone and Mineral Research. J Bone Miner Res 2014;29(1):1–23.
39. Adler RA, El-Hajj Fuleihan G, Bauer DC, et al. Managing osteo- porosis in patients on long-term bi- sphosphonate điều trị : Report of a task force of the American Society for Bone and Mineral Research. J Bone Miner Res 2015;31(1):16-35.
40. Ettinger B, Black DM, Mitlak BH, et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: Results from a 3-year randomized clinical trial. Multiple Outcomes of Raloxifene Evaluation (MORE) Investiga- tors. JAMA 1999;282(7):637–645.
41. Barrett-Connor E, Mosca L, Collins P, et al. Effects of raloxifene on car- diovascular events and breast can- cer in postmenopausal women. N Engl J Med 2006;355(2):125–137.
42. Pinkerton JV, Harvey JA, Lindsay R, et al. Effects of bazedoxifene/ conjugated estrogen on the endo- metrium and bone: A randomized trial. J Clin Endocrinol Me- tab 2014;99(2):E189-E198.
43. Lindsay R, Gallagher JC, Kagan R, Pickar JH, Constantine G. Efficacy of tissue-selective estrogen complex bazedoxifene/conjugated estrogen for osteoporosis prevention in at-risk postmenopausal women. Fertil steril 2009;92(3):1045–1052.
44. Silverman SL, Christiansen C, Genant HK, et al. Efficacy of bazedoxifene in reducing new vertebral fracture risk in postmeno- pausal women with osteoporosis: Results from a 3-year random- ized, placebo-, and active-con- trolled clinical trial. J Bone Miner Res 2008;23(12):1923-1934.
45. Teriparatide (forteo) for osteoporsis. Med Lett Drugs Ther 2003;45(1149):9–10.
46. Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hor- mone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001;344(19):1434-1441.
47. Lindsay R, Scheele WH, Neer R, et al. Sustained vertebral fracture risk reduction after withdrawal of teri- paratide in postmenopausal women with osteoporosis. Arch Intern Med 2004;164(18):2024-2030.
48. Prince R, Sipos A, Hossain A, et al. Sustained nonvertebral fragility fracture risk reduction after discon- tinuation of teriparatide điều trị . J Bone Miner Res 2005;20(9):1507- 1513.
49. Cummings SR, San Martin J, McClung MR, et al. Denosum- ab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med 2009;361(8):756–765.
50. Bone HG, Wagman RB, Brandi ML, et al. 10 years of denosumab điều trị in postmenopausal women with osteoporosis: Results from phase 3 randomised FREEDOM trial and open-label extension. Lancet Diabetes Endocrinology 2017; 5(7):513–523.
51. Lamy O, Gonzalez-Rodriguez E, Stoll D, Hans D, Aubry-Rozier B. Severe rebound-associated ver- tebral fractures are denosumab discontinuation: 9 clinical cases report. J Clin Endocrinol Metab 2017;102(2):354-358.
52. Miller PD, Bolognese MA, Lewiecki E, et al. Effect of denosumab on bone density and turnover in postmenopausal women with low bone mass after long-term combined, discontinued, and restarting of therapy: A ran- domized blinded phase 2 clinical trial. Bone 2008;43(2):222–229.
53. Miller PD, Hattersley G, Riss BJ, et al. Effect of abaloparatide vs placebo on new vertebral fractures in postmenopausal women with osteoporosis a randomized clinical trial. JAMA 2016;316(7):722–733.
54. Jolette J, Attalla B, Valera A, et al. Comparing the incidence of bone tumors in rats chronically exposed to the selective PTH type 1 recep- tor agonist abaloparatide or PTH (1-34). Regul Toxicol Pharma- col 2017;86:356–365.
55. Cauley JA, Robbins J, Chen Z, et al. Effects of estrogen plus pro- gestin on risk of fracture and bone mineral density: The Women's Health Initiative randomized trial. JAMA 2003; 290 (13): 1729-1738.
56. Rossouw JE, Anderson GL, Pren- tice RL, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: Principal results from the Women's Health Initiative randomized controlled trial. JAMA 2002;288(3):321-333.
57. Chesnut CH 3rd, Silverman S, An- driano K, et al. A randomized trial of nasal spray salmon calcitonin in postmenopausal women with es- tablished osteoporosis: The prevent recurrence of osteoporotic fractures study. PROOF Study Group. Am J Med 2000;109(4):267–276.
58. Knopp JA, Diner BM, Blitz M, Ly- ritis GP, Rowe BH. Calcitonin for treating acute pain of osteoporotic vertebral compression fractures: A systematic review of random- ized, controlled trials. Osteoporos Int 2005;16(10):1281-1290.
59. Meunier PJ, Roux C, Seeman E, et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmeno- pausal osteoporosis. N Engl J Med 2004;350(5):459–468.
60. Schoofs MW, van der Klift M, Hofman A, et al. Thiazide diuretics and the risk for hip fracture. Ann Intern Med 2003;139(6):476–482.
61. Dvorak MM, De Joussineau C, Carter DH, et al. Thiazide diuretics directly induce osteoblast differ- entiation and mineralized nodule formation by interacting with a sodium chloride co-transporter in bone. J Am Soc Nephrol 2007; 18 (9):2509-2516.
62. Binkley N, Krueger D. Combination therapy for osteoporosis: Considerations and controversy. Curr Osteoporos Rep 2005;3(4):150-154.
63. Black DM, Greenspan SL, Ensrud KE, et al. The effects of parathyroid hormone and alendronate alone or in combination in postmeno- pausal osteoporosis. N Engl J Med 2003;349(13):1207-1215.
64. Black DM, Bilezikian JP, Ensrud KE, et al. One year of alendro- nate after one year of parathyroid hormone (1-84) for osteoporosis. N Engl J Med 2005;353(6):555–565.
65. Leder BA, Tsai JN, Uihlein V, et al. Two years of denosumab and teriparatide administration in postmenopausal women with osteoporosis (the DATA Extension Study): A randomized controlled trial. J Clin Endocrinol Me- tab 2014;99(5):1694-1700.
66. Leder BZ, Tsai JN, Uihlein AV, et al. Denosumab and teriparati- de transitions in postmenopausal osteoporosis (the DATA-Switch study): Extension of a randomized controlled trial. Lancet 2015; 386(9999):1147–1155.
67. Leder BZ, Tsai JN, Jiang LA, Lee H. Importance of prompt antiresorptive therapy in postmenopausal women discontinuing teriparatide or denosumab: The denosumab and teriparatide follow-up study (DA- TA-Follow-up). Bone 2017;98: 54-58.
68. Black DM, Schwartz AV, Ensrud KE, et al. Effects of continuing or stopping alendronate after 5 years of điều trị . The fracture inter- vention trial long-term extension (FLEX): A randomized trial. JAMA 2006; 296(24):2927-2938.
69. Schwartz AV, Bauer DC, Cum- mings SR, et al. Efficacy of con- tinued alendronate for fractures in women with and without prevalent vertebral fracture: The FLEX trial. J Bone Miner Res 2010; 25 (5):976-982.
70. Bauer DC, Schwartz AV, Palermo L, et al. Fracture prediction after discontinuation of 4 to 5 years of alendronate therapy. The FLEX study. JAMA 2014; 174(7): 1126-1134.
71. Black DM, Reid IR, Boonen S, et al. The effect of 3 versus 6 years of zoledronic acid điều trị of osteo- porosis: A randomized extension to the HORIZON-Pivotal frac- ture trial (PFT). J Bone Miner Res 2012;27(2):243-254.
72. Cosman F, Cauley JA, Estell R, et al. Reassessment of fracture risk in women after 3 years of điều trị with zoledronic acid: When is it reasonable to discontinue điều trị ? J Clin Endocrin Metab 2014; 99(12):4546-4554.
73. Heaney RP. Calcium, dairy prod- ucts and osteoporosis. J Am Coll Nutr 2000;19(2 Suppl):83S-99S.
74. Chapuy MC, Arlot ME, Delmas PD, Meunier PJ. Effect of calcium and cholecalciferol điều trị for three years on hip fractures in elderly women. BMJ 1994;308(6936):1081–1082.
75. Bischoff-Ferrari HA, Willett WC, Wong JB, Giovannucci E, Dietrich T, Dawson-Hughes B. Fracture prevention with vitamin D suplementation: A meta-anal- ysis of randomized controlled trials. JAMA 2005;293(18): 2257-2264.
76. Bolland MJ, Avenell A, Baron JA, et al. Effect of calcium supplements on risk of myocardial infarction and cardiovascular events: Meta-analy- sis. BMJ 2010;341:c3691:
77. Todd JA, Robinson RJ. Osteopo- rosis and exercise. Postgrad Med J 2003;79(932):320–323.
78. Weinstein RS. Clinical practice. Glucocorticoid-induced bone dis- ease. N Engl J Med 2011; 365 (1) : 62-70.
79. Buckley L, Guyatt G, Fink HA, et al. 2017 American College of Rheumatology guideline for the prevention and điều trị of gluco- corticoid-induced osteoporosis. Ar- thritis Care Res (Hoboken) 2017; 69(8):1095-1110.
80. Napoli N, Chandran M, Pierroz DD, Abrahamsen B, Schwartz AV, Ferrari SL. Mechanisms of diabe- tes mellitus-induced bone fragili- ty. Nature 2017; 13(4):208–218.
81. Gianggregorio LM, Leslie WD, Lix LM, et al. FRAX underes- timates fracture risk in patients with diabetes. J Bone Miner Res 2012;27(2):301–308.

