Tổng quan về đặc điểm cấu trúc và chức năng của đường hô hấp dưới

Trungtamthuoc.com - Đường hô hấp dưới đóng vai trò quan trọng trong việc trao đổi khí với môi trường. Bài viết dưới đây sẽ cung cấp thông tin cho người đọc về đặc điểm cấu trúc, chức năng, hoạt động sinh lý của đường hô hấp dưới, từ đó giúp phòng ngừa, chẩn đoán và điều trị hiệu quả các rối loạn hô hấp.
Tiến sĩ, Bác sĩ Nguyễn Văn Thành - Phó chủ tịch Hội Hô hấp Việt Nam, Phó chủ tịch Hội Phổi Việt Nam
Tải bản PDF TẠI ĐÂY
Khoảng 10.000 lít không khí và 8.000 lít máu đi qua hệ thống hô hấp mỗi ngày. Hoạt động này được thực hiện dưới tác động của sự chênh lệch áp suất, được tạo ra do tình trạng co và dãn theo nhịp điệu của cơ vân dưới sự kiểm soát tự động và không tự động của hệ thống thần kinh trung ương. Sự tương xứng của lưu lượng không khí và máu là kết quả của các phản xạ từ trung tâm và tại chỗ đáp ứng với các kích thích bên trong và bên ngoài từ đó kiểm soát hoạt động bơm máu của tim và hoạt động của cơ trơn trong thành của đường thở và mạch máu.
Một loạt các cơ chế thần kinh và miễn dịch bảo vệ phổi chống lại các tác nhân gây hại đến từ môi trường. Nhiều cơ chế có tính thích nghi (thu được), có khả năng nhớ để làm tăng độ nhạy và phản ứng khi tiếp xúc nhiều lần với các kích thích. Khoảng hơn 10% dân số, các phản ứng đối với các kích thích môi trường trở thành bệnh lý, dẫn đến sự nhạy cảm quá mức và phản ứng bất thường đối với cả các kích thích đặc hiệu và không đặc hiệu. Đáp ứng bất thường này nếu lặp lại kéo dài có thể dẫn tới hiện tượng tái cấu trúc thực thể của đường thở và phổi.
Một lượng khí lớn xâm nhập, di chuyển và trao đổi liên tục ở phổi. Bụi, khí độc hại và tác nhân có khả năng gây bệnh có trong không khí vào phổi có thể làm hỏng mô phổi, cản trở cơ học hô hấp và hạn chế trao đổi khí. Cả hai quá trình thụ động và chủ động đều bảo vệ phổi khỏi những tác hại từ môi trường bằng cách lọc không khí được hít vào, thay đổi luồng không khí và lưu lượng máu để hạn chế khả năng tiếp xúc phế nang và hệ thống với các tác động có hại, thu giữ, tiêu diệt và làm sạch tác nhân gây bệnh cũng như sửa chữa hiệu quả các mô bị tổn thương để phục hồi hàng rào niêm mạc.
Một số cơ chế bảo vệ thu được giúp làm tăng tính nhạy cảm của hệ thống và tăng cường độ phản ứng với những kích thích có hại về sau. Rối loạn các cơ chế bảo vệ có thể làm tăng độ nhạy cảm với các kích thích không đặc hiệu và dẫn đến các phản ứng không tương xứng, thái quá, đẩy cơ thể vào tình trạng bệnh. Hiểu được các cơ chế hình thành các phản ứng quá mức này giúp phòng, chẩn đoán xác định và điều trị một cách hiệu quả các rối loạn đến mức “bệnh”, trong đó có COPD.
1 GIẢI PHẪU CHỨC NĂNG CỦA ĐƯỜNG HÔ HẤP DƯỚI
Luồng không khí (hay luồng khí, airflow) di chuyển qua đường hô hấp dưới tác động bởi các chênh lệch áp suất nhỏ, công thở và lực cản trong từng đoạn trên đường thở. Khả năng tạo ra lực cản dòng khí khi đi qua một ống cứng có liên quan đến chiều dài và đường kính của lòng ống. Tuy nhiên, hầu hết các đường thở đều có thể biến dạng, co dãn sinh lý. Cơ, mạch máu , các tuyến trong thành đường thở nằm dưới sự kiểm soát của phản xạ tại chỗ và đồng thời có phản ứng tích cực với những thay đổi của môi trường bên trong và bên ngoài.
Toàn bộ đường hô hấp được chia thành hai khu vực lớn: Đường hô hấp trên và đường hô hấp dưới. Đường hô hấp dưới bao gồm các đoạn ngoài lồng ngực và trong lồng ngực của khí quản, phế quản ngoài phổi và trong phổi, các tiểu phế quản, ống phế nang và phế nang, nằm trong lồng ngực và trong phổi.
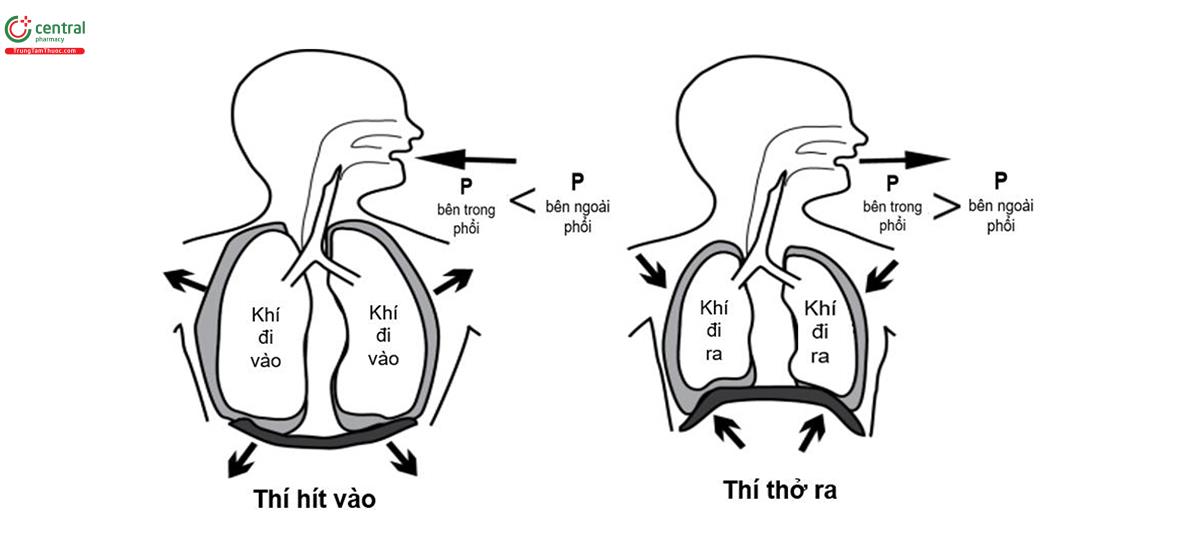
Đường dẫn khí ngoài phổi trong lồng ngực chịu sự tác động của áp suất trong khoang màng phổi, áp suất này thường âm tính nhưng trở nên dương tính khi thở ra gắng sức. Đường dẫn khí trong phổi được bao quanh bởi các phế nang và đường kính của chúng bị chịu sự tác động của thay đổi sức căng của mô phổi cũng như áp suất của phế nang dao động từ âm sang dương trong chu kỳ hô hấp. Đường dẫn khí gần tiểu phế quản hô hấp không gắn với phế nang nên được phân loại là đường dẫn khí, trong khi tiểu phế quản hô hấp, ống phế nang và phế nang tạo thành vùng trao đổi khí của phổi (hình 2 và bảng 1).

Bảng 1. Danh pháp đường hô hấp dưới
Tên phế quản | Tên Tiếng Anh | Thế hệ phân chia | Đường kính (mm) |
Khí quản | Trachea | 0 | 25 |
Phế quản gốc | Main bronchi | 1 | 11 - 19 |
Phế quản thùy | Lobar bronchi | 1 - 3 | 4 - 13 |
Phế quản phân thùy | Segmental bronchi | 3 - 6 | 4 - 7 |
Phế quản dưới phân thùy | Subsegmental bronchi | 4 - 7 | 3 - 6 |
Phế quản | Bronchi | 6 - 8 | 1,5 - 3 |
Phế quản tận cùng | Terminal bronchi | 9-15 | 1 |
Tiểu phế quản | Bronchioles | 0, 8 - 1 | |
Tiểu phế quản tiểu thùy phổi | Lobular bronchioles | 0,8 | |
Tiểu phế quản tận | Terminal bronchioles | 15 - 16 | 0,6 - 0,7 |
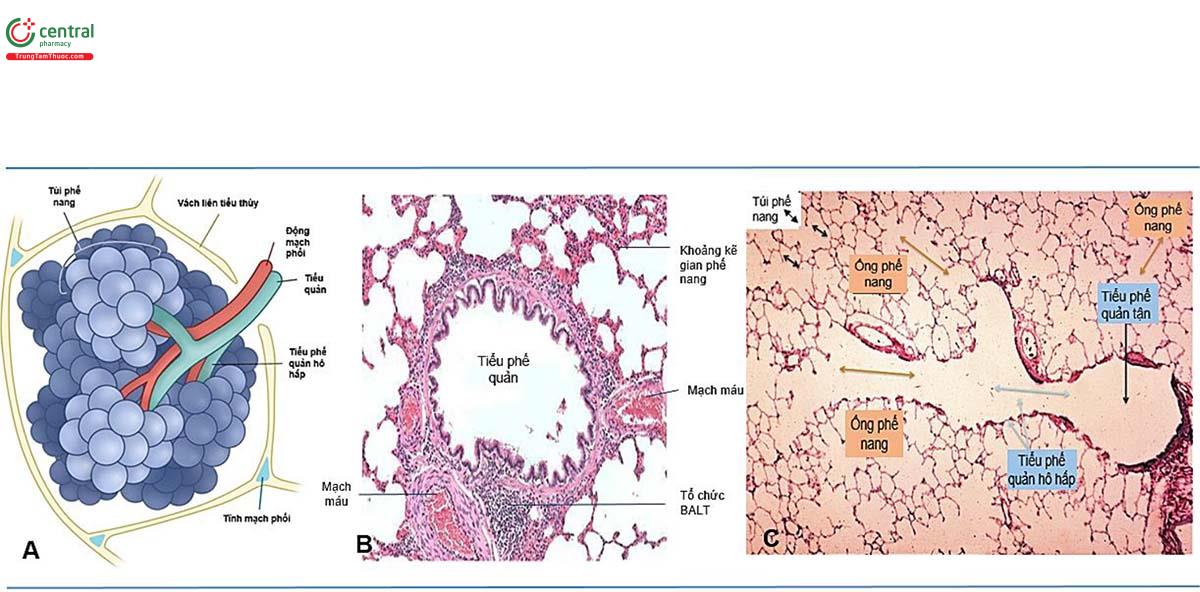
Khí quản, phế quản tới các tiểu phế quản tận là khu vực đường dẫn khí, không gắn với phế nang. Khí quản kéo dài từ thanh quản (ở vùng cổ) đến carina (trong khoang ngực). Thành khí quản có cấu trúc nâng đỡ với 15-20 vòng sụn hình chữ C xen kẽ với mô mềm. Cấu trúc thành màng (thành sau) nối hai đầu của các vòng sụn trong đó có chứa cơ trơn, có thể rút ngắn khoảng cách giữa các đầu của sụn, làm giảm đường kính của khí quản. Cơ trơn nằm giữa các vòng sụn (hay còn gọi là cơ liên sụn) cho phép, ở một mức độ nhỏ, điều hòa chủ động chiều dài khí quản. Việc rút ngắn khí quản có thể làm giảm sức cản luồng không khí bằng cách vừa giảm chiều dài của khí quản vừa tăng lực kéo lên hầu, làm cứng thành khí quản và chống xẹp khí quản. Ngược lại với khí quản, thành phế quản được hỗ trợ bởi các tấm sụn, không liên tục nên có mức độ biến dạng cao hơn so với các vòng sụn khí quản. Cấu trúc thành của các tiểu phế quản không có sụn, với cấu trúc thành bao gồm biểu mô gắn sát với màng đáy, lớp mô đệm và cơ trơn. Vách phế nang gắn với bên ngoài tiểu phế quản bắt đầu từ tiểu phế quản hô hấp (hình 3). Với cấu trúc như vậy, tính định hình của các tiểu phế quản là thấp. Những thay đổi về áp suất phế nang và sức căng trong mô phổi có ảnh hưởng lớn đến đường kính của tiểu phế quản. Các tiểu phế quản phân nhánh thành các ống phế nang kết thúc trong các túi phế nang.
Sự phân nhánh của đường dẫn khí dẫn đến sự gia tăng số lượng đường dẫn khí. Đường kính của mỗi đường thở giảm nhưng tổng đường kính hay tổng đường kính các mặt cắt ngang của đường dẫn khí tăng lên khi dần ra tới ngoại vi. Điều này có hai tác động chức năng nổi bật. Đầu tiên, tốc độ di chuyển của luồng khí giảm đi, dòng khí giảm chuyển động nhiễu loạn (turbulence). Thứ hai, tổng lực cản đối với luồng khí giảm theo cấp số nhân với sự gia tăng tổng bán kính của đường thở. Chỉ có khoảng 2% tổng sức cản đường thở là do các tiểu phế quản và ống phế nang gây ra. Tương tự như vậy, chỉ có sự giảm nhẹ áp suất nội lòng xảy ra dọc theo đường dẫn khí đầu xa bình thường trong thì thở ra. Sự sụt giảm áp suất tương đối nhỏ dọc theo đường thở nhỏ nằm trong phổi góp phần làm giảm thiểu xu hướng lòng phế quản nhỏ bị xẹp lại do bị đè ép bởi nhu mô phổi xung quanh có áp lực dương hơn trong thì thở ra. Như vậy có thể dễ dàng hình dung, ở các phế quản lớn, với số lượng ít, trở kháng phụ thuộc rất nhiều vào kích thước nội lòng. Nếu kích thước nội lòng giảm (co thắt phế quản, viêm phù nề hoặc ứ đọng dịch tiết) thì cần có chênh lệch áp lực lớn để đẩy khí đi qua khoảng hẹp và do vậy cần tăng công thở. Ngược lại, ở các phế quản nhỏ đầu xa, do số lượng nhiều, tổng diện tích mặt cắt lớn hơn nhiều nên phải có một số lượng đủ lớn đường thở nhỏ bị thu hẹp thì mới làm tăng công thở và tạo ra triệu chứng. Do vậy, khu vực đường thở nhỏ còn được lưu ý là “vùng yên lặng”. Trên biểu đồ hình 5 cho thấy trở kháng đường thở tăng ở các phế quản phân thùy, dưới phân thùy (tức là khoảng thế hệ thứ 4- 5) rồi sau đó giảm dần ra ngoại vi.

Phế nang được bao bọc bởi một lớp tế bào, tế bào biểu mô phế nang dạng vảy (squamous cell, hay tế bào type I). Các tế bào phế nang type II nằm xen kẽ trong thành phế nang có nhiệm vụ tạo ra lớp diện hoạt (surfactant). Màng ngăn cách giữa phế nang và mao mạch phổi (còn gọi là màng hô hấp) rất mỏng, có độ dầy <1μm, do hai lớp biểu mô phế nang và mao mạch phổi có chung màng đáy, tạo thuận lợi cho sự khuếch tán khí qua màng dễ dàng (hình 5).
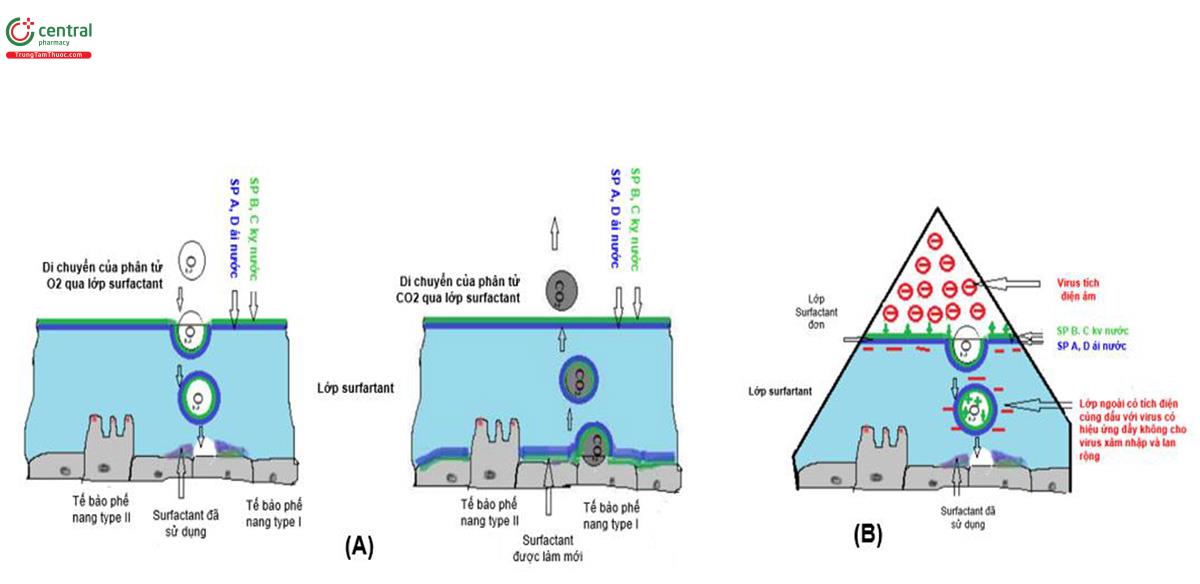
Lớp surfactant (còn gọi là lớp diện hoạt) lót mặt trong phế nang do các tế bào phổi type II tạo ra. Thành phần của surfactant gồm Phospholipid, chủ yếu là dipalmitoylphosphatidylcholine (DPPC), lipid trung tính (bao gồm cholesterol) và protein [1]. Các apoprotein surfactant không chỉ tham gia tạo ra sức căng bề mặt, góp phần tác động tới cơ học phổi mà còn tham gia vào các hoạt động điều hòa đáp ứng miễn dịch [2,3] và diệt khuẩn [2]. Sự thay đổi số lượng và thành phần của lớp surfactant là nguyên nhân của nhiều bệnh cấp và mạn tính [1]. Bề mặt lớp surfactant là các protein (surfactant protein, SP) B, C, các protein kỵ nước hoạt động làm giảm sức căng bề mặt, trong khi các SP A, D, là các protein ái nước nằm ở lớp bên dưới được cho là có vai trò như là hàng rào che chắn sự xâm nhập của bụi, vi sinh gây bệnh [4] (hình 6).
Các sợi Collagen và sợi đàn hồi (elastin) là thành phần của cấu trúc mô kẽ phổi, kết nối các proteoglycan và glycosaminoglycan của chất nền với các tế bào tạo nên bề mặt phổi, thành phế nang, mạch máu và đường thở. Cấu trúc nền ngoại bào sợi (fibrous matrix) này tạo thành một hệ thống kết nối các cấu trúc phổi với nhau (tức là đường dẫn khí, mạch máu, phế nang) [5]. Các sợi đàn hồi chịu trách nhiệm chính cho độ đàn hồi của mô phổi và xu hướng khôi phục hình dạng ban đầu của nó sau khi bị biến dạng. Các sợi collagen cứng hơn các sợi elastin. Khi phổi thu nhỏ, sợi collagen được cho là bị chùng xuống, ngược lại khi phổi phồng lên, các sợi collagen trở nên căng ra và tạo độ cứng cho mô, chống lại sự kéo căng quá mức của mô phổi (hình 7) [6].
Mô kẽ, ngoài các đặc tính tác động tới sự dãn ra và co lại của phổi, khoảng kẽ vách phế nang cũng tác động đến cơ học và chức năng của phổi. Sức căng khoảng kẽ vách phế nang có khuynh hướng kéo, làm thu nhỏ bề mặt diện trao đổi. Sức căng này tạo thêm lực co để làm thu nhỏ phổi trong thì thở ra nhưng ngược lại, làm cản trở sự dãn ra của phổi. Trương lực khoảng kẽ vách phế nang tạo áp lực đẩy khí từ các phế nang có bán kính nhỏ sang các phế nang có bán kính lớn hơn. Trong trường hợp trương lực mô kẽ vách phế nang quá cao có thể làm xẹp các phế nang nhỏ dẫn tới xẹp phổi. Trương lực khoảng kẽ vách phế nang cũng tác động lên áp suất chất lỏng trong khoảng kẽ và có thể đẩy nước ra khỏi mao mạch phổi vào khoảng kẽ và vào lòng phế nang gây phù kẽ, phù phế nang.
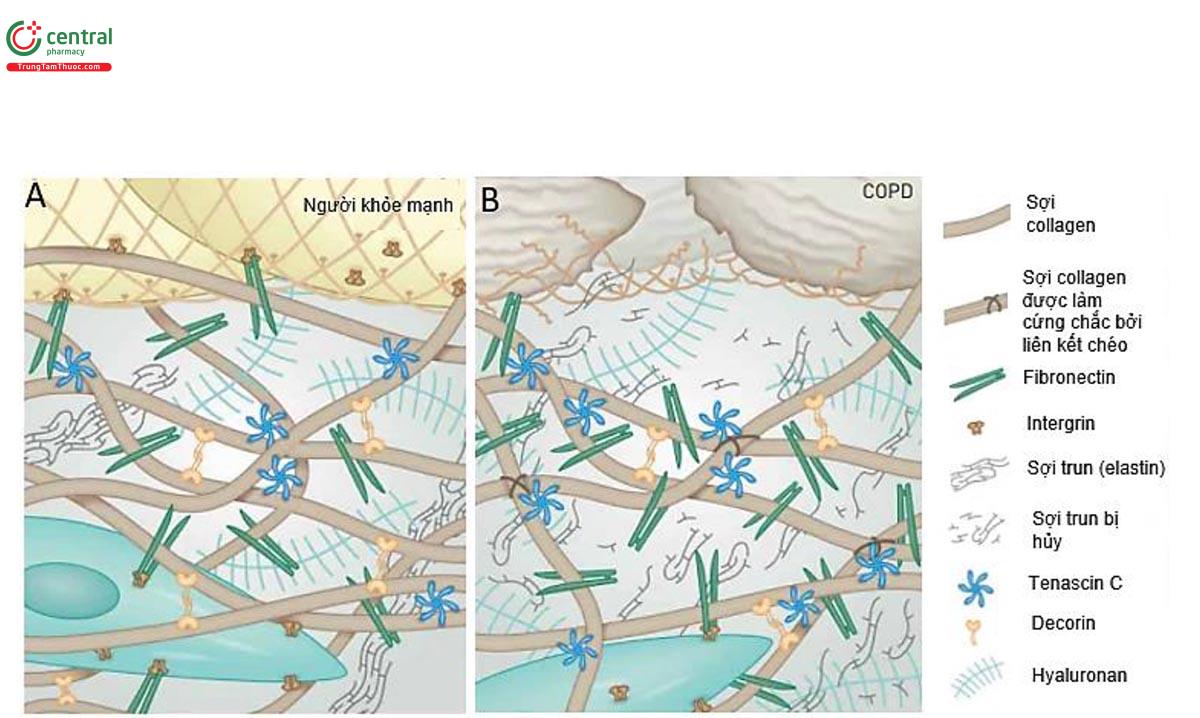
Cũng giống như ở tất cả các hệ thống cơ quan khác, cấu trúc nền ngoại bào (extracellular matrix, ECM) phổi được cấu thành bởi hai loại cấu trúc chính: i) Màng đáy, là những tấm glycoprotein mỏng bao phủ mặt đáy của biểu mô và nội mô mao mạch có các tế bào cơ, mỡ và thần kinh ngoại biên, bao quanh và ii) Ma trận (matrix, trong tài liệu này sẽ gọi là cấu trúc nền) khoảng kẽ, tạo thành một mạng lưới lỏng lẻo và giống như sợi, liên kết các loại tế bào cấu trúc trong các mô giúp duy trì tính liên kết ba chiều và các đặc tính cơ sinh học của phổi [6]. ECM là cấu trúc xác định khung của phổi đồng thời mang lại sự ổn định cơ học và độ đàn hồi, rất cần thiết cho chức năng sinh lý của phổi, một tạng hoạt động chức năng “động” liên tục. ECM cũng là nơi phát ra các tín hiệu sinh hóa và cơ sinh học (biomechanical) tầm tế bào để đóng vai trò quyết định trong sự phát triển của phổi, quá trình tái tạo mô và duy trì cân bằng nội môi ở người trưởng thành. Các nghiên cứu về sinh học protein (proteomic) đã chứng minh rằng có ít nhất 150 loại protein ECM, các glycosaminoglycan và các dạng enzyme biến đổi có trong phổi, chúng tập hợp thành các vật liệu sinh học tổng hợp phức tạp. Các tổ hợp protein ECM này tương tác và sửa đổi glycan của chúng để có thể hoạt động như một giao diện liên kết vững chắc với hàng trăm protein chế tiết để từ đó tạo ra những khuôn mẫu tín hiệu giàu thông tin cho hoạt động chức năng và sự biệt hóa của tế bào. Những thay đổi động trong ECM xảy ra khi bị thương hoặc quá trình lão hóa có liên quan đến một số bệnh phổi mạn tính [7].
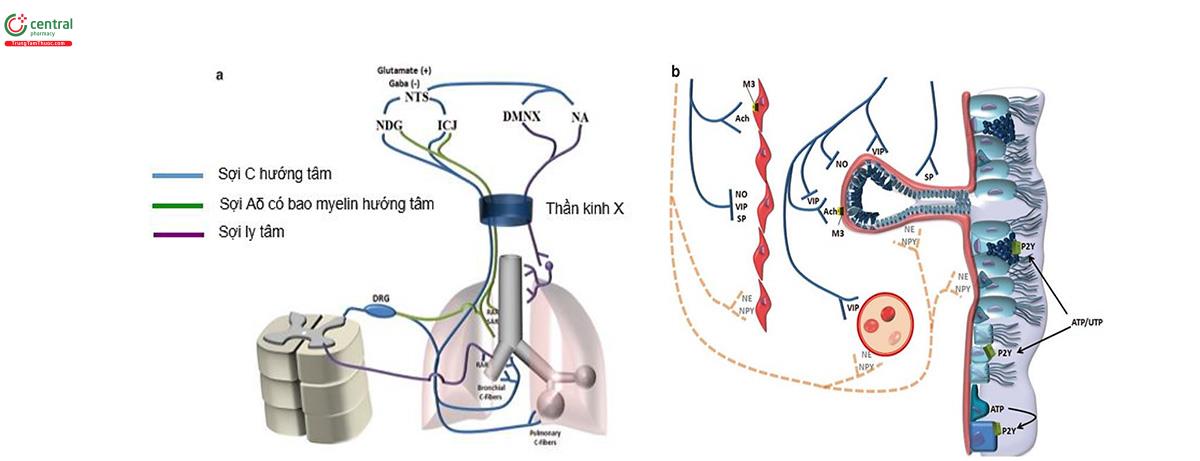
Phổi được phân bố thần kinh phó giao cảm, giao cảm và NANC (non-adrenergic non-cholinergic, hoạt động thần kinh với chất dẫn truyền không qua acetylcholine, adrenalin, noradrenalin). Hoạt động thần kinh giao cảm và giao cảm không-adrenergic thông qua các sợi thần kinh tủy sống (từ T1-T6). Hầu hết các sợi giao cảm hậu hạch ly tâm bắt nguồn từ hạch cổ trên và hạch lồng ngực. Hoạt động thần kinh phó giao cảm và phó giao cảm không-cholinergic thông qua dây thần kinh X (hình 8).
Cơ trơn đường hô hấp của con người có ít phân bố sợi giao cảm, trong khi các loài khác tác dụng co thắt và dãn của cơ trơn phế quản được điều khiển đáng kể qua trung gian giao cảm dựa trên sự có mặt của các thụ thể α- hoặc β- adrenoceptors trên màng sau synap [8]. Tương tự như vậy, ở người, vai trò kiểm soát của thần kinh giao cảm đối với các chất tiết của tuyến và biểu mô còn chưa được chứng minh [9].

Phân bố thần kinh phó giao cảm của phổi bao gồm các tế bào thần kinh hướng tâm và ly tâm. Các nơ-ron thần kinh phó giao cảm tiền hạch đi ra từ các nhân vận động lưng của dây X hoặc từ nhân mơ hồ (nhân mơ hồ là một phần của não kiểm soát một số cơ liên quan đến nói và nuốt, cũng như nhịp tim và hơi thở. Gọi là “mơ hồ” bởi vì nó không được xác định rõ ràng về hình dạng hoặc vị trí. Nó nằm ở hành tủy, là phần dưới của thân não). Các sợi hậu hạch bắt nguồn từ các đám rối trong thành khí quản kết hợp với niêm mạc, lớp dưới niêm mạc, cơ trơn, các lớp quanh khí quản và quanh phế quản [10]. Các sợi hướng tâm thoát ra khỏi phổi đi theo dây X đến hạch nút và hạch cổ (hình 8) và hạch nội sọ, từ đó có đầu ra đi vào nhân đơn độc. Các tế bào thần kinh hướng tâm bao gồm các sợi Aδ có bao myelin và các sợi C không có bao myelin. Các sợi Aδ có các đầu tận cùng gắn vào cấu trúc nền ngoại bào của niêm mạc làm cho chúng có khả năng phản ứng với biến dạng cơ học của thành đường thở [11]. Các sợi nhạy cảm cơ học Aδ có thể được phân tách thành các kiểu hình chức năng thích ứng chậm (slowly adapting, SAR) và thích ứng nhanh (rapidly adapting, RAR). Với các SAR, hoạt động có liên quan đến phản xạ điều hòa làm phồng phổi và làm giảm phồng phổi (ví dụ: phản xạ Hering-Breuer, phản xạ giữ cho phổi không bị căng quá mức khi hít vào). RAR có đa hình thức và liên kết với các phản xạ bảo vệ như ho và hắt hơi [12]. Các sợi C hướng tâm phổi là các sợi nhỏ, không có bao myelin, tận cùng ở thành đường thở, mạch máu và nhu mô. Tương tự như các cơ quan thụ cảm đau trong các mô khác, các sợi này là đa hình và thường được phân loại là cơ quan thụ cảm hóa học [13]. Các sợi C trong phổi được phân thành hai nhóm, phế quản và phổi, dựa trên sự tuần hoàn tưới máu cho các mô mà chúng chi phối.
Ngoài các sợi giao cảm adrenergic và phó giao cảm cholinergic thông thường, đường hô hấp trên và dưới chứa đầy các tế bào thần kinh giải phóng các chất dẫn truyền không-cholinergic không- adrenergic, phối hợp với hoặc độc lập với acetylcholine và norepinephrine. Các neuron non- adrenergic non-adrenergic (NANC) ban đầu được gọi là một phân nhóm tế bào thần kinh rời rạc [9], nhưng ngày càng có nhiều tài liệu về các tế bào thần kinh này như là các phân nhóm của tế bào thần kinh giao cảm và phó giao cảm [8]. Sự giải phóng các chất dẫn truyền thần kinh, đặc biệt là các chất dẫn truyền NANC, dẫn đến kiểm soát nội tại các chức năng đường thở, bắt đầu các phản ứng hoặc điều chỉnh các phản ứng trung gian. Mặc dù kém phát triển hơn ở ruột, mạng lưới thần kinh trong thành đường thở rất rộng và thể hiện một số khả năng kiểm soát các chức năng của đường thở mà không cần sự truyền đi từ hệ thống thần kinh trung ương. Mặc dù còn thiếu bằng chứng thực nghiệm trực tiếp về tầm quan trọng của việc kiểm soát nội tại trương lực đường thở và hoạt động chế tiết, nhưng thực tế là đường thở trong phổi khi được cấy ghép có thể hoạt động tương đối bình thường trong nhiều năm mà không cần sự phân bố thần kinh từ bên ngoài là lập luận ủng hộ một số cơ chế nội tại có thể duy trì sự thông thoáng của đường thở và bảo vệ đường thở khỏi các tác động của môi trường [10] (hình 9).
Trong khi SAR phản ứng chủ yếu với các phản xạ điều hòa (hiểu nôm na là “đối nội”) thì RAR và sợi C phản ứng đa phương thức, đáp ứng với các kích thích xúc giác đa dạng bao gồm nhiệt độ, độ a-xít và thẩm thấu có khả năng điều hòa trương lực cơ và tính thấm mạch máu trong điều kiện bình thường và bệnh lý, chịu trách nhiệm về các phản xạ bảo vệ (hiểu nôm na là “đối ngoại”) [14]. Các kênh cation tiềm năng thụ thể tạm thời (là một nhóm các kênh ion nằm chủ yếu trên màng sinh chất của nhiều loại tế bào động vật - Transient receptor potential cation channels, TRP) có liên quan trong việc truyền dẫn các kích thích từ môi trường vào các tế bào có liên quan tới sinh lý phản hồi. Các kênh TRP được thể hiện trên nhiều loại tế bào trong thành đường dẫn khí, bao gồm cả tế bào thần kinh.
Trong điều kiện bình thường, tế bào thần kinh SAR, tế bào thần kinh RAR và tế bào thần kinh sợi C là các quần thể riêng biệt về mặt sinh lý và giải phẫu [14]. Có bằng chứng gián tiếp ủng hộ giả thuyết rằng hệ thống thần kinh phế vị bị rối loạn điều hòa trong bệnh phổi tắc nghẽn mạn tính. Sự rối loạn điều hòa này có thể dẫn đến tăng nhạy cảm của phản xạ ho làm cho cơn ho đôi khi trở nên “không có tác dụng” hoặc không phù hợp. Rối loạn điều hòa phế vị cũng có thể dẫn đến sự gia tăng hoạt động kiểm soát phản xạ phó giao cảm đường thở, góp phần tăng tiết chất nhầy và tăng co cơ trơn phế quản [15].
2 PHẢN XẠ VÀ ĐIỀU HÒA PHẢN XẠ
Các phản xạ trong hệ thống hô hấp được chia thành hai loại, điều hòa và bảo vệ. Phản xạ điều hòa có bản chất làm cân bằng nội môi. Các thông số sinh lý được theo dõi, thông khí và tưới máu được điều chỉnh thông qua phản xạ để duy trì thành phần của máu động mạch đồng thời tối đa hóa hiệu quả hô hấp và trao đổi khí. Các thông số sinh lý chính được theo dõi trong phản xạ điều hòa là biến dạng cơ học của đường thở và mạch máu, CO2 thông qua pH và áp suất riêng phần O2 máu động mạch (PaO2). Ngược lại, phản xạ bảo vệ đáp ứng lại với các kích thích từ môi trường để bảo vệ chức năng tim phổi. Thành phần hoặc chất lượng của không khí được giám sát. Các chức năng thông khí, tưới máu và niêm mạc được điều chỉnh để giảm thiểu sự tiếp xúc của các mô với các yếu tố gây thương tích hoặc bất lợi. Các thông số chính gây ra phản xạ bảo vệ là những thay đổi về cảm giác xúc giác, nhiệt độ, độ a-xít và cấu trúc phân tử ở bề mặt niêm mạc.
Phản xạ điều hòa duy trì nồng độ O2, CO2 và pH là chức năng chính của hệ hô hấp. Các phản xạ cơ bản liên quan đến sự thay đổi O2, CO2 và pH với thông khí phổi. Trong điều kiện bình thường, tăng CO2 và giảm oxy máu là những tác nhân kích thích chính đối trung tâm hô hấp (central pattern generator, CPG) ở thân não. Khi ngủ, ở người bình thường, độ nhạy cảm với CO2 giảm, dẫn đến tăng PaCO2 từ 3–6mmHg [16,17]. Người bình thường vẫn nhạy cảm với những thay đổi nhỏ của CO2 trong khi ngủ và phản ứng tạo ra những thay đổi về thông khí giúp duy trì PaCO2 trong phạm vi hẹp và trên ngưỡng ngưng thở [18]. Ngoài sự điều hòa từ trung tâm hô hấp, bản thân đường hô hấp dưới cũng phản ứng với sự biến dạng cục bộ của đường thở và mô phổi dẫn đến phản ứng điều hòa đường kính đường thở, điều hòa hô hấp và chức năng tim. Trong số ba loại sợi cảm giác được thấy trong đường thở - SAR, RAR và sợi C thì các tế bào thần kinh SAR có liên quan chặt chẽ nhất với các phản xạ điều hòa. Kích thích các sợi cảm giác dẫn đến tăng nhịp tim, dãn cơ trơn đường thở, ức chế hít vào và kéo dài thời gian thở ra [19-21].
Các phản xạ bảo vệ làm trung gian cho những thay đổi trong quá trình thanh thải chất nhầy, hắt hơi và ho, để chủ động loại bỏ các tác nhân hít vào ra khỏi đường thở. Những thay đổi có tính phản xạ trong thông khí và tưới máu làm hạn chế sự xâm nhập của các tác nhân bị hít vào tới phổi và các cơ quan khác. So với các sợi SAR liên quan đến phản xạ điều hòa, tế bào thần kinh RAR và sợi C thể hiện độ nhạy cao hơn đối với kích thích xúc giác, pH và các tác nhân hóa học. Chúng đóng vai trò chính trong phản xạ bảo vệ. Tế bào thần kinh RAR có khả năng phản ứng cả với biến dạng cơ học và cả với các chất kích thích trong khí hít vào (ví dụ: khói và amoniac) [19] cũng như với các dung dịch có độ thẩm thấu thấp [20]. Sợi C ít nhạy cảm hơn với biến dạng cơ học nhưng rất nhạy cảm với sự thay đổi pH, hóa chất (ví dụ: ozon và capsaicin), dung dịch có độ thẩm thấu cao và thay đổi nhiệt độ [19,20]. Phản ứng của các thụ thể RAR có liên quan đến ho, co thắt phế quản và tiết nhầy [21]. Kích hoạt sợi C dẫn tới ho, thở nhanh nông và ngưng thở, co thắt phế quản, tăng tiết chất nhầy, nhịp tim chậm và hạ huyết áp [19-21].
Trong điều kiện bình thường, tế bào thần kinh SAR, RAR và sợi C là các phân nhóm khác biệt về mặt sinh lý và giải phẫu. Phản ứng với các kích thích riêng, thể hiện các phản ứng tạm thời riêng đối với các kích thích và kết thúc ở các vùng riêng biệt trong nhân đơn độc ở hành não (nucleus tractus solitarius, NTS). Tuy nhiên, kết quả đi ra từ NTS ở các tế bào thần kinh não và tủy sống để kiểm soát thông khí, chức năng tim, đường kính đường thở, tiết nhầy, nước bọt và đau, dẫn đến sự chồng chéo đáng kể trong các phản ứng ly tâm đối với sự kích hoạt SAR, RAR và sợi C [19]. Hơn nữa, sự khác biệt về sinh lý giữa các phân lớp tế bào thần kinh trở nên mờ nhạt trong tình trạng viêm, điều này có thể thay đổi kiểu biểu hiện của các kênh TRP (kênh cation tiềm năng thụ thể tạm thời) trong tế bào, làm tăng tính đa dạng của các kích thích kích hoạt từng phân nhóm nơ-ron.
Ho vừa là một cơ chế bảo vệ cấp tính để loại bỏ mầm bệnh, hóa chất và mảnh vụn khỏi đường thở, vừa là một biểu hiện mạn tính do kích thích của nhiễm trùng và viêm. Phản xạ ho có thể được bắt đầu thông qua các kích thích cơ học hoặc hóa học thông qua các con đường hướng tâm của dây X. Có ít nhất hai con đường kích hoạt phản xạ ho cùng tồn tại. Một con đường được kích hoạt bởi capsaicin và bị ức chế khi gây mê, và một con đường khác không được kích hoạt bởi capsaicin và vẫn bảo tồn khi gây mê. Con đường được kích hoạt bởi capsaicin được liên kết với các sợi C phế quản phổi [11]. Các sợi C thể hiện các kênh cation tiềm năng của thụ thể tạm thời, TRPV1, giúp chúng có khả năng đáp ứng với capsaicin và TRPA1, được kích hoạt bởi acrolein trong khói thuốc lá, allyl isothiocyanate và nicotin [22]. Chúng tận cùng ở niêm mạc, dưới niêm mạc, nhu mô và mạch máu từ thanh quản đến ngoại vi phổi. Ho xảy ra do có kích hoạt hóa học sợi C và thường là kịch phát. Ho cũng có thể được bắt đầu bởi các thụ thể trong thanh quản, khí quản và phế quản lớn kích hoạt các sợi Aδ. Trái ngược với ho do sợi C gây ra, ho do sợi Aδ hiếm khi kịch phát [14].
3 HOẠT ĐỘNG THANH THẢI NHẦY - LÔNG CHUYỂN (MUCOCILIARY CLEARANCE) VÀ KIỂM SOÁT TIẾT NHẦY
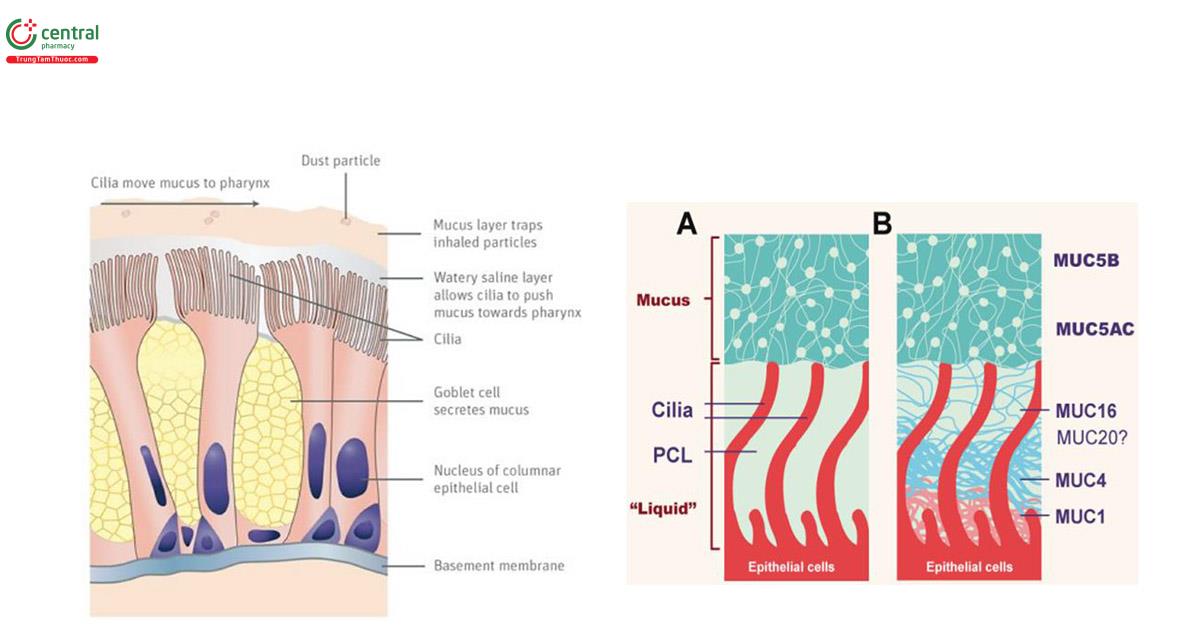
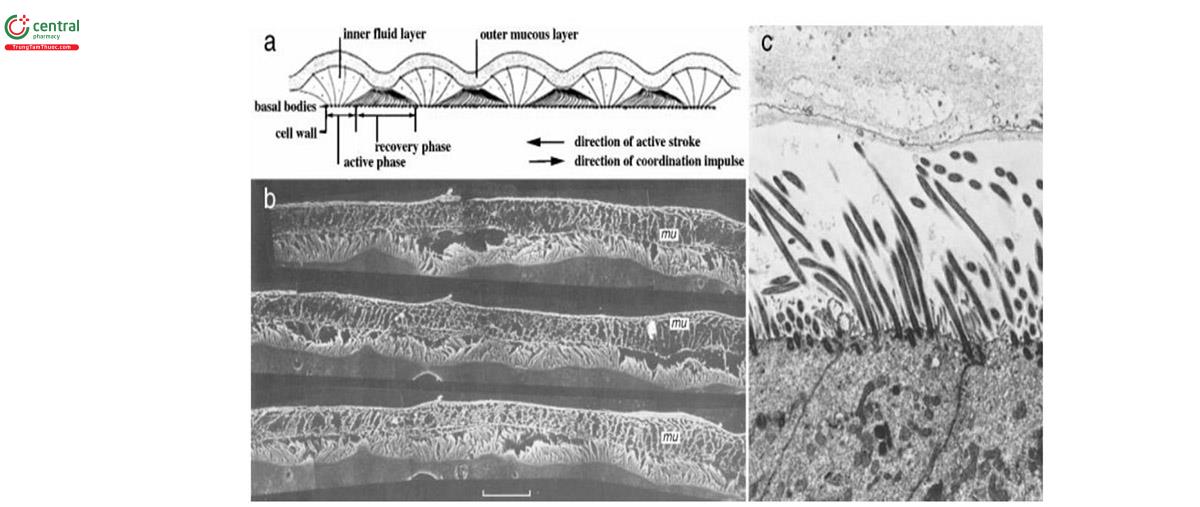
Các hạt theo khí thở đi vào đường thở, lắng đọng trên bề mặt niêm mạc đường thở sẽ bị bắt dính và mắc lại trong lớp gel nhầy nổi trên bề mặt biểu mô đường thở. Lớp nhầy (mucin) bề mặt đường thở gồm hai lớp. Lớp dưới là một màng mỏng 7μm dịch nhầy lỏng ion hóa (phase sol) bao quanh các lông chuyển và cho phép lông chuyển chuyển động. Ở phía trên lớp dịch này được bổ sung thêm một lớp dịch nhầy dính (phase gel) dày khoảng 7-70μm có khả năng bắt dính các hạt lọt vào đường thở [23,24] (hình 10).
Ở đường hô hấp lớn, 95% chất nhầy được tiết ra từ các tuyến dưới niêm mạc và chỉ 5% có nguồn gốc từ tế bào hình đài (hay hình cốc, goblet) biểu mô bề mặt, nhưng ở đường hô hấp < 2mm, các tế bào không có lông ở biểu mô bề mặt là nguồn duy nhất cung cấp glycoprotein chất nhầy [25] .
Chất nhầy niêm mạc
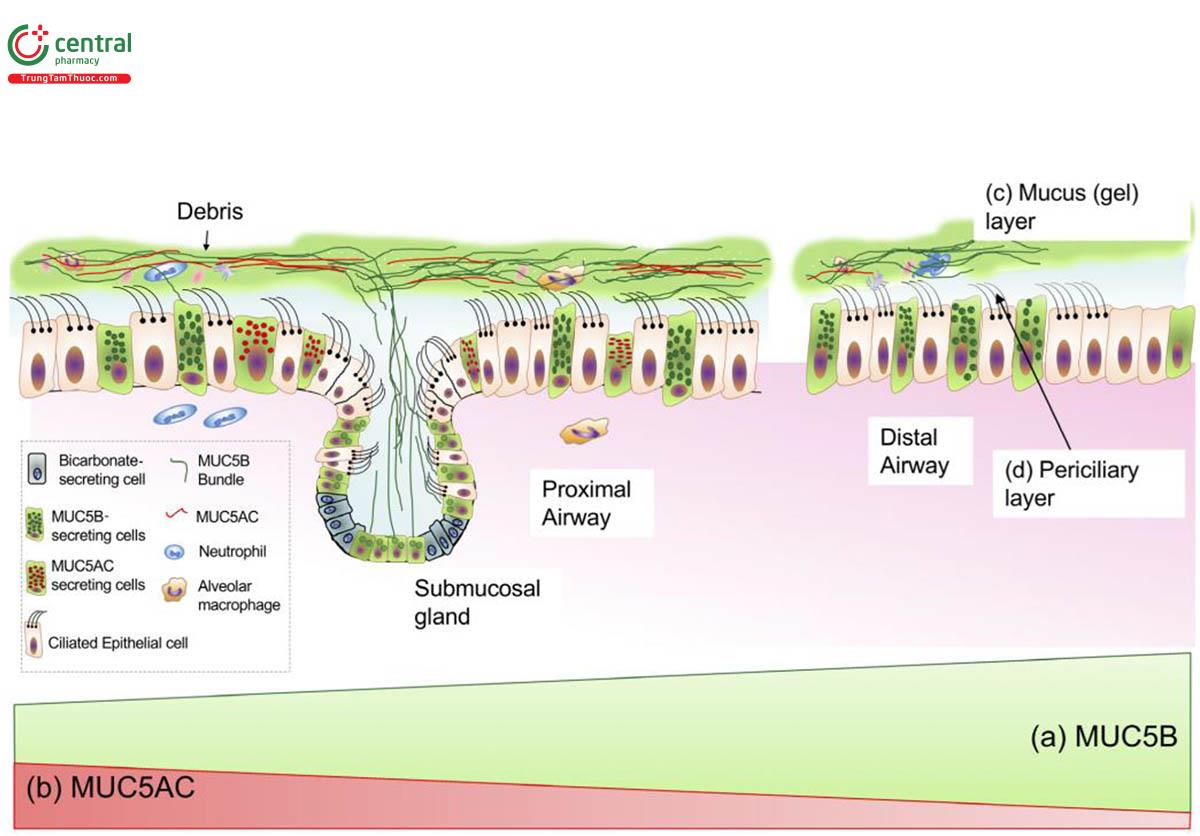
Chất nhầy có 80% thành phần là carbohydrate [26] cho phép chúng tích tụ nước để hình thành chất nhầy. Lớp dịch nhầy phía trên (pha gel) bao gồm MUC5AC và MUC5B, chiếm 90% thành phần đờm. Lớp dịch nhầy quanh lông chuyển (pha sol) bao gồm MUC1, MUC4, MUC16, chiếm 10% thành phần đờm (hình 10,12).
Chất nhầy có thành phần là glycoprotein phức tạp và được phân loại theo khung protein và được mã hóa theo số thứ tự trên gen MUC (viết tắt từ chữ mucin) định vị trên nhiễm sắc thể [27]. Các glycoprotein trong chất nhầy tham gia vào quá trình hoạt động thanh thải của hệ thống nhầy-lông chuyển và cũng góp phần vào hoạt động của hệ thống miễn dịch bẩm sinh đường thở. Các kích thích cấp tính đối với đường thở (bao gồm khói bụi, nhiễm trùng, chất gây dị ứng) kích hoạt các chất trung gian gây đáp ứng viêm/miễn dịch phổi. Một số chất trung gian hóa học khởi động nhanh quá trình tăng tiết tạo ra và giải phóng nhanh (trong vài phút) dịch nhầy từ các hạt chế tiết có trong các tế bào hình đài ra tới bề mặt lớp tế bào biểu mô (hình 13). Dịch nhầy tăng tiết tạo ra một cơ chế bảo vệ bẩm sinh đối với biểu mô đường thở bằng cách tăng kết dính các hạt, các tế bào viêm mà cơ chế tầm phân tử chúng ta vẫn còn chưa biết rõ [27].
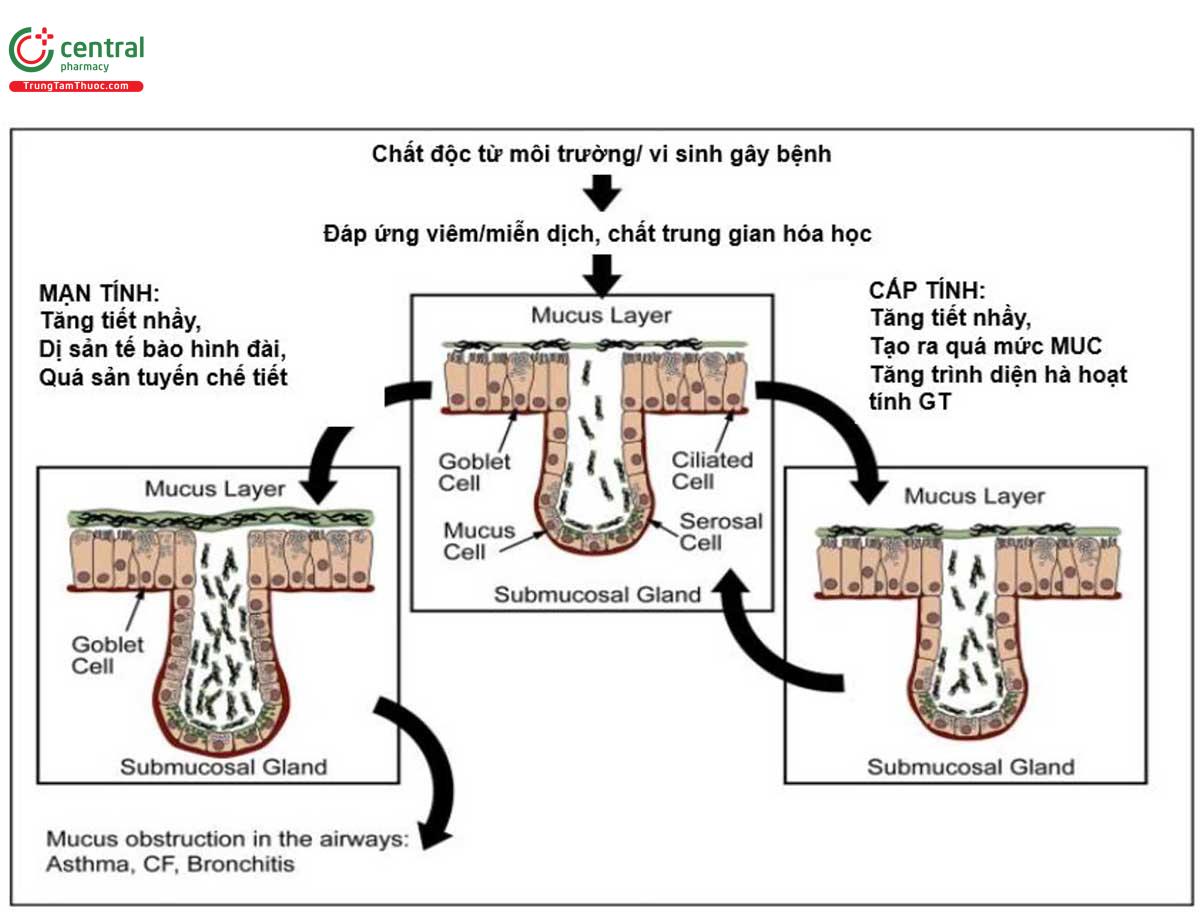
Khi không có các tác nhân kích thích, chất nhầy đường thở được tạo ra quá mức ở những bệnh nhân mắc các bệnh mạn tính về đường hô hấp (như hen, viêm phế quản mạn tính/COPD và CF) có thể liên quan tới hiện tượng tăng sản tế bào hình đài (goblet cell hyperplasia, GCH). Hiện tượng GCH có lẽ liên quan tới mô hình tái cấu trúc (remodeling) cấu trúc niêm mạc đường thở [28] mặc dù cơ chế cụ thể trong từng bệnh chúng ta cũng còn chưa biết rõ. Viêm mạn tính đường thở do bụi, khói có lẽ là cơ chế trung gian cho sự hình thành GCH trong viêm phế quản mạn tính/COPD.
Đường hô hấp trung tâm của bệnh nhân viêm phế quản mạn tính/COPD bị viêm mạn tính với số lượng đại thực bào và tế bào lympho T tăng lên [29]. Tương ứng với đặc điểm viêm tế bào, có sự gia tăng nồng độ IL-6, IL-1β, IL-8, TNF-α và protein hóa ứng động bạch cầu đơn nhân -1 trong đờm hoặc trong dịch rửa phế quản – phế nang ở bệnh nhân COPD giai đoạn ổn định [30]. Trong các đợt cấp, có hiện tượng tăng bạch cầu đa nhân trung tính, chemokine bạch cầu đa nhân trung tính và trình diện thụ thể [31]. Bạch cầu đa nhân trung tính và đại thực bào giải phóng các Protease góp phần tạo ra môi trường viêm và lấn át hệ thống kháng protease bảo vệ. Ngoài ra, các chất có gốc oxy phản ứng (reactive oxygen species, ROS), được tạo ra bởi khói thuốc lá hoặc bởi các tế bào viêm, có thể hoạt động như các phân tử truyền tín hiệu, điều chỉnh chức năng tế bào hoặc gây ra stress oxy hóa và phá hủy các phân tử sinh học, gây tổn thương đường thở và nhu mô [32]. Phối hợp cùng với nhau, các chất trung gian này làm tổn thương đường thở, kích hoạt các chương trình tu sửa (bao gồm GCH) và/hoặc điều hòa gen MUC.
Một số mô hình in vivo thực nghiệm đã chứng minh rằng khói thuốc lá làm tăng quá trình viêm và tăng sản tế bào chế tiết đường thở, bất kể đó là khói thuốc hay các chất chiết suất từ khói thuốc [33,34]. Thành phần aldehyde trong khói thuốc làm tăng trình diện gen MUCA5C ở phổi chuột [35] và làm tăng sản tế bào chế tiết [27].
Khói bụi (hay các chất ô nhiễm không khí nói chung) cũng gây ra hiện tượng dị sản tế bào chế tiết trong các mô hình in vivo thực nghiệm trên động vật. Việc tiếp xúc với sulfur dioxide gây ra tăng sản tế bào chế tiết bề mặt niêm mạc ở chuột [36] và phì đại tuyến nhầy ở chó [37] . Ozone gây ra tăng sản tế bào tiết nhầy ở biểu mô đường hô hấp ở mũi chuột [38]. Hoạt tính phân giải protein của elastase bạch cầu đa nhân trung tính kích thích tăng sản tế bào tiết nhầy phế quản ở chuột [39]. Điều đáng chú ý là tình trạng viêm liên quan đến khói thuốc lá hoặc các chất ô nhiễm dường như làm trung gian cho sự phát triển của tăng sản tế bào chế tiết. Khái niệm này được hỗ trợ bởi bằng chứng cho thấy điều trị glucocorticoid làm giảm tác động của khói thuốc lá hoặc ozone trên tăng sản tế bào tiết [27].
Vi khuẩn, bao gồm S. aureus, S. pneumoniae và H. influenzae, là những vi khuẩn gây bệnh phổ biến trong các đợt cấp COPD. Các sản phẩm của vi khuẩn điều chỉnh sự trình diện gen mucin trong các dòng tế bào biểu mô in vitro [27]. Trên in vivo, nội độc tố hoặc lipopolysacarit (LPS), một thành phần của màng tế bào vi khuẩn Gram âm, làm tăng số lượng tế bào hình đài trong biểu mô đường thở chuột [40,41]. Nội độc tố cũng làm tăng sản tế bào bào chế tiết khi có kích thích ozone trên biểu mô mũi chuột [42]. Điều này cho thấy nhiễm trùng và các chất ô nhiễm phối hợp với nhau để làm trầm trọng thêm quá trình tăng sản tế bào chế tiết. Paramyxovirus cũng gây ra tăng sản tế bào chế tiết in vivo trên mô hình gây hen thực nghiệm ở chuột [43]. Những nghiên cứu này chứng minh tác dụng mạnh mẽ của các tác nhân nhiễm trùng đối với việc hiện tượng tăng sản tế bào chế tiết, từ đó dẫn đến tăng sản xuất chất nhầy. Có khả năng một số chất trung gian viêm (mediator) tương tác có tính hiệp đồng với các chất ô nhiễm, tác nhân nhiễm trùng và chất trung gian viêm do bạch cầu đa nhân trung tính tạo ra để tăng cường quá trình tái cấu trúc mà đỉnh điểm là sản xuất quá mức chất nhầy và tăng tiết quá mức trong tình trạng bệnh đường hô hấp [27].
Trong một bài viết với tựa đề “Tích tụ chất nhầy đường thở trong COPD: nghịch lý cholinergic!”, Burgel P-R nhận định rằng kích thích cholinergic làm tăng độ thanh thải chất nhầy nhưng thuốc kháng cholinergic lại là trị liệu trong COPD. Cũng chính tác giả này lý giải rằng trương lực cholinergic đã tăng quá mức ở bệnh nhân COPD và các thuốc kháng muscarinic có tác dụng có lợi, có khả năng điều hòa được một phần bởi tác dụng trong việc giảm chất nhầy. Sự tích tụ chất nhầy, liên quan đến việc sản xuất và bài tiết chất nhầy quá mức trên đường thở và là một đặc điểm đã được xác định trên đường thở của bệnh nhân COPD. Viêm phế quản mạn tính thường được cho là do viêm và tăng tiết chất nhầy đường thở bởi các tế bào chế tiết của biểu mô đường thở và các tuyến dưới niêm mạc ở đoạn gần đường thở [44]. Ở đường thở xa, nơi không có tuyến dưới niêm mạc, chất nhầy đường thở được cho là có nguồn gốc từ tế bào biểu mô đường thở và tình trạng ứ chất tiết gây bít tắc đường thở có liên quan đến hạn chế luồng khí [45] và khả năng sống sót [46]. Mặc dù mục tiêu tích tụ chất nhầy có thể là một lựa chọn điều trị ở bệnh nhân mắc COPD, nhưng các loại thuốc hiện tại chỉ có tác dụng hạn chế trong việc sản xuất, bài tiết và/hoặc thanh thải chất nhầy dư thừa [47]. Những khó khăn trong việc đạt được tiến bộ trong lĩnh vực này bao gồm việc thiếu các mô hình động vật thích hợp (vì loài gặm nhấm có ít tuyến dưới niêm mạc đường thở) và sự phức tạp trong việc nghiên cứu sự điều hòa sản xuất chất nhầy, thành phần của chất nhầy đường thở và độ thanh thải của chất nhầy. Sự phát triển của các mô hình động vật mới ở động vật lớn hơn, trong đó cấu trúc đường thở giống với cấu trúc ở người hơn và sự tiến bộ trong các công cụ nghiên cứu hàm lượng chất nhầy và độ thanh thải chất nhầy, đã dẫn đến những tiến bộ gần đây trong sự hiểu biết của chúng ta về đặc điểm chính này của bệnh đường thở mạn tính [48]. Trong một nghiên cứu trên đường thở súc vật thí nghiệm đã cắt rời (ex-vivo), Lin và cs [49] kết luận rằng khói thuốc lá làm giảm nước trong chất nhầy (chiều cao của lớp dịch pha sol giảm), giảm chuyển động của nhung mao và kết quả là làm giảm dịch chuyển lớp dịch nhầy, tăng tích tụ dịch nhầy trên đường thở. Đặc biệt, tác giả còn ghi nhận kích thích cholinergic bằng carbachol cải thiện được tình trạng trên. Xử lý carbachol trong 30 phút tăng độ dầy lớp chất lỏng bề mặt đường thở, tăng tần số đập của lông chuyển và tăng tồc độ vận chuyển chất nhầy trên khí quản động vật thí nghiệm. Tuy nhiên, hạn chế của nghiên cứu là không nhận định được tình trạng tích tụ dịch ở đường thở xa, tình trạng quá tiết và nhận định rằng kích thích cholinergic cải thiện được tình trạng tích tụ chất nhầy trên đường thở chưa được nhiều tác giả chấp nhận vì tăng trương lực cholinergic trong hệ thống cả thần kinh và không thần kinh (neuronal và non-neuronal) là bản chất bệnh học trong COPD [50,51] và kháng muscarinic vẫn được xem là một trị liệu căn bản trong COPD [52].
4 PHÂN BỐ CÁC RECEPTOR ĐÍCH CỦA THUỐC ĐIỀU TRỊ Ở PHỔI
Hầu hết các loại thuốc hiện đang được sử dụng để điều trị các bệnh hô hấp thông thường đều tương tác với các thụ thể tế bào trên đường hô hấp. Chúng bao gồm chất chủ vận beta2- adrenoceptor, chất đối kháng thụ thể muscarinic (thuốc kháng cholinergic), corticosteroid và chất đối kháng thụ thể cysteinyl-leukotriene-1 (cys-LT1) (antileukotrienes). Sự phân bố các thụ thể đối với các chất chủ vận hoặc chất đối kháng này là yếu tố quan trọng quyết định cơ chế hoạt động của thuốc điều trị vì nó xác định tế bào nào có thể là mục tiêu nhắm tới của các loại thuốc trên nhưng nó cũng xác định các tác dụng phụ, vì hầu hết các thụ thể này cũng được phân bố rộng rãi trong cơ thể. Điều này đã dẫn đến sự phát triển của phương pháp phân phối các loại thuốc này qua đường hít (thuốc chủ vận beta2, thuốc kháng cholinergic và corticosteroid) nhằm tối đa hóa tác dụng trên đường hô hấp và giảm thiểu tác dụng phụ toàn thân. Đối với thuốc kháng leukotrien, các thụ thể liên quan phần lớn chỉ giới hạn ở đường hô hấp và do đó sử dụng toàn thân ít tạo ra tác dụng phụ bất lợi đáng kể ngoài phổi, do đó việc đưa thuốc vào phổi qua đường hít không có lợi thế. Sự phân bố các thụ thể rõ ràng là một yếu tố quan trọng quyết định tác dụng lâm sàng của thuốc và điều này rất phù hợp với các loại thuốc mới đang trong quá trình phát triển có thể nhắm vào các thụ thể mới hoặc các phân nhóm thụ thể cụ thể của các thụ thể đã biết.
Thụ thể adrenergic (Adrenoceptors)
Thụ thể adrenergic hiện diện với nồng độ cao trong mô phổi. Các nghiên cứu lập bản đồ bức xạ tự động (autoradiographic mapping) cho thấy chúng tập trung ở một số loại tế bào [53,54] (hình 14). Các nghiên cứu cho thấy khoảng 70% thụ thể ở phổi thuộc phân nhóm 2 (beta2 receptor) [55,56]. Các thụ thể này được định vị ở cơ trơn đường thở, biểu mô, cơ trơn mạch máu và các tuyến dưới niêm mạc [57], trong khi các thụ thể beta1 được định vị ở các tuyến dưới niêm mạc. Có sự phân bố đồng đều các thụ thể beta1/beta2 trên thành phế nang với tỷ lệ thụ thể là 2:1 [58,59].
Cơ trơn đường thở có mật độ thụ thể beta2 không thay đổi ở các cấp độ đường thở khác nhau, do đó các tiểu phế quản có mật độ tương tự như các đường thở lớn. Điều này cho thấy thuốc chủ vận beta2 có thể làm dãn phế quản ở tất cả các cấp độ đường thở. Đặc điểm phân bố này đặc biệt quan trọng trong bệnh hen và COPD, nơi có liên quan đến đường hô hấp nhỏ.
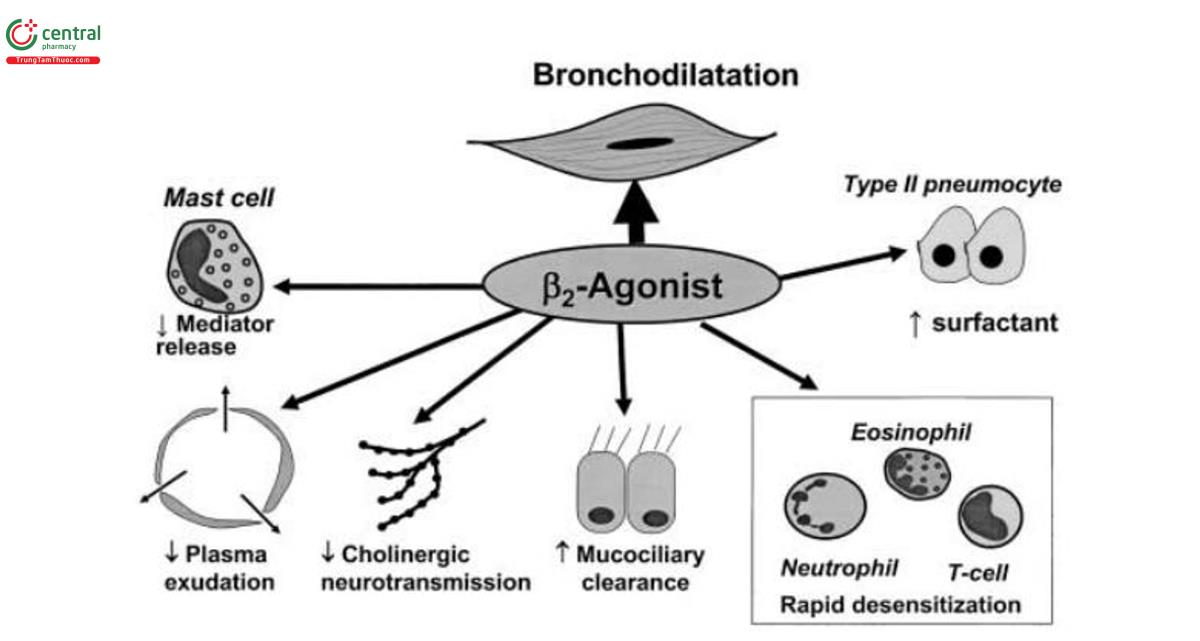
Thụ thể beta2 trên tế bào mast cũng tạo ra nhiều hiệu ứng khác trên đường hô hấp [54]. Chúng ức chế sự giải phóng histamine và cysteinyl-leukotrien trong nghiên cứu từ phổi người cắt nhỏ và tế bào mast phổi đã được làm sạch [60]. Thuốc chủ vận beta2 dạng hít có tác dụng bảo vệ, chống co thắt phế quản do Adenosine gây ra qua trung gian khử hạt tế bào mast mạnh hơn so với co thắt phế quản do histamine và methacholine gây ra. Điều này cho thấy tác dụng ức chế bổ sung của chất chủ vận beta2 dạng hít đối với tế bào mast [61,62]. Do vậy, có thể thấy là quan trọng khi sử dụng chất chủ vận beta2 như là thuốc dự phòng hen do tiếp xúc với dị nguyên, do gắng sức thể lực cũng như trong bệnh hen nặng và các đợt cấp tính nặng, tất cả các tình huống trên đều liên quan đến hoạt hóa tế bào mast. Điều thú vị là thuốc chủ vận beta2 dạng hít có hiệu quả hơn thuốc chủ vận beta2 đường uống khi cùng có tác dụng dãn phế quản trong việc bảo vệ chống lại bệnh hen do gắng sức thể lực [63]. Chất chủ vận beta2 cũng ức chế sự giải phóng acetylcholine từ dây thần kinh cholinergic, do đó làm giảm co thắt phế quản qua phản xạ thần kinh cholinergic [53]. Đây là đặc điểm đồng vận quan trọng của thuốc kích thích beta2.
Sự thoát huyết tương (plasma exudation) từ các tĩnh mạch sau mao mạch là một thành phần quan trọng của tình trạng viêm cấp tính. Các thụ thể beta2 hiện diện trên các tế bào nội mô tĩnh mạch sau mao mạch và các chất chủ vận beta2 ức chế sự thoát huyết tương bằng cách ngăn chặn sự dãn tách của các tế bào nội mô trong các tĩnh mạch sau mao mạch [64]. Tác dụng này được thấy ở tất cả các chất chủ vận beta2 [65,66]. Bằng cách này, chất chủ vận beta2 có thể phát huy tác dụng chống viêm và chống phù nề cấp tính ở đường thở. Trong khi các chất chủ vận beta tiêm tĩnh mạch không có hiệu quả trong việc ức chế sự thoát huyết tương trên súc vật thí nghiệm [67] nhưng lại có hiệu quả ức chế sự thoát dịch do các chất trung gian dạng hít gây ra khi đưa qua đường khí dung. Điều này cho thấy rằng nồng độ cục bộ cao có thể hữu ích trong việc ức chế sự thoát huyết tương trong phản ứng viêm [68,69]. Liệu những tác dụng của thuốc chủ vận beta dạng hít trên tế bào nội mạc như trên có liên quan đến tác dụng trong hen hay không vẫn còn chưa chắc chắn vì rất khó định lượng sự thoát huyết tương ở đường hô hấp dưới của con người. Formoterol dạng hít làm giảm sự gia tăng protein huyết tương do histamine hít vào trong đờm của người bình thường, cho thấy liều điều trị của thuốc chủ vận beta2 dạng hít có thể ức chế sự thoát huyết tương [70].
Beta-agonists cũng có thể có tác dụng kích hoạt các dây thần kinh cảm giác trên đường thở. Beta-agonists ức chế phản ứng co thắt phế quản nonadrenergic-noncholinergic (NANC) ở phổi súc vật thí nghiệm [71]. Tác dụng điều chỉnh này được thực hiện thông qua thụ thể beta2 trên các dây thần kinh cảm giác nhạy cảm với capsaicin trên đường thở. Liệu các thụ thể beta receptor có điều chỉnh các dây thần kinh cảm giác trên đường hô hấp của người hay không còn chưa chắc chắn [53]. Một số bằng chứng gợi ý rằng thụ thể beta2 có thể được điều chỉnh bởi tác dụng ức chế phản ứng ho của albuterol [72].
Các tế bào viêm có liên quan đến bệnh hen và COPD, bao gồm bạch cầu ái toan, bạch cầu đa nhân trung tính, tế bào lympho T và đại thực bào. Tất cả đều biểu hiện số lượng thụ thể beta2 thấp. Chất chủ vận beta2 đã được chứng minh in vitro là có tác dụng ức chế sự giải phóng các chất trung gian gây viêm từ các tế bào này [73]. Tuy nhiên, những tác dụng như trên nhanh chóng trở nên dung nạp do điều hòa giảm thụ thể beta2 [74]. Điều này có nghĩa là chất chủ vận beta2 không có tác dụng chống viêm mạn tính trong các bệnh về đường hô hấp. Thuốc beta2 agonists cho đến nay là thuốc dãn phế quản hiệu quả nhất trong bệnh hen vì chúng hoạt động như chất đối kháng chức năng và do đó đảo ngược và ngăn chặn sự co thắt phế quản từ nhiều cơ chế co thắt phế quản trong đường thở của bệnh hen. Tiến bộ lớn nhất là sự ra đời của thuốc chủ vận beta2 tác dụng kéo dài (LABA), có thời gian tác dụng trên 12 giờ. LABA hiện đang được sử dụng kết hợp với corticosteroid dạng hít để kiểm soát bệnh hen. Những loại thuốc này đã được phát triển để có sự phân ly chậm từ các thụ thể beta2 và tồn tại lâu hơn trong phổi từ đó làm tăng hiệu quả điều trị.
Kháng cholinergic (Anticholinergics)
Ở phổi khỏe mạnh, các thụ thể muscarinic kiểm soát trương lực cơ trơn, tiết chất nhầy, dãn mạch và viêm. Thuốc kháng cholinergic dạng hít, đối kháng với thụ thể muscarinic trên đường thở, là loại thuốc dãn phế quản hiệu quả nhất ở bệnh nhân COPD mà trương lực cholinergic (phế vị) đường thở là thành phần duy nhất có thể đảo ngược trong bệnh lý này. Trong bệnh hen, thuốc kháng cholinergic có tác dụng dãn phế quản kém hơn đáng kể so với thuốc chủ vận beta2 vì chúng chỉ ngăn chặn thành phần cholinergic của co thắt phế quản, thường rất nhỏ so với tác dụng co thắt trực tiếp của các chất trung gian, chẳng hạn như cys-LT (cysteinyl leukotrienes). Mục tiêu chính của thuốc kháng cholinergic là các thụ thể muscarinic trong đường hô hấp và những thụ thể này được phân bố trên một số loại tế bào. Đường hô hấp được chi phối bởi dây thần kinh phế vị, dây thần kinh này mang các sợi cholinergic trước hạch dẫn truyền đến các hạch cục bộ trên thành đường thở. Sau đó, các sợi sau hạch sẽ chi phối cơ trơn đường dẫn khí và các tuyến dưới niêm mạc. Sự phân bố thần kinh phế vị của đường thở chủ yếu ở đường thở lớn và giảm dần ở ngoại biên mà không tham gia vào chức năng vận động của đường thở nhỏ và nhu mô phổi [75].
Sự phân bố của các thụ thể muscarinic đã được lập bản đồ trong đường hô hấp của động vật và con người bằng phương pháp chụp bức xạ tự động thụ thể. Trong đường thở của chồn sương và chuột lang có mật độ thụ thể muscarinic cao trong cơ trơn của đường hô hấp lớn và giảm dần khi đường thở giảm kích thước, phù hợp với sự phân bố của các dây thần kinh cholinergic [76,77]. Tuy nhiên, trong đường thở của con người, các thụ thể muscarinic được định vị ở cơ trơn của tất cả các đường thở, mặc dù mật độ ở đường thở lớn hơn cao hơn [77]. Các thụ thể muscarinic cũng được định vị ở biểu mô đường dẫn khí và các tuyến dưới niêm mạc, phù hợp với tác dụng kích thích của acetylcholine (ACh) đối với sự tiết chất nhầy.

Có bốn trong năm phân nhóm thụ thể muscarinic hiện đã được xác định ở phổi bằng các nghiên cứu sự tương tác giữa các phân tử và dược lý học [78]. Các thụ thể muscarinic làm trung gian cho sự co thắt phế quản ở đường thở của người và động vật thuộc phân nhóm thụ thể M3, trong khi sự tiết chất nhầy dường như qua trung gian các thụ thể M1 và M3. Kích thích thụ thể muscarinic dẫn đến dãn mạch thông qua kích hoạt thụ thể M3 trên tế bào nội mô giải phóng NO. Các thụ thể M1 cũng được định vị ở hạch phó giao cảm, nơi chúng tạo điều kiện thuận lợi cho việc dẫn truyền thần kinh qua trung gian thụ thể nicotinic. Các thụ thể ức chế muscarinic (autoreceptors) đã được chứng minh trên các dây thần kinh cholinergic của đường hô hấp ở động vật in vivo và trong phế quản của con người in vitro [78]. Các thụ thể ở vị trí tiền sinap (điểm tiếp hợp thần kinh, prejunctional receptors) ức chế giải phóng ACh và có thể dùng để hạn chế co thắt phế quản phế vị. Các thụ thể ức chế muscarinic trong đường thở của con người thuộc phân nhóm thụ thể M2, trong khi cơ trơn và tuyến đường hô hấp thuộc phân nhóm thụ thể M3. Các loại thuốc như Atropine và Ipratropium bromide, ngăn chặn cả thụ thể M2 trước và thụ thể M3 sau sinap trên cơ trơn với hiệu quả như nhau, do đó làm tăng nồng độ ACh, và như vậy có thể vượt qua sự phong tỏa sau sinap. Điều này có nghĩa là những loại thuốc này sẽ không có hiệu quả hoàn toàn chống co thắt phế quản qua cơ chế chống lại chất chủ vận cholinergic [53]. Lập bản đồ chụp X-quang bằng cách sử dụng phương pháp X-quang đồng vị phóng xạ đã chứng minh được có sự hiện diện của thụ thể M2 và M3 trong cơ trơn đường thở trên đường thở của người và các thụ thể M1 và M3 trong tuyến dưới niêm mạc [77]. Ngoài ra còn có thụ thể M1 trong nhu mô phổi. Có sự biểu hiện cao của gen thụ thể M3 trong cơ trơn đường thở của tất cả các cấp độ đường thở, với bằng chứng rõ ràng về sự biểu hiện ở đường thở ngoại vi cũng như các tuyến dưới niêm mạc.
Bằng chứng gần đây cho thấy ACh cũng có thể được giải phóng từ các tế bào trong đường hô hấp ngoài dây thần kinh, bao gồm cả tế bào biểu mô, nhưng vai trò của ACh ngoại bào trong đường hô hấp của con người hiện chưa chắc chắn [79,80]. Sự tổng hợp ACh trong tế bào biểu mô được tăng lên do các kích thích viêm làm tăng sự biểu hiện của choline acetyltransferase (ChAT), enzyme chịu trách nhiệm tổng hợp ACh. ChAT cũng được biểu hiện trong các tế bào viêm, bao gồm đại thực bào và tế bào lympho T, cho thấy một nguồn ACh khác trong các bệnh viêm đường hô hấp [80]. Tế bào lympho T ở người biểu hiện ChAT và giải phóng ACh khi kích hoạt miễn dịch, nhưng cũng biểu hiện thụ thể muscarinic, do đó cũng có khả năng đáp ứng với ACh [81,82].
Cholinergic không chỉ có hiệu ứng trong điều hòa hoạt động trên các tế bào cấu trúc đường thở mà còn có vai trò trong đáp ứng với phản ứng viêm. Trong viêm, không chỉ các tế bào viêm có khả năng tổng hợp ACh mà chúng còn có thể phản ứng với ACh thông qua việc kích hoạt các thụ thể muscarinic. Điều này cho thấy khả năng thuốc kháng cholinergic có thể có tác dụng ức chế các tế bào viêm khi mà chúng được kích hoạt bởi ACh giải phóng từ tế bào thần kinh và ngoại bào. Tế bào lympho T được ACh kích hoạt thông qua thụ thể M1 để giải phóng interleukin-2 và do đó tăng phân chia để gia tăng số lượng [83]. ACh kích thích các tế bào biểu mô phế quản của người giải phóng các yếu tố hóa hướng động bạch cầu đơn nhân và bạch cầu đa nhân trung tính thông qua các thụ thể M1 [84]. Liệu thuốc kháng cholinergic có bất kỳ tác dụng chống viêm nào hay không vẫn chưa được xác định nhưng cần được nghiên cứu thêm, đặc biệt là trên các tế bào của bệnh nhân mắc COPD. Có thể tác dụng chống viêm của thuốc kháng muscarinic là cơ chế làm giảm (khoảng 25%) các đợt cấp bệnh COPD được thấy trong các nghiên cứu dài hạn [85,86].
Corticosteroids
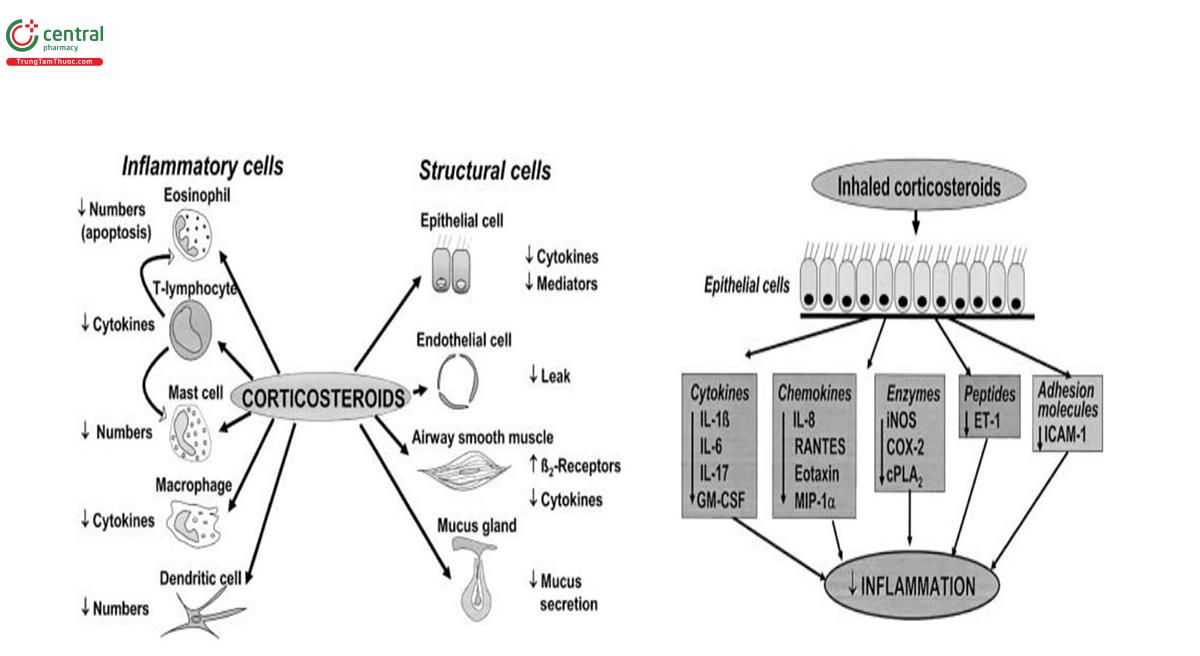
Corticosteroid dạng hít là trụ cột chính trong quản lý hen. Tác dụng của chúng được thực hiện qua trung gian kích hoạt thụ thể glucocorticoid (glucocorticoid receptors, GR) trong tế bào đích ở phổi [87]. Corticosteroid dạng hít đi qua màng tế bào và liên kết với GR tế bào chất, sau đó di chuyển vào nhân, nơi chúng có thể liên kết với các yếu tố nhận biết trong vùng khởi động của gen chống viêm, hoặc liên kết với các phân tử đồng hoạt hóa và thu hút histone deacetylase-2 để đảo ngược quá trình acetyl hóa histone và do đó tắt nhiều gen gây viêm được kích hoạt [88]. Hầu hết mọi loại tế bào đều có biểu hiện GR, nhưng số lượng GR trên mỗi tế bào dường như khác nhau và có thể là một trong những yếu tố quyết định khả năng đáp ứng steroid. GR có mật độ cao nhất trong các tế bào nội mô và biểu mô. Có khả năng là có nhiều loại tế bào là mục tiêu của corticosteroid dạng hít, bao gồm các tế bào viêm như bạch cầu ái toan và tế bào lympho T, tế bào đuôi gai và đại thực bào (hình 16). Trong các tế bào cấu trúc của bệnh nhân hen bao gồm tế bào biểu mô, cơ trơn, tế bào nội mô và nguyên bào sợi cũng có biểu hiện nhiều gen gây viêm và có thể là nguồn tế bào chính của các chất trung gian viêm. Có vẻ như các tế bào biểu mô đường dẫn khí có tầm quan trọng đặc biệt như là mục tiêu tế bào của corticosteroid dạng hít, vì các tế bào này biểu hiện nhiều protein gây viêm điều phối quá trình viêm phức tạp trong bệnh hen [89] (hình 16). GR phân bố rộng rãi bên ngoài phổi, vì vậy các tác dụng phụ toàn thân đối với xương, sự tăng trưởng, da, cơ xương và mạch máu là phổ biến. Điều này cung cấp cơ sở lý luận cho việc sử dụng corticosteroid dạng hít để giảm phơi nhiễm toàn thân. Loại thụ thể glucocorticoid thứ hai, GR-β, là một biến thể ghép nối của gen GR và liên kết với cùng vị trí gắn DNA như GR-α. Tuy nhiên, GR-β không liên kết với corticosteroid, do đó về mặt lý thuyết có thể hoạt động như một chất ức chế âm tính trội với tín hiệu GR. Sự biểu hiện tăng GR-β đã được mô tả trong đường thở của bệnh nhân hen kháng steroid [90], nhưng rất khó có thể giải thích được tình trạng không nhạy cảm với corticosteroid ở những bệnh nhân này vì lượng GR-β ít hơn nhiều so với GR-α [91].
5 ĐẶC TÍNH CƠ HỌC CỦA PHỔI BÌNH THƯỜNG VÀ CƠ CHẾ CƠ HỌC CẤU TRÚC NỀN NGOẠI BÀO (EXTRACELLULAR MATRIX, ECM) TRONG COPD
Phổi là một cơ quan phục vụ nhu cầu trao đổi khí của cơ thể. Để trao đổi khí hiệu quả, diện tích bề mặt bên trong phải được tối đa hóa, trong khi khoảng cách di chuyển của O2 và CO2 giữa không khí phế nang và máu mao mạch phải được giảm thiểu. Hơn nữa, nhu cầu hoạt động của cơ thể cũng đòi hỏi khả năng dự trữ chức năng đáng kể của phổi và do đó cần có diện tích bề mặt lớn đủ để trao đổi khí cả trong trạng thái nghỉ và trong trạng thái gắng sức. Những đòi hỏi chức năng như vậy đặt ra yêu cầu quan trọng đối với cấu trúc bên trong của phổi. Đầu tiên, vùng trao đổi khí cần được kết nối với đường thở với độ mở cần thiết. Thứ hai, để trao đổi khí hiệu quả, nhìn một cách tổng thể, các khu vực khác nhau cần được lưu thông khí đầy đủ [92]. Trong một khoang ngực giới hạn, để đáp ứng yêu cầu chức năng, phổi phải có cấu trúc ba chiều dạng cây phân nhánh fractal (hình 17). Các nhánh cuối của cây cung cấp không khí cho tiểu phế quản hô hấp có kết nối với hàng nghìn phế nang, nơi sự trao đổi khí xảy ra thông qua khuếch tán. Với cấu trúc như vậy, bề mặt trao đổi khí của phổi, có diện tích gần bằng một sân tennis, có thể thu gọn trong khoang ngực [93].
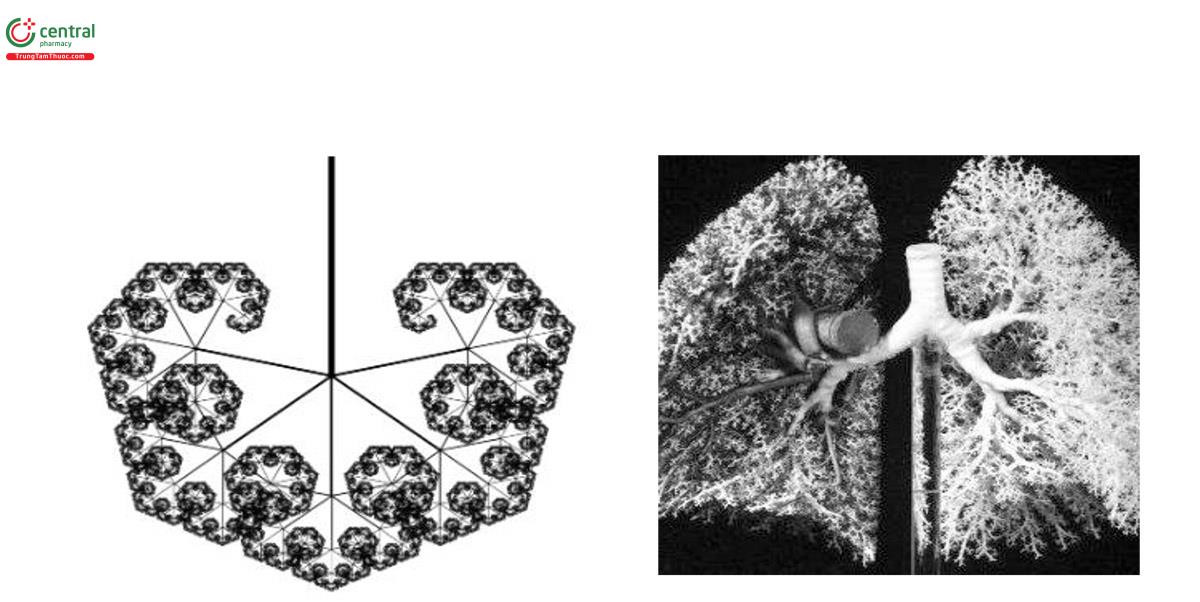
Trao đổi khí trong phổi được duy trì thông qua quá trình hít vào và thở ra nhịp nhàng. Các túi phế nang nối thông với đường thở mở và do đó áp suất trong phế nang hầu như luôn gần bằng áp suất khí quyển. Vì phế nang có thành mỏng dễ bị xẹp xuống nên chúng phải được giữ ở trạng thái mở bằng áp lực xuyên thành dương tính. Áp lực này, được gọi là áp lực xuyên phổi (transpulmonary pressure, Ptp), được tạo ra bởi áp suất âm xung quanh phổi trong khoang ngực. Do có sự liên kết cơ học của nhu mô phổi, tác động làm căng của Ptp tạo ra một ứng suất kéo, hay dự ứng lực (prestress), trong toàn bộ nhu mô phổi. Mức độ căng của phế nang phụ thuộc vào dự ứng lực thay đổi theo chu kỳ thở. Dự ứng lực phổi phụ thuộc vào tính chất cơ học của nhu mô. Do đó, hiệu quả trao đổi khí gắn bó chặt chẽ với ba đặc điểm cơ bản của phổi: Tổ chức cấu trúc của nhu mô, tính chất cơ học của các thành phần của nó và dự ứng lực. Dự ứng lực là yếu tố chính quyết định sự biến dạng của phổi, ảnh hưởng đến nhiều hiện tượng bao gồm thông khí cục bộ, lưu lượng máu khu vực, độ cứng mô, sự co của cơ trơn và sự ổn định của phế nang. Con đường chính để truyền lực tác động (stress) làm căng phế nang là thông qua cấu trúc nền ngoại bào (ECM). Do đó, các tính chất cơ học của chất nền ngoại bào đóng vai trò quan trọng cả về chức năng phổi và sinh học. Các tính chất cơ học của ECM được quyết định bởi các thành phần của mô này, bao gồm cả elastin, collagen và proteoglycan. Ngoài ra, các đặc tính cơ học phổi cũng bị ảnh hưởng bởi sức căng bề mặt và ở một mức độ nào đó, bởi trạng thái co của các tế bào kết nối.
6 KẾT LUẬN
Với chức năng trao đổi khí với môi trường, có một lưu lượng lớn khí và tuần hoàn máu đi qua phổi. Để sự trao đổi đổi khí hiệu quả, cấu trúc, sinh lý phổi phế quản hoạt động có tính tương tác và phân tầng chức năng phức tạp. Ở hơn 10% dân số, phản ứng với các kích thích của môi trường trở thành bệnh lý, dẫn đến sự nhạy cảm quá mức, phản ứng bất thường với cả các kích thích đặc hiệu cũng như không đặc hiệu, và đạt đến đỉnh điểm là sự tái cấu trúc vật lý của đường thở và phổi. Phòng ngừa, chẩn đoán xác định và điều trị hiệu quả các rối loạn đòi hỏi sự hiểu biết tốt hơn về cơ chế phản ứng quá mức với các kích thích môi trường.
7 Tài liệu tham khảo
1. Perez-Gil J, Weaver TE. Pulmonary surfactant pathophysiology: current models and open questions. Physiology (Bethesda). 2010;25(3):132–41
2. Orgeig S, Hiemstra PS, Veldhuizen EJ, Casals C, Clark HW, Haczku A, Knudsen L, Possmayer F. Recent advances in alveolar biology: evolution and function of alveolar proteins. Respir Physiol Neurobiol. 2010;173(Suppl):S43–54.
3. Forbes LR, Haczku A. SP-D and regulation of the pulmonary innate immune system in allergic airway changes. Clin Exp Allergy. 2010;40(4):547–62
4. Makarand Phadke. Role of Pulmonary Surfactant in Gas Exchange Mechanism and Providing Protection against Progression of any Respiratory Viral Disease like SARS-CoV-2 and Need to focus it as First Point of Medication for all Respiratory Disease. Research Square. 2021. DOI: https://doi.org/10.21203/rs.3.rs-692200/v1 (This is a preprint).
5. Faffe DS, Zin WA. Lung parenchymal mechanics in health and disease. Physiol Rev. 2009;89(3):759–75.
6. Sorokin L. The impact of the extracellular matrix on inflammation. Nat Rev Immunol 2010; 10: 712–723.
7. Burgstaller G, Oehrle B, Gerckens M, et al. The instructive extracellular matrix of the lung: basic composition and alterations in chronic lung disease. Eur Respir J 2017; 50: 1601805 [https://doi. org/10.1183/13993003.01805-2016]
8. Canning BJ. Reflex regulation of airway smooth muscle tone. J Appl Physiol. 2006;101(3): 971–85.
9. Rogers DF. Motor control of airway goblet cells and glands. Respir Physiol. 2001;125(1–2): 129–44
10. Wine JJ. Parasympathetic control of airway submucosal glands: central reflexes and the airway intrinsic nervous system. Auton Neurosci. 2007;133(1):35–54
11. Canning BJ. Functional implications of the multiple afferent pathways regulating cough. Pulm Pharmacol Ther. 2011;24(3):295–9
12. Widdicombe JG. Pulmonary and respiratory tract receptors. J Exp Biol. 1982;100:41–57
13. Lee LY, Pisarri TE. Afferent properties and reflex functions of bronchopulmonary C-fibers. Respir Physiol. 2001;125(1–2):47–65
14. R. Van Scott Michael et al. Chapter 2. Airway Anatomy, Physiology, and Inflammation. In: W.J. Meggs (ed.), The Toxicant Induction of Irritant Asthma, Rhinitis, 19 and Related Conditions, DOI 10.1007/978-1-4614-9044-9_2, © Springer Science+Business Media, LLC 2013
15. Bradley J. Undem et al. The Role of Vagal Afferent Nerves in Chronic Obstructive Pulmonary Disease. Proc Am Thorac Soc Vol 2. pp 355–360, 2005
16. Dempsey JA, Veasey SC, Morgan BJ, O’Donnell CP. Pathophysiology of sleep apnea. Physiol Rev. 2010;90(1):47–112
17. Skatrud JB, Dempsey JA. Interaction of sleep state and chemical stimuli in sustaining rhythmic ventilation. J Appl Physiol. 1983;55(3):813–22.
18. Naughton MT. Loop gain in apnea: gaining control or controlling the gain? Am J Respir Crit Care Med. 2010;181(2):103–5.
19. Kubin L, Alheid GF, Zuperku EJ, McCrimmon DR. Central pathways of pulmonary and lower airway vagal afferents. J Appl Physiol. 2006;101(2):618–27
20. Coleridge HM, Coleridge JC. Pulmonary reflexes: neural mechanisms of pulmonary defense. Annu Rev Physiol. 1994;56:69–91
21. Hlastala MP, Berger AJ. Physiology of respiration. New York: Oxford University Press; 2001
22. Banner KH, Igney F, Poll C. TRP channels: emerging targets for respiratory disease. Pharmacol Ther. 2011;130(3):371–84.
23. Fahy JV, Dickey BF. Airway mucus function and dysfunction. N Engl J Med. 2010;363(23):2233–47
24. Tarran R, Button B, Boucher RC. Regulation of normal and cystic fibrosis airway surface liquid volume by phasic shear stress. Annu Rev Physiol. 2006;68:543–61
25. Trout L, Corboz MR, Ballard ST. Mechanism of substance P-induced liquid secretion across bronchial epithelium. Am J Physiol Lung Cell Mol Physiol. 2001;281(3):L639–45.
26. Hansson GC. Mucus and mucins in diseases of the intestinal and respiratory tracts. J Intern Med 2019; 285: 479–490
27. Mary Callaghan Rose et al. Respiratory Tract Mucin Genes and Mucin Glycoproteins in Health and Disease. Physiol Rev 86: 245–278, 2006
28. Fahy JV, Corry DB, and Boushey HA. Airway inflammation and remodeling in asthma. Curr Opin Pulm Med 6: 15–20, 2000.
29. Borchers MT, Wert SE, and Leikauf GD. Acrolein-induced MUC5ac expression in rat airways. Am J Physiol Lung Cell Mol Physiol 274: L573–L581, 1998.
30. Chung K. Cytokines in chronic obstructive pulmonary diseases. Eur Respir J 18: 505–595, 2001.
31. Qui Y, Zhu J, Bandi V, Atmar RL, Hattotuwa K, Guntupalli KK, and Jeffrey PK. Biopsy neutrophilia, neutrophil chemokine and receptor gene expression in severe exacerbations of chronic obstructive pulmonary disease. Am J Respir Crit Care Med 168: 968–1075, 2003.
32. Senior RM and Shapiro SD. Chronic obstructive pulmonary disease: epidemiology, pathophysiology, and pathogenesis. In: Fishman’s Pulmonary Diseases and Disorders, edited by A. P. Fishman. New York: McGraw-Hill, 1998, p. 659–
33. Lamb D and Reid L. Goblet cell increase in rat bronchial epithelium after exposure to cigarette and cigar tobacco smoke. Br Med J 1: 33–35, 1969.
34. Miller L, Foster WM, Dambach DM, Doebler D, McKinnon M, Killar L, and Longphre M. A murine model of cigarette smoke induced pulmonary inflammation using intranasally administered smoke-conditioned medium. Exp Lung Res 28: 435–455, 2004.
35. Borchers MT, Wesselkamper S, Wert SE, Shapiro SD, and Leikauf GD. Monocyte inflammation augments acrolein-induced Muc5ac expression in mouse lung. Am J Physiol Lung Cell Mol Physiol 277: L489–L497, 1999
36. Lamb D and Reid L. Mitotic rates, goblet cell increase and histochemical changes in mucus in rat bronchial epithelium during exposure to sulphur dioxide. J Pathol Bacteriol 96: 97–111, 1968.
37. Seltzer J, Scanlon PD, Drazen RH, Ingram JM Jr, and Reid L. Morphologic correlation of physiologic changes caused by SO2- induced bronchitis in dogs. Am Rev Respir Dis 129: 790–797, 1984.
38. Harkema JR, Hotchkiss JA, and Henderson RF. Effects of 0.12 and 0.80 ppm ozone on rat nasal and nasopharyngeal epithelial mucosubstances: quantitative histochemistry. Toxicol Pathol 17: 525–535, 1989
39. Voynow JA, Fischer BM, Malarkey DE, Burch LH, Wong T, Longphre M, Ho SB, and Foster WM. Neutrophil elastase induces mucus cell metaplasia in mouse lung. Am J Physiol Lung Cell Mol Physiol 287: L1293–L1302, 2004.
40. Shimizu T, Takahashi Y, Kawaguchi S, and Sakakura Y. Hypertrophic and metaplastic changes of goblet cells in rat nasal epithelium induced by endotoxin. Am J Respir Crit Care Med 153: 1412–1418, 1996.
41. Yanagihara K, Seki M, and Cheng PW. Lipopolysaccharide induces mucus cell metaplasia in mouse lung. Am J Respir Cell Mol Biol 24: 66–73, 2001.
42. Wagner JG, VanDuyken SJ, Hotchkiss JA, and Harkema JR. Endotoxin enhancement of ozone-induced mucous cell metaplasia is neutrophil-dependent in rat nasal epithelium. Toxicol Sci 60: 338–347, 2001
43. Walter MJ, Morton JD, Kajiwara N, Agapov E, and Holtzman MJ. Viral induction of a chronic asthma phenotype and genetic segregation from the acute response. J Clin Invest 110: 165–175, 2002
44. Mullen JB, Wright JL, Wiggs BR, et al. Reassessment of inflammation of airways in chronic bronchitis. Br Med J 1985; 291: 1235–1239.
45. Hogg JC, Chu F, Utokaparch S, et al. The nature of small-airway obstruction in chronic obstructive pulmonary disease. N Engl J Med 2004; 350: 2645–2653.
46. Hogg JC, Chu FS, Tan WC, et al. Survival after lung volume reduction in chronic obstructive pulmonary disease: insights from small airway pathology. Am J Respir Crit Care Med 2007; 176: 454–459.
47. Martin C, Frija-Masson J, Burgel PR. Targeting mucus hypersecretion: new therapeutic opportunities for COPD? Drugs 2014; 74: 1073–1089.
48. Boucher RC. Muco-obstructive lung diseases. N Engl J Med 2019; 380: 1941–1953.
49. Lin VY, Kaza N, Birket SE, et al. Excess mucus viscosity and airway dehydration impact COPD airway clearance. Eur Respir J 2020; 55: 1900419.
50. Montalbano AM, Di Sano C, Chiappara G, et al. Cigarette smoke and non-neuronal cholinergic system in the airway epithelium of COPD patients. J Cell Physiol 2018; 233: 5856–5868.
51. Barnes PJ. The role of anticholinergics in chronic obstructive pulmonary disease. Am J Med 2004; 117: Suppl. 12A, 24s–32s.
52. Beeh KM, Burgel PR, Franssen FME, et al. How do dual long-acting bronchodilators prevent exacerbations of chronic obstructive pulmonary disease? Am J Respir Crit Care Med 2017; 196: 139–149.
53. Peter J. Barnes. Distribution of Receptor Targets in the Lung. Proc Am Thorac Soc Vol 1. pp 345–351, 2004
54. Barnes PJ. Beta-adrenergic receptors and their regulation. Am J Respir Crit Care Med 1995;152:838–860.
55. Carstairs JR, Nimmo AJ, Barnes PJ. Autoradiographic localisation of β-adrenoceptors in human lung. Eur J Pharmacol 1984;103:189–190.
56. Carstairs JR, Nimmo AJ, Barnes PJ. Autoradiographic visualization of β-adrenoceptor subtypes in human lung. Am Rev Respir Dis 1985;132: 541–547
57. Mak JCW, Grandordy B, Barnes PJ. High affinity [3 H]formoterol binding sites in lung: characterization and autoradiographic mapping. Eur J Pharmacol 1994;269:35–41.
58. Hamid QA, Mak JC, Sheppard MN, Corrin B, Venter JC, Barnes PJ. Localization of 2adrenoceptor messenger RNA in human and rat lung using in situ hybridization: correlation with receptor autoradiography. Eur J Pharmacol 1991;206:133–138.
59. Mak JCW, Nishikawa M, Haddad E-B, Kwon OJ, Hirst SJ, Twort CHC, Barnes PJ. Localization and expression of β-adrenergic receptor subtype mRNAs in human lung. Eur J Pharmacol 1996;302:215–221
60. Drury DE, Chong LK, Ghahramani P, Peachell PT. Influence of receptor reserve on beta-adrenoceptor- mediated responses in human lung mast cells. Br J Pharmacol 1998;124:711–718.
61. O’Connor BJ, Fuller RW, Barnes PJ. Non-bronchodilator effects of inhaled β2-agonists. Am J Respir Crit Care Med 1994;150:381–387.
62. Nightingale JA, Rogers DF, Barnes PJ. Differential effect of formoterol on adenosine monophosphate and histamine reactivity in asthma. Am J Respir Crit Care Med 1999;159:1786–1790.
63. Anderson SD, Seale JP, Rozea P, Bandler I, Theobald G, Lindsay DA. Inhaled and oral Salbutamol in exercise- induced asthma. Am Rev Respir Dis 1976;114:493–500.
64. Baluk P, McDonald DM. The β2-adrenergic receptor agonist formoterol reduces microvascular leakage by inhibiting endothelial gap formation. Am J Physiol 1994;266:L461–L468.
65. Tokuyama K, Lotvall JO, Lofdahl C-G, Barnes PJ, Chung KF. Inhaled formoterol inhibits histamine-induced airflow obstruction and airway microvascular leakage. Eur J Pharmacol 1991;193:35–40.
66. Bolton PB, Lefevre P, McDonald DM. Salmeterol reduces early- and late-phase plasma leakage and leukocyte adhesion in rat airways. Am J Respir Crit Care Med 1997;155:1428–1435.
67. Boschetto P, Roberts NM, Rogers DF, Barnes PJ. The effect of anti-asthma drugs on microvascular leak in guinea pig airways. Am Rev Respir Dis 1989;139:416–421.
68. Tokuyama K, Lotvall JO, Lofdahl C-G, Barnes PJ, Chung KF. Inhaled formoterol inhibits histamine-induced airflow obstruction and airway microvascular leakage. Eur J Pharmacol 1991;193:35–40.
69. Sulakvelidze I, McDonald DM. The anti-edema action of formoterol in rat trachea does not depend on capsaicin- sensitive sensory nerves. Am J Respir Crit Care Med 1994;149:232–238.
70. Greiff L, Wollmer P, Andersson M, Svensson C, Persson CG. Effects of formoterol on histamine induced plasma exudation in induced sputum from normal subjects. Thorax 1998;53:1010–1013.
71. Verleden GM, Belvisi MG, Rabe KF, Miura M, Barnes PJ. β2-Adrenoceptors inhibit NANC neural bronchoconstrictor responses in vitro. J Appl Physiol 1993;74:1195–1199.
72. Nichol G, Nix A, Barnes PJ, Chung KF. Prostaglandin F2α enhancement of capsaicin induced cough in man: modulation by beta2-adrenergic and anticholinergic drugs. Thorax 1990;45:694–698.
73. Barnes PJ. Effect of β-agonists on inflammatory cells. J Allergy Clin Immunol 1999;104:10–17
74. Leff AR, Herrnreiter A, Naclerio RM, Baroody FM, Handley DA, Munoz NM. Effect of enantiomeric forms of albuterol on stimulated secretion of granular protein from human eosinophils. Pulm Pharmacol Ther 1997;10:97–104.
75. Barnes PJ. Neural control of human airways in health and disease. Am Rev Respir Dis 1986;134:1289–1314.
76. Barnes PJ, Basbaum CB, Nadel JA. Autoradiographic localization of autonomic receptors in airway smooth muscle: marked differences between large and small airways. Am Rev Respir Dis 1983;127:758–762.
77. Mak JCW, Barnes PJ. Autoradiographic visualization of muscarinic receptor subtypes in human and guinea pig lung. Am Rev Respir Dis 1990; 141:1559–1568.
78. Barnes PJ. Muscarinic receptor subtyes in airways. Life Sci 1993;52:521– 528.
79. Wessler I, Kirkpatrick CJ, Racke K. Non-neuronal acetylcholine, a locally acting molecule, widely distributed in biological systems: expression and function in humans. Pharmacol Ther 1998;77:59–79.
80. Wessler IK, Kirkpatrick CJ. The non-neuronal cholinergic system: an emerging drug target in the airways. Pulm Pharmacol Ther 2001;14: 423–434.
81. Tayebati SK, El Assouad D, Ricci A, Amenta F. Immunochemical and immunocytochemical characterization of cholinergic markers in human peripheral blood lymphocytes. J Neuroimmunol 2002;132:147– 155.
82. Kawashima K, Fujii T. The lymphocytic cholinergic system and its biological function. Life Sci 2003;72:2101–2109
83. Nomura J, Hosoi T, Okuma Y, Nomura Y. The presence and functions of muscarinic receptors in human T cells: the involvement in IL-2 and IL-2 receptor system. Life Sci 2003;72:2121–2126.
84. Koyama S, Rennard SI, Robbins RA. Acetylcholine stimulates bronchial epithelial cells to release neutrophil and monocyte chemotactic activity. Am J Physiol 1992;262:L466–L47
85. Vincken W, van Noord JA, Greefhorst AP, Bantje TA, Kesten S, Korducki L, Cornelissen PJ and the Dutch/Belgian Tiotropium Study Group. Improved health outcomes in patients with COPD during 1 yr’s treatment with tiotropium. Eur Respir J 2002;19:209–216.
86. Sin DD, McAlister FA, Man SF, Anthonisen NR. Contemporary management of chronic obstructive pulmonary disease: scientific review. JAMA 2003;290:2301–2312.
87. Barnes PJ, Adcock IM. How do corticosteroids work in asthma? Ann Intern Med 2003;139:359–370.
88. Ito K, Barnes PJ, Adcock IM. Glucocorticoid receptor recruitment of histone deacetylase 2 inhibits IL-1β-induced histone H4 acetylation on lysines 8 and 12. Mol Cell Biol 2000;20:6891–6903.
89. Schweibert LM, Stellato C, Schleimer RP. The epithelium as a target for glucocorticoid action in the treatment of asthma. Am J Respir Crit Care Med 1996;154:S16–S20.
90. Hamid QA, Wenzel SE, Hauk PJ, Tsicopoulos A, Wallaert B, Lafitte JJ, Chrousos GP, Szefler SJ, Leung DY. Increased glucocorticoid receptor beta in airway cells of glucocorticoid-insensitive asthma. Am J Respir Crit Care Med 1999;159:1600–1604.
91. Gagliardo R, Chanez P, Vignola AM, Bousquet J, Vachier I, Godard P, Bonsignore G, Demoly P, Mathieu M. Glucocorticoid receptor α and β in glucocorticoid dependent asthma. Am J Respir Crit Care Med 2000;162:7–13
92. Kitaoka H, Suki B. Branching design of the bronchial tree based on a diameter-flow relationship. J Appl Physiol. 1997; 82:968–976. [PubMed: 9074989]
93. Weibel ER. What makes a good lung? Swiss Med Wkly. 2009; 139:375–386. [PubMed: 19629765]

