Tìm hiểu về siêu âm đánh giá mặt và cổ thai nhi ở tuổi thai nhỏ
CHƯƠNG 9 : MẶT VÀ CỔ THAI NHI, trang 271-334, Sách SIÊU ÂM THAI QUÝ 1
Dịch từ sách: First Trimester Ultrasound Diagnosis of Fetal Abnormalities -Tác giả Alfred Abuhamad và Rabih Chaoui
Người dịch: Bác sĩ Vũ Văn Tài
Tải bản PDF TẠI ĐÂY
1 GIỚI THIỆU
Siêu âm đánh giá mặt và cổ thai nhi ở tuổi thai nhỏ là một khía cạnh quan trọng vì nó đã được đưa vào chương trình đánh giá nguy cơ lệch bội (aneuploidy) thai nhi trong quý 1 (Chương 1 và 5). Mặt cắt dọc giữa của thai nhi là một phần của phép đo độ mờ da gáy (NT) và cũng được dùng để đánh giá xương mũi. Đánh giá mặt và cổ thai nhi chi tiết hơn trong quý 1 giúp chẩn đoán một số bất thường hay gặp, bao gồm cả lệch bội và hội chứng di truyền. Trong chương này, chúng tôi trình bày cách tiếp cận có hệ thống để đánh giá mặt và cổ thai nhi và thảo luận chi tiết về các bất thường lớn ở mặt và cổ có thể chẩn đoán được trong quý 1. Hố sau, cũng được thấy ở mặt cắt dọc giữa của thai nhi, và được thảo luận riêng trong Chương 8 về các bất thường của hệ thần kinh trung ương (CNS).
2 PHÔI THAI HỌC
Sự phát triển của mặt và cổ trong thời kỳ phôi thai là một quá trình phức tạp, bao gồm sự phối hợp của nhiều mô gồm ngoại bì (ectoderm), mào thần kinh (neural crest), trung bì (mesoderm) và nội bì (endoderm) cùng với 6 cặp vòm hầu (pharyngeal arches). Vòm hầu đóng vai trò chính trong việc tạo dựng mặt và cổ, bao gồm cả cấu trúc xương, cơ, mạch máu và dây thần kinh.
Bằng chứng đầu tiên về sự phát triển của mặt được quan sát thấy trong tuần thứ 3 của quá trình tạo phôi thai với sự hình thành màng hầu miệng (miệng) (oropharyngeal (oral) membrane), nằm ở phần đầu của ruột trước (foregut) và là khoang miệng trong tương lai. Trong tuần thứ 4 đến tuần thứ 7 của quá trình hình thành phôi thai, 5 lồi mặt (facial swellings) kết hợp và hợp nhất để tạo thành các cấu trúc trên khuôn mặt, bao gồm 1 lồi mũi trán (frontonasal process), có nguồn gốc từ các tế bào mào thần kinh, và 2 lồi hàm trên (maxillary processes) và 2 lồi hàm dưới (mandibular processes), phát sinh từ cung hầu đầu tiên (Hình 9.1). Lồi mũi trán tạo thành 2 lồi mũi trong (medial nasal processes) và 2 lồi mũi bên (lateral nasal processes). Bảng 9.1 và Hình 9.1 và 9.2 liệt kê sự đóng góp khác nhau của các lồi mặt đối với sự phát triển cấu trúc trên khuôn mặt. Sự kết hợp và hợp nhất của các lồi mũi trong và lồi hàm trên tạo thành vòm miệng nguyên phát (primary palate), và vòm miệng thứ phát (secondary palate) được hình thành bởi sự hợp nhất các lồi hàm trên, sự phát triển của khuôn mặt hoàn thành vào tuần thứ 12 của quá trình hình thành phôi thai, và tiếp tục tăng trưởng với những thay đổi về tỷ lệ và đặc điểm các cấu trúc khuôn mặt. Chi tiết về sự phát triển phôi thai của mặt và cổ nằm ngoài phạm vi của cuốn sách này. Sự thất bại trong quá trình phát triển hoặc hợp nhất các lồi mặt gây ra phần lớn các bất thường trên khuôn mặt, bao gồm cả khe hở môi-vòm miệng, sẽ được thảo luận ở phần sau của chương này.
| Bảng 9.1 • Các lồi mặt góp phần vào cấu trúc khuôn mặt trong giai đoạn phôi thai |
Lồi mũi trán: Trán, sống mũi (dorsum of nose) Lồi mũi bên: Mặt bên mũi Lồi mũi trong: Vách ngăn mũi Lồi hàm trên: Má trên, hầu hết môi trên và vòm miệng thứ phát Lồi hàm dưới: Má dưới, cằm và môi dưới |
.jpg)
Hình 9.1: Hình vẽ minh họa sự phát triển của miệng và mũi ở đầu tuần thứ 6 (A) và cuối tuần thứ 7 (B) của quá trình hình thành phôi. Hai lồi mũi trong và hai lồi mũi bên hợp nhất ở giữa cùng với lồi hàm trên và lồi hàm dưới ở bên để tạo thành mũi, như được cho thấy ở A và miệng, như được cho thấy ở B. Vòm miệng nguyên phát được hình thành bởi lồi mũi trong và lồi hàm trên, trong khi vòm miệng thứ phát được hình thành bởi sự hợp nhất các lồi hàm trên. Màu sắc của mũi, hàm trên và hàm dưới ở A và B cho thấy các lồi mặt góp phần vào quá trình hình thành phôi thai. Xem văn bản để biết thêm chi tiết.
Cung hầu góp phần vào sự phát triển của cổ. Cung hầu thứ 3 tạo thành cấu trúc xương của xương móng (hyoid bone). Các tuyến cận giáp và sụn thanh quản được hình thành bởi sự hợp nhất cung hầu thứ 4 và thứ 6. Tuyến giáp tạo thành từ khoảng ngày thứ 24 của quá trình hình thành phôi thai từ hầu nguyên thủy (primitive pharynx) và tế bào mào thần kinh (neural crest cells), tương ứng tạo thành tuyến giáp trong và tuyến giáp ngoài, và tuyến giáp trong trở thành tuyến giáp chính. Sau đó tuyến giáp đi xuống cổ cho đến khi ở phía trước khí quản vào tuần thứ 7 của quá trình hình thành phôi thai. Tuyến giáp là cơ quan nội tiết đầu tiên phát triển và bắt đầu sản xuất hormone giáp vào tuần thứ 12 của tuổi kinh nguyệt.
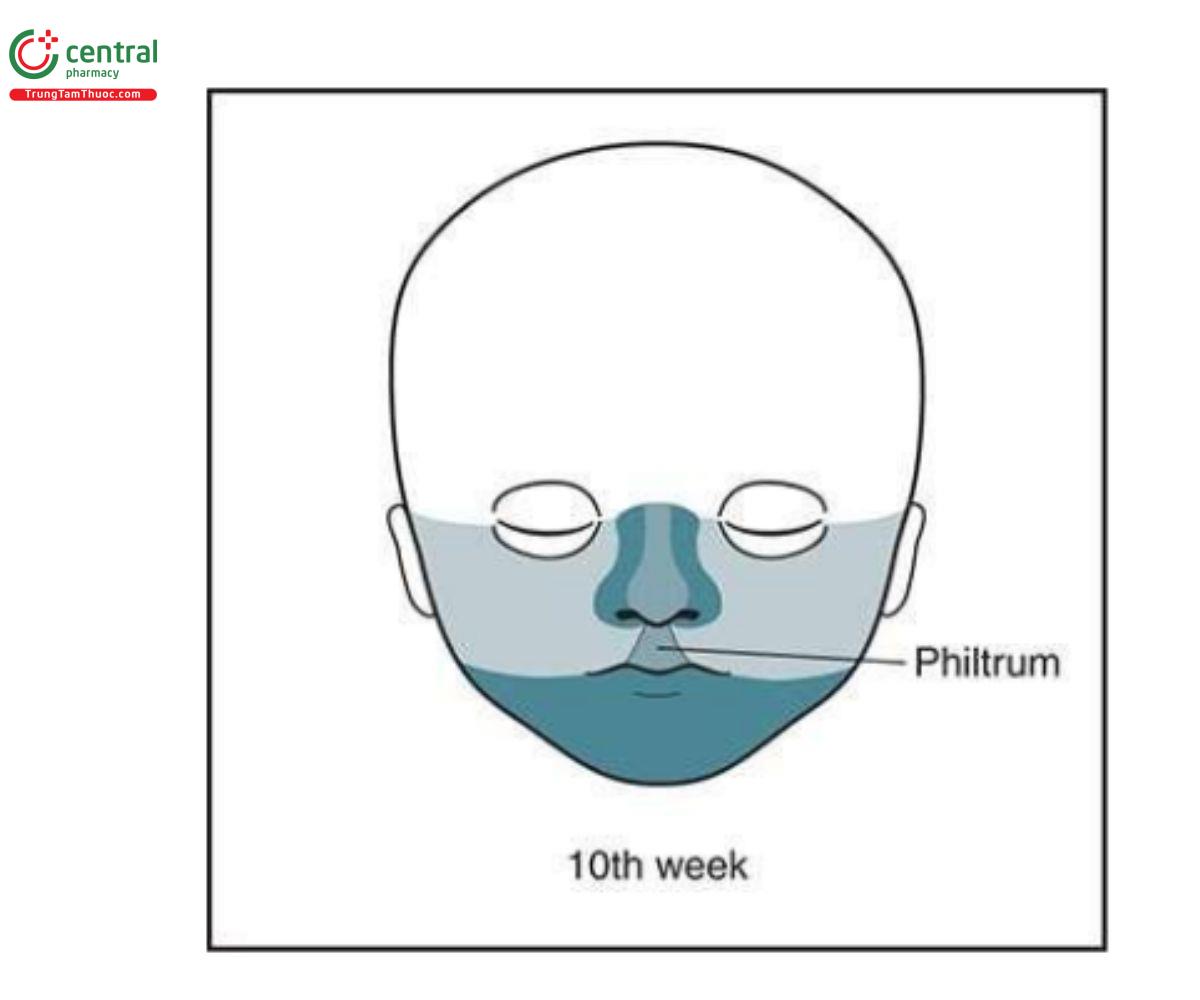
Hình 9.2: Sự hình thành mặt dưới lúc 10 tuần của quá trình hình thành phôi thai. Lưu ý, khuôn mặt đã hình thành hoàn chỉnh, và có sự góp phần của các lồi mặt khác nhau. Xem Hình 9.1 để biết màu sắc tương ứng và đọc văn bản để biết thêm chi tiết.
3 GIẢI PHẪU HÌNH ẢNH SIÊU ÂM BÌNH THƯỜNG
Đánh giá có hệ thống mặt và cổ bao gồm nhiều cách tiếp cận từ các mặt cắt dọc giữa, mặt cắt vành và mặt cắt ngang. Cách tiếp cận bằng mặt cắt dọc giữa giúp đánh giá các đặc điểm trên khuôn mặt và đo độ mờ đa gáy, đồng thời các mặt cắt vành và ngang cũng giúp đánh giá các đặc điểm khác trên khuôn mặt và cổ. Một số cấu trúc giải phẫu của não, như đồi thị, thân não, não thất bốn, não thất bên và đám rối mạch mạc, cũng có thể thấy ở mặt cắt dọc giữa và dọc bên của đầu và mặt 1 và đã được thảo luận chi tiết trong Chương 5 và 8. Do đó, chúng tôi sẽ mô tả các đặc điểm hình ảnh siêu âm bình thường của mặt và cổ ở mỗi mặt cắt giải phẫu.
3.1 Mặt cắt dọc
Trong quý 1, mặt cắt dọc giữa đầu thai nhi (Hình 9.3 và 9.4), cho thấy các đặc điểm của khuôn mặt, đồng thời cho phép đánh giá trán, mũi với xương mũi, miệng với hàm trên, hàm dưới ở phía trước và NT ở phía sau. Trong quý 1, tỷ lệ đầu/cơ thể thai nhi dường như lớn hơn một chút so với giai đoạn sau của thai kỳ, và ở mặt cắt dọc giữa này, ở trán cho thấy một số "lồi trán" trông rất bình thường (Hình 9.3 và 9.4). Ở giai đoạn tuổi thai nhỏ này, khớp trán (metopic suture) vẫn còn rộng và không thấy xương trán ở mặt cắt dọc giữa. Ở mặt cắt dọc giữa, có thể thấy rõ các cấu trúc trên khuôn mặt khi chùm sóng siêu âm đi tới vuông góc với các cấu trúc mũi của mặt. Các dấu mốc rất quan trọng để xác định chính xác xương mũi ở mặt cắt dọc giữa, nếu thấy "dấu bằng" được hình thành bởi xương mũi ở dưới và da mũi ở trên (Hình 9.4, 9.5A, 9.6 và 1.1 ). Ở mặt cắt dọc giữa, hàm trên là một vùng cốt hóa liên tục trên khuôn mặt (Hình 9.4 đến 9.6), và phần trước hàm dưới được thấy như một chấm hồi âm dày (echogenic dot) nằm dưới hàm trên ở trước (Hình 9.6A). Ở mặt cắt dọc bên, có thể thấy phần xương hàm dưới lớn hơn (Hình 9.6C) cũng như mỏm hàm trên (processus maxillaris) giữa xương mũi và xương hàm trên (Hình 9.6B). Một số phép đo trên khuôn mặt ở mặt cắt dọc giữa đã được đề xuất trong y văn. 2–8 Ý nghĩa của các số đo bất thường trên khuôn mặt và các ―marker‖ giải phẫu sẽ được thảo luận ở phần sau của chương này.
Phía sau mặt cắt dọc giữa, còn thấy cổ với NT, và thảo luận chi tiết về phép đo độ mờ da gáy (NT) (Hình 9.3 và 9.4) và ý nghĩa của nó đã được trình bày trong Chương 1 và 6. Các tình trạng liên quan với NT dày và nang bạch huyết (cystic hygroma) sẽ được thảo luận ở cuối chương này.
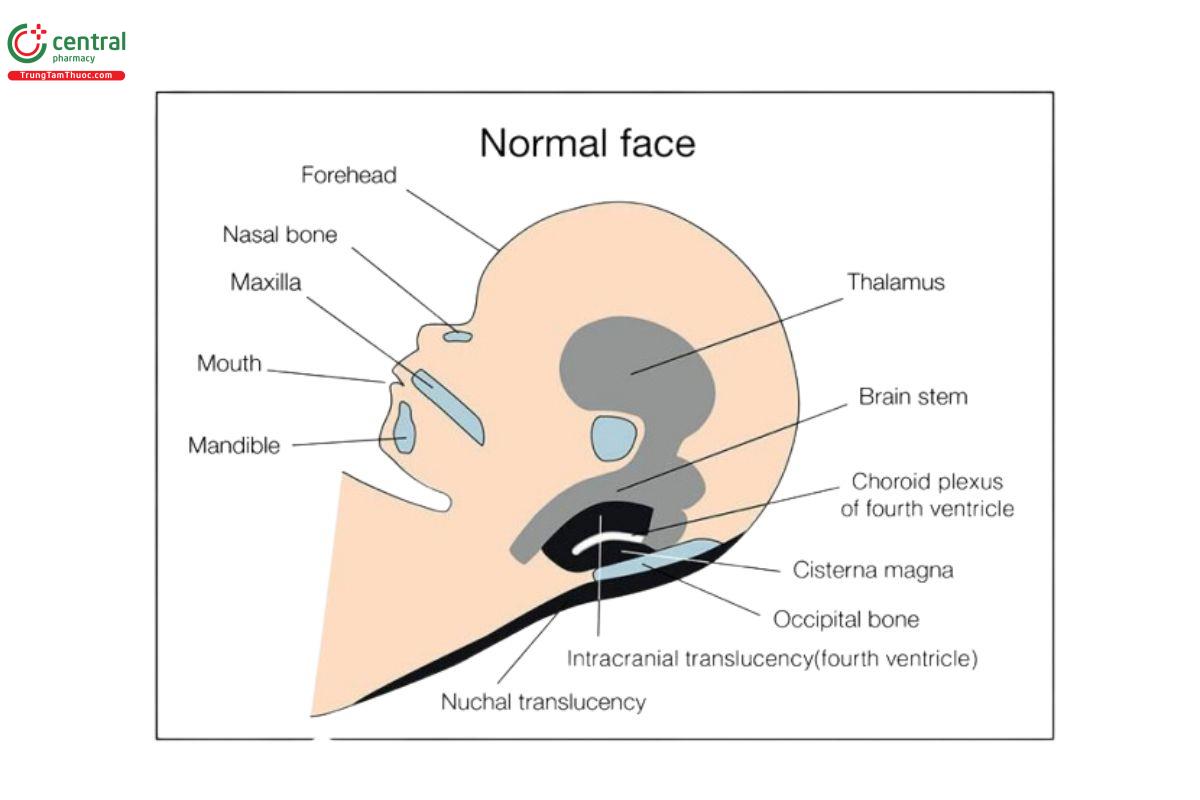
Hình 9.3: Hình vẽ minh họa mặt cắt dọc giữa đầu thai nhi cho thấy các đặc điểm trên khuôn mặt và các cấu trúc giải phẫu quan trọng được đánh giá qua siêu âm quý 1, bao gồm trán, xương mũi, hàm trên, miệng, hàm dưới, cấu trúc hệ thần kinh trung ương ở đường giữa, và khoảng sáng sau gáy. Xem hình ảnh siêu âm tương ứng trong Hình 9.4 và xem văn bản để biết thêm chi tiết.
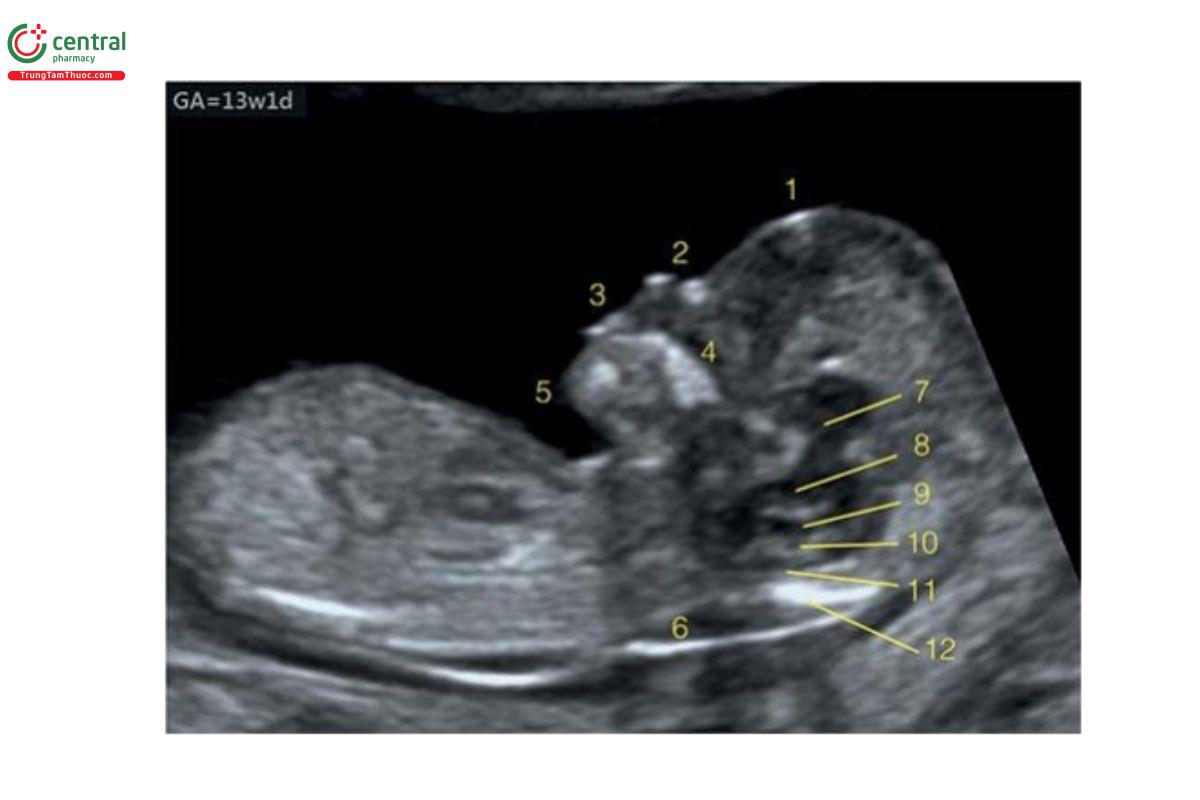
Hình 9.4: Mặt cắt dọc giữa đầu thai nhi 13 tuần tuổi, trên siêu âm 2D cho thấy các đặc điểm của khuôn mặt với trán (1), mũi với xương mũi (2), miệng (3), hàm trên (4) và cằm với hàm dưới (5). Phía sau mặt cắt này còn thấy khoảng sáng sau gáy (6) và các cấu trúc giải phẫu khác nhau của não ở đường giữa bao gồm đồi thị (7), thân não (8), não thất bốn dưới dạng khoảng sáng nội sọ (9), đám rối mạch mạc của não thất bốn (10), bể lớn đang phát triển (11), và xương chẩm (12). Xem Hình 9.3 với hình vẽ minh họa tương ứng.
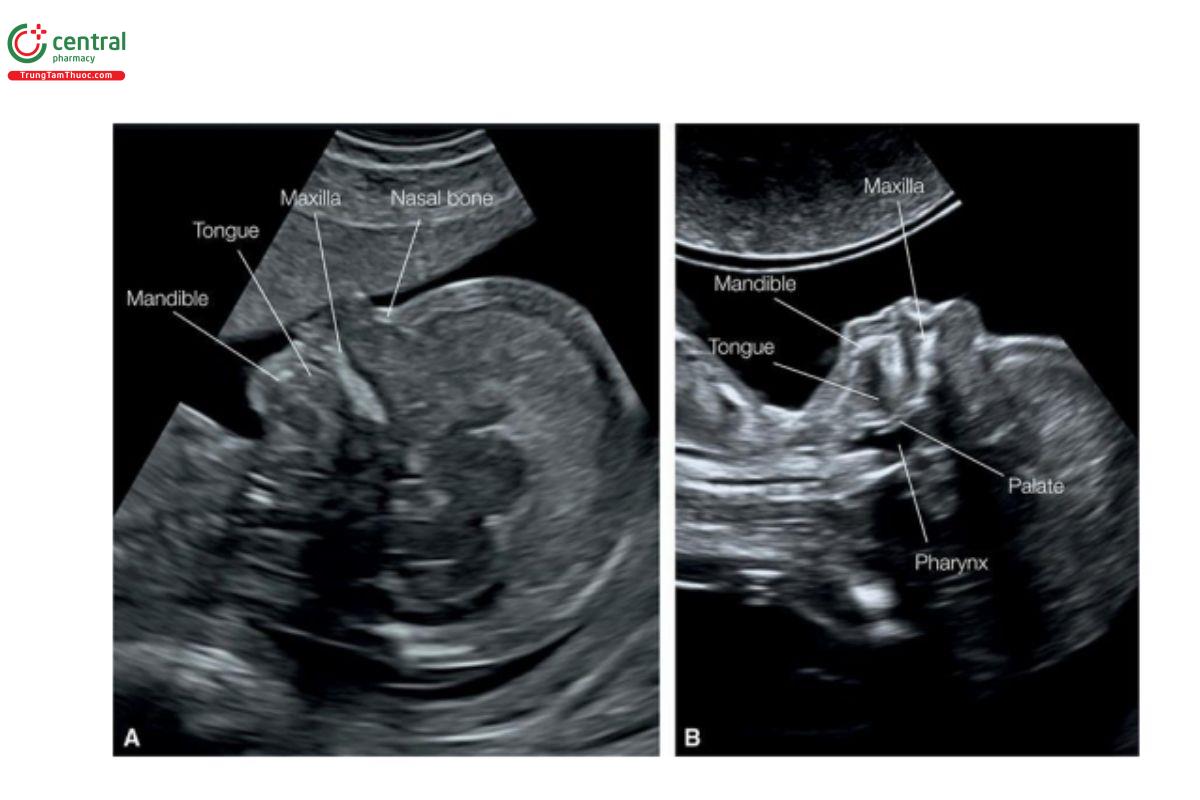
Hình 9.5: Siêu âm qua ngả âm đạo với mặt cắt dọc giữa mặt ở 2 thai nhi (A và B) lúc 13 tuần tuổi. Ở thai A, chùm sóng siêu âm vuông góc với trục dài của khuôn mặt và cho thấy rõ mũi với xương mũi, hàm trên và cằm với hàm dưới. Lưu ý ở A, lưỡi nằm giữa hàm trên và hàm dưới. Ở thai B, chùm sóng siêu âm từ phía dưới cằm, cho thấy vùng miệng phía sau với lưỡi, vòm miệng cứng và mềm, và hầu.
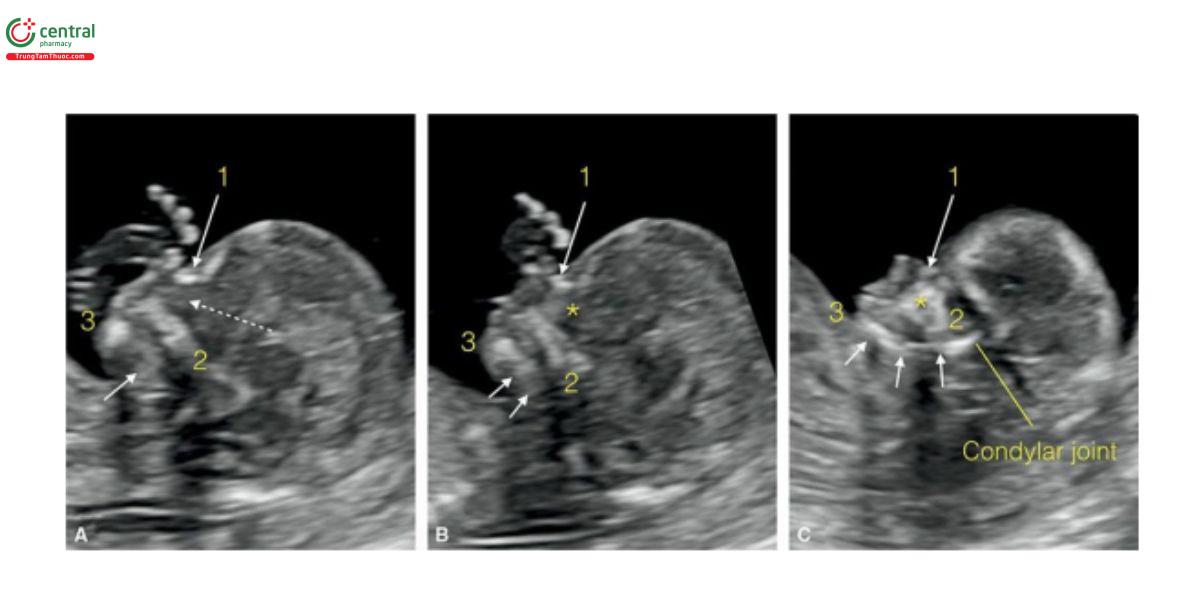
Hình 9.6: Mặt cắt dọc giữa (A) và 2 mặt cắt dọc bên (B và C) của mặt ở cùng một thai nhi 13 tuần tuổi cho thấy xương mũi (1), xương hàm trên (2) và xương hàm dưới (3). Ở A, mặt cắt dọc giữa, thấy xương hàm trên (2), nhưng không thấy mỏm hàm trên (mũi tên nét đứt). Cũng ở A, thấy chóp (tip) của xương hàm dưới (3), nhưng không thấy thân xương hàm dưới (mũi tên ngắn). B là mặt cắt dọc bên thu được là nhờ nghiêng nhẹ đầu dò từ mặt cắt dọc giữa, bắt đầu thấy mỏm hàm trên (dấu hoa thị) và thân xương hàm dưới (hai mũi tên). Mặt cắt dọc bên khi nghiêng đầu dò hơn nữa được thấy ở C, cho thấy xương mặt với mỏm hàm trên (dấu hoa thị) giữa xương mũi (1) và hàm trên (2) và mặt bên xương hàm dưới (3) với thân, ngành (ramus), và khớp lồi cầu (condylar joint) (các mũi tên ngắn)
3.2 Mặt cắt vành
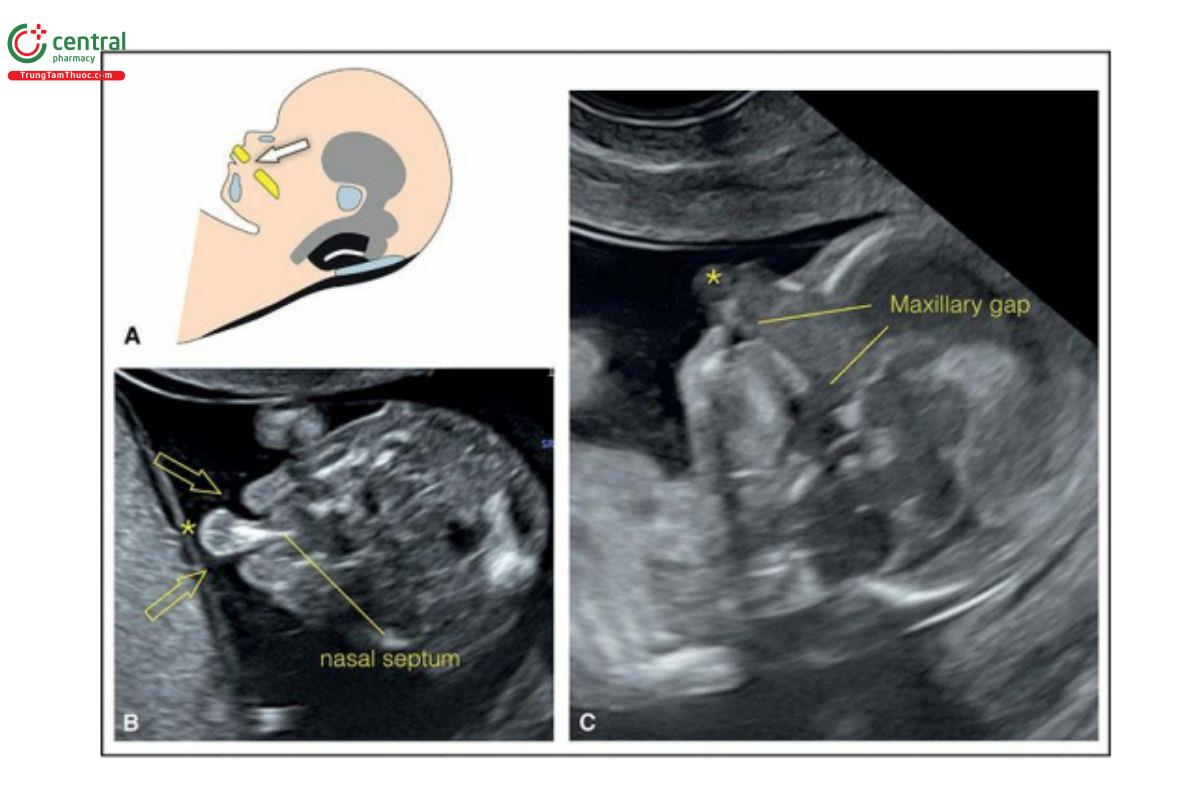
Trong quý 1, mặt cắt vành trán (frontal coronal view) của mặt cho thấy cả hốc mắt (orbits) và mắt và mối tương quan của chúng với sống mũi (nasal bridge) và hàm trên (Hình 9.7) (xem Chương 5). Vị trí, kích thước, hình dạng của mắt và hốc mắt thường được đánh giá một cách chủ quan. Mặt cắt vành của mặt cho thấy hàm ở trước (ụ ổ răng (alveolar ridge)) (Hình 9.7). Tam giác sau mũi được đánh giá ở mặt cắt chếch (oblique plane), giữa mặt cắt vành và mặt cắt ngang của mặt, ở vùng mũi và hàm trên (Hình 9.7B)9 (xem Chương 5 và Hình 5.9). Mặt cắt chếch giữa hàm trên và hàm dưới thường thấy khe hở hàm dưới (mandibular gap) (Hình 9.7B). 10Có thể thấy rõ các cấu trúc bằng cách dựng hình bề mặt 3D khuôn mặt, lý tưởng nhất là khi siêu âm qua ngả âm đạo.
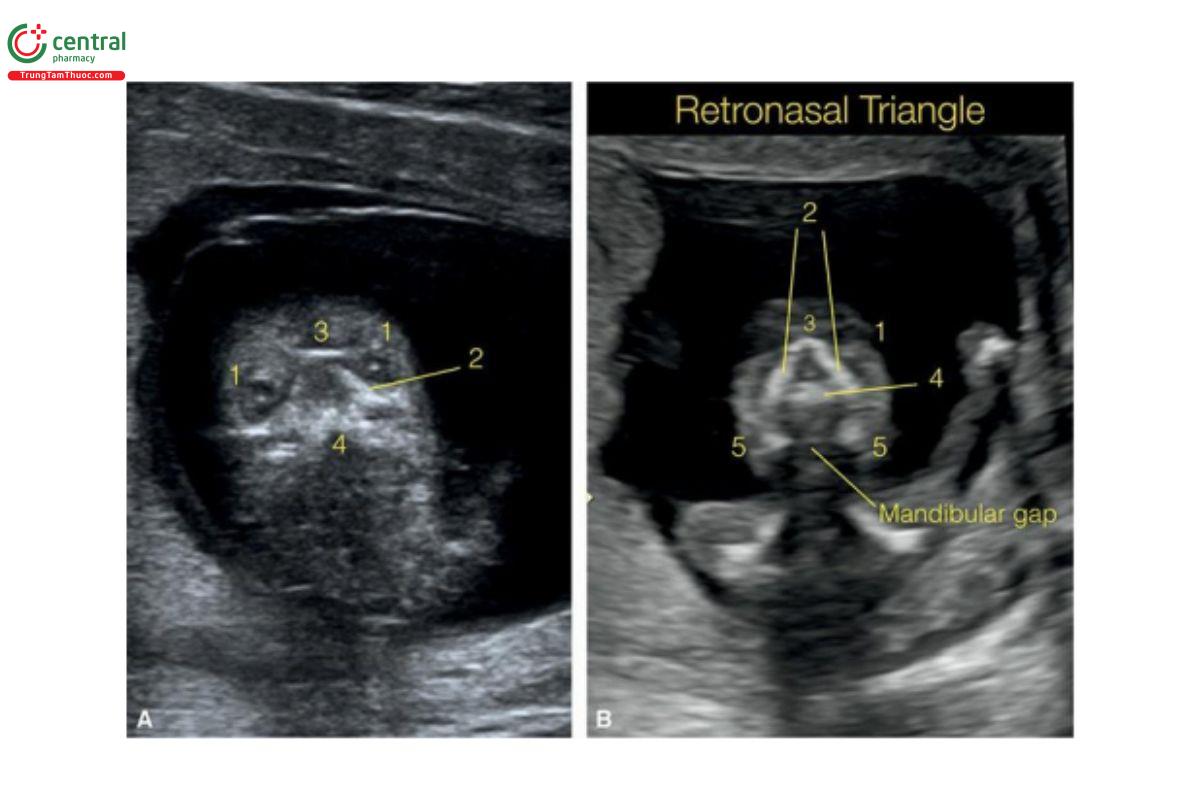
Hình 9.7: Mặt cắt vành qua trán ở 2 thai nhi (A và B) 12 tuần tuổi. Ở thai nhi A, mặt cắt vành ở mức hốc mắt và cho thấy hai mắt (1) với hốc mắt và thủy tinh thể (lenses), giữa các mỏm hàm trên (2), xương mũi (3) và mặt trước xương hàm trên (4) với ụ ổ răng (alveolar ridge). Ở thai nhi B, mặt cắt chếch cho thấy tam giác sau mũi (xem văn bản để biết thêm chi tiết), được tạo thành bởi xương mũi ở trên (3), các lồi trán của xương hàm trên ở bên (2), và ụ ổ răng (vòm miệng nguyên phát) ở dưới (4). Mặt cắt vành này (B) ở sau chóp (tip) xương hàm dưới, và do đó, thấy 2 thân xương hàm dưới ở bên (5) với khe hở bình thường ở giữa, được gọi là khe hở hàm dưới. Cằm nhỏ (micrognathia) sẽ làm mất khe hở hàm dưới ở mặt cắt tam giác sau mũi. Xem Hình 9.14 để giúp hiểu hơn về vị trí giải phẫu khuôn mặt của mặt cắt tam giác sau mũi.
3.3 Mặt cắt ngang
Theo kinh nghiệm của các tác giả, đánh giá có hệ thống các mặt cắt ngang mặt không mang lại nhiều ý nghĩa so với các mặt cắt dọc giữa và mặt cắt vành (Chương 5). Như được thực hiện trong quý 2, nhiều mặt cắt ngang từ đầu đến chân thu được trong quý 1 có thể cho thấy hốc mắt, sống mũi (nasal bridge) với xương mũi, xương hàm trên và xương hàm dưới (Hình 9.8) (Chương 5). Trong quý 1, siêu âm qua thành bụng có thể không thấy rõ môi của thai nhi và khi cần, có thể cần phải siêu âm qua ngả âm đạo bằng đầu dò độ phân giải cao để đánh giá kĩ càng hơn.
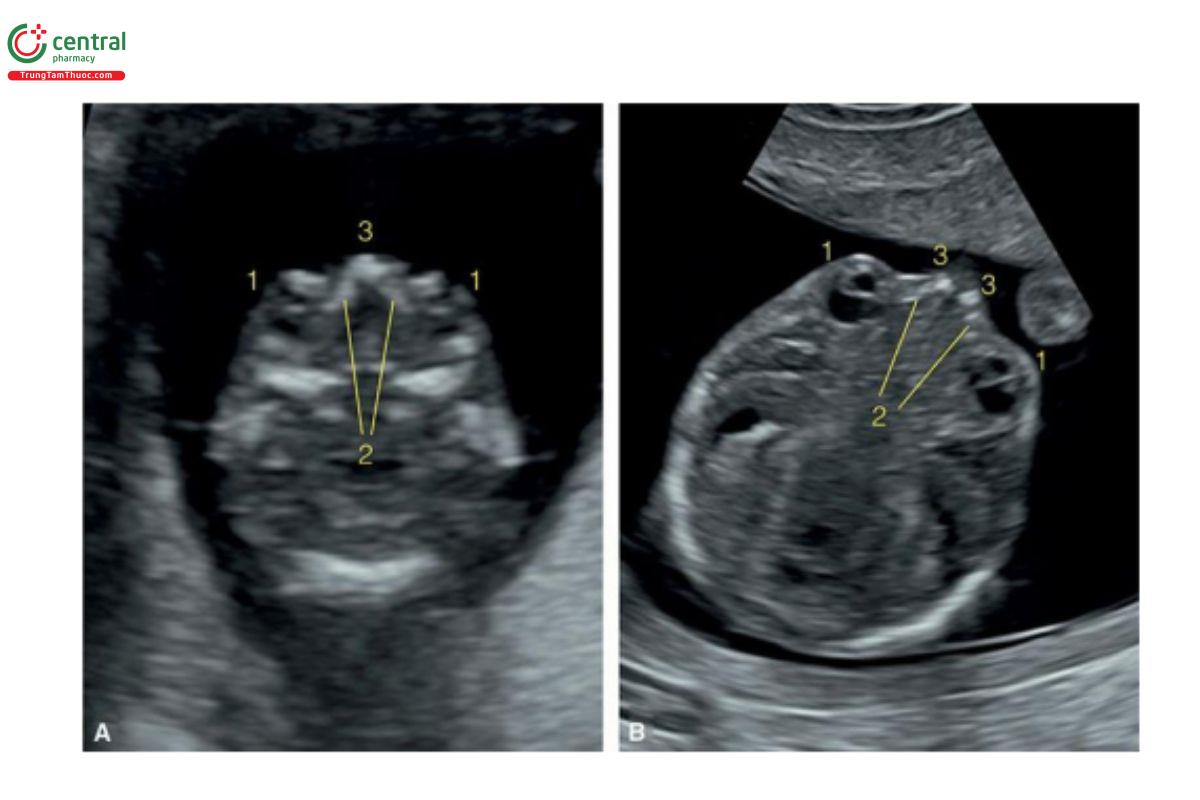
Hình 9.8: Mặt cắt ngang hốc mắt ở 2 thai nhi 13 tuần tuổi với siêu âm qua thành bụng (A) và qua ngả âm đạo (B). Lưu ý, thấy mắt (1), mỏm hàm trên (2) và xương mũi (3) ở mặt cắt này. Siêu âm qua ngả âm đạo (B), cũng thấy thủy tinh thể (1) và hai xương mũi riêng biệt (3).
3.4 Siêu âm 3D mặt thai nhi
Tương tự như ứng dụng siêu âm 3D mặt thai nhi ở chế độ bề mặt trong quý 2 và 3, siêu âm 3D trong quý 1 (Hình 9.9) mang lại thêm thông tin cho các mặt cắt ngang, mặt cắt trán, mặt cắt dọc giữa của mặt khi siêu âm 2D11. Trong quý 1, khi nghi ngờ thai nhi có bất thường, siêu âm 3D mặt thai nhi ở chế độ bề cho phép đánh giá chi tiết các đặc điểm trên khuôn mặt, bao gồm trán, mắt, mũi, miệng, cằm và tai ( Hình 9.9 đến 9.11). Siêu âm 3D mặt thai nhi thường được thực hiện qua thành bụng, nhưng khi nghi ngờ có bất thường, tiếp cận qua ngả âm đạo mang lại thông tin chi tiết và có độ phân giải cao hơn. Hình 9.9 đến 9.11 là các ví dụ về mặt thai nhi bình thường và bất thường trên siêu âm 3D trong quý 1. Siêu âm 3D cũng có thể được ứng dụng ở chế độ hiển thị đa mặt cắt (multiplanar display) đồng thời tái tạo các mặt cắt (reconstruction of planes) để đánh giá cụ thể các vùng giải phẫu mục tiêu (Hình 9.12 đến 9.14) chẳng hạn như khuôn mặt hoặc vòm miệng khi đánh giá các bất thường trên khuôn mặt (xem phần sau). Để biết thêm chi tiết về ứng dụng siêu âm 3D trong quý 1, vui lòng tham khảo Chương 3 trong cuốn sách này và một cuốn sách được xuất bản gần đây về việc ứng dụng 3D trên lâm sàng trong siêu âm tiền sản
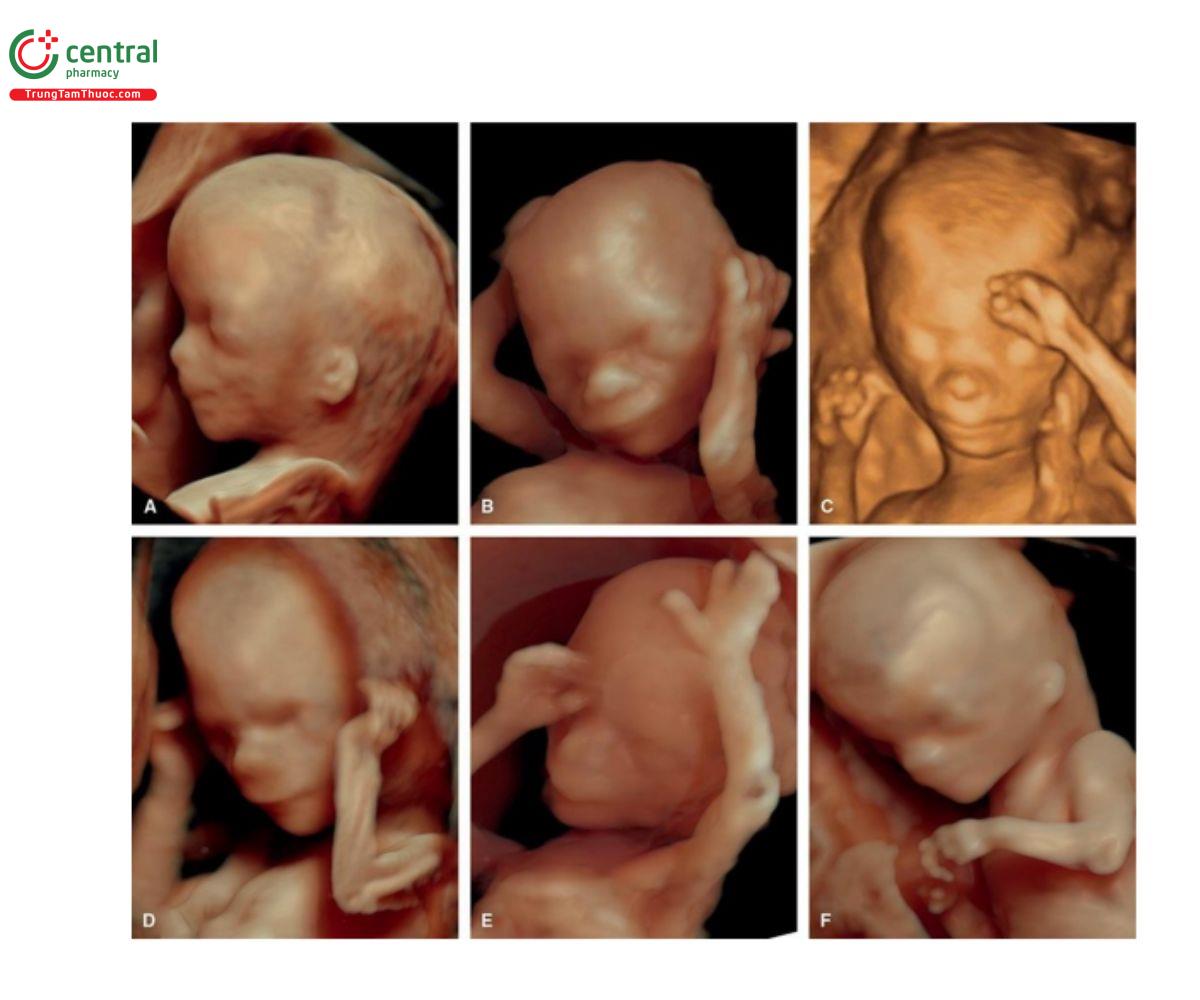
Hình 9.9: Hình ảnh siêu âm 3D + chế độ bề mặt (surface mode) của mặt thai nhi bình thường thu được từ 6 thai nhi (A – F) với siêu âm qua ngả âm đạo. Lưu ý, lồi trán sinh lý (hysiologic frontal bossing) và các vùng giải phẫu rõ ràng của trán, mắt, mũi, miệng, cằm và tai. So sánh với hình 9.10 và 9.11 thu được ở những thai nhi bất thường.
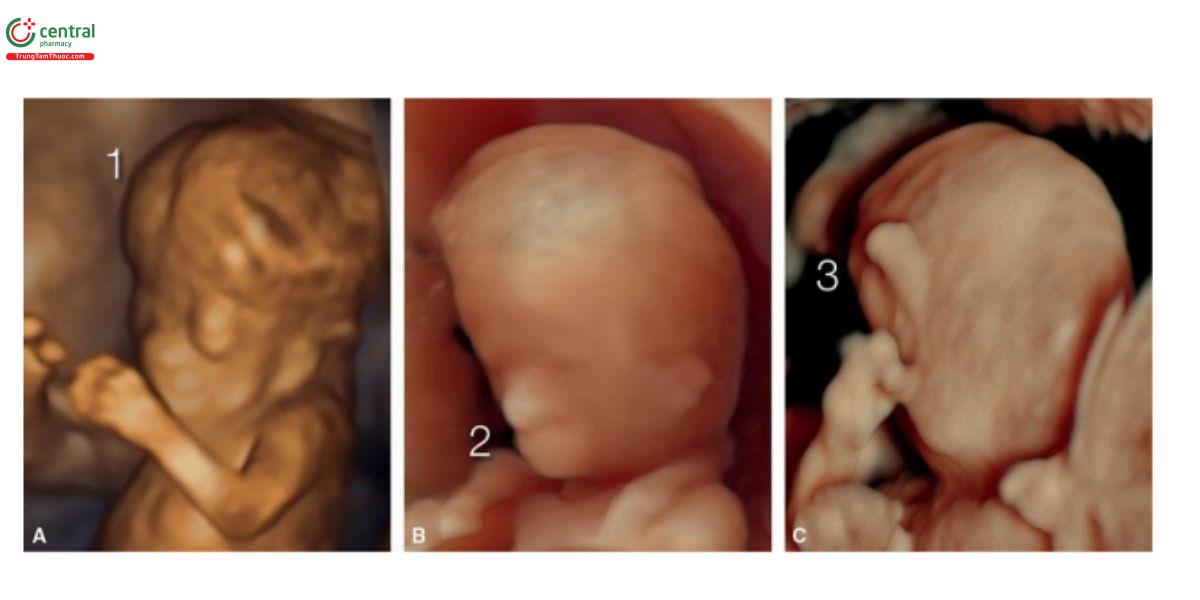
Hình 9.10: Hình ảnh siêu âm 3D + chế độ bề mặt (surface mode) của mặt thai nhi bất thường thu được từ 3 thai nhi (A–C) với siêu âm qua ngả âm đạo. Thai A bị acrania/exencephaly (1); thai B bị trisomy 13 với não thất duy nhất (holoprosencephaly), hai hốc mắt gần nhau (hypotelorism), và dị tật đầu khỉ (cebocephaly) (2) (mũi nhỏ với một lỗ mũi); và thai C bị trisomy 13 với vòi voi (proboscis) ở mặt (3).
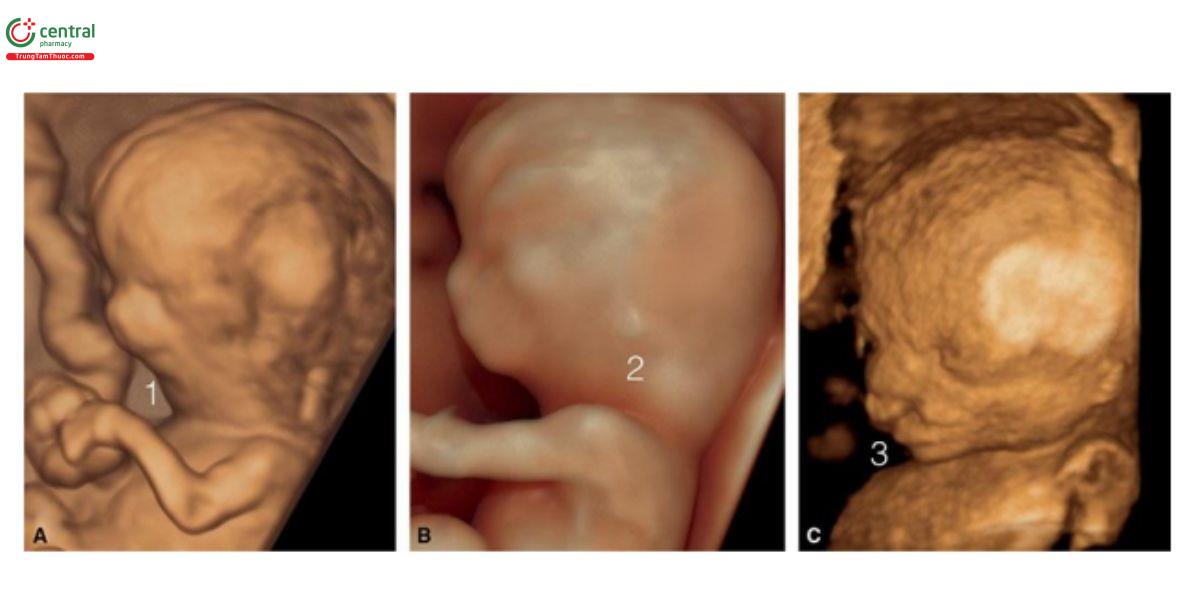
Hình 9.11: Hình ảnh siêu âm 3D + chế độ bề mặt (surface mode) của mặt thai nhi bất thường thu được từ 3 thai nhi (A – C) với siêu âm qua ngả âm đạo. Thai A bị trisomy 13 với cằm nhỏ (micrognathia) (1), thai B bị trisomy 18 với khuôn mặt bất thường và tai loạn sản (dysplastic ears) (2), và thai C mắc hội chứng với khe hở mặt (facial cleft) kèm theo (3).
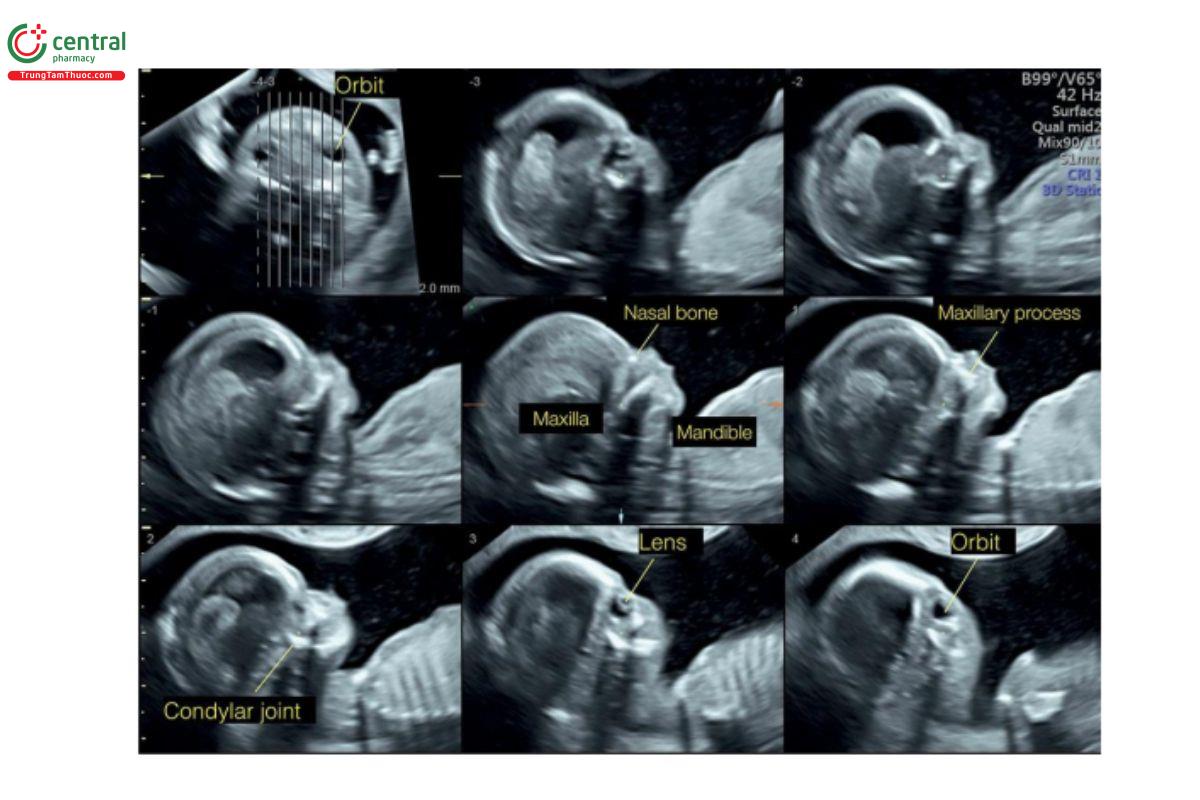
Hình 9.12: Siêu âm 3D mặt thai nhi bình thường thu được qua ngả âm đạo lúc 12 tuần tuổi và được hiển thị ở chế độ cắt lớp. Lưu ý, các chi tiết giải phẫu được đánh giá ở mặt cắt dọc giữa và dọc bên.
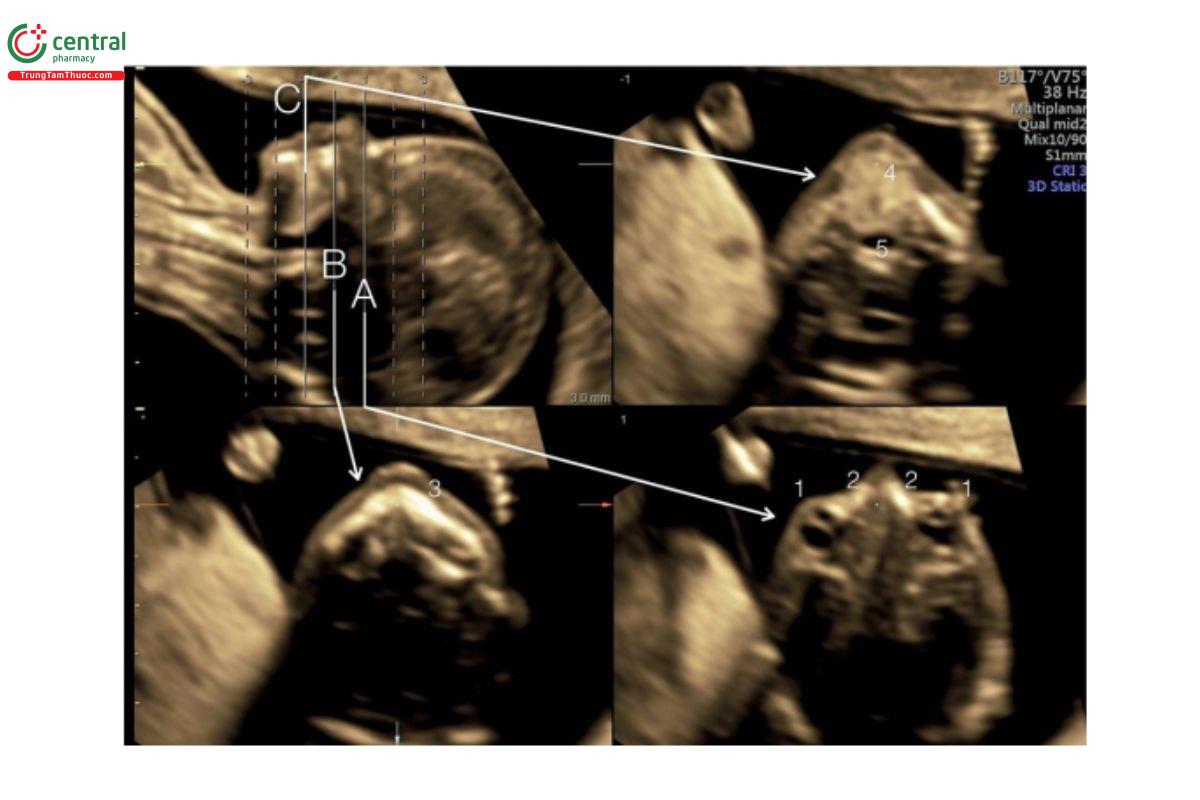
Hình 9.13: Siêu âm 3D mặt thai nhi thu được qua ngả âm đạo ở thai nhi 12 tuần tuổi và được hiển thị ở chế độ cắt lớp. Ở hình ảnh tham chiếu (phía trên bên trái), cho thấy mặt cắt dọc giữa và các mặt cắt vành cắt lớp tương ứng được hiển thị với mặt cắt A ở mức mắt (1), mặt cắt B ở mức hàm trên (3) và mặt cắt C ở mức lưỡi (4). Các mỏm hàm trên (2) và hầu (5) cũng được cho thấy tương ứng ở A và C. Siêu âm 3D đầu thai nhi ở tuổi thai nhỏ cho phép đánh giá chi tiết giải phẫu khuôn mặt.
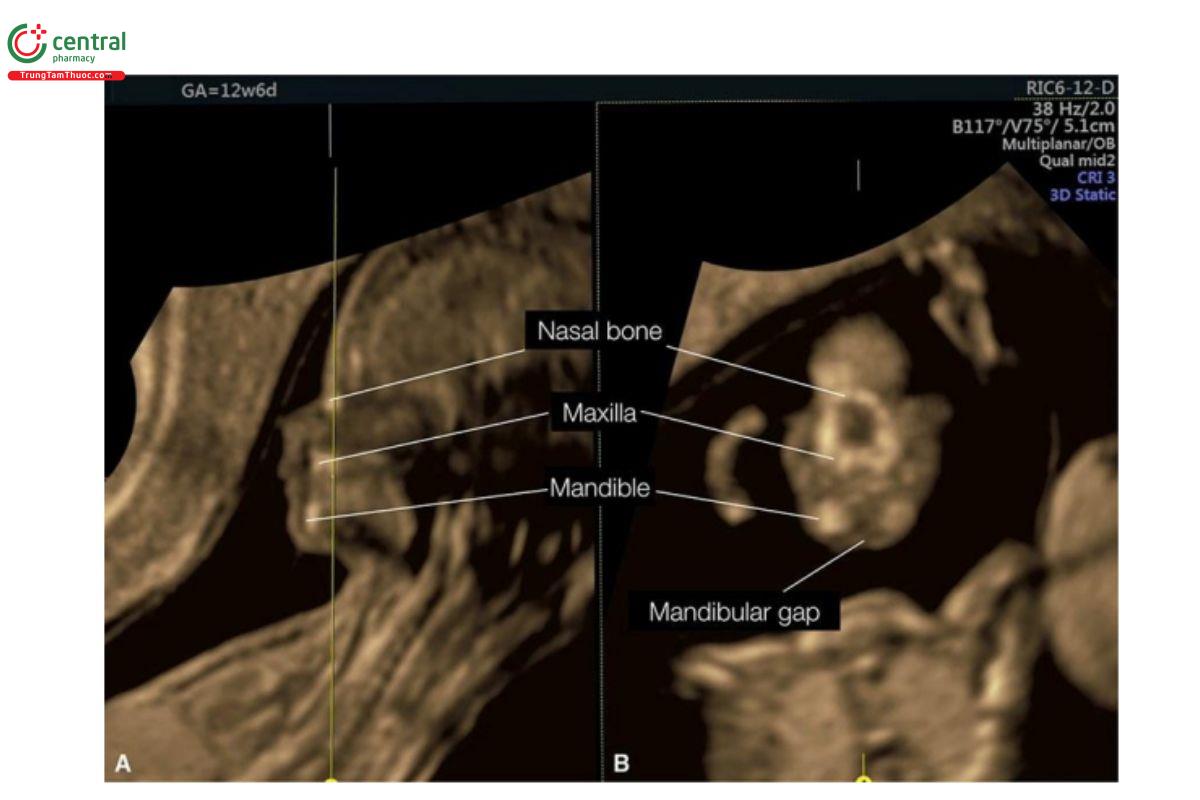
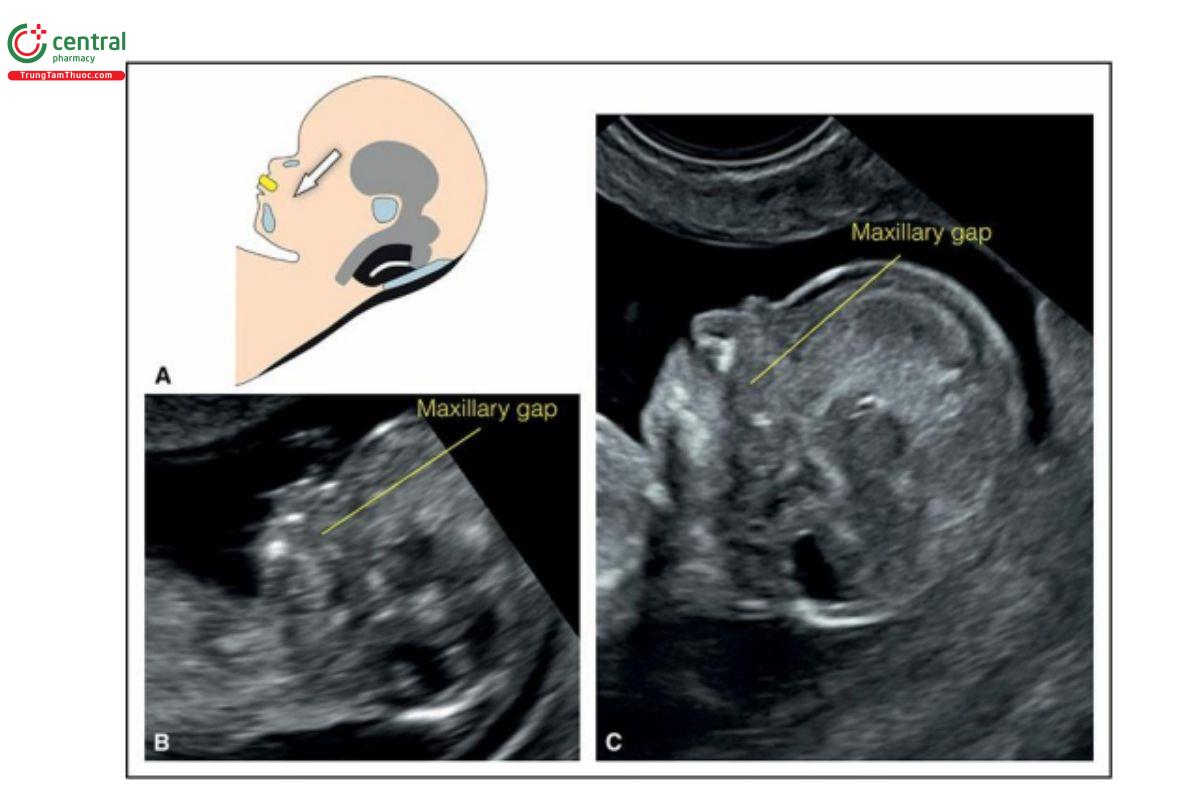
Hình 9.14: Siêu âm 3D mặt thai nhi thu được qua ngả âm đạo ở thai nhi 12 tuần tuổi và được hiển thị ở chế độ cắt lớp. Trong hình này, chỉ có 2 mặt cắt được hiển thị: mặt cắt A, là mặt cắt dọc giữa đầu với các đặc điểm của khuôn mặt và mặt cắt B là mặt cắt vành tương ứng ở mức đường màu vàng. Lưu ý, mặt cắt B cho thấy tam giác sau mũi (retronasal triangle) với khe hở hàm dưới (mandibular gap). Xem Hình 9.7 để biết thêm chi tiết.
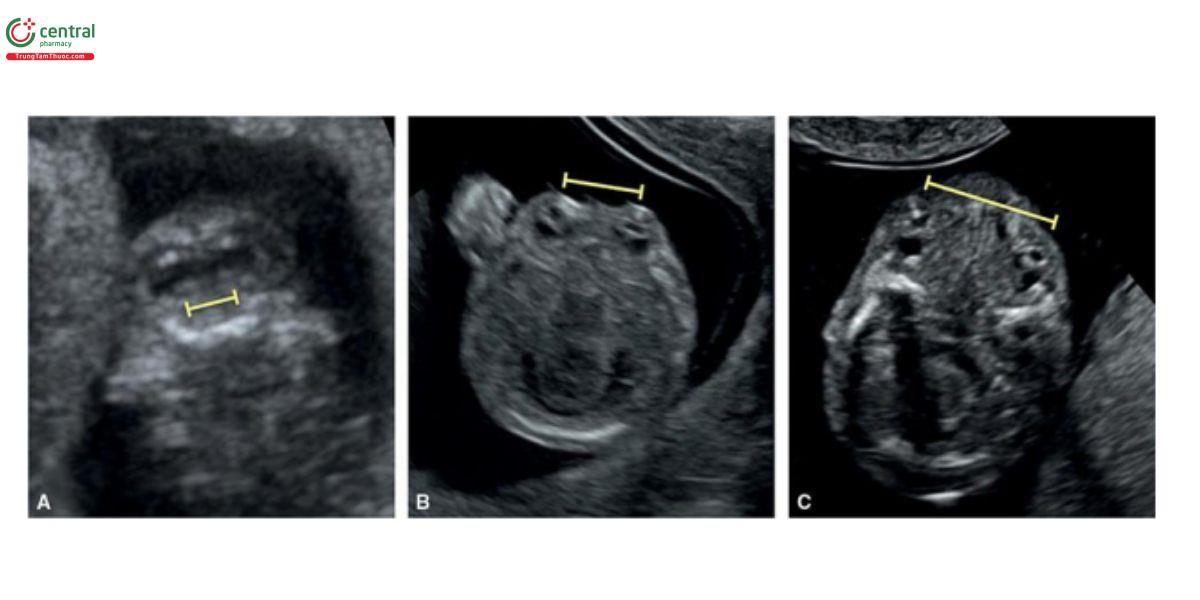
4 CHỈ SỐ SINH TRẮC HỌC CỦA KHUÔN MẶT
Hiện nay, một số chỉ số sinh trắc học đã được công bố để đánh giá các đặc điểm của khuôn mặt trong quý 2 và 3, và một vài chỉ số này được đề xuất sử dụng trong siêu âm sàng lọc quý 1, bao gồm đường kính, tỷ số và góc, chủ yếu được thực hiện ở mặt cắt dọc giữa mặt thai nhi, và chủ yếu được dùng trong quý 1 để sàng lọc các thể lệch bội (aneuploidies) hoặc phát hiện khe hở mặt (facial clefts) và tật cằm nhỏ (micrognathia). Một vài chỉ số này được thảo luận trong các phần sau.
4.1 Chiều dài xương mũi (Nasal Bone Length)
Khoảng tham chiếu đối với chiều dài xương mũi thai nhi được báo cáo trong quý 2 và 3, và xương mũi được mô tả là không có hoặc ngắn ở thai nhi bị trisomy 21.12 Phát hiện này được áp dụng để sàng lọc lệch bội ở tuổi thai từ 11 đến 14 tuần và Cicero và cộng sự 2 đã chứng minh rằng trong quý 1, xương mũi thiểu sản hoặc không cốt hóa ở phần lớn thai nhi bị trisomy 21^2 (Hình 9.15 và 6.1), ở các thể lệch bội và hội chứng khác (Hình 6.6, 6.8, 6.33 và 6.35). 13 Đánh giá xương mũi cũng được dùng để cải thiện hiệu quả của sàng lọc kết hợp (combined screening) hội chứng Down trong quý 1.13,14 Bảng 1.2 trong Chương 1 tóm tắt các tiêu chí cần thiết để đánh giá xương mũi chính xác trong quý 1.
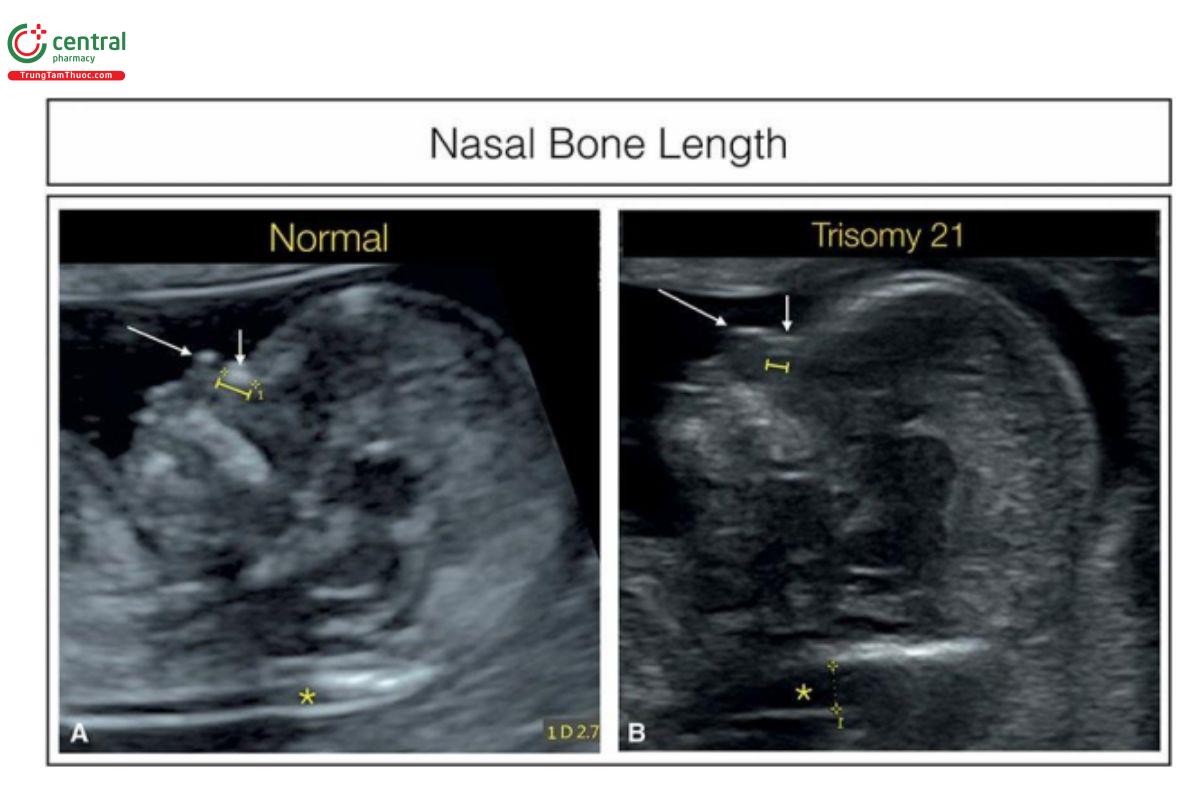
Hình 9.15: Mặt cắt dọc giữa mặt thai nhi cho thấy số đo chiều dài xương mũi ở thai nhi bình thường (A) và thai nhi bị trisomy 21 (B). Trong > 1/2 số thai nhi bị trisomy 21, xương mũi hoàn toàn không cốt hóa hoặc như trong trường hợp này, xương mũi cốt hóa kém, dẫn đến ngắn và mỏng. Mũi tên dài chỉ vào chóp (tip) mũi và mũi tên ngắn chỉ vào da mũi. Phép đo độ mờ da gáy cũng được thực hiện (dấu hoa thị). So sánh với Hình 1.3 trong Chương 1 và Hình 9.16.
4.2 Độ dày trước mũi (Prenasal Thickness)
Da vùng trán, được gọi là "độ dày trước mũi," tăng trong quý 2 ở thai nhi bị trisomy 2115,16 đã dẫn đến việc ứng dụng ―marker‖ này vào trong quý 1 (Hình 9.16). Để giảm tỷ lệ dương tính giả của số đo độ dày trước mũi, tỷ số giữa độ dày trước mũi và chiều dài xương mũi đã được đề xuất (Hình 9.16). Ở thai nhi bình thường, độ dày trước mũi nhỏ và xương mũi tương đối dài, dẫn đến tỷ số xấp xỉ 0,6 5 . Trong quý 1, thai nhi bị trisomy 21, độ dày trước mũi tăng, trong khi chiều dài xương mũi giảm, dẫn đến tỷ số > 0,8.
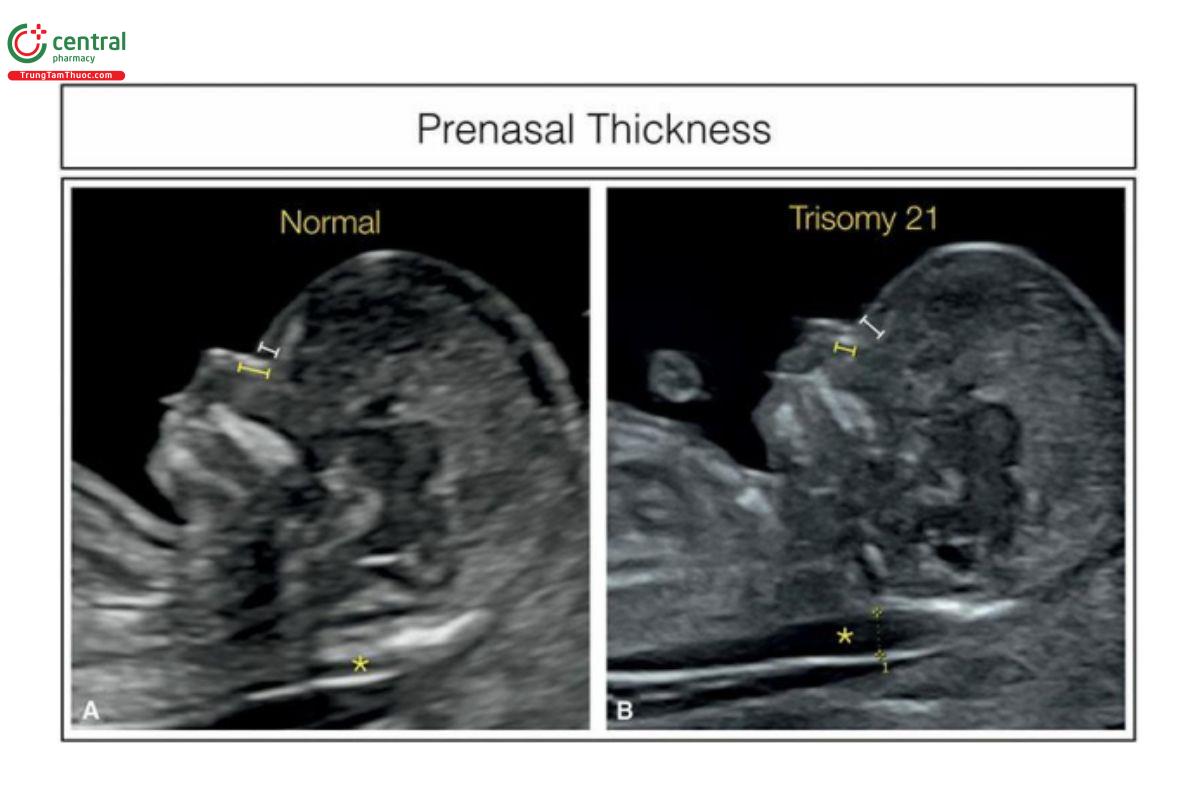
Hình 9.16: Mặt cắt dọc giữa mặt thai nhi cho thấy độ dày trước mũi ở thai nhi bình thường (A) và thai nhi bị trisomy 21 (B). Độ dày trước mũi được áp dụng từ quý 2, bởi thai nhi bị trisomy 21 cho thấy tăng độ dày trước mũi. Độ dày trước mũi (đường màu trắng) được đo như ở A và B. Lưu ý, độ dày trước mũi tăng ở thai nhi B bị trisomy 21. Để giảm tỷ lệ dương tính giả, tỷ số độ dày trước mũi (đường màu trắng)/ chiều dài xương mũi (đường màu vàng) đã được đề xuất. Ở thai nhi bình thường, tỉ số này < 0,6 và tăng lên ở thai nhi bị trisomy 21. Lưu ý ở A, đường màu trắng ngắn hơn đường màu vàng, trong khi ở B thì ngược lại. Phép đo độ mờ da gáy cũng được thực hiện (dấu hoa thị).
4.3 Chiều dài xƣơng hàm trên (Maxillary Length)
Thai nhi bị trisomy 21 có khuôn mặt phẳng do thiểu sản giữa mặt (midfacial hypoplasia), tạo thành đặc điểm đặc trưng là lưỡi nhô ra (protruding tongue). Đo chiều dài xương hàm trên trong khoảng thời gian từ 11 đến 14 tuần tuổi thai được đề xuất như một phương pháp để xác định tình trạng thiểu sản giữa mặt. 3 Phép đo được thực hiện ở mặt cắt hơi dọc bên của mặt và bao gồm cả khớp hàm dưới.3 Chiều dài xương hàm trên ngắn ở thai nhi bị trisomy 21.3 Thiểu sản giữa mặt cũng có thể được đánh giá gián tiếp bởi góc trán hàm trên (frontomaxillary facial angle), bao gồm cả hàm trên.18 Góc trán hàm trên sẽ được thảo luận trong phần tiếp theo.
4.4 Góc trán hàm trên (Frontomaxillary Facial Angle)
Góc trán hàm trên (FMF) là góc giữa hàm trên và trán với thai nhi bình thường có số đo góc là 85° (± 10°) (Hình 9.17A). 18 Góc FMF rộng được báo cáo ở thai nhi bị trisomy 214,19 (Hình 9.17B), trong khi góc FMF hẹp được phát hiện ở thai nhi bị tật chẻ đôi đốt sống thể hở (open spina bifida) (Hình 9.18). 20 Góc FMF bất thường cũng được báo cáo ở thai nhi bị trisomy 18 với thiểu sản giữa mặt (midfacial hypoplasia) và cằm nhỏ (micrognathia) 21 và thai nhi bị trisomy 13 kèm theo não thất duy nhất (holoprosencephaly). 22 Tuy nhiên, nên thận trọng khi đánh giá góc FMF vì các mặt cắt hơi chếch sẽ cho kết quả dương tính và âm tính giả. Đo góc FMF bằng cách sử dụng công cụ dựng hình đa mặt cắt 3D (3D multiplanar rendering) có thể giúp cải thiện độ chính xác.18,23 Góc FMF rộng ở thai nhi bị lệch bội, có thể là do xương hàm trên ngắn, trong khi ở tật chẻ đôi đốt sống (spina bifida), góc hẹp có thể là do đầu nhỏ dẹt vì não dịch chuyển ra sau và giảm lượng dịch não tủy trong não thất. Một góc khác là góc hàm trên–gốc mũi–hàm dưới (maxilla–nasion–mandible: MNM) và sử dụng gốc mũi làm điểm tham chiếu giao nhau của xương trán và xương mũi.8,24 Góc MNM được định nghĩa là góc giữa đường hàm trên–điểm gốc mũi và đường hàm dưới–điểm gốc mũi ở mặt cắt dọc giữa và có thể được dùng để xác định thai có nguy cơ cao bị lệch bội, cằm nhỏ và khe hở mặt.
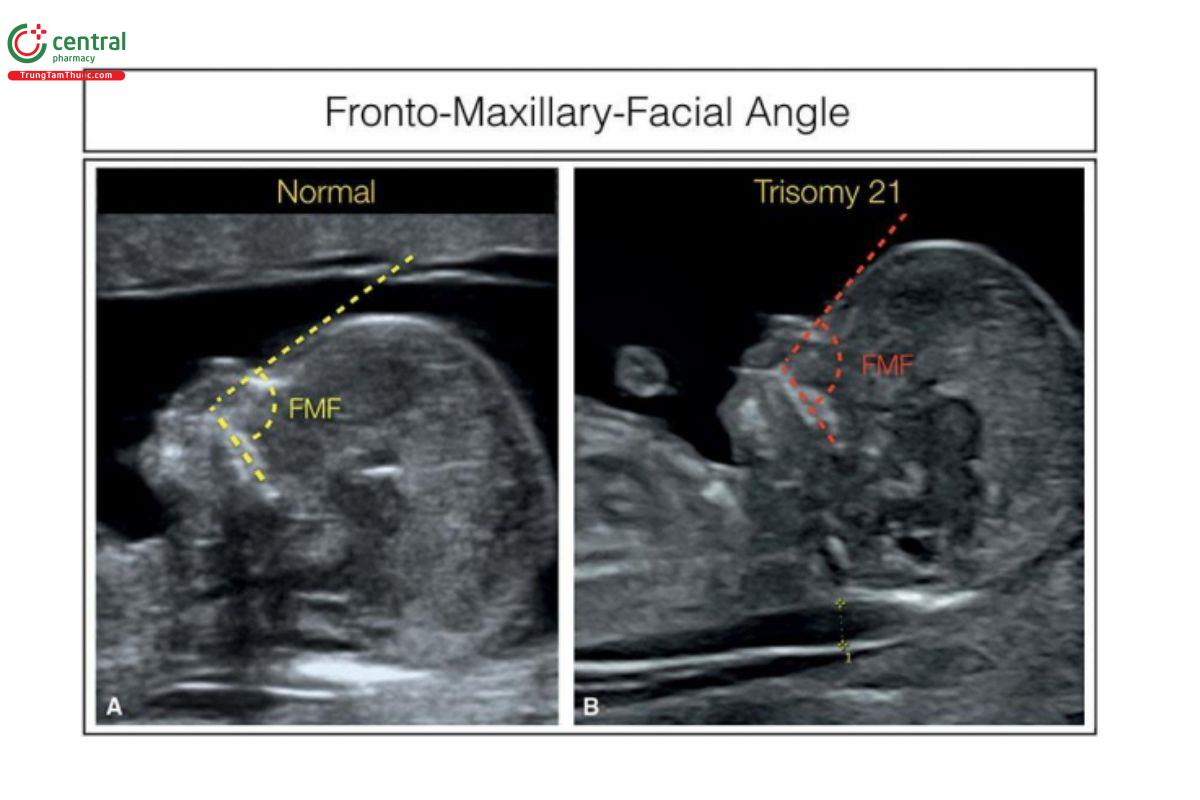
Hình 9.17: Mặt cắt dọc giữa mặt thai nhi cho thấy số đo góc trán-hàm trên (FMF) ở thai nhi bình thường (A) và thai nhi bị trisomy 21 (B). Góc FMF được đo ở mặt cắt dọc giữa mặt, giữa hàm trên và trán, như được cho thấy ở A và B. Ở thai nhi bình thường (A), góc xấp xỉ 85° (đường màu vàng), trong khi ở thai nhi bị trisomy 21 (B), góc > 85° (đường màu đỏ). Phép đo độ mờ da gáy cũng được thực hiện ở thai B. Xem thêm Hình 9.18.
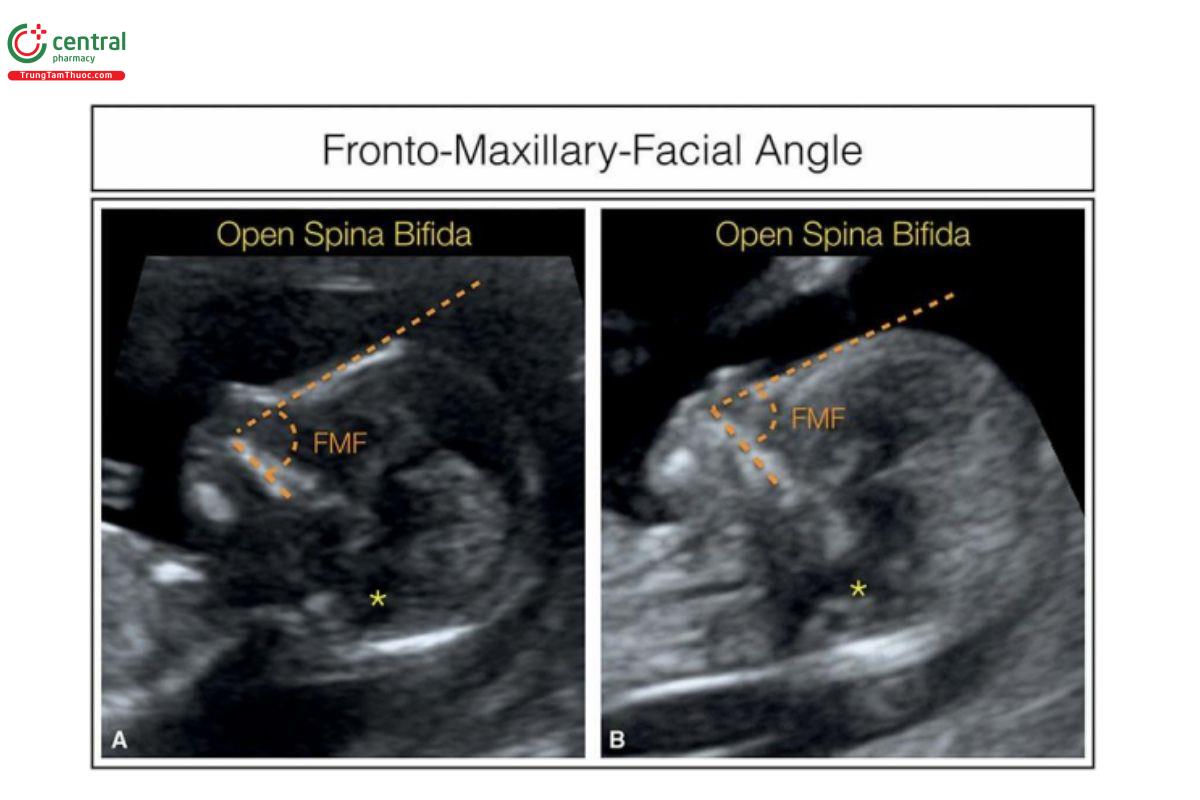
Hình 9.18: Mặt cắt dọc giữa mặt thai nhi cho thấy số đo góc trán-hàm trên (FMF) ở 2 thai nhi (A và B) có tật chẻ đôi đốt sống thể hở. Góc FMF thường nhỏ hơn ở thai nhi có tật chẻ đôi đốt sống do đầu nhỏ hơn và giảm lượng dịch não tủy trong não thất, dẫn đến khuôn mặt phẳng. Lưu ý, thân não dày (dấu hoa thị) và dịch não tủy gần như không có trong khoảng sáng nội sọ (IT).
4.5 Khoảng cách không gian trƣớc trán (Prefrontal Space Distance)
Khoảng cách không gian trước trán (PSD) thu được bằng cách vẽ một đường từ mặt trước của cả xương hàm dưới và xương hàm trên và kéo dài về phía trán thai nhi (Hình 9.19). 6,7 PSD được tính bằng khoảng cách từ da trước mũi đến đường kéo dài này (Hình 9.19), và có thể có giá trị dương hoặc âm.6 PSD bất thường ở thai nhi bị lệch bội, như trisomy 21, 18 và 13,6 cũng như ở thai nhi có cằm nhỏ và khe hở mặt 7 (Hình 9.19).
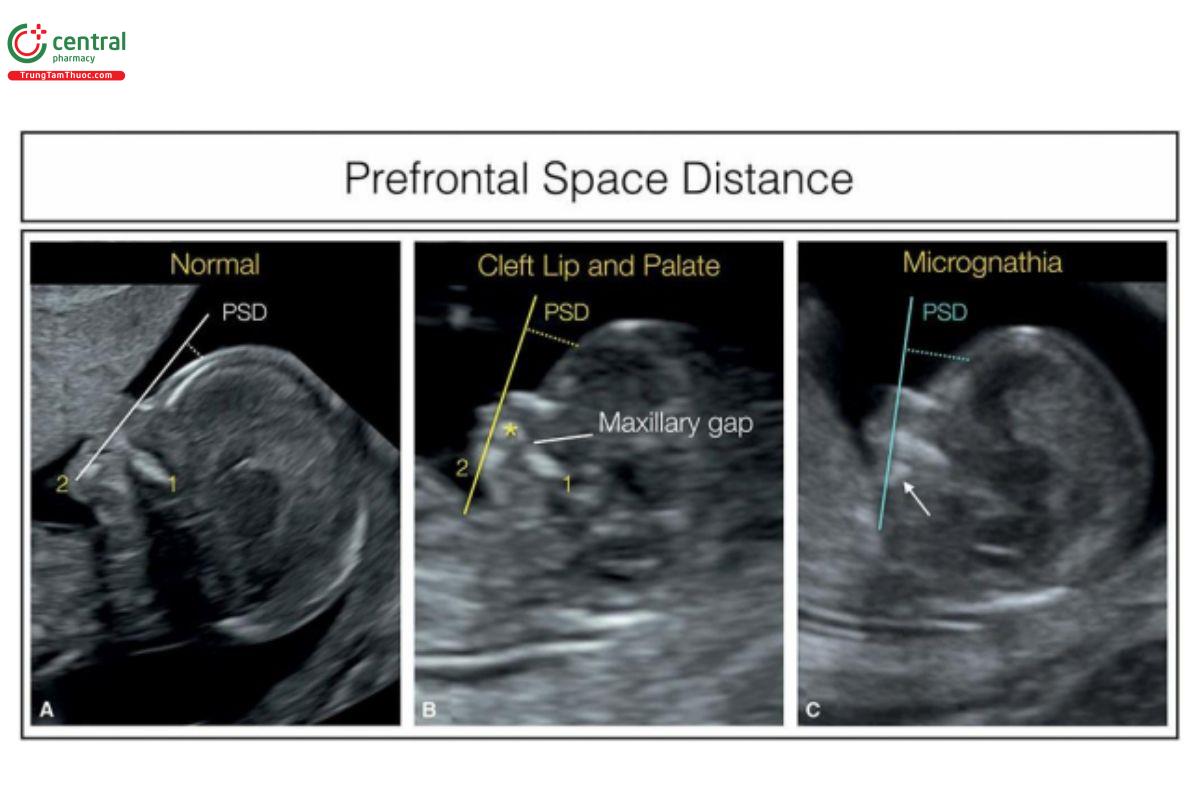
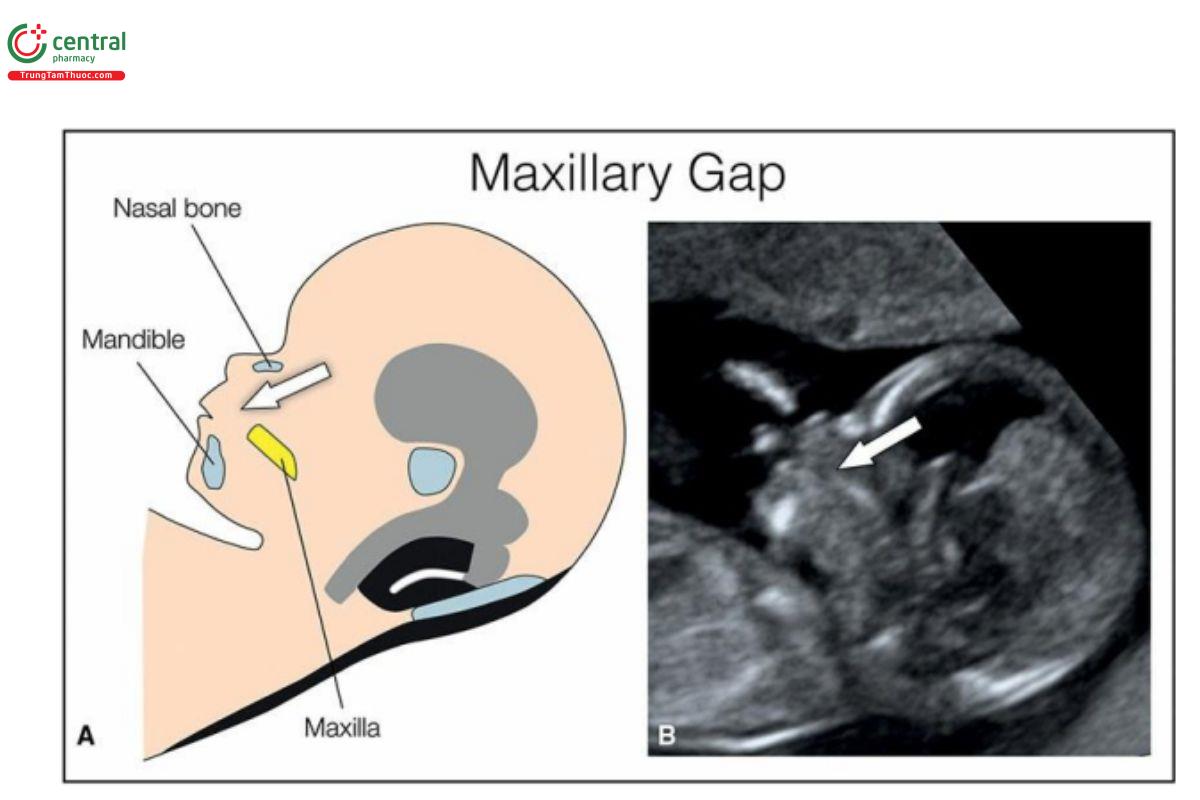
Hình 9.19: Mặt cắt dọc giữa mặt thai nhi cho thấy số đo khoảng cách không gian trước trán (prefrontal space distance) ở thai nhi bình thường (A), thai nhi bị khe hở môi và vòm miệng (B), và thai nhi có cằm nhỏ (C). Khoảng cách không gian trước trán (PSD) là khoảng cách giữa trán và một đường được vẽ từ mặt trước của xương hàm trên (1) và hàm dưới (2). Ở thai bình thường (A), PSD khá ngắn. Khi bị sứt môi (thai B), hàm trên nhô ra (dấu hoa thị) và PSD tăng. Khi có tật cằm nhỏ (thai C), hàm dưới bị dịch chuyển ra sau (mũi tên), cũng làm tăng PSD. Lưu ý, ở thai B, hàm trên bị gián đoạn, được gọi là khe hở hàm trên (maxillary gap), một dấu hiệu của khe hở môi và vòm miệng ở mặt cắt dọc giữa.
4.6 Kích thƣớc và khoảng cách hai hốc mắt
Theo hiểu biết của chúng tôi, hiện nay, không có biểu đồ nào về kích thước của hốc mắt và khoảng cách gian hốc mắt trong quý 1, và các phép đo như vậy không được thực hiện thường quy. Gần đây, có một bài báo về khoảng cách giữa hai thủy tinh thể (interlens distance), bắt đầu từ 12 tuần tuổi thai.
5 BẤT THƯỜNG MẶT THAI NHI TRONG CÁC THỂ LỆCH BỘI VÀ DỊ TẬT HỆ THẦN KINH TRUNG ƯƠNG
5.1 Đặc điểm khuôn mặt thai nhi trong các thể lệch bội
Thai nhi bị trisomy 21 thường có khuôn mặt phẳng bất thường với xương mũi không có hoặc thiểu sản (Hình 9.15), xương hàm trên ngắn, góc FMF tăng (Hình 9.17) và độ dày trước mũi dày (Hình 9.16). Đặc điểm khuôn mặt tương tự cũng có thể thấy ở thai nhi bị trisomy 18, ngoài khe hở mặt (facial clefts) và cằm tụt sau (retrognathia). Thai nhi bị trisomy 13 cho thấy các dị tật nghiêm trọng trên khuôn mặt do hay kèm theo não thất duy nhất (holoprosencephaly) (Hình 9.20) và / hoặc khe hở mặt. Các "marker" siêu âm của các thể lệch bội, bao gồm các bất thường trên khuôn mặt trong quý 1, đã được thảo luận chi tiết trong Chương 6.
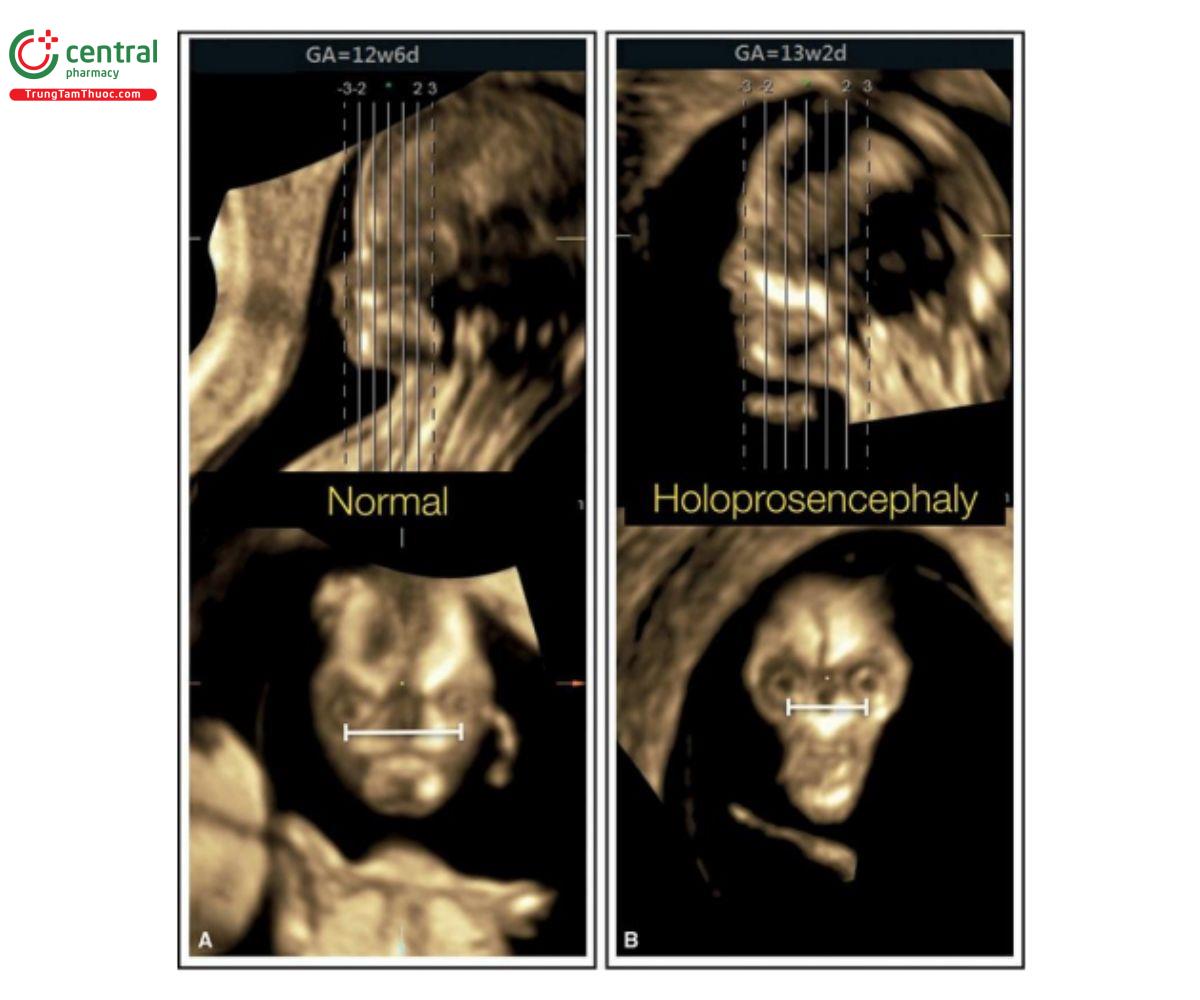
5.2 Não thất duy nhất (Holoprosencephaly)
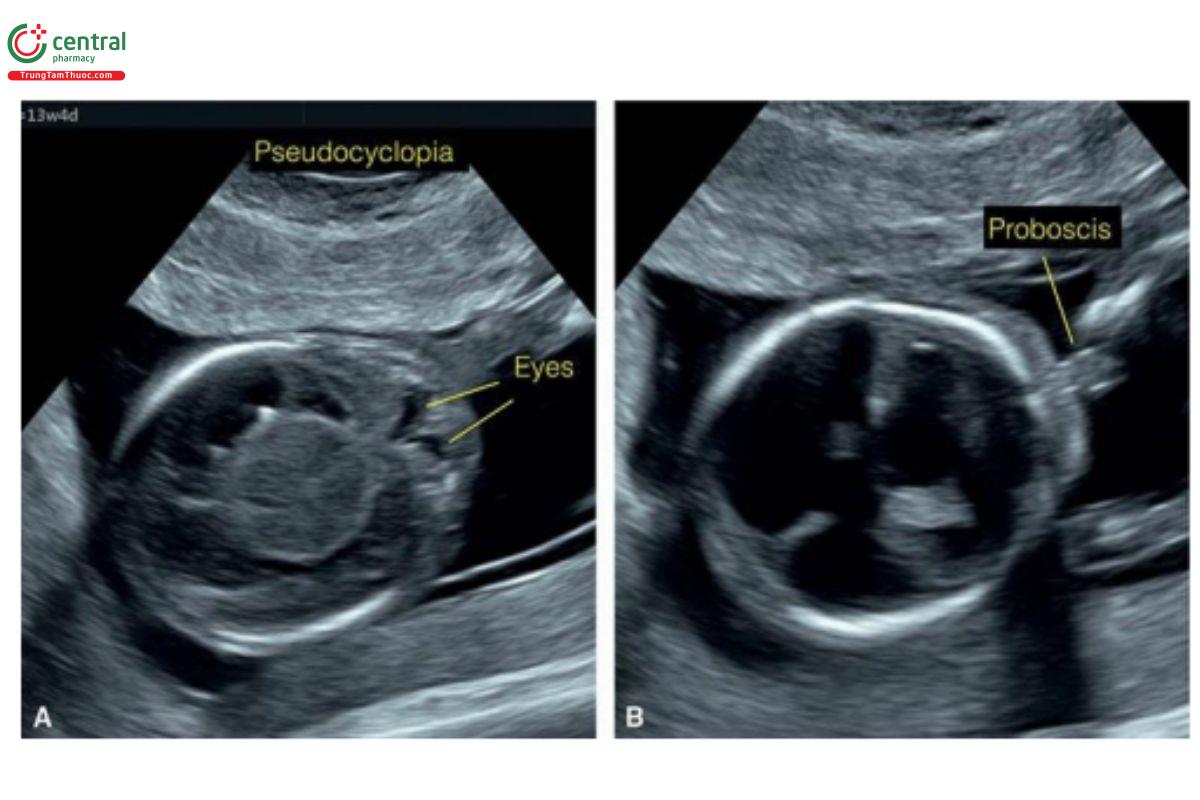
Não thất duy nhất thể phân thùy (Lobar) và bán phân thùy (semilobar) thường kèm theo các bất thường trên khuôn mặt như chỉ có một hốc mắt (cyclopia), giảm khoảng cách gian hốc mắt (hypotelorism), vòi voi (proboscis), tật đầu khỉ (cebocephaly), bất sản xương hàm dưới (agnathia)-não thất duy nhất, thiểu sản mũi và khe hở mặt.26 Trong hầu hết các trường hợp, khuôn mặt bất thường nghiêm trọng, ngoài não và hình dạng đầu bất thường. Hình 9.10 và 9.20 cho thấy các khuôn mặt bất thường ở thai nhi mắc não thất duy nhất thể không phân thùy. Não thất duy nhất đã được thảo luận chi tiết trong Chương 8.
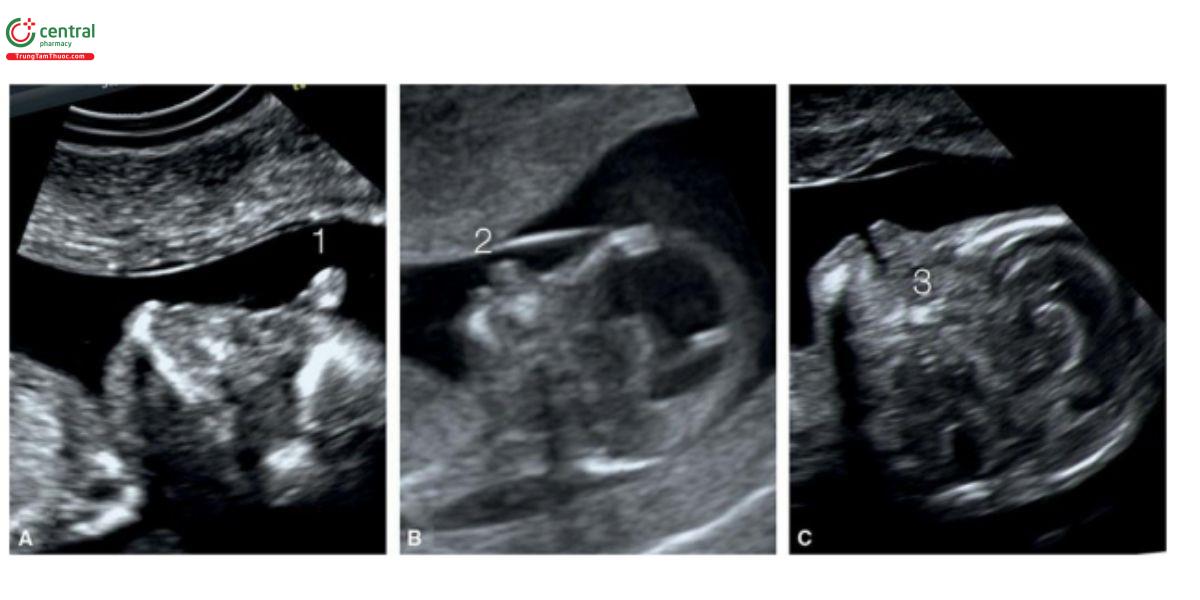
Hình 9.20: Mặt cắt dọc giữa mặt ở 3 thai nhi (A – C) với não thất duy nhất thể không phân thùy tương ứng ở 11, 12 và 13 tuần tuổi. Ở thai A, không thấy cấu trúc bình thường nào của khuôn mặt và có thể thấy vòi voi (1) ở đường giữa. Ở thai B, thấy tật đầu khỉ với mũi bất thường (2) (so sánh với hình ảnh 3D trong Hình 9.10). Thai C, ở mặt cắt dọc giữa, không thấy hàm trên (3) do có khe hở lớn ở đường giữa.
5.3 Acrania / Anencephaly / Exencephaly
Trong acrania / anencephaly / exencephaly, mặt cắt dọc giữa và mặt cắt vành qua trán của mặt có các bất thường đặc trưng với mắt to và mặt nhỏ. Mặt cắt dọc giữa mặt ở Hình 9.21 cho thấy các hình dạng khác nhau của vùng trán trong acrania. Các bất thường về cấu trúc khuôn mặt trong anencephaly / exencephaly đã được thảo luận chi tiết trong Chương 8.
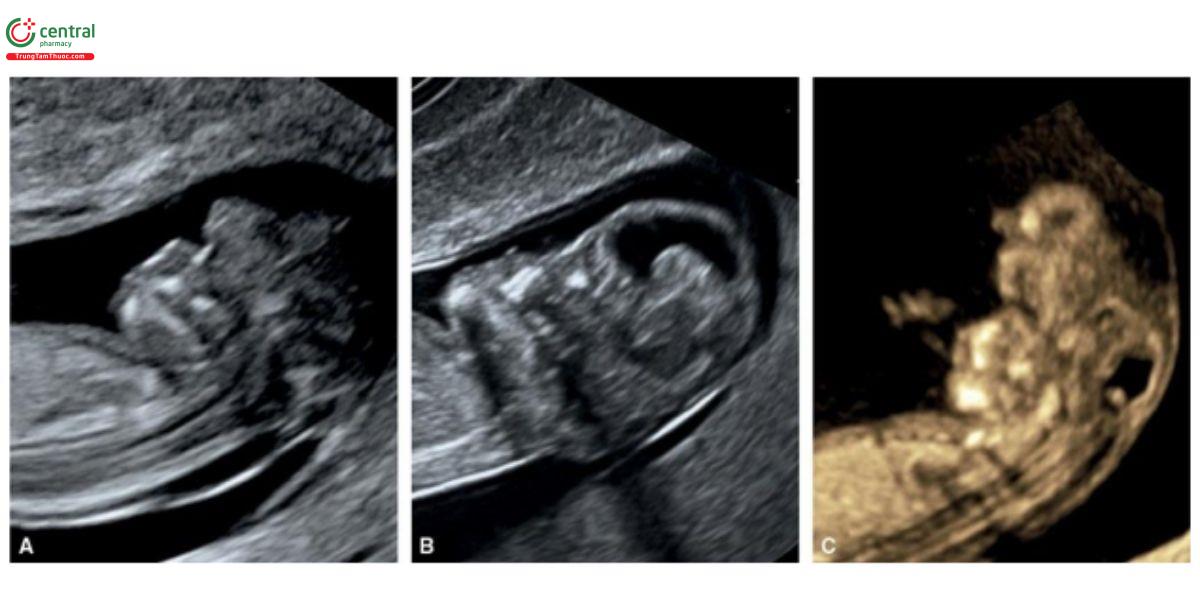
Hình 9.21: Mặt cắt dọc giữa mặt ở 3 thai nhi bị acrania / exencephaly tương ứng ở 10 (A), 12 (B) và 11 (C) tuần tuổi. Lưu ý, các khía cạnh khác nhau của acrania / exencephaly ở tuổi thai nhỏ trên siêu âm. Không thấy trán bình thường và vùng mũi cũng bất thường.
5.4 Tật chẻ đôi đốt sống thể hở (Open Spina Bifida)
Tật chẻ đôi đốt sống thể hở có liên quan với giảm dịch não tủy ở đầu, làm cho đầu nhỏ, với đường kính lưỡng đỉnh (BPD) nhỏ. 27 Trong 90% trường hợp, rò rỉ dịch não tủy dẫn đến trán phẳng và góc FMF giảm khoảng 10°. 20 Hình 9.18A và B cho thấy đặc điểm khuôn mặt với trán phẳng ở 2 thai nhi có tật chẻ đôi đốt sống thể hở trong quý 1.
5.5 Epignathus
Epignathus là một u quái miệng hầu (oropharyngeal teratoma), thường có nguồn gốc từ khoang miệng. Nguồn gốc có thể là từ xương bướm (sphenoid bone), vòm miệng, lưỡi hoặc hầu. 28,29 Thường phát triển ra ngoài khoang miệng, nhưng epignathus cũng có thể phát triển vào não và mặt. Các báo cáo về bất thường rất hiếm gặp này thường từ những thai được chẩn đoán trong quý 2 hoặc 3, nhưng tương tự như u quái ở các vị trí khác (xem Chương 14), và cũng có thể thấy rõ trong quý 1 (Hình 9.22). Đặc điểm điển hình là khối lồi ra ở vùng miệng có hình dạng không đều với hỗn hợp mô tăng âm với một số cấu trúc dạng nang. Nếu khối lồi ra nhỏ, nó có thể trông giống như sứt môi 2 bên, nhưng siêu âm chi tiết cho thấy hình dạng không đều trong epignathus, không điển hình cho khe hở mặt. Hình 9.22 cho thấy một epignathus, thấy rõ ở mặt cắt dọc giữa mặt lúc thai nhi 13 tuần tuổi.
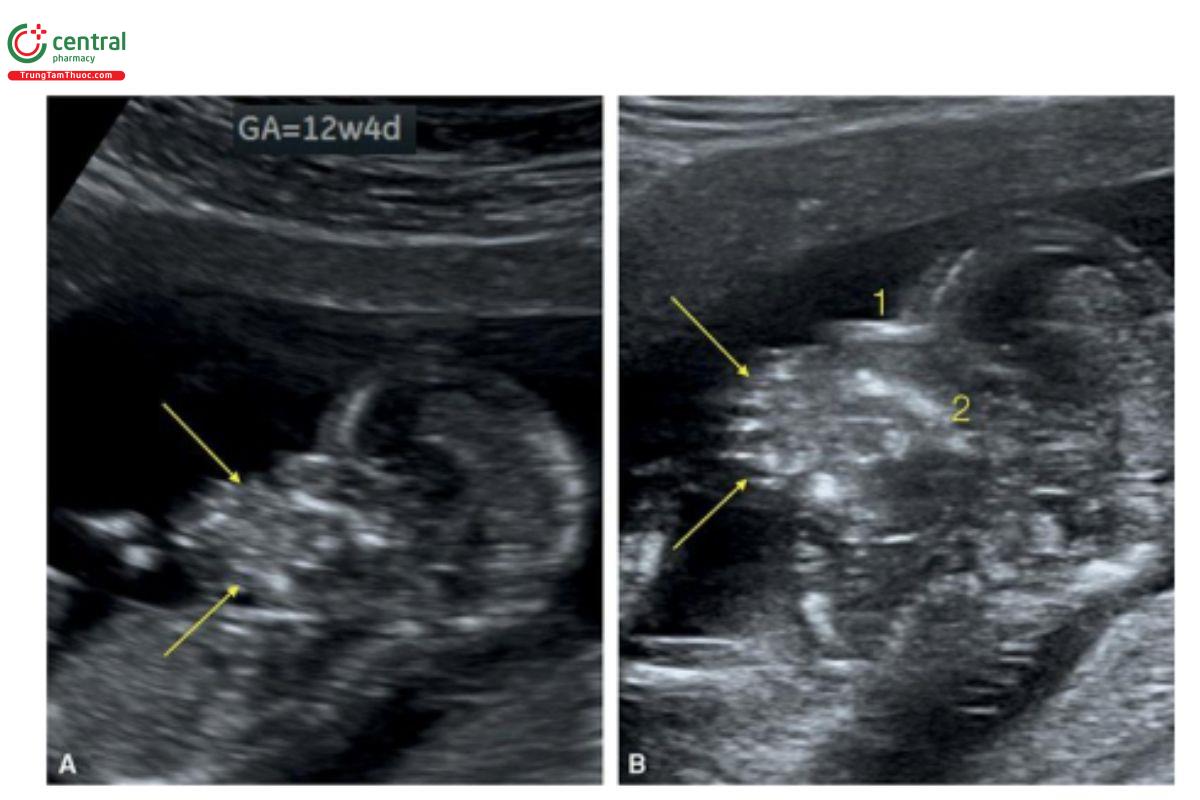
Hình 9.22: Mặt cắt dọc giữa mặt ở thai nhi 12 tuần tuổi bị epignathus. B là hình ảnh phóng to của A. Lưu ý, khối u đặc (các mũi tên) có nguồn gốc từ miệng thai nhi. Xương mũi (1) và xương hàm trên (2) được xác định ở đường giữa.
5.6 Thoát vị não vùng trán (Frontal Cephalocele)
Như đã thảo luận trong Chương 8, hầu hết các thoát vị não phát sinh từ vùng chẩm, nhưng cũng có thể từ vùng đỉnh hoặc vùng trán. 30 Thoát vị não vùng trán, còn được gọi là thoát vị não trước, ít gặp hơn các loại thoát vị não khác. Trong nghiên cứu của Sepulveda và cộng sự 30, chỉ có 3/25 (9%) trường hợp thoát vị não ở vùng trán. Thoát vị não vùng trán có thể là một thoát vị màng não (meningocele) với giải phẫu nội sọ bình thường hoặc thoát vị não-màng não (encephalocele) với mô não nhô ra qua chỗ khiếm khuyết dẫn đến các thay đổi nội sọ. Trong quý 1, khi nghi ngờ thoát vị não vùng trán hoặc vùng đỉnh, cần phải xem xét hội chứng dải ối (amniotic band syndrome) (xem Chương 8). Chẩn đoán phân biệt với thoát vị não vùng trán bao gồm vòi voi trong não thất duy nhất (proboscis in holoprosencephaly), u thần kinh đệm (glioma) ở mũi hoặc u quái. Trong não thất duy nhất, có thêm các dấu hiệu đặc trưng trên khuôn mặt và trong não, giúp phân biệt vòi voi với thoát vị não. Trong quý 1, không thể dự đoán được tiên lượng của thoát vị não vùng trán, nhưng nếu thoát vị não vùng trán được phát hiện ở tuổi thai càng nhỏ, thì tiên lượng càng xấu. Hình 9.23 cho thấy một thai 11 tuần tuổi với thoát vị não vùng trán.
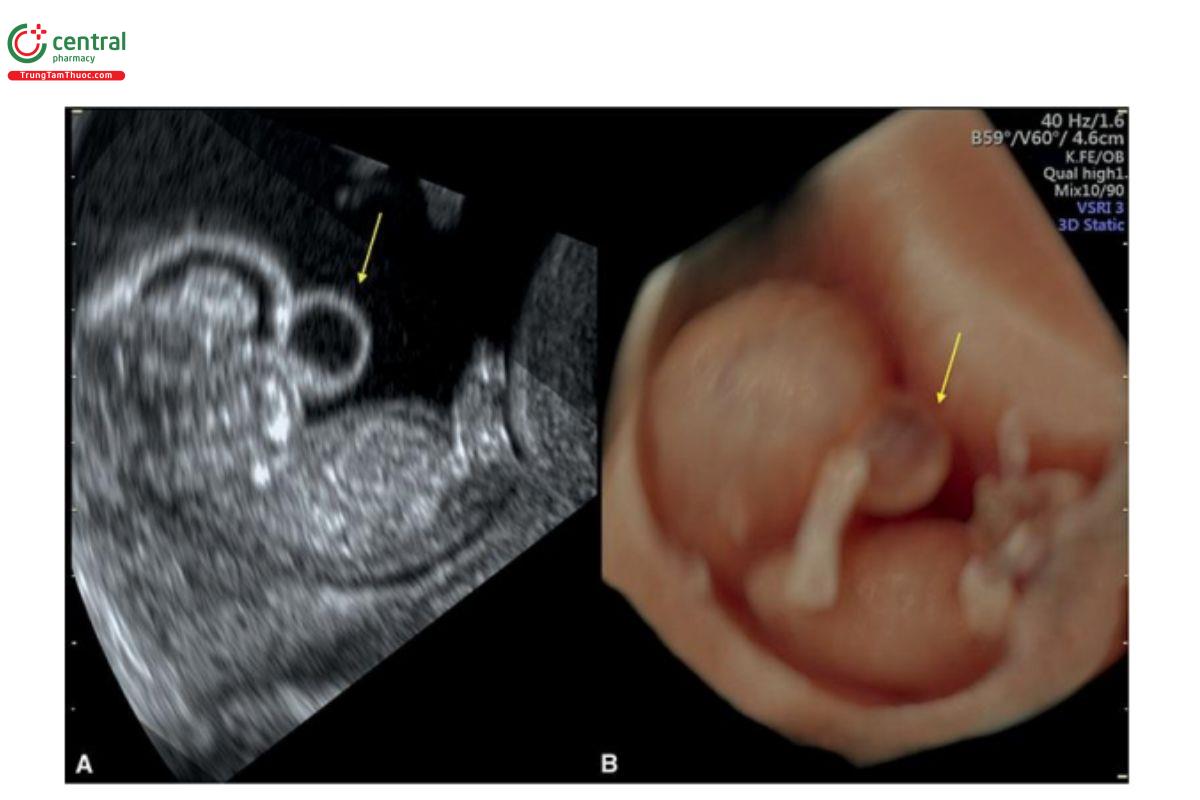
Hình 9.23: Thai nhi 11 tuần tuổi bị thoát vị não trước, mặt cắt dọc giữa đầu trên siêu âm 2D ở A và siêu âm 3D ở chế độ bề mặt (surface mode) ở B. Khiếm khiếm có dạng nang gợi ý chẩn đoán thoát vị não.
5.7 Rối loạn hố sau
Rối loạn hố sau với bất thường tiểu não, tăng lượng dịch não tủy trong não thất bốn và / hoặc thân não bị chèn ép hoặc gấp khúc bất thường có thể gặp ở một số tình trạng, bao gồm lệch bội (aneuploidies), các hội chứng như hội chứng Walker–Warburg, hội chứng Joubert hoặc dị tật Dandy–Walker, và như một biến thể bình thường với tồn tại nang túi Blake (persistent Blake pouch cyst) (xem Chương 8). Rối loạn hố sau thường gặp trong trisomy 18 và 13 hoặc thể tam bội (triploidy) (Hình 9.24). Trong quý 1, khi nghi ngờ hội chứng Walker–Warburg, mắt có thể bị ảnh hưởng nên siêu âm qua ngả âm đạo với trọng tâm là mắt và thủy tinh thể có thể thấy các bất thường mà có thể phù hợp với chẩn đoán.31 Tiền sử mắc hội chứng này rất quan trọng vì nó là mục tiêu khi siêu âm thai quý 1. Tuy nhiên, điều quan trọng cần lưu ý, trong quý 1, không có đục thủy tinh thể (cataract) cũng không thể loại trừ hội chứng Walker–Warburg vì nó có thể không biểu hiện rõ ràng cho đến giai đoạn sau thai kỳ.
.jpg)
Hình 9.24: Mặt cắt dọc giữa đầu ở 4 thai nhi (A – D) với dãn hố sau (dấu hoa thị) tương ứng ở 12, 12, 14 và 13 tuần tuổi. Thai A bị trisomy 18 với không có xương mũi với khe hở môi và vòm miệng được nhận biết bởi khe hở hàm trên (maxillary gap). Thai B bị trisomy 13 với cằm nhỏ (micrognathia) (mũi tên). Thai C và D không có dấu hiệu bất thường trên khuôn mặt ở mặt cắt dọc giữa, và siêu âm theo dõi xác nhận dị tật Dandy – Walker ở cả 2 thai nhi.
6 CÁC BẤT THƯỜNG TRÊN KHUÔN MẶT THAI NHI
6.1 Khe hở môi và vòm miệng
6.1.1 Định nghĩa
Khe hở môi và vòm miệng (CLP) là một trong những dị tật bẩm sinh phổ biến nhất, với tỷ lệ mắc mới 1/700 đến 1/1.000 trẻ sinh sống. 32,33 Do tỷ lệ hiện mắc của CLP cao, đánh giá môi trên và nhân trung (philtrum) hiện là một phần của siêu âm sản khoa cơ bản trong quý 2. 34 Trong số các trường hợp CLP, khoảng 1/3 chỉ ảnh hưởng đến môi, và 2/3 ảnh hưởng cả môi và vòm miệng. 35 CLP có thể đơn độc hoặc kèm theo một loạt các bất thường nhiễm sắc thể và hội chứng di truyền. Khoảng 1/3 số bệnh nhân bị CLP không hội chứng (nonsyndromic) có tiền sử gia đình bị CLP và nhờ những tiến bộ di truyền gần đây, đã xác định được một số locus mới có liên quan đáng kể với CLP.36 CLP thường gặp ở nam giới hơn (nam / nữ = 1,7), đặc biệt là CLP đơn độc. 35 Có nhiều phân loại khe hở mặt khác nhau, 35, 37,38 và trong quý 1, thường khó thu thập được tất cả các chi tiết cần thiết để phân loại chính xác CLP. Trước sinh, và đặc biệt trong quý 1, chúng tôi khuyến nghị dùng phân loại CLP của Nyberg (Hình 9.25), với type 1 là sứt môi đơn độc, type 2 là CLP một bên, type 3 là CLP hai bên, type 4 là CLP ở đường giữa, và type 5 là khe hở mặt toàn bộ (complete facial clefts), chủ yếu gặp trong hội chứng dải ối (amniotic band syndrome).
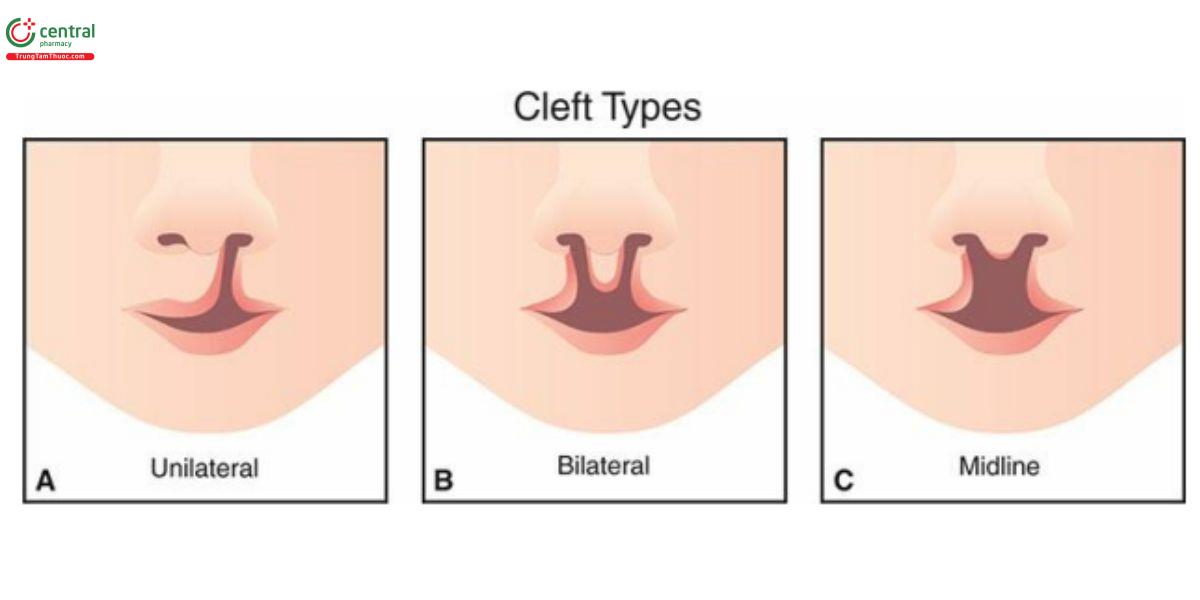
Hình 9.25: Hình vẽ minh họa khe hở môi và vòm miệng điển hình (CLP) trên siêu âm ở tuổi thai nhỏ. CLP có thể ở một bên, hoặc bên trái hoặc bên phải (A). CLP cũng có thể ở hai bên (B) với một giả khối (pseudomass) ở giữa hoặc đường giữa, như cho thấy ở C. Xem văn bản để biết thêm chi tiết.
6.1.2 Dấu hiệu trên siêu âm
Trong quý 1, thường khó chẩn đoán CLP đơn độc, chủ yếu là do các cấu trúc trên khuôn mặt có kích thước nhỏ. 39–41 Thật vậy, hầu hết các trường hợp CLP đơn độc không được phát hiện trong siêu âm quý 1. Nghiên cứu của Syngelaki và cộng sự 42 (xem Bảng 5.2 trong Chương 5), chỉ 1/20 (5%) thai nhi không lệch bội có khe hở mặt được phát hiện trong quý 1, trong khi đó, một nghiên cứu khác gần đây từ 2 trung tâm chuyển tuyến chuyên khoa, tỷ lệ phát hiện khe hở mặt đơn độc ở tuổi thai nhỏ là 24%. 43 Trong quý 1, mặt cắt dùng để phát hiện CLP tương tự như mặt cắt được dùng trong siêu âm quý 2, nhưng rất khó đánh giá vùng mũi - môi do các cấu trúc này có độ phân giải thấp và kích thước nhỏ. Do đó, để xác định CLP trong quý 1, chúng tôi khuyến nghị dùng mặt cắt ngang hàm trên hoặc mặt cắt vành hơi chếch của tam giác sau mũi (Hình 9.7). 9 Ngoài ra, khi siêu âm sàng lọc, dấu hiệu được chúng tôi báo cáo, được gọi là ―dấu hiệu khe hở hàm trên‖ (maxillary gap sign) (Hình 9.26 đến 9.32) khá đơn giản và có thể nghi ngờ CLP, nhưng cần được xác nhận ở mặt cắt ngang hàm trên hoặc mặt cắt vành hơi chếch của tam giác sau mũi (Hình 9.26 đến 9.32). Dấu hiệu khe hở hàm trên sẽ được thảo luận chi tiết hơn ở phần sau của phần này. Mặt cắt tam giác sau mũi (RNT), được đề xuất bởi Sepulveda và cộng sự, 9 là mặt cắt chếch của mũi và phần trước hàm trên (Hình 9.7) và được tạo thành bởi 2 xương mũi ở trên, lồi trán xương hàm trên ở bên, và ụ ổ răng (alveolar ridge) (vòm miệng nguyên phát) ở dưới 9 (Hình 9.7). Có thể thu được RNT từ mặt cắt dọc giữa mặt thai nhi bằng cách xoay đầu dò 90° và nghiêng nhẹ để đưa các lồi trán của xương hàm trên và vòm miệng nguyên phát vào cùng một mặt cắt. 44 CLP được chẩn đoán khi thấy khiếm khuyết ở vòm miệng nguyên phát ở mặt cắt RNT (Hình 9.28A). Trong một nghiên cứu tiến cứu sử dụng siêu âm 3D, xác định CLP trong quý 1 bằng mặt cắt RNT cho thấy độ nhạy 87,5% và độ đặc hiệu 99,9%,45 nhưng vẫn chưa rõ liệu với siêu âm 2D sàng lọc có đạt được độ nhạy như vậy hay không. Trong những trường hợp khó, siêu âm 3D có thể giúp đánh giá khuôn mặt và mặt cắt RNT và do đó đóng một vai trò quan trọng trong việc xác nhận CLP ở tuổi thai nhỏ (Hình 9.11). 11,39,45,46 RNT có lẽ là mặt cắt tốt nhất để phát hiện hoặc loại trừ CLP trong quý 1, nhưng mặt cắt này không phải lúc nào cũng dễ dàng thực hiện được và không phải là một phần của siêu âm sàng lọc. Như đã thảo luận trước đó và theo quan điểm của chúng tôi, tỷ lệ phát hiện CLP trong quý 1 có thể được cải thiện nếu một ―marker‖ siêu âm có thể được tích hợp vào siêu âm sàng lọc. Vì mục đích này, Chaoui và cộng sự đã báo cáo về khe hở hàm trên ở mặt cắt dọc giữa của thai nhi trong quý 1 như là một dấu hiệu của CLP (Hình 9.26). 43 Phát hiện này có ý nghĩa bởi mặt cắt dọc giữa của thai nhi thường được dùng để đánh giá NT, xương mũi và hố sau. Khe hở hàm trên gặp ở 96% trường hợp CLP không đơn độc (nonisolated) và > 65% trường hợp CLP đơn độc. 43 Tuy nhiên, khe hở hàm trên nhỏ có thể thấy ở 5% đến 7% thai nhi bình thường và có thể gây chẩn đoán dương tính giả 7,43 , và có thể liên quan đến tình trạng cốt hóa chậm của xương hàm trên ở tuổi thai từ 11 đến 13 tuần. Thật vậy, khe hở hàm trên > 1,5 mm hoặc hoàn toàn không có hàm trên ở mặt cắt dọc giữa (Hình 9.26 đến 9.32) gặp ở 69% CLP không đơn độc, 35% CLP đơn độc, và không thấy ở thai nhi bình thường. 43 Tuy nhiên, điều quan trọng cần lưu ý, khe hở hàm trên chỉ là một dấu hiệu của CLP và chẩn đoán phải được xác nhận ở mặt cắt ngang hoặc vành thấy trực tiếp khe hở mặt. Hơn nữa, trong khe hở mặt hai bên, thường thấy lồi trước hàm trên (premaxillary protrusion), 47 có thể dễ dàng thấy ở mặt cắt dọc giữa mặt như một khối trước vùng miệng và mũi (Hình 9.29 và 9.30). Đo PSD7 (Hình 9.19) hoặc góc hàm trên - gốc mũi - hàm dưới 8 như được mô tả trước đó trong phần các số đo sinh trắc học của khuôn mặt sẽ giúp đánh giá khách quan hơn. Với các số đo như vậy, cũng có thể phát hiện các trường hợp có cằm tụt sau (retrognathia) liên quan với CLP và được thảo luận trong phần tiếp theo.
Hình 9.26: Hình vẽ minh họa mặt cắt dọc giữa mặt thai nhi (A) cùng với hình ảnh siêu âm tương ứng (B) cho thấy khe hở hàm trên (các mũi tên trắng) ở thai nhi bị khe hở môi và vòm miệng. So sánh với hình vẽ minh họa của thai nhi bình thường trong hình 9.3. Ở mặt cắt dọc giữa này, thấy toàn bộ hàm trên. Kích thước và vị trí khe hở hàm trên thay đổi tùy theo kích thước và type khe hở. So sánh với Hình 9.27 đến Hình 9.31.
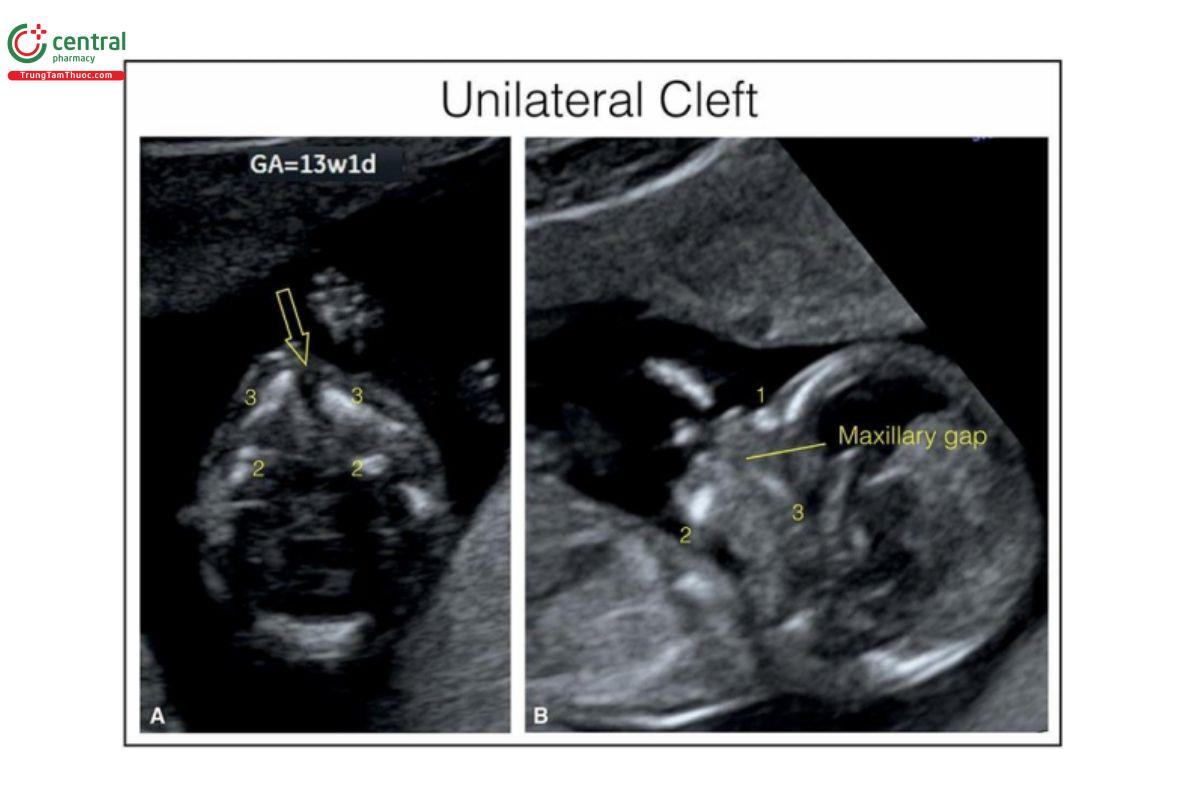
Hình 9.27: Mặt cắt ngang (A) và dọc giữa (B) mặt ở thai nhi 13 tuần tuổi bị khe hở môi và vòm miệng một bên. Thấy khe hở môi và vòm miệng ở mặt cắt ngang (A) (mũi tên mở). Lưu ý, khe hở hàm trên ở mặt cắt dọc giữa mặt (B). Còn thấy các cấu trúc sau đây của khuôn mặt: xương mũi (1), xương hàm dưới (2) và xương hàm trên (3). Ở thai nhi này, khe hở là đơn độc, và sau sinh, cháu bé đã được phẫu thuật thành công.
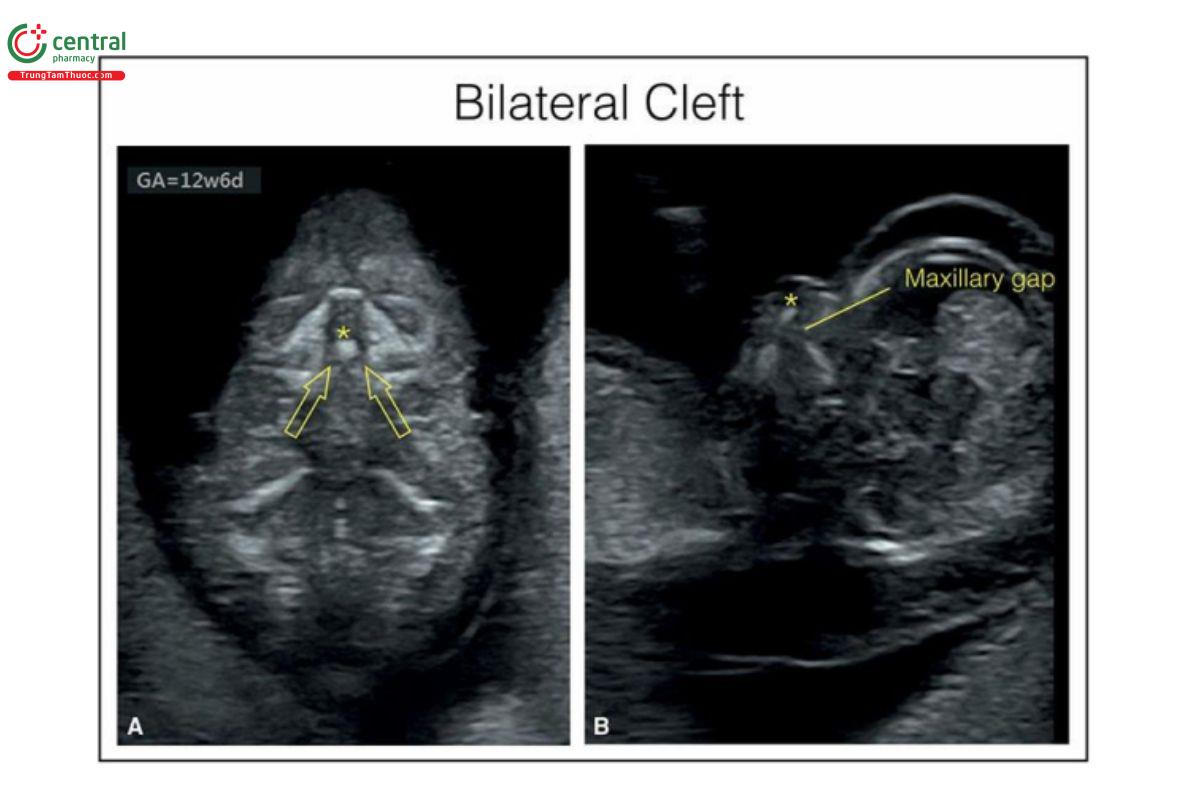
Hình 9.28: Mặt cắt tam giác sau mũi (A) và dọc giữa (B) của mặt ở thai nhi 13 tuần tuổi bị khe hở môi và vòm miệng hai bên. Thấy khe hở hai bên ở mặt cắt tam giác sau mũi (A) (các mũi tên mở). Lưu ý, khe hở hàm trên lớn ở mặt cắt dọc giữa mặt (B). Cũng cần lưu ý, có một giả khối nhô ra (protrusion of a pseudomass) (dấu hoa thị) ở A và B, như thường thấy ở hầu hết các thai nhi có khe hở hai bên trong quý 1. Thai nhi này cũng bị trisomy 18.
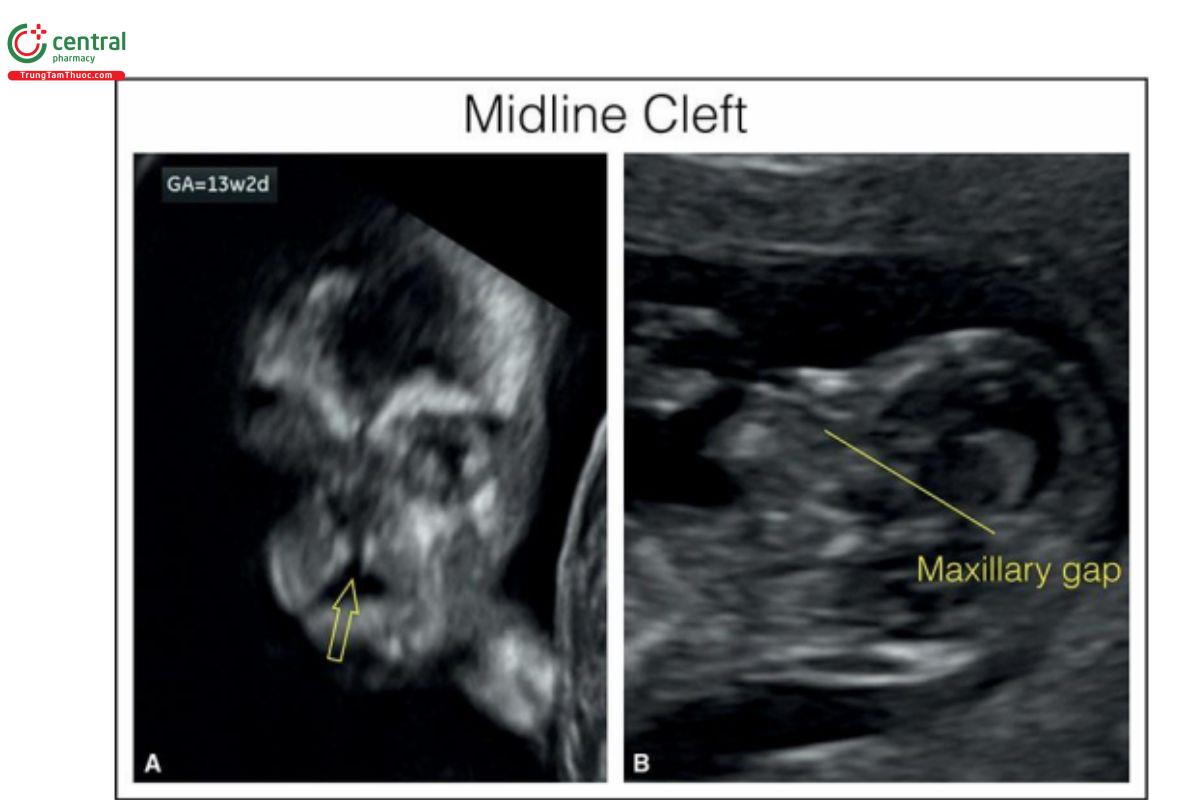
Hình 9.29: Mặt cắt vành (A) và dọc giữa (B) của mặt ở thai nhi 13 tuần tuổi có khe hở đường giữa. Thấy khe hở đường giữa ở mặt cắt vành (A) (các mũi tên mở). Lưu ý, gần như không có toàn bộ xương hàm trên ở mặt cắt dọc giữa mặt (B). Thai nhi này có đồng thời cả não thất duy nhất và trisomy 13.
Hình 9.30: Hình vẽ minh họa mặt cắt dọc giữa mặt thai nhi (A) cùng với các hình ảnh siêu âm mặt cắt ngang (B) và dọc (C) tương ứng cho thấy khe hở hàm trên (mũi tên trắng ở A, chú thích ở C) ở thai nhi bị khe hở môi và vòm miệng và trisomy 13. Lưu ý, có một giả khối nhô ra (protrusion of a pseudomass) ở B và C (dấu hoa thị) phía trước vùng hàm trên. Khuôn mặt (C) rõ ràng là bất thường trong những trường hợp như vậy. Trong trường hợp này, khe hở hàm trên được phát hiện (mũi tên màu trắng ở A, ghi chú ở C) do xương hàm trên mất liên tục ở phần trước. Tùy thuộc vào góc tới (angle of insonation) của chùm sóng siêu âm mà vị trí khe hở có thể khác nhau. Trong các trường hợp như vậy, mặt cắt dọc giữa chuẩn có thể thấy vách ngăn mũi và trông giống với xương hàm trên, nhưng mặt cắt hơi dọc bên sẽ cho thấy khe hở hàm trên.
Hình 9.31: Hình vẽ minh họa mặt cắt dọc giữa mặt thai nhi (A) cùng với mặt cắt dọc giữa ở hai thai nhi (B và C) có khe hở hai bên và không thấy rõ lồi trước hàm trên. Lưu ý, khe hở hàm trên lớn ở cả 2 thai nhi. Trong các trường hợp như vậy, khoảng cách không gian trước trán (xem Hình 9.19) sẽ không bất thường. Thai B bị trisomy 18 và thai C mắc hội chứng. Ở cả 2 thai nhi, khe hở hàm trên được nhận biết ở mặt cắt dọc giữa.
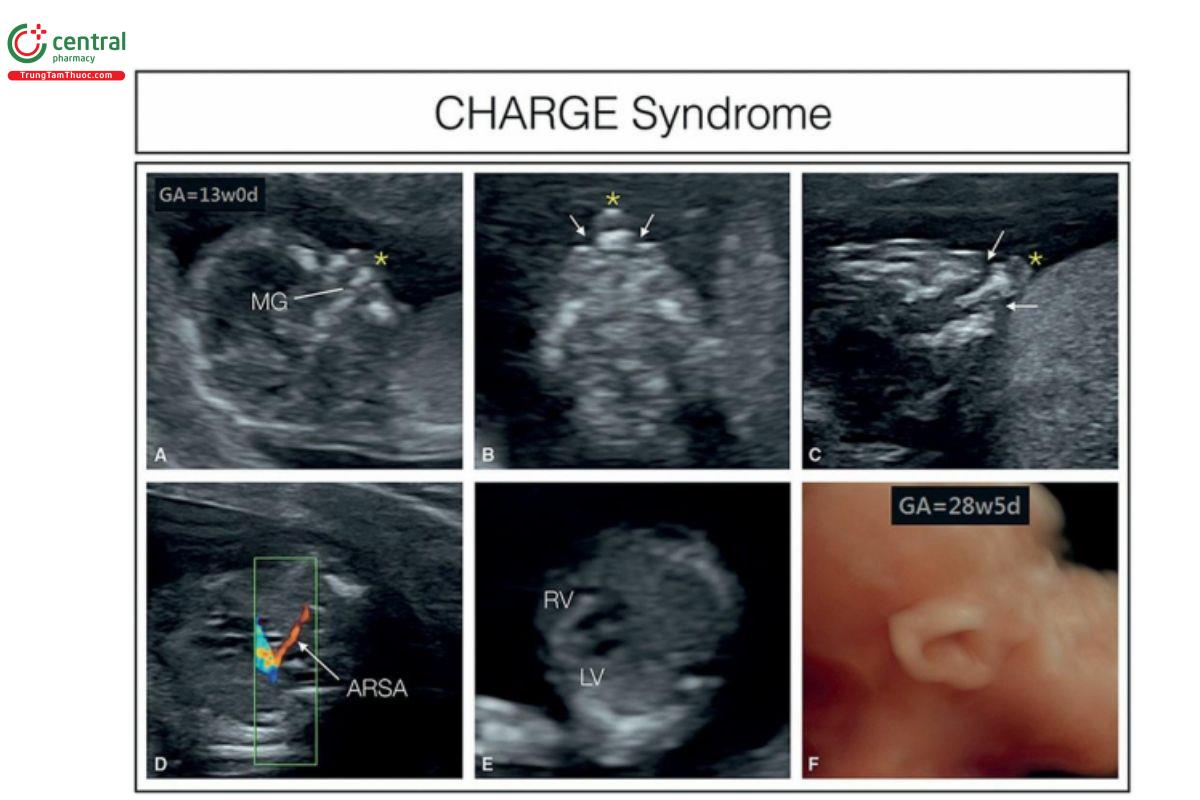
Hình 9.32: Hình ảnh siêu âm của một thai nhi được chẩn đoán mắc hội chứng CHARGE. Trong quý 1, lúc thai nhi 13 tuần tuổi, phát hiện các dấu hiệu sau đây: A, mặt cắt dọc giữa mặt cho thấy lồi trước hàm trên (dấu hoa thị) và khe hở hàm trên (MG) gợi ý khe hở mặt. Thấy khe hở mặt hai bên (mũi tên) cùng với lồi trước hàm trên (dấu hoa thị) ở mặt cắt ngang hàm trên ở B với đầu dò cong (convex transducer) và ở C với đầu dò phẳng (linear transducer). D: Động mạch dưới đòn phải lạc chỗ (ARSA) với tim bình thường (mặt cắt bốn buồng cho thấy ở E). Chọc ối lúc 16 tuần tuổi cho thấy nhiễm sắc thể đồ và microarray bình thường. Khi thai được 28 tuần tuổi, phát hiện thông liên thất quanh màng (perimembranous ventricular septal defect) (không được cho thấy ở đây) cùng với tai loạn sản (dysplastic ear) (F), điều này khiến chúng tôi hướng mục tiêu xét nghiệm di truyền phân tử vào hội chứng CHARGE, và phát hiện đột biến trên gen CHD7.
6.1.3 Các dị tật liên quan
CLP có thể đơn độc hoặc liên quan với > 100 hội chứng di truyền và thể lệch bội 48 (xem Chương 6 và Bảng 9.2). Trong một nghiên cứu lớn bao gồm 5.449 trường hợp CLP từ mạng lưới EUROCAT ở 14 quốc gia Châu Âu, có 3.860 trường hợp CLP (70,8%) đơn độc và 1.589 (29,2%) kèm theo các khiếm khuyết khác như đa dị tật bẩm sinh không rõ nguyên nhân, các bất thường nhiễm sắc thể và hội chứng có thể nhận biết được. 35 Dị tật liên quan hay gặp ở trẻ bị CLP (34,0%) hơn so với trẻ chỉ bị sứt môi (20,8%). Nghiên cứu này xác nhận rằng, các dị tật về cơ xương, tim mạch và hệ thần kinh trung ương hay gặp trong CLP.35 Mối liên quan của CLP với các dị tật phụ thuộc nhiều vào type giải phẫu của khe hở. 38,49 Trong một nghiên cứu lớn trên 500 trường hợp CLP, Gillham và cộng sự 49 phát hiện, CLP một bên 9,8%, CLP hai bên 25% và CLP ở giữa (hoặc đường giữa) 100% kèm theo các dị tật khác. Một nghiên cứu khác từ một trung tâm y học bào thai chuyển tuyến cấp ba (tertiary referral fetal center) đã phân tích dữ liệu từ 70 thai nhi bị sứt môi và cũng cho phát hiện tương tự, đó là tất cả các thai nhi có khe hở đường giữa đều kèm theo dị tật khác.50 Tuy nhiên, trong nghiên cứu này, các dị tật kèm theo ở 2 nhóm khác cao hơn, 48% ở các thai nhi bị sứt môi một bên và 72% với sứt môi hai bên, so với các nghiên cứu khác. 50 Do đó, khi phát hiện CLP, khuyến nghị siêu âm thai chi tiết, tìm kiếm thêm các dị tật cấu trúc bao gồm dị tật mặt, não, tim và xương. Điều thú vị là hầu hết CLP đường giữa, cùng với CLP hai bên mà không có lồi trước hàm trên, đều kèm theo dị tật nội sọ và lệch bội.49–51 Mặt khác, CLP kèm theo dị tật tim sẽ làm gia tăng nghi ngờ mất đoạn 22q11, mất đoạn 4p− ( Hội chứng Wolf–Hirschhorn), hoặc hội chứng CHARGE (Hình 9.32). Sự hiện diện CLP ở mẹ hoặc bố của thai nhi bị ảnh hưởng sẽ làm gia tăng nghi ngờ về một tình trạng di truyền trội trên nhiễm sắc thể thường, như hội chứng Van der Woude. Ở các trung tâm của chúng tôi, khi phát hiện CLP trong quý 1, chúng tôi sẽ thực hiện siêu âm thai chi tiết để tìm thêm các bất thường và chỉ định xét nghiệm chẩn đoán di truyền xâm lấn để đánh giá nhiễm sắc thể đồ và microarray. Siêu âm 2D và 3D theo dõi vào đầu quý 2 cũng được thực hiện để đánh giá hình thái thai nhi. Bảng 9.2 liệt kê một số tình trạng liên quan với CLP.
| Bảng 9.2 • Các hội chứng thƣờng gặp trong khe hở mặt (Facial Clefts) |
|
6.2 Cằm nhỏ (Micrognathia)
6.2.1 Định nghĩa
Cằm nhỏ là thuật ngữ dùng để mô tả một dị tật hiếm gặp trên khuôn mặt, đặc trưng bởi hàm dưới nhỏ, kém phát triển. Cằm tụt sau (Retrognathia) là thuật ngữ dùng để mô tả hàm dưới bị tụt ra sau so với hàm trên và thường kèm theo cằm nhỏ. Trước sinh, cả hai tình trạng thường được phát hiện đồng thời và các thuật ngữ được sử dụng thay thế cho nhau. Trong chương này, chúng tôi sẽ dùng thuật ngữ cằm nhỏ (micrognathia) để mô tả tình trạng này vì chỉ những dị tật nghiêm trọng mới có thể phát hiện được trong quý 1.
6.2.2 Dấu hiệu trên siêu âm
Trong quý 1, ở mặt cắt dọc giữa mặt thai nhi, cằm nhỏ được nghi ngờ đầu tiên khi thấy hàm dưới không ở cùng mức với hàm trên, thay vào đó tụt về phía sau (Hình 9.33). Không giống như trong giải phẫu mặt bình thường, trong cằm nhỏ, đường thẳng vẽ từ hàm dưới về phía hàm trên sẽ không giao nhau với trán (Hình 9.19), 7, 10 và có thể được định lượng bằng góc FMF, 21 PSD7 (Hình. 9.19), hoặc góc MNM.8 Khi nghi ngờ cằm nhỏ trong quý 1, cằm thường có thể rất nhỏ, nhưng siêu âm theo dõi trong quý 2 và 3, với sự tăng trưởng tương xứng và khuôn mặt thai nhi sẽ trông ít bất thường hơn (Hình 9.34). Do đó, trong một số trường hợp cằm nhỏ đơn độc, không thể dự đoán được mức độ cằm nhỏ chỉ với mặt cắt dọc giữa. Một phát hiện thú vị là, đánh giá vùng cằm với mặt cắt RNT. Trong quý 1, ở thai nhi bình thường, mặt cắt RNT cho thấy một khe hở đặc trưng giữa thân phải và thân trái của hàm dưới, được gọi là khe hở hàm dưới (mandibular gap) (Hình 9.35). 10 Khe hở hàm dưới này có thể được đo từ điểm giữa bờ hồi âm của xương hàm dưới này tới xương hàm dưới kia và dường như tăng tuyến tính khi CRL tăng.10 Sepulveda và cộng sự 10 phát hiện, không có khe hở hàm dưới hoặc không xác định được xương hàm dưới ở mặt cắt RNT, gợi ý nhiều đến tật cằm nhỏ ( Hình 9.35). Do đó, trong quý 1, khi không thấy khe hở hàm dưới ở mặt cắt vành, thì cần phải siêu âm thai chi tiết để xác định cằm nhỏ và tìm kiếm các dị tật khác. Thông thường, cằm nhỏ dẫn đến khoang miệng nhỏ, và do đó, lưỡi bị dịch chuyển ra sau được gọi là sa lưỡi (glossoptosis), gần như luôn kèm theo khe hở vòm miệng sau (cleft of the posterior palate), và đã được báo cáo vào đầu quý 252 và theo chúng tôi, cũng có thể thấy trong quý 1. Khi nghi ngờ cằm nhỏ, nên siêu âm qua ngả âm đạo để đánh giá vùng vòm miệng sau, nếu khả thi về mặt kỹ thuật, (Hình 9.5), như được mô tả bởi Wilhelm và Borgers, 53thấy nước ối trong hầu, nhưng không có trong cằm nhỏ kèm sa lưỡi. Vì cằm nhỏ liên quan với nhiều hội chứng (Hình 9.36), nên phải đánh giá chi tiết khuôn mặt, tai và não bằng siêu âm 2D và 3D (Hình 9.37).
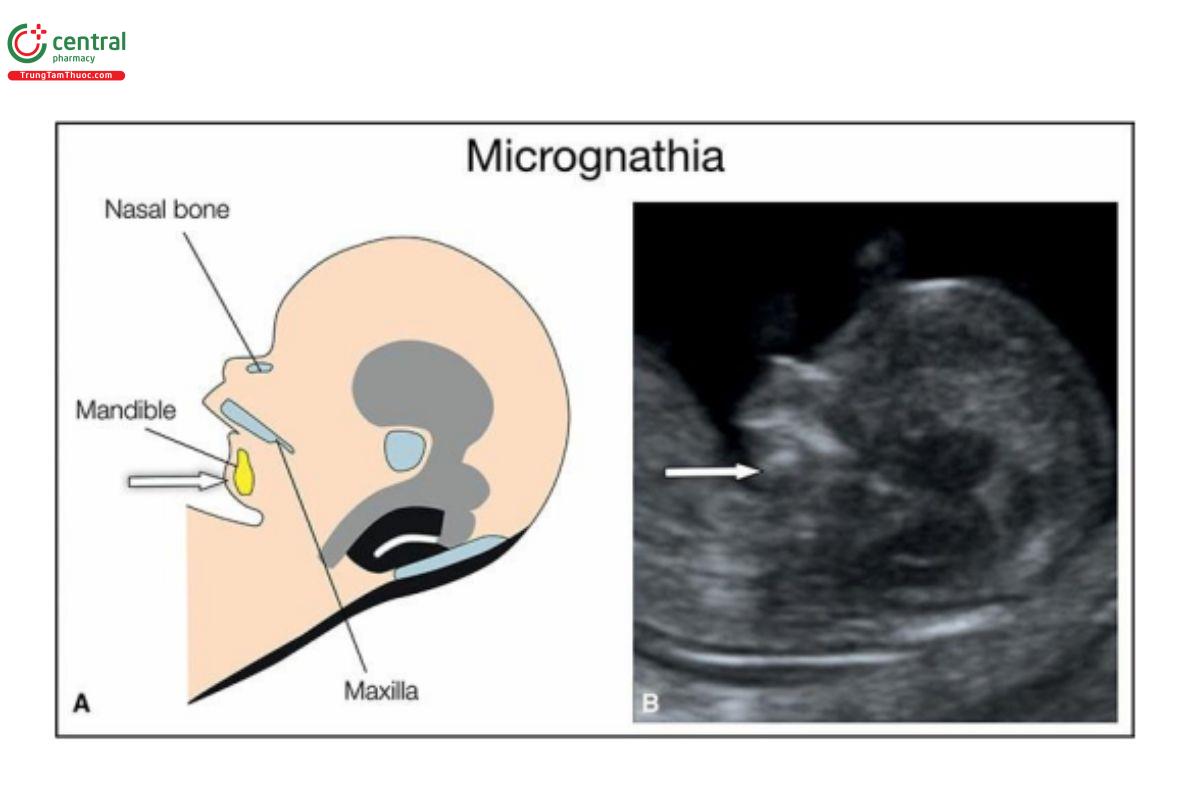
Hình 9.33: Hình vẽ minh họa mặt cắt dọc giữa mặt (A) cùng với hình ảnh siêu âm tương ứng (B) của một thai nhi có cằm nhỏ (các mũi tên màu trắng). So sánh với hình vẽ minh họa của thai nhi bình thường ở hình 9.3. Lưu ý, chóp hàm dưới không chạm tới mặt trước hàm trên ở A và B, mà chạm tới phần giữa của nó. Cằm nhỏ có thể đơn độc như trong hội chứng Pierre Robin nhưng cũng có thể là một phần của nhiều hội chứng. So sánh với Hình 9.34 đến Hình 9.37. Xem văn bản để biết thêm chi tiết.
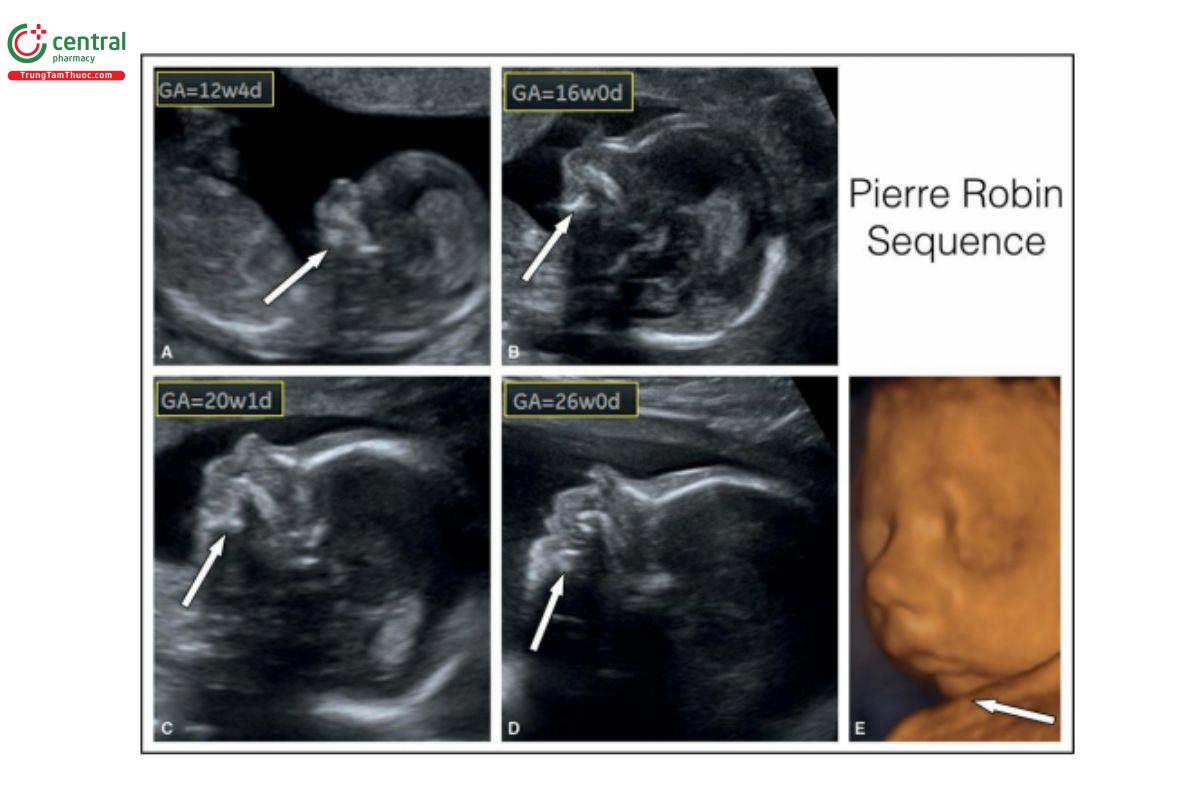
Hình 9.34: Sự tăng trưởng và phát triển trên khuôn mặt thai nhi có cằm nhỏ trong hội chứng Pierre Robin, được cho thấy ở 12 (A), 16 (B), 20 (C) và 26 (D) tuần tuổi và trên siêu âm 3D với chế độ bề mặt lúc 26 tuần tuổi (E). Các mũi tên trắng chỉ vào hàm dưới. Lưu ý, cằm rất nhỏ (nghiêm trọng) trong quý 1 (A), nhưng với sự tăng trưởng của xương hàm dưới, khuôn mặt trông ít bất thường hơn trong quý 2 (B – E) và 3. Trong trường hợp này, cằm nhỏ là đơn độc, và khe hở vòm miệng đã được sửa chữa sau sinh.
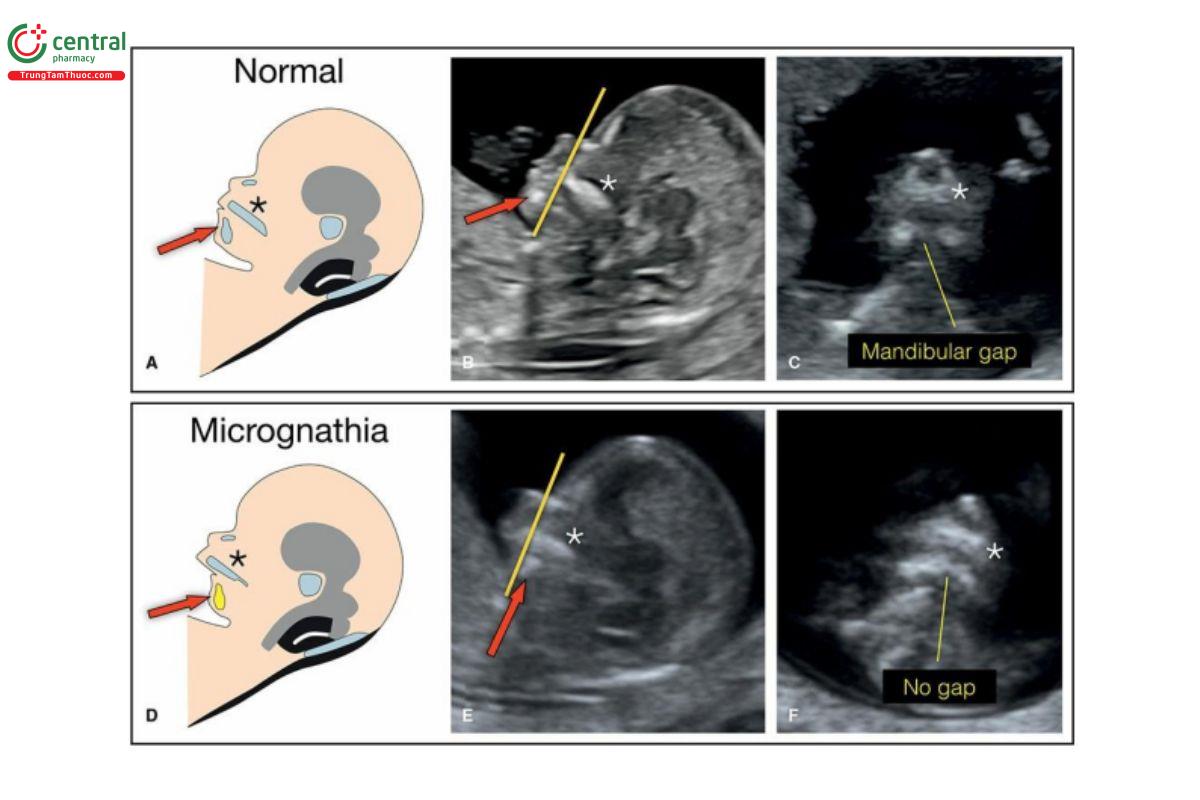
Hình 9.35: Hình vẽ minh họa mặt cắt dọc giữa mặt thai nhi (A, D) cùng với hình ảnh siêu âm mặt cắt dọc giữa (B, E) và tam giác sau mũi (C, F) tương ứng ở thai nhi bình thường (A–C) và thai nhi có cằm nhỏ (D–F). Lưu ý, ở thai nhi bình thường, chóp hàm dưới (mũi tên đỏ) chạm tới phía dưới mặt trước hàm trên (dấu hoa thị), như hình A và B. Ở thai nhi bình thường, mặt cắt tam giác sau mũi (C) cho thấy khe hở hàm dưới bình thường. Ở thai nhi có cằm nhỏ (D-F), cằm tụt ra sau đường kẻ (mũi tên đỏ) (E), và không thấy khe hở hàm dưới ở mặt cắt tam giác sau mũi, như được cho thấy ở F. Xem văn bản để biết thêm chi tiết.
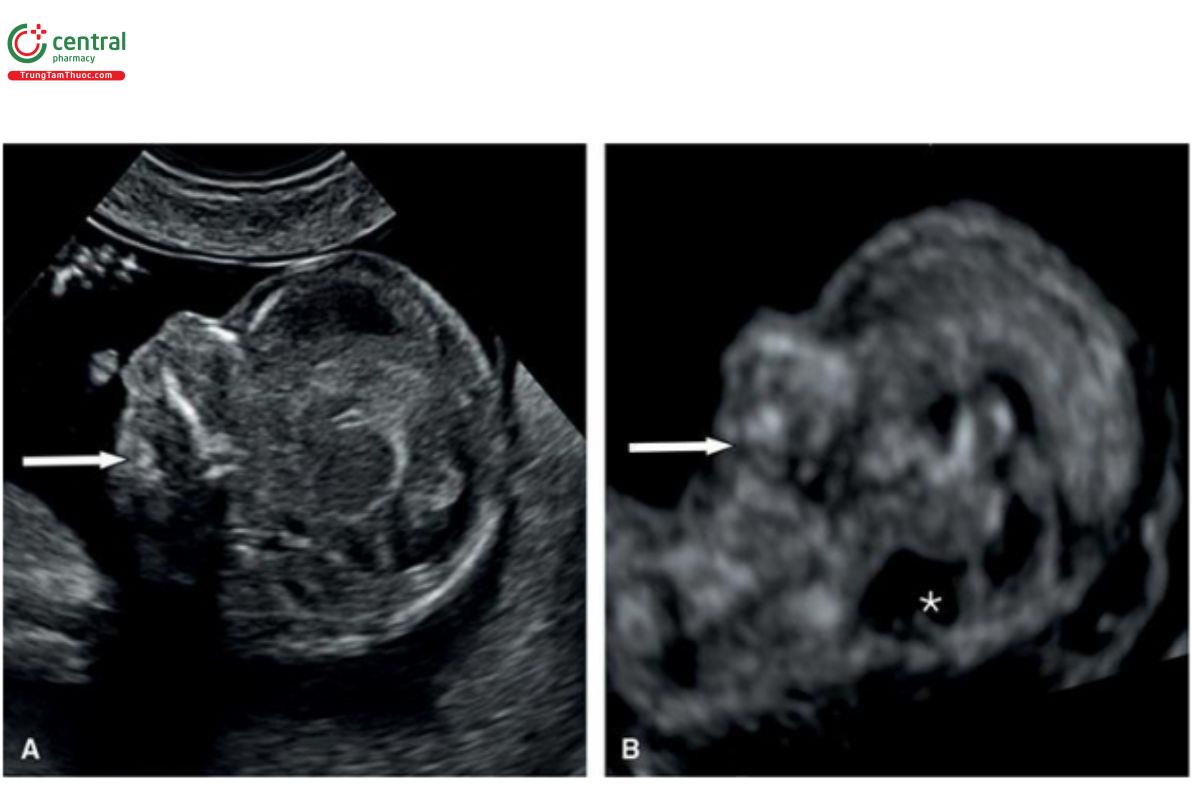
Hình 9.36: Mặt cắt dọc giữa mặt ở 2 thai nhi bị trisomy 13 và tật cằm nhỏ (mũi tên trắng) tương ứng ở 14 (A) và 12 (B) tuần tuổi. Lưu ý, thai B còn có dãn hố sau (dấu hoa thị). Hình 9.37 là hình ảnh dựng hình 3D khuôn mặt ở thai B.
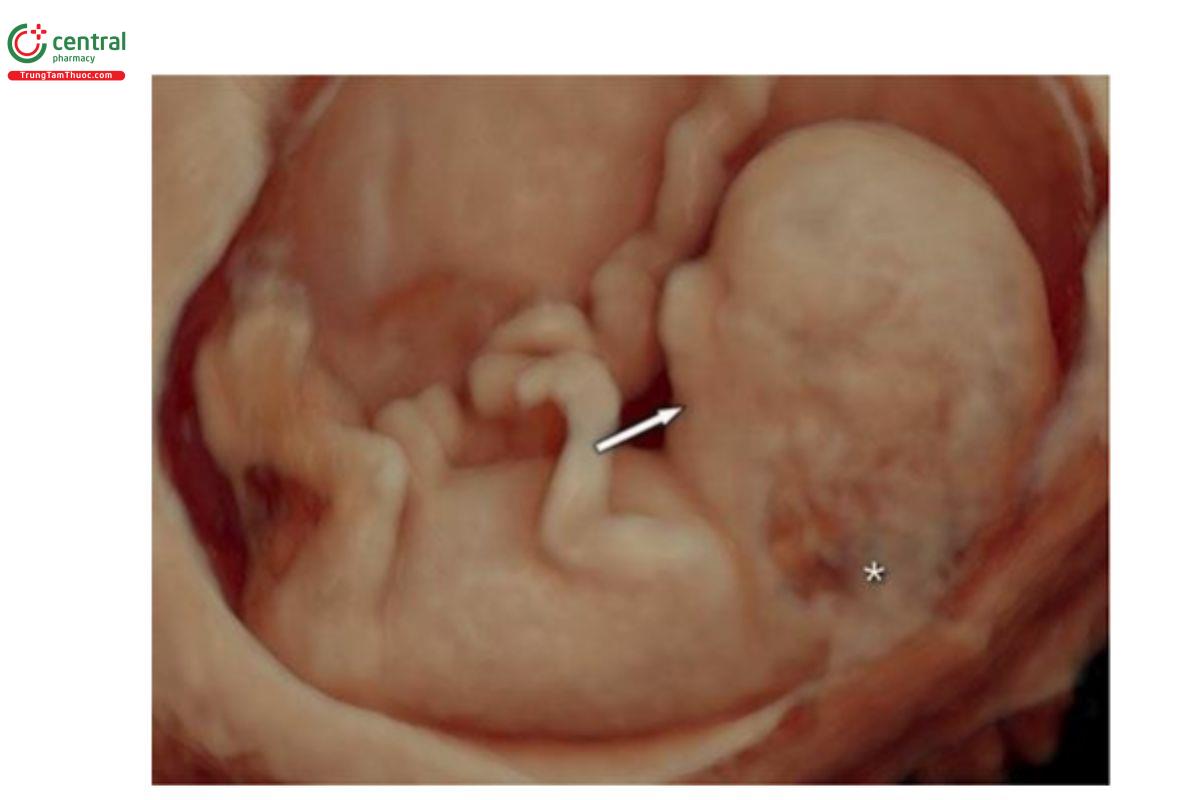
Hình 9.37: Siêu âm 3D với chế độ bề mặt (surface mode) ở thai nhi bị trisomy 13 lúc 12 tuần tuổi (giống như trong Hình 9.36B). Lưu ý, cằm nhỏ, tụt ra sau (tật cằm nhỏ) kèm theo độ mờ da gáy dày (dấu hoa thị).
6.2.3 Các dị tật liên quan
Cằm nhỏ có thể đơn độc như trong hội chứng Pierre Robin, thường kèm theo khe hở vòm miệng (cleft palate) và sa lưỡi (glossoptosis), nhưng cũng có thể liên quan với các bất thường nhiễm sắc thể khác, bao gồm trisomy 18 và 13, thể tam bội và nhiều hội chứng di truyền. 8,54,55 Đáng chú ý, cằm nhỏ có liên quan mật thiết với hội chứng Pierre Robin và có thể chẩn đoán được trong quý 156 như cho thấy ở Hình 9.35, và tai đóng thấp có thể là dấu hiệu gợi ý. Không thấy hàm trên hoặc hàm dưới gặp trong bất sản xương hàm dưới (agnathia) và có liên quan với otocephaly (người dịch chú thích: dị tật đầu đặc trưng bởi bất sản xương hàm dưới và 2 tai hợp nhất ngay dưới cằm), một dị tật nghiêm trọng gây chết.26,57 Ngoài những tình trạng này, cũng nên xem xét hội chứng Goldenhaar và hội chứng Treacher Collins. Quản lý tiền sản đối với chẩn đoán cằm nhỏ trong quý 1 tương tự như CLP.
6.2.4 Bất thường mắt
Các bất thường mắt và hốc mắt hiếm khi được phát hiện trong quý 1 ngoại trừ kèm theo các dị tật thai khác hoặc tiền sử gia đình có các tình trạng này (Hình 9.38 đến 9.40). Các bất thường mắt và hốc mắt thường được phát hiện có liên quan với não thất duy nhất thể không phân thùy (alobar holoprosencephaly), ví dụ như vòi voi (proboscis) (Hình 9.10 và 9.39). Hốc mắt bất thường, chẳng hạn như giảm hoặc tăng khoảng cách gian hốc mắt (hypotelorism or hypertelorism), thường được đánh giá chủ quan trong quý 1 (Hình 9.38 đến 9.40), đặc biệt trong các hội chứng bất thường hình thái khuôn mặt. Nhìn chung, trong những trường hợp như vậy, trisomy 13 và 18 là tình trạng hay được phát hiện nhất (Hình 9.38 và 9.39). Không có nhãn cầu đơn độc (Isolated anophthalmia) rất hiếm gặp và tật mắt nhỏ (microphthalmia) cũng có thể được phát hiện khi kèm theo dị tật khác. đục thủy tinh thể (cataract) hoặc mắt nhỏ đơn độc có thể rất khó chẩn đoán, vì bản thân dị tật có thể không rõ ràng trong quý 1. Đục thủy tinh thể thai nhi được báo cáo trong quý 1 thường là những trường hợp tái phát (recurrent) hoặc là một phần của các hội chứng như hội chứng Walker–Warburg31 hoặc hội chứng vi Warburg với tật đầu nhỏ (Warburg micro syndrome with microcephaly), sẽ trở nên rõ ràng vào cuối quý 2. Ở những bệnh nhân nguy cơ cao, khi muốn khẳng định chắc chắn mắt và hốc mắt bình thường, cần phải đánh giá trực tiếp hốc mắt và thủy tinh thể với siêu âm qua ngả âm đạo. Khi nghi ngờ, siêu âm lặp lại qua ngả âm đạo trong quý 2, nếu khả thi, sẽ giúp xác nhận hoặc loại trừ các bất thường mắt và hốc mắt.
Hình 9.38: Mặt cắt ngang hốc mắt của 3 thai nhi bất thường. Thai A, hai hốc mắt rất gần nhau liên quan với não thất duy nhất (holoprosencephaly) và trisomy 13. Thai B, hai hốc mắt gần nhau liên quan với não thất duy nhất và nhiễm sắc thể bình thường nhưng có đột biến PIGF. Thai C, hai hốc mắt xa nhau (hypertelorism) và hình dạng hốc mắt bất thường liên quan với trisomy 13 và các đặc điểm kỳ lạ trên khuôn mặt. So sánh với giải phẫu hốc mắt bình thường ở hình 9.8.
Hình 9.39: Mặt cắt ngang (A và B) hốc mắt của thai nhi bị trisomy 13, não thất duy nhất, giả một hốc mắt duy nhất (pseudocyclopia) và vòi voi (proboscis) ở 13 tuần tuổi. A: Ở mặt cắt này cho thấy hai mắt gần như hợp nhất và không có hốc mắt. B: Mặt cắt cao hơn cho thấy vòi voi.
Hình 9.40: Siêu âm 3D ở chế độ cắt lớp (tomographic mode) thu được từ mặt cắt dọc giữa mặt ở thai nhi bình thường (A) và thai nhi có não thất duy nhất (B). Các mặt cắt vành tương ứng của khuôn mặt thai nhi, với đôi mắt được hiển thị ở các hình ảnh bên dưới. Lưu ý, khoảng cách hai mắt bình thường (vạch trắng) ở khuôn mặt bình thường ở A, và hai hốc mắt gần nhau ở B.
7 CÁC BẤT THƢỜNG CỦA CỔ THAI NHI
7.1 Nang bạch huyết (Cystic Hygroma)
7.1.1 Định nghĩa
Nang bạch huyết là bất thường bẩm sinh liên quan đến hệ thống bạch huyết ở thai nhi và đặc trưng bởi các nang chứa đầy dịch trong mô mềm, thường ở mặt sau bên (posterolateral aspects) của cổ hoặc các vị trí khác trong cơ thể (Hình 9.41 đến 9.44). Cơ chế bệnh sinh được cho là hậu quả của sự kết nối bất thường giữa hệ thống bạch huyết và mạch máu, chủ yếu là do thất bại trong quá trình phát triển sự thông thương (communication) giữa túi bạch huyết ở cổ (jugular lymphatic sac) với tĩnh mạch cảnh (jugular vein) 58, và có thể dẫn đến phù bạch mạch tiến triển và phù thai. Tuy nhiên, đôi khi, nang bạch huyết có thể thoái triển nếu hệ thống bạch huyết và mạch máu đã có sự thông thương. Nang bạch huyết có thể có nhiều vách ngăn (multiseptated) và do đó được phân loại là có vách ngăn hoặc không có vách ngăn (Hình 9.42 và 9.43). Trong một số trường hợp, có thể thấy vách ngăn dày ở đường giữa, tương ứng với dây chằng cổ (nuchal ligament). 58 Tỷ lệ nang bạch huyết được báo cáo là 1: 285 thai kỳ quý 1. Hiện đang vẫn tranh luận về việc liệu nang bạch huyết có phải là một thực thể riêng biệt so với NT lớn hay không, bởi vì có thể thấy vách ngăn trong cả 2 tình trạng. 60 Bất kể tên gọi của tình trạng tích tụ dịch ở vùng cổ là NT hay nang bạch huyết, nhưng khi phát hiện ra, cần phải đánh giá các bất thường giải phẫu và di truyền thai nhi.
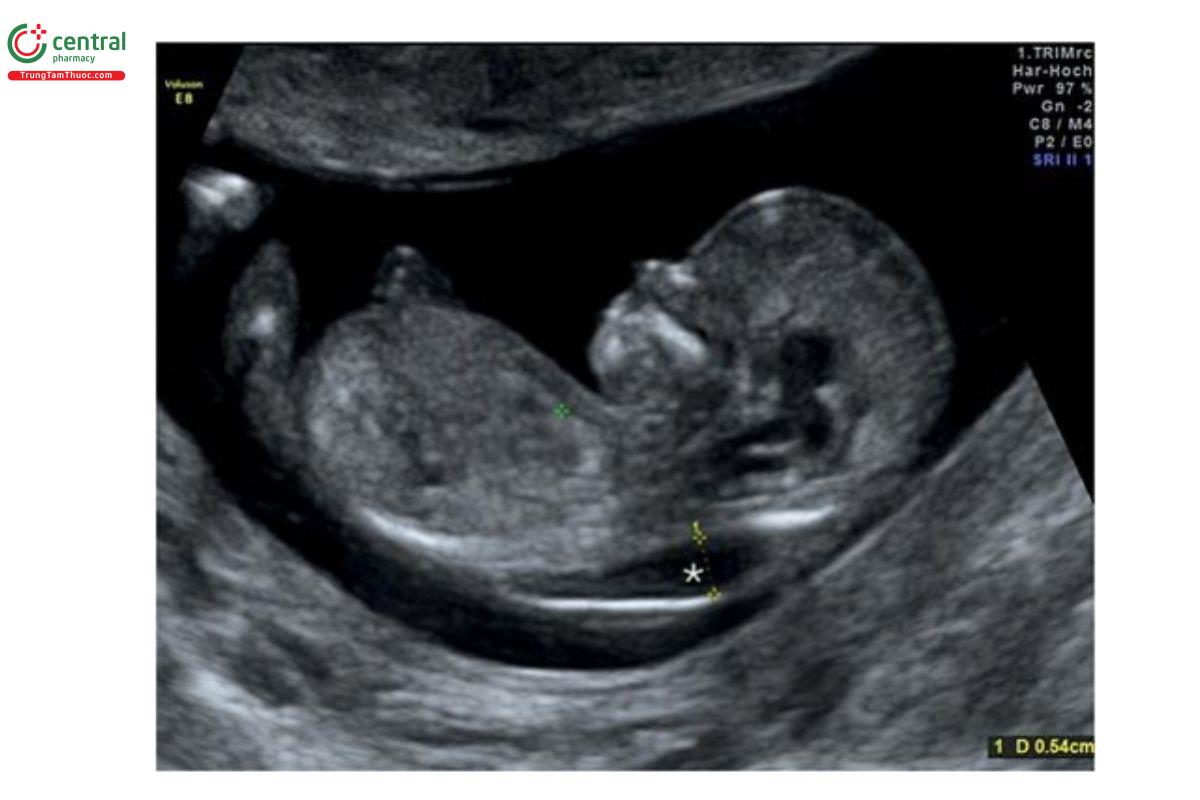
Hình 9.41: Mặt cắt dọc giữa của thai nhi 13 tuần tuổi cho thấy độ mờ da gáy dày (NT (dấu hoa thị). Khi NT có vách ngăn, trong một số trường hợp, chẩn đoán xác định là nang bạch huyết. Các vách ngăn của NT được đánh giá tốt nhất ở mặt cắt ngang.
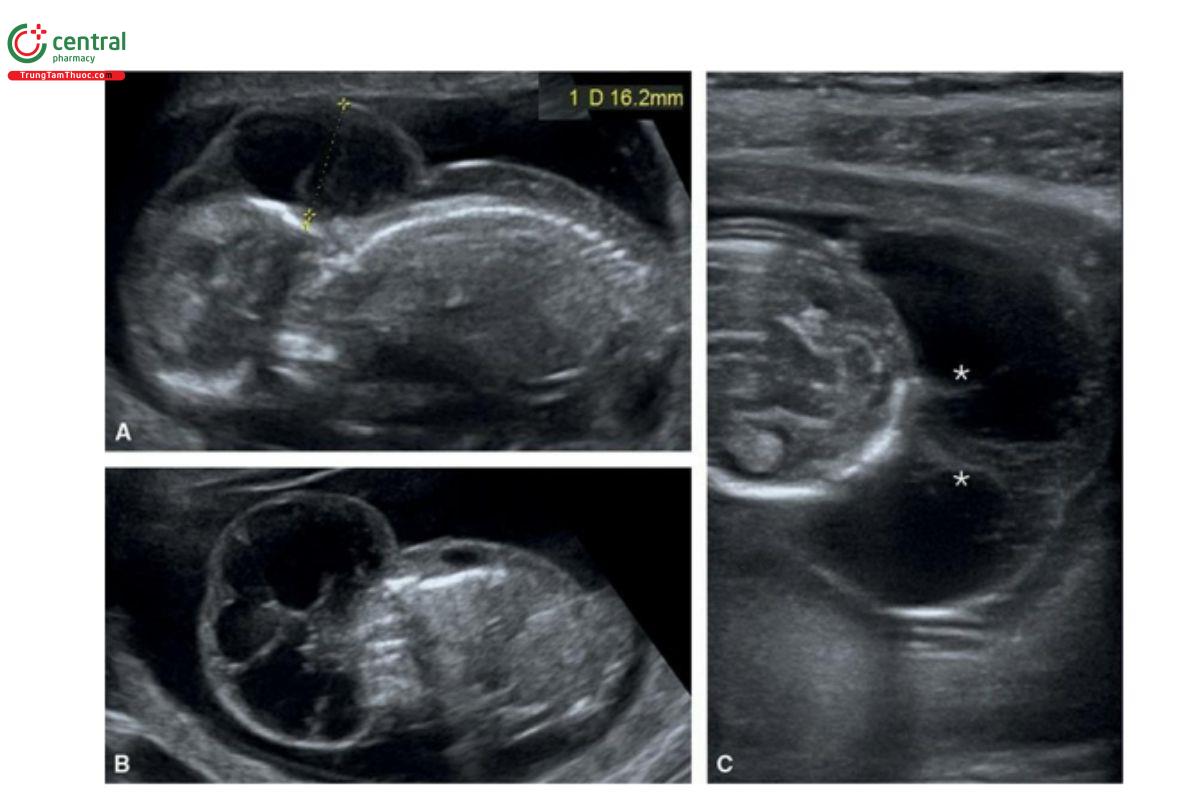
Hình 9.42: Mặt cắt dọc giữa (A), vành (B) và ngang (C) ở thai nhi 13 tuần tuổi có nang bạch huyết và hội chứng Turner. Lưu ý, NT dày 16 mm ở A và vách ngăn NT (dấu hoa thị) ở B và C.
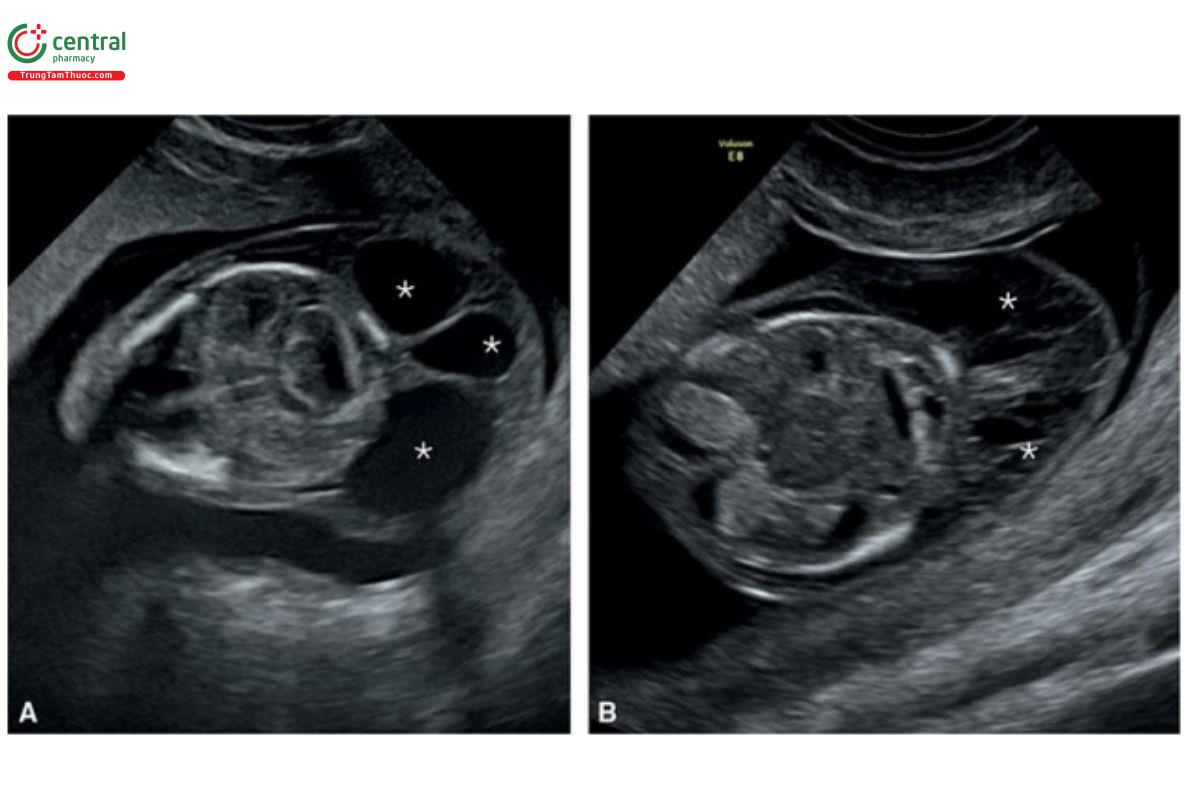
Hình 9.43: Mặt cắt ngang đầu của 2 thai nhi có nang bạch huyết tương ứng ở 13 (A) và 12 (B) tuần tuổi. Lưu ý, có các vách ngăn ở cả 2 thai nhi và cũng lưu ý, dịch bên trong các vách ngăn (dấu hoa thị) trống âm ở A và hồi âm giống như thạch (jelly-like) ở B.
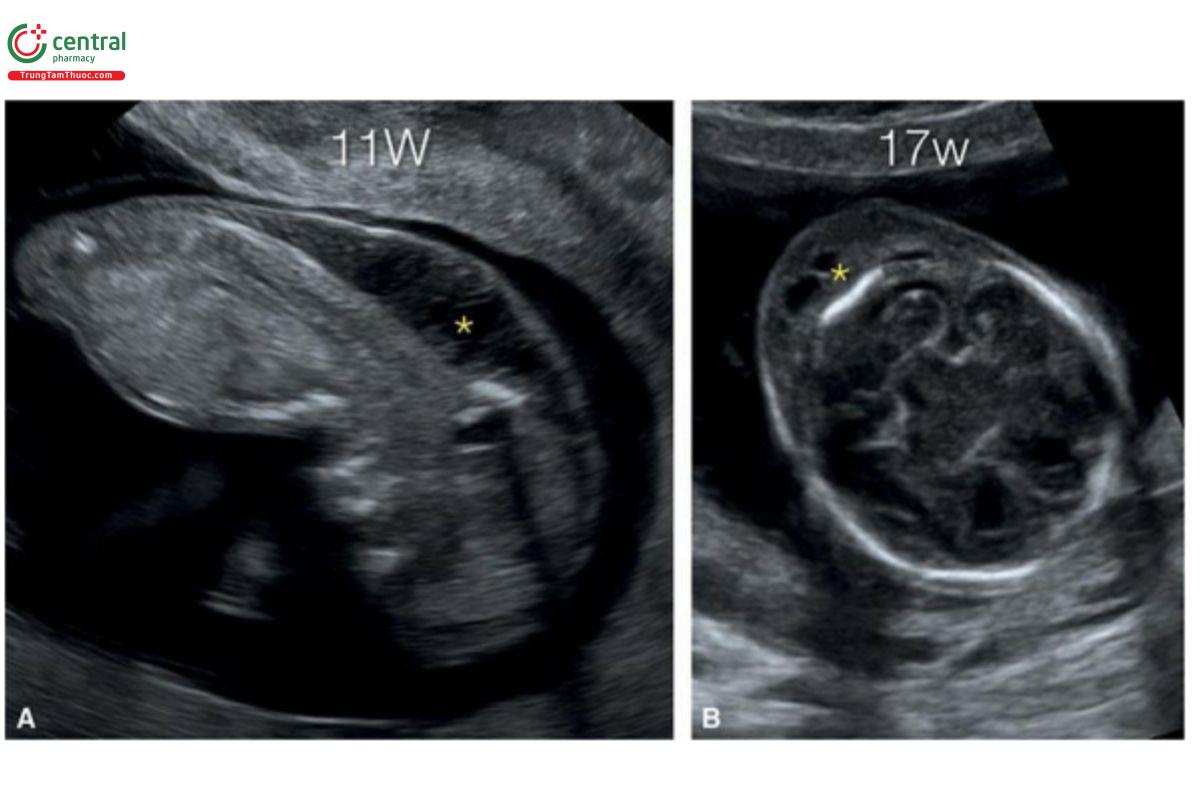
Hình 9.44: Mặt cắt dọc giữa lúc 11 tuần tuổi (A) và mặt cắt ngang lúc 17 tuần tuổi (B) ở thai nhi có độ mờ da gáy dày (NT), được chẩn đoán lúc 11 tuần tuổi, như cho thấy ở A (dấu hoa thị). Ở thai nhi này, phù da gáy kéo dài sang quý 2 (B).
7.1.2 Dấu hiệu trên siêu âm
Siêu âm phát hiện các khối dạng nang ở mặt sau bên của cổ thai nhi gợi ý nang bạch huyết, và có thể dễ dàng thấy ở mặt cắt ngang cổ (Hình 9.42 và 9.43) và khi nang bạch huyết lan rộng có thể thấy cả ở mặt cắt dọc giữa dùng để đo NT (Hình 9.41 và 9.42). Vách ngăn được đánh giá tốt nhất ở mặt cắt ngang cổ và ngực trên (Hình 9.44), và vách ngăn dày thường thấy ở đường giữa vùng cổ sau tương ứng với dây chằng cổ (nuchal ligament) (Hình 9.43). Khi có nhiều vách ngăn, hình ảnh nang bạch huyết trên siêu âm giống như tổ ong (honeycomb). Nang bạch huyết không có vách ngăn trên siêu âm là khoang dạng nang ở 2 bên cổ thai nhi, do dãn hệ bạch huyết vùng cổ. Do nang bạch huyết rất hay kèm theo các dị tật và bất thường nhiễm sắc thể khác, nên khi được chẩn đoán trong quý 1, cần phải siêu âm thai chi tiết để đánh giá toàn diện thai nhi.
7.1.3 Các dị tật liên quan
60% trường hợp nang bạch huyết có liên quan với các bất thường giải phẫu thai nhi khác. Các bất thường liên quan thường bao gồm tim, hệ tiết niệu sinh dục, hệ xương và hệ thần kinh trung ương, và phần lớn có thể thấy trên siêu âm quý 1. Các bất thường nhiễm sắc thể rất thường gặp, trong đó, trisomy 21 và hội chứng Turner là hai lệch bội nhiễm sắc thể hay gặp nhất, với > 50% trường hợp. 59 Một hội chứng điển hình mà cũng nên được xem xét là hội chứng Noonan (Hình 9.45). Các bất thường nước ối rất hay gặp, nhưng thường chỉ phát hiện được trong quý 2 và quý 3. Phù toàn thân cũng hay gặp và có tiên lượng xấu. 61 Kết cục thường tốt khi nang bạch huyết thoái triển trước sinh và nhiễm sắc thể đồ bình thường.
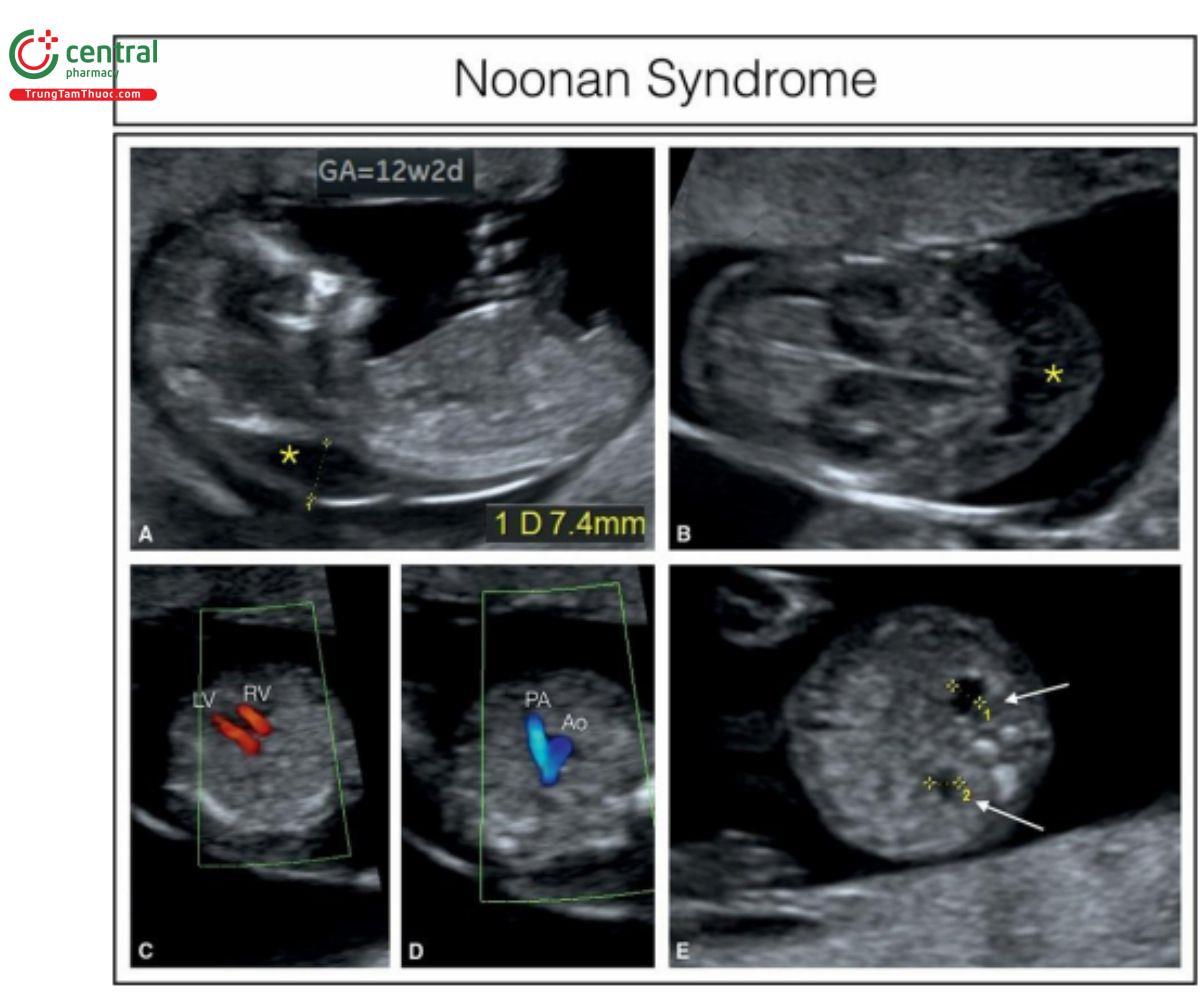
Hình 9.45: Hình ảnh siêu âm song thai hai màng đệm lúc 12 tuần tuổi của một thai phụ 40 tuổi đến để sàng lọc di truyền. Lưu ý, ở A và B, độ mờ da gáy lớn (dấu hoa thị), kích thước 7,4 mm. C và D: Tương ứng là mặt cắt bốn buồng bình thường và mặt cắt ba mạch máu-khí quản bình thường. Ở E cho thấy đường tiết niệu dãn nhẹ. Sinh thiết gai nhau (Chorionic villous sampling) cho thấy nhiễm sắc thể đồ bình thường, nhưng do các dấu hiệu trên siêu âm, nên đã chỉ định xét nghiệm di truyền phân tử hội chứng Noonan, và xác nhận một đột biến của gen PTPN11, gặp ở 50% trường hợp bị ảnh hưởng.
7.2 NT dày với nhiễm sắc thể đồ bình thường
Hiện nay, mối liên quan giữa NT dày với bất thường nhiễm sắc thể đã được xác định rõ ràng, đặc biệt là hội chứng Down. Khi phát hiện NT dày, thì cần phải tư vấn di truyền và lựa chọn xét nghiệm sàng lọc bổ sung, hoặc xét nghiệm chẩn đoán xâm lấn. NT dày với nhiễm sắc thể đồ bình thường là một thách thức lớn trong việc tư vấn và thực hiện thêm các xét nghiệm khác, và vẫn còn đang tranh luận về cách quản lý tối ưu từ cuối những năm 1990.62–69 NT dày có liên quan với lệch bội (Hình 9.46), và NT dày với nhiễm sắc thể đồ bình thường cũng liên quan với vô số các dị tật thai lớn và nhỏ, bao gồm cả các hội chứng di truyền (Hình 9.47) và tăng nguy cơ thai lưu (Hình 9.48). 14,65,66,69,70 Nguy cơ chậm phát triển thần kinh hiện vẫn chưa rõ ràng và có các quan điểm trái ngược nhau. 65 Mặc dù, NT dày với siêu âm và nhiễm sắc thể đồ bình thường, thì khả năng sinh ra một đứa trẻ ―khỏe mạnh‖ không có dị tật sẽ tỷ lệ nghịch với độ dày NT (Hình 9.49). Trong phần này, chúng tôi trình bày những điểm thiết yếu liên quan với chủ đề này trong y văn.
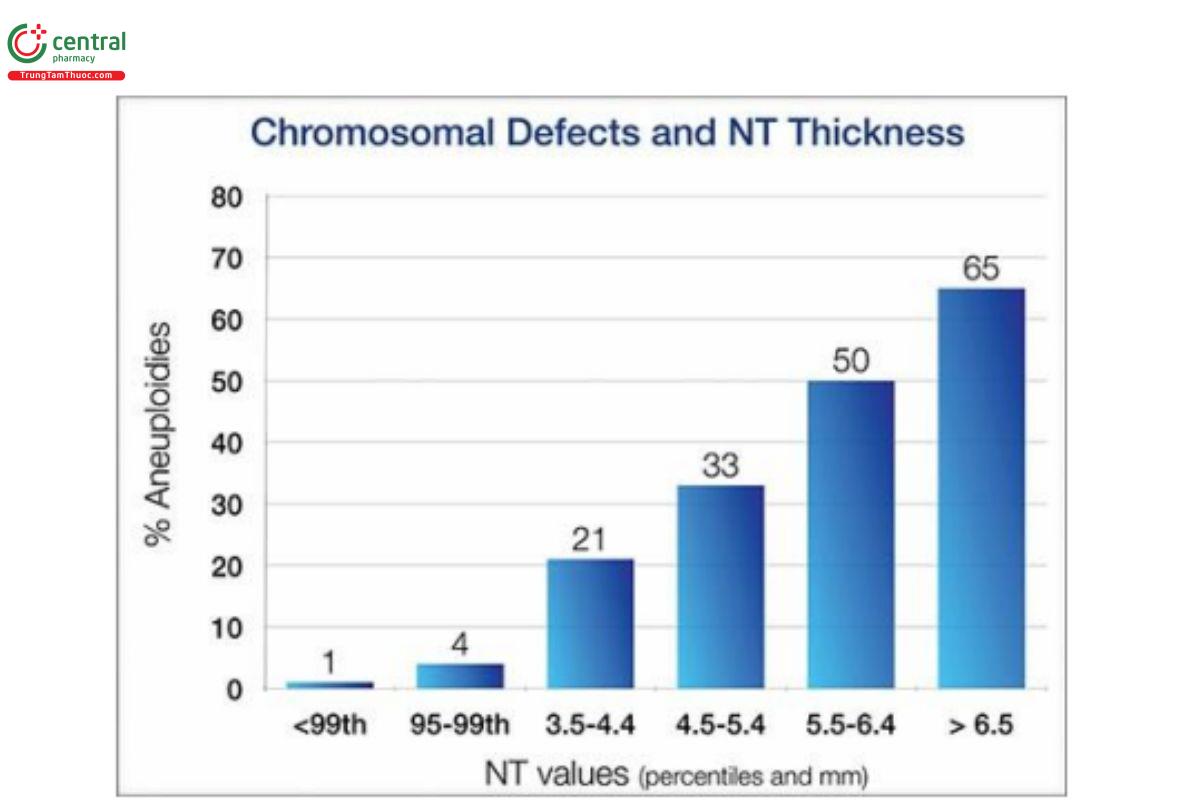
Hình 9.46: Mối liên quan giữa độ dày NT (trục x) và tỷ lệ bất thường nhiễm sắc thể (trục y). (Graph is based on data from Souka AP, von Kaisenberg CS, Hyett JA, et al. Increased nuchal translucency with normal karyotype. Am J Obstet Gynecol. 2005;192:1005–1021.)
.jpg)
Hình 9.47: Mối liên quan giữa độ dày NT (trục x) và tỷ lệ mắc dị tật lớn (trục y). (Graph is based on data from Souka AP, von Kaisenberg CS, Hyett JA, et al. Increased nuchal translucency with normal karyotype. Am J Obstet Gynecol. 2005;192:1005– 1021.)
.jpg)
Hình 9.48: Mối liên quan giữa độ dày NT (trục x) và tỷ lệ thai chết lưu (trục y). (Graph is based on data from Souka AP, von Kaisenberg CS, Hyett JA, et al. Increased nuchal translucency with normal karyotype. Am J Obstet Gynecol. 2005;192:1005– 1021.)
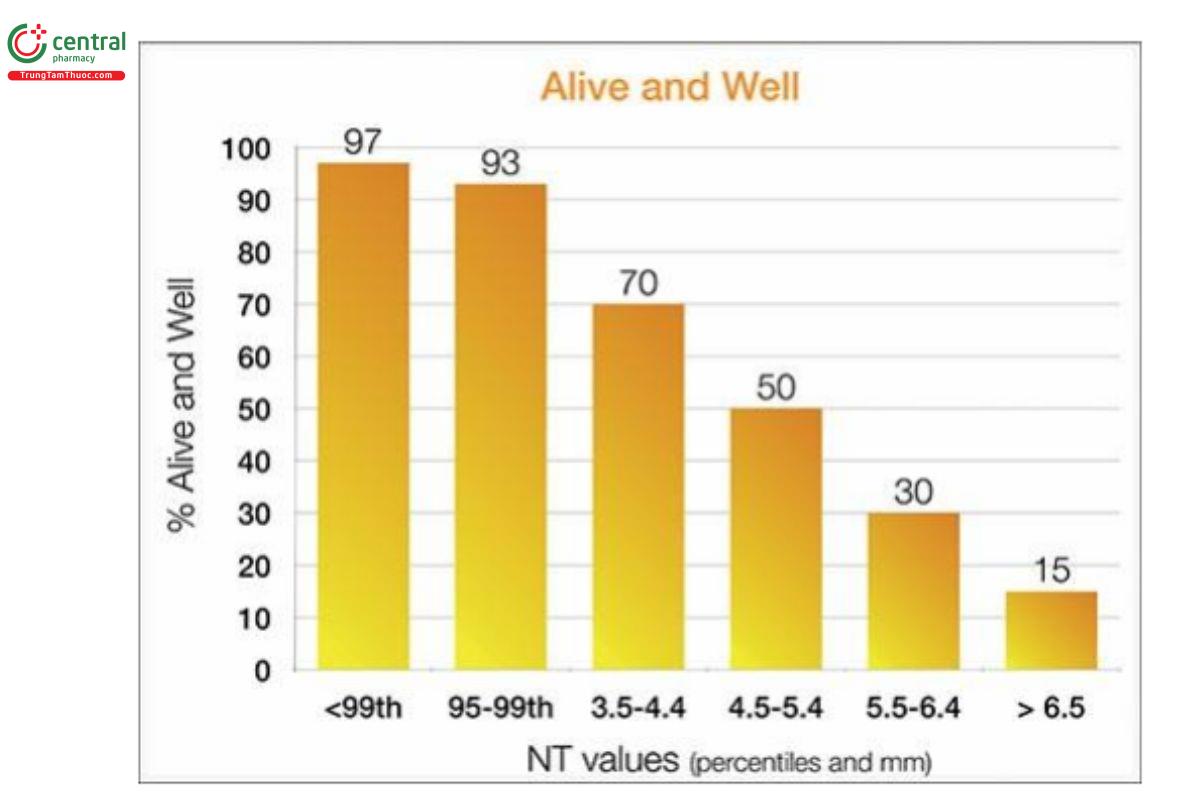
Hình 9.49: Mối liên quan giữa độ dày NT (trục x) và tỷ lệ trẻ sinh sống không có dị tật lớn (trục y). (Graph is based on data from Souka AP, von Kaisenberg CS, Hyett JA, et al. Increased nuchal translucency with normal karyotype. Am J Obstet Gynecol.)
7.3 Sinh lý bệnh của NT dày
Hiểu rõ sinh lý bệnh của tình trạng tăng tích tụ dịch ở thai nhi có NT dày là vô cùng quan trọng vì nó giúp thiết lập mối liên hệ với các tình trạng thai bất thường khác nhau. 14,65 Tuy nhiên, nhiệm vụ này không hề dễ dàng và dường như NT dày có thể là hậu quả từ các tình trạng khác nhau. NT dày có thể do bất thường nhiễm sắc thể, nhưng cũng có thể do bất thường về chức năng và cấu trúc của tim; rối loạn hệ thống bạch huyết; rối loạn chuyển hóa collagen; nguyên nhân cơ học như chèn ép trong lồng ngực, nhiễm trùng, rối loạn chuyển hóa và huyết học; hoặc kết hợp giữa các tình trạng kể trên. Các loại bất thường chính liên quan với NT dày ngoài lệch bội 71 (Hình 9.46) bao gồm dị tật tim72 (Hình 11.7 trong Chương 11), các dị tật lớn (Hình 9.47) với các hội chứng cụ thể (ví dụ, hội chứng Noonan) (Hình. 9.45), 68,73 loạn sản xương,74 thoát vị hoành hội chứng và không có hội chứng (nonsyndromic), và các hội chứng phức tạp ảnh hưởng đến não, thận và các cơ quan khác.65,66 Mối liên quan giữa NT dày với các bất thường này tăng theo độ dày NT (Hình 9.47 ).
7.4 Khiếm khuyết tim bẩm sinh
Hyett và cộng sự 72 phát hiện, tần suất dị tật tim tỷ lệ thuận với độ dày NT, và điều này cũng đã được các nghiên cứu khác xác nhận. Tồn tại mối tương quan trực tiếp giữa kích thước NT và nguy cơ bất thường tim (Hình 11.7 trong Chương 11). Ở các trung tâm của chúng tôi, NT dày là một chỉ định siêu âm tim thai sớm, thậm chí ngay trước khi thực hiện thủ thuật xâm lấn. Siêu âm tim thai theo dõi cũng được thực hiện lúc 16 đến 22 tuần tuổi. Vui lòng tham khảo Chương 11 để thảo luận chi tiết về việc đánh giá tim thai trong quý 1.
7.5 Các bất thƣờng cấu trúc và hội chứng di truyền khác
Có một danh sách khá dài các bất thường cấu trúc và hội chứng di truyền liên quan với NT dày66 (xem Bảng 9.3). Tuy nhiên, vẫn chưa rõ liệu trong tất cả các trường hợp được báo cáo, mối quan hệ đó là nhân quả hay là ngẫu nhiên.65 Các dị tật thai như thoát vị rốn (omphalocele) và thoát vị hoành (diaphragmatic hernia), đơn độc hoặc hội chứng, có liên quan mạnh với NT dày (xem trường hợp bị hội chứng Fryns ở Hình 10.20 trong Chương 10). Nhiều hội chứng được liệt kê trong các loạt ca bệnh (series) báo cáo kết cục của thai nhi có NT dày và nhiễm sắc thể bình thường. Tuy nhiên, rất khó để chứng minh mối quan hệ nhân quả hoặc mối liên quan mạnh giữa các hội chứng di truyền cụ thể và NT dày bởi hầu hết các hội chứng có tỷ lệ cực kỳ thấp trong dân số. 65 Trong một nghiên cứu, các hội chứng di truyền và rối loạn đơn gen (single gene disorders) được phát hiện ở 12,7% thai nhi có NT dày. 63 Hội chứng Noonan hiện được chấp nhận là tình trạng di truyền phân tử duy nhất có mối liên quan rõ ràng với NT dày trong quý 1 (Hình 9.45), 68 đặc biệt nếu phù da gáy (nuchal edema) kéo dài sang quý 2. Loạn sản xương cũng có mối liên quan mạnh với NT dày. Trong danh sách các trường hợp loạn sản xương quý 1 được báo cáo bởi Khalil và cộng sự, 74 hầu hết các trường hợp đều có NT dày (xem thêm Chương 15 về dị tật xương). Bảng 9.3 tóm tắt một số bất thường liên quan với NT dày được báo cáo trong y văn. 66
| Bảng 9.3 • Một số bất thƣờng thai nhi có độ mờ da gáy dày | |||
| Bất thường CNS, đầu và cổ | Bất thường bụng và ngực | Bất thường xương | Bệnh di truyền và chuyển hóa |
| Acrania/anencephaly | Cơ quan sinh dục mơ hồ | Bất sản sụn | Hội chứng BeckwithWiedemann |
| Bất sản thể chai | Bất thường phức hợp cơ thể | Bất sản sụn | Hội chứng CHARGE |
| Bất sản xương hàm dưới/cằm nhỏ | Bất thường tim (tất cả) | Loạn dưỡng lồng ngực gây ngạt | Phù bạch mạch bẩm sinh |
| Dính khớp sọ sớm (Craniosynostosis) | Lộn ổ nhớp | Loạn sản xương sụn Blomstrand | Hội chứng Cornelia de Lange |
| Nang bạch huyết (Cystic hygroma) | Tăng sản tuyến thượng thận bẩm sinh | Loạn sản Campomelic | Suy giảm hệ thống miễn dịch |
| U mỡ vùng cổ | Hội chứng thận hư bẩm sinh | Loạn sản xương sọ-xương đòn | Hội chứng DiGeorge |
| Dị tật Dandy– Walker | Dị dạng nang tuyến phổi bẩm sinh | Giảm sản sụn | Hội chứng EEC |
| Tủy sống chẻ đôi (Diastematomyelia) | Thoát vị hoành | Giảm phosphatase kiềm | Chuỗi biến dạng mất vận động thai nhi (fetal akinesia deformation sequence) |
| Thoát vị não-màng não | Teo tá tràng | Hội chứng Jarcho–Levin | Thiếu máu thai nhi (các căn nguyên) |
| Khe hở mặt | Teo thực quản | Gù vẹo cột sống | GM1 gangliosidosis |
| Hội chứng Fowler | Thoát vị rốn | Khiếm khuyết giảm chi | Mucopolysaccharidosis type VII |
| Não thất duy nhất | Hội chứng Fryns | Hội chứng Nance–Sweeney | Loạn dưỡng tăng trương lực cơ (myotonic dystrophy) |
| Hội chứng Hydrolethalus | Hở thành bụng | Bệnh tạo xương bất toàn | Bệnh não rung giật cơ trẻ sơ sinh (neonatal myoclonic encephalopathy) |
| Iniencephaly | Thận ứ nước | Hội chứng Roberts | Hội chứng Noonan |
| Hội chứng Joubert | Lỗ tiểu đóng thấp | Hội chứng Robinow | Hội chứng Perlman |
| Tật đầu to | Hội chứng Meckel–Gruber | Hội chứng thừa ngón-xương sườn ngắn | Chậm phát triển nặng không rõ nguyên nhân |
| Tật đầu nhỏ | Bàng quang to | Hội chứng người cá (Sirenomelia) | Hội chứng Smith– Lemli–Opitz |
| Tật mắt nhỏ | Thận loạn sản nhiều nang | Bàn chân khoèo | Teo cơ tủy sống (SMA) type 1 |
| Tật chẻ đôi đốt sống (Spina bifida) | Thận đa nang, trẻ nhỏ | Bệnh lùn gây chết (Thanatophoric dwarfism) | Hội chứng Stickler |
| Hội chứng Treacher Collins | Tắc ruột non | Hội chứng VACTER | Hội chứng không xác định |
| Tật đầu hình tam giác (Trigonocephaly) | Còi xương kháng trị với Vitamin D | ||
| Dãn não thất | Hội chứng Zellweger | ||
| Modified from Souka AP, von Kaisenberg CS, Hyett JA, et al. Increased nuchal translucency with normal karyotype. Am J Obstet Gynecol. 2005;192:1005–1021. (Copyright Elsevier Ltd, with permission.) | |||
7.6 Đánh giá di truyền bổ sung
7.6.1 Lai so sánh bộ gen bằng array (Comparative Genomic Hybridization Array)
Trong một phân tích gộp gần đây, lai so sánh bộ gen (CGH) bằng array hoặc microarray bất thường gặp ở khoảng 5% NT dày, với dao động khoảng 10% trong một số nghiên cứu. 69 Vì vậy, chỉ định CGH đối với thai kỳ có NT dày dường như là hợp lý.
7.6.2 Bệnh đơn gen
Có một số nghiên cứu báo cáo tỷ lệ mắc hội chứng Noonan cao ở thai nhi có NT dày, 68,73 đặc biệt khi NT dày kéo dài sang quý 2. 73 Trong một loạt 120 thai nhi, có 8 thai nhi mắc hội chứng Noonan.68 Các phát hiện sơ bộ về mối liên quan giữa NT dày và teo cơ tủy sống (SMA-Type 1), không được xác nhận trong đánh giá sau đó. 68 Có thể trong tương lai, giải trình tự toàn bộ hệ gen (whole genomic sequencing) có thể được chỉ định ở các tình trạng này, nhưng trước khi triển khai rộng rãi, giá trị của cách tiếp cận này phải được chứng minh trong các nghiên cứu lớn.
7.7 Quản lý và theo dõi NT dày
Trong quý 1, nếu phát hiện thai nhi có NT dày, thì cần phải siêu âm thai chi tiết, bao gồm cả siêu âm qua ngả âm đạo nếu khả thi. Các thành phần của siêu âm thai chi tiết trong quý 1 được trình bày trong Chương 5. Cũng cần siêu âm theo dõi lúc 16 tuần tuổi để đánh giá lại giải phẫu thai nhi.75 Đánh giá nếp gấp da gáy (nuchal fold) trong quý 2 cũng rất quan trọng bởi kết cục được cải thiện nếu nếp gấp da gáy bình thường (Hình 9.49). Siêu âm thai chi tiết lúc 18 đến 22 tuần tuổi kèm theo siêu âm tim thai cũng được khuyến nghị. Cách tiếp cận này sẽ phát hiện được hầu hết các dị tật lớn, các hội chứng, và nhiều tình trạng trong số đó có thể được phát hiện khi siêu âm thai quý 1 và đầu quý 2.
8 TÀI LIỆU THAM KHẢO
- Chaoui R, Benoit B, Mitkowska-Wozniak H, et al. Assessment of intracranial translucency (IT) in the detection of spina bifida at the 11-13-week scan. Ultrasound Obstet Gynecol. 2009;34:249–252
- Cicero S, Curcio P, Papageorghiou A, et al. Absence of nasal bone in fetuses with trisomy 21 at 11-14 weeks of gestation: an observational study. Lancet. 2001;358:1665–1667.
- Cicero S, Curcio P, Rembouskos G, et al. Maxillary length at 11-14 weeks of gestation in fetuses with trisomy 21. Ultrasound Obstet Gynecol. 2004;24:19–22.
- Sonek J, Borenstein M, Dagklis T, et al. Frontomaxillary facial angle in fetuses with trisomy 21 at 11- 136 weeks. Amer J Obstet Gynecol. 2007;196:271.e1–271.e4.
- Manegold-Brauer G, Bourdil L, Berg C, et al. Prenasal thickness to nasal bone length ratio in normal and trisomy 21 fetuses at 11-14 weeks of gestation. Prenat Diagn. 2015;35:1079–1084.
- Yazdi B, Riefler P, Fischmüller K, et al. The frontal space measurement in euploid and aneuploid pregnancies at 11-13 weeks‘ gestation. Prenat Diagn. 2013;33:1124– 1130.
- Hoopmann M, Sonek J, Esser T, et al. Frontal space distance in facial clefts and retrognathia at 11- 13 weeks‘ gestation. Ultrasound Obstet Gynecol. 2016;48:171– 176.
- Bakker M, Pace M, de Jong-Pleij E, et al. Prenasal thickness, prefrontal space ratio and other facial profile markers in first-trimester fetuses with aneuploidies, cleft palate, and cằm nhỏ. Fetal Diagn Ther. 2016. doi:10.1159/000449099.
- Sepulveda W, Wong AE, Martinez-Ten P, et al. Retronasal triangle: a sonographic landmark for the screening of cleft palate in the first trimester. Ultrasound Obstet Gynecol. 2010;35:7–13.
- Sepulveda W, Wong AE, Vinals F, et al. Absent mandibular gap in the retronasal triangle view: a clue to the diagnosis of cằm nhỏ in the first trimester. Ultrasound Obstet Gynecol. 2012;39:152–156.
- Chaoui R, Heling K-S. 3D Ultrasound in Prenatal Diagnosis: A Practical Approach. 1st ed. Berlin, New York: DeGruyter; 2016.
- Guis F, Ville Y, Vincent Y, et al. Ultrasound evaluation of the length of the fetal nasal bones throughout gestation. Ultrasound Obstet Gynecol. 1995;5:304–307.
- Nicolaides KH. Screening for fetal aneuploidies at 11 to 13 weeks. Prenat Diagn. 2011;31:7–15.
- Nicolaides KH. Nuchal translucency and other first-trimester sonographic markers of chromosomal abnormalities. Am J Obstet Gynecol. 2004;191:45–67.
- Maymon R, Levinsohn-Tavor O, Cuckle H, et al. Second trimester ultrasound prenasal thickness combined with nasal bone length: a new method of Down syndrome screening. Prenat Diagn. 2005;25:906–911.
- Persico N, Borenstein M, Molina F, et al. Prenasal thickness in trisomy-21 fetuses at 16-24 weeks of gestation. Ultrasound Obstet Gynecol. 2008;32:751–754.
- Miron J-P, Cuckle H, Miron P. Prenasal thickness in first-trimester screening for Down syndrome. Prenat Diagn. 2012;32:695–697.
- Borenstein M, Persico N, Kaihura C, et al. Frontomaxillary facial angle in chromosomally normal fetuses at 11 + 0 to 13 + 6 weeks. Ultrasound Obstet Gynecol. 2007;30:737–741.
- Borenstein M, Persico N, Kagan KO, et al. Frontomaxillary facial angle in screening for trisomy 21 at 11 + 0 to 13 + 6 weeks. Ultrasound Obstet Gynecol. 2008;32:5–11.
- Lachmann R, Picciarelli G, Moratalla J, et al. Frontomaxillary facial angle in fetuses with spina bifida at 11-13 weeks‘ gestation. Ultrasound Obstet Gynecol. 2010;36:268–271.
- Borenstein M, Persico N, Strobl I, et al. Frontomaxillary and mandibulomaxillary facial angles at 11 + 0 to 13 + 6 weeks in fetuses with trisomy 18. Ultrasound Obstet Gynecol. 2007;30:928–933.
- Borenstein M, Persico N, Dagklis T, et al. Frontomaxillary facial angle in fetuses with trisomy 13 at 11 + 0 to 13 + 6 weeks. Ultrasound Obstet Gynecol. 2007;30:819– 823.
- Plasencia W, Dagklis T, Pachoumi C, et al. Frontomaxillary facial angle at 11 + 0 to 13 + 6 weeks: effect of plane of acquisition. Ultrasound Obstet Gynecol. 2007;29:660–665.
- de Jong-Pleij EAP, Ribbert LSM, Manten GTR, et al. Maxilla-nasion-mandible angle: a new method to assess profile anomalies in pregnancy. Ultrasound Obstet Gynecol. 2011;37:562–569.
- Kivilevitch Z, Salomon LJ, Benoit B, et al. Fetal interlens distance: normal values during pregnancy. Ultrasound Obstet Gynecol. 2010;36:186–190.
- Blaas HGK, Eriksson AG, Salvesen KÅ, et al. Brains and faces in não thất duy nhất: pre- and postnatal description of 30 cases. Ultrasound Obstet Gynecol. 2002;19:24–38.
- Karl K, Benoit B, Entezami M, et al. Small biparietal diameter in fetuses with spina bifida on 11-13-week and mid-gestation ultrasound. Ultrasound Obstet Gynecol. 2012;40:140–144.
- Tonni G, Centini G, Inaudi P, et al. Prenatal diagnosis of severe epignathus in a twin: case report and review of the literature. Cleft Palate-Craniofac J. 2010;47:421– 425.
- Gull I, Wolman I, Har-Toov J, et al. Antenatal sonographic diagnosis of epignathus at 15 weeks of pregnancy. Ultrasound Obstet Gynecol. 1999;13:271–273.
- Sepulveda W, Wong AE, Andreeva E, et al. Sonographic spectrum of firsttrimester fetal thoát vị não: review of 35 cases. Ultrasound Obstet Gynecol. 2015;46:29–33.
- Ashwal E, Achiron A, Gilboa Y, et al. Prenatal ultrasonographic diagnosis of cataract: in utero manifestations of cryptic disease. Ultraschall Med. 2016. doi:10.1055/s-0042-120841.
- Vanderas AP. Incidence of cleft lip, cleft palate, and cleft lip and palate among races: a review. Cleft Palate J. 1987;24:216–225.
- IPDTOC Working Group. Prevalence at birth of cleft lip with or without cleft palate: data from the International Perinatal Database of Typical Oral Clefts (IPDTOC). Cleft Palate Craniofac J. 2011;48:66–81.
- American Institute of Ultrasound in Medicine. AIUM practice guideline for the performance of obstetric ultrasound examinations. J Ultrasound Med. 2013;32:1083– 1101.
- Calzolari E, Pierini A, Astolfi G, et al. Associated anomalies in multi-malformed infants with cleft lip and palate: an epidemiologic study of nearly 6 million births in 23 EUROCAT registries. Am J Med Genet A. 2007;143A:528–537.
- Dixon MJ, Marazita ML, Beaty TH, et al. Cleft lip and palate: understanding genetic and environmental influences. Nat Rev Genet. 2011;12:167–178.
- Kernahan DA. The striped Y—a symbolic classification for cleft lip and palate. Plast Reconstr Surg. 1971;47:469–470.
- Nyberg DA, Sickler GK, Hegge FN, et al. Fetal cleft lip with and without cleft palate: US classification and correlation with outcome. Radiology. 1995;195:677–684.
- Ghi T, Arcangeli T, Radico D, et al. Three-dimensional sonographic imaging of fetal bilateral cleft lip and palate in the first trimester. Ultrasound Obstet Gynecol. 2009;34:119–120.
- Gullino E, Serra M, Ansaldi C, et al. Bilateral cleft lip and palate diagnosed sonographically at 11 weeks of pregnancy. J Clin Ultrasound. 2006;34:398–401.
- Picone O, De Keersmaecker B, Ville Y. Ultrasonographic features of orofacial clefts at first trimester of pregnancy: report of two cases [in French]. J Gynéco Obstétr et Biol Reprod. 2003;32:736–739.
- Syngelaki A, Chelemen T, Dagklis T, et al. Challenges in the diagnosis of fetal non-chromosomal abnormalities at 11-13 weeks. Prenat Diagn. 2011;31:90–102.
- Chaoui R, Orosz G, Heling KS, et al. Maxillary gap at 11-13 weeks‘ gestation: marker of cleft lip and palate. Ultrasound Obstet Gynecol. 2015;46:665–669.
- Sepulveda W, Cafici D, Bartholomew J, et al. First-trimester assessment of the fetal palate: a novel application of the Volume NT algorithm. J Ultrasound Med. 2012;31:1443–1448.
- Li W-J, Wang X-Q, Yan R-L, et al. Clinical significance of first-trimester screening of the retronasal triangle for identification of primary cleft palate. Fetal Diagn Ther. 2015;38(2):135–141.
- Tonni G, Grisolia G, Sepulveda W. Early prenatal diagnosis of orofacial clefts: evaluation of the retronasal triangle using a new three-dimensional reslicing technique. Fetal Diagn Ther. 2013;34:31–37.
- Nyberg DA, Hegge FN, Kramer D, et al. Premaxillary protrusion: a sonographic clue to bilateral cleft lip and palate. J Ultrasound Med. 1993;12:331–335.
- Jones MC. Facial clefting. Etiology and developmental pathogenesis. Clin Plast Surg. 1993;20:599– 606.
- Gillham JC, Anand S, Bullen PJ. Antenatal detection of cleft lip with or without cleft palate: incidence of associated chromosomal and structural anomalies. Ultrasound Obstet Gynecol. 2009;34:410–415.
- Bergé SJ, Plath H, Van de Vondel PT, et al. Fetal cleft lip and palate: sonographic diagnosis, chromosomal abnormalities, associated anomalies and postnatal outcome in 70 fetuses. Ultrasound Obstet Gynecol. 2001;18:422–431.
- Gabrielli S, Piva M, Ghi T, et al. Bilateral cleft lip and palate without premaxillary protrusion is associated with lethal aneuploidies. Ultrasound Obstet Gynecol. 2009;34:416–418.
- Bronshtein M, Blazer S, Zalel Y, et al. Ultrasonographic diagnosis of glossoptosis in fetuses with Pierre Robin sequence in early and mid pregnancy. Am J Obstet Gynecol. 2005;193:1561–1564.
- Wilhelm L, Borgers H. The ―equals sign‖: a novel marker in the diagnosis of fetal isolated cleft palate. Ultrasound Obstet Gynecol. 2010;36:439–444.
- Bianchi DW. Cằm nhỏ. In: Bianchi DW, Crombleholme TM, D‘Alton M, eds. Fetology: Diagnosis and Management of the Fetal Patient. New York, NY: McGrawHill Medical Pub. Division; 2010: 233– 238.
- Paladini D. Fetal cằm nhỏ: almost always an ominous finding. Ultrasound Obstet Gynecol. 2010;35:377–384.
- Teoh M, Meagher S. First-trimester diagnosis of cằm nhỏ as a presentation of Pierre Robin syndrome. Ultrasound Obstet Gynecol. 2003;21:616–618.
- Chaoui R, Heling KS, Thiel G, et al. Agnathia-otocephaly with não thất duy nhất on prenatal three-dimensional ultrasound. Ultrasound Obstet Gynecol. 2011;37:745– 748.
- Chervenak FA, Isaacson G, Blakemore KJ, et al. Fetal cystic hygroma. Cause and natural history. N Engl J Med. 1983;309:822–825.
- Malone FD, Ball RH, Nyberg DA, et al. First-trimester septated cystic hygroma: prevalence, natural history, and pediatric outcome. Obstet Gynecol. 2005;106:288– 294.
- Molina FS, Avgidou K, Kagan K-O, et al. Cystic hygromas, nuchal edema, and nuchal translucency at 11-14 weeks of gestation. Obstet Gynecol. 2006;107:678–683.
- Johnson MP, Johnson A, Holzgreve W, et al. First-trimester simple hygroma: cause and outcome. Am J Obstet Gynecol. 1993;168:156–161.
- Souka AP, Snijders RJ, Novakov A, et al. Defects and syndromes in chromosomally normal fetuses with increased nuchal translucency thickness at 10-14 weeks of gestation. Ultrasound Obstet Gynecol. 1998;11:391–400.
- Bilardo CM, Pajkrt E, de Graaf I, et al. Outcome of fetuses with enlarged nuchal translucency and normal nhiễm sắc thể đồ. Ultrasound Obstet Gynecol. 1998;11:401– 406.
- Bilardo CM. Increased nuchal translucency and normal nhiễm sắc thể đồ: coping with uncertainty. Ultrasound Obstet Gynecol. 2001;17:99–101.
- Hyett JA. Increased nuchal translucency in fetuses with a normal nhiễm sắc thể đồ. Prenat Diagn. 2002;22:864–868.
- Souka AP, Kaisenberg von CS, Hyett JA, et al. Increased nuchal translucency with normal nhiễm sắc thể đồ. Am J Obstet Gynecol. 2005;192:1005–1021.
- Bakker M, Pajkrt E, Bilardo CM. Increased nuchal translucency with normal nhiễm sắc thể đồ and anomaly scan: what next? Best Pract Res Clin Obstet Gynaecol. 2014;28:355–366.
- Pergament E, Alamillo C, Sak K, et al. Genetic assessment following increased nuchal translucency and normal nhiễm sắc thể đồ. Prenat Diagn. 2011;31:307–310.
- Grande M, Jansen FAR, Blumenfeld YJ, et al. Genomic microarray in fetuses with increased nuchal translucency and normal nhiễm sắc thể đồ: a systematic review and meta-analysis. Ultrasound Obstet Gynecol. 2015;46:650–658.
- Hyett J, Perdu M, Sharland G, et al. Using fetal nuchal translucency to screen for major congenital cardiac defects at 10-14 weeks of gestation: population based cohort study. BMJ (Clin Res Ed). 1999;318:81–85.
- Snijders RJ, Noble P, Sebire N, et al. UK multicentre project on assessment of risk of trisomy 21 by maternal age and fetal nuchal-translucency thickness at 10-14 weeks of gestation. Fetal Medicine Foundation First Trimester Screening Group. Lancet. 1998;352:343–346.
- Hyett JA, Perdu M, Sharland GK, et al. Increased nuchal translucency at 10-14 weeks of gestation as a marker for major cardiac defects. Ultrasound Obstet Gynecol. 1997;10:242–246.
- Bakker M, Pajkrt E, Mathijssen IB, et al. Targeted ultrasound examination and DNA testing for Noonan syndrome, in fetuses with increased nuchal translucency and normal nhiễm sắc thể đồ. Prenat Diagn. 2011;31:833–840
- Khalil A, Pajkrt E, Chitty LS. Early prenatal diagnosis of skeletal anomalies. Prenat Diagn. 2011;31:115–124.
- Le Lous M, Bouhanna P, Colmant C, et al. The performance of an intermediate 16th-week ultrasound scan for the follow-up of euploid fetuses with increased nuchal

