Thay van động mạch chủ qua đường ống thông - Một tiếp cận ít xâm lấn
Nguồn: Sách Tim mạch can thiệp
Chủ biên
PGS.TS.BS. Phạm Mạnh Hùng
Tác giả
TS.BSNT.Đinh Huỳnh Linh
PGS.TS.BS.Phạm Mạnh Hùng
PGS.TS.BS.Nguyễn Ngọc Quang
Thay van Động Mạch Chủ qua đường ống thông (Transcatheter Aortic Valve Implantation, viết tắt: TAVI) là hướng tiếp cận ít xâm lấn. Kỹ thuật này như thế nào? Hãy cùng Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) tìm hiểu trong bài viết sau đây.
1 Đại cương
Hẹp van động mạch chủ (Động Mạch Chủ) do thoái hoá là bệnh lý van tim phổ biến ở người cao tuổi. Hẹp van Động Mạch Chủ khi đã biểu hiện triệu chứng lâm sàng có tiên lượng tồi, với tỉ lệ tử vong sau 5 năm lên tới 68% ở những bệnh nhân không được thay van Động Mạch Chủ. Trước đây, phẫu thuật tim hở thay van Động Mạch Chủ là chỉ định tuyệt đối cho những bệnh nhân này. Tuy nhiên, nhiều bệnh nhân không thể tiến hành cuộc mổ do các bệnh lý nội khoa nặng nề kèm theo như bệnh mạch vành, suy tim trái nặng, suy thận, bệnh phổi mạn tính, đái tháo đường.
Thay van Động Mạch Chủ qua đường ống thông(Transcatheter Aortic Valve Implantation, viết tắt: TAVI) là hướng tiếp cận ít xâm lấn, giúp mở rộng đáng kể diện tích lỗ van Động Mạch Chủ, giảm chênh áp qua van Động Mạch Chủ, cải thiện triệu chứng lâm sàng và giảm biến cố tim mạch cho bệnh nhân. Các thử nghiệm lâm sàng đã chứng minh TAVI có hiệu quả không kém phẫu thuật thay van Động Mạch Chủ, trong khi tỉ lệ biến chứng lại thấp hơn.
Kể từ ca TAVI đầu tiên vào năm 2002, tới nay đã có gần 500 ngàn bệnh nhân trên thế giới được tiến hành thủ thuật này. Các tiến bộ về công nghệ và kỹ thuật giúp thủ thuật tiến hành đơn giản hơn, ít biến chứng hơn, giảm thời gian nằm viện. TAVI trở thành lĩnh vực phát triển nhanh nhất trong chuyên ngành tim mạch can thiệp, từ một thủ thuật phức tạp trở thành một biện pháp điều trị đơn giản, được ứng dụng rộng rãi ở nhiều trung tâm tim mạch trên toàn thế giới.
Dựa trên kết quả nhiều nghiên cứu lớn, chỉ định TAVI ngày càng được mở rộng, ban đầu chỉ dành cho bệnh nhân không thể tiến hành phẫu thuật, sau đó là bệnh nhân nguy cơ phẫu thuật cao, nguy cơ trung bình, và hiện giờ cả các bệnh nhân nguy cơ thấp. TAVI đã thay đổi đáng kể lựa chọn điều trị cho bệnh nhân hẹp van Động Mạch Chủ.
2 Lịch sử ra đời và phát triển của thay van Động Mạch Chủ qua đường ống thông
2.1 Lịch sử ra đời của TAVI
Can thiệp bệnh van động mạch chủ qua đường ống thông là một lĩnh vực thu hút nhiều nghiên cứu từ những năm 1960. Những nghiên cứu đầu tiên được tiến hành bởi Davies (1965), Moulopoulos (1971), Phillips (1976), Andersen (1989), và Matsubara (1992), bước đầu cho thấy tính khả thi của kỹ thuật thay van tim qua da. Năm 2000, Bonhoeffer và cộng sự sử dụng một van làm từ tĩnh mạch của bò, đặt trong khung stent, và đặt thành công van này vào động mạch phổi của cừu, tạo cơ sở cho ca thay van động mạch phổi đầu tiên ở người.
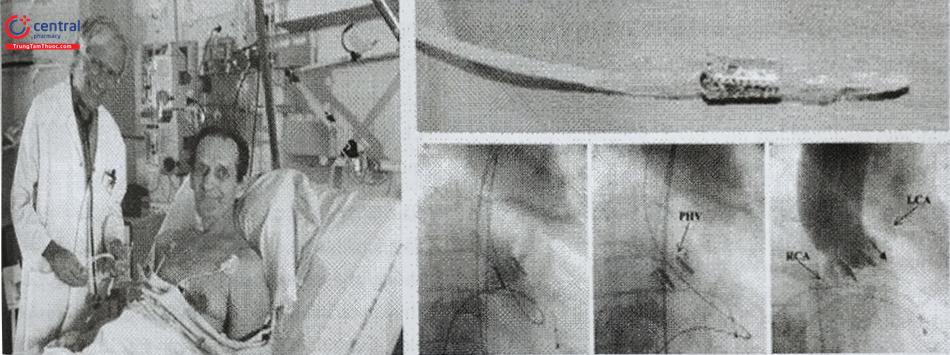
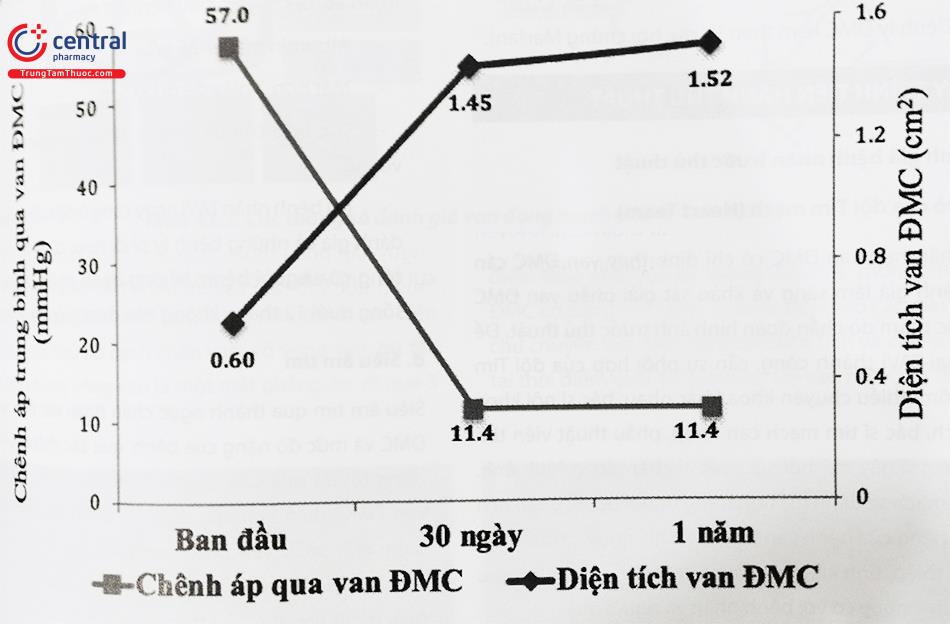
Ca TAVI đầu tiên được bác sĩ Alain Cribier tiến hành ngày 16 tháng 4 năm 2002, ở một bệnh nhân nam 57 tuổi, sốc tim, có nhiều bệnh phối hợp như ung thư phổi, viêm tuỵ mạn, thiếu máu chi bán cấp. Siêu âm tim có diện tích lỗ van 0,6 cm2, chênh áp trung bình qua van 30 mmHg, chức năng thất trái giảm nặng (EF 8-12%). Tất cả các bác sĩ ngoại khoa đều từ chối phẫu thuật. TAVI trở thành biện pháp khả dĩ duy nhất có thể cứu sống người bệnh.
Do động mạch ngoại biên tổn thương nặng, ca TAVI đầu tiên được tiến hành qua đường tĩnh mạch đùi phải. Van Động Mạch Chủ sinh học được đưa từ tĩnh mạch đùi, qua vách liên nhĩ, xuống buồng thất trái, rồi đặt ở vị trí vòng van Động Mạch Chủ của người bệnh. Van nhân tạo sử dụng là van nở bằng bóng, lồng trên một bóng nong kích cỡ 23×30 mm. Ngay sau thủ thuật, chênh áp qua van giảm còn 6 mmHg, áp lực cuối tâm trương thất trái 25 mmHg, cung lượng tim đạt 2,5 L/phút, diện tích van 1,9 cm2. Chụp buồng thất trái cho thấy EF đạt 17%. Bệnh nhân cải thiện rõ rệt về mặt lâm sàng.
Trường hợp thay van thành công này đã mở ra một kỉ nguyên mới cho việc điều trị bệnh lý hẹp van Động Mạch Chủ, là tiền đề phát triển các thế hệ van tim tiếp sau. Tiếp nối, nhiều công trình nghiên cứu được công bố, chứng minh tính khả thi và hiệu quả của kỹ thuật này.
Năm 2005, Cribier và cộng sự báo cáo kết quả 36 ca TAVI đầu tiên, tiến hành trên các bệnh nhân không thể phẫu thuật. Thủ thuật thành công với tỉ lệ 75%. Sau 9 tháng theo dõi, 11 bệnh nhân vẫn còn sống.
Năm 2006, lần đầu tiên tiến hành TAVI qua đường động mạch đùi, với tỉ lệ sống sau 75 ngày là 89% (16/18 bệnh nhân). Năm 2006, lần đầu tiên tiến hành tạo nhịp thất nhanh khi thả van, để giảm nguy cơ di lệch van. Cũng trong năm này, E.Grube và cộng sự lần đầu tiên sử dụng loại van tự nở (CoreValve) thay cho van nở bằng bóng.
Các kết quả nghiên cứu chứng minh hiệu quả và tính an toàn của TAVI, làm cơ sở để năm 2007, hai loại van sinh học đầu tiên (Sapiens và CoreValve) được phép chấp thuận sử dụng trên con người.
2.2 Các nghiên cứu nền tảng về TAVI
2.2.1 TAVI ở bệnh nhân không thể tiến hành phẫu thuật
Năm 2010, nghiên cứu PARTNER 1B so sánh TAVI với điều trị nội khoa ở các bệnh nhân hẹp van Động Mạch Chủ không thể phẫu thuật. Tỉ lệ tử vong sau 1 năm ở nhóm TAVI là 30,7%, thấp hơn với nhóm nội khoa là 50,7% (p<0,05). Sau 5 năm theo dõi, tỉ lệ tử vong do mọi nguyên nhân ở nhóm TAVI là 71,8%, so với nhóm điều trị nội khoa là 93,6% (p<0,0001). TAVI cũng làm giảm tỉ lệ tái nhập viện của bệnh nhân hẹp van Động Mạch Chủ (47,6% so với 87,3%).
2.2.2 TAVI ở bệnh nhân nguy cơ phẫu thuật cao
Thử nghiệm PARTNER 1A so sánh TAVI với phẫu thuật thay van Động Mạch Chủ ở bệnh nhân hẹp van Động Mạch Chủ khít nguy cơ phẫu thuật cao (STS 11%). Sau 5 năm, TAVI có tỉ lệ tử vong 67,8%, tương đương với nhóm phẫu thuật (tỉ lệ 62,4%, p=0,76).
Năm 2014, nghiên cứu CoreValve US cho thấy TAVI ưu điểm hơn mổ thay van ở bệnh nhân nguy cơ phẫu thuật cao, với tỉ lệ tử vong sau 1 năm thấp hơn (14% so với 19%), diện tích van Động Mạch Chủ được mở rộng hơn (1,9 cm2, so với 1,6 cm2), và chênh áp qua van thấp hơn (8,8 mmHg so với 11,7 mmHg).
2.2.3 TAVI ở bệnh nhân nguy cơ phẫu thuật trung bình
Thử nghiệm PARTNER 2 so sánh TAVI với phẫu thuật thay van Động Mạch Chủ ở 2032 bệnh nhân nguy cơ phẫu thuật trung bình (STS 5,5%). Kết quả: tỉ lệ biến cố đích (tử vong hoặc đột quỵ não) sau 2 năm theo dõi không khác biệt giữa hai nhóm (p=0,25).
Thử nghiệm lâm sàng SURTAVI (STS trung bình 4,4%) cho thấy tỉ lệ tử vong sau 1 năm của TAVI là 6,7%, trong khi phẫu thuật là 6,8%. Tỉ lệ tử vong sau 2 năm ở hai nhóm cũng như nhau (11,4% và 11,6%, p>0,05).
2.2.4 TAVI ở bệnh nhân nguy cơ phẫu thuật thấp
Thử nghiệm NOTION so sánh TAVI với phẫu thuật ở bệnh nhân nguy cơ phẫu thuật thấp (STS 3%). Sau 5 năm theo dõi, tỉ lệ tử vong ở cả hai nhóm đều là 27,7% (p=0,9). Tỉ lệ biến cố cộng gộp (tử vong, đột quỵ não, NMCT) nhóm TAVI là 39,2%, so với nhóm phẫu thuật là 35,8% (p=0,78). TAVI cải thiện diện tích lỗ van tốt hơn (1,7 cm2 so với 1,2 cm2, p<0,0001), chênh áp qua van thấp hơn phẫu thuật (8,2 mmHg so với 13,7 mmHg, p<0,001). TAVI có tỉ lệ cấy máy tạo nhịp cao hơn, nhưng ít nguy cơ chảy máu nặng, suy thận, rung nhĩ, hơn nhóm phẫu thuật.
Thử nghiệm PARTNER 3 so sánh TAVI với phẫu thuật thay van Động Mạch Chủ. Kết quả theo dõi 1 năm cho thấy tỉ lệ biến cố (tử vong, đột quỵ não, nhập viện) ở nhóm TAVI là 8,5%, thấp hơn nhóm phẫu thuật là 15,1% (p=0,001).
Thử nghiệm EVOLUT so sánh TAVI với phẫu thuật ở bệnh nhân nguy cơ thấp (STS < 3%) cho thấy: sau 24 tháng, tỉ lệ tử vong ở cả hai nhóm đều là 4,5%. Tỉ lệ đột quỵ não, kẹt van nhân tạo cũng ngang nhau.
2.3 Thay đổi khuyến cáo về TAVI theo thời gian
Các tiến bộ về kỹ thuật, cũng như bằng chứng từ các thử nghiệm lâm sàng là cơ sở để Cơ quan quản lý thuốc và thực phẩm Hoa Kỳ (FDA) và các Hiệp hội tim mạch lớn chấp thuận sử dụng TAVI trong điều trị hẹp chủ khít, với chỉ định ngày càng rộng rãi. Năm 2012, FDA chấp thuận sử dụng TAVI cho các bệnh nhân nguy cơ phẫu thuật cao. Khuyến cáo 2012 về bệnh lý van tim của Hiệp hội Tim mạch Châu Âu (ESC) chỉ định TAVI cho các bệnh nhân hẹp van Động Mạch Chủ nguy cơ phẫu thuật cao (STS>10%) hoặc không thể tiến hành phẫu thuật.
Năm 2014, khuyến cáo về bệnh lý van tim của Hiệp hội Tim mạch Hoa Kỳ/Trường môn Tim mạch Hoa Kỳ/Hiệp hội Phẫu thuật lồng ngực Hoa Kỳ (AHA/ACC/STS) chỉ định TAVI cho các bệnh nhân không thể phẫu thuật (khuyến cáo mức độ I, bằng chứng B) hoặc phẫu thuật nguy cơ cao (khuyến cáo mức độ IIa, bằng chứng B).
Năm 2017, bản cập nhật khuyến cáo của AHA/ACC/STS đã nâng khuyến cáo về TAVI lên mức độ I-A cho đối tượng không thể phẫu thuật hoặc phẫu thuật nguy cơ cao, khuyến cáo IIa-B cho bệnh nhân nguy cơ phẫu thuật trung bình. Cùng năm đó, khuyến cáo ESC 2017 về bệnh lý van tim chỉ định TAVI cho các trường hợp không thể phẫu thuật, phẫu thuật nguy cơ cao hay trung bình, nếu bệnh nhân phù hợp với thay van Động Mạch Chủ qua đường ống thông.
Tháng 8/2019, FDA đã chính thức mở rộng chỉ định TAVI cho các bệnh nhân hẹp van Động Mạch Chủ nguy cơ phẫu thuật thấp.
Theo khuyến cáo của Hiệp hội Tim mạch Hoa Kỳ 2020 và Khuyến cáo của Hiệp hội tim mạch châu Âu về bệnh lý van tim năm 2021, TAVI được chỉ định cho cả các bệnh nhân nguy cấp phẫu thuật thấp. Lựa chọn TAVI hay phẫu thuật tuỳ thuộc vào tuổi và tình trạng lâm sàng của người bệnh trong từng trường hợp cụ thể.
Bảng 1. Lựa chọn biện pháp thay van Động Mạch Chủ ở bệnh nhân hẹp van Động Mạch Chủ khít
| Ưu tiên TAVI | Ưu tiên phẫu thuật | |
| Tình trạng lâm sàng | ||
| Nguy cơ phẫu thuật thấp (STS/EuroSCORE II < 4%) | - | + |
| Nguy cơ phẫu thuật cao (STS/EuroSCORE ≥ 8%) | + | - |
| Người < 75 tuổi | - | + |
| Người cao tuổi (≥ 75) | + | - |
Tiền sử phẫu thuật tim (đặc biệt phẫu thuật CABG có nguy cơ tổn thương graft khi mở xương ức) | + | - |
| Thể trạng yếu | + | - |
| Viêm nội tâm mạc nhiễm khuẩn | - | + |
Chú thích: Động Mạch Chủ: Động mạch chủ; TAVI: Thay van động mạch chủ qua đường ống thông; CABG: Bắc cầu nối chủ-vành; Thang điểm STS (Society of Thoracic Surgeons); Thang điểm EuroSCORE (European System for Cardiac Operative Risk Evaluation).
2.4 TAVI ở Châu Á và Việt Nam
Ca TAVI đầu tiên ở bệnh nhân châu Á được tiến hành năm 2009 ở Singapore. Nghiên cứu Asian-TAVR, theo dõi 848 ca TAVI tại 11 trung tâm tim mạch ở Singapore, Hồng Kông, Đài Loan, Nhật Bản, Hàn Quốc, trong thời gian từ tháng 3/2010 đến tháng 9/2014. Kết quả cho thấy thủ thuật thành công ở 97,5% trường hợp. Tỉ lệ tử vong 30 ngày là 2,5%, tử vong 1 năm là 10,8%, tử vong 2 năm là 16,7%. Kết quả này cũng phù hợp với các công trình nghiên cứu đã công bố tại Mỹ và châu Âu.
Ở Việt Nam, ca lâm sàng thay van Động Mạch Chủ qua đường ống thông đầu tiên được bác sĩ Nguyễn Lân Hiếu thực hiện
năm 2011 ở bệnh viện trường Đại học Y Hà Nội. Từ đó đến nay, đã có nhiều ca TAVI được tiến hành tại nhiều trung tâm tim mạch trong nước như bệnh viện Bạch Mai, bệnh viện Đại học Y Dược Thành phố Hồ Chí Minh, bệnh viện đa khoa quốc tế Vinmec, bệnh viện Đại học Y Hà Nội, cùng nhiều trung tâm khác. Nghiên cứu của Phạm Mạnh Hùng và Đinh Huỳnh Linh (2019) tổng kết kết quả làm TAVI tại 5 trung tâm Tim mạch lớn ở Việt Nam cho thấy TAVI ở bệnh nhân Việt Nam có tỉ lệ thành công cao (98%), cải thiện đáng kể triệu chứng lâm sàng và các thông số huyết động trên siêu âm, với tỉ lệ tử vong sau 1 năm là 8,3%.
3 Chỉ định và chống chỉ đinh của TAVI
3.1 Chỉ định
Bản cập nhật khuyến cáo AHA/ACC 2020 về điều trị bệnh lý van tim chỉ định TAVI cho các đối tượng dưới đây:
- Hẹp van Động Mạch Chủ khít (chênh áp trung bình qua van 40 mmHg, vận tốc dòng tối đa qua van > 4,0 m/giây, diện tích lỗ van < 1 cm2), có triệu chứng lâm sàng NYHA II trở lên.
- Hẹp van Động Mạch Chủ khít không triệu chứng, chức năng tâm thu thất trái dưới 50%.
- Hẹp van Động Mạch Chủ chênh áp thấp, cung lượng thấp, đồng thời có triệu chứng lâm sàng.
- Thay van Động Mạch Chủ ở bệnh nhân có thoái hoá van Động Mạch Chủ sinh học.
3.2 Chống chỉ định
Bệnh lý ngoài bệnh tim mạch dẫn đến kỳ vọng sống dưới 12 tháng;
Nhồi máu cơ tim mới trong vòng 30 ngày trước đó;
đột quỵ não mới trong vòng 6 tháng trước đó (với bằng chứng trên phim chụp MRI sọ não).
Đặc điểm giải phẫu van Động Mạch Chủ không phù hợp với thủ thuật TAVI:
- Đường kính vòng van Động Mạch Chủ đo trên MSCT < 17 mm hoặc > 32
- Chiều cao từ mặt phẳng vòng van tới lỗ động mạch vành thấp hơn 10
- Đường kính Động Mạch Chủ lên lớn hơn 50
Đường kính hệ động mạch chậu–đùi chỗ hẹp nhất < 5 mm.
Bệnh cơ tim phì đại, có hoặc không có tắc nghẽn.
Siêu âm tim có hình ảnh khối u tim hoặc huyết khối ở
Viêm nội tâm mạc nhiễm khuẩn đang tiến triển.
Bệnh lý Động Mạch Chủ kèm theo (ví dụ: hội chứng Marfan).
4 Quy trình tiến hành thủ thuật
4.1 Đánh giá bệnh nhân trước thủ thuật
4.1.1 Vai trò của đội Tim mạch (Heart Team)
Bệnh nhân hẹp van Động Mạch Chủ có chỉ định thay van Động Mạch Chủ cần được đánh giá lâm sàng và khảo sát giải phẫu van Động Mạch Chủ bằng các thăm dò chẩn đoán hình ảnh trước thủ thuật. Để triển khai TAVI thành công, cần sự phối hợp của đội Tim mạch gồm nhiều chuyên khoa khác nhau: bác sĩ nội khoa tim mạch, bác sĩ tim mạch can thiệp, phẫu thuật viên tim mạch, bác sĩ gây mê hồi sức, bác sĩ chẩn đoán hình ảnh. Đội Tim mạch sẽ đánh giá tình trạng người bệnh, phân tích mức độ nặng của bệnh van tim, đánh giá nguy cơ cuộc mổ hay can thiệp, tính khả thi về mặt kỹ thuật, cũng như trao đổi lợi ích – nguy cơ với bệnh nhân và người nhà.
4.1.2 Phân tầng nguy cơ người bệnh
Các thang điểm phân tầng nguy cơ cho bệnh nhân TAVI là thang điểm STS (do Hội phẫu thuật lồng ngực Hoa Kỳ, Society of Thoracic Surgeons, đề xuất) và thang điểm EuroSCORE (European System for Cardiac Operative Risk Evaluation). Hai thang điểm này đều được xây dựng dựa trên số liệu về phẫu thuật tim mạch, ban đầu được dùng để ước tính nguy cơ tử vong và các biến cố trong cuộc mổ. Định nghĩa nguy cơ phẫu thuật thấp nếu điểm STS < 4%, nguy cơ trung bình nếu STS 4-8%, nguy cơ cao nếu STS > 8%. Bệnh nhân có STS > 15% được xếp vào nhóm “không thể tiến hành phẫu thuật”. Bên cạnh thang điểm STS, thang điểm EuroScore II cũng được sử dụng để ước tính nguy cơ cuộc mổ.
Năm 2017, ACC đã ban hành một công cụ để ước tính nguy cơ tử vong trong bệnh viện của bệnh nhân TAVI. Công cụ này, dưới dạng một phần mềm máy tính, có thể được sử dụng để đánh giá bệnh nhân dự định làm TAVI, cũng như so sánh với nguy cơ cuộc mổ.
4.1.3 Tình trạng già yếu
Tình trạng già yếu được chứng minh có tương quan với tiên lượng tồi sau thủ thuật. Các tiêu chí để xếp một bệnh nhân là “già yếu”, theo Trường môn Tim mạch Hoa Kỳ ACC, bao gồm:
- Mất khả năng tự thực hiện > 2 hoạt động cơ bản thường ngày (trong số 6 hoạt động: ăn uống, tắm, mặc quần áo, di chuyển, tiểu tiện, đại tiện).
- Albumin máu < 35 g/L.
- Mất hơn 7 giây để đi bộ 5m
- Lực bóp của bàn tay < 30 kg với nam và < 18 kg với nữ.
- Do bệnh nhân TAVI ngày càng ở độ tuổi cao hơn, cần đánh giá cả những bệnh lý phối hợp, cũng như kỳ vọng sống của người bệnh. Những bệnh nhân có tiên lượng sống dưới 12 tháng không nên được tiến hành
4.1.4 Siêu âm tim
Siêu âm tim qua thành ngực chẩn đoán xác định hẹp van Động Mạch Chủ và mức độ nặng của bệnh, qua các thông số vận tốc dòng tối đa qua van, chênh áp tối đa và trung bình qua van Động Mạch Chủ, diện tích van Động Mạch Chủ. Siêu âm tim đánh giá đặc điểm giải phẫu van Động Mạch Chủ (van Động Mạch Chủ hai lá van hay ba lá van, mức độ vôi hoá van) và cơ chế hẹp van Động Mạch Chủ (do thoái hoá, bệnh van tim hậu thấp, hẹp van Động Mạch Chủ bẩm sinh, hay thương tổn phối hợp).
Siêu âm tim cũng cung cấp thông tin về những bệnh lý van tim kèm theo, tình trạng tăng áp lực động mạch phổi, rối loạn vận động thành tim, chức năng tâm thu thất trái EF. Nếu siêu âm qua thành ngực chưa rõ ràng, cần tiến hành siêu âm tim qua thực quản hoặc siêu âm tim gắng sức với Dobutamine.
4.1.5 Chụp cắt lớp vi tính đa dãy đầu dò (MSCT) van động mạch chủ
Chụp MSCT là thăm dò chẩn đoán hình ảnh cơ bản để đánh giá bệnh nhân trước thủ thuật TAVI. Phim MSCT cần được chụp với cổng điện tâm đồ, qua đó cung cấp hình ảnh giải phẫu ba chiều tương ứng các giai đoạn chu chuyển tim.
Dựa trên hình ảnh MSCT, thu được thông tin về giải phẫu van Động Mạch Chủ, gốc Động Mạch Chủ, hệ Động Mạch Chủ – động mạch chậu, đùi.
Bên cạnh đó MSCT cũng đo chiều cao từ mặt phẳng vòng van đến lỗ ĐMV, đường kính van Động Mạch Chủ, chu vi vòng van, tình trạng vôi hoá van, vôi hoá đường ra thất trái.
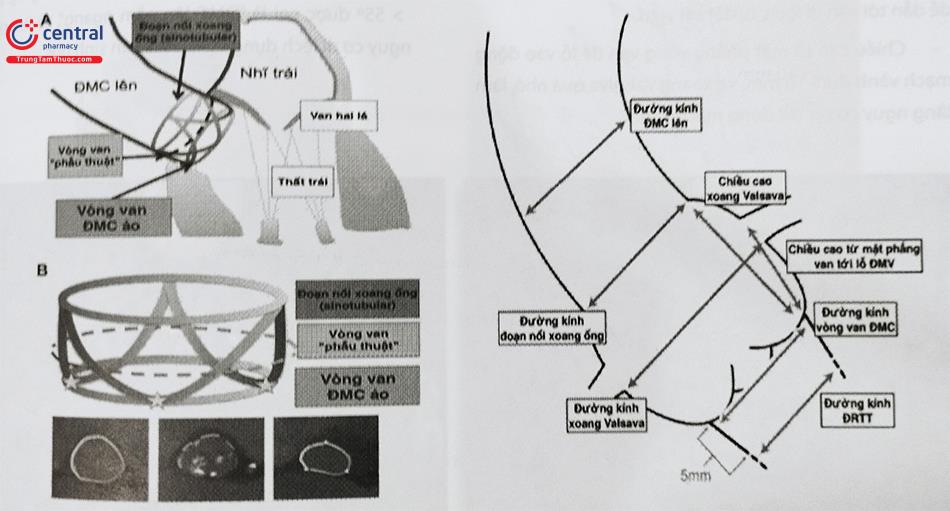
Kích thước vòng van Động Mạch Chủ là thông số quyết định để lựa chọn kích cỡ van Động Mạch Chủ sinh học, cũng như tránh các biến cố có thể gặp như hở cạnh chân van, vỡ vòng van, bít tắc ĐMV. Mặt phẳng vòng van là một mặt phẳng ảo, đi qua 3 điểm thấp nhất của ba xoang Valsalva. Thông thường, van Động Mạch Chủ có dạng hình elip, và biến đổi theo các giai đoạn của chu chuyển tim. Tiến hành đo diện tích và chu vi vòng van tại thời điểm giữa thì tâm thu, khi van mở rộng tối đa.
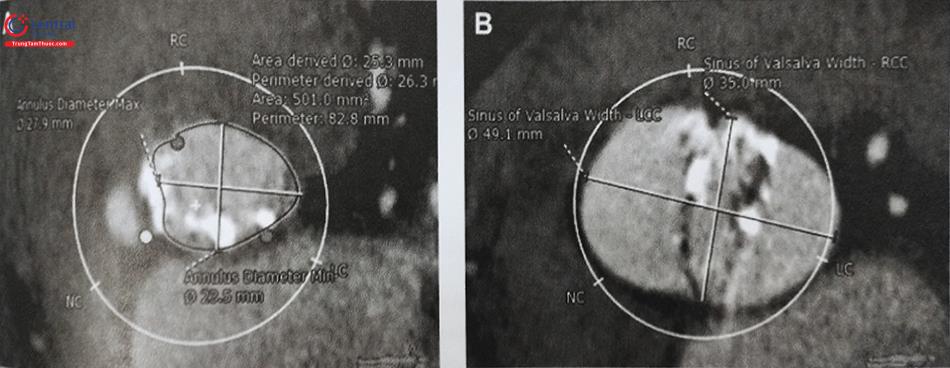
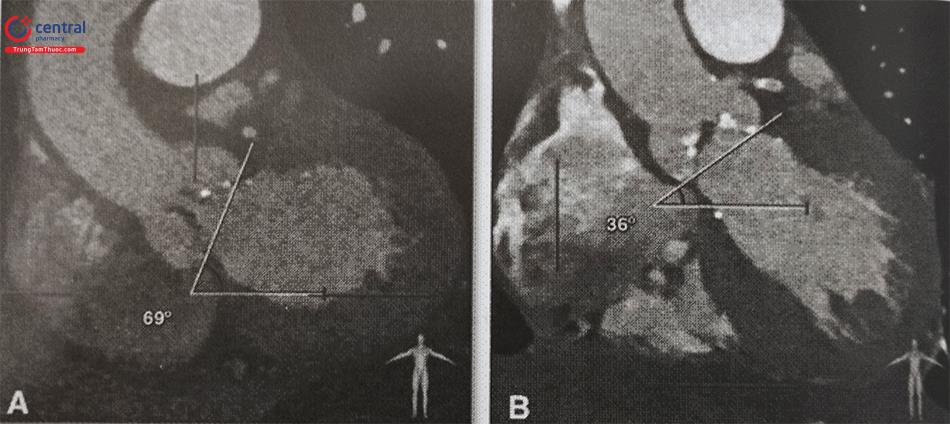
Hình A: Đo đường kính tối đa, đường kính tối thiểu và chu vi vòng van, ở vị trí mặt phẳng van Động Mạch Chủ.
Hình B: Đo các đường kính xoang Valsalva. Phim MSCT cho thấy hình ảnh van Động Mạch Chủ hai lá van do dính lá vành trái với lá vành phải, van vôi hoá mức độ trung bình.
Một số thông số giải phẫu khác cũng ảnh hưởng đến thủ thuật TAVI:
- Phì đại vách liên thất và vôi hoá đường ra thất trái dễ dẫn tới van di lệch, bị đặt sai vị trí.
- Chiều cao từ mặt phẳng vòng van để lỗ vào động mạch vành dưới 10 mm, và xoang Valsalva quá nhỏ, làm tăng nguy cơ bít tắc động mạch vành.
- Van vôi hoá quá nhiều tăng nguy cơ hở cạnh chân van
- Góc tạo bởi gốc Động Mạch Chủ với mặt phẳng G 55º được coi là “Động Mạch Chủ lên nằm ngang”, sẽ làm tăng nguy cơ di lệch dụng cụ khi thả van sinh học.
Phim MSCT mạch máu giúp lựa chọn đường vào mạch máu tối ưu cho thủ thuật. Động mạch đùi là đường vào phổ biến nhất. Tuy nhiên, nếu có hẹp động mạch chủ chậu, hoặc động mạch đùi quá xoắn vặn hay quá vôi hoá, hoặc có kích thước quá nhỏ, có thể lựa chọn đường vào động mạch dưới đòn, động mạch cảnh, hoặc qua đường mở Động Mạch Chủ lên.
Quy trình chụp MSCT tiêu chuẩn cần dùng 80-100 mL thuốc cản quang. Tuy nhiên, với bệnh nhân suy thận, có thể lựa chọn liều cản quang thấp hơn, chấp nhận chất lượng hình ảnh giảm đi. Trong trường hợp này, có thể phối hợp thêm siêu âm tim qua thực quản với đầu dò 3D để dựng hình van Động Mạch Chủ và tính toán kích cỡ van.
4.2 Van sinh học nhân tạo dùng trong TAVI
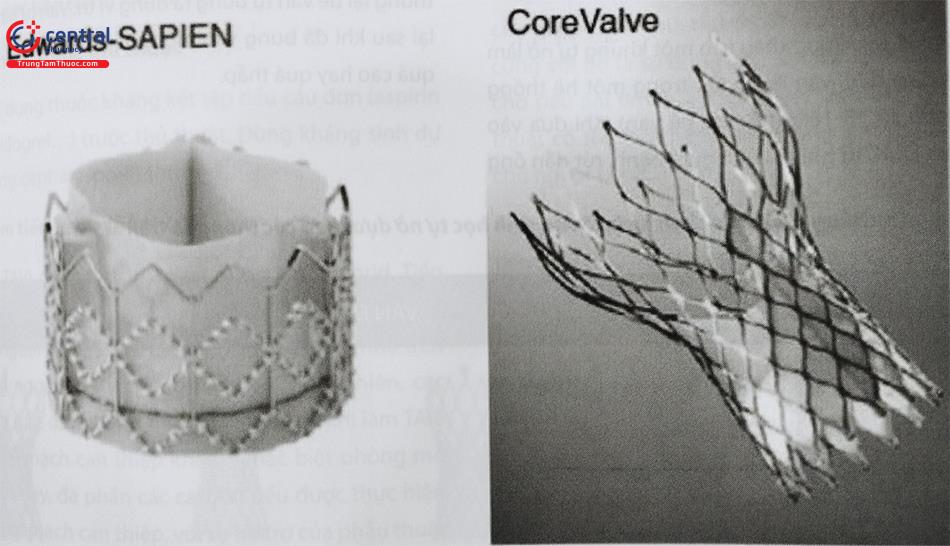
Hiện nay có nhiều loại van sinh học được FDA chấp thuận sử dụng làm TAVI. Đa số các loại van hiện nay được đặt vào cơ thể theo một trong hai cơ chế: van nở bằng bóng và van tự nở. Van Động Mạch Chủ sinh học thế hệ đầu tiên bao gồm van Sapien XT của hãng Edwards và CoreValve của hãng Medtronic. Các van Động Mạch Chủ sinh học thế hệ thứ hai bao gồm Sapien 3, Evolut R (được thay thế bằng Evolut PRO), Lotus, Symetis Acurate,…
4.2.1 Van nở bằng bóng
Loại van này, tiêu biểu là Sapien (hãng Edwards LifeScience) gồm một khung cobalt-chrome và ba lá van làm từ màng ngoài tim bò. Van được lồng phía ngoài một
bóng tương tự bóng sử dụng để nong van Động Mạch Chủ. Khi đưa thiết bị vào vị trí van Động Mạch Chủ tự nhiên, tiến hành bơm bóng làm nở khung van. Sau đó làm xẹp bóng và rút dụng cụ ra.
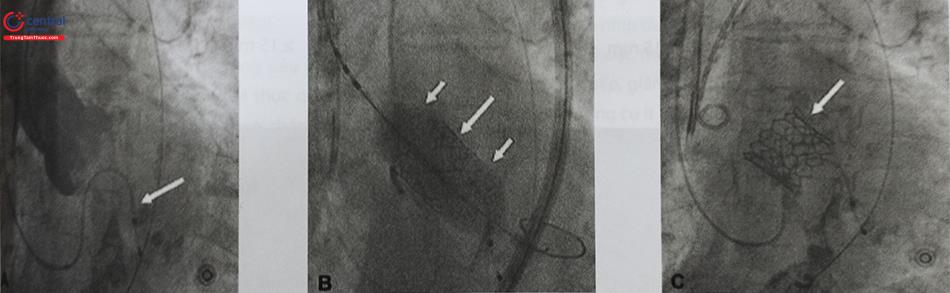
Hình A: Chụp gốc Động Mạch Chủ trước thủ thuật. (Mũi tên chỉ điện cực tạo nhịp tạm thời trong buồng thất phải)
Hình B: Nong bóng làm nở rộng van Động Mạch Chủ trong lúc tạo nhịp thất nhanh. (Mũi tên dài chỉ van sinh học. Mũi tên ngắn chỉ 2 đầu bóng nong)
Hình C: Van S3 nằm đúng vị trí (Mũi tên chỉ van động mạch chủ sinh học)
4.2.2 Van tự nở
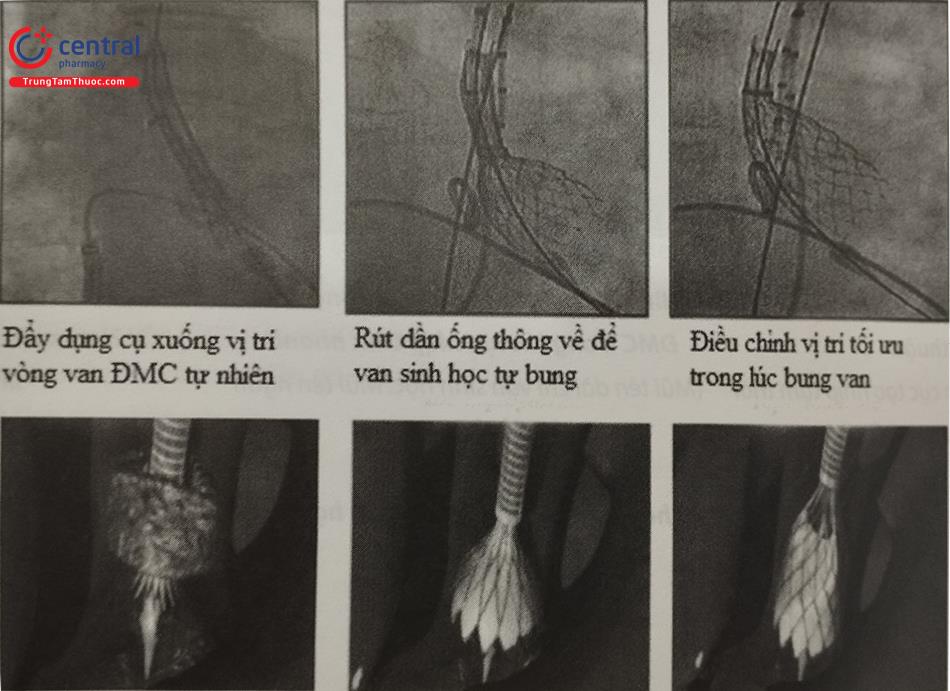
Van tự nở gồm lá van được khâu vào một khung tự nở làm bằng nitinol. Ban đầu, van được đặt trong một hệ thống ống thông kích cỡ 16-18Fr (tuỳ thế hệ van). Khi đưa vào vị trí vòng van Động Mạch Chủ tự nhiên của người bệnh, rút dần ống thông lại để van tự bung ra đúng vị trí. Van tự nở có thể thu lại sau khi đã bung van một phần, nếu thấy vị trí đặt van quá cao hay quá thấp.

4.3 Các bước tiến hành thủ thuật
4.3.1 Lưu ý thuốc trước thủ thuật
Chỉ cần sử dụng thuốc kháng kết tập tiểu cầu đơn (aspirin hoặc clopidogrel…) trước thủ thuật. Dùng kháng sinh dự phòng bằng Cephalosporin thế hệ 1.
4.3.2 Địa điểm tiến hành thủ thuật
Trước kia, TAVI được thực hiện tại phòng mổ hybrid. Tiến hành TAVI ở phòng mổ hybrid giúp thầy thuốc kịp thời can thiệp ngoại khoa, xử trí các biến chứng nặng như tràn máu màng ngoài tim, vỡ vòng van Động Mạch Chủ. Tuy nhiên, các nghiên cứu gần đây chứng minh tỉ lệ biến cố khi làm TAVI ở phòng tim mạch can thiệp không khác biệt phòng mổ hybrid. Hiện nay, đa phần các ca TAVI đều được thực hiện tại phòng tim mạch can thiệp, với sự hỗ trợ của phẫu thuật viên lồng ngực – mạch máu.
4.3.3 Vai trò của siêu âm tim trong thủ thuật
Siêu âm tim giúp đánh giá chênh áp qua van (trước và sau thủ thuật), đánh giá tình trạng hở cạnh chân van sau khi thả van, từ đó làm cơ sở để bác sĩ can thiệp quyết định có nong lại van sinh học bằng bóng hay không. Ngoài ra, siêu âm cũng có vai trò đánh giá nhanh các trường hợp biến cố như tràn máu màng tim, thủng buồng tim, vỡ vòng van, suy tim cấp, biến chứng mạch máu (Xem thêm Chương 15: Ứng dụng siêu âm tim trong can thiệp).
Trước đây, các ca TAVI đều sử dụng siêu âm tim qua thực quản. Tuy nhiên, siêu âm tim qua thực quản kéo dài thời gian tiến hành thủ thuật, tăng sang chấn vùng hầu họng, thực quản, ảnh hưởng đến thao tác của bác sĩ can thiệp, cũng như bắt buộc phải gây mê toàn thân cho người bệnh. Ở các trung tâm nhiều kinh nghiệm, sử dụng siêu âm qua thành ngực không làm tăng tỉ lệ biến chứng, giúp thủ thuật đơn giản hơn và giảm thời gian nằm viện cho bệnh nhân.
4.3.4 Các bước tiến hành TAVI
4.3.5 Phương pháp vô cảm
Thời gian đầu, các ca TAVI đều được tiến hành với gây mê toàn thân qua đường nội khí quản. Gây mê toàn thân giúp bệnh nhân ổn định hơn, đặc biệt nếu cần đặt đầu dò siêu âm qua thực quản hỗ trợ thủ thuật.
Hiện nay, khi ngày càng nhiều trung tâm sử dụng gây tê tại chỗ hoặc gây ngủ khi tiến hành TAVI. Kinh nghiệm của thủ thuật viên tốt hơn, các dụng cụ thế hệ mới nhỏ gọn hơn cho phép tiến hành thủ thuật nhanh hơn và an toàn hơn, cùng với đó là sử dụng siêu âm tim qua thành ngực thay cho siêu âm tim qua thực quản, là những lý do khiến thủ thuật có thể tiến hành mà không cần gây mê toàn thân cho người bệnh.
Kết quả nghiên cứu tại nhiều trung tâm cho thấy, thời gian tiến hành thủ thuật và số ngày nằm viện ở nhóm gây tê tại chỗ thấp hơn nhóm gây mê toàn thân, trong khi tỉ lệ biến cố không thay đổi
Mở đường vào mạch máu
- Dựa vào phim MSCT để lựa chọn đường vào mạch máu phù hợp. Lý tưởng nhất là đường vào động mạch đùi. Mở đường vào động mạch đùi theo phương pháp Seldinger, đặt sheath cỡ Sau khi mở mạch máu, tiêm Heparin liều 100 IU/kg cân nặng, duy trì ACT 250- 350 giây.
- Ở động mạch đùi bên đối diện, đặt một sheath kích cỡ Qua đó, đưa một ống thông pigtail cỡ 5Fr lên lá không vành. Tiến hành chụp gốc Động Mạch Chủ ở các tư thế để đánh giá vị trí lỗ van Động Mạch Chủ và tình trạng hở van Động Mạch Chủ trước thủ thuật.
- Đặt điện cực tạo nhịp tạm thời vào buồng thất phải, qua đường tĩnh mạch đùi hoặc tĩnh mạch dưới đòn. Điện cực tạo nhịp được dùng để tạo nhịp thất nhanh khi nong bóng hoặc thả van sinh học, tạo tình trạng cung lượng tim thấp, giảm lưu lượng máu qua đường ra thất trái, giúp dụng cụ ít bị di lệch.
Lái ống thông qua van động mạch chủ
Từ đường động mạch đùi, đưa ống thông AL-1 cỡ 6Fr đến vị trí van Động Mạch Chủ. Qua ống thông AL, lái dây dẫn cỡ 0,035 inch qua van Động Mạch Chủ bị hẹp. Tùy vị trí giải phẫu của van Động Mạch Chủ mà sử dụng ống thông AL-2, JR4, hoặc MP thay thế.
Sau khi đã lái dây dẫn xuống buồng thất trái, tráo ống thông AL-1 bằng ống thông pigtail. Tiến hành khảo sát áp lực buồng thất trái và đo chênh áp qua van Động Mạch Chủ.
Đưa dây dẫn siêu cứng vào thất trái
Qua ống thông pigtail, đẩy một dây dẫn siêu cứng vào buồng thất trái. Bóng nong và van sinh học sẽ được đẩy vào vị trí trên dây dẫn này. Dây dẫn này cần đảm bảo một số đặc điểm: (1) đầu được uốn cong đảm bảo ít gây ảnh hưởng thất trái (thủng buồng tim, kích thích ngoại tâm thu), (2) thân dây dẫn đủ cứng để có thể chuyên chở các dụng cụ trong thủ thuật.
Có hai loại dây dẫn: (1) loại không được uốn cong từ trước (Lunderquist, MeierTM, hay Amplatz Super Stiff ), và (2) loại chuyên dụng được uốn cong sẵn (Amplatz Extra-Stiff APEX, Confida, Safari). Với dây dẫn loại 1, bác sĩ can thiệp cần chủ động tạo vòng cong trước khi đẩy dây dẫn vào trong cơ thể người bệnh. Có thể dùng kim chọc mạch kích thước 18 hay 21G để uốn.
Lựa chọn dây dẫn phù hợp tuỳ theo giải phẫu buồng thất trái và gốc Động Mạch Chủ, mức độ vôi hoá van Động Mạch Chủ, cũng như cấu hình của thiết bị sử dụng trong thủ thuật. Dây dẫn Safari có 3 kích cỡ khác nhau, dùng cho các trường hợp thất trái kích cỡ nhỏ, trung bình, hay giãn lớn. Những dây dẫn chuyên dụng (Confida của hãng Medtronic, Safari của hãng Boston Scientific) thường mềm mại hơn và là lựa chọn đầu tay. Các trường hợp hẹp van quá khít, van vôi hóa nặng, hoặc gốc Động Mạch Chủ nằm ngang, có thể cần dây dẫn cứng hơn như Amplatz Super Stiff hay Lunderquist.
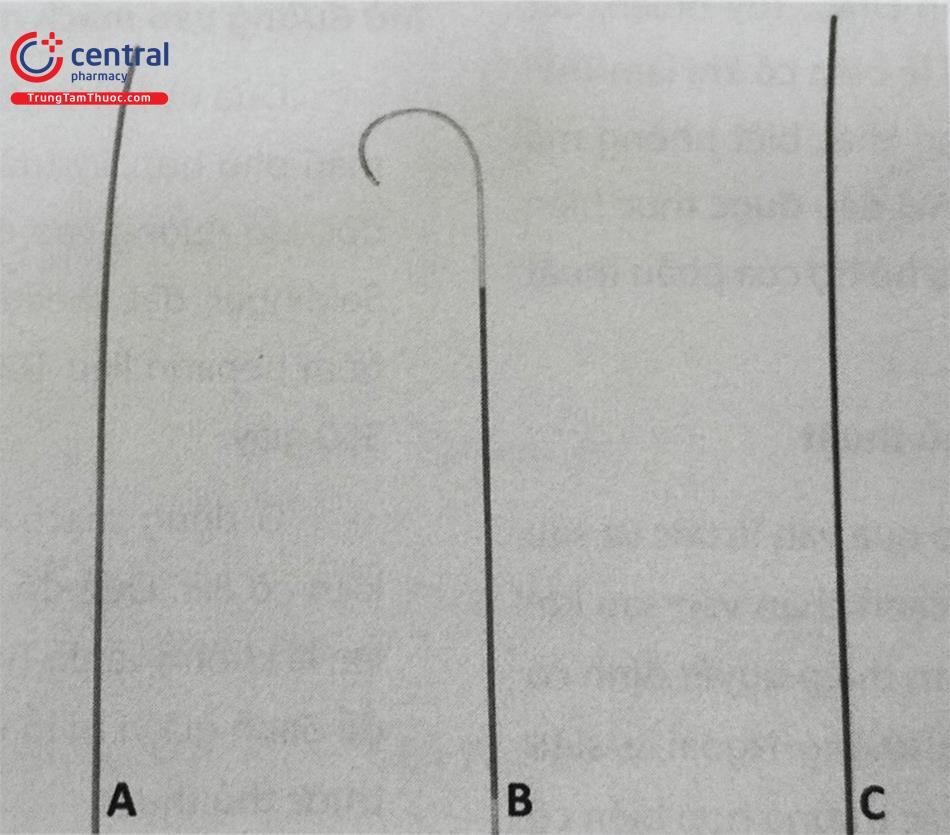
Chú thích A: Lunderquist® Extra-Stiff (Cook Medical) là dây dẫn cứng nhất, B: MeierTM (Boston Scientific), C: Amplatz Super Stiff (Boston Scientific).
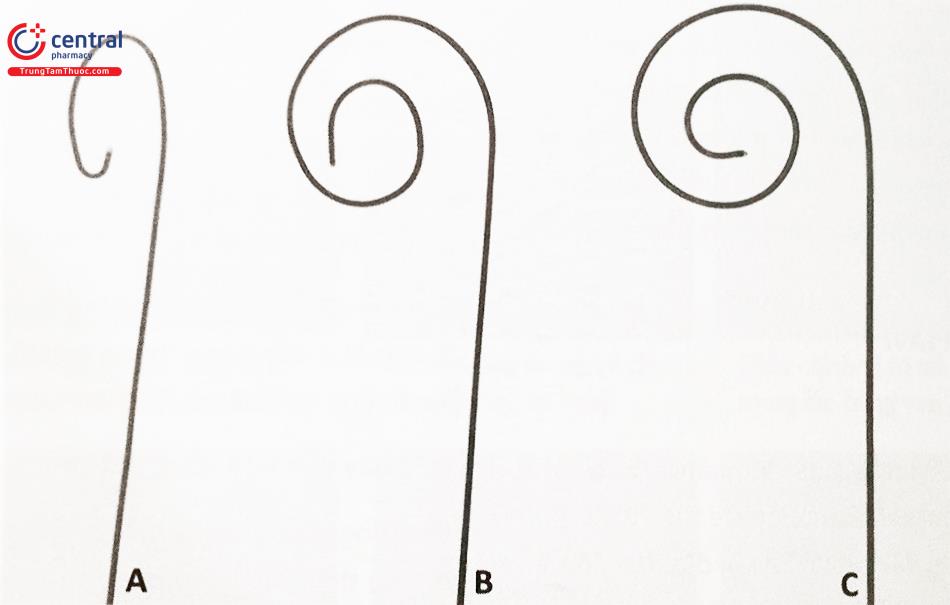
Chú thích: A: Amplatz Extra-Stiff APEX (Cook Medical), B: Confida Brecker (Medtronic). C: Safari (Boston Scientific).
Nong van động mạch chủ bằng bóng
Trước kia, nong van Động Mạch Chủ bằng bóng là bước bắt buộc trong mọi ca thay van Động Mạch Chủ qua đường ống thông, do những van sinh học thế hệ đầu có kích cỡ lớn (van Edward Sapien cỡ 22-24Fr, CoreValve cỡ 24Fr), nếu không nong van thì đẩy dụng cụ rất khó khăn. Tuy nhiên, các van sinh học thế hệ mới có kích cỡ nhỏ gọn hơn (hệ thống Sapien S3 và Evolut R chỉ có 16Fr), nên đi qua van tự nhiên dễ hơn. Ngoài ra, nong van Động Mạch Chủ bằng bóng có thể làm bong mảng xơ vữa ở van Động Mạch Chủ, tăng nguy cơ đột quỵ não. Các biến cố khác của nong van Động Mạch Chủ bao gồm gây hở van Động Mạch Chủ cấp, rối loạn dẫn truyền, vỡ vòng van Động Mạch Chủ. Cuối cùng, những bệnh nhân suy tim EF thấp có thể không dung nạp tình trạng tạo nhịp thất nhanh khi nong van Động Mạch Chủ, dẫn đến suy tim cấp không hồi phục trong quá trình làm thủ thuật.
Các nghiên cứu cho thấy thả van trực tiếp không cần nong van không ảnh hưởng hiệu quả lâm sàng và huyết động của thủ thuật TAVI. Hiện nay, chỉ định nong van Động Mạch Chủ trước TAVI nếu van Động Mạch Chủ hẹp quá khít hay vôi hoá quá nhiều, van Động Mạch Chủ hai lá van.
Tiến hành nong bóng khi tạo nhịp thất nhanh (thường là với tần số 160-200 chu kỳ/phút).
Thả van động mạch chủ sinh học
Đẩy van sinh học từ động mạch đùi, đi qua cung Động Mạch Chủ, xuống vị trí van Động Mạch Chủ. Vị trí đặt van lý tưởng là điểm thấp nhất của van sinh học nằm dưới mặt phẳng vòng van tự nhiên 3-5 mm. Van nằm quá sâu có thể chèn vào đường dẫn truyền gây block nhánh, block nhĩ thất. Van nằm quá cao có thể tăng tỉ lệ hở cạnh chân van, hoặc rơi van lên Động Mạch Chủ lên.
Sau khi thả van, đo lại chênh áp qua van Động Mạch Chủ và áp lực cuối tâm trương thất trái, cũng như chụp gốc Động Mạch Chủ để đánh giá tình trạng hở cạnh chân van. Nếu có hở cạnh chân van mức độ nhiều, hoặc van chưa nở ra hoàn toàn (thường trong trường hợp van Động Mạch Chủ tự nhiên vôi hóa nặng), nong lại bằng bóng để van nở tối ưu.
Đóng mạch máu
Chụp lại động mạch ngoại biên để khẳng định không có biến chứng liên quan đến đường vào mạch máu. Đóng mạch máu bằng dụng cụ chuyên dụng (Perclose ProGlide®, hãng Abbott, Hoa Kỳ).
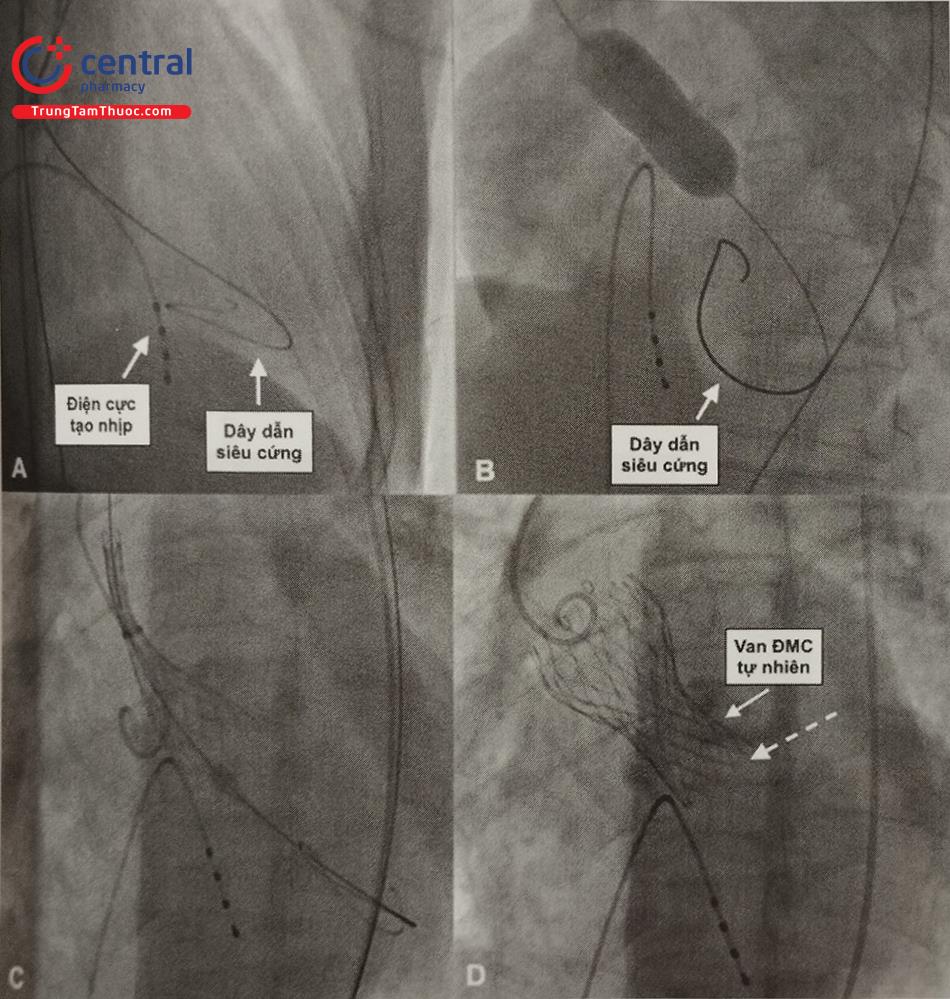
Hình A: Đưa dây dẫn siêu cứng vào mỏm thất trái, điện cực tạo nhịp tạm thời được đặt ở mỏm thất phải.
Hình B: Nong van Động Mạch Chủ bằng bóng.
Hình C: Thả van tự nở dưới hướng dẫn của màn tăng sáng. Hình D: Thả van thành công, van nở hoàn toàn. Điểm thấp nhất của van sinh học (mũi tên nét đứt) nằm dưới vòng van Động Mạch Chủ tự nhiên khoảng 6 mm. (Nguồn: Viện Tim mạch Việt Nam)

Chú thích: Trước thủ thuật: áp lực thất trái 118/16, áp lực Động Mạch Chủ 90/46, chênh áp trung bình qua van Động Mạch Chủ 30 mmHg. Sau thủ thuật: không còn chênh áp qua van Động Mạch Chủ trong thì tâm thu (nguồn: Viện Tim mạch Việt Nam)
5 Tiêu chí thành công của thủ thuật
Theo tiêu chuẩn VARC-2 (Valve Academic Research Consortium-2), thủ thuật TAVI được coi là thành công khi thoả mãn các tiêu chí:
Đặt van đúng vị trí, chênh áp trung bình qua van Động Mạch Chủ dưới 20
Không có biến cố nặng trong quá trình tiến hành thủ thuật: tử vong, đột quỵ não, nhồi máu cơ tim, hở van động mạch chủ cấp, vỡ vòng van Động Mạch Chủ, tách thành Động Mạch Chủ, phải chuyển phẫu thuật cấp cứu.
6 Theo dõi bệnh nhân sau thủ thuật và liệu pháp kháng huyết khối
6.1 Theo dõi bệnh nhân sau thủ thuật
Sau thủ thuật, bệnh nhân được chuyển về đơn vị hồi sức tim mạch
Nếu bệnh nhân phải đặt nội khí quản, tiến hành rút nội khí quản khi toàn trạng người bệnh ổn định.
Biến cố của thủ thuật được theo dõi trong lúc tiến hành thủ thuật và trong thời gian nằm viện, đánh giá theo bảng phân loại VARC-2, bao gồm:
- Tử vong
- Nhồi máu cơ
- Đột quỵ não.
- Chảy máu.
- Biến chứng mạch máu.
- Suy thận cấp.
- Rối loạn nhịp
- Rơi dụng cụ.
- Hở cạnh chân van.
Rút điện cực tạo nhịp tạm thời sau 72 giờ nếu không có biến chứng rối loạn nhịp. Trong các trường hợp nghi ngờ có rối loạn nhịp chậm, tiến hành ghi Holter điện tâm đồ 24 giờ trước khi chỉ định rút điện cực tạo nhịp tạm thời.
6.2 Liệu pháp kháng huyết khối sau TAVI
Việc sử dụng thuốc kháng đông cho bệnh nhân sau TAVI vẫn chưa có sự đồng thuận tuyệt đối. Trong nghiên cứu OCEAN-TAVI, chụp MSCT thường quy phát hiện tỉ lệ huyết khối van tim sau TAVI là 9,3%. Huyết khối van tim sau TAVI chỉ là vi huyết khối, không đánh giá được trên siêu âm tim. Tình trạng này không ảnh hưởng tới hoạt động của van nhưng tăng nguy cơ đột quỵ não thoáng qua.
Thử nghiệm POPular-TAVI (công bố năm 2020) đánh giá phác đồ điều trị kháng huyết khối sau TAVI. Ở nhánh A, gồm những bệnh nhân không có chỉ định dùng thuốc chống đông đường uống, liệu pháp kháng kết tập tiểu cầu
kép (aspirin và clopidogrel) không ưu điểm hơn Aspirin đơn trị liệu, mà lại làm tăng nguy cơ chảy máu. Ở nhánh B, nếu bệnh nhân có chỉ định dùng thuốc chống đông đường uống, dùng phối hợp Clopidogrel với thuốc chống đông đường uống (thuốc kháng vitamin K hoặc thuốc chống đông trực tiếp đường uống (DOAC)) làm tăng nguy cơ chảy máu, chủ yếu là chảy máu nhỏ ở điểm chọc mạch, đồng thời không làm giảm biến cố tắc mạch so với phác đồ chỉ dùng thuốc chống đông đường uống.
Một số kết quả từ những thử nghiệm lâm sàng khác cũng cho kết quả tương tự. Khuyến cáo hiện hành là dùng thuốc kháng kết tập tiểu cầu đơn kéo dài sau TAVI nếu bệnh nhân không có chỉ định dùng thuốc chống đông. Nếu bệnh nhân phải dùng thuốc chống đông, duy trì thuốc chống đông đường uống kéo dài mà không bổ sung thêm thuốc kháng tiểu cầu.
7 Các biến chứng của TAVI
Năm 2012, các Hiệp hội tim mạch lớn đã thống nhất đề ra bản đồng thuận VARC-2, định nghĩa và chuẩn hoá biến chứng liên quan đến thủ thuật thay van Động Mạch Chủ qua đường ống thông. Về tổng thể, so với phẫu thuật tim hở thay van Động Mạch Chủ sử dụng tuần hoàn ngoài cơ thể, TAVI có tỉ lệ biến chứng sớm và trong vòng 2 năm theo dõi tương đương hoặc thấp hơn, ngoại trừ tỉ lệ block nhĩ thất cần cấy máy tạo nhịp vĩnh viễn cao hơn.

7.1 Tử vong
Tỉ lệ tử vong liên quan đến TAVI (trong thủ thuật và trong vòng 30 ngày sau thủ thuật) khoảng 6-17%, tuỳ từng nghiên cứu. Các nguyên nhân hàng đầu gây tử vong trong thủ thuật là NMCT, ép tim cấp, suy tim cấp, vỡ Động Mạch Chủ hay vòng van Động Mạch Chủ. Các nguyên nhân chính gây tử vong trong quá trình hậu phẫu bao gồm: suy tim cấp, nhiễm khuẩn, suy đa tạng, biến cố mạch máu.
7.2 Nhồi máu cơ tim
Đa số bệnh nhân có tổn thương nhẹ cơ tim sau TAVI. 99% trường hợp có tăng troponin, 72% có tăng CK-MB. Tỉ lệ NMCT sau TAVI vào khoảng 1,1%. Các nguyên nhân dẫn đến thiếu máu cơ tim bao gồm: tụt áp kéo dài, tạo nhịp thất nhanh, van sinh học ép vào mô cơ tim, van sinh học bít tắc ĐMV, và chấn thương trực tiếp thành tâm thất. Tiền sử bệnh mạch vành trước đó không phải là yếu tố dự báo NMCT sau thủ thuật.
Bít tắc động mạch vành (ĐMV) là biến chứng nặng nhưng hiếm gặp (dưới 1%). Các yếu tố dưới đây làm tăng nguy cơ bít tắc ĐMV: xoang Valsalva hẹp, lá van Động Mạch Chủ vôi hóa nặng, lỗ ĐMV nằm sát mặt phẳng vòng van, TAVI ở bệnh nhân có van Động Mạch Chủ sinh học (van-trong-van).
7.3 Đột quỵ não
Tỉ lệ đột quỵ não cấp trong vòng 24 giờ sau TAVI là 1,5%, tỉ lệ đột quỵ não bán cấp (trong vòng 30 ngày sau TAVI) là 3-6,7%. Nguyên nhân đột quỵ não là do bong mảng xơ vữa ở gốc Động Mạch Chủ trong quá trình làm thủ thuật, hoặc rung nhĩ mới xuất hiện sau thủ thuật. Hiện nay, một số lưới lọc bảo vệ mạch não (Sentinel, TriGuard) đang được nghiên cứu và phát triển, đã giảm tỉ lệ đột quỵ não liên quan đến TAVI.
7.4 Vỡ gốc và vỡ vòng van động mạch chủ
Vỡ gốc Động Mạch Chủ hoặc vỡ vòng van có tỉ lệ thấp, hay gặp ở bệnh nhân vôi hoá nặng Động Mạch Chủ và đường ra thất trái hoặc lựa chọn kích cỡ van sinh học quá lớn. Đây là biến cố nặng, thường dẫn đến chảy máu ồ ạt quanh Động Mạch Chủ và tử vong. Cần mổ cấp cứu để xử trí.
7.5 Thủng buồng thất
Dây dẫn và ống thông có thể gây thủng buồng thất trái, trong khi điện cực tạo nhịp có thể gây thủng buồng thất phải. Nếu thấy huyết áp tụt trong hoặc sau thủ thuật, cần làm siêu âm tim ngay lập tức. Dẫn lưu dịch màng tim nếu cần thiết. Thủng buồng thất phải thông thường chỉ cần
dẫn lưu dịch màng tim, ngừng thuốc chống đông, theo dõi sát tình trạng huyết động và công thức máu. Nếu bệnh nhân ổn định, có thể rút dẫn lưu dịch màng tim sau 48-72 giờ. Thủng buồng thất trái thường cần phẫu thuật cấp cứu.
7.6 Biến cố đường vào mạch máu
Bao gồm tách thành mạch máu, vỡ mạch, chảy máu không cầm sau thủ thuật, hẹp, tắc lòng mạch, huyết khối đoạn xa. Cần nghĩ đến biến cố chảy máu vết chọc mạch ở mọi bệnh nhân có tụt huyết áp cấp sau thủ thuật. Hẹp, tắc mạch có thể được xử trí bằng nong bóng tái thông dòng chảy. Trường hợp thủng mạch máu gây chảy máu nặng, có thể cần xử trí ngoại khoa.
7.7 Rối loạn nhịp và nghẽn dẫn truyền
Rối loạn nhịp tim (tạm thời hoặc bền bỉ) là biến cố thường gặp sau TAVI. Rối loạn nhịp nhanh bao gồm rung nhĩ và rối loạn nhịp thất. Nếu có rung nhĩ mới xuất hiện, tiến hành chuyển nhịp (sốc điện hoặc dùng thuốc), khởi đầu thuốc chống đông đường uống, và kiểm soát tần số thất.
Các van sinh học tự nở, do kích cỡ lớn hơn van nở bằng bóng, có thể gây ra block nhánh trái và block nhĩ thất hoàn toàn. Cơ chế là do dụng cụ chèn ép trực tiếp vào đường dẫn truyền nhĩ thất, hoặc do tổn thương viêm, phù nề trong quá trình nong bóng và thả dụng cụ. Rối loạn dẫn truyền gây mất đồng bộ cơ tim, giảm khả năng phục hồi của thất trái, tăng tỉ lệ tái nhập viện vì suy tim.
Thông thường block nhĩ thất độ cao thường xuất hiện ngay trong quá trình làm thủ thuật và trong vòng 24 giờ đầu tiên sau thủ thuật. Trong những trường hợp này, cần tiến hành cấy máy tạo nhịp vĩnh viễn sớm cho bệnh nhân.
7.8 Hở cạnh chân van
Hở van Động Mạch Chủ sau thủ thuật TAVI là hở bên ngoài van (cạnh chân van) chứ không phải hở trong van. Tỉ lệ hở cạnh chân van hay gặp hơn ở TAVI so với phẫu thuật. Cơ chế hở cạnh chân van bao gồm: van quá nhỏ so với van tự nhiên, van đặt quá cao hoặc quá thấp, van Động Mạch Chủ tự nhiên vôi hoá quá nhiều, van Động Mạch Chủ tự nhiên có dạng elip.
Hở van Động Mạch Chủ mức độ vừa-nhiều đã được chứng minh làm tăng tỉ lệ tử vong. Tùy từng trường hợp, có thể xử trí hở cạnh chân van bằng cách nong bóng áp lực cao để van nở tối ưu, hoặc đặt thêm van số hai.
7.9 Rơi dụng cụ

8 Những tiến bộ mới về TAVI
Rơi dụng cụ do thả van quá cao hoặc quá thấp, nhất là khi van tự nhiên vôi hoá rất nhiều. Với các van thế hệ mới, tỉ lệ biến cố này ngày càng giảm đi.
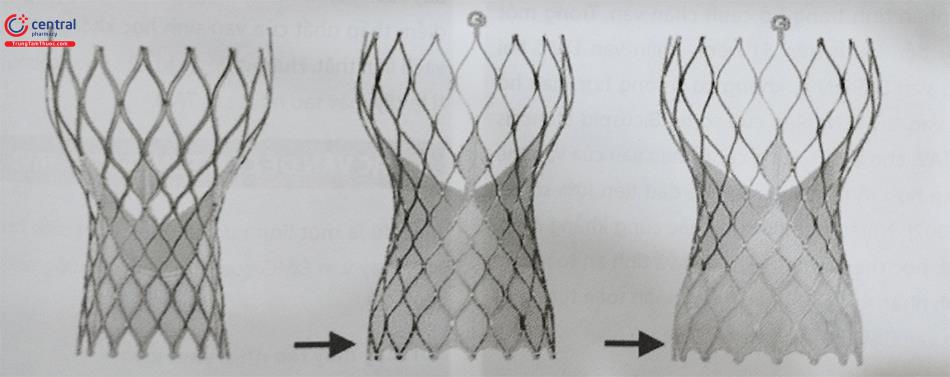
8.1 Thiết kế các loại van thế hệ mới
Các van thế hệ mới nhất có kích cỡ nhỏ gọn (14-18 Fr), giúp việc thao tác dễ dàng hơn, ít gây biến chứng mạch máu. Một số van có thể thu lại được nếu vị trí đặt van lần đầu chưa phù hợp, nhờ vậy giảm nguy cơ biến chứng liên quan đến TAVI. Thiết kế của van thế hệ mới cũng được bổ sung phần màng bên ngoài để giảm tỉ lệ hở cạnh chân van.
8.2 TAVI ở bệnh nhân thoái hoá van Động Mạch Chủ sinh học
Tỉ lệ thoái hoá van Động Mạch Chủ sinh học sau phẫu thuật có thể lên tới 18% trong thời gian 10 năm, làm tăng chênh áp qua van, có thể cần phải tái phẫu thuật. Tiến hành TAVI ở các bệnh nhân có van nhân tạo sinh học (thủ thuật van-trong- van) là một giải pháp hiệu quả, tránh cho bệnh nhân phải mổ lại. Tuy vậy, thủ thuật này có nguy cơ bít tắc ĐMV cao hơn TAVI ở bệnh nhân van tim tự nhiên, do đó cần khảo sát kỹ bằng MSCT trước thủ thuật để đưa ra chỉ định phù hợp.
Một số trường hợp loại van dùng trong phẫu thuật có kích cỡ quá nhỏ, vì thế khi đặt van TAVI có thể gây hẹp đáng kể diện tích lỗ van Động Mạch Chủ, dẫn đến chênh áp qua van không cải thiện nhiều. Khi đó, có thể dùng bóng nong vỡ van sinh học trước khi thả van TAVI.
Kết quả các nghiên cứu PARTNER 2 Valve-in-valve và CoreValve US cho thấy trong tương lai TAVI sẽ trở thành lựa chọn ưu tiên cho các trường hợp thoái hoá van Động Mạch Chủ sinh học sau mổ.
8.3 TAVI ở bệnh nhân van Động Mạch Chủ hai lá van
Nhiều đặc điểm giải phẫu của van Động Mạch Chủ hai lá có thể gây trở ngại cho thủ thuật TAVI: van không cân đối mà có dạng elip, kích thước hai lá van chênh lệch, vôi hoá nặng hơn, các nốt vôi phân bố không đồng đều. Điều này đã tăng tỉ lệ biến cố như hở cạnh chân van, vỡ vòng van,… Ngoài ra van Động Mạch Chủ hai lá thường gặp bệnh lý Động Mạch Chủ kèm theo, làm tăng nguy cơ tách thành hoặc vỡ Động Mạch Chủ. Do vậy, các thử nghiệm lâm sàng đầu tiên về TAVI loại bỏ bệnh nhân van Động Mạch Chủ hai lá ra khỏi đối tượng nghiên cứu.
Myloette và cộng sự chứng minh có thể tiến hành TAVI một cách an toàn ở bệnh nhân van Động Mạch Chủ hai lá, sử dụng các van sinh học thế hệ đầu tiên (van SAPIEN hoặc CoreValve). Kết quả nghiên cứu ghi nhận hở cạnh chân van ≥2+ là 28,4%, tỉ lệ tử vong sau 1 năm là 17,5%.
Các loại van sinh học thế hệ sau (SAPIEN 3, LOTUS) đã khắc phục một phần tình trạng hở cạnh chân van. Trong một nghiên cứu tiến hành trên 51 bệnh nhân van Động Mạch Chủ hai lá, sử dụng van SAPIEN 3, không có trường hợp nào hở cạnh chân van ≥ 2+. Nghiên cứu sổ bộ Bicuspid Stenosis Following TAVI cho thấy tỉ lệ hở cạnh chân van của van thế hệ mới thấp hơn rõ rệt so với thế hệ đầu tiên (0% so với 8,5%, p=0,002). Nhiều nghiên cứu khác cũng khẳng định, với van sinh học thế hệ mới, hiệu quả và tính an toàn của TAVI ở bệnh nhân van Động Mạch Chủ hai lá van hoàn toàn tương tự bệnh nhân van Động Mạch Chủ ba lá.
Các van thế hệ mới thường có lớp màng phía ngoài (external skirt), giúp van nhân tạo gắn vào vị trí van Động Mạch Chủ tự nhiên tốt hơn. Một ưu điểm khác là những van thế hệ mới có thể thu lại được nếu lần thả đầu tiên chưa đúng vị trí tối ưu.
8.4 TAVI ở bệnh nhân hở van Động Mạch Chủ đơn thuần
Hiện nay, vẫn chưa có chỉ định thay van Động Mạch Chủ qua đường ống thông cho bệnh nhân hở van Động Mạch Chủ đơn thuần. Ở các bệnh nhân này, vòng van và lá van không vôi hoá khiến van sinh học dễ bị rơi, hoặc đặt không đúng vị trí. Gần đây van JenaValve (hãng JenaValve Technology, Đức) đã được chứng minh có thể sử dụng an toàn van hiệu quả cho bệnh nhân hở van Động Mạch Chủ đơn thuần. Đây là cơ sở để mở rộng chỉ định TAVI cho các bệnh nhân hở van Động Mạch Chủ.
8.5 Tiến bộ trong quy trình tiến hành thủ thuật
Một số tiến bộ trong quy trình tiến hành thủ thuật, như phương pháp vô cảm (gây tê tại chỗ hoặc gây ngủ thay cho gây mê toàn thân nội khí quản), sử dụng siêu âm qua thành ngực thay cho siêu âm qua thực quản, mở mạch máu theo phương pháp Seldinger thay cho phẫu thuật bộc lộ mạch máu… đã giúp tiết kiệm thời gian, giảm chi phí và biến cố của thủ thuật, giảm thời gian nằm viện. Trong quá trình làm TAVI cần phải tạo nhịp thất nhanh, những trung tâm nhiều kinh nghiệm đã tiến hành tạo nhịp qua dây dẫn, thay vì qua đặt điện cực tạo nhịp vào buồng thất phải, nhờ đó giảm biến cố thủng buồng thất do điện cực tạo nhịp.
Trước đây, quan điểm chung là đặt van ở vị trí thấp hơn mặt phẳng vòng van khoảng 4-8 mm, để tránh trôi dụng cụ. Kỹ thuật MIDAS (MInimizing Depth According to the membranous Septum) xác định vị trí đặt van dựa theo bề dày vách liên thất: khoảng cách từ mặt phẳng vòng van tới điểm thấp nhất của van sinh học không vượt quá bề dày vách liên thất. Hướng tiếp cận này được chứng minh giảm tỉ lệ cấy máy tạo nhịp sau TAVI.
9 Các vấn đề còn tồn tại ở TAVI
Mặc dù là một lĩnh vực có bước phát triển hết sức mạnh mẽ, thay van Động Mạch Chủ qua đường ống thông vẫn còn một số hạn chế.
9.1 Cấy máy tạo nhịp vĩnh viễn
Tỉ lệ cấy máy tạo nhịp vĩnh viễn, đặc biệt với các van sinh học tự nở, có thể lên tới 20%. Ngay cả với nhiều tiến bộ mới về công nghệ và kỹ thuật, tỉ lệ block nhĩ thất hoàn toàn của TAVI vẫn cao hơn đáng kể so với phẫu thuật thay van Động Mạch Chủ.
9.2 Hở cạnh chân van
Đặt van cao sẽ giảm nguy cơ ảnh hưởng đường dẫn truyền, nhưng dễ gây hở cạnh chân van. Các van sinh học thế hệ mới, với nhiều cải tiến về thiết kế, đã phần nào giải quyết được vấn đề này. Tuy nhiên tỉ lệ hở cạnh chân van sau thủ thuật còn cao, và là một yếu tố tiên lượng tồi khi theo dõi dài hạn.
9.3 Tuổi thọ của van sinh học nhân tạo dùng trong TAVI
Hiện nay, TAVI ngày càng được chỉ định cho các bệnh nhân trẻ tuổi hơn, vì vậy tuổi thọ của van sinh học là một vấn đề nhiều người quan tâm. Do đây là kỹ thuật mới, thời gian theo dõi chưa đủ dài, nên chưa có câu trả lời chính xác về tuổi thọ van. Một số kết quả theo dõi 10 năm cho thấy van hoạt động tốt, chênh áp qua van sinh học gần như không tăng lên, tỉ lệ phải tái can thiệp (phẫu thuật, làm TAVI lần hai) rất thấp.
So sánh với van sinh học sử dụng trong phẫu thuật, tỉ lệ thoái hoá van TAVI thấp hơn đáng kể. Tỉ lệ thoái hoá van TAVI sau 8 năm dao động từ 0,6-3,6%, tuỳ từng nghiên cứu. Trong thử nghiệm NOTION, kết quả theo dõi 6 năm cho thấy tỉ lệ bệnh nhân có chênh áp qua van ≥ 20 mmHg ở nhó TAVI là 5%, nhóm phẫu thuật thay van Động Mạch Chủ sinh học là 22%. Tuy nhiên cần theo dõi trong thời gian dài hơn để có thể kết luận đầy đủ về tuổi thọ của van TAVI.
9.4 Chụp và can thiệp ĐMV sau TAVI
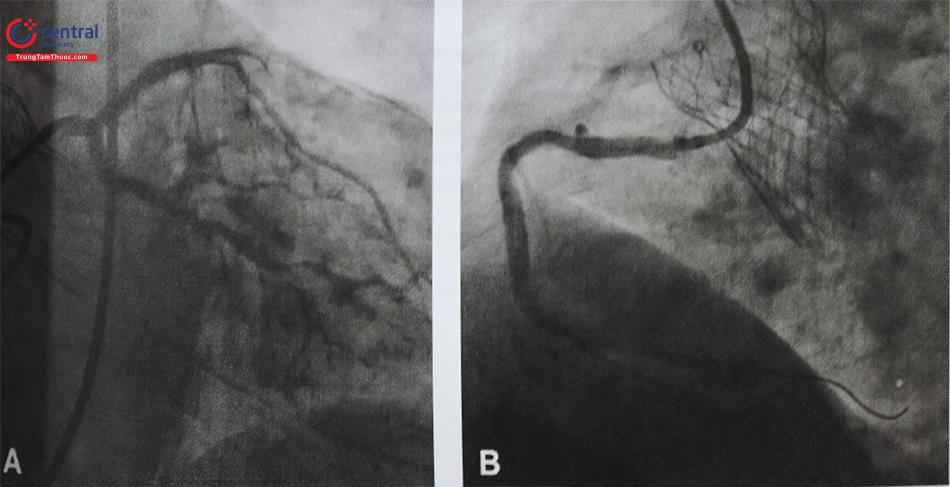
Hẹp van Động Mạch Chủ do thoái hoá có cùng các yếu tố nguy cơ với bệnh mạch vành, và khoảng 50% bệnh nhân hẹp chủ có hẹp động mạch vành (ĐMV) kèm theo. Giờ đây, khi TAVI được chỉ định cho các bệnh nhân trẻ tuổi hơn, ngày càng nhiều bệnh nhân sau đặt TAVI cần chụp và can thiệp ĐMV. Mặc dù thủ thuật có thể khó khăn do van Động Mạch Chủ sinh học che khuất một phần đường tiếp cận ĐMV (đặc biệt với van sinh học tự nở), nhiều nghiên cứu cho thấy việc chụp ĐMV vẫn khả thi.
Với những bệnh nhân có chỉ định khảo sát ĐMV sau TAVI, tốt nhất là chụp MSCT trước thủ thuật để đánh giá lỗ vào mạch vành và đề ra chiến lược phù hợp. Với van Evolut, do thiết kế vòng eo nhỏ, có thể cần dùng ống thông chụp ĐMV kích cỡ nhỏ hơn (ví dụ JL 3,5 hay JL 3,0 thay cho JL 4,0). Đôi khi, cần lái một guidewire mạch vành vào trong lòng mạch vành, và qua đó đẩy ống thông vào trong lòng mạch. Cần đặc biệt lưu ý các thao tác khi rút ống thông ra khỏi mạch vành, do ống thông có thể bị gập khi đi qua khung thép của van sinh học.
Chụp và can thiệp ĐMV ở các bệnh nhân TAVI được dùng van Sapiens (nở bằng bóng) có thể tiến hành tương tự các trường hợp thông thường.
9.5 Giá thành của thủ thuật
Cuối cùng, TAVI là một thủ thuật có chi phí không nhỏ. Ở Mỹ, chi phí y tế trung bình cho một ca TAVI vào khoảng 45 ngàn USD. Tại Đức, chi phí một ca TAVI khoảng 40 ngàn Euro. Con số này tại các quốc gia châu Á dao động từ 30-50 ngàn USD. Mặc dù thử nghiệm PARTNER 2 cho thấy TAVI lợi ích hơn phẫu thuật về mặt chi phí – hiệu quả nhờ giảm thời gian nằm viện, cải thiện tỉ lệ tử vong và chất lượng cuộc sống người bệnh, điều này không phải lúc nào cũng đúng ở các quốc gia khác, do giá thành cuộc mổ tim ở các quốc gia là không giống nhau. Ngay cả với một nước có thu nhập cao như Singapore, ước tính để TAVI thực sự được phổ biến rộng rãi, chi phí của dụng cụ không thể vượt quá 15 ngàn USD. Giá thành thủ thuật cao vẫn là rào cản lớn nhất đối với sự ứng dụng của TAVI trong thực hành lâm sàng, nhất là tại các nước đang phát triển như Việt Nam.
10 Kết luận
Thay van Động Mạch Chủ qua đường ống thông đã được chứng minh cải thiện rõ rệt hiệu quả lâm sàng và tiên lượng của bệnh nhân hẹp khít van Động Mạch Chủ, với tỉ lệ biến cố không cao hơn phẫu thuật. Đây là một thủ thuật phức tạp, đòi hỏi thiết bị hiện đại, bác sĩ tim mạch được đào tạo chuyên môn cao, cũng như sự phối hợp đồng bộ của cả “đội tim mạch”, đảm bảo từng khâu trong hệ thống đều được tiến hành thuận lợi, giảm thiểu nguy cơ cho người bệnh.
Trước đây, TAVI chỉ được chỉ định cho các bệnh nhân nguy cơ phẫu thuật rất cao, khi người bệnh không còn lựa chọn điều trị nào khác. Tuy nhiên, sau gần 20 năm ra đời và phát triển, những tiến bộ mới về thiết bị và công nghệ, kĩ thuật can thiệp, quy trình chuẩn bị và theo dõi bệnh nhân, đã giúp TAVI trở thành một thủ thuật đơn giản hơn, an toàn hơn, có tính ứng dụng cao hơn trong thực hành lâm sàng.
Các bằng chứng lâm sàng về hiệu quả và tính an toàn của TAVI là cơ sở để các Hiệp hội Tim mạch hàng đưa ra những khuyến cáo hiện tại thống nhất chính thức chỉ định rộng rãi TAVI cho bệnh nhân hẹp van Động Mạch Chủ khít, qua đó đã thay đổi bộ mặt điều trị của bệnh lý này.
11 Tài liệu tham khảo
- Holmes, R., Jr., et al., 2012 ACCF/AATS/SCAI/STS expert consensus document on transcatheter aortic valve replacement. J Am Coll Cardiol, 2012. 59(13): p. 1200-54.
- Iung, , et al., Decision-making in elderly patients with severe aortic stenosis: why are so many denied surgery? Eur Heart J, 2005. 26(24): p. 2714-20.
- Wenaweser, , et al., Clinical outcomes of patients with estimated low or intermediate surgical risk undergoing transcatheter aortic valve implantation. Eur Heart J, 2013. 34(25): p. 1894-905.
- Cribier, A., et al., Percutaneous transluminal balloon valvuloplasty of adult aortic stenosis: report of 92 cases. J Am Coll Cardiol, 1987. 9(2): p. 381-6.
- Ben-Dor, , et al., Complications and outcome of balloon aortic valvuloplasty in high-risk or inoperable patients. JACC Cardiovasc Interv, 2010. 3(11): p. 1150-6.
- Svensson, G., et al., A comprehensive review of the PARTNER trial. J Thorac Cardiovasc Surg, 2013. 145(3 Suppl): p. S11-6.
- Otto, C.M., et al., Prospective study of asymptomatic valvular aortic stenosis. Clinical, echocardiographic, and exercise predictors of outcome. Circulation, 1997. 95(9): p. 2262-70.
- Rosenhek, , et al., Natural history of very severe aortic stenosis. Circulation, 2010. 121(1): p. 151-6.
- Otto, C.M. and R.A. Nishimura, New ACC/AHA valve guidelines: aligning definitions of aortic stenosis severity with treatment recommendations. Heart, 2014. 100(12): p. 902-4.
- Currie, J., et al., Continuous-wave Doppler echocardiographic assessment of severity of calcific aortic stenosis: a simultaneous Doppler-catheter correlative study in 100 adult patients. Circulation, 1985. 71(6): p. 1162-9.
- Barbanti, , et al., Transcatheter aortic valve implantation in 2017: state of the art. EuroIntervention, 2017. 13(AA): p. AA11-AA21.
- Zajarias, and A.G. Cribier, Outcomes and safety of percutaneous aortic valve replacement. J Am Coll Cardiol, 2009. 53(20): p. 1829-36.
- Krasopoulos, G., et al., European real world trans-catheter aortic valve implantation: systematic review and meta-analysis of European national registries. J Cardiothorac Surg, 2016. 11(1): p.
- Leon, M.B., et al., Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med, 2010. 363(17): p. 1597-607.
- Carabello, B.A., Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. Curr Cardiol Rep, 2011. 13(3): p. 173-4.
- Smith, C.R., et al., Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med, 2011. 364(23): p. 2187-98.
- Barker, M. and M.J. Reardon, The CoreValve US pivotal trial. Semin Thorac Cardiovasc Surg, 2014. 26(3): p. 179-86.
- Leon, M.B., et al., Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med, 2016. 374(17): p. 1609-20.
- Reardon, M.J., et al., Surgical or Transcatheter Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med, 2017. 376(14): p. 1321-1331.
- Siemieniuk, R.A., et al., Transcatheter versus surgical aortic valve replacement in patients with severe aortic stenosis at low and intermediate risk: systematic review and meta-analysis. BMJ, 354: p. i5130.
- Nishimura, A., et al., 2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol, 2017. 70(2): p. 252-289.
- Yoon, H., et al., Outcomes in Transcatheter Aortic Valve Replacement for Bicuspid Versus Tricuspid Aortic Valve Stenosis. J Am Coll Cardiol, 2017. 69(21): p. 2579-2589.
- Yoon, H., et al., Transcatheter Aortic Valve Replacement With Early- and New-Generation Devices in Bicuspid Aortic Valve Stenosis. J Am Coll Cardiol, 2016. 68(11): p. 1195-1205.

