10 Thảm họa liên quan đến thuốc đen tối nhất của ngành dược thế giới

Thảm họa liên quan đến thuốc kéo theo hậu quả rất nghiêm trọng. Trong đó thảm họa siro ho cho trẻ em được phát hiện chứa các chất gây độc thận khiến 300 người tử vong tại ít nhất 7 quốc gia. Trong bài viết này, Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) xin gửi đến bạn đọc những thông tin chi tiết về 10 thảm họalớn liên quan đến thuốc.
1 Thảm họa cồn thuốc Sulfanilamide
Sulfanilamide là một loại kháng sinh nhóm Sulfonamide, hoạt động bằng cách ức chế cạnh tranh các phản ứng enzym liên quan đến axit para-aminobenzoic (PABA). PABA là chất cần thiết trong các phản ứng tạo ra axit folic, chất này hoạt động như một coenzym trong quá trình tổng hợp purine, pyrimidine và các axit amin khác.
Sulfanilamide được sản xuất bởi Công ty Massengill và ban đầu được sử dụng để sơ cứu, giảm nguy cơ nhiễm trùng và điều trị nhiễm nấm âm đạo.
Sulfanilamide được bào chế ở dạng elixir, chứa tá dược diethylene glycol (DEG) và có hương vị quả Mâm Xôi. Công ty bắt đầu bán và phân phối thuốc này vào tháng 9 năm 1937. Đến ngày 11 tháng 10, Hiệp hội Y khoa Hoa Kỳ nhận được báo cáo về một số ca tử vong do Elixir Sulfanilamide gây ra. Kết quả kiểm tra cho thấy, việc pha chế không đúng cách đã gây ra ngộ độc hàng loạt ở Hoa Kỳ. Trong đó, DEG là nguyên nhân chính của các tác dụng phụ gây tử vong vì nó gây độc cho người và các động vật có vú khác. Kết quả là làm hơn 100 trẻ em tử vong vì suy thận.
Sau đó, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã tiến hành thu hồi các sản phẩm thuốc Sulfanilamide đã được phân phối. Nhà hóa học Watkins, người tạo ra loại thuốc elixir trên đã tự tử trước khi ra tòa. Đến năm 1938 đạo luật về thực phẩm, thuốc và mỹ phẩm ra đời yêu cầu thuốc phân phối ra thị trường phải được thử tính an toàn.[1]
2 Biến cố siro ho độc hại
Kể từ những năm cuối của thế kỷ 20, một số vụ ngộ độc siro ho độc hại đã xảy ra ở các nước đang phát triển. Trong những trường hợp đó, một thành phần trong siro ho, là glycerine (Glycerol), được thay thế bằng diethylene glycol. Diethylene glycol (DEG) được cho là có thể gây độc cho thận và gây ra hội chứng rối loạn chức năng đa cơ quan (MODS), đặc biệt là ở trẻ nhỏ.
Các trường hợp ngộ độc do siro ho có thành phần DEG thay vì Gycerin xảy ra ở nhiều nơi, bao gồm Panama, Trung Quốc, Haiti, Bangladesh, Argentina, Nigeria, Ấn Độ, Indonesia, Uzbekistan và Gambia từ năm 1992 đến 2022. Điển hình tại Bangladesh, Panama và Indonesia. Từ tháng 10/2022, các quốc gia đã báo cáo về một số sự cố về thuốc ho không kê đơn dành cho trẻ em, liên quan đến hơn 300 trường hợp tử vong, trong đó hầu hết là trẻ nhỏ dưới 5 tuổi.
2.1 Tại Bangladesh
Một bác sĩ nhi khoa người Mỹ, Michael L. Bennish, đã nhận thấy một số trường hợp tử vong dường như trùng hợp với đợt phân phối siro ho do chính phủ cấp. Tuy nhiên, Chính phủ Bangladesh thời điểm đó đã từ chối nỗ lực điều tra thuốc của bác sĩ. Sau đó, vị bác sĩ này đã mang những chai siro về Mỹ để kiểm nghiệm. Kết quả cho thấy có thành phần DEG độc hại trong những chai siro này. Trong bài báo năm 1995 trên Tạp chí Y học Anh, bác sĩ Bennish cho biết, với lượng thuốc được kê đơn, số người chết có thể đã lên tới hàng chục nghìn.
2.2 Tại Indonesia
Vào năm 2022, cái chết của gần 100 trẻ em ở Indonesia được cho là có liên quan đến siro ho và thuốc nước. Tại đây, một số loại siro ho có chứa diethylene glycol và ethylene glycol, có liên quan đến chấn thương thận cấp tính (AKI). Vào tháng 10, các nhân viên y tế đã báo cáo khoảng 200 trường hợp AKI ở trẻ em, hầu hết là trẻ dưới 5 tuổi. Vì vậy, Indonesia tạm thời cấm bán và kê đơn tất cả các loại thuốc siro ho và thuốc nước.
2.3 Tại Panama
Vào tháng 5 năm 2007, 365 trường hợp tử vong đã được báo cáo ở Panama và được cho là có liên quan đến siro ho. Tại đây, nguồn DEG được nhập khẩu từ một nhà sản xuất Trung Quốc. Tuy nhiên, Cục Quản lý Thực phẩm và Dược phẩm Trung Quốc không coi vụ bê bối siro ho độc hại này là lỗi của họ. Các nhà chức trách cho biết, nhà sản xuất Trung Quốc đã xuất khẩu DEG dưới tên TD glycerine và sau đó, những người trung gian (người Tây Ban Nha) đã đổi tên thành glycerine khi họ điền vào tờ khai hải quan ở Panama.

Dựa trên các báo cáo của các quốc gia, WHO đã đưa ra 3 cảnh báo y tế toàn cầu để giải quyết các sự cố này. Cảnh báo Sản phẩm Y tế số 6/2022 vào ngày 5 tháng 10 năm 2022 tập trung vào đợt bùng phát ở Gambia, Cảnh báo Sản phẩm Y tế Số 7/2022 vào ngày 6 tháng 11 năm 2022 tập trung vào Indonesia và Cảnh báo Sản phẩm Y tế Số 1/2023 vào ngày 11 tháng 1 năm 2023 tập trung vào Uzbekistan. [2]
3 Thảm họa Diethylstilbesterol (DES)
Diethylstilbesterol thuộc danh mục estrogen tổng hợp. Chế phẩm DES (dạng viên 5mg) đã được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ phê duyệt vào ngày 19 tháng 9 năm 1941 cho bốn chỉ định: viêm âm đạo do lậu, viêm teo âm đạo, các triệu chứng mãn kinh và ức chế tiết sữa sau sinh để ngăn ngừa căng tức sữa.
Các nhà khoa học cho biết, DES là một loại estrogen tổng hợp độc hại và có khả năng gây ung thư. Tuy nhiên, vào thời điểm đó, thuốc này đã được kê đơn cho hàng triệu phụ nữ đang mang thai ở Hoa Kỳ trong nhiều thập kỷ (từ năm 1938 đến năm 1971), một số ít trường hợp vẫn tiếp tục sử dụng thuốc này trong vài năm sau đó. Ngoài ra, một số khu vực của Châu Mỹ Latinh, Châu Âu, Úc,... đã sử dụng DES cho đến giữa những năm 1980. Có thể nói, thảm họa này đã kéo dài hơn 30 năm.

Trong thời gian đó, DES đã mang tới nguy cơ ung thư vú, ung thư âm đạo và cổ tử cung, ung thư tinh hoàn ở thai nhi. Thuốc này thậm chí có thể gây ung thư cho thế hệ con cái khi mẹ dùng trong thời kỳ mang thai.
Các tác hại của DES thực sự được chú ý khi được chứng minh là nguyên nhân gây ra một khối u âm đạo hiếm gặp ở các bé gái và thiếu nữ. Năm 1971, Tạp chí Y học New England đã công bố một báo cáo cho thấy 7 trong số 8 phụ nữ trẻ (tuổi từ 14 đến 22), được chẩn đoán mắc ung thư biểu mô tuyến tế bào trong âm đạo, đã tiếp xúc với DES trước khi sinh. Các nghiên cứu sau đó đã cho thấy nguy cơ ung thư biểu mô tế bào trong âm đạo hoặc cổ tử cung tăng khoảng 40 lần ở những phụ nữ tiếp xúc với DES. Dựa vào các bằng chứng này, DES được coi là chất gây ung thư ở người và bị cấm sử dụng.
>>> Xem thêm: Ung Thư- Các Thông Tin Cần Thiết Cho Bệnh Nhân Mắc Bệnh Ung Thư Căn Bệnh Làm Nhiều Người Sợ Hãi
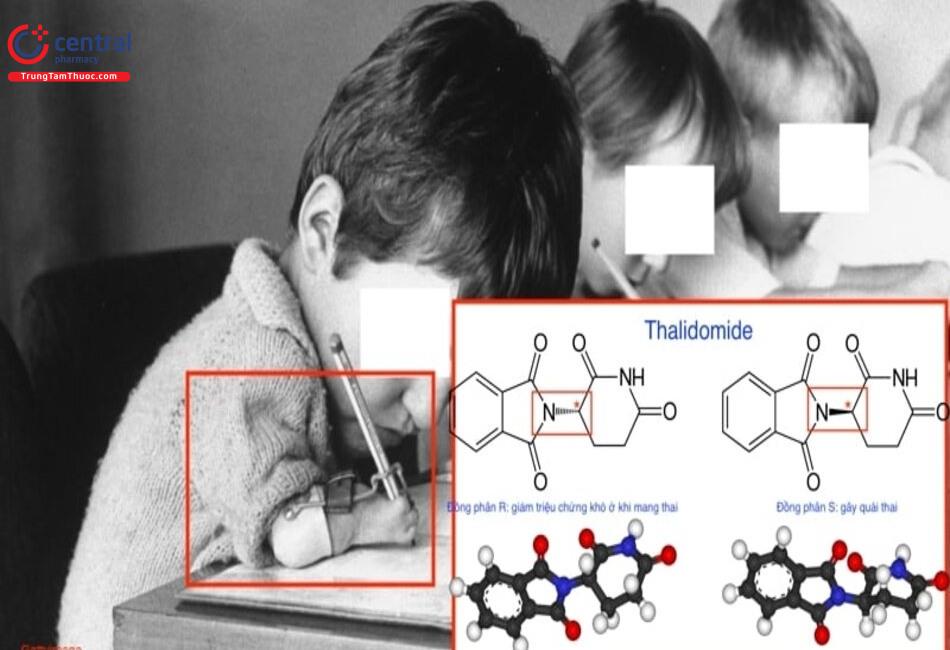
4 Thảm họa Thalidomide
Thalidomide thuộc danh mục thuốc điều hòa miễn dịch, với tác dụng chống tạo mạch và stress oxy hóa, ức chế sản xuất các chất trung gian hóa học. Ban đầu, Thalidomide được kê đơn như một loại thuốc an thần hoặc làm giảm các triệu chứng lo lắng, mất ngủ, đau dạ dày và căng thẳng. Sau đó, nó được sử dụng để chống buồn nôn và giảm ốm nghén ở phụ nữ mang thai.
Thalidomide được sản xuất bởi Công ty Chemie Grunenthal, trở thành thuốc không kê đơn ở Đức vào ngày 01 tháng 10 năm 1957. Ngay sau khi thuốc được bán, khoảng 5.000 đến 7.000 trẻ sơ sinh được sinh ra với tật dị dạng chân tay - hội chứng chim cánh cụt (phocomelia). Trong số đó, chỉ 40% những đứa trẻ này sống sót. Trên khắp thế giới, có khoảng 10.000 trường hợp trẻ sơ sinh ở 46 nước bị phocomelia do Thalidomide đã được báo cáo và chỉ 50% trong số đó sống sót.
Ngoài ra, một số trẻ còn có các triệu chứng khác bao gồm mắt và tim bị biến dạng, đường tiêu hóa và tiết niệu bị biến dạng, mù và điếc. Tuy nhiên, bất chấp các tác dụng phụ nghiêm trọng với sức khỏe, Thalidomide vẫn được bán và sử dụng tại các hiệu thuốc ở Canada cho đến năm 1962. Canada là quốc gia cuối cùng chấm dứt việc bán thuốc Thalidomide. Có thể thấy, tính nghiêm trọng của thảm họa Thalidomide có thể được xếp vào top 3 thảm họa của ngành dược thế giới.
5 Biến cố Fenfluramine/Phentermine
Fenfluramine/Phentermine được sử dụng để ngăn ngừa béo phì, bằng cách tăng cảm giác no lâu hoặc chán ăn. Thuốc được sản xuất bởi Công ty Wyeth tại Mỹ.
Trong quá trình sử dụng, đã có một số báo cáo về tình trạng bất thường van tim (với sự dày lên của lá van và dây chằng), tăng huyết áp phổi, xơ hóa tim. Bất thường van tim được nhận định là do thành phần Fenfluramine của thuốc.
Các chuyên gia cho biết, hiện tượng này có thể liên quan đến các thụ thể serotonin ở van tim, có vai trò điều chỉnh sự phát triển của van tim. Fenfluramine và chất chuyển hóa có hoạt tính của nó (Norfenfluramine) kích thích các thụ thể serotonin gây ra những bất thường về van tim.
Đặc biệt Norfenfluramine là một chất chủ vận mạnh của thụ thể 5-HT2B, có rất nhiều trong van tim của con người. Các nhà nghiên cứu cho rằng, sự kích thích quá mức thụ thể 5-HT2B có thể dẫn đến sự rối loạn và phân chia không kiểm soát của các tế bào van tim. Thực tế, sự bất thường van tim cũng đã xảy ra ở những bệnh nhân sử dụng các loại thuốc khác mà tác động lên thụ thể 5-HT2B.
Theo một nghiên cứu trên 5743 người đã từng sử dụng Fenfluramine/Phentermine trước đây, tổn thương van tim vẫn tiếp tục kéo dài sau khi ngừng thuốc. Trong số những người dùng được thử nghiệm, có 20% phụ nữ và 12% nam giới bị ảnh hưởng. Đối với tất cả những người đã từng sử dụng, nguy cơ cần phẫu thuật van tim bị lỗi do thuốc gây ra tăng gấp 7 lần.
Với những bằng chứng trên, Fenfluramine/Phentermine bị rút khỏi thị trường Hoa Kỳ vào năm 1997. Sau đó thuốc này cũng bị thu hồi khỏi các thị trường khác trên thế giới và đã bị cấm ở Ấn Độ vào năm 1998.
6 Biến cố Troglitazone (Rezulin)
Troglitazone thuộc nhóm thuốc trị tiểu đường Thiazolidinediones hoạt động bằng cách kích hoạt các thụ thể kích hoạt chất tăng sinh peroxisome. Thuốc được sản xuất bởi Daichi Sankyo và Parke-Davis, tại Vương Quốc Anh.
Troglitazone là thiazolidinedione đầu tiên được phép sử dụng ở Hoa Kỳ và được cấp phép sử dụng đơn độc hoặc kết hợp với các thuốc điều trị đái tháo đường khác để điều trị bệnh tiểu đường loại 2 vào năm 1997. Troglitazone từng được bán dưới tên thương hiệu Rezulin và có sẵn ở dạng viên nén 400 mg.
Các báo cáo về tình trạng tổn thương gan nghiêm trọng và tử vong do suy gan cấp tính đã bắt đầu xuất hiện ngay sau khi thuốc này được phổ biến rộng rãi. Các nghiên cứu tiến cứu lớn cho thấy rằng sự gia tăng đáng kể nồng độ aminotransferase trong huyết thanh (bằng hoặc lớn hơn 3 lần giới hạn trên của mức bình thường) xảy ra ở 1,9% bệnh nhân mắc bệnh tiểu đường được điều trị bằng troglitazone trong 24 đến 48 tuần, so với chỉ 0,6% ở người nhận giả dược. Một số bệnh nhân xuất hiện các triệu chứng tổn thương gan và vàng da tiến triển.
Sinh thiết gan ở những bệnh nhân sử dụng Troglitazone cho thấy tình trạng viêm cấp tính và mức độ hoại tử khác nhau, từ hoại tử đốm hiếm gặp đến hoại tử gan bắc cầu và hoại tử dưới da hoặc hoại tử lớn. Ít nhất 20 trường hợp suy gan cấp tính và tử vong hoặc cần ghép gan đã được báo cáo cho FDA trước khi troglitazone bị thu hồi vào năm 2000.
7 Biến cố Nimesulide
Nimesulide là hoạt chất thuộc nhóm NSAID, ức chế chọn lọc cox-2. Thuốc được sản xuất bởi Công ty Helsinn Healthcare SA, dùng để điều trị các cơn đau cấp tính, điều trị triệu chứng bệnh thoái hóa khớp và thống kinh nguyên phát ở thanh thiếu niên và người lớn trên 12 tuổi.
Trong quá trình sử dụng, đã có một số báo cáo về các phản ứng có hại của thuốc tại Ấn Độ. Trong khoảng thời gian từ năm 1999 đến 2006, đã có 6 trường hợp suy gan nặng khi dùng Nimesulide. Vào ngày 12 tháng 2 năm 2011, Express India cho biết Bộ Y tế và Phúc lợi Gia đình Ấn Độ đã quyết định cấm sử dụng thuốc giảm đau Nimesulide cho trẻ em. Từ ngày 10 tháng 3 năm 2011 trở đi, các công thức Nimesulide dùng cho người ở trẻ em dưới 12 tuổi đã bị cấm.

Đến năm 2003, Alembic Ltd. đã ban hành một thông tư yêu cầu các nhà bán buôn và bán lẻ thu hồi tất cả các chế phẩm Nimegesic Drops (một dạng bào chế dành cho trẻ em). Tóm lại, Nimegesic cũng giống như hầu hết các NSAID, không được chỉ định cho trẻ em.
8 Biến cố Cerivastatin (Baycol)
Cerivastatin là thuốc hạ mỡ máu nhóm Statin, thuộc công ty Bayer, Hoa Kỳ. Thuốc được sử dụng để giảm cholesterol máu và điều trị các bệnh tim mạch. Tuy nhiên, việc sử dụng Cerivastatin có liên quan đến tình trạng tiêu cơ vân và suy thận. Một số trường hợp nghiêm trọng đã xuất hiện các triệu chứng bao gồm: đau cơ, nôn mửa và lú lẫn,...
Trong quá trình giám sát hậu mãi, 52 trường hợp tử vong (31 trường hợp tử vong ở Hoa Kỳ và 21 trường hợp tử vong trên toàn thế giới) đã được báo cáo ở những bệnh nhân sử dụng Cerivastatin, chủ yếu do tiêu cơ vân và hậu quả là suy thận. Trong nhiều trường hợp tử vong, bệnh nhân đã dùng đủ liều Cerivastatin (0,8 mg/ngày) hoặc đang sử dụng đồng thời với hoạt chất Gemfibrozil. Tương tác thuốc-thuốc này có liên quan đến 12 trong số 31 trường hợp tử vong ở Hoa Kỳ.
9 Biến cố Rofecoxib (Vioxx)
Rofecoxib có bản chất là một NSAID, được sản xuất bởi Công ty Merck & Co, Hoa Kỳ. Thuốc được sử dụng để điều trị viêm xương khớp, đau nhức cấp tính và Đau Bụng Kinh.
Vào ngày 30 tháng 9 năm 2004, Merck rút Rofecoxib khỏi thị trường vì lo ngại về nguy cơ đau tim và đột quỵ gia tăng khi sử dụng liều cao và kéo dài. Phía công ty tiết lộ rằng, họ đã giấu thông tin về rủi ro của Rofecoxib với bác sĩ và bệnh nhân trong hơn 5 năm. Hậu quả là dẫn đến khoảng 88.000 đến 140.000 trường hợp mắc bệnh tim nghiêm trọng sau khi dùng thuốc. Có thể nói, Rofecoxib là một trong những loại thuốc được sử dụng rộng rãi nhất từng bị rút khỏi thị trường Rofecoxib.
10 Biến cố Benfluorex (Mediator)
Benfluorex được cấp bằng sáng chế và sản xuất bởi công ty dược phẩm Pháp Servier. Nó có cấu trúc liên quan đến fenfluramine (một loại amphetamine thay thế) có tác dụng gây chán ăn, kiểm soát đường huyết và hạ lipid máu
Benfluorex có mặt trên thị trường từ năm 1976 đến 2009 và được cho là đã gây ra cái chết của 500 đến 2.000 người. Trong một nghiên cứu, các nhà khoa học đã xem xét hơn 1 triệu người mắc bệnh tiểu đường, cho thấy tỷ lệ nhập viện vì bệnh van tim cao hơn ở những người dùng Benfluorex. Cùng với đó, Công ty Servier bị nghi ngờ đã bán Benfluorex trái ngược với đặc tính y tế đã được phê duyệt của thuốc.
Vào ngày 18 tháng 12 năm 2009, Cơ quan Dược phẩm Châu Âu đã quyết định thu hồi tất cả các loại thuốc có chứa Benfluorex ở Liên minh Châu Âu, vì lo ngại rủi ro của chúng (đặc biệt là nguy cơ mắc bệnh van tim) lớn hơn lợi ích mà chúng mang lại. Tác dụng phụ của Benfluorex trên van tim giống như Fenfluramine. Vì vậy sau khi Fenfluramine bị cấm sử dụng trên toàn thế giới thì Benfluorex cũng bị thu hồi tại Châu Âu [3]
Vào ngày 29 tháng 3 năm 2021, một tòa án ở Pháp đã phạt Servier 2,7 triệu euro (tương đương 2,3 triệu bảng Anh) sau khi kết tội lừa dối và ngộ sát. Cựu giám đốc điều hành Jean-Philippe Seta đã bị kết án 4 năm tù treo.
Tóm lại, các thảm họa liên quan đến thuốc đã để lại hậu quả rất nghiêm trọng liên quan trực tiếp đến tính mạng con người. Vì thế, các nhân viên y tế và bệnh nhân cần hết sức thận trọng trong quá trình sử dụng thuốc. Đồng thời cần báo cáo cho cơ quan có thẩm quyền nếu phát hiện những biến cố mới hoặc nghiêm trọng liên quan đến thuốc.
Tài liệu tham khảo
- ^ Suja C, Navaneeth Krishna Manoj, [...] (Ngày đăng: Ngày 08 tháng 04 năm 2015). A Review on Drug Disaster in the History of Medicine, RJPT. Ngày truy cập: Ngày 18 tháng 05 năm 2023
- ^ WHO (Ngày đăng: Ngày 23 tháng 01 năm 2023). WHO urges action to protect children from contaminated medicines, WHO. Ngày truy cập: Ngày 18 tháng 05 năm 2023
- ^ EMA (Ngày đăng: Ngày 27 tháng 07 năm 2011). European Medicines Agency recommends withdrawal of benfluorex from the market in European Union, EMA. Ngày truy cập: Ngày 18 tháng 05 năm 2023

