Tế bào học cổ tử cung và vai trò tầm soát phát hiện ung thư sớm
Đại học Huế - Trường ĐH Y Dược
Đồng chủ biên
GS.TS. Nguyễn Vũ Quốc Huy
GS.TS. Cao Ngọc Thành
PGS.TS. Lê Minh Tâm
PGS.TS. Trương Thành Vinh
Cùng nhiều tác giả tham gia biên soạn
1 ĐẠI CƯƠNG
Các công trình nghiên cứu về hình thái học tế bào ở người được khởi đầu vào giữa thế kỷ XIX, nhờ vào sự phát triển vượt bậc của kỹ thuật sản xuất kính hiển vi quang học. Cuốn sách ảnh đầu tiên về tế bào học được xuất bản vào năm 1885 bởi hai tác giả người Pháp Donné và Lebert. Hai năm sau đó, Pouchet, một tác giả người Pháp khác xuất bản cuốn sách ảnh về tế bào học của chu kỳ kinh nguyệt. Năm 1860, Beale công bố bài viết đầu tiên về sự hiện diện của tế bào ung thư tìm thấy trong đàm ở bệnh nhân ung thư phế quản. Trong lĩnh vực Phụ khoa các tác giả Gluge và Koeniger ở Đức lần đầu tiên năm 1850 công bố các bài viết về tế bào ung thư của cơ quan sinh dục nữ.
Sang đầu thế kỷ XX, Schaustein (1908) và Rubin (1910) mô tả các thương tổn tiền ung thư trên các bệnh phẩm mô học. Hai tác giả này cho rằng ung thư xâm lấn diễn ra sau khi có các thương tổn tiền ung thư. Lý thuyết này là cơ sở giải phẫu bệnh cho việc chẩn đoán sớm ung thư trước khi diễn ra hiện tượng xâm lấn. Danh từ ung thư trong liên bào (carcinoma in situ) được Schottlander và Kermauner sử dụng lần đầu tiên năm 1912. Năm 1925, thông qua phương pháp thăm khám bằng máy soi cổ tử cung (colposcope) Hinselmann đã mô tả chi tiết vị trí giải phẫu của các thương tổn ung thư cổ tử cung. Đây là cơ sở cho công trình nghiên cứu tiếp theo của Meyer (1930) về vai trò của sinh thiết trong chẩn đoán xác định các thương tổn ác tính ở cổ tử cung.
Bước đột phá quan trọng nhất trong lĩnh vực tế bào học phụ khoa diễn ra năm 1928, khi hai tác giả Papanicolaou (New York, USA) và Babes (Bucharest, Romania) đồng thời công bố hai công trình nghiên cứu về sự hiện diện của tế bào ung thư trên phiến đồ âm đạo - cổ tử cung. Tuy nhiên, phải đợi đến giữa thập kỷ 40, khi Papanicolaou và Traut công bố các kết quả phát hiện sớm ung thư cổ tử cung thông qua phiến đồ âm đạo - cổ tử cung và xuất bản cuốn sách ảnh hoàn chỉnh về các tế bào ung thư phụ khoa thì phương pháp này mới có được tiếng vang và bắt đầu đi vào ứng dụng lâm sàng. Trong hai thập kỷ 60 và 70, khi phương pháp tế bào học đã chứng minh được tính ưu việt của nó trong phát hiện và chẩn đoán ung thư cổ tử cung, ở các nước công nghiệp phát triển bắt đầu hình thành và phát triển các chương trình phòng chống ung thư cổ tử cung thông qua xét nghiệm phiến đồ âm đạo sàng lọc. Sau hơn 30 năm tiến hành chương trình này tỷ lệ ung thư cổ tử cung xâm lấn đã giảm một cách rõ rệt, thay đổi tùy từng vùng và từng quốc gia từ 50-78%, đồng thời làm giảm tỷ lệ tử vong do ung thư cổ tử cung xuống 65-72%.
Bên cạnh nhiều ưu điểm, phương pháp chẩn đoán tế bào học cũng có nhiều nhược điểm và vấn đề đặt ra cần phải giải quyết. Nhiều tác giả như Gompel (1974), Rylander (1978), Hilgarth (1980), Van der Graaf (1987) đã công bố các bài viết gầy nhiều tranh luận về các kết quả âm tính giả trong chẩn đoán tế bào học ung thư cổ tử cung, thay đổi trong khoảng 40-10% với độ đặc hiệu 74-94%. Ngày nay, tại các nước công nghiệp phát triển chương trình phát hiện sớm ung thư cũng không bao gồm được tất cả quần thể nguy cơ cao, mà chính các đối tượng trong quần thể này mới cần được khám xét sàng lọc trước nhất. Về mặt kỹ thuật, việc đánh giá tiêu bản phụ thuộc vào nhiều yếu tố, từ kỹ năng lấy mẫu nghiệm của người bác sĩ lâm sàng, kỹ thuật nhuộm tiêu bản cho đến khả năng đánh giá của người đọc tiêu bản và cuối cùng là việc đánh giá kết quả tế bào học để có hướng theo dõi và xử trí lâm sàng tương ứng.
2 CƠ SỞ MÔ BỆNH HỌC CỦA TẾ BÀO HỌC PHỤ KHOA
2.1 Biểu mô lát không sừng hóa
Biểu mô này hiện diện ở môi nhỏ, âm đạo và mặt ngoài cổ tử cung, được chia làm 5 lớp từ nông đến sâu:
Lớp nông (lớp bề mặt): gồm các tế bào có kích thước lớn nhất, đường kính 40-60um, có hình đa giác, chứa nhiều thành phần cấu tạo nên keratin. Dưới ảnh hưởng của estrogen các tế bào này trưởng thành, nhân đông đặc, nguyên sinh chất bắt màu acid mạnh. Các tế bào bong ra chủ yếu dưới dạng riêng lẻ, không tạo thành mảng tế bào.
Lớp trung gian: là lớp dày nhất, các tế bào có bờ từ bầu dục đến đa giác, kích thước 15-45pm, nhân hình tròn, chứa nhiều glycogen, nguyên sinh chất bắt màu kiềm. Các tế bào ở phần nông của lớp này có kích thước lớn hơn rõ rệt so với các tế bào ở sâu hơn. Hàm lượng glycogen gia tăng dưới tác dụng của estrogen và Progesterone và đạt cực đại trong thai kỳ. Các tế bào liên kết với nhau bởi nhiều cầu nối liên bào, vì vậy chúng sẽ bong ra thành từng mảng.
Lớp cận đáy gồm các tế bào hình tròn đến bầu dục, kích thước 15-25pm, nguyên sinh chất thường bắt màu kiềm hoặc đôi khi cả hai màu.
Lớp đáy gồm một hàng tế bào, là các tế bào nhỏ nhất, có kích thước 12-20um hình tròn, nguyên sinh chất bắt màu kiềm mạnh. Sự hiện diện của loại tế bào này chứng tỏ biểu mô đã thương tổn sâu.
Màng đáy phân cách biểu mô với mô liên kết phía dưới, được tạo thành từ Collagen và các sợi protein khác. Sự phá vỡ màng đáy và hiện diện các tế bào ác tính trong mô liên kết là tiêu chuẩn để chẩn đoán ung thư xâm nhiễm.
2.2 Biểu mô lát sừng hóa
Biểu mô này hiện diện ở môi lớn, trong một số bệnh lý có thể gặp ở âm đạo, cổ tử cung hoặc nội mạc tử cung dưới dạng chuyển sản. Đặc điểm của loại biểu mô này là sự hiện diện của một lớp tế bào nông không nhân và sừng hóa mạnh.
2.3 Biểu mô trụ (tuyến) ống cổ tử cung
Ống cổ tử cung được lát bởi biểu mô tuyến, các tế bào có kích thước từ 20-30pm, có nhân hình tròn đến bầu dục và nằm ở phần đáy của tế bào. Một số tế bào tạo thành các tuyến nằm sâu vào trong tổ chức liên kết. Xung quanh vùng lỗ ngoài cổ tử cung, dưới tác động của các hiện tượng viêm, tái tạo và chuyển sản các tuyến này có thể bị bít lại, về sau sẽ tạo nên các nang Naboth.
Phía đáy của lớp tế bào tuyến này và ở vùng tiếp giáp với biểu mô lát có các tế bào nhỏ hơn, nằm xen kẽ giữa chân của các tế bào tuyến, được gọi là các tế bào dự trữ. Chúng có khả năng biệt hóa thành các tế bào biểu mô tuyến hoặc biểu mô lát, trong trường hợp thứ hai sẽ diễn ra hiện tượng chuyển sản biểu mô lát và có khả năng dẫn đến loạn sản.
2.4 Vùng tiếp giáp biểu mô trụ - lát
Bình thường vùng này nằm ở lỗ ngoài giải phẫu cổ tử cung, tuy nhiên vị trí thay đổi tùy theo độ tuổi. Ở thiếu nữ chưa dậy thì biểu mô trụ lên cao trong ống cổ tử cung, tuy nhiên có một số trường hợp lấn ra ngoài và tạo nên một vùng “lộn tuyến” bẩm sinh. Đến tuổi dậy thì và trong thời kỳ hoạt động sinh dục sẽ diễn ra hiện tượng chuyển sản để thay thế biểu mô tuyển bằng biểu mô lát. Sau khi mãn kinh vùng tiếp nối này lên cao trong ống cổ tử cung.
2.5 Hiện tượng chuyển sản (dị sản)
Như đã đề cập ở trên, chuyển sản là hiện tượng thay thế một loại biểu mô bằng một loại biểu mô khác. Chuyển sản biểu mô lát là sự thay thể biểu mô tuyến bằng biểu mô lát có nguồn gốc từ các tế bào dự trữ. Biểu mô chuyển sản cũng có thể biệt hóa hoàn toàn (trưởng thành) hoặc từng phần (kém trưởng thành). Tại cổ tử cung hiện tượng này diễn ra chủ yếu ở vùng tiếp giáp biểu mô lát - trụ. Đây là vùng thường diễn ra các quá trình biến đổi ác tính ở cổ tử cung.
2.6 Nội mạc tử cung
Nội mạc tử cung được lót mặt trong bởi một lớp tế bào tuyến với kích thước 7-20um, tạo thành các tuyến ăn sâu vào mô liên kết. Nội mạc trẻ em ở dạng thiểu dưỡng. Trong chu kỳ kinh nguyệt, dưới tác động của nồng độ và sự thay đổi của nội tiết tố sinh dục nữ các tế bào nội mạc sẽ trải qua các giai đoạn tăng sinh, chế tiết và bong. Sau khi sinh tại nội mạc sẽ diễn ra hiện tượng tái tạo và hoàn tất sau 3 tuần. Sau khi mãn kinh nội mạc trở về trạng thái thiểu dưỡng.
2.7 Vòi tử cung
Niêm mạc vòi tử cung bao gồm các tế bào tuyến chế tiết và tế bào có lông mao.
2.8 Buồng trứng
Bề mặt buồng trứng được che phủ bởi các tế bào biểu mô hình lập phương có nguồn gốc lá tạng của bào thai. Sự trưởng thành của nang noãn diễn ra trong mô buồng trứng đi kèm với các biến đổi nội tiết và làm biến đổi biểu mô lát - tuyến của cơ quan sinh dục nữ.
3 KỸ THUẬT LẤY, CỐ ĐỊNH VÀ VẬN CHUYỂN MẪU NGHIỆM
3.1 Chuẩn bị
Bệnh nhân không được thụt rửa, giao hợp hoặc đặt thuốc âm đạo trong 24 giờ trước đó. Mẫu nghiệm tế bào học cần được lấy trước khi khám âm đạo. Không được làm trơn mỏ vịt dùng để bộc lộ âm đạo, do chất bôi trơn nếu nhiễm vào trên tiêu bản sẽ nhuộm màu xanh đậm với thuốc nhuộm Papanicolaou, gây ảnh hưởng đến việc đọc tiêu bản.
Dụng cụ lấy tiêu bản tùy tình huống có thể dùng tăm bông, thìa gỗ Ayre hoặc “bàn chải” Cytobrush. Đối với bệnh nhân mãn kinh, âm đạo khô teo hoặc cần lấy phiến đồ ở vùng tiền đình - âm hộ có thể thấm ướt tăm bông bằng dung dịch muối sinh lý để có thể thu được nhiều tế bào hơn.
3.2 Lấy mẫu nghiệm
3.2.1 Bệnh phẩm tế bào cổ điển
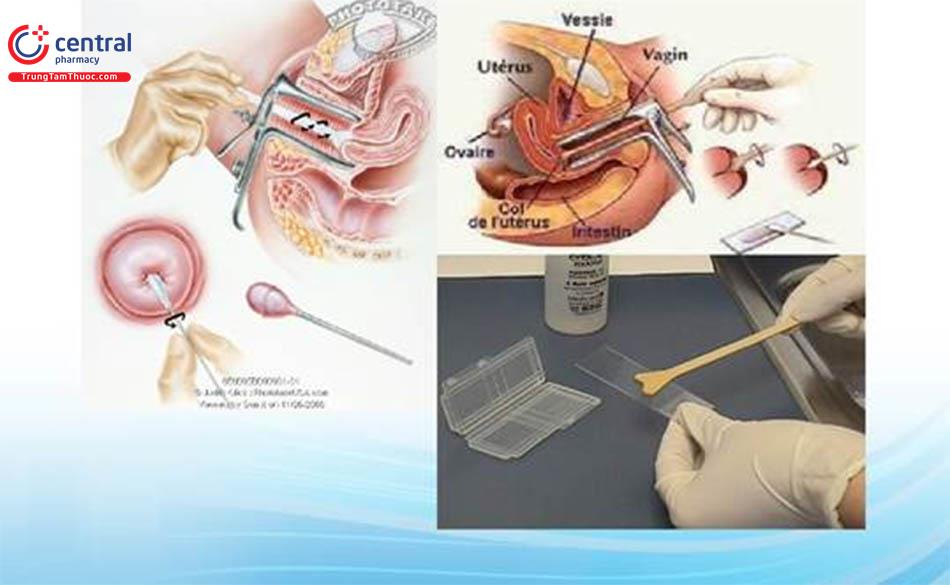
Có thể lấy bệnh phẩm từ nhiều vị trí khác nhau của đường sinh dục dưới phụ nữ. Dịch tiết nằm ở túi cùng sau âm đạo được lấy bằng thìa gỗ Ayre hoặc que đè lưỡi bằng gỗ, có thể dùng tăm bông nhưng nhiều thành phần tế bào sẽ bị giữ lại trên tăm bông. Dịch tiết này chứa các tế bào bong ra từ biểu mô âm đạo và cổ tử cung, chất nhầy, bạch cầu và các sản phẩm thoái hóa tế bào khác, đôi khi có thể gặp tế bào từ nội mạc; còn các tế bào từ vòi tử cung và buồng trứng hiếm gặp hơn. Trong trường hợp viêm nhiễm âm đạo - cổ tử cung, dịch tiết này còn có thể chứa vi khuẩn, virus, nấm hoặc ký sinh trùng đơn bào. Ưu điểm của phương pháp này là sự đa dạng của các tế bào thu thập được, bao gồm hầu hết đường sinh dục nữ. Phương pháp này tỏ ra hiệu quả hơn phiến đồ cổ tử cung trong việc phát hiện các khối u của nội mạc vòi - buồng trứng cũng như các di căn ung thư khác tại đường sinh dục nữ. Tuy vậy nếu các tế bào bong ra đã lâu thì sẽ thoái hóa, gây khó khăn trong việc đánh giá tiêu bản. Để đánh giá hoạt động nội tiết người ta lấy mẫu nghiệm ở 1/3 trên thành bên âm đạo, tốt nhất là với đầu tròn của thìa gỗ Ayre.
Để lấy bệnh phẩm tế bào từ cổ tử cung người ta thường sử dụng đầu vát của thìa Ayre, Hình dạng của đầu này cho phép tiếp xúc được cùng lúc cả mặt ngoài cổ tử cung lẫn phần thấp của ống cổ tử cung. Sau khi đặt tiếp xúc với cổ tử cung cần xoay thia một vòng 360 với áp lực vừa phải để “quét” hết bề mặt cổ tử cung. Tăm bông cũng có thể được sử dụng để lấy mẫu nghiệm từ mặt ngoài cổ tử cung tuy nhiên một phần lớn mẫu bệnh phẩm tế bào sẽ bị giữ lại trong bông và không được chuyển một cách đây đủ sang lam kính.
Có nhiều loại “bàn chải” đã được phát minh để lấy mẫu nghiệm tế bào từ ống cổ tử cung và kể cả buồng tử cung. Hai loại thường được dùng nhất là Cytobrush và Cervex. Tuy nhiên, ống cổ tử cung chứa biểu mô tuyến rất dễ bị tổn thương vì vậy phải xoay bàn chải với áp lực vừa phải để tránh làm chảy máu nhiều, gây khó khăn cho việc soi cổ tử cung và khám lâm sàng sau đó.
Mẫu nghiệm sau khi lấy được phết ngay tức thì lên một phiến kính chắc, có độ dày đều đặn. Cần phết một cách đều đặn và nhanh, tốt nhất là theo một chiều và trên toàn bộ diện tích dành sắn của phiến kính, tránh phết nhiều lần trên cùng một vị trí, đồng thời đảm bảo toàn bộ bề mặt của dụng cụ lấy tiếp xúc được với phiến kính để đạt được số lượng tối đa các tế bào lấy được.
Khách hàng | Dụng cụ lấy tế bào | Lam kính | Người đọc | Kết quả | |
+ | + | + | + | (+) thật | TỐT |
+ | + | + | - | 2/3 do quy trình lấy tế bào | Nguy hiểm! |
+ | + | - | - |
| |
+ | - | - | - |
| |
- | - | - | + | (+) giả | Tốn kém |
- | - | - | - | (-) thật | TỐT |
Dương tính giả: Chủ yếu do người đọc nhận định không chính xác, có thể tạo ra những chi phí không đáng có cho hệ thống y tế và khách hàng cũng như tác động xấu đến tâm lý khách hàng.
Âm tính giả là tình huống tác động xấu đến sức khỏe và quyền lợi của khách hàng, có thể nguy hiểm đến tính mạng của khách nếu không được theo dõi chặt chẽ sau đó. Người lấy bệnh phẩm tế bào chịu trách nhiệm đến 2/3 các trường hợp âm tính giả, do đó dụng cụ và kỹ thuật lấy tế bào đóng vai trò rất quan trọng trong việc giảm tỷ lệ âm tính giả này.
3.2.2 Bệnh phẩm tế bào nhúng dịch
Trong hơn 20 năm trở lại đây, phương pháp thu thập bệnh phẩm tế bào trong dung dịch (liquid-based cytology - LBC) đã dần được đưa vào áp dụng trong chẩn đoán tế bào học thường quy. Trong phương pháp này, sau khi lấy bệnh phẩm phần đầu của dụng cụ lấy (và các thành phần tế bào nằm trên đó) sẽ được cho vào một hộp nhỏ chứa dung dịch bảo quản, sau đó thành phần tế bào trong dung dịch sẽ được tách ra bằng quay ly tâm và lắng đọng. Phương pháp này có ưu điểm làm gia tăng tỷ lệ phát hiện các trường hợp bất thường tế bào học cũng như còn lại bệnh phẩm để tiến hành các xét nghiệm bổ sung (xét nghiệm ADN của HPV, định danh HPV, hóa tế bào miễn dịch...) mà bệnh nhân không cần phải tái khám lần khác. Tại một số quốc gia như Anh, Scotland, Ireland, Úc, phương pháp này đã thay thế hoàn toàn phương pháp lấy bệnh phẩm cổ điển. Rất nhiều nước phát triển cũng đã cung cấp phương pháp này song song với phương pháp cổ điển.
Các bước lấy bệnh phẩm tế bào nhúng dịch bao gồm:
Dùng dụng cụ phết chuyên biệt được cung cấp bởi nhà sản xuất để phết lên cổ tử cung.
Khuấy dụng cụ phết vào trong hộp chứa dung dịch bảo quản để chuyển bệnh phẩm tế bào vào dung dịch bảo quản.
Chuyển đến cơ sở xét nghiệm.
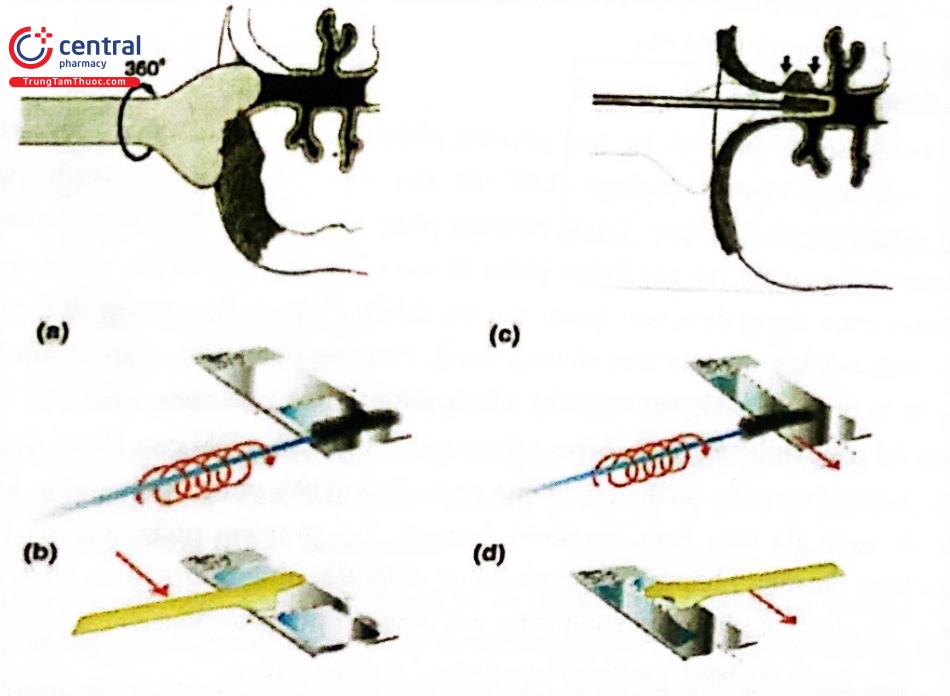
Hệ thống ThinPrep Pap test: Mẫu tế bào trong dung dịch được xử lý bằng máy T2000 bằng cách trộn và phân tán nhẹ nhàng nhằm mục đích làm cho mẫu đồng nhất; sử dụng máy hút chân không để kéo các thể vẩn xuyên qua các lưới lọc polycarbonate. Các tế bào được giữ trên lớp lưới lọc sau đó được chuyển thành một lớp đơn trên lam kính khi lưới lọc này chạm vào bề mặt của lam kính.

a) Dụng cụ lấy bệnh phẩm và hộp chứa dung dịch bảo quản; b) Chuyển tế bào từ dụng cụ phết vào dung dịch bảo quản; c) Máy T2000 để xử lý bệnh phẩm; đ) Lam kính mang bệnh phẩm tế bào (hình tròn).
Hệ thống prestain: Các mẫu tế bào cổ tử cung sau khi lấy từ cổ tử cung được bảo quản trong Ethanol, sau đó được ly tâm theo gradient tỷ trọng để loại bỏ các tế bào viêm và các thành phần không sử dụng cho chẩn đoán. Các tế bào sau đó sẽ được máy dàn đều lên một lam kính có phủ sẵn các chất kết dính, sau đó được nhuộm tự động với thuốc nhuộm Papanicolaou cải tiến. Mỗi lam kính được nhuộm riêng với một thể tích thuốc nhuộm cố định, chất lượng tiêu bản sẽ tốt hơn vì thuốc nhuộm sẽ không bị chảy tràn sang các lam kính khác.
3.3 Cố định và vận chuyển mẫu nghiệm
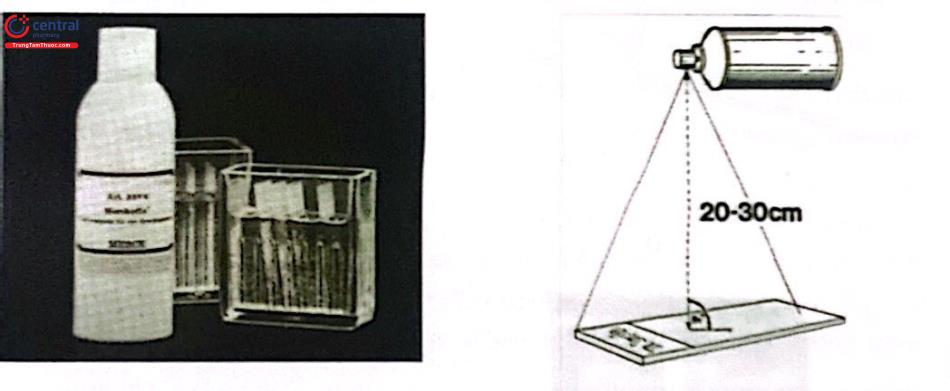
Phiến kính mang bệnh phẩm phải được cố định ngay sau khi lấy bằng khí dung dành cho tế bào học hoặc trong còn 95 trong thời gian tối thiểu 30 phút trước khi nhuộm để tránh sự mất nước và làm thay đổi hình thái tế bào. Nếu cố định bằng khí dung thì cần để tiêu bản cách binh khí dung khoảng 25-30cm và thẳng góc với luồng khí dung. Trong trường hợp cần phải chuyển mẫu nghiệm đến một trung tâm khác để xử lý và đọc kết quả thì nên sử dụng khí dung để cố định tiêu bản, sau đó đóng gói và chuyển đi.
4 CÁC PHƯƠNG PHÁP NHUỘM TẾ BÀO HỌC PHỤ KHOA
Tất cả các phương pháp nhuộm đều có chung một nguyên lý, đó là sử dụng Hematoxylin để nhuộm màu nhân, phối hợp với một hoặc nhiều hóa chất khác.
Trải qua nhiều cải tiến và một số thay đổi về mặt kỹ thuật, cho đến nay phương pháp nhuộm Papanicolaou vẫn là phương pháp chuẩn nhất và được sử dụng rộng rãi trên toàn thế giới. Phương pháp này phối hợp Hematoxylin để nhuộm màu nhân và Orange G6 cùng EA50 để nhuộm màu nguyên sinh chất.
Phương pháp nhuộm Shorr hoặc Shorr-Hematoxylin sử dụng thuốc nhuộm Shorr chúa Orange G6 và Fast Green FCF. Nguyên sinh chất của các tế bào từ nông đến sâu bắt màu tương phản nhau một cách rõ rệt, vì vậy phương pháp này được sử dụng trong chẩn đoán tế bào học nội tiết.
Sau khi kết thúc quá trình nhuộm người ta gắn một lá kính lên tiêu bản để giữ cho các tế bào khỏi bị thay đổi hình thái, màu sắc cũng như phục vụ cho mục đích lưu trữ tiêu bản lâu dài. Tại châu u và Hoa Kỳ, các tiêu bản tế bào học được lưu trữ trung bình trong 10 năm, các tiêu bản dương tính có thể đến 20 năm.
Các bước nhuộm | Thời gian |
1. Cồn 80% 2. Cồn 70% 3. Nước 4. Nước 5. Gill Hematoxyllin II 6. Nước chảy 7. Cồn 70% 8. Cồn 80% 9. Cồn 99% 10. PAP II Orange G 11. Cồn 99% 12. Cồn 99% 13. PAP III - Polychrom 14. Cồn 99% 15. Cồn 99% 16. Cồn 99% 17. Xylol 18. Xylol | 15 giây 15 giây 15 giây 15 giây 2 phút 5 phút 30 giây 30 giây 30 giây 4 phút 30 giây 30 giây 8 phút 30 giây 30 giây 30 giây 3-5 phút 3-5 phú |
5 CÁC HÌNH THÁI TẾ BÀO SINH LÝ VÀ BỆNH LÝ
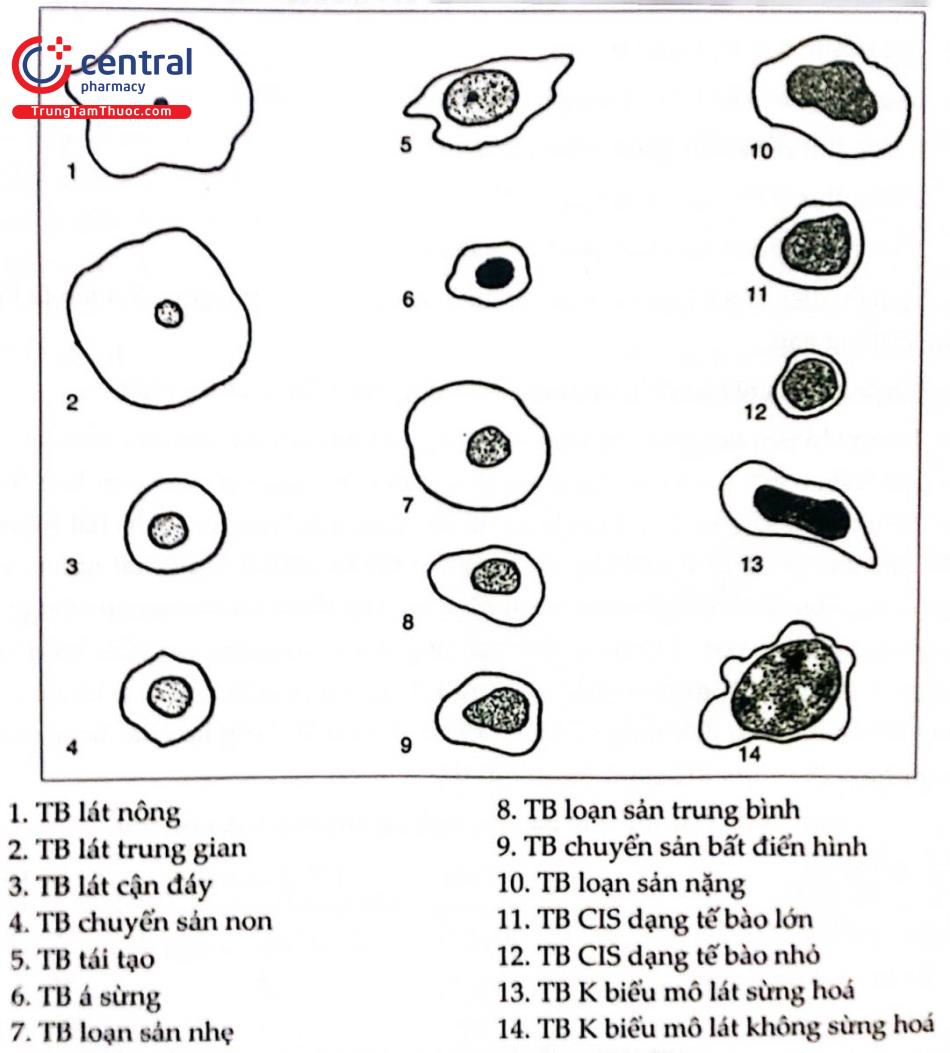
5.1 Tế bào lát của cổ ngoài
5.1.1 Tế bào đáy
Các tế bào này rất hiếm khi thấy trên phiến đồ, thường chỉ thấy khi phá vỡ các lớp trên biểu mô. Tế bào hoạt động là các tế bào nhỏ nhất của biểu mô lát có hình tròn hoặc hình bầu dục. Nguyên sinh chất bắt màu kiềm đậm. Nhân phần lớn rộng, tròn hoặc bầu dục, có cấu trúc chất nhiễm sắc dạng hạt mịn.
5.1.2 Tế bào cận đáy
Các tế bào cận đáy lớn hơn rõ so với tế bào đáy. Khi không có hiện tượng viêm hoặc không có biến đổi dạng thoái hóa, các tế bào cận đáy có hình tròn hoặc hình bầu dục, bắt màu kiềm.
5.1.3 Tế bào trung gian
Các tế bào này phát triển từ tế bào cận đáy bằng cách biệt hóa tiếp tục. Tế bào trung gian có hình dạng đa giác với đường kính đồng đều, nguyên sinh chất ưa kiểm, sáng trong suốt và ranh giới tế bào rõ. Nhân hình thuyền nằm ở trung tâm có chất nhiễm sắc dạng hạt mịn và phân bố đều, có một vài hạt nhiễm sắc.
5.1.4 Tế bào bề mặt (nóng)
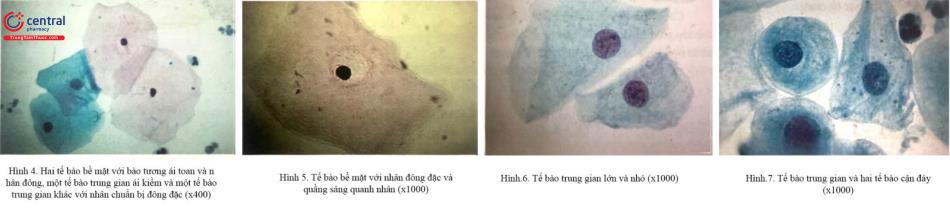
Tế bào bề mặt (nông) là các tế bào trưởng thành nhất của biểu mô lát cổ tử cung Nguyên sinh chất sáng trong suốt, đa số ái toan (đỏ) và có sừng hóa mức độ nhẹ. Ranh giới tế bào rất rõ. Đối lập với tế bào của các lớp sâu hơn, tế bào nông chứa một nhân đông kích thước nhỏ.
5.2 Tế bào ống cổ tử cung bình thường
Biểu mô lát không sừng hóa của cổ ngoài kết thúc đột ngột tại ranh giới biểu mô trụ đơn của ống cổ tử cung, tạo nên vùng tiếp xúc nối trụ - lát. Bệnh phẩm tế bào đạt yêu cầu về kỹ thuật bao gồm các tế bào biểu mô xuất phát từ cổ ngoài, ống cổ tử cung và nội mạc cũng như các thành phần tế bào của dòng máu. Hai loại tế bào của các tế bào trụ có thể được xác định: tế bào chế tiết và tế bào lông mao.
Nhân hình tròn hoặc bầu dục thường nằm ở đáy. Cấu trúc chất nhiễm sắc thường có dạng hạt mịn đồng nhất với vài hạt nhiễm sắc, đôi khi có cả hạch nhân. Tế bào ống cổ tử cung có thể xuất hiện đơn độc hoặc dạng mảng. Đôi khi chúng tạo thành hình ống hoặc hình lát đá. Tùy theo góc nhìn, chúng thể hiện dạng nghiêng hình trụ hoặc cấu trúc tổ ong điển hình. Mất nguyên sinh chất của tế bào ống cổ tử cung, “nhân trần” có nguồn gốc ống cổ tử cung là một hình ảnh thường gặp. Các tế bào có lông mao được cho rằng có chức năng tạo nên dòng chảy của dịch nhầy từ các cấu trúc tuyến trong ống cổ tử cung ra phía lỗ ngoài.
Hình 34.8. Tế bào tuyến ống cổ tử cung nhìn nghiêng và thẳng (x400)
5.3 Tế bào nội mạc tử cung
Thông thường, tế bào nội mạc xuất hiện trên phiến đó tế bào học chỉ trong 10-12 ngày đầu của chu kỳ kinh. Tế bào biểu mô nội mạc có thể biểu hiện dưới dạng chế tiết hoặc tế bào lông mao. Tế bào mô liên kết của nội mạc xuất phát từ phần nóng hoặc sâu của nội mạc. Các tế bào nội mạc nhỏ hơn, nhân đậm màu hơn tế bào ống cổ tử cung. Chúng thường xuất hiện thành mảng 3 chiều. Các mảng tế bào nội mạc bong ra thưởng kèm theo tế bào hạt, tế bào mô liên kết và mô bào.
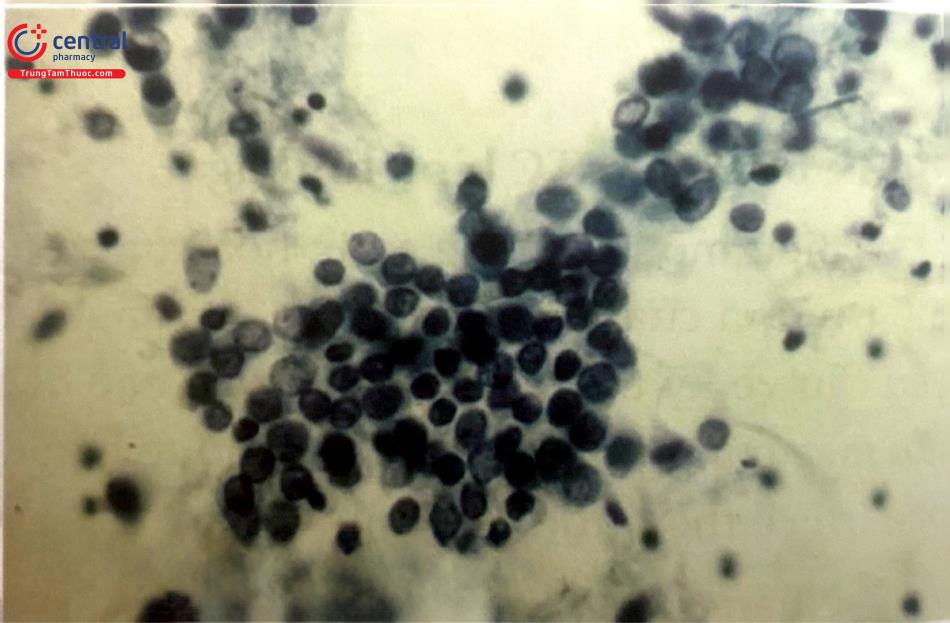
5.4 Tế bào học viêm nhiễm và thoái hóa
Khuẩn chí Lactobacilli bình thường: Khoảng 7 loại lactobacilli khác nhau có thể được tìm thấy trong khuẩn chí âm đạo người khỏe mạnh. Lactobacilli là các vi khuẩn Gram dương có chiều dài khác nhau, sản xuất Acid Lactic (pH 3,8-4,8) có chức năng bảo vệ âm đạo. Về cơ bản chỉ có lactobacilli có thể sống trong môi trường pH này, do đó phòng ngừa sự phát triển của các vi khuẩn có hại khác. Các hiện tượng sinh bệnh lý của phản ứng viêm thường rõ ràng trên bệnh phẩm tế bào.
Viêm cấp: Dịch xuất tiết giàu bạch cầu đa nhân.
Viêm mạn: Cùng với bạch cầu xuất hiện thêm lympho bào, mô bào và tương bào. Tự bản thân bạch cầu không nhất thiết biểu hiện cho một phản ứng viêm. Ở một số giai đoạn như trước và sau hành kinh, sự hiện diện của bạch cầu là hoàn toàn sinh lý.
Mô bào khổng lồ thường gặp trên phiến đồ thiểu dưỡng của phụ nữ hậu mãn kinh.
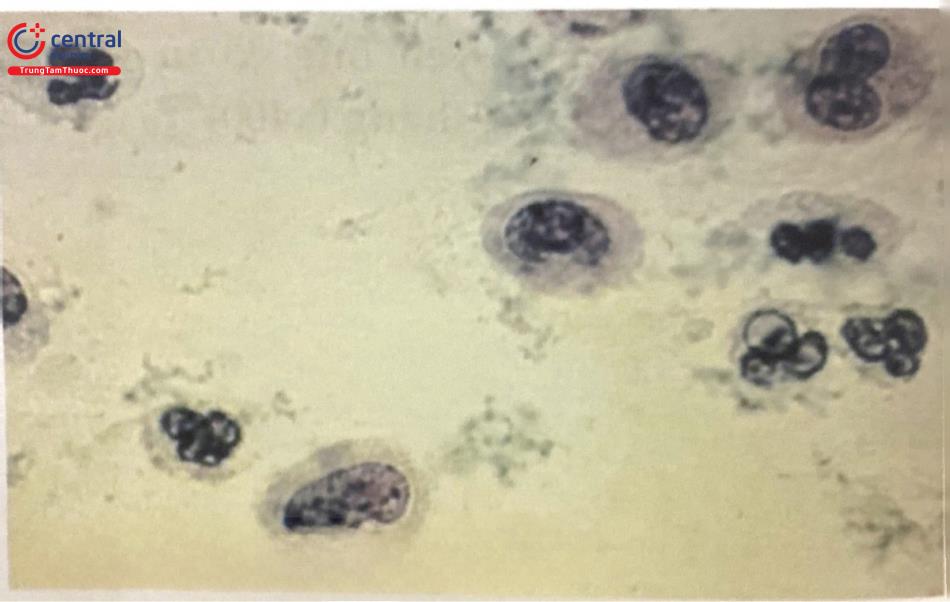
Viêm cổ tử cung dạng nang lympho: Một số hiếm các trường hợp có sự hình thành các nang lympho trưởng thành trong lớp mô liên kết dưới biểu mô cổ tử cung. Về mặt tế bào sẽ tìm thấy chuỗi của các lympho bào. Một dấu hiệu chẩn đoán đặc biệt là hình ảnh bầu trời sao, trên phiến đồ, kết quả của sự thực bào bởi các mô bào chứa các thể thực bào.
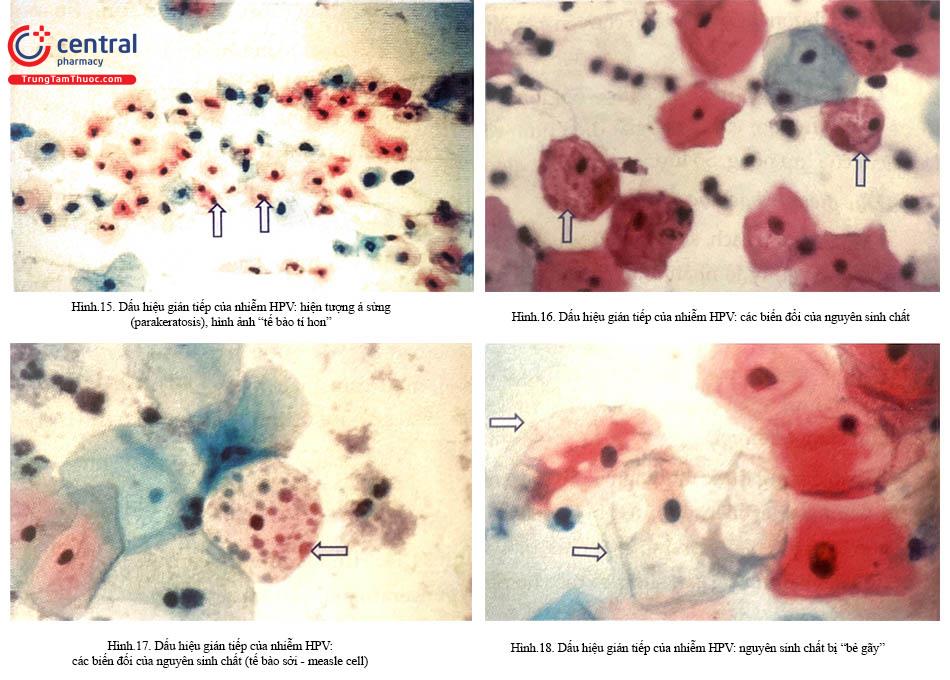
5.5 Nhiễm Human Papillomavirus (HPV)
Ngày nay, nhiễm HPV là chẩn đoán hình thái học phổ biến nhất của biểu mô lát cổ tử cung. Chỉ có hình ảnh “koilocyte” là bằng chứng tế bào tuyệt đối của nhiễm HPV. Một cách điển hình, các tế bào nông hoặc trung gian hiện diện với một nhân bất điển hình lớn, đôi khi có nếp. Các nhân này được bao quanh bởi một khoang rộng và có bờ rõ. Một dạng tế bào thứ hai khác cũng thường được quan sát thấy trong nhiễm HPV là hiện tượng được gọi là “loạn sừng” luôn xảy ra theo từng đám, các đám tế bào nông, ái toan phân bố ba chiều với nhân đông. Chúng thường phối hợp với koilocyte.
5.6 Sự chết của tế bào
Được biểu hiện trên bệnh phẩm tế bào bởi:
Karyorrhexis: sự phân mảnh của chất nhiễm sắc
Tiêu nhân: sự đồng nhất của chất nhiễm sắc và ly giải nhân sau đó
Nhân đồng; sự cô đặc cấu trúc nhân
Không bào hóa nguyên sinh chất

5.7 Các phản ứng tăng sinh lành tính
5.7.1 Biểu mô tái tạo
Sau khi biểu mô bị phá hủy, một quá trình tái tạo được bắt đầu. Các tế bào mới thay thế biểu mô bị phá hủy. Các tế bào tạo nên các mảng vôi hóa ranh giới tế bào rõ. Các hạch nhân lớn là một hình ảnh điển hình. Nhân lớn ra.
Hình 12. Tế bào từ biểu mô tái tạo (x400)
5.7.2 Chuyển sản lát non và trưởng thành
Sự hiện diện của tế bào chuyển sản của vùng chuyển tiếp là một hình ảnh thường gặp. Các tế bào thường đơn độc nhưng đôi khi xuất hiện dưới dạng đám có liên kết lỏng lẻo. Ranh giới tế bào dễ nhìn và tế bào thường được phân cách với nhau bằng một khoảng ngắn.
Các kích thích cơ học, thực thể và hóa học vào biểu mô tuyến dẫn đến sự tăng sinh của các tế bào dự trữ, chúng sẽ biệt hóa thành tế bào chuyển sản non rồi sau đó là chuyển sản trưởng thành. Hình ảnh đặc hiệu là giống dạng khảm. Trong trường hợp thương tổn nằm giữa biểu mô tuyến các tế bào dự trữ có thể biệt hóa thành tế bào tuyến và thay thế mô tuyến bị tổn thương.
Hình 13. Tế bào chuyển sản lát, độ trưởng thành trung bình (x1000)
5.7.3 Quá sừng
Sự sừng hóa của biểu mô lát bình thường không sừng hóa được đến các tế bào nông sùng hóa và các tế bào bong không nhân trên tiêu bản. Một “bóng nhân” có thể còn thấy ở vùng trước đó là nhân. Nguyên sinh chất nhuộm màu ái toan mạnh, màu cam hoặc vàng. Tế bào nóng với các hạt keratohyalin ái toan hoặc ái kiềm trong nguyên sinh chất cũng có thể hiện diện.
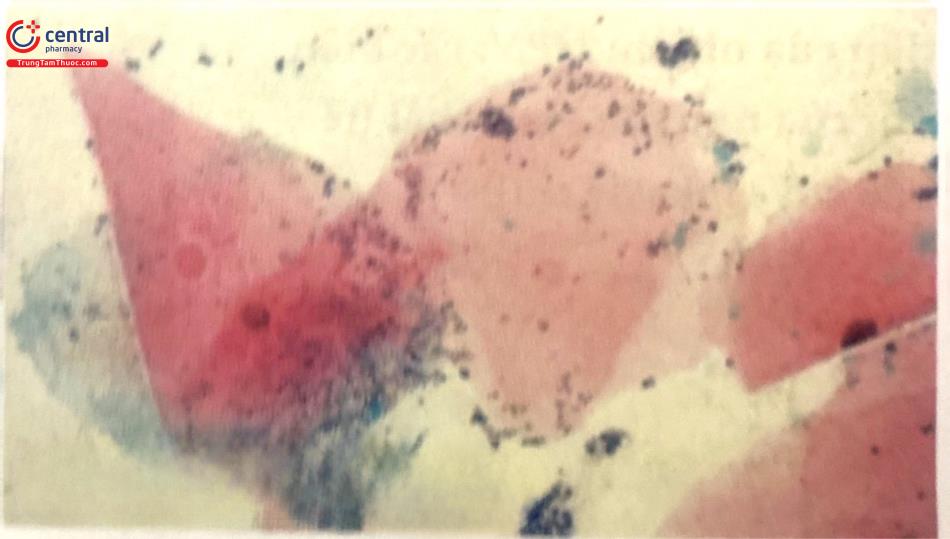
5.7.4 Cận sừng (Á sừng)
Tế bào á sừng được định nghĩa phù hợp nhất là “các hình ảnh tí hon của tế bào nông”. Chúng xuất hiện đơn độc hoặc thành mảng với ranh giới rõ và cực nhân được bảo toàn tốt. Nguyên sinh chất nhuộm màu đỏ vàng hoặc cam đậm. Nhân nhỏ và đông lại. Hiện tượng cận sừng có thể che phủ một biểu mô lát bình thường hoặc một bệnh lý nặng hơn.
5.8 Tân sinh trong biểu mô cổ tử cung (loạn sản)
Về mô học, loạn sản được phân thành các mức độ nhẹ - CIN I, trung bình - CIN II, nặng - CIN III. Loạn sản nhẹ (LSIL, CIN I) có một tỷ lệ thoái triển tự phát cao. Loạn sản trung bình (HSIL, CIN II) và loạn sản nặng (HSIL CIN III) thường tiến triển thành ung thư trong liên bào nhiều hơn loạn sản nhẹ.
Loạn sản nhẹ (LSIL): Phiến đồ chỉ chứa số lượng ít các tế bào loạn sản nhẹ, đa số chúng tương ứng với lớp tế bào nồng (Hình 34.19),
Loạn sản trung bình (HSIL); Số lượng tế bào loạn sản và mức độ bất thường nguyễn sinh chất và nhân gia tăng. Tế bào loạn sản xuất phát từ lớp trên và giữa biểu mô lát bình thường hoặc biểu mô chuyển sản lát. Chúng có thể biểu hiện các dấu hiệu sừng hóa.
Loạn sản nặng (HSIL): Ngược với loạn sản nhẹ và trung bình, loạn sản nặng được đặc trưng bởi các tế bào bất điển hình rõ rệt của các lớp sâu bên cạnh tế bào loạn sản của lớp nông. Số lượng tế bào bất điển hình gia tăng.
Đặc điểm tế bào học của loạn sản
Nền tiêu bản sạch, sự phân bố tế bào chủ yếu là đơn độc, đôi khi thành mảng. Nhân lớn rõ rệt, tỷ lệ nhân/nguyên sinh chất tăng mạnh. Chất nhiễm sắc đa số là ưu sắc, dạng mịn đồng nhất và có hạt nhiễm sắc. Không có hạt nhân.
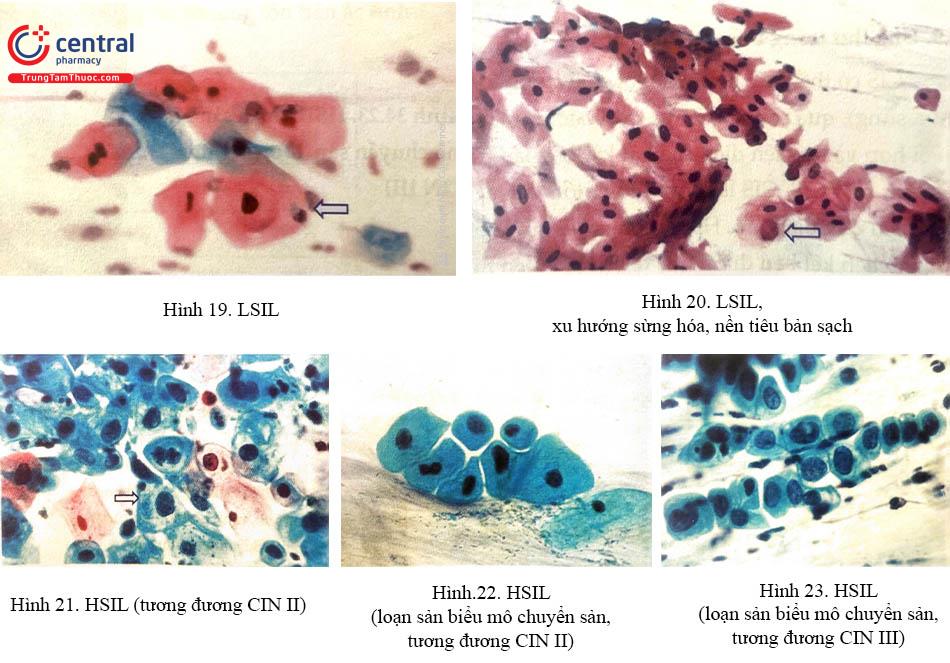
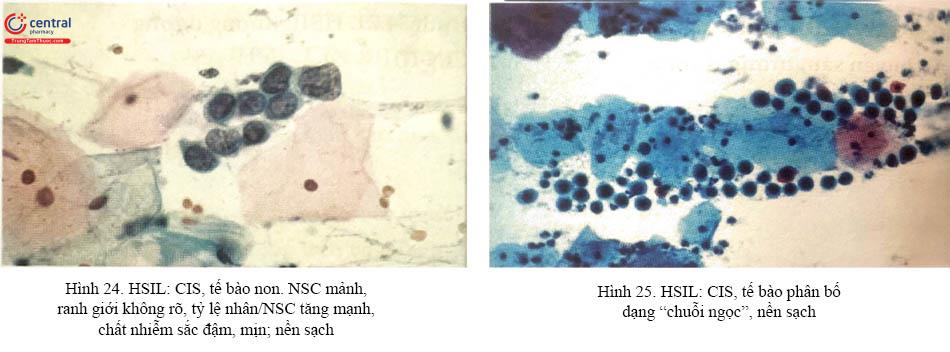
5.9 Ung thư trong biểu mô (tại chỗ)
CIS có thể phối hợp với một số thương tổn khác như loạn sản, tăng sừng hóa (quá sừng), quá sản tế bào dự trữ hoặc chuyển sản. Do vậy, thường gặp hình ảnh phối hợp và sự hiện diện của bất kỳ loại nào trong các thương tổn này đều không loại trừ một CIS. CIS là một thương tổn tiền ác tính được xác định rõ, chiếm toàn bộ chiều dày biểu mô. Hiện tượng phân tầng bị mất hoàn toàn. Không có sự xâm lấn mô liên kết bên dưới. Các tế bào bất điển hình nặng. Hình ảnh tế bào học nền tiêu bản sạch, mỗi tiêu bản có trên 500 tế bào bất điển hình. Kích thước tế bào nhỏ, tỷ lệ nhân/nguyên sinh chất rất cao (đặc biệt cao). Chất nhiễm sắc ưu sắc, dạng hạt thô đồng nhất hoặc nguyên sinh chất dạng hạt mịn đồng nhất, không có hạt nhân.
Biến đổi biểu mô | Loạn sản | CIS | Vi xâm lấn |
Đa hình thái tế bào và nhân | 10% | 12% | 72% |
Mất tính phân cực của nhân | 8% | 10% | 61% |
Rối loạn sự trưởng thành biểu mô | 14% | 6% | 68% |
Nhân mở | 6% | 8% | 39% |
Hạt nhân | 2% | 6% | 61% |
5.10 Ung thư tế bào lát xâm lấn
Ung thư tế bào lát cổ tử cung được phân thành:
Ung thư tế bào lát không sừng hóa, tế bào lớn.
Ung thư tế bào lát sừng hóa.
Ung thư tế bào lát không biệt hóa, tế bào nhỏ.
Sự hiện diện của CIS hoặc loạn sản tại rìa của một tổn thương xâm lấn là hiện tượng thường gặp.
Các hình ảnh tế bào điển hình nhất của ung thư tế bào lát xâm lấn:
Trong khi nền tiêu bản của loạn sản nặng và CIS sạch thì ung thư xâm lấn thể hiện một “nền bẩn”: với bạch cầu, hồng cầu, vi khuẩn và sản phẩm thoái hóa (hoại tử u). Số lượng tế bào rất lớn. Kích thước tế bào thay đổi. Nguyên sinh chất thường nhiều hơn so với CIS. Chất nhiễm sắc dạng hạt thô rõ, có kết khối chất nhiễm sắc. Nhân đông. Hạt nhân nhỏ gặp một cách rộng rãi. Hạt nhân lớn hiếm gặp trong ung thư tế bào lát sừng hóa. Tế bào ác tính của ung thư tế bào xâm lấn biểu hiện kích thước tế bào và nhân to nhỏ khác nhau rõ rệt. Trong ung thư tế bào lát có hiện tượng tế bào đa hình thái rộng và nhiều tế bào khổng lồ dạng kéo dài hoặc mảnh đôi khi cũng được tìm thấy,
| CIS | Ung thư vi xâm lấn | Ung thư xâm lấn |
Số lượng tế bào bất điển hình Tế bào đơn độc Mảng tế bào Hợp bào | + +++ (-) + | ++ + + +++ | +++ ++ (+) ++ |
Chất chiến sắc Dạng hạt thô đồng nhất Dạng hạt mịn đống nhất Dạng hạt thô không đồng nhất |
+++ - - |
+ + (+) |
- + +++ |
Hạt nhân Hạt nhân nhỏ Hạt nhân lớn | - - - | + +++ + | ++ ++ ++++ |
Hoại tử khối u | - | (+) | ++++ |
Tỷ lệ bất thường tế bào học | |||
Loại chấn đoán | Số phòng xét nghiệm | Trung bình (%) | 50th bách phân vị |
LSIL | 243 | 2,06 | 1,4 |
HSIL+ | 233 | 0,7 | 0,4 |
ASC-US | 237 | 3,81 | 3,1 |
ASC-H | 148 | 0,48 | 0,1 |
ASC/SIL+ | 220 | 1,82 | 1,44 |
6 DANH PHÁP TẾ BÀO HỌC PHỤ KHOA
6.1 Danh pháp Papanicolaou
Việc phân loại các hình thái sinh lý và bệnh lý trong tế bào học phụ khoa được bắt đầu bởi Papanicolaou. Ông đã sử dụng các ký hiệu P-I, P-II, P-III, thỉnh thoảng là P-II+, P-IIIa, P-IIIb, P-IIIc,... để đánh dấu ngay trên các tiêu bản. Năm 1943 Papanicolaou và Traut đưa ra bảng phân loại với 5 nhóm như chúng ta đã biết. Tại Hoa Kỳ, nơi tế bào học phụ khoa được đưa vào ứng dụng trong lâm sàng rất sớm, từ cuối thập niên 50 của thế kỷ XX, nhiều nhà tế bào học nổi tiếng khác như J. Reagan, S. Patten lại không sử dụng danh pháp này mà đưa ra các danh pháp riêng của mình. Nhiều nước trên thế giới đã chấp nhận và sử dụng danh pháp Papanicolaou trong một thời gian dài. Tuy vậy, cách xếp loại theo 5 nhóm của Papanicolaou có nhược điểm là không đi sâu được vào chi tiết của các thương tổn khác nhau, do đó không đáp ứng được đầy đủ yêu cầu đặt ra bởi các bác sĩ lâm sàng. Vì vậy, về sau nhiều nước đã lập nên hệ thống danh pháp riêng trên cơ sở danh pháp Papanicolaou.
Nhóm | Chẩn đoán |
I | Phiến đồ bình thường |
II | Phiến đồ viêm và các biến đổi lành tính khác |
III | Phiến đồ “nghi ngờ |
IV | Phiến đồ hiện diện các tế bào ác tính |
V | Phiến đồ ung thư với số lượng lớn các tế bào ác tính |
6.2 Danh pháp Munich II
Danh pháp Munich được đưa ra lần đầu năm 1975, được chấp nhận và sự dụng tại Đức, Áo, Thụy Sĩ. Danh pháp này đã được sửa đổi và bổ sung 2 lần, lần đầu vào năm 1989 và lần mới nhất vào năm 1998. Trong lần bổ sung gần nhất, các khuyến cáo về phương pháp xử trí, đặc biệt là sử dụng phương pháp soi cổ tử cung đã được đưa thêm vào. Về cơ bản, danh pháp Munich sử dụng danh pháp Papanicolaou nhưng phân chia thành nhiều nhóm nhỏ hơn, đặc biệt là đối với các thương tổn loạn sản, ung thư trong liên bào và nghi ngờ xâm lấn.
6.3 Danh pháp Bethesda
Cho đến giữa thập niên 80 của thế kỷ XX, ngay tại Hoa Kỳ vẫn tồn tại song song nhiều hệ thống danh pháp khác nhau trong mô tả kết quả tế bào cổ tử cung. Với mục đích thống nhất cách phân loại và đưa ra các khuyến cáo thực tế cho các nhà lâm sàng, danh pháp Bethesda đã được đưa ra lần đầu tiên năm 1988, được bổ sung và minh họa chi tiết lần thứ hai vào năm 1991. Sau một thập niên sử dụng tại Hoa Kỳ và ở khá nhiều quốc gia khác trên thế giới, bản sửa đổi lần 2 này cũng đã bộc lộ một số khiếm khuyết, đặc biệt trong các phân nhóm có hình ảnh ác tính không rõ ràng và phân nhóm các thương tổn tế bào tuyến. Do đó, danh pháp Bethesda đã được sửa chữa bổ sung lại lần thứ ba vào năm 2001. Tại Hoa Kỳ, cũng đã xuất hiện xu hướng mô tả kết quả mô học cổ tử cung theo bảng phân loại tương tự như danh pháp dùng cho tế bào học với một số thay đổi nhỏ (The modified Bethesda system for reporting cervical pathology). Trên cơ sở phân loại tế bào học và mô học, các hiệp hội chuyên ngành đã đưa ra khuyến cáo xử trí phù hợp (ASCCP: American Society for Colposcopy and Cervical Pathology).
Danh pháp Besthesda được cập nhật lần gần nhất vào năm 2014.
1. LOẠI BỆNH PHẨM Nêu rõ bệnh phẩm được lấy bằng phương pháp phết cổ điển (phết trực tiếp) hoặc tế bào nhúng dịch hoặc phương pháp khác. 2. TÍNH THỎA ĐÁNG CỦA BỆNH PHẨM - Đạt yêu cầu để đánh giá (mô tả việc có hay không thành phần tế bào của vùng chuyển tiếp/ống cổ tử cung và những thành phần tế bào khác có giá trị chẩn đoán, hoặc có nhiều hồng cầu hoặc các tế bào viêm che phủ). - Không đạt yêu cầu để đánh giá... (nêu rõ lý do). + Bệnh phẩm bị loại bỏ, không được xử lý (nêu rõ lý do). + Bệnh phẩm đã xử lý và khảo sát nhưng không thỏa đáng cho việc đánh giá bất thường biểu mô vì... (nêu rõ lý do). 3. PHÂN LOẠI CHUNG (không bắt buộc) - Không có tổn thương trong biểu mô hoặc ác tính. - Những kết quả khác: xem ở phần Diễn giải/kết quả (ví dụ có tế bào nội mạc trên phiến đồ phụ nữ ≥ 45 tuổi). - Bất thường tế bào biểu mô: xem ở phần Diễn giải/kết quả (ghi rõ “vảy” hoặc “tuyến” khi cần). 4. DIỄN GIẢI/ KẾT QUẢ KHÔNG CÓ TỔN THƯƠNG TRONG BIỂU MÔ HOẶC ÁC TÍNH (Nếu không có bằng chứng tế bào về tổn thương tân sinh cần ghi rõ trong phần Phân loại chung ở trên và/hoặc trong phần Diễn giải/kết quả của Phiếu trả lời kết quả; việc có hay không các vi sinh vật hoặc các kết quả không tân sinh khác) Các kết quả không tân sinh (không bắt buộc báo cáo) - Các thay đổi tế bào không tân sinh: + Chuyển sản lát. + Các thay đổi sừng hóa. + Chuyển sản vòi tử cung. + Thiểu dưỡng. + Các thay đổi liên quan đến thai nghén. - Các thay đổi tế bào dạng phản ứng liên quan + Phản ứng viêm (bao gồm sửa chữa mô). + Viêm cổ tử cung (nang) lympho. + Xạ trị. + Dụng cụ tử cung. - Tình trạng tế bào tuyến sau cắt tử cung Vi sinh vật - Trichomonas vaginalis. - Nấm có hình thái phù hợp Candida. - Thay đổi khuẩn chí phù hợp với viêm âm đạo tạp khuẩn (bacterial vaginosis). - Vi khuẩn có hình thái phù hợp với Actinomyces. - Thay đổi tế bào phù hợp với virus Herpes. - Thay đổi tế bào phù hợp với Cytomegalovirus. KHÁC - Tế bào nội mạc (ở phụ nữ ≥ 45 tuổi). (Ghi rõ nếu “không có tổn thương trong biểu mô vảy”). BẤT THƯỜNG TẾ BÀO BIỂU MÔ Tế bào vảy - Tế bào vảy bất điển hình: + Ý nghĩa chưa xác định (ASC-US). + Không loại trừ HSIL (ASC-H). - Tổn thương nội biểu mô vảy độ thấp (LSIL) (bao gồm tổn thương do nhiễm HPV/loạn sản nhẹ/CIN 1). - Tổn thương nội biểu mô vảy độ cao (HSIL) (bao gồm loạn sản trung bình và nặng, CIS; CIN 1 và CIN 3). - Với hình ảnh nghi ngờ ung thư xâm nhập (nếu nghi ngờ có xâm nhập). - Ung thư tế bào vảy. Tế bào tuyến - Tế bào tuyến không điển hình: + Tế bào ống cổ tử cung (không định loại hoặc nếu rõ thì nêu cụ thể). + Tế bào tuyến nội mạc tử cung (không định loại hoặc nếu rõ thì nêu cụ thể). + Tế bào tuyến (không định loại hoặc nếu rõ thì nêu cụ thể). - Tế bào tuyến không điển hình thiên về tân sản, gồm: + Tế bào tuyến ống cổ tử cung. + Tế bào mô tuyến. - Ung thư biểu mô tuyến cổ tử cung tại chỗ (AIS). - Ung thư biểu mô tuyến (xâm nhập). + Biểu mô tuyến ống cổ tử cung. + Biểu mô tuyến nội mạc tử cung. + Từ một cơ quan ngoài tử cung. + Không rõ nguồn gốc. Các tổn thương tân sinh ác tính khác. 5. CÁC XÉT NGHIỆM BỔ SUNG Mô tả ngắn gọn phương pháp xét nghiệm và báo cáo kết quả theo cách nhà lâm sàng có thể hiểu dễ dàng. 6. DIỄN GIẢI TẾ BÀO CỔ TỬ CUNG BẰNG MÁY TÍNH Nếu được khảo sát bằng một hệ thống tự động cần ghi rõ tên hệ thống và kết quả. 7. GHI CHÚ VỚI MỤC ĐÍCH ĐÀO TẠO VÀ BÌNH LUẬN ĐÍNH KÈM BẢN KẾT QUẢ TẾ BÀO (không bắt buộc) Các gợi ý cần được trình bày súc tích và phù hợp các hướng dẫn theo dõi lâm sàng do các tổ chức nghề nghiệp công bố (có thể trích dẫn các công bố liên quan). |
7 TÀI LIỆU THAM KHẢO
1. Châu Khắc Tú, Nguyễn Vũ Quốc Huy, Ung thư cổ tử cung: từ dự phòng đến can thiệp sớm, Nhà xuất bản Đại học Huế, 2011.
2. Nguyễn Vũ Quốc Huy và cộng sự (2008), “Phát hiện thương tổn tiền ung thư và ung thư cổ tử cung bằng phương pháp quan sát cổ tử cung sau bôi acid axetic”, Tạp chí Phụ sản, 7(2):58-65.
3. Nguyễn Vũ Quốc Huy (2010), “Dự phòng ung thư cổ tử cung dựa trên bằng chứng: cập nhật 2010”, Tạp chí Phụ sản (8)2-3:25-34.
4. Phạm Thị Cẩm Tú, Nguyễn Vũ Quốc Huy (2011), “Giá trị của một số phương pháp thăm dò và chẩn đoán tổn thương tiền ung thư và ung thư cổ tử cung”, Tạp chí Phụ sản, (9)1:22-29.
5. Nguyễn Viết Tiến, Lưu Thị Hồng, Nguyễn Vũ Quốc Huy (2011), “Dự phòng ung thư cổ tử cung: Từ bằng chứng khoa học đến chính sách y tế”, Tạp chí Phụ sản 9(3): 1-9,
6. Nguyễn Vũ Quốc Huy, Lê Minh Tâm, Trương Quang Vinh, Đặng Công Thuận, Cao Ngọc Thành, “Sàng lọc tổn thương tiền ung thư và ung thư cổ tử cung bằng xét nghiệm tế bào cổ tử cung”, Tạp chí Phụ sản, 2013,11(1):50-59.
7. Võ Văn Khoa, Trương Quang Vinh, Đặng Công Thuận, Nguyễn Khoa Nguyên, Nguyễn Vũ Quốc Huy, “Sàng lọc các tổn thương tiền ung thu và ung thu cổ tử cung bằng xét nghiệm tế bào cổ tử cung và test VIA tại tuyến y tế cơ sở”, Tạp chỉ Khoa học Đại học Huế 2014, 89(1):45-57.
8. Nguyen Vu Quoc Huy, Le Minh Tam, Ngo Viet Quynh Tram, Dang Cong Thuan, Truong Quang Vinh, Cao Ngọc Thanh, Linus Chuang. The value of visual inspection with acetic acid and Pap smear in cervical cancer screening program in low resource settings - A population-based study. Gynecologic Oncology Reports. Gynecologic Oncology Reports 24 (2018) 18-20.
9. Ritu Nayar R, Wilbur DC, The Pap Test and Bethesda 2014. Acta Cytologica 2015;59:121-132.
10. Ng A.B.P. and Reagan J, Compendium on Diagnostic Cytology, 1997, Tutorials of Cytology, Chicago, IL, USA.
11. Davey DD, Neal MH, Wilbur DC, Colgan TJ, Styer PE, Mody DR. Bethesda 2001 Implementation and Reporting Rates: 2003 Practices of Participants in the College of American Pathologists Interlaboratory Comparison Program in Cervicovaginal Cytology. Arch Pathol Lab Med. 2004;128:1224-1229.

