Tầm quan trong của hoàng thể và phác đồ hỗ trợ hoàng thể trong chu kỳ
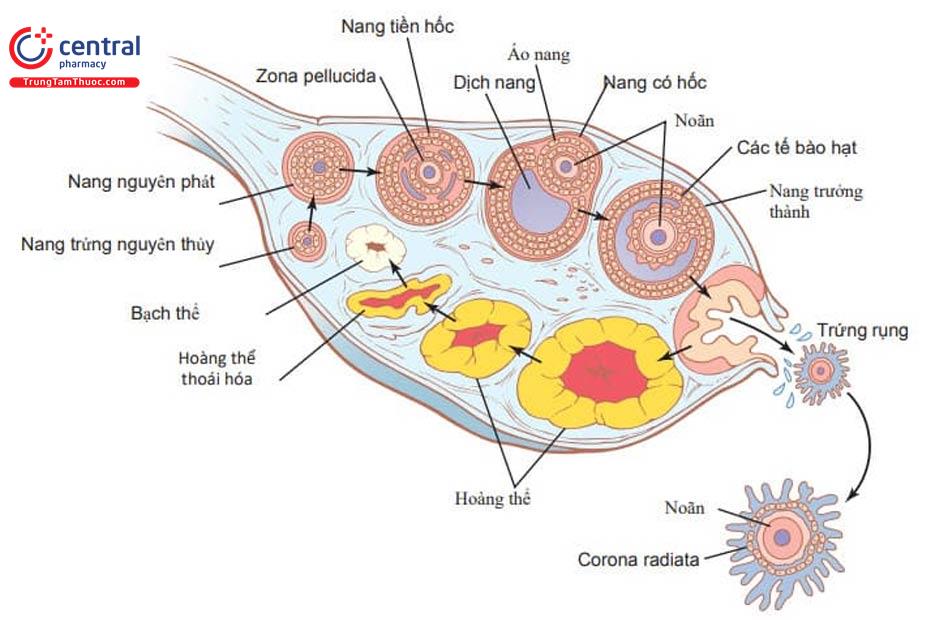
Nguồn: Các vấn đề trọng yếu trong hỗ trợ sinh sản
Chủ biên: PGS.TS.BS. Lê Minh Tâm
Tham gia soạn biên
GS.TS.BS. Cao Ngọc Thành
ThS.BS. Trần Thị Như Quỳnh
ThS.BS. Nguyễn Đắc Nguyên
1 Tổng quan
Kỹ thuật hỗ trợ sinh sản (Assisted Reproductive Technologies - ART) là phương pháp được chấp nhận rộng rãi để điều trị cho các cặp vợ chồng vô sinh. Sự gia tăng mạnh nồng độ steroid sinh dục do quá trình kích thích buồng trứng trong các chu kỳ thụ tinh ống nghiệm được cho là nguyên nhân gây ra tình trạng ức rối loạn hormone giai đoạn hoàng thế, làm rút ngắn giai đoạn hoàng thể do hậu quả của sự sụt giảm hormone.
Các thuốc hỗ trợ hoàng thể ngoại sinh bao gồm: progesterone, hCG, estrogen, chất đồng vận GnRH sử dụng đơn thuần hoặc kết hợp đã được dùng để bù đắp cho sự thiếu hụt này. Tuy nhiên, vẫn còn nhiều tranh luận xung quanh câu hỏi phác đồ hỗ trợ hoàng thể nào là tối ưu trong các chu kỳ chuyển phôi. Do vậy, tổng hợp các bằng chứng lâm sàng trực và gián tiếp là cần thiết để có thể đưa ra lựa chọn phác đồ phù hợp, cụ thể hóa điều trị.
2 Chức năng sinh lý hoàng thể bình thường và thiếu hụt
2.1 Chức năng sinh lý hoàng thể
Trong các chu kỳ tự nhiên, hoàng thể tiết ra progesterone để tạo thuận lợi cho sự làm tổ và duy trì thai kỳ, cho đến khi nhau thai có đủ khả năng chế tiết progesterone thay thế hoàng thể. Nếu loại bỏ hoàng thể trước khi nhau thai phát triển đầy đủ chức năng sẽ dẫn đến sẩy thai tự nhiên. Sinh lý giai đoạn hoàng thể bình thường có một số đặc điểm:
Chiều dài giai đoạn hoàng thể điển hình tương đối cố định ở 12 - 14 ngày nhưng có thể dao động từ 11 - 17 ngày.
Mức progesterone đạt đỉnh trong các chu kỳ không có thai kéo dài từ 6 - 8 ngày sau khi phóng noãn.
Progesterone được tiết ra theo xung dưới sự kiểm soát của LH.
Sự sản xuất progesterone của hoàng thể rất linh hoạt, được tiết ra để đáp ứng với các xung LH; xung progesterone rõ ràng hơn ở giữa và cuối pha hoàng thể, và mức progesterone có thể tăng lên gấp tám lần trong vòng 90 phút.
Phản ứng của nội mạc tử cung là sự phản ánh của estrogen pha nang noãn và của estrogen cùng progesterone pha hoàng thể. Sự sản xuất và chế tiết các hormone này phụ thuộc vào sự phát triển ở giai đoạn nang noãn, sự phóng noãn và chức năng của hoàng thể trong giai đoạn hoàng thể.
Khi có hiện tượng làm tổ của phôi, progesterone sẽ được hoàng thể tiết ra phụ thuộc vào nồng độ hCG của nguyên bào nuôi.
Nếu nồng độ hCG không tăng phù hợp sẽ trực tiếp dẫn đến suy hoàng thể và giảm mức progesterone.
2.2 Thiếu hụt chức năng hoàng thể
Thiếu hụt giai đoạn hoàng thể (Luteal Phase Deficiency - LPD) lần đầu tiên được mô tả vào năm 1949 đề cập một giai đoạn hoàng thể bất thường. Do tầm quan trọng của giai đoạn hoàng thể trong việc hình thành và duy trì một thai kỳ bình thường thiếu hụt giai đoạn hoàng thể được cho là nguyên nhân gây ra sẩy thai, đặc biệt là sẩy thai liên tiếp. Quy ước, được xem là LPD khi trên lâm sàng giai đoạn hoàng thể có độ dài ≤ 10 ngày, một số định nghĩa khác dùng mốc ≤ 11 ngày và ≤ 9 ngày. Định nghĩa sinh hóa cũng đã được đề xuất dựa trên nồng độ progesterone thấp trong giai đoạn hoàng thể. Thường các xét nghiệm sinh hóa và lâm sàng đã phối hợp để chẩn đoán LPD.
Về ý nghĩa lâm sàng của LPD, do progesterone của buồng trứng là rất cần thiết để mang thai trong tử cung bình thường, tình trạng LPD có khả năng gây vô sinh hoặc sẩy thai là giải thích hợp lý. Mặc dù nồng độ progesterone có sự biến động lớn trong giai đoạn hoàng thể, một số nghiên cứu đã ghi nhận sự gia tăng nhanh hơn của progesterone và mức độ estrogen và progesterone giữa hoàng thế cao hơn trong các chu kỳ có thụ thai so với các chu kỳ không xảy ra thụ thai, mặc dù tác động ban đầu của hCG từ phôi thai trong chu kỳ có thụ thai không thể bị loại trừ hoàn toàn. Ngoài ra, đặc điểm giai đoạn hoàng thế giống nhau ở cùng một phụ nữ trong các chu kỳ mang thai thành công so với các chu kỳ có kết cục sẩy thai sớm.
LPD cũng được cho là có liên quan đến vô sinh, sẩy thai trong ba tháng đầu, chu kỳ kinh nguyệt ngắn và ra máu tiền kinh nguyệt. Điều quan trọng là LPD cũng đã được chẩn đoán trong các chu kỳ ngẫu nhiên của phụ nữ có kinh nguyệt bình thường. Nhìn chung, vẫn chưa rõ liệu chức năng hoàng thể bất thường có phải là nguyên nhân độc lập gây ra sự thất bại trong quá trình làm tổ hoặc mất thai sớm trong chu kỳ tự nhiên hay không.
3 Các tình trạng gây rối loạn hoàng thể
3.1 Các rối loạn không liên quan đến hỗ trợ sinh sản
Về lý thuyết, các tình trạng bệnh lý làm rối loạn GnRH và xung LH có thể dẫn đến LPD. Chẳng hạn, các tình trạng có liên quan đến LPD bao gồm vô kinh do suy vùng dưới đồi, rối loạn ăn uống, luyện tập thể lực quá mức, sút cân, căng thẳng, béo phì, hội chứng buồng trứng đa nang, lạc nội mạc tử cung, lão hóa, thiếu hụt 21-hydroxylase không được chẩn đoán hoặc điều trị phù hợp, rối loạn chức năng tuyến giáp, tăng prolactin máu, kích thích buồng trứng đơn thuần và chu kỳ hỗ trợ sinh sản. Những nghiên cứu đã công bố sử dụng các tiêu chuẩn LPD khác nhau dẫn đến khó khăn trong chẩn đoán.
Rối loạn tuyến giáp và prolactin có thể làm rối loạn chế tiết GnRH và làm thay đổi chức năng hoạt động trục dưới đồi - tuyến yên - buồng trứng. Sự tăng tiết hormone giải phóng thyrotropin trong bệnh cường giáp có thể dẫn đến tăng prolactin máu do tăng sản xuất và tiết prolactin từ tế bào lactotroph. Tăng prolactin máu có thể ức chế bài tiết GnRH trực tiếp bằng cách tác động lên các thụ thể prolactin tế bào thần kinh GnRH hoặc gián tiếp bằng cách tăng mức độ dopamine và peptide opioid ở vùng dưới đồi.
ASS IN SU Sleek Full- featured, thin light design OPL Các tình trạng khác có liên quan đến thay đổi nồng độ progesterone hoàng thể như ghép thận, tăng nồng độ beta-endorphin và cho con bú. Béo phì có liên quan đến giảm khả năng sinh sản và tăng tỷ lệ sẩy thai. Nghiên cứu ghi nhận có sự thay đổi độ dao động LH (giảm biên độ xung LH) và giảm bài tiết glucuronid (chất chuyển hóa chính của progesterone) trong giai đoạn hoàng thể ở phụ nữ béo phì so với những phụ nữ kiểm soát cân nặng bình thường.
Tuổi lớn cũng có liên quan bất thường chức năng giai đoạn hoàng thể. Các nghiên cứu ghi nhận sự giảm sản xuất progesterone và thiếu hụt progesterone và Estradiol giai đoạn hoàng thể ở phụ nữ lớn tuổi. Tuy nhiên, giảm dự trữ buồng trứng không liên quan đến LPD, khi hiệu chỉnh theo tuổi.
3.2 Các rối loạn liên quan đến hỗ trợ sinh sản
Ngay từ thời kỳ đầu thực hiện hỗ trợ sinh sản, giai đoạn hoàng thể đã được báo cáo là có sự rối loạn, mặc dù cơ chế cơ bản chưa rõ ràng. Đầu tiên người ta cho rằng sự chọc hút noãn gây ra thiếu hụt ở giai đoạn hoàng thể và đặc biệt là sự tiết steroid, nhưng lý thuyết này đã bị bác bỏ khi Kerin (Kerin 1981) chứng minh rằng việc chọc hút một nang noãn không dẫn đến suy giảm chức năng steroid.
Thiếu LH được cho là do cơ chế phản + vòng ngắn sau khi dùng hCG để trưởng thành tế bào noãn. Lý thuyết này cũng bị bác bỏ, vì phản hồi âm trong thời gian dài của các estrogen buồng trứng có ảnh hưởng lớn hơn đến nồng độ LH, và hCG không làm giảm tiết LH ở phụ nữ rụng trứng bình thường.
Giả thuyết khác cho rằng việc điều trị với chất chủ vận GnRH gây ra trơ hoá tuyến yên kéo dài, dẫn đến thiếu LH, do đó hoàng thể không phát triển đầy đủ. Trong chu kỳ kích thích buồng trứng hỗ trợ sinh sản, tuyến yên của người phụ nữ cần được gây trơ hoá bằng thuốc để kiểm soát nồng độ LH nội sinh. FSH ngoại sinh giúp các nang noãn phát triển và không bị hoàng thể hoá sớm hay phóng noãn. Đặc biệt trong phác đồ dài sử dụng đồng vận GnRH, sự trơ hoá tuyến yên càng rõ nét và dẫn đến suy yếu hoạt động hoàng thể.
Gần đây, LPD được giải thích liên quan đến nồng độ LH bị giảm thấp do nồng độ steroid cao. Mức độ steroid cao do có nhiều nang noãn phát triển, nhiều hoàng thể được hình thành, tạo ra nhiều steroid hơn so với chu kỳ tự nhiên. Điều này gây ra phản hồi âm lên tuyến yên và làm giảm nồng độ LH. Bằng cách này, giai đoạn hoàng
thể bị rút ngắn (được gọi là ly giải hoàng thể sớm), và dẫn đến giảm cơ hội mang thai.
Vì mức progesterone thấp có thể làm giảm cơ hội làm tổ, nên giai đoạn hoàng thể của chu kỳ hỗ trợ sinh sản cần được hỗ trợ. Các phác đồ sử dụng gồm progesterone ngoại sinh được dùng đường uống, đặt âm đạo hoặc tiêm bắp, hCG (kích thích sản xuất progesterone) hoặc đồng vận GnRH. Chất đồng vận GnRH được cho là có thể khôi phục mức LH và hỗ trợ giai đoạn hoàng thể một cách tự nhiên.
4 Các phác đồ hỗ trợ hoàng thể
4.1 Progesterone
4.1.1 Giới thiệu
Progesterone đóng vai trò quan trọng trong sự chuyển dạng chế tiết nội mạc tử cung và hỗ trợ thai giai đoạn sớm. Sau kích thích buồng trứng trong chu kỳ thụ tinh ống nghiệm, sự chế tiết progesterone nội sinh của lớp tế bào hạt hoàng thể thường không đủ, có thể do tác dụng phân giải hoàng thể của GnRH đồng vận hoặc đối vận sử dụng trong quá trình kích thích hay chính việc hút tế bào hạt trong quá trình lấy noãn. Hơn nữa, vì mức độ progesterone tối ưu của hoàng thể sau khi điều trị IVF chưa được hiểu rõ, nên việc bổ sung là cần thiết để hỗ trợ quá trình làm tổ của phôi và tăng khả năng mang thai diễn tiến.
Hiệu quả hỗ trợ hoàng thể của progesterone dùng đường uống, tiêm bắp, đặt âm đạo hay tiêm dưới da với sinh khả dụng và khả năng dung nạp khác nhau vẫn đang được nghiên cứu, tuy vậy, không có phương thức hoặc phác đồ hỗ trợ duy nhất nào được xác định là có hiệu quả vượt trội. Progesterone vi hạt đặt âm đạo dưới dạng gel hoặc viên nang, hiện được ưa chuộng hơn dạng uống và tiêm bắp nhưng cũng cần quan tâm đến tác dụng phụ gây kích ứng âm đạo. Trong những năm gần đây, dydrogesterone đường uống với ưu điểm giúp giảm bớt sự bất tiện và tác dụng phụ do đặt âm đạo hoặc tiêm bắp, được chứng minh có tác dụng không thua kém progesterone vi hạt đã được chấp nhận để sử dụng trong hỗ trợ hoàng thể ở một số quốc gia.
4.1.2 Khuyến cáo
Progesterone được khuyến cáo sử dụng thường quy trong phác đồ hỗ trợ hoàng thể sau chu kỳ thụ tinh ống nghiệm.
Có thể sử dụng progesterone tự nhiên với các đường dùng khác nhau (trừ đường uống) để hỗ trợ hoàng thể.
Liều dùng progesterone tự nhiên có thể thay đổi theo kinh nghiệm lâm sàng:
- 50 mg/ngày đối với progesterone tiêm bắp.
- 25 mg/ngày đối với progesterone tiêm dưới da.
- 90 mg/ngày đối với progesterone dạng gel đặt âm đạo
- 200 mg x 3 lần/ngày đối với progesterone viên nang dầu đặt âm đạo.
- 100 mg x 2 - 3 lần/ngày đối với progesterone vi hạt đặt âm đạo.
- 400 mg x 2 lần/ngày đối với pessary progesterone.
Việc bổ sung progesterone nhằm tạo cửa sổ làm tổ phù hợp cho phôi, thường bắt đầu trong giai đoạn từ buổi tối ngày lấy noãn đến ngày thứ 3 sau khi lấy noãn.
Một nghiên cứu gần đây đã cho thấy, bổ sung progesterone từ ngày thứ 5 sau khi chuyển phôi có thể làm gia tăng đáng kể tỷ lệ mang thai tiếp diễn so với việc bổ sung sớm.
Nên bổ sung progesterone kéo dài ít nhất đến ngày thử thai.
4.1.3 Bằng chứng
Về hiệu quả: một phân tích tổng hợp của Cochrane về hiệu quả bổ sung Progesterone so với giả dược/không điều trị (từ 8 thử nghiệm ngẫu nhiên có đối chứng, 875 phụ nữ) gợi ý về lợi ích ở nhóm progesterone về tỷ lệ sinh sống hoặc tỷ lệ mang thai diễn tiến (OR 1,77, KTC 95% 1,09 - 2,86, 5 RCT, 642 phụ nữ, I2 = 35%, chất lượng bằng chứng rất thấp) nhưng không có bằng chứng rõ ràng về sự khác biệt khi sử dụng mô hình tác động ngẫu nhiên (OR 1,77, KTC 95% 0,96 - 3,26).
Về phác đồ sử dụng, nghiên cứu tổng hợp đánh giá tỷ lệ sinh sống hoặc thai diễn tiến như sau: tiêm bắp (IM) so với uống: OR 0,71, KTC 95% 0,14 - 3,66 (1 RCT, 40 phụ nữ, bằng chứng chất lượng rất thấp); IM so với âm đạo/trực tràng: OR 1,37, KTC 95% 0,94 - 1,99 (7 RCT, 2309 phụ nữ, I2 = 71%, bằng chứng chất lượng rất thấp); âm đạo/ trực tràng so với đường uống: OR 1,19, KTC 95% 0,83 - 1,69 (4 RCT 857 phụ nữ, I2 = 32%, bằng chứng chất lượng thấp); liều thấp so với liều cao đặt âm đạo: OR 0,97, KTC 95% 0,84 - 1,11 (5 RCT, 3720 phụ nữ, I2 = 0%, bằng chứng chất lượng trung bình); phác đồ ngắn và dài: OR 1,04, KTC 95% 0,79 - 1,36 (5 RCT, 1205 phụ nữ, I2 = 0%, bằng chứng chất lượng thấp); progesterone vi hạt so với tổng hợp: OR 0,9, KTC 95% 0,53 - 1,55 (2 RCT, 470 phụ nữ, I2 = 0%, bằng chứng chất lượng thấp); viên đặt âm đạo so với gel: OR 1,09, KTC 95% 0,88 - 1,36 (1 RCT, 1271 phụ nữ, bằng chứng chất lượng thấp); bôi da so với gel âm đạo: OR 0,92, KTC 95% 0,74 - 1,14 (2 RCT, 1465 phụ nữ, I2 = 0%, bằng chứng chất lượng thấp); âm đạo so với trực tràng: OR 1,28, KTC 95% 0,64 - 2,54 (một RCT, 147 phụ nữ, bằng chứng chất lượng rất thấp). Tỷ lệ OHSS chỉ được báo cáo cho hai nghiên cứu so sánh: IM so với đường uống, và đặt âm đạo liều thấp so với liều cao; nhìn chung không có bằng chứng về sự khác biệt giữa các phác đồ khác nhau.
Về thời gian bắt đầu sử dụng progesterone, có 6 nghiên cứu được tiến hành từ 1999 đến 2018 đã báo cáo rằng việc bổ sung progesterone vào ngày lấy noãn so với ngày sau khi lấy noãn trong chu kỳ chuyển phôi tươi đều không khác nhau về tỷ lệ thai sinh sống. Ba thử nghiệm lâm sàng so sánh tỷ lệ thai lâm sàng ở nhóm bắt đầu dùng progesterone vào buổi tối ngày lấy noãn với buổi tối ngày chuyển phôi lần lượt trên 103, 84 và 255 phụ nữ cũng cho thấy không có sự khác biệt đáng kể. Một nghiên cứu với cỡ mẫu nhỏ khác (126 phụ nữ) so sánh bổ sung progesterone và ngày thứ 3 và ngày thứ 6 sau khi lấy noãn lại cho thấy tỷ lệ mang thai lâm sàng khi bắt đầu bổ sung progesterone từ ngày thứ 6 thấp hơn có ý nghĩa so với từ ngày thứ 3 (lần lượt là 44,8% và 61,0%).
Về thời điểm ngừng progesterone, phân tích tổng hợp từ 6 nghiên cứu thực hiện năm 2012 so sánh việc ngưng sử dụng progesterone tại thời điểm thử thai so với việc tiếp tục dùng đến tuần thứ 6 - 7 thai kỳ đã báo cáo rằng không tìm thấy sự khác biệt đáng kể về tỷ lệ thai sinh sống trên 369 phụ nữ (RR 0,95, KTC 95%: 0,86 - 1,05) hoặc tỷ lệ mang thai tiếp diễn trên 1066 phụ nữ (RR 0,97, KTC 95%: 0,90 - 1,05).
So sánh progesterone đơn thuần so với progesterone + estrogen (16 RCT, 2577 phụ nữ) ghi nhận không có bằng chứng về sự khác biệt giữa các nhóm về tỷ lệ sinh sống hoặc đang mang thai (OR 1,12, KTC 95% 0,91 - 1,38, 9 RCT 1651 phụ nữ, I = 0%, bằng chứng chất lượng thấp) hoặc OHSS (OR 0,56, KTC 95% 0,2 - 1,63, 2 RCT 461 phụ nữ, I = 0%, bằng chứng chất lượng thấp).
So sánh phác đồ progesterone đơn thuần với progesterone + chất chủ vận GnRH (7 RCT, 1708 phụ nữ) ghi nhận, tỷ lệ sinh sống hoặc có thai diễn tiến ở nhóm chỉ dùng progesterone thấp hơn so với nhóm chủ vận progesterone cộng với GnRH (OR 0,62, KTC 95% 0,48 - 0,81, 9 RCT, 2861 phụ nữ, I = 55%, tác dụng ngẫu nhiên, bằng chứng chất lượng thấp ). OHSS chỉ được báo cáo trong một nghiên cứu; không có bằng chứng về sự khác biệt giữa các nhóm (OR 1,00, KTC 95% 0,33 - 3,01, 1 RCT, 300 phụ nữ, bằng chứng chất lượng rất thấp).
4.1.4 Tính an toàn
Progesterone từ lâu đã được sử dụng rộng rãi để hỗ trợ trong những trường hợp mang thai nguy cơ cao và dọa sẩy thai. Sự an toàn cho thai nhi của progesterone đã được nghiên cứu kỹ lưỡng ở nhóm phụ nữ vô sinh và thai phụ đang dùng thuốc.
Một phân tích tổng hợp dựa trên 12 nghiên cứu hồi cứu đã cho thấy rằng tỷ lệ các dạng dị tật bẩm sinh trên thai nhi nói chung là 0,99%, trong đó, tỷ lệ mắc tim bẩm sinh là 1,06% và khiếm khuyết chi là 1,04%, không khác biệt với tỷ lệ mắc dị tật bẩm sinh của quần thể phụ nữ có khả năng sinh sản bình thường.
Tuy vậy, dựa vào tác dụng dược lý, các nhà lâm sàng vẫn lo ngại về nguy cơ gây dị tật bộ phận sinh dục của thai nhi của progesterone. Tiến hành phân tích 14 báo cáo khác nhau, liên quan đến 65.567 phụ nữ về lĩnh vực này đã kết luận rằng không tìm thấy sự khác biệt giữa nhóm thai phụ sử dụng hormone sinh dục trong tam cá nguyệt đầu tiên với dị tật bộ phận sinh dục ngoài.
4.2 Dydrogesterone (DYD)
4.2.1 Khuyến cáo
Dydrogesterone có thể được khuyến nghị sử dụng trong phác đồ hỗ trợ hoàng thể.
4.2.2 Bằng chứng
Các nghiên cứu cho thấy, dydrogesterone đường uống có mức độ an toàn, khả năng dung nạp và tỷ lệ mang thai liên tục tương tự với progesterone. Một phân tích tổng hợp so sánh DYD đường uống và progesterone đặt âm đạo đã báo cáo rằng không có sự khác biệt về tỷ lệ thai sinh sống hay thai tiếp diễn. Một nghiên cứu lớn hơn với cỡ mẫu trên 1034 phụ nữ so sánh tác dụng của hai chế phẩm này cũng cho kết quả tương tự.
Đồng thời chưa tìm thấy bằng chứng về sự khác biệt của tỷ lệ trẻ sinh ra mắc các dị tật bẩm sinh giữa 2 nhóm.
4.2.3 Tính an toàn
DYD từ lâu đã được sử dụng rộng rãi trong những trường hợp dọa sẩy thai, sẩy thai liên tiếp hay các bệnh lý phụ khoa khác như đau bụng kinh, hội chứng tiền kinh nguyệt hay suy hoàng thể. Các nghiên cứu đã ghi nhận hiệu quả tương đương của thuốc với progesterone vi hạt đặt âm đạo. Tuy vậy, sự ít ỏi của các nghiên cứu đã đặt ra vấn đề về an toàn của thai nhi đã khiến cho Cục quản lý Thực phẩm và Dược phẩm Hoa Kỳ (Food and Drug Administration - FDA) xem xét thu hồi DYD loại viên nén dạng uống hàm lượng 5 mg và 10 mg vào năm 2017. Tính đến năm 2018, chỉ có khoảng 500 báo cáo được công bố về kết cục trẻ sơ sinh khi thai kỳ có tiếp xúc với DYD.
Nghiên cứu lớn thực hiện năm 2019 đã báo cáo tỷ lệ nhóm trẻ sơ sinh có tiếp xúc với DYD trong thai kỳ cao hơn đáng kể các dị tật phụ thuộc tác dụng của progestin. Phân tích này đã bị rút lại chính thức vào tháng 5 năm 2020 bởi thiết kế nghiên cứu không phù hợp, thiếu sót trong điều chỉnh các yếu tố gây nhiễu, sử dụng nhiều loại thuốc trong quá trình hỗ trợ sinh sản như: đồng vận, đối vận GnRH, hCG, gonadotropins, estradiol, kháng sinh và lỗi thống kê, tính toán.
Năm 2020, một tổng quan hệ thống tương tự đã tiến hành phân tích đánh giá nguy cơ tổng thể về các dị tật thai nhi giữa hai nhóm có sử dụng DYD (10.531 trường hợp) và nhóm đối chứng không dùng thuốc (741.218 trường hợp) dựa trên 11 nghiên cứu. Phân tích gợi ý rằng DYD cho thấy tác dụng gây quái thai độc lập có thể có ý nghĩa. Tuy nhiên, việc chỉ định rộng rãi DYD ở những phụ nữ vô sinh trong chu kỳ thụ tinh trong ống nghiệm là một trong những yếu tố gây nhiễu quan trọng, bởi tỷ lệ dị tật bẩm sinh cũng gia tăng đáng kể khi gia tăng tuổi mẹ. Việc không đề cập đến những yếu tố gây nhiễu trong các nghiên cứu trên, sự sai sót trong trích dẫn tài liệu đã vấp phải nhiều tranh cãi về kết quả nghiên cứu.
Như vậy, cho đến nay các dữ liệu lâm sàng riêng lẻ về nguy cơ và lợi ích khi sử dụng DYD trên lâm sàng được phê duyệt đã chứng minh rằng chưa tìm thấy bất kỳ mối liên quan nào giữa các dị tật bẩm sinh ở thai nhi với việc sử dụng DYD trong thai kỳ.
4.3 Estrogen
4.3.1 Khuyến cáo
Không khuyến nghị bổ sung estradiol kèm theo progesterone trong phác đồ hỗ trợ hoàng thể.
4.3.2 Bằng chứng
Các phân tích đã báo cáo rằng không có sự khác biệt về tỷ lệ thai sinh sống hoặc thai tiếp diễn hoặc nguy cơ quá kích buồng trứng khi so sánh hai phác đồ progesterone đơn thuần với progesterone kết hợp estradiol.
Không tìm thấy sự khác biệt đáng kể về tỷ lệ sinh sống khi bổ sung estradiol với liều dùng 2 mg, 4 mg hay 6 mg/ngày trong hỗ trợ hoàng thể.
4.4 Human chorionic gonadotropin (hCG)
4.4.1 Khuyến cáo
Trong những chu kỳ kích thích buồng trứng có gây trưởng thành noãn bằng hCG, không khuyến khích sử dụng hCG trong giai đoạn hỗ trợ hoàng thể với liều tiêu chuẩn 1500IU.
4.4.2 Bằng chứng
Phân tích tổng hợp của Cochrane về hiệu quả hCG so với giả dược/không điều trị (5 RCT, 746 phụ nữ) cho thấy lợi ích ở nhóm hCG về tỷ lệ sinh sống hoặc tỷ lệ mang thai diễn tiến khi dữ liệu được phân tích với mô hình hiệu quả cố định (OR 1,76, KTC 95% 1,08 - 2,86, 3 RCT, 527 phụ nữ, I2 = 24%, chất lượng bằng chứng rất thấp). Tuy nhiên kèm theo đó, tỷ lệ nguy cơ quá kích buồng trứng cũng tăng lên (OR 4,28, KTC 95% 1,91 - 9,6, một RCT, 387 phụ nữ, bằng chứng chất lượng thấp).
Khi so sánh phác đồ hCG đơn độc và hCG với progesterone(16 RCT, 2162 phụ nữ), không có bằng chứng về sự khác biệt giữa phác đồ progesterone và hCG về tỷ lệ sinh sống hoặc tỷ lệ thai diễn tiến (OR 0,95, KTC 95% 0,65 - 1,38, năm RCT, 833 phụ nữ, 12 = 0%, bằng chứng chất lượng thấp). Progesterone có liên quan đến tỷ lệ OHSS thấp hơn so với phác đồ hCG (OR 0,46, KTC 95% 0,30 đến 0,71, 5 RCT, 1293 phụ nữ, I2 = 48%). Việc bổ sung hCG thường xuyên không cải thiện kết quả mang thai trong hầu hết các trường hợp.
4.5 Đồng vận GnRH
4.5.1 Khuyến nghị
Một liều đồng vận GnRH duy nhất cùng với progesterone hoặc tiêm lặp lại, đơn thuần hay kết hợp trong hỗ trợ hoàng thể ở các chu kỳ thụ tinh ống nghiệm trigger bằng hCG hiện chỉ được áp dụng trong các thử nghiệm lâm sàng.
4.5.2 Bằng chứng
Một liều đồng vận GnRH duy nhất (Triptorelin 0,1 mg/1 ml) vào ngày thứ 6 sau khi lấy noãn kết hợp với progesterone có thể làm tăng đáng kể tỷ lệ thai sinh sống/thai tiếp diễn mà không làm tăng tỷ lệ quá kích buồng trứng.
Phân tích tổng hợp của Cochrane cho thấy việc bổ sung thêm đồng vận GnRH đơn liều hoặc đa liều cũng làm tăng đáng kể kết cục mang thai so với sử dụng progesterone đơn thuần trong hỗ trợ hoàng thể. Một nghiên cứu thuần tập hồi cứu lớn gồm 2529 phụ nữ so sánh tác dụng của GnRH đơn thuần với progesterone trong hỗ trợ hoàng thể đã báo cáo tỷ lệ thai sinh sống cao hơn đáng kể ở nhóm GnRH đơn thuần (17,6% so với 9,8%).
Bằng chứng về ảnh hưởng lâu dài của đồng vận GnRH lên sức khỏe ở trẻ sơ sinh vẫn chưa được nghiên cứu. Do vậy, các khuyến nghị đưa ra chỉ nên sử dụng chất đồng vận GnRH cho hỗ trợ hoàng thể trong bối cảnh thử nghiệm lâm sàng.
4.6 Luteinizing hormone (LH)
4.6.1 Khuyến nghị
Việc bổ sung LH cùng với progesterone trong hỗ trợ hoàng thể chỉ có thể được sử dụng trong các thử nghiệm lâm sàng.
4.6.2 Bằng chứng
Một phân tích nhỏ trên 35 phụ nữ đã báo cáo không có sự khác biệt về tỷ lệ thai sinh sống (22,2% so với 23,5%) và số lượng tế bào trứng thu được (11,7 ± 1,9 so với 13,8 ± 1,8) giữa nhóm bổ sung LH và progesterone đơn thuần.
4.7 Aspirin
Nghiên cứu hồi cứu trên 127 phụ nữ đã báo cáo rằng sử dụng Aspirin 81 mg/ngày có thể cải thiện đáng kể tưới máu tại tử cung trong giai đoạn hoàng thể ở những phụ nữ vô sinh không rõ nguyên nhân và suy giảm lưu lượng máu đến tử cung. Do vậy, bổ sung aspirin liều thấp có thể được cân nhắc trong hỗ trợ hoàng thể tùy từng trường hợp cụ thể.
Tóm lại, hỗ trợ hoàng thể bằng progesterone hoặc hCG trong giai đoạn hoàng thể ở các chu kỳ hỗ trợ sinh sản có thể liên quan đến tỷ lệ sinh sống hoặc thai diễn tiến cao hơn so với giả dược hoặc không điều trị. Việc bổ sung GnRHa cùng progesterone dường như có cải thiện kết quả. hCG có thể làm tăng nguy cơ mắc OHSS so với giả dược. Hơn nữa, hCG, có hoặc không có progesterone, có liên quan đến tỷ lệ OHSS cao hơn progesterone đơn thuần. Việc bổ sung estrogen hoặc đường dùng progesterone dường như không liên quan đến việc cải thiện kết quả. Nhìn chung, các bằng chứng hiện tại vẫn có mức độ tin cậy chưa cao và cần có thêm dữ liệu để có thể kết luận.
5 Tài liệu tham khảo
1. Bar Hava I, Blueshtein M, Ganer Herman H, Omer Y, Ben David G (2017). Gonadotropin- releasing hormone analogue as sole luteal support in antagonist- based assisted reproductive technology cycles. Fertility and sterility; 107: 130-135.e131. 23
2. Barbosa MWP, Valadares NPB, Barbosa ACP, Amaral AS, Iglesias JR, Nastri CO, Martins WP, Nakagawa HM (2018). Oral dydrogesterone vs. vaginal progesterone capsules for luteal- phase support in women undergoing embryo transfer: a systematic review and meta- analysis. JBRA assisted reproduction; 22: 148-156.
3. Cao Ngọc Thành, Lê Minh Tâm (2017). Nội tiết phụ khoa và Y học sinh sản. Nhà xuất bản Đại học Huế. tr.168-177
4. ESHRE Reproductive Endocrinology Guideline Group (2019). Ovarian stimulation for IVF/ ICSI: Guideline of the European Society of Human Reproduction and Embryology - Luteal phase support (LPS); p106-114.
5. Ghanem ME, Bedairy MH, Shaaban A, Albahlol IA (2020). Does the time of starting progesterone luteal support affect embryo transfer in long agonist protocol downregulated ICSI cycles? A Randomized Controlled Trial. Reprod Sci; 28(3):897-903. doi: 10.1007/ s43032- 020-00309-0.
6. Griesinger G, Blockeel C, G TS, Patki A, Dhorepatil B, Yang DZ, Chen ZJ, Kahler E, Pexman- Fieth C, Tournaye H (2016). Oral dydrogesterone versus intravaginal micronized progesterone gel for luteal phase support in IVF: a randomized clinical trial. Human reproduction (Oxford, England) 2018;33: 2212-2221. Ismail Madkour WA, Noah B, Abdel Hamid AM, Zaheer H, Al- Bahr A, Shaeer M, Moawad A. Luteal phase support with estradiol and progesterone versus progesterone alone in GnRH antagonist ICSI cycles: a randomized controlled study. Human fertility (Cambridge, England); 19: 142-149.
7. Griesinger G, Blockeel C, Sukhikh GT, et al (2018). Oral dydrogesterone versus intravaginal micronized progesterone gel for luteal phase support in IVF: a randomized clinical trial. Hum Reprod; 33(12):2212-2221. doi:10.1093/ humrep/ dey306.
8. Le Minh Tam, Tran Thi Nhu Quynh, Nguyen Thi Ni, Nguyen Vu Quoc Huy, Le Dinh Duong, Cao Ngoc Thanh (2019). The related factors of thin endometrium in IVF cycles and the outcomes of subsequent frozen- thaw embryo transfer. Abstract Nr 305. Oral presentation. The 9th Congress of the Asia Pacific Initiative on Reproduction (ASPIRE 2019), Hongkong from 3-5 May 2019.
9. Mirza FG, Patki A, Pexman- Fieth C (2016). Dydrogesterone use in early pregnancy. Gynecol Endocrinol;32:97-106.
10. Tournaye H, Sukhikh GT, Kahler E, Griesinger G (2017). A Phase III randomized controlled trial comparing the efficacy, safety and tolerability of oral dydrogesterone versus micronized vaginal progesterone for luteal support in in vitro fertilization. Human reproduction (Oxford, England);32: 1019-1027.
11. Wu H, Zhang S, Lin X, Wang S, Zhou P (2021). Luteal phase support for in vitro fertilization/ intracytoplasmic sperm injection fresh cycles: a systematic review and network meta- analysis. Reprod Biol End

