Tác động của men vi sinh đối với trẻ thừa cân hoặc béo phì

Trungtamthuoc.com - Ngày 4 tháng 8 năm 2023, một nghiên cứu để khám phá xem liệu men vi sinh có thể làm giảm tình trạng thừa cân hoặc béo phì ở trẻ em hay không bằng một phân tích tổng hợp và tổng quan hệ thống đã được đăng tải trên tạp chí Journal of Translational Medicine.
Effects of probiotic administration on overweight or obese children: a meta-analysis and systematic review
Tác giả: Ya Li, Tonghua Liu, Lingling Qin & Lili Wu
Tạp chí: Journal of Translational Medicine
(Tải file PDF: tại đây)
1 Các từ viết tắt
BMI: Chỉ số khối cơ thể
TC: cholesterol toàn phần
TG: Triglyceride
HDL-C: Cholesterol lipoprotein tỷ trọng cao
LDL-C: Cholesterol lipoprotein tỷ trọng thấp
TNF-α: Yếu tố hoại tử khối u-α
WMD: Sự khác biệt trung bình có trọng số
SMD: Sự khác biệt trung bình được tiêu chuẩn hóa
NAFLD: Bệnh gan nhiễm mỡ không do rượu
WHO: Tổ chức Y tế Thế giới
SCFA: Axit béo chuỗi ngắn
LP: Lipopolysacarit
FABP4: Protein liên kết axit béo 4
CPT-1: Carnitine palmitoyltransferase-1
AMPK: Adenosine monophosphate kinase
SREBP-1c: Protein-1c liên kết với yếu tố điều hòa sterol
FXR: Thụ thể Farnesoid X
NF-κB: Kích hoạt yếu tố hạt nhân kappa-B
IL-6: Interleukin-6
GPR: Thụ thể liên kết protein G
ROS: Các loại oxy phản ứng
2 Tóm tắt
2.1 Tổng quan
Nghiên cứu này nhằm mục đích đánh giá tác động của men vi sinh (Probiotics) đối với 8 yếu tố ở trẻ em thừa cân hoặc béo phì thông qua phân tích tổng hợp, bao gồm: chỉ số khối cơ thể (BMI), cholesterol toàn phần (TC), triglyceride (TG), cholesterol lipoprotein tỷ trọng cao (HDL-C), cholesterol lipoprotein tỷ trọng thấp (LDL-C), adiponectin, leptin và yếu tố hoại tử khối u-α (TNF-α) và tổng hợp các cơ chế hoạt động của men vi sinh dựa trên các nghiên cứu hiện có.
2.2 Phương pháp
Tra cứu, tìm kiếm tài liệu trên 6 cơ sở dữ liệu bao gồm: PubMed, Web of Science, Embase, Cochrane Library, SinoMed và CNKI cho đến tháng 3 năm 2023.
Trình quản lý đánh giá 5.4 (Review manager 5.4) được sử dụng để phân tích tổng hợp.
Dữ liệu được phân tích bằng cách sử dụng chênh lệch trung bình có trọng số (WMD) hoặc chênh lệch trung bình tiêu chuẩn hóa (SMD) theo mô hình tác động cố định hoặc mô hình tác động ngẫu nhiên để quan sát tác động của việc sử dụng men vi sinh đối với các chỉ số được đưa vào quan sát.
So sánh giữa 2 nhóm: sử dụng men vi sinh và sử dụng giả dược (placebo).
2.3 Kết quả
4 nghiên cứu đáp ứng tiêu chí lựa chọn với tổng số 206 trẻ thừa cân hoặc béo phì được đưa vào đánh giá.
Theo phân tích tổng hợp, men vi sinh có thể làm giảm đáng kể mức HDL-C (MD, 0,06; KTC 95% 0,03, 0,09; P = 0,0001), LDL-C (MD, − 0,06; KTC 95% – 0,12 , − 0,00; P = 0,04), adiponectin (MD, 1,39; KTC 95% 1,19, 1,59; P < 0,00001), leptin (MD, − 2,72; KTC 95% − 2,9, − 2,54; P < 0,00001) và TNF- α (MD, − 4,91; KTC 95% − 7,15, − 2,67; P < 0,0001) so với những người trong nhóm sử dụng giả dược (placebo). Tuy nhiên, đối với BMI, nhóm placebo dường như cho thấy sự thay đổi tốt hơn nhóm sử dụng men vi sinh (MD, 0,85; KTC 95% 0,04, 1,66; P = 0,04). 2 chỉ số TC (MD, − 0,05; KTC 95% − 0,12, 0,02; P = 0,14) và TG (MD, − 0,16; KTC 95% − 0,36, 0,05; P = 0,14) không khác biệt giữa hai nhóm.
2.4 Kết luận
Nghiên cứu này cho thấy men vi sinh có thể đóng vai trò điều chỉnh HDL-C, LDL-C, adiponectin, leptin và TNF-α ở trẻ thừa cân hoặc béo phì. Ngoài ra, nghiên cứu tổng quan hệ thống này cũng cho thấy men vi sinh có thể cải thiện quá trình chuyển hóa lipid và cải thiện các triệu chứng liên quan đến béo phì theo một số cách.
Phân tích tổng hợp này đã được đăng ký tại PROSPERO với ID: CRD42023408359.

3 Tổng quan
Tỷ lệ thừa cân hoặc béo phì ở trẻ em ngày càng gia tăng do những thay đổi trong cơ cấu chế độ ăn uống và thói quen tập thể dục, được xác định bằng chỉ số khối cơ thể (BMI) tính từ chiều cao và cân nặng. Với chỉ số BMI nằm trong khoảng bách phân vị từ 85 đến 94 được phân loại là thừa cân và lớn hơn phân vị thứ 94 được phân loại là béo phì, trong đó 95% là béo phì đơn giản [1].
Kể từ năm 1980, tỷ lệ Béo phì ở trẻ em trên toàn cầu đã tăng 47,1% và vượt qua tốc độ tăng trưởng béo phì ở người trưởng thành. Tỷ lệ thừa cân béo phì ở trẻ em từ 7 tuổi trở lên ở Trung Quốc dự kiến lên đến 28% vào năm 2030 [ 2 ]. Béo phì ở trẻ em có thể gây ra một số biến chứng lâm sàng như tăng huyết áp, bệnh gan nhiễm mỡ không do rượu (NAFLD) và bệnh tim mạch [ 3, 4 ]. Ngoài ra, nó còn có thể làm phát sinh các vấn đề về tâm lý như tự ti [5, 6] trầm cảm, thậm chí làm giảm chất lượng cuộc sống và giảm tuổi thọ [7].
Nguyên nhân chính gây thừa cân hoặc béo phì ở trẻ em là thói quen ăn uống không lành mạnh và thiếu vận động, dẫn đến năng lượng đưa vào nhiều hơn mức năng lượng được tiêu thụ và kết quả là tích tụ mỡ trong cơ thể [8]. Trong đó, thói quen ăn uống không tốt bao gồm việc tiêu thụ quá nhiều đồ uống có đường và thực phẩm thiếu chất dinh dưỡng nhưng giàu chất béo bão hòa. Theo khuyến cáo của Tổ chức Y tế Thế giới (WHO), trẻ em nên có ít nhất 60 phút hoạt động thể chất vừa phải đến mạnh mỗi ngày, tuy nhiên nhiều trẻ em không đạt đủ thời gian tập luyện theo khuyến cáo trên [9, 10]. Hơn nữa, tình trạng béo phì ở trẻ em cũng có mối liên quan mật thiết với một số hành vi không lành mạnh như thiếu ngủ, sử dụng quá nhiều thiết bị điện tử và tiếp xúc với quảng cáo đồ ăn vặt [ 11 ,12 ]. Sự phức tạp của nguyên nhân đa yếu tố trong bệnh thừa cân/béo phì mang lại nhiều thách thức cho các nhà nghiên cứu và bác sĩ lâm sàng trong việc phòng ngừa và quản lý.
Hiện nay, việc điều trị thừa cân/béo phì ở trẻ em chủ yếu được thực hiện thông qua ba phương pháp sau:
Đầu tiên, trẻ cần được thiết lập một lối sống lành mạnh [13]. Điều này bao gồm việc ăn ba bữa chính đều đặn và hạn chế ăn bữa phụ. Cụ thể, cần tăng cường tiêu thụ trái cây, rau, ngũ cốc nguyên hạt, protein và các sản phẩm từ sữa ít béo, đồng thời giảm tiêu thụ đồ uống có đường, natri, chất béo rắn và đường bổ sung [14]. Ngoài ra, cần đảm bảo hoạt động thể chất và thời gian ngủ đủ, đồng thời hạn chế thời gian sử dụng thiết bị điện tử [15].
Thứ hai là can thiệp bằng thuốc. Orlistat, loại thuốc duy nhất được Cơ quan Quản lý Thực phẩm và Dược phẩm phê duyệt để điều trị béo phì ở trẻ em từ 12 tuổi trở lên [16,17].
===> Xem thêm về hoạt chất Orlistat: Orlistat - Giải pháp giảm nhanh nỗi lo tăng cân, béo phì
Thứ ba, phương pháp phẫu thuật giảm cân. Bệnh nhân có BMI ≥ 35 kg/m2 đồng thời mắc bệnh tiểu đường típ 2, ngưng thở khi ngủ từ trung bình đến nặng hoặc bệnh gan nhiễm mỡ không do rượu nặng có thể cân nhắc phẫu thuật giảm cân. Qua phẫu thuật, bệnh nhân có thể giảm cân và giảm nguy cơ các biến chứng liên quan [18].
Tuy nhiên, mỗi phương pháp trên đều có nhược điểm riêng. Ví dụ, phương pháp thay đổi lối sống có nhược điểm là thiếu sự tự giác của cá nhân và yêu cầu sự giám sát từ người khác. Việc sử dụng thuốc để điều trị cũng bị hạn chế do tác dụng phụ đáng kể trên hệ tiêu hóa và tác dụng chưa được xác định đầy đủ. Đồng thời, việc điều trị bằng phẫu thuật đòi hỏi sự hợp tác của nhiều chuyên ngành và yêu cầu chăm sóc hậu phẫu cẩn thận. Vì vậy, việc tìm ra một phương pháp an toàn và hiệu quả để điều trị thừa cân và béo phì ở trẻ em vẫn là rất cần thiết.
Hệ vi sinh vật đường ruột giữa trẻ béo và trẻ gầy có sự khác biệt đáng kể, có thể là do chế độ ăn nhiều chất béo và đường làm giảm sự đa dạng của hệ vi sinh vật đường ruột. Điều này đặc biệt ảnh hưởng đến sự phong phú của vi khuẩn sản xuất axit butyric và các vi sinh vật có lợi khác [19]. Trong khi ngày càng có nhiều nghiên cứu chỉ ra rằng hệ vi sinh vật đường ruột có thể điều chỉnh quá trình chuyển hóa năng lượng, tình trạng viêm và điều hòa miễn dịch trong cơ thể [20, 21]. Hơn nữa, hệ vi sinh vật đường ruột ở trẻ em dễ bị tổn thương hơn so với người trưởng thành. Do đó, việc can thiệp sớm lên hệ vi khuẩn đường ruột của trẻ thừa cân hoặc béo phì là điều cần thiết để cải thiện sức khỏe khi bé và cân bằng nội môi của hệ vi sinh vật đường ruột suốt đời [22].
Theo định nghĩa của WHO, men vi sinh là các vi sinh vật sống có khả năng điều chỉnh hay cân bằng hệ vi sinh đường ruột và khi được cung cấp với liều lượng thích hợp, nó sẽ mang lại lợi ích sức khỏe cho cơ thể con người. Chủng men được sử dụng phổ biến là Lactobacillus spp. và Bifidobacterium spp. [23]. Một số nghiên cứu chỉ ra rằng men vi sinh có thể làm giảm tình trạng thừa cân hoặc béo phì ở trẻ em [24]. Tuy nhiên, các nghiên cứu khác lại cho thấy men vi sinh không có hiệu quả trên và thậm chí loài Lactobacillus còn có thể làm tăng cân [25, 26]. Vì lí do trên, nghiên cứu này được thực hiện để tìm hiểu xem liệu men vi sinh có thể làm giảm tình trạng thừa cân hoặc béo phì ở trẻ em hay không bằng một phân tích tổng hợp và đánh giá hệ thống các cơ chế hoạt động cụ thể của men vi sinh trong một tổng quan hệ thống.
Bài viết này áp dụng nguyên tắc PICO, bao gồm người tham gia, sự can thiệp, so sánh và kết quả. Các yếu tố cụ thể như sau:
P - trẻ thừa cân hoặc béo phì
I - bổ sung men vi sinh và không giới hạn chủng loại và hình thức
C - liều giả dược placebo bằng với men vi sinh
O - các chỉ số chính: BMI, TC và TG, và các chỉ số phụ: HDL-C, LDL-C, leptin, adiponectin và TNF-α.
4 Đối tượng và phương pháp nghiên cứu
4.1 Chiến lược tìm kiếm
Phân tích tổng hợp và đánh giá hệ thống này được thực hiện theo hướng dẫn tại Mục báo cáo ưu tiên dành cho đánh giá hệ thống và phân tích tổng hợp (PRISMA) [27].
Sáu cơ sở dữ liệu (PubMed, Embase, Cochrane Library, Web of Science, SinoMed, and CNKI) được tìm kiếm từ khi bắt đầu nghiên cứu đến tháng 3 năm 2023.
Các thuật ngữ tìm kiếm như sau: [(obese adolescents) OR (Pediatric Obesity) OR (Obesity, Pediatric) OR (Obesity in Childhood) OR (Childhood Onset Obesity) OR (Obesity, Childhood Onset) OR (Child Obesity) OR (Obesity, Child) OR (Childhood Obesity) OR (Obesity, Childhood) OR (Adolescent Overweight) OR (Overweight, Adolescent) OR (Infant Overweight) OR (Overweight, Infant) OR (Adolescent Obesity) OR (Obesity, Adolescent) OR (Obesity in Adolescence) OR (Childhood Overweight) OR (Overweight, Childhood) OR (Infantile Obesity) OR (Obesity, Infantile) OR (Infant Obesity) OR (Obesity, Infant)] AND [(probiotic agent) OR (gastrointestinal microbiota) OR (gut dysbiosis) OR (gut microbiota) OR (gut microbiome) OR (Probiotics)] AND [(randomized controlled trial OR randomized OR placebo)].
Tổng cộng có 424 bài viết được tìm kiếm, tương ứng với PubMed (n=20), Embase (n=25), Cochrane Library (n=211), Web of Science (n=159), SinoMed (n=5) và CNKI (n=4).
4.2 Lựa chọn nghiên cứu
Tiêu chuẩn lựa chọn:
- Thử nghiệm ngẫu nhiên có đối chứng về men vi sinh dành cho trẻ thừa cân hoặc béo phì.
- Độ tuổi của trẻ là 6-18 tuổi
- Trẻ thừa cân, béo phì không mắc bất kỳ bệnh nào khác.
Tiêu chuẩn loại trừ:
Các bài báo thuộc các loại sau bị loại trừ: đề cương nghiên cứu, không có dữ liệu toàn văn và không có dữ liệu cần thiết.
Quá trình sàng lọc nghiên cứu được thể hiện trong hình dưới đây.
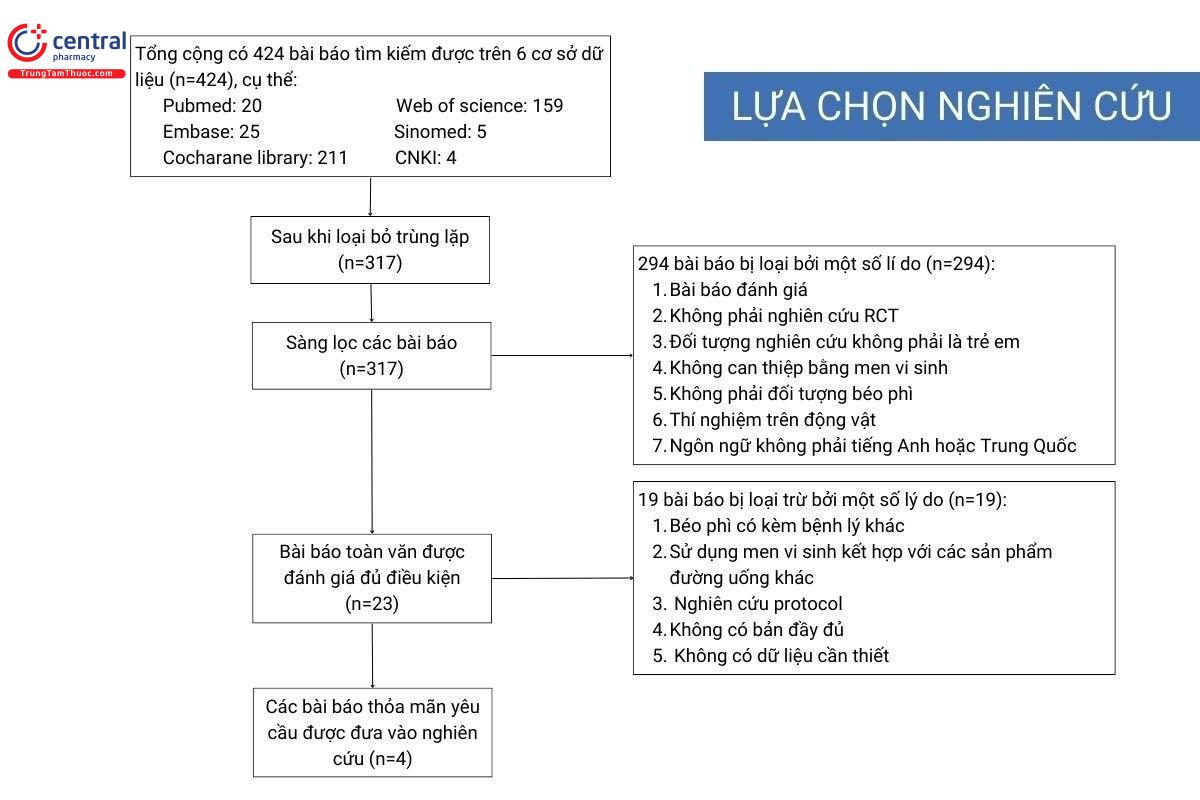
4.3 Trích xuất dữ liệu
Đối với phân tích tổng hợp, các thông tin sau đã được tóm tắt: (1) tên tác giả đầu tiên và năm xuất bản; (2) nhóm men vi sinh hoặc nhóm giả dược (placebo), số người trong mỗi nhóm và độ tuổi; (3) các phương pháp can thiệp khác nhau của men vi sinh và giả dược (placebo), thời gian can thiệp và (4) kết quả được quan sát.
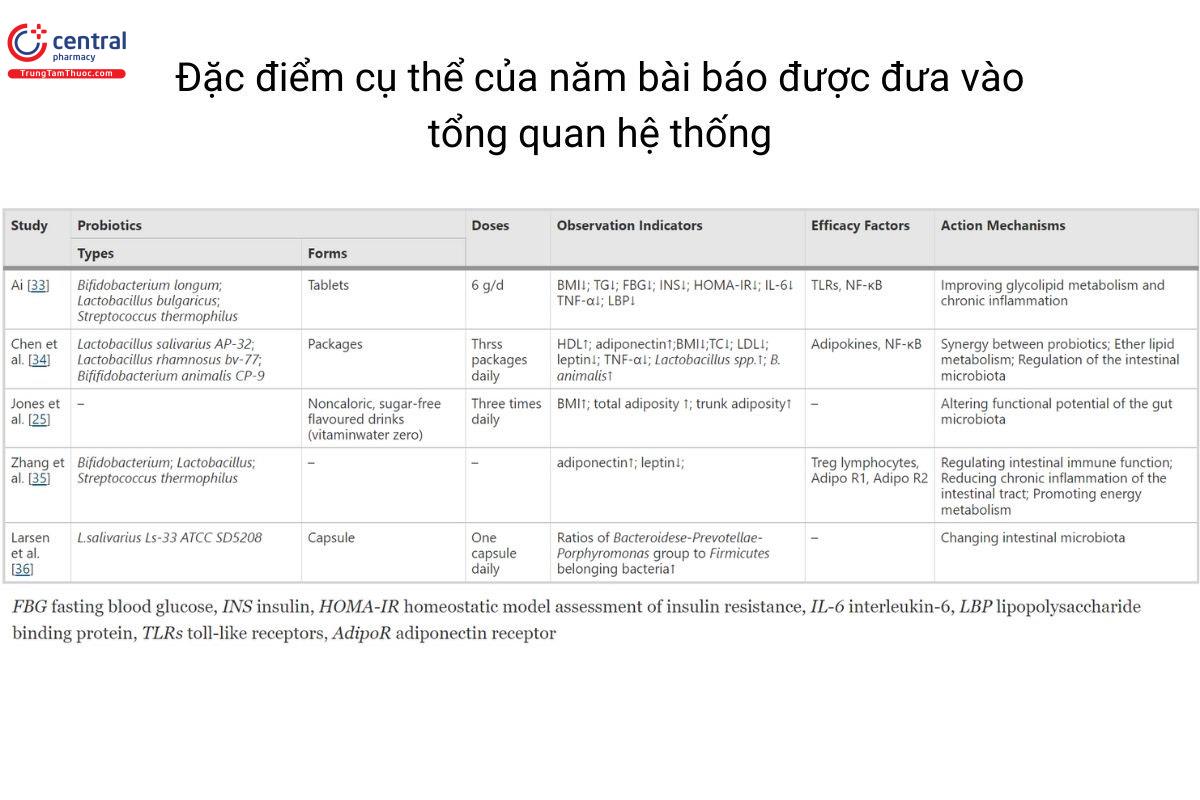
Để tổng quan hệ thống, các thông tin liên quan về các nghiên cứu được đưa vào đã được tóm tắt, bao gồm: (1) tên tác giả đầu tiên và năm xuất bản; (2) các loại chủng, dạng uống và liều lượng trong nhóm probiotic; (3) các chỉ số quan sát; (4) các yếu tố hiệu quả và cơ chế hoạt động liên quan.
4.4 Đánh giá chất lượng nghiên cứu
Việc đánh giá sai lệch rủi ro cho các nghiên cứu được đưa vào là dựa trên tiêu chí đánh giá của Cochrane Handbook [28]. Công việc này được hoàn thành bởi hai nhà phê bình độc lập và một người thứ ba chịu trách nhiệm giải quyết các vấn đề gây tranh cãi. Đánh giá sai lệch rủi ro của các nghiên cứu được đưa vào được trình bày trong Hình 3.
4.5 Kết quả quan sát
Kết quả chính trong nghiên cứu này là 3 chỉ số: BMI, TG và TC, và kết quả phụ bao gồm chỉ số HDL-C, LDL-C, adiponectin, leptin và TNF-α.
4.6 Tổng hợp và phân tích dữ liệu
Một công cụ từ Trung tâm Thông tin Công nghệ sinh học Quốc gia (National Center for Biotechnology Information) đã được sử dụng để hoàn thành việc trích xuất dữ liệu đồ họa cho các nghiên cứu được đưa vào và sau đó Review Manager 5.4 - một phần mềm phân tích tổng hợp từ Cochrane Collaborative Network [ 29 ] - được sử dụng để tổng hợp và phân tích dữ liệu.
SMDs (chênh lệch trung bình tiêu chuẩn hóa) được chọn để phân tích dữ liệu nếu đơn vị và phương pháp đo lường của các chỉ số quan sát được là khác nhau giữa các nghiên cứu; trường hợp ngược lại, sử dụng WMD (chênh lệch trung bình có trọng số) để phân tích dữ liệu [30].
Khoảng tin cậy 95% được áp dụng cho các biến liên tục. Giá trị P < 0,05 thể hiện sự khác biệt về mặt thống kê.
Tính không đồng nhất của các bài báo được đánh giá dựa trên số liệu thống kê I2, là tỷ lệ phần trăm để định lượng mức độ thay đổi quy mô ảnh hưởng trong nghiên cứu với các mức I2 từ 0–25%, 25–50% và 50–75% tương ứng với mức độ không đồng nhất thấp, trung bình và cao [31]. Mô hình tác động cố định đã được áp dụng để tổng hợp dữ liệu khi thống kê I2 thấp hơn 50%, thể hiện sự không đồng nhất có thể chấp nhận được giữa các nghiên cứu được đưa vào. Ngược lại, khi số liệu thống kê I2 > 50% thì mô hình tác động ngẫu nhiên được sử dụng [32].
.jpg)
5 Kết quả
5.1 Mô tả nghiên cứu trong phân tích tổng hợp
Phân tích tổng hợp này bao gồm 4 nghiên cứu với tổng số 206 trẻ em bị thừa cân hoặc béo phì. Trong số đó, 105 trẻ được chia vào nhóm dùng men vi sinh và 101 trẻ thuộc nhóm dùng giả dược. Nhóm trẻ sử dụng men vi sinh trong các nghiên cứu này đều sử dụng hỗn hợp men vi sinh làm biện pháp can thiệp. Ngoài ra, chỉ có một nghiên cứu có thời gian quan sát là 15 ngày, trong khi những nghiên cứu khác có thời gian quan sát kéo dài hơn 2 tháng.

5.2 Tác dụng của men vi sinh đối với các chỉ số chính
Bốn nghiên cứu có báo cáo về chỉ số BMI cho thấy nhóm dùng men vi sinh không hiệu quả bằng nhóm sử dụng giả dược (WMD, 0,85; KTC 95% 0,04, 1,66; P = 0,04) và tìm thấy sự không đồng nhất đáng kể giữa các bài báo (I2 = 83%, P = 0,0005).
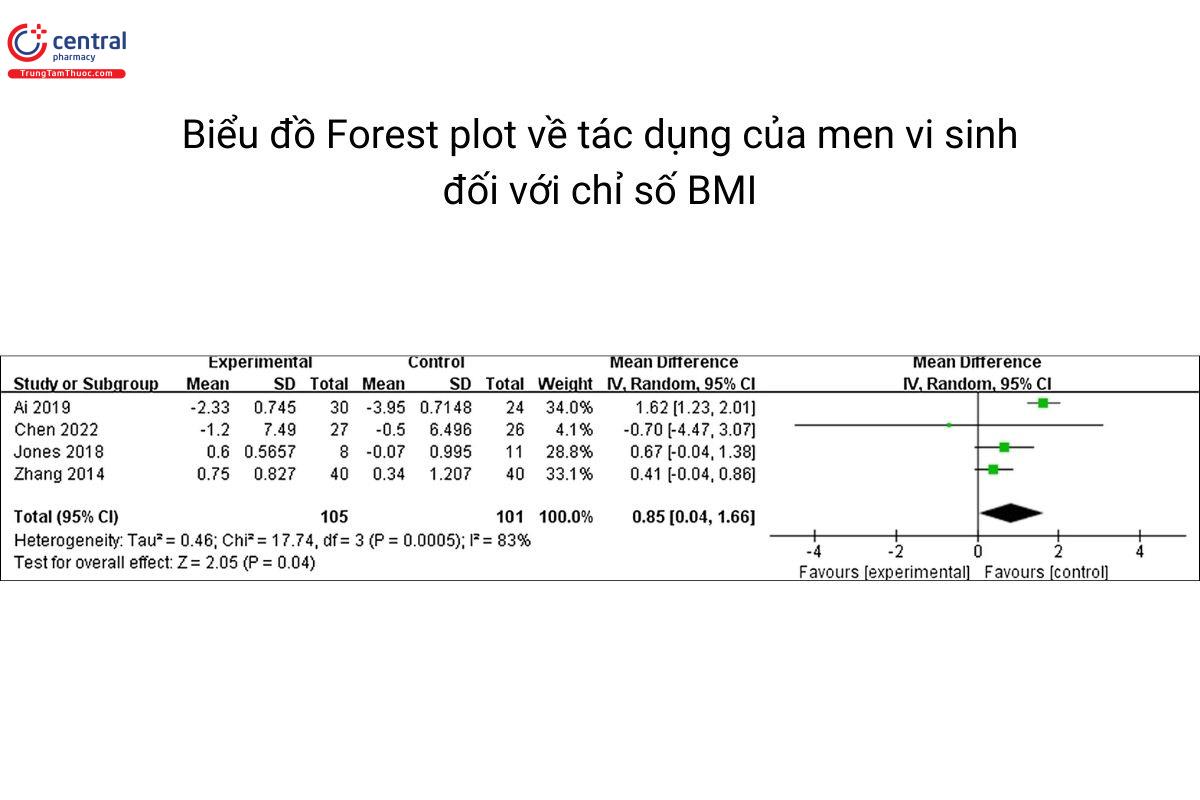
Hai nghiên cứu đề cập đến chỉ số TG, kết quả chỉ ra không có sự khác biệt có ý nghĩa thống kê giữa hai nhóm (WMD, −0,16; KTC 95% − 0,36, 0,05; P = 0,14) và giữa các nghiên cứu có sự không đồng nhất đáng chú ý (I2 = 90%, P = 0,001).

Ba nghiên cứu đề cập đến chỉ số TC: không tìm thấy sự khác biệt thống kê giữa hai nhóm (WMD, −0,05; KTC 95% − 0,12, 0,02; P = 0,14) và không phát hiện thấy sự không đồng nhất giữa hai nhóm (I2 = 0%, P = 0,47).

5.3 Tác dụng của men vi sinh đối với các chỉ số phụ
Hai nghiên cứu có đánh giá chỉ số HDL-C: sự khác biệt đáng kể đã được tìm thấy giữa hai nhóm và không có sự không đồng nhất (MD, 0,06; KTC 95% 0,03, 0,09; P = 0,0001; I2 = 0%, P = 1,00 đối với tính không đồng nhất).

Hai nghiên cứu đánh giá chỉ số LDL-C. Nhóm sử dụng men vi sinh có hiệu quả hơn nhóm giả dược (MD, −0,06; KTC 95% − 0,12, −0,00; P = 0,04) và không có sự không đồng nhất giữa các báo cáo.

Hai bài báo đánh giá chỉ số adiponectin cho thấy nhóm sử dụng men vi sinh có hiệu quả rõ rệt hơn so với nhóm dùng giả dược (MD, 1,39; KTC 95% 1,19, 1,59; P < 0,00001) và không có sự không đồng nhất đã được quan sát.

Ba bài báo đề cập đến chỉ số leptin: nhóm sử dụng men vi sinh hiệu quả hơn nhóm giả dược và không có tính không đồng nhất (MD, − 2,72; 95% CI − 2,9, − 2,54; P < 0,00001; I2 = 0%, P = 0,54 ).

Hai nghiên cứu liên quan đến TNF-α. Kết quả tốt hơn ở nhóm sử dụng men vi sinh so với nhóm giả dược và không có sự không đồng nhất (MD, − 4,91; 95% CI − 7,15, − 2,67; P < 0,0001; I2 = 0%, P = 0,86 đối với tính không đồng nhất).

5.4 Cơ chế hoạt động của men vi sinh liên quan đến các nghiên cứu được lựa chọn
Từ đánh giá có hệ thống này, chúng tôi kết luận rằng men vi sinh có thể cải thiện tình trạng thừa cân hoặc béo phì và các vấn đề liên quan ở trẻ em ở một số khía cạnh. Ai và cộng sự. [ 33 ] phát hiện ra rằng men vi sinh có thể cải thiện quá trình chuyển hóa glycolipid và tình trạng viêm mãn tính liên quan đến béo phì. Cụ thể, đầu tiên, men vi sinh có thể làm giảm cholesterol và cải thiện nồng độ lipid trong máu. Thứ hai, men vi sinh có thể tăng cường độ nhạy Insulin và cải thiện chuyển hóa Glucose trong máu bằng cách bảo vệ tế bào beta tuyến tụy, giảm áp lực lên mạng lưới nội chất và ức chế kích hoạt đại thực bào. Cuối cùng, men vi sinh cũng tham gia vào việc điều chỉnh hoạt động của hệ miễn dịch và trao đổi chất để cải thiện tình trạng viêm liên quan đến béo phì. Chen và cộng sự [ 34] phát hiện ra rằng men vi sinh và các thành phần chức năng khác có thể hiệp đồng tác dụng để điều chỉnh hệ vi khuẩn đường ruột khi bị rối loạn, làm tăng số lượng của Lactobacillus spp. và ức chế chuyển hóa ether lipid. Ngoài ra, nó cũng làm giảm nồng độ leptin và TNF-α và tăng tiết adiponectin. Zhang và cộng sự [ 35 ] phát hiện ra rằng men vi sinh có thể làm giảm tình trạng viêm mãn tính ở đường ruột bằng cách điều chỉnh chức năng của hệ miễn dịch đường ruột, làm thay đổi mức độ leptin và adiponectin, từ đó thúc đẩy quá trình trao đổi chất của cơ thể để giảm cân. Larsen và cộng sự [ 36 ] sử dụng Lactobacillus Salvary Ls-33 cho thanh thiếu niên béo phì và cho thấy những thay đổi về tỷ lệ chủng vi khuẩn đường ruột, điều đó cho thấy rằng Ls-33 có thể đóng vai trò điều tiết hoạt động trên hệ vi sinh vật đường ruột. Thông tin chi tiết trong hình dưới đây.
6 Bàn luận
Từ phân tích tổng hợp này, chúng tôi phát hiện ra rằng men vi sinh có thể cải thiện đáng kể các chỉ số HDL-C, LDL-C, adiponectin, leptin, TNF-α ở trẻ thừa cân hoặc béo phì. Tuy nhiên, không có ảnh hưởng đáng kể đến BMI, TC và TG. Các kết quả trên chứng minh rằng men vi sinh có thể điều chỉnh quá trình chuyển hóa lipid và đáp ứng miễn dịch ở một mức độ nào đó ở trẻ thừa cân hoặc béo phì. Dựa trên những điều này, chúng tôi tiếp tục nghiên cứu một cách có hệ thống cơ chế hoạt động của men vi sinh đối với trẻ thừa cân hoặc béo phì. Tuy nhiên, cơ chế hoạt động của men vi sinh trong việc điều chỉnh bệnh béo phì vẫn chưa được hiểu đầy đủ và có thể liên quan đến việc điều hòa cân bằng nội môi của hệ vi sinh đường ruột, cải thiện chuyển hóa năng lượng, giảm viêm và đáp ứng miễn dịch,...
6.1 Men vi sinh có thể tái tạo lại hệ vi sinh đường ruột bị rối loạn
Thừa cân hoặc béo phì có liên quan đến hệ vi sinh vật đường ruột bị rối loạn, với sự gia tăng của Bacteroides fragilis (B. fragilis), Escherichia coli (E. coli), Firmicutes và Staphylococci, đồng thời giảm lượng Bifidobacteria, Desulfovibrio và Lactobacillus [34, 37, 38]. Vi sinh vật đường ruột ở những người thừa cân hoặc béo phì có khả năng tiêu thụ nhiều năng lượng từ thức ăn để tăng cân, và cũng có thể gây tác động tiêu cực lên hormone đường ruột [39, 40]. Thậm chí một số chủng vi khuẩn đường ruột quan trọng nhất định, chẳng hạn như vi khuẩn Thetaiotamicron và Methanobrevibacter smithii, vẫn có thể thúc đẩy sự tích tụ chất béo [41]. Tuy nhiên, Larsen và cộng sự đã phát hiện một sự tăng tỷ lệ của nhóm vi khuẩn Bacteroides-Prevotella-Porphyromonas so với các vi khuẩn thuộc nhóm Firmicutes sau khi trẻ dùng Lactobacillus Salvius Ls-33 trong 12 tuần, cho thấy Ls-33 có hoạt động điều tiết đối với hệ vi sinh vật đường ruột [36] . Và trong các nghiên cứu khác, người ta cũng nhận thấy rằng bổ sung men vi sinh có thể làm tăng số lượng Bifidobacteria và axit béo chuỗi ngắn (SCFA) sản xuất Lactobacilli trong ruột. Axit linoleic liên hợp được sản xuất bởi Bifidobacterium spp. và Lactobacillus spp. có thể thúc đẩy quá trình phân giải lipid [42]. Ngoài ra, men vi sinh làm tăng lượng Akkermansia muciniphila dồi dào, chất này thúc đẩy bài tiết chất nhầy biểu mô ruột, củng cố hàng rào ruột, làm giảm nồng độ lipopolysacarit (LPS) trong huyết thanh, nồng độ TC, TG và LDL-C, đồng thời tăng HDL-C [43] . Chen và cộng sự [34] phát hiện ra rằng việc sử dụng men vi sinh bằng đường uống làm tăng nồng độ Lactobacillus spp. và B. Animalis ở trẻ béo phì, trong đó Lactobacillus spp. tác động tiêu cực đến TC, LDL-C và chuyển hóa lipid etheric nhưng tác động tích cực với HDL-C, và B. Animalis có tác động tích cực với HDL và nồng độ adiponectin huyết thanh và tác động tiêu cực với mức độ viêm. Hơn nữa, nồng độ B. fragilis và E. coli thấp đã được quan sát thấy trong nhóm dùng men vi sinh và sự phong phú của chúng có mối tương quan tích cực với bệnh béo phì.
6.2 Men vi sinh điều hòa quá trình chuyển hóa lipid
Thừa cân hoặc béo phì là kết quả của sự tích tụ lipid quá mức, trong đó chế độ ăn nhiều chất béo và calo cao khiến việc sản xuất lipid vượt quá quá trình phân giải lipid [44]. Tuy nhiên, men vi sinh có thể ức chế sự tích tụ lipid bằng cách cải thiện quá trình chuyển hóa lipid.
Cụ thể, đầu tiên là cải thiện lipid huyết thanh. Ví dụ, hỗn hợp men vi sinh có chứa Lactobacillus salivarius AP-32, Lactobacillus rhamnosus bv-77 và Bifidobacterium Animalis CP-9 có thể làm giảm nồng độ TC và LDL-C trong huyết thanh, tăng rõ rệt mức HDL-C [34].
Thứ hai, điều chỉnh sự biểu hiện của các phân tử liên quan đến lipid. Chẳng hạn như L. plantarum HAC01 có khả năng giảm sự biểu hiện của các gene liên quan đến quá trình tạo mỡ, ví dụ như synthase axit béo và stearoyl-CoA desaturase [45]. B. breve B-3 làm tăng biểu hiện protein 4 giống angiopoietin, có thể ức chế lipoprotein Lipase để giảm tích tụ chất béo [46]. L. kefiri có thể làm tăng biểu hiện của thụ thể-α được kích hoạt bởi chất tăng sinh peroxisome (PPAR-α), sau đó là điều chỉnh tăng biểu hiện của protein liên kết với axit béo 4 (FABP4) và Carnitine palmitoyltransferase-1 (CPT-1). Trong đó, FABP4 là protein ngoại bào có tác dụng ức chế quá trình tạo mỡ và thúc đẩy quá trình phân giải lipid, và CPT-1 là enzyme giới hạn tốc độ oxy hóa axit béo, xúc tác quá trình oxy hóa β của axit béo vào ma trận ty thể. L. sakei OK67 tăng cường sự biểu hiện của adenosine monophosphate kinase (AMPK), kích hoạt CPT-1 để thúc đẩy quá trình oxy hóa β axit béo ty thể, đồng thời giảm hoạt động của acetyl-CoA carboxylase và protein gắn kết yếu tố điều chỉnh sterol (SREBP-1c) để ức chế quá trình tổng hợp axit béo [47, 48, 49, 50, 51].
Thứ ba, men vi sinh có thể hòa tan axit mật. Chủng Lactobacilli và Bifidobacteria có khả năng sinh enzyme muối mật hydrolase, có khả năng thủy phân các axit mật liên kết thành axit mật tự do, các axit mật tách rời khó tái hấp thu ở ruột và chủ yếu thải ra ngoài qua phân. Điều này thúc đẩy quá trình dị hóa cholesterol để tổng hợp nhiều axit mật hơn và do đó làm giảm mức cholesterol [ 52 ].
Ngoài ra, axit mật có thể điều chỉnh nồng độ lipid bằng receptor farnesoid X (FXR) và axit mật thứ cấp. Một mặt, sự liên kết của acid mật với FXR sẽ ức chế sự biểu hiện của SREBP-1c, sau đó ngăn chặn sự tổng hợp TG bằng enzyme tổng hợp axit béo và cũng làm giảm nồng độ lipoprotein mật độ rất thấp. Ngoài ra, FXR làm tăng quá trình oxy hóa axit béo bằng cách tăng biểu hiện của thụ thể được kích hoạt PPAR-α [ 53 , 54 ]. Mặt khác, axit mật thứ cấp được tạo ra bởi sự tương tác giữa axit mật nguyên phát và hệ vi khuẩn đường ruột là phối tử cho thụ thể kết hợp protein G 5, làm giảm nồng độ TG trong gan [55].
6.3 Men vi sinh có thể làm giảm viêm và đáp ứng miễn dịch
Các loại tế bào trong mô mỡ ở người béo và người gầy là khác nhau. Ở người gầy, mô mỡ chủ yếu chứa tế bào lympho Treg, tế bào lympho Th2, bạch cầu ái toan và đại thực bào M2 trong khi ở người béo phì, nó chủ yếu bao gồm các đại thực bào CD8+ Tc, CD4+ Th1 và M1. Sự xâm nhập của đại thực bào tiền viêm vào mô mỡ làm tăng mức độ béo phì cao hơn và các tế bào mỡ tiết ra nhiều yếu tố gây viêm hơn như leptin, visfactin, resistin, kích hoạt yếu tố hạt nhân kappa-B (NF-κB) và protein hoạt hóa 1, do đó tạo ra nhiều yếu tố gây viêm hơn như như TNF-α và interleukin-6, gây ra chứng viêm liên quan đến béo phì [56, 57, 58]. Men vi sinh có thể làm giảm việc sản xuất các yếu tố gây viêm và tăng các yếu tố chống viêm do tế bào mỡ tiết ra. Ví dụ, cả hai nghiên cứu đều quan sát thấy mức độ leptin hoặc TNF-α giảm đáng kể và mức độ adiponectin tăng lên sau khi trẻ được sử dụng hỗn hợp men vi sinh [34, 35]. Adiponection, một chất ức chế viêm, có thể ức chế sự kích hoạt NF-κB của thụ thể và phân biệt các đại thực bào với kiểu hình M2 chống viêm [59]. Ngoài ra, trong một số thí nghiệm trên động vật, người ta phát hiện ra rằng men vi sinh có thể điều chỉnh phản ứng miễn dịch và giảm mức độ viêm. B. Animalis subsp. lactis Bi1 , B. breve Bbr 8 và B. breve BL10 có thể làm giảm số lượng tế bào CD4+ T, tổng số đại thực bào và đại thực bào M1 đã hoạt hóa cũng như giảm mức độ TNF-α và interferon-γ bằng cách ức chế hoạt hóa NF-κB, nhưng làm tăng sản xuất interleukin-10 và biến đổi yếu tố tăng trưởng-β [60]. L. rhamnosus LMG S-28148 và B. Animalis subsp. lactis LMG P-28149 làm giảm sự biểu hiện của gen đặc hiệu đại thực bào CD68 và F4/80, đồng thời tăng mức độ đánh dấu tế bào T điều hòa FOXP3 trong mô mỡ, chứng minh rằng men vi sinh có thể thúc đẩy sự xâm nhập của tế bào Treg vào mô mỡ và gián tiếp ức chế quá trình viêm chuyển hóa [61].
6.4 Men vi sinh có thể làm giảm viêm và đáp ứng miễn dịch
SCFA là chất chuyển hóa được tạo ra bởi men vi sinh trong quá trình lên men và phân hủy tinh bột của men vi sinh, các polysaccharide khó tiêu hóa, cellulose, polysaccharide không chứa chất xơ và chất nhầy trong ruột [62, 63].
Trước hết, SCFAs có khả năng làm giảm giá trị pH của hệ vi sinh vật đường ruột và ức chế sự phát triển của vi khuẩn gây bệnh thích hợp với môi trường kiềm yếu. Ngoài ra, SCFAs đóng vai trò quan trọng trong việc điều hòa quá trình chuyển hóa năng lượng và phản ứng miễn dịch của cơ thể sau khi đi vào hệ tuần hoàn dưới dạng tín hiệu phân tử. Thứ nhất, SCFAs có thể tương tác với thụ thể liên kết với protein G (GPR) 41 và GPR43 để tăng biểu hiện của polypeptide YY và glucagon - như peptide 1 trong ruột, kích thích những thay đổi về đặc điểm dễ bị kích thích của tế bào thần kinh vỏ não, tăng cường cảm giác no và giảm tích tụ chất béo [64].
Thứ hai, SCFAs kích hoạt AMPK ở gan và cơ, làm tăng quá trình oxy hóa axit béo [65]. Axit axetic cũng có thể làm tăng sự biểu hiện của các gen oxy hóa lipid của ty thể [66].
Thứ ba, axit axetic, axit propionic và axit butyric, chiếm hơn 95% SCFA, có thể làm giảm tình trạng viêm cấp độ thấp liên quan đến các bệnh chuyển hóa bằng cách ức chế hoạt động của NF-κB và giảm sự xâm nhập của đại thực bào cục bộ để giảm sản xuất của các cytokine và chemokine gây viêm [ 67 ]. T
hứ tư, SCFAs có thể kích thích tiết ra các protein và chất nhầy liên kết chặt chẽ trong niêm mạc ruột để tăng cường tính toàn vẹn của hàng rào biểu mô ruột, do đó làm giảm sự xâm nhập ra bên ngoài của LPS trong lòng ruột và ngăn ngừa sự xuất hiện của chuỗi phản ứng viêm [ 68 ] .
6.5 Men vi sinh làm giảm căng thẳng oxy hóa (oxidative stress) và căng thẳng lên lưới nội chất (stress endoplasmic reticulum)
Chế độ ăn nhiều đường và nhiều chất béo kéo dài tạo ra dư thừa các loại oxy phản ứng (ROS), dẫn đến stress oxy hóa, được đặc trưng bởi sự mất cân bằng giữa các gốc tự do và chất chống oxy hóa trong cơ thể hay khả năng oxy hóa lớn hơn tác dụng chống oxy hóa. Stress oxy hóa mức độ nghiêm trọng là một yếu tố quan trọng trong cơ chế bệnh sinh của bệnh béo phì. Cụ thể, ROS dư thừa có thể gây ra quá trình peroxid hóa lipid làm giảm điện thế màng ty thể và gây ra rối loạn chức năng ty thể, từ đó làm giảm quá trình oxy hóa β của axit béo, tăng TG và suy giảm chuyển hóa lipid bình thường [69]. Người ta phát hiện ra rằng LAB có khả năng loại bỏ các gốc tự do và ức chế quá trình peroxid hóa lipid [70]. L. coryniformis subsp. Tormen T3 và L. paracasei subsp. paracasei M5 có thể làm tăng mức độ Glutathione Peroxidase, catalase và tổng superoxide dismutase và làm giảm hàm lượng malondialdehyd của sản phẩm peroxid hóa lipid ở người béo phì [71].
Áp lực của mạng lưới nội chất, cụ thể là sự kết tập của các protein chưa được mở ra, cũng là một yếu tố gây bệnh béo phì. L. plantarum MTCC5690 và L. fermentum MTCC5689 làm giảm chế độ ăn nhiều chất béo gây ra sự gia tăng các dấu hiệu áp lực của mạng lưới nội chất như GRP78, PERK và IRE1α,... trong cơ xương [72].
Stress oxy hóa và stress mạng lưới nội chất cũng có thể dẫn đến phản ứng viêm thông qua kích hoạt các con đường truyền tín hiệu TNF-α, NF-κB và JNK. L. plantarum MTCC5690, L. fermentum MTCC5689 và L. rhamnosus GG có thể làm giảm mức độ viêm do căng thẳng lưới nội chất gây ra [ 73 ].
6.6 Men vi sinh và các con đường hoạt động khác
Ngoài ra, men vi sinh cũng có thể ức chế sự phát triển và sinh sôi của các tác nhân gây bệnh trong ruột bằng cách cạnh tranh loại trừ và chống lại sự xâm nhập/định cư của các chất chuyển hóa,... Một mặt, men vi sinh có thể ức chế sự phát triển ức chế sự phát triển của tác nhân gây bệnh bằng cách cạnh tranh vị trí receptor và dưỡng chất trong ruột. Ví dụ, Escherichia coli Nissle 1917 và E. coli HS đã ngăn chặn sự phát triển của E. coli gây bệnh bằng cách cạnh tranh cùng loại carbohydrate [74]. Mặt khác, men vi sinh còn có thể tạo ra bacteriocin, một peptide kháng khuẩn bao gồm 30-60 axit amin, có tác dụng ngăn chặn sự phát triển của một số mầm bệnh. Ví dụ, L. plantarum và L. acidophilus sản xuất các peptide kháng khuẩn có tác dụng ức chế sự phát triển và tăng sinh của Helicobacter pylori, C. diffcile, rotavirus, Shigella spp. đa kháng thuốc và E. coli [75]. Reuterin do L. reuteri sản xuất có thể ức chế sự sinh sản của Helicobacter pylori và C. difficile để bảo vệ đường tiêu hóa [76]. Với sự phát triển của công nghệ giải trình tự, ngày càng có nhiều vi khuẩn có lợi trong hệ vi sinh đường ruột được xác định, chẳng hạn như B. fragilis với khả năng ức chế nhiễm vi khuẩn gây bệnh [77].
Trong nghiên cứu này, chúng tôi phát hiện ra rằng men vi sinh có thể làm giảm tình trạng thừa cân hoặc béo phì và các vấn đề sức khỏe liên quan ở trẻ em bằng nhiều cách tiếp cận khác nhau. Nghiên cứu này có thể đóng vai trò là tài liệu tham khảo đáng tin cậy cho các công trình nghiên cứu tiếp theo và các ứng dụng lâm sàng trong tương lai. Tuy nhiên, nghiên cứu của chúng tôi vẫn còn một số hạn chế. Thứ nhất, số lượng thử nghiệm ngẫu nhiên có đối chứng kiểm tra tác dụng của men vi sinh đối với trẻ thừa cân hoặc béo phì còn ít và cỡ mẫu của nghiên cứu được đưa vào còn hạn chế. Thứ hai, hầu hết việc sử dụng men vi sinh đều ở dạng hỗn hợp, trong khi tác dụng của các chủng men vi sinh khác nhau đối với tình trạng thừa cân hoặc béo phì có thể khác nhau, còn thiếu nghiên cứu về tác dụng của từng chủng men vi sinh đơn lẻ. Thứ ba, thời gian quan sát tương đối ngắn của một trong số các bài báo được lựa chọn kết hợp với sự tuân thủ kém của trẻ em trong quá trình nghiên cứu lâm sàng, có thể đã gây ra một số sai lệch trong kết quả.
Vẫn cần tiến hành nhiều nghiên cứu lâm sàng hơn nữa. Trước hết, cần xác định các yếu tố như chủng men vi sinh nào có lợi hơn, hình thức hấp thụ tối ưu và liều lượng thích hợp để hiểu chính xác mối quan hệ giữa men vi sinh với trẻ thừa cân hoặc béo phì. Ngoài ra, cần có một số thí nghiệm cơ bản để khám phá cơ chế hoạt động cụ thể của men vi sinh trong việc cải thiện các vấn đề sức khỏe liên quan đến thừa cân hoặc béo phì, giúp chúng ta có cái nhìn sâu sắc hơn về vai trò của men vi sinh.
7 Kết luận
Trong phân tích tổng hợp này, chúng tôi phát hiện ra rằng men vi sinh có thể cải thiện HDL-C, LDL-C, adiponectin, leptin và TNF-α ở trẻ thừa cân hoặc béo phì, do đó chúng tôi đã kiểm tra cơ chế hoạt động của men vi sinh thông qua đánh giá có hệ thống và nhận thấy rằng men vi sinh hoạt động chủ yếu bằng cách ổn định lại hệ vi sinh vật đường ruột bị rối loạn, điều hòa chuyển hóa lipid, giảm tình trạng viêm và phản ứng miễn dịch, phát huy tác dụng tích cực của SCFAs được tạo ra, giảm bớt stress oxy hóa và stress mạng lưới nội chất, đồng thời ức chế sự phát triển và sinh sản của mầm bệnh trong ruột.
8 Tài liệu tham khảo
1. Parmaksız G, Kekeç ŞD, Cengiz ND, Noyan A. The relationship between body mass index and renal length in obese children. Pediatr Nephrol. 2020;35(5):901–5.
2. Cathaoir KÓ. Childhood obesity and the right to health. Health Hum Rights. 2016;18(1):249–62.
3. Gonzalez-Muniesa P, Martinez-Gonzalez MA, Hu FB, Despres JP, Matsuzawa Y, et al. Obesity. Nat Rev Dis Primers. 2017;3:17034.
4. Sommer A, Twig G. The impact of childhood and adolescent obesity on cardiovascular risk in adulthood: a systematic review. Curr Diab Rep. 2018;18:91.
5. Milaneschi Y, Simmons WK, van Rossum EFC, Penninx BWJH. Depression and obesity: evidence of shared biological mechanisms. Mol Psychiatry. 2019;24:18–33.
6. Mühlig Y, Antel J, Föcker M, Hebebrand J. Are bidirectional associations of obesity and depression already apparent in childhood and adolescence as based on high-quality studies? A systematic review. Obes Rev. 2016;17:235–49.
7. Ludwig DS. Lifespan weighed down by DietDiet and decreasing LifespanDiet and decreasing lifespan. JAMA. 2016;315:2269–70.
8. Sisson SB, Krampe M, Anundson K, Castle S. Obesity prevention and obesogenic behavior interventions in child care: a systematic review. Prev Med. 2016;87:57–69.
9. Bull FC, Al-Ansari SS, Biddle S, Borodulin K, Buman MP, Cardon G, et al. World health organization 2020 guidelines on physical activity and sedentary behaviour. Br J Sports Med. 2020;54(1451–62):21.
10. Wu CL, Chang CK. Results from the Chinese Taipei (Taiwan) 2018 report card on physical activity for children and youth. J Exerc Sci Fit. 2019;17:8–13.
11. Robinson TN, Banda JA, Hale L, Lu AS, Fleming-Milici F, et al. Screen media exposure and obesity in children and adolescents. Pediatrics. 2017;140:S97–101.
12. Hale L, Guan S. Screen time and sleep among school-aged children and adolescents: a systematic literature review. Sleep Med Rev. 2015;21:50–8.
13. Economos CD, Hammond RA. Designing effective and sustainable multifaceted interventions for obesity prevention and healthy communities. Obesity. 2017;25:1155–6.
14. DeSalvo KB, Olson R, Casavale KO. Dietary guidelines for AmericansDietary guidelines for AmericansDietary guidelines for Americans. JAMA. 2016;315:457–8.
15. Paruthi S, Brooks LJ, D’Ambrosio C, Hall WA, Kotagal S, et al. Recommended amount of sleep for pediatric populations: a consensus statement of the American academy of sleep medicine. J Clin Sleep Med. 2016;12:785–6.
16. Chao AM, Wadden TA, Berkowitz RI. The safety of pharmacologic treatment for pediatric obesity. Expert Opin Drug Saf. 2018;17:379–85.
17. Kelly AS, Fox CK. Role of pharmacotherapy in the treatment of pediatric obesity and its comorbidities in pediatric obesity: etiology. In: Freemark MS, editor. Pathogenesis and treatment. Cham: Springer International Publishing; 2018. p. 613–27.
18. Michalsky M, Reichard K, Inge T, Pratt J, Lenders C. ASMBS pediatric committee best practice guidelines. Surg Obes Relat Dis. 2012;8:1–7.
19. Kong C, Gao R, Yan X, Huang L, Qin H. Probiotics improve gut microbiota dysbiosis in obese mice fed a high-fat or high-sucrose diet. Nutrition. 2019;60:175–84.
20. Yu Z, Yu XF, Zhao X, Su Z, Ren PG. Greater alteration of gut microbiota occurs in childhood obesity than in adulthood obesity. Front Pediatr. 2023;26(11):1087401.
21. Turnbaugh PJ. Microbes and diet-induced obesity: fast, cheap, and out of control. Cell Host Microbe. 2017;21(3):278–81.
22. Ley RE, Bäckhed F, Turnbaugh P, Lozupone CA, Knight RD, Gordon JI. Obesity alters gut microbial ecology. Proc Natl Acad Sci USA. 2005;102(31):11070–5.
23. Sánchez B, Delgado S, Blanco-Míguez A, Lourenço A, Gueimonde M, Margolles A. Probiotics, gut microbiota, and their influence on host health and disease. Mol Nutr Food Res. 2017. https://doi.org/10.1002/mnfr.201600240.
24. Zhang Q, Wu Y, Fei X. Effect of probiotics on body weight and body-mass index: a systematic review and meta-analysis of randomized, controlled trials. Int J Food Sci Nutr. 2015;67:571–80.Li et al. Journal of Translational Medicine (2023) 21:525 Page 12 of 13
25. Jones RB, Alderete TL, Martin AA, Geary BA, Hwang DH, Palmer SL, et al. Probiotic supplementation increases obesity with no detectable effects on liver fat or gut microbiota in obese Hispanic adolescents: a 16-week, randomized, placebo-controlled trial. Pediatr Obes. 2018;13:705–14.
26. Million M, Angelakis E, Paul M, Armougom F, Leibovici L, Raoult D. Comparative meta-analysis of the effect of lactobacillus species on weight gain in humans and animals. Microb Pathog. 2012;53:100–8.
27. Moher D, Liberati A, Tetzlaff J, Altman DG. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. PLoS Med. 2009;6:e1000097.
28. Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The cochrane collaboration’s tool for assessing risk of bias in randomised trials. BMJ. 2011;343:d5928.
29. The Nordic Cochrane Centre, T.C.C. Review Manager (RevMan) 2020. [19 February 2021].
30. Li Y, Wu Y, Wu L, Qin L, Liu T. The effects of probiotic administration on patients with prediabetes: a meta-analysis and systematic review. J Transl Med. 2022;20(1):498.
31. Zheng Y, Wang M, He S, Ji G. Short-term effects of intragastric balloon in association with conservative therapy on weight loss: a meta-analysis. J Transl Med. 2015;29(13):246.
32. Bai Z, Fong KNK, Zhang JJ, Chan J, Ting KH. Immediate and long-term effects of BCI-based rehabilitation of the upper extremity after stroke: a systematic review and meta-analysis. J Neuroeng Rehabil. 2020;17(1):57.
33. Zhuanzhuan Ai. Intervention study on energy metabolism and inflammatory factors in children with simple obesity by Lactobacillus bifidum triplex tablets. Fujian: Fujian University of Medical Science; 2019.
34. Chen AC, Fang TJ, Ho HH, Chen JF, Kuo YW, Huang YY, Tsai SY, Wu SF, Lin HC, Yeh YT. A multi-strain probiotic blend reshaped obesity-related gut dysbiosis and improved lipid metabolism in obese children. Front Nutr. 2022;4(9):922993.
35. Zhang AQ, Sun CY, Hu MY, Ren LH, Zhang C, Zhang YJ. Clinical observation on the effect of probiotics on leptin, lipocalin and blood lipid levels in children with simple obesity[J]. Int J Immunol. 2014;37(6):543–5.
36. Larsen N, Vogensen FK, Gøbel RJ, Michaelsen KF, Forssten SD, Lahtinen SJ, Jakobsen M. Effect of Lactobacillus salivarius Ls-33 on fecal microbiota in obese adolescents. Clin Nutr. 2013;32(6):935–40.
37. Vinke PC, El Aidy S, van Dijk G. The role of supplemental complex dietary carbohydrates and gut microbiota in promoting cardiometabolic and immunological health in obesity: lessons from healthy non-obese individuals. Front Nutr. 2017;4:34.
38. Indiani C, Rizzardi KF, Castelo PM, Ferraz LFC, Darrieux M, Parisotto TM. Childhood obesity and fifirmicutes/bacteroidetes ratio in the gut microbiota: a systematic review. Child Obes. 2018;14:501–9.
39. Machado MV, Cortez-Pinto H. Diet, microbiota, obesity, and NAFLD: a dangerous quartet. Int J Mol Sci. 2016;17:481.
40. Kirpich IA, Marsano LS, Mcclain CJ. Gut–liver axis, nutrition, and non-alcoholic fatty liver disease. ClinBiochem. 2015;48:923–30.
41. Conterno L, Fava F, Viola R, Tuohy KM. Obesity and the gut microbiota: does up-regulating colonic fermentation protect against obesity and metabolic disease? Genes Nutr. 2011;6:2410–3260.
42. Daniali M, Nikfar S, Abdollahi M. A brief overview on the use of probiotics to treat overweight and obese patients. Expert Rev Endocrinol Metab. 2020;15:1–4.
43. Cerdó T, García-Santos JA, García-Bermúdez M, Azcona-Sanjulián MC. The role of probiotics and prebiotics in the prevention and treatment of obesity. Nutrients. 2019;11:635.
44. Li X, Zhang Z, Cheng J, Diao C, Yan Y, Liu D, et al. Dietary supplementation of soybean-derived sterols regulates cholesterol metabolism and intestinal microbiota in hamsters. Journal of Functional Foods. 2019;59:242–50.
45. Park S, Ji Y, Jung HY, Park H, Kang J, Choi SH, et al. Lactobacillus plantarum HAC01 regulates gut microbiota and adipose tissue accumulation in a dietinduced obesity murine model. Appl Microbiol Biotechnol. 2017;101:1605–14.
46. Nova E, De Heredia FP, Gómez-Martínez S, Marcos A. The role of probiotics on the microbiota. Nutr Clin Pract. 2016;31:387–400.
47. Wu Q, Wang Q, Fu J, Ren R. Polysaccharides derived from natural sources regulate triglyceride and cholesterol metabolism: a review of the mechanisms. Food Funct. 2019;10:2330–9.
48. Jang HM, Han SK, Kim JK, Oh SJ, Jang HB, Kim DH. Lactobacillus sakei alleviates high-fat-diet-induced obesity and anxiety in mice by inducing AMPK activation and SIRT1 expression and inhibiting gut microbiotamediated NF-κB activation. Mol Nutr Food Res. 2019;63:1800978.
49. Ray M, Hor PK, Ojha D, Soren JP, Singh SN, Mondal KC. Bifidobacteria and its rice fermented products on diet induced obese mice: analysis of physical status, serum profile and gene expressions. Benef Microbes. 2018;9:441–52.
50. Dahiya DK, Puniya M, Shandilya UK, Dhewa K, Kumar N, Kumar S, et al. Gut microbiota modulation and its relationship with obesity using prebiotic fibers and probiotics: a review. Front Microbiol. 2017;8:563.
51. Davie E, Forte GM, Petersen J. Nitrogen regulates AMPK to control TORC1 signaling. Curr Biol. 2015;25:445–54.
52. Watanabe M, Houten SM, Wang L, Moschetta A, Mangelsdorf DJ, Heyman RA, et al. Bile acids lower triglyceride levels via a pathway involving FXR, SHP, and SREBP-1c. J Clin Investig. 2004;113:1408–18.
53. Ding L, Yang L, Wang Z, Huang W. Bile acid nuclear receptor FXR and digestive system diseases. Acta Pharm Sin B. 2015;5:135–44.
54. Jiao Y, Lu Y, Li XY. Farnesoid X receptor: a master regulator of hepatic triglyceride and glucose homeostasis. Acta Pharmacol Sin. 2015;36:44–50.
55. Düfer M, Hörth K, Krippeit-Drews P, Drews G. The signifificance of the nuclear farnesoid X receptor (FXR) in β cell function. Islets. 2012;4:333–8.
56. Rainone V, Schneider L, Saulle I, Ricci C, Biasin M, Al-Daghri NM, Giani E, Zuccotti GV, Clerici M, Trabattoni D. Upregulation of inflammasome activity and increased gut permeability are associated with obesity in children and adolescents. Int J Obes. 2016;40(6):1026–33.
57. Stofkova A. Resistin and visfatin: Regulators of insulin sensitivity, inflammation and immunity. Endocr Regul. 2010;44:25–36.
58. McGee KC, Harte AL, da Silva NF, Al-Daghri N, Creely SJ, Kusminski CM, et al. Visfatin is regulated by rosiglitazone in type 2 diabetes mellitus and influenced by NF-κB and JNK in human abdominal subcutaneous adipocytes. PLoS ONE. 2011;6:e20287.
59. Kadowaki T, Yamauchi T, Kubota N, Hara K, Ueki K, Tobe K. Adiponectin and adiponectin receptors in insulin resistance, diabetes, and the metabolic syndrome. J Clin Investig. 2006;116:1784–92.
60. Roselli M, Finamore A, Brasili E, Rami R, Nobili F, Orsi C, et al. Beneficial effects of a selected probiotic mixture administered to high fat-fed mice before and after the development of obesity. J Funct Foods. 2018;45:321–9.
61. Alard J, Lehrter V, Rhimi M, Mangin I, Peucelle V, Abraham AL, et al. Beneficial metabolic effects of selected probiotics on diet-induced obesity and insulin resistance in mice are associated with improvement of dysbiotic gut microbiota. Environ Microbiol. 2016;18:1484–97.
62. Bermudez-Brito M, Plaza-Díaz J, Muñoz-Quezada S, Gómez-Llorente C, Gil A. Probiotic mechanisms of action. Ann Nutr Metab. 2012;61(2):160–74.
63. Chen L, Gnanaraj C, Arulselvan P, El-Seedi H, Teng H. A review on advanced microencapsulation technology to enhance bioavailability of phenolic compounds: based on its activity in the treatment of type 2 diabetes. Trends Food Sci Technol. 2019;85:149–62.
64. Hur KY, Lee MS. Gut microbiota and metabolic disorders. Diabetes Metab J. 2015;39:198–203.
65. Canfora EE, Jocken JW, Blaak EE. Short-chain fatty acids in control of body weight and insulin sensitivity. Nat Rev Endocrinol. 2015;11:577–91.
66. Yamashita H, Maruta H, Jozuka M, Kimura R, Iwabuchi H, Yamato M, et al. Effects of acetate on lipid metabolism in muscles and adipose tissues of type 2 diabetic otsuka long-evans tokushima fatty (OLETF) rats. Biosci Biotechnol Biochem. 2009;73:570–6.
67. Canfora EE, Jocken JW, Blaak EE. Short-chain fatty acids in control of body weight and insulin sensitivity. Nat Rev Endocrinol. 2015;11(10):577–91.
68. Ciccia F, Guggino G, Rizzo A, Alessandro R, Luchetti MM, Milling S, Saieva L, Cypers H, Stampone T, di Benedetto P, et al. Dysbiosis and zonulin upregulation alter gut epithelial and vascular barriers in patients with ankylosing spondylitis. Ann Rheum Dis. 2017;76:1123–32.
69. Wang X, Ota N, Manzanillo P, Kates L, Zavala-Solorio J, Eidenschenk C, et al. Interleukin-22 alleviates metabolic disorders and restores mucosal immunity in diabetes. Nature. 2014;514:237–41.
70. Han Q, Kong B, Chen Q, Sun F, Zhang H. In vitro comparison of probiotic properties of lactic acid bacteria isolated from Harbin dry sausages and selected probiotics. J Funct Foods. 2017;32:391–400.
71. Song W, Song C, Shan Y, Lu W, Zhang J, Hu P, et al. The anti-oxidative effects of three lactobacilli on high-fat diet induced obese mice. RSC Adv. 2016;6:65808–15.
72. Balakumar M, Prabhu D, Sathishkumar C, Prabu P, Rokana N, Kumar R, et al. Improvement in glucose tolerance and insulin sensitivity by probiotic strains of Indian gut origin in high-fat diet-fed C57BL/6J mice. Eur J Nutr. 2018;57:279–95.
73. Yang L, Wang JF, Liu N, Wang X, Wang J, Yang GH, Yang GY, Zhu YH. Lactobacillusjohnsonii L531 protects against salmonella infantis-induced intestinal damage by regulating the NOD activation, endoplasmic reticulum stress, and autophagy. Int J Mol Sci. 2022;23(18):10395.
74. Maltby R, Leatham-Jensen MP, Gibson T, Cohen PS, Conway T. Nutritional basis for colonization resistance by human commensal Escherichia coli strains HS and Nissle 1917 against E. coli O157:H7 in the mouse intestine. PLoS ONE. 2013;8(1):e53957.
75. Jeong D, Kim DH, Song KY, Seo KH. Antimicrobial and anti-biofilm activities of Lactobacillus kefiranofaciens DD2 against oral pathogens. J Oral Microbiol. 2018;10:1472985.
76. Urrutia-Baca VH, Escamilla-García E, de la Garza-Ramos MA, Tamez-Guerra P, Gomez-Flores R, Urbina-Ríos CS. In vitro antimicrobial activity and downregulation of virulence gene expression on Helicobacter pylori by reuterin. Probiotics Antimicro Prot. 2018;10:168–75.
77. Spinler JK, Auchtung J, Brown A, Boonma P, Oezguen N, Ross CL, et al. Nextgeneration probiotics targeting clostridium difficile through precursordirected antimicrobial biosynthesis. Infect Immun. 2017;85:e00303-e317.

