Suy tuyến yên: nguyên nhân, triệu chứng và phác đồ điều trị

1 NGUYÊN LÝ CHUNG
1.1 Định nghĩa
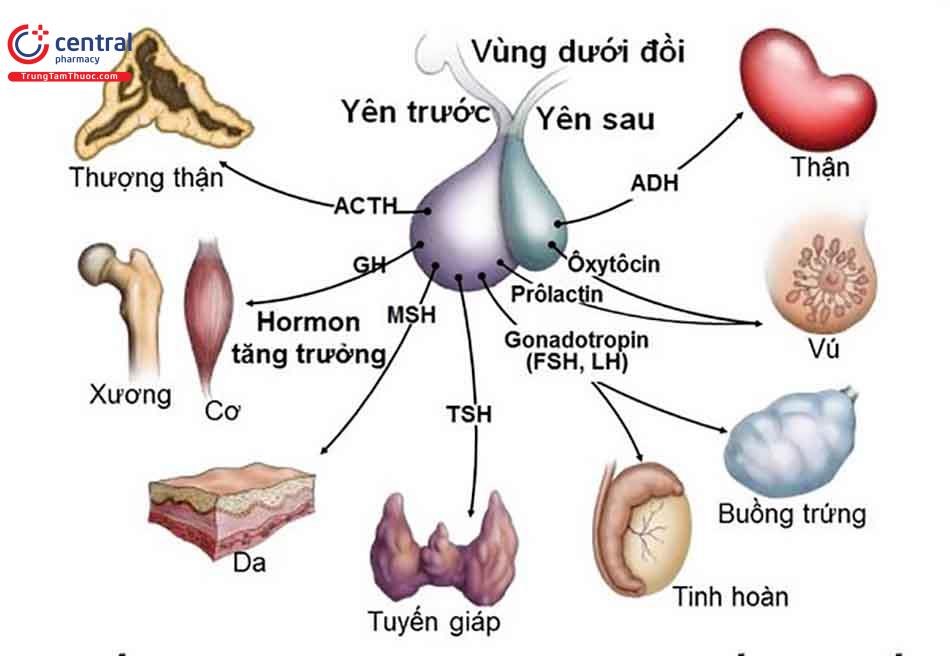
Suy tuyến yên là tình trạng giảm tiết hormon ngoại biên do sản xuất không đủ hoặc không hiệu quả các hormon tuyến yên bao gồm cả suy thượng thận thứ phát, suy giáp thứ phát, suy sinh dục thứ phát, thiếu hụt GH và đái tháo nhạt (xem Chương 4, Đái tháo nhạt).
1.2 Dịch tễ học
Các rối loạn bẩm sinh và di truyền gây suy tuyến yên thường xuất hiện ở đầu thời kỳ thơ ấu, tình trạng dậy thì bị chậm lại hoặc không có dậy thì.
Các rối loạn mắc phải có thể xuất hiện trong suốt cuộc đời bệnh nhân. Tỷ lệ lưu hành ở người lớn vào khoảng 45/100.000 người dân [1].
Microadenoma tuyến yên hiếm khi gây suy giảm hormon thùy trước tuyến yên. Suy giảm của ít nhất một hormon tuyến yên xảy ra ở khoảng 60% đến 85% bệnh nhân bị Macroadenoma tuyến yên [2].
Suy thuỷ trước tuyến yên mới xảy ra ở 5% đến 7% các bệnh nhân sau mổ adenoma tuyến yên qua xương bướm [3].
1.3 Bệnh căn
Tình trạng suy tuyến yên có thể là hậu quả của bất kỳ tổn thương hoặc tác động nào tấn công tới vùng dưới đồi hoặc tuyến yên [4].
Tất cả các khối u hổ yên hoặc trên hố yên đều có thể gây suy tuyến yên (xem Chương 1, Các khối u hố yên và trên hố yên). Các căn nguyên bổ sung thêm được tóm tắt trong Bảng 6.15.
Tần suất gặp được báo cáo đối với các căn nguyên đặc hiệu thay đổi tùy theo quần thể đối tượng nghiên cứu [1,6,7] nhưng nhìn chung, hầu hết các tình trạng suy tuyến yên ở người lớn có thể do:
- Adenoma tuyến yên (55%).
- U so hầu (4 -12%).
- Các u của hệ thần kinh trung ương không phải là u tuyến yên ( - 4%).
- Tia xạ không liên quan với bệnh lý tuyến yên (1%).
- Tổn thương não do chấn thương (2 - 4%).
- Hố yên rỗng (1 - 7%).
- Hội chứng Sheehan (1 - 6%).
- Các rối loạn viêm/ thâm nhiễm (1 - 2%).
- Viêm tuyến yên (2%).
- Vô căn (8 - 10%).
Bệnh nhân được điều trị bằng tia xạ đối với cả các bệnh lý tuyến yên và ngoài tuyến yên đều có gia tăng nguy cơ bị suy tuyến yên và tình trạng này có thể xuất hiện tới 20 năm sau điều trị. Nguy cơ càng cao khi liều xạ trị càng cao và thời gian theo dõi sau điều trị càng kéo dài [8].
- Tình trạng thiếu hụt GH xảy ra ở gần như 100% bệnh nhân vào năm thứ 5 sau điều trị mặc dù tần suất mắc mới phụ thuộc vào tiêu chuẩn được sử dụng để chẩn đoán.
- Suy sinh dục thứ phát xảy ra ở 60%, suy giáp thứ phát ở 30% và thượng thận thứ phát ở 60% bệnh nhân tới năm thứ 10 sau điều trị. Tăng nồng độ prolactin máu xảy ra chủ yếu ở bệnh nhân nữ được xạ trị với liều ха > 40Gy.
Trong xạ phẫu não định vị (SRS), tần suất mới mắc đối với suy tuyến yên mới khởi phát cao hơn ở bệnh nhân có adenoma tuyến yên hoạt động chức năng khi so sánh với adenoma tuyến yên không hoạt động chức năng do liều xạ trị sử dụng cao hơn.
- Tỷ lệ bị suy tuyến yên đã được báo cáo là 0% - 40% (trung bình 8,8%) ở các bệnh nhân có adenoma tuyến yên không hoạt động chức năng, 0 - 69% (trung bình 24,3%), ở các bệnh nhân bị bệnh Cushing và 0 - 40% (trung bình 16,4%) ở các bệnh nhân bị to đầu chi [9].
- Thiếu hụt GH xảy ra ở 85% đến 100% bệnh nhân được xạ trị do u não không phải u tuyến yên ở tuổi thơ ấu tới 5 năm sau điều trị, khởi phát bệnh sẽ nhanh hơn nếu được điều trị với liều cao [10].
- 41% bệnh nhân người lớn sử dụng xạ trị cho các u não không phải là u tuyến yên sẽ xuất hiện tình trạng suy tuyến yên sau thời gian trung bình là 3,2 năm [11]. Bệnh nhân bị carcinoma sọ hầu được điều trị tia xạ liều cao tới vùng nền sọ và 62% xuất hiện suy tuyến yên sau 5 năm [12].
Trong tổn thương não do chấn thương, tỷ lệ bị suy tuyến yên do tổn thương não do chấn thương được báo cáo là từ 15 - 68% [13].
- Nguy cơ suy tuyến yên sẽ cao hơn đối với bệnh nhân tổn thương não do chấn thương nặng (35%) so với tổn thương não do chấn thương từ nhẹ tới vừa (11 - 17%) và xảy ra nhiều hơn khi chấn thương bị lặp đi lặp lại (ví dụ, vận động viên đấm bốc, bóng đá) và có thể biểu hiện nhiều năm sau chấn thương [14].
- Tình trạng thiếu hụt hormon lâu dài xảy ra ở 23 - 32% các bệnh nhân bị tổn thương não do chấn thương từ vừa đến nặng.
- Thiếu hụt GH xảy ra ở 20%, suy sinh dục thứ phát ở 11%, suy thượng thận ở 7%, suy giáp thứ phát ở 6% và đái tháo nhạt ở 3% các trường hợp [13,15].
- Tần suất mắc mới đối với thiếu hụt hormon tuyến yên là cao nhất ( > 60% với suy sinh dục thường gặp nhất) trong 3 tháng đầu sau khi bị tổn thương não do chấn thương.
Chảy máu dưới nhện gây suy tuyến yên mạn tính ở 38% các bệnh nhân với thiếu hụt GH xảy ra > 20%, suy sinh dục thứ phát ở 6%, suy thượng thận thứ phát ở 6%, suy giáp thứ phát ở 9% và đái tháo nhạt ở 3% các bệnh nhân [15].
Tình trạng thiếu hụt hormon tuyến yên có thể hồi phục hoặc xuất hiện mới trong vòng 3 đến ≥ 12 tháng sau cả tổn thương não do chấn thương và chảy máu dưới nhện [15,16].
Thuốc ức chế điểm kiểm soát miễn dịch (xem Chương 40, Các tác động nội tiết của thuốc chữa ung thư) có thể gây tình trạng suy tuyến yên.
- CTLA-4 (chất chống lại chất gây độc tế bào T- liên quan kháng nguyên 4 [Anti-cytotoxic T-lymphocyte-associated antigen 4]) và chất gây chết tế bào theo chương trình 1 (PD-1), các kháng thể đơn dòng đối với thụ thể PD-1 ligand (PD-1 ligand receptor monoclonal antibodies) được sử dụng trong điều trị u hắc tố bào và các bệnh lý ác tính khác được kết hợp với một số độc tính về nội tiết bao gồm viêm tuyến yên.
- Tần suất bị viêm tuyến yên cao nhất với ipilimumab, (CTLA-4 mAb) khi so sánh với các anti-CTLA-4 mAbs khác như tremelimumab và anti-PD-1/PD-L1 mAbs (ví dụ, nivolumab, pembrolizumab, atezolizumab, avelumab, và durvalumab).
- Ipilimumab, được dùng để điều trị u hắc tố bào giai đoạn muộn, carcinoma tế bào thận, tuyến tiền liệt và phổi gây viêm tuyến yên tự miễn ở 5 - 17% bệnh nhân [17].
- Bệnh nhân được biểu hiện bằng đau đầu, yếu cơ và các triệu chứng khác liên quan với thiếu hụt hormon.
- Tuyến yên to ra và/hoặc có biểu hiện dạng khối u được thấy trên phim MRI.
- Không giống với các nguyên nhân của suy tuyến yên khác, suy thượng thận thứ phát, suy giáp và suy sinh dục thường gặp nhưng GH vẫn được bảo tồn.
- Suy giáp và suy sinh dục thứ phát có thể hồi phục, song suy thượng thận tiếp diễn ở hầu hết các bệnh nhân trong thời gian dài. Glucorticoid liều cao có thể giúp cải thiện triệu chứng, song chưa được chứng minh là giúp điều trị khỏi tình trạng suy thượng thận khi so sánh với dùng liều điều trị thay thế sinh lý cho bệnh nhân [18].
Sốt xuất huyết với hội chứng thận là một bệnh lý toàn thân nặng do Hantavirus gây nên, bệnh có thể được truyền bởi các động vật gặm nhấm. Tại Hoa Kỳ, Hantavirus thường được gặp hơn ở bờ tây của sông Mississippi, nhất là ở vùng tây nam. Hội chứng này dẫn tới tình trạng suy tuyến yên ở 18% bệnh nhân sau 2 năm theo dõi [19].
| Bảng 6.1. Các nguyên nhân không phải ung thư của suy tuyến yên | |
Điều trị bệnh lý hố yên hoặc trên hố yên
Bệnh lý thâm nhiễm
Mạch máu
Di truyền
Phát triển
Chấn thương
| Nhiễm khuẩn
Thuốc
Bệnh hệ thống
Hố yên rỗng hoặc rỗng một phần Vô căn |
| GnRH (gonadotropin-releasing hormone): Hormon giải phóng kích tố hướng sinh dục. Dữ liệu từ Carmichael JD. Anterior pituitary failure. In: Melmed S, ed. The Pituitary. 4th ed. London: Academic Press; 2017:329-364. | |
2 CHẨN ĐOÁN
Chẩn đoán và điều trị đối với tình trạng suy sinh dục thứ phát, suy thượng thận và suy giáp được thảo luận chi tiết trong các chương riêng cho các bệnh lý này. Chẩn đoán và điều trị thiếu hụt GH ở người trưởng thành sẽ được thảo luận riêng ở dưới.
2.1 Biểu hiện lâm sàng
Tùy thuộc vào căn nguyên, biểu hiện có thể xảy ra đột ngột như trong ngập máu tuyến yên và sau phẫu thuật hoặc xuất hiện âm thầm nhiều năm với các triệu chứng mơ hồ (ví dụ, mệt mỏi, suy giảm nhận thức, giảm khả năng hoạt động thể lực) sau điều trị tia xạ.
Tế bào tiết kích tố hướng sinh dục thường bị tác động nhất và thường xảy ra đơn độc khi không liên quan với căn nguyên u (ví dụ, bệnh mạn tính).
Các tế bào tiết ACTH và TSH ít chịu tác động của hiệu ứng khối nhất và là các tế bào cuối cùng của tuyến yên bị mất chức năng. Suy giáp thứ phát hoặc suy thượng thận thường là chỉ dấu có tình trạng suy toàn bộ tuyến yên.
Thiếu hụt hormon tăng trưởng (GHD) thường thấy khi có thiếu hụt hai hoặc nhiều hơn hormon khác.
Tình trạng thiếu hụt prolactin hiếm gặp và xảy ra khi thùy trước tuyến yên bị phá hủy hoàn toàn như trong ngập máu tuyến yên.
2.2 Tiêu chuẩn chẩn đoán
Nói chung, chẩn đoán có suy giảm hormon tuyến yên được đặt ra khi nồng độ hormon ngoại biên thấp dai dẳng với nồng độ hormon kích tố của tuyến yên thấp hoặc bình thường không thích hợp [4].
Khi có sẵn test để sử dụng và không có chống chỉ định, có thể khẳng định có thiếu hụt hormon trung ương khi làm test kích thích không thấy có tăng nồng độ hormon kích tố tuyến yên.
Chụp MRI tuyến yên có hoặc không tiêm gadolinium là thăm dò hình ảnh học được ưu tiên áp dụng để loại trừ khối u hố yên. Kỹ thuật này được khuyến cáo ngay cả khi nghĩ tới căn nguyên có thể không phải là do khối u.
3 ĐIỀU TRỊ
Bệnh nhân bị bệnh lý cấp tính với suy thượng thận thứ phát phải được điều trị bằng glucocorticoid liều stress (stress-dose glucocorticoids).
Bệnh nhân có biểu hiện ngập máu tuyến yên phải được bắt đầu điều trị glucocorticoid thay thế ngay trong khi chờ kết quả xét nghiệm chẩn đoán suy thượng thận.
Suy thượng thận có thể làm che dấu tình trạng đái tháo nhạt không hoàn toàn và các triệu chứng đái tháo nhạt có thể được thấy rõ sau khi tiến hành điều trị glucocorticoid thay thế [20].
4 CÁC TRƯỜNG HỢP ĐẶC BIỆT
Các bệnh nhân nữ bị suy tuyến yên cần được theo dõi sát trong quá trình mang thai do cần điều chỉnh liều thuốc sử dụng.
Hydrocortison hoặc prednison có thể được dùng trong khi có thai. Dexamethason không bị nhau thai gây bất hoạt, vì vậy không nên dùng. Có thể cần tăng liều dùng glucocorticoid trong ba tháng cuối của thai kỳ.
Bệnh nhân bị suy giáp nguyên phát hoặc thứ phát nói chung cần tăng liều levothyroxin của họ lên thêm 30% khi mang thai. Nồng độ 14 tự do phải được theo dõi 4 - 6 tuần/lần trong khi mang thai và điều chỉnh liều để duy trì được một nồng độ 14 tự do trong giới hạn bình thường cao.
Điều trị thay thế GH không được khuyến cáo trong khi có thai.
5 THIẾU HỤT HORMON TĂNG TRƯỞNG Ở NGƯỜI LỚN (AGHD)
5.1 Biểu hiện lâm sàng
Các triệu chứng của AGDH không đặc hiệu và có thể bao gồm tình trạng yếu cơ, giảm khả năng hoạt động thể lực, mệt mỏi, giảm chất lượng cuộc sống.
Thiếu hụt hormon tăng trưởng ở người lớn thường kết hợp với tình trạng rối loạn lipid máu, kháng insulin và tăng các chỉ dấu viêm, giảm sức mạnh cơ bắp, giảm khối xương và khối nạc của cơ thể và tăng nguy cơ bị bệnh lý tim mạch [21,22].
5.2 Chẩn đoán
Các test để phát hiện tình trạng AGHD có thể được xem xét trong các tình huống sau:
- Bệnh nhân có tiền sử thiếu hụt GH khởi phát từ tuổi thơ ấu và hiện bệnh nhân đạt tới chiều cao của người trưởng thành.
- Bệnh nhân có tiền sử bị bệnh lý dưới đồi hoặc tuyến yên hoặc phẫu thuật và/hoặc tia xạ tuyến yên hoặc vùng dưới đồi.
- Bệnh nhân có tiền sử chấn thương đầu (ví dụ, tổn thương não do chấn thương hoặc chảy máu dưới nhện).
- Bệnh nhân có tiền sử bị suy giảm hay thiếu hụt các hormon tuyến yên khác.
Một nồng độ IGF-1 trong giới hạn bình thường không đủ để loại trừ tình trạng thiếu hụt GH và xét nghiệm định lượng GH làm ngẫu nhiên không đủ để chẩn đoán AGHD, do GH được giải phóng thành từng đợt.
Test kích thích GH ở người lớn:
Một số thuốc gây kích thích tiết GH ở người bình thường có thể được dùng để xác nhận chẩn đoán tình trạng thiếu hụt GH.
- Nghiệm pháp dung nạp insulin (ITT) được cho là tiêu chuẩn vàng để đánh giá thiếu hụt GH ở người lớn [3] song hiếm khi được thực hiện do tính an toàn khi làm nghiệm pháp. Insulin người loại tác dụng nhanh với liều 0,05 - 0,15 IU/kg được dùng đường tĩnh mạch để làm giảm nồng độ Glucose xuống dưới 2,2 mmol/L (40 mg/dL). Lấy các mẫu máu để định lượng nồng độ GH được thực hiện vào lúc đói 20, 30, 40 và 60 phút sau khi xảy ra tình trạng hạ đường máu. Nồng độ GH < 3 đến 5 ug/L sau khi bị hạ đường máu có độ nhạy 96% và độ đặc hiệu 92% để chẩn đoán AGHD [23].
- Nghiệm pháp phối hợp Arginin với hormon gây phóng thích hormon tăng trưởng (GHRH) (the growth hormone-releasing hormone (GHRH)-arginine test) thường được thực hiện ở các nước ngoài Hoa Kỳ (theo các công bố GHRH không có trên thị trường Hoa Kỳ). GHRH kích thích trực tiếp chế tiết GH từ tuyến yên và arginin làm gia tăng đáp ứng của tuyến yên với GHRH bằng cách gây ức chế Somatostatin. Sử dụng GHRH liều bolus tĩnh mạch là 1 ug/kg và tiếp theo cho arginin (30 g) truyền trong 30 phút. Lấy các mẫu máu để định lượng nồng độ GH máu ở mức giá trị nền và mỗi 30 phút trong 120 phút. Do đáp ứng tiết GH bị giảm đi ở các đối tượng béo phì, giá trị điểm cắt của GH phụ thuộc vào chỉ số khối cơ thể (BMI) (< 11,0 ug/L đối với BMI > 30, < 8,0 ug/L đối với BMI 25 - 30, và < 4,0 ug/L đối với BMI <25) [24].
- Nghiệm pháp kích thích bằng glucagon có thể được sử dụng khi không có sẵn GHRH để sử dụng và ITT bị chống chỉ định hoặc không được áp dụng trong thực hành [21]. Cơ chế chính xác gây kích thích GH không được biết song có thể do glucagon gây giải phóng insulin nội sinh thứ phát khi đáp ứng với tăng nồng độ đường máu. 1 mg glucagon tiêm bắp (1,5 mg nếu trọng lượng của bệnh nhân > 90 kg), tiến hành định lượng nồng độ đường máu và GH huyết thanh ở mức giá trị nền 30 phút/lần trong vòng 4 giờ. Khi giá trị đỉnh của GH<3 ug/L ở bệnh nhân có BMI < 25 được cho là phù hợp với tình trạng thiếu hụt GH. Giá trị điểm cắt GH<1 ng/L đã được đề xuất cho các bệnh nhân có BMI > 25 để làm giảm khả năng chẩn đoán quá mức tình trạng thiếu hụt GH ở người lớn [24].
- Hội Nội tiết Hoa Kỳ khuyến cáo các dữ liệu sau được sử dụng để chẩn đoán tình trạng thiếu hụt GH ở người lớn [21]:
- Đối với bệnh nhân có bệnh cảnh lâm sàng gợi ý khả năng bị thiếu hụt GH (ví dụ, tiền sử tia xạ tuyến yên), không cần phải làm nghiệm pháp kích thích ở bệnh nhân bị thiếu hụt ≥ 3 hormon và nồng độ IGF-1 thấp so với giới tính và tuổi tương ứng thì khả năng bị thiếu hụt GH đồng thời là cao.
- Nghiệm pháp kích thích chỉ được khuyến cáo để xác định chẩn đoán ở bệnh nhân bị thiếu hụt < 3 hormon.
- Do hiếm gặp thiếu hụt GH vô căn khởi phát ở người lớn. Nên tiến hành hai nghiệm pháp kích thích để xác định chẩn đoán.
5.3 Điều trị
Do có các tranh luận liên quan với điều trị cho người lớn bị thiếu hụt GH, quyết định bắt đầu cho một bệnh nhân cần điều trị thay thế GH đòi hỏi phải cân nhắc kỹ lưỡng và cá thể hoá giữa các nguy cơ và lợi ích liên quan với điều trị.
Liều GH khởi đầu được khuyến cáo phụ thuộc vào tuổi của bệnh nhân (0,4 - 0,5 mg/ngày ở tuổi < 30; 0,2 - 0,3 mg/ngày ở tuổi từ 30 - 60 và 0,1 - 0,2 mg/ngày ở tuổi > 60) do bệnh nhân càng cao tuổi càng nhạy cảm hơn với các tác dụng phụ liên quan với GH. Liều dùng có thể được điều chỉnh tăng lên hoặc giảm đi dựa trên đáp ứng sinh hóa và lâm sàng của từng bệnh nhân cụ thể [25]. Bệnh nhân nữ đang dùng estrogen đường uống cần dùng các liều cao hơn do có tình trạng ức chế sản xuất IGF-1 từ gan.
Các tác dụng phụ bao gồm dị cảm, cứng khớp, phù ngoại biên, đau khớp, đau cơ, hội chứng đường hầm cổ tay, tăng đường máu và bệnh võng mạc (hiếm gặp).
Bồi phụ lại GH đã được chứng minh giúp làm tăng khối nạc của cơ thể [26], tăng BMD [27], giảm nguy cơ gãy xương [28] và cải thiện chất lượng cuộc sống [29,30].
Một số song không phải tất cả các nghiên cứu đều cho thấy có tăng sức mạnh và/hoặc khả năng gắng sức đi kèm với tăng khối cơ [31].
Mặc dù làm tăng LDL [25,26] và giảm các chỉ dấu viêm [22], song hiện chưa rõ là liệu GH có giúp cải thiện các chỉ dấu đại diện của bệnh tim mạch và/hoặc làm giảm nguy cơ xuất hiện hội chứng chuyển hóa hay không [32,33].

Điều trị bồi phụ GH có thể làm tăng tạm thời nồng độ đường máu song không chứng minh là điều trị này làm tăng nguy cơ đái tháo đường [35].
Về mặt lý thuyết, bồi phụ GH gây lo ngại là có thể làm tăng nguy cơ bị bệnh lý ác tính hoặc khối u tuyến yên phát triển to trở lại /tái phát, một số nghiên cứu đã cho thấy điều trị GH dài ngày không làm tăng nguy cơ bị ung thư lần hai và/hoặc làm tăng nguy cơ tái phát các khối u tuyến yên [25]. Tuy vậy, điều trị GH bị chống chỉ định đối với các bệnh nhân có bệnh lý ác tính đang hoạt động.
Mặc dù, một số nghiên cứu gợi ý tăng tỷ lệ tử vong ở bệnh nhân suy tuyến yên có liên quan với thiếu hụt GH ở người lớn [36,37], không có các nghiên cứu ngẫu nhiên tiến cứu dài hạn so sánh giữa điều trị bằng GH và giả dược trên kết cục và tỷ lệ tử vong do tim mạch ở bệnh nhân bị thiếu hụt hormon tăng trưởng.
6 TÀI LIỆU THAM KHẢO
1. Regal M, Paramo C, Sierra SM. Garcia-Mayor RV. Prevalence and incidence of hypopituitarism in an adult Caucasian population in northwestern Spain. Clin Endocrinol (Oxf) 2001;55(6): 735-740.
2. Vieira LN, Boguszewski CL, Araujo LA, et al. A review on the diagnosis and treatment of patients with clinically nonfunctioning pituitary adenoma by the Neuroendocrinology Department of the Brazilian Society of Endocrinology and Metabolism. Arch Endocrinol Metab 2016;60(4):374–390.
3. Dallapiazza RF, Jane JA Jr. Outcomes of endoscopic transsphenoidal pituitary surgery. Endocrinol Metab Clin North Am 2015;44(1):105–115.
4. Fleseriu M, Hashim IA, Karavitaki N, et al. Hormoneal replacement in hypopituitarism in adults: An endocrine society clinical practice guideline. J Clin Endocrinol Metab 2016;101(11): 3888-3921.
5. Carmicahel J. Chapter 10: Anterior pituitary failure. In: Melmed S, ed. The Pituitary. 4th ed. Academic Press; 2017:329-364.
6. Abs R, Bengtsson BA, Hernberg- Stahl E, et al. GH replacement in 1034 growth hormone deficient hypopituitary adults: demographic and clinical characteristics, dosing and safety. Clin Endocrinol (Oxf) 1999:50(6):703–713.
7. Doknic M, Pekic S, Miljic D, et al. Etiology of hypopituitarism in adult patients: The experience of a single center database in the serbian population. Int J Endocrinol 2017;2017:6969286.
8. Darzy KH, Shalet SM. Hypopi- tuitarism following radiotherapy. Pituitary 2009;12(1):40–50.
9. Ding L, Starke RM, Sheehan JP. treatment paradigms for pituitary adenomas: defining the roles of radiosurgery and radiation therapy. J Neurooncol 2014;117(3):445–457.
10. Clayton PE, Shalet SM. Dose dependency of time of onset of radiation-induced growth hormone deficiency. J Pediatr 1991;118(2):226–228.
11. Agha A, Sherlock M, Brennan S, et al. Hypothalamic-pituitary dysfunction after irradiation of nonpituitary brain tumors in adults. J Clin Endocrinol Metab 2005;90(12):6355–6360.
12. Lam KS, Tse VK, Wang C, Yeung RT, Ho JH. Effects of cranial irradiation on hypothalamic- pituitary function a 5-year longitudinal study in patients with nasopharyngeal carcinoma. QJ Med 1991;78(286):165–176.
13. Tritos NA, Yuen KC, Kelly DF. American Association of Clinical Endocrinologists and American College of Endocrinology disease state clinical review: a neuroen- docrine approach to patients with traumatic brain injury. Endocr Pract 2015;21(7):823-831.
14. Tanriverdi F. Unluhizarci K. Coksevim B, Selcuklu A, Casanueva FF, Kelestimur F. Kickboxing sport as a new cause of traumatic brain injury-mediated hypopituitarism. Clin Endocrinol (Oxf) 2007;66(3):360–366.
15. Giordano G, Aimaretti G, Ghigo E. Variations of pituitary function over time after brain injuries: the lesson from a prospective study. Pituitary 2005;8(3-4): 227-231.
16. Lauzier F, Turgeon AF, Bou- tin A, et al. Clinical outcomes, predictors, and prevalence of anterior pituitary disorders following traumatic brain injury: a systematic review. Crit Care Med 2014;42(3):712–721.
17. Dillard T, Yedinak CG, Alumkal J, Fleseriu M. Anti-CTLA-4 antibody therapy associated autoimmune hypophysitis: serious immune related adverse events across a spectrum of cancer subtypes. Pituitary 2010;13(1): 29-38.
18. Albarel F, Gaudy C, Castinetti F, et al. Long-term follow-up of ipilimumab- induced hypophysitis, a common adverse event of the anti-CTLA-4 antibody in melanoma. Eur J Endocrinol 2015;172(2):195–204.
19. Stojanovic M, Pekic S, Cvijovic G, et al. High risk of hypopituitarism in patients who recovered from hemorrhagic fever with renal syndrome. J Clin Endocrinol Metab 2008;93(7): 2722-2728.
20. Iwasaki Y, Kondo K, Hasegawa H, Oiso Y. Osmoregulation of plasma vasopressin in three cases with adrenal insufficiency of diverse etiologies. Horm Res 1997;47(1): 38-44.
21. Molitch ME, Clemmons DR, Malozowski S, Merriam GR, Vance ML. Evaluation and treatment of adult growth hormone deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2011;96(6):1587-1609.
22. Melmed S, ed. The Pituitary. 4th ed. Academic Press; 2017.
23. Yuen KC, Tritos NA, Samson SL, Hoffman AR, Katznelson L. American Association of Clinical Endocrinologists and American College of Endocrinology disease state clinical review: update on growth hormone stimulation testing and proposed revised cut- point for the glucagon stimulation test in the diagnosis of adult growth hormone deficiency. Endocr Pract 2016;22(10): 1235-1244.
24. Yuen KCJ. Growth hormone stimulation tests in assessing adult growth hormone deficiency. In: De Groot LJ, Chrousos G, Dungan K, et al., eds. Endotext. South Dartmouth, MA: MDText.com, Inc; 2000.
25. Gasco V, Caputo M, Lanfranco F, Ghigo E, Grottoli S. Management of GH treatment in adult GH deficiency. Best Pract Res Clin
Endocrinol Metab 2017;31(1): 13-24.
31. Rubeck KZ, Bertelsen S, Vestergaard P, Jorgensen JO. Impact of GH sub- stitution on exercise capacity and muscle strength in GH-deficient adults: a meta-analysis of blinded, placebo-controlled trials. Clin Endocrinol (Oxf) 2009;71(6): 860-866.
32. Claessen KM, Appelman-Dijkstra NM, Adoptie DM, et al. Metabolic profile in growth hormone-deficient (GHD) adults after long-term recombinant human growth hormone (rhGH) therapy. J Clin Endocrinol Metab 2013;98(1):352–361.
33. Attanasio AF, Mo D, Erfurth EM, et al. Prevalence of metabolic syndrome in adult hypopituitary growth hormone (GH)-deficient patients before and after GH replacement. J Clin Endocrinol Metab 2010;95(1):74–81.
34. Woodmansee WW, Hartman ML, Lamberts SW, Zagar AJ, Clemmons DR. Occurrence of impaired fasting glucose in GH-deficient adults receiving GH replacement compared with untreated subjects. Clin Endocrinol (Oxf) 2010;72(1): 59–69.
35. Attanasio AF, Jung H, Mo D, et al. Prevalence and incidence of diabetes mellitus in adult patients on growth hormone replacement for growth hormone deficiency: a surveillance database analysis. J Clin Endocrinol Metab 2011;96(7):2255-2261.
36. Stochholm K, Gravholt CH, Laursen T, et al. Mortality and GH deficiency: a nationwide study. Eur J Endocrinol 2007;157(1):9-18.
37. Svensson J, Bengtsson BA, Rosen T, Oden A, Johannsson G. Malignant disease and cardiovascular morbidity in hypopituitary adults with or without growth hormone replacement therapy. J Clin Endocrinol Metab 2004;89(7):3306-3312.

