Chứng suy sinh dục nam - Điều khó nói của nam giới

Khoa nội tiết chuyển hóa và nghiên cứu
Đồng chủ biên
Thomas J.Braranski, MD, PhD
Janet B.McGill, MD, MA, FACE
Julie M.Silverstein, MD
Và các tác giả khác tham gia biên soạn
1 NGUYÊN LÝ CHUNG
Suy sinh dục là rối loạn chức năng tinh hoàn thường gặp nhất trong thực hành lâm sàng [1]. Các triệu chứng của suy sinh dục nam phụ thuộc vào tuổi bắt đầu bị bệnh của bệnh nhân. Sản xuất một lượng testosteron thỏa đáng là điều cần thiết cho sự phát triển của cơ quan sinh dục ngoài và các đặc điểm sinh dục phụ ở trẻ em và trẻ vị thành niên. Ở người lớn, sản xuất androgen cần thiết để duy trì khối cơ thể nąc, khối xương, ham muốn tình dục, chức năng sinh dục và sinh tinh trùng [2,3]. Nam giới với tổng nồng độ testosteron dưới mức khoảng 300 ng/dL thường xuất hiện các dấu hiệu và triệu chứng suy sinh dục, tình trạng này có thể gây các tác động lâm sàng về dài hạn.

1.1 Định nghĩa
Suy sinh dục nam được định nghĩa là tình trạng tinh hoàn bị suy giảm sản xuất testosteron, tinh trùng hoặc cả hai.
1.2 Phân loại
Suy sinh dục được phân loại thành suy sinh dục nguyên phát, thứ phát, kết hợp cả nguyên phát và thứ phát.
Suy sinh dục nguyên phát là hậu quả của tình trạng suy chức năng của tinh hoàn (suy sinh dục với tăng hormon hướng sinh dục).
Suy sinh dục thứ phát là hậu quả của các khiếm khuyết ở dưới đồi tuyến yên (suy sinh dục với giảm hormon hướng sinh dục).
Suy sinh dục kết hợp, được biểu hiện bằng cả các khiếm khuyết của tinh hoàn và vùng dưới đồituyến yên.
Suy sinh dục khởi phát muộn là một hội chứng lâm sàng riêng biệt được biểu hiện bằng tình trạng thiếu hụt testosteron và các triệu chứng tình dục (giảm ham muốn tình dục, giảm cương dương vào buổi sáng và rối loạn chức năng cương cứng dương vật) ở nam giới có tuổi (4,5].
==> Bạn đọc có thể đọc tham khảo thêm: Quá trình sinh tổng hợp, chuyển hóa hormone sinh dục nam và nữ
1.3 Dịch tễ học
Tại Hoa Kỳ 4 5 triệu nam giới có tình trạng suy sinh dục.
Tỷ lệ mắc đối với tình trạng thiếu hụt androgen có triệu chứng ở nam, ở độ tuổi từ 30 – 79 là 5,6% [6].
Trong các nghiên cứu theo dõi dọc, khi nam giới già đi, tổng lượng testosteron bị giảm xuống. Nồng độ testosteron huyết thanh giảm dưới 1 2% mỗi năm sau tuổi 30. Người ta ước tính là 30 40% nam giới trên 65 tuổi và 49 80% nam giới trên 80 tuổi có tình trạng suy sinh dục [7,8].
1.4 Bệnh căn
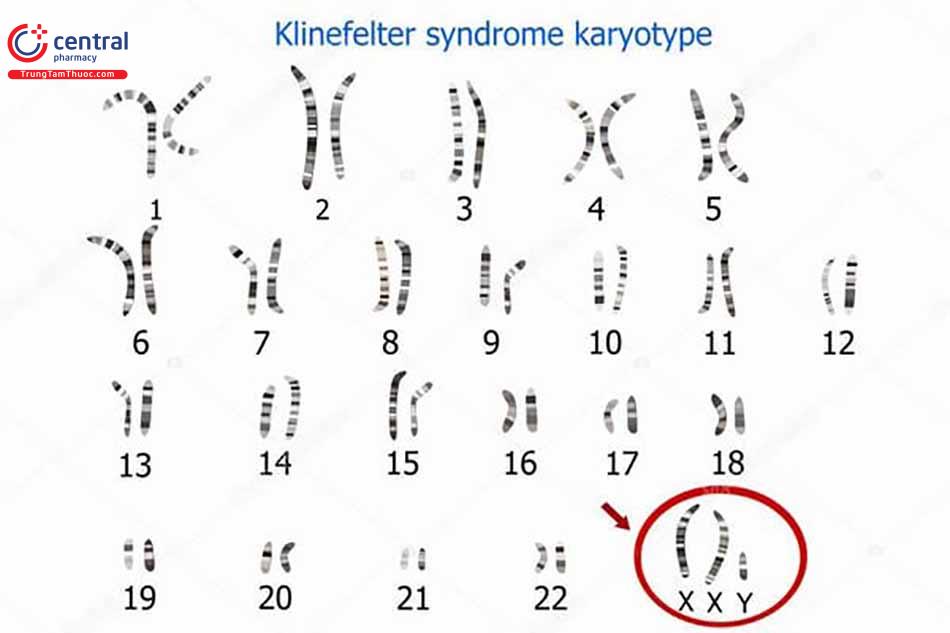
Suy sinh dục nguyên phát
- Các khiếm khuyết phát triển:
- Hội chứng Klinefelter là khuyết tật bẩm sinh thường gặp nhất gây ra tình trạng suy sinh dục nam (tỷ lệ 1/10.000 nam giới). Các đặc điểm lâm sàng của hội chứng này bao gồm: tinh hoàn nhỏ và cứng với giảm phát triển sinh dục ở các mức độ khác nhau, không có tinh trùng, vú to nam giới và tăng kích tố hướng sinh dục. Khuyết tật nền là do có thêm một nhiễm sắc thể X, tức là bộ nhiễm sắc thể 47 với kiểu XXY thường gặp nhất. Chẩn đoán được khẳng định bằng phân tích kiểu nhiễm sắc thể [9]. Rối loạn này được kết hợp với xuất hiện bệnh đái tháo đường, Lupus ban đỏ hệ thống và u tế bào mầm giống ung thư và ung thư vú và có thể là u lympho không Hodgkin xuất hiện muộn trong cuộc đời bệnh nhân [1014]. Bệnh nhân có tỷ lệ tử vong do ung thư vú cao hơn nhưng tỷ lệ tử vong do ung thư tuyến tiền liệt thấp hơn [14].
- Kiểu nhiễm sắc thể 46, XY/XO (dạng khảm do mất nhiễm sắc thể Y) được biểu hiện về lâm sàng bằng một phổ rộng đi từ hội chứng Turner tới rối loạn phát triển tuyến sinh dục hỗn hợp (mixed gonadal dysgenesis [MGD]), giả lưỡng tính nam (male pseudohermaphroditism [MPH]) hoặc bình thường về kiểu hình nam. Các cơ quan sinh dục thay đổi từ dạng không phát triển tới các tinh hoàn bình thường. Nếu thấy cả hai cơ quan sinh dục chỉ có dạng dải và tinh hoàn bị loạn sinh (dysgenetic testis) (“MGD”), nguy cơ phát triển thành u nguyên bào sinh dục (gonadoblastoma) gặp ở ít nhất 20% bệnh nhân. Vì vậy, nên tiến hành cắt bỏ cơ quan sinh dục (tinh hoàn) cho bệnh nhân [15,16). Các đột biến của gen mã hóa sinh tổng hợp và tiết testosteron có thể dẫn tới giảm hoặc không chế tiết testosteron dẫn tới nam hóa không hoàn toàn.
- Tật ẩn tinh hoàn có thể tác động tới một hoặc cả hai tinh hoàn, rối loạn này sẽ được phản ảnh bằng con số tinh trùng, nồng độ FSH và nồng độ testosteron máu. Tình trạng này thường kết hợp với tăng nguy cơ bị ung thư tinh hoàn [17].
- Các khuyết tật khác bao gồm đột biến gen mã hóa thụ thể LH và FSH [1,18,19], loạn dưỡng tăng trương lực cơ [1,20], không có tinh hoàn bẩm sinh [1,21] và giãn tĩnh mạch thừng tinh [1].
- Các bệnh lý mắc phải:
- Quai bị là nhiễm trùng thường gặp nhất tác động tới tinh hoàn. Tình trạng này thường xảy ra ở tuổi trưởng thành và có thể dẫn tới vô sinh và giảm nồng độ testosteron [1]. Tia xạ tác động tới cả quá trình sinh tinh trùng và sản xuất testosteron [1].
- Các thuốc như ketoconazol, spironolacton, cyproteron, suramin [22] có tác động giao thoa với sinh tổng hợp testosteron. Các thuốc gây cảm ứng enzym P450, như Phenytoin và carbamazepin có thể gây giảm sinh khả dụng của testosteron, làm tăng globulin gắn với hormon sinh dục (SHBG), nồng độ LH và giảm độ thanh thải chuyển hóa. Các thuốc alkyl hóa, như Cyclophosphamide, chlorambucil, Cisplatin, busulfan có thể gây tổn hại các ống sinh tinh dịch và gây giảm testosteron ở mức độ ít hơn [1]. Spironolacton, cyproteron, cimetidin, omeprazol cạnh tranh với thụ thể androgen là nguyên nhân gây vú to nam giới và liệt dương [23].
- Các nguyên nhân khác bao gồm các chất gây độc từ môi trường, chấn thương tinh hoàn, xoắn tinh hoàn và cắt bỏ cả hai bên tinh hoàn [1].
Suy sinh dục thứ phát
- Các rối loạn bẩm sinh:
- Suy sinh dục giảm hormon hướng sinh dục đơn độc (IHH) [1,24] hoặc giảm tiết hormon giải phóng gonadotropin (GnRH) bẩm sinh chủ yếu là một bệnh của nam giới. Nói chung tình trạng này được chia thành hai phân nhóm là nhóm bị mất khứu giác và nhóm khứu giác bình thường.
- IHH có thể được biểu hiện ở bất kỳ tuổi nào.
- Các đối tượng bị tác động ngay từ khi sinh có thể có giảm phát triển dương vật được đặc trưng bằng dương vật nhỏ và/hoặc tinh hoàn ẩn do thiếu hụt sản xuất testosteron ở ba tháng cuối của thai kỳ.
- Trong tuổi thơ ấu, chẩn đoán nghi ngờ chỉ bằng các dấu hiệu không liên quan đến cơ quan sinh sản (ví dụ, mất khứu giác ở một số bệnh nhân hoặc các bất thường hệ xương như sứt môi hay hở môi/khe hở vòm miệng hay hở hàm ếch hoặc tật dính ngón tay).
- Biểu hiện ở tuổi thanh thiếu niên được đặc trưng bằng suy giảm trưởng thành giới tính. Các đối tượng này có kiểu hình nam bình thường khi sinh do hCG từ mẹ kích thích biệt hóa giới tính bình thường trong ba tháng đầu của thai kỳ.
- Các biểu hiện lâm sàng khác bao gồm tuổi xương bị trễ lại (thường không vượt quá 11 12 năm ở nam), nhược xương, ở tỷ lệ các phần cơ thể dạng hoạn (eunuchoid body proportions), vú to nam giới và chậm dậy thì.
- Bệnh nhân nam với tinh hoàn ≥ 4 cm bị IHH không hoàn toàn, trong khi các bệnh nhân nam có tinh hoàn < 4 cm bị IHH hoàn toàn. Các giá trị của kích tố hướng sinh dục và testosteron không thể phân biệt được hai rối loạn này.
- Suy sinh dục với giảm hormon hướng sinh dục (IHH) phải được phân biệt với chậm dậy thì song chẩn đoán phân biệt này chỉ được đưa ra tới khi bệnh nhân quá 18 tuổi. Điều trị GnRH theo một nhịp đều đặn giúp tạo sự phát triển dậy thì đầy đủ. Hội chứng Kallmann là một thể mất khứu giác của IHH. Hội chứng này được đặc trưng bằng IHH và tình trạng mất ngửi có kèm hoặc không kèm với các bất thường khác ngoài cơ quan sinh dục.
- Bệnh nhân có thể có khe hở đường giữa mặt (midfacial clefting), không có một hoặc cả hai thận (renal agenesis) và các bất thường thần kinh (điếc, rối loạn chức năng tiểu não, chậm phát triển tâm thần, các bất thường về mắt).
- Một số gen đã được đề cập có liên quan với căn nguyên của IHH bẩm sinh: gen ANOS1 (trước đây được gọi là KAL1), FGF8 và FGF1 (KAL2 gene), đột biến prokineticin 2 (PROK2) và thụ thể prokineticin 2 (PROKR2) (KAL3 and KAL4), đột biến kisspeptin và thụ thể KISS1 (trước đây được gọi là gen GPR54), đột biến thụ thể GNRH1 và GnRH, đột biến tachykinin 3 (TAC3) và thụ thể tachykinin 3 (T4C3R), CHD7 và semaphorin 3A. Không khuyến cáo tiến hành phân tích kiểu nhiễm sắc thể trừ khi thấy có biểu hiện nhiều bất thường bẩm sinh.
- Suy sinh dục thứ phát cũng có thể xảy ra trong đột biến leptin và thụ thể leptin (được biểu hiện bằng tình trạng béo phì bệnh lý) [1,25], đột biến LH và dưới đơn vị B của FSH [1], hội chứng Laurence Moon và hội chứng Bardet Biedl. Rối loạn chức năng của thụ thể androgen gây tình trạng nam hóa không hoàn toàn ở một nam giới với bộ nhiễm sắc thể 46,XY, đối tượng này có tinh hoàn cả hai bên và sản xuất testosteron bình thường. Nên xem xét chẩn đoán này ở các bé gái có các khối u ở bẹn hoặc môi sinh dục, phụ nữ bị vô kinh nguyên phát, trẻ em gái từ tuổi vị thành niên trở nên bị nam hóa và xuất hiện âm vật to, các bé trai tuổi vị thành niên có tình trạng vú to tiếp diễn và không xuất hiện dậy thì, nam giới trưởng thành với nam hóa không hoàn toàn (hay đầy đủ) hoặc vô sinh kết hợp với không có tinh trùng hoặc bị giảm nghiêm trọng số lượng tinh trùng.
- Giảm phát triển tuyến yên dẫn tới suy sinh dục. Các đột biến của gen PROP1 gây tình trạng không tiết một số hormon tuyến yên, đột biến gen HESXI gây tình trạng loạn sản thần kinh thị giác và vách trong suốt của não (septooptic dysplasia), hội chứng này có thể bao gồm cả tình trạng tuyến yên kém phát triển [26].
- Các rối loạn mắc phải
- Tất cả các bệnh tác động tới vùng dưới đồi, cuống tuyến yên và tuyến yên có thể dẫn tới suy sinh dục giảm kích tố hướng sinh dục hoặc do ức chế tiết kích tố hướng sinh dục hoặc gây tổn thương trực tiếp các tế bào sản xuất kích tố hướng sinh dục. Các tổn thương khối choán chỗ của tuyến yên hoặc vùng dưới đồi (các tổn thương hố yên hoặc trên hố yên) có thể phá hủy tuyến yên hoặc làm gián đoạn các sợi thần kinh vận chuyển GnRH tới tuần hoàn tuyến yên. Bệnh nhân có biểu hiện đau đầu, rối loạn thị lực và các biểu hiện suy tuyến yên ở các mức độ khác nhau.
- Các khối u sản ACTH có thể gây liệt dương, giảm ham muốn tình dục và vô sinh. Nồng độ testosteron hạ thấp và nồng độ LH khi kích thích bằng GnRH bị ức chế.
- U tiết prolactin tác động tới nhịp chế tiết đều đặn của GnRH. Nam giới có nồng độ testosteron thấp làm nhịp chế tiết đều đặn của LH bị giảm đi. Điều trị bằng thuốc chủ vận dopamin có thể làm bình thường hóa nồng độ prolactin và phục hồi lại chức năng sinh dục.
- Các bệnh lý thâm nhiễm như bệnh tăng mô bào loại tế bào Langerhans và bệnh sarcoid có thể tác động tới vùng dưới đồi và tuyến yên, vì vậy gây suy sinh dục.
- Nhiễm khuẩn: Viêm màng não là một nguyên nhân gây suy sinh dục hiếm gặp tại Hoa Kỳ. Viêm màng não do lao có thể dẫn tới suy tuyến yên thường được gặp hơn ở các nước có bệnh lao lưu hành. Các khối u tế bào Leydig và u thượng thận sản xuất estradiol, dẫn đến tình trạng vú to nam giới và suy giảm kích tố hướng sinh dục. hCG do ung thư nguyên bào nuôi (choriocarcinoma) tiết có thể làm tăng nồng độ estradiol và gây ức chế kích tố hướng sinh dục. Hoạt động thể lực quá mức có thể gây suy sinh dục nguồn gốc dưới đồi ở nam tương tự như tình trạng vô kinh do gắng sức thể lực ở nữ. Định lượng nồng độ testosteron định kỳ và liên tục đã được đề xuất như một biện pháp để sàng lọc hội chứng luyện tập quá mức ở các vận động viên nam đạt thành tích suất sắc trong thi đấu thể thao.
- Suy giáp nguyên phát có thể gây tăng prolactin máu và suy sinh dục (do tăng nồng độ hormon gây giải phóng kích tố hướng tuyến giáp [TRH]).
- Chấn thương làm đứt cuống tuyến yên, các tổn thương sau nhiễm trùng của hệ thần kinh trung ương, bất thường mạch máu của hệ thần kinh trung ương, bệnh lý nặng cần hồi sức, tia xạ não và ngập máu tuyến yên là một số nguyên nhân khác gây suy sinh dục thứ phát. Tổn thương não do chấn thương có thể gây giảm tạm thời hoặc tiếp diễn chức năng của một hoặc một số trục tuyến yên (tới 68,5%) [27,28]. Trục thường bị tác động nhất là trục tuyến yên trục sinh dục (tới 22,7% theo một số báo cáo loạt bệnh). Các trục bị tác động theo tần suất gặp là giảm GH (< 18,2%), ACTH và TSH) (cả hai trục này là ≤ 5%) [29]. Sử dụng glucocorticoid dài ngày có thể làm giảm tác dụng của GnRH, cơ chế chưa được biết rõ. Tình trạng này cũng có thể tác dụng trực tiếp trên sản xuất testosteron của tinh hoàn [30]. Các thuốc có thể ức chế chế tiết GnRH, LH và FSH. Các chất tương tự GNRH được sử dụng để điều trị ung thư tuyến tiền liệt dẫn tới làm mất nhịp tiết đều đặn của quá trình chế tiết GnRH. Các steroid sinh dục như androgen, estrogen, progestin và megestrol, được sử dụng như một chất kích thích tình trạng ăn ngon miệng có thể gây suy sinh dục thứ phát. Sử dụng opiat mạn tính có thể gây ức chế trục dưới đồi tuyến yên tuyến sinh dục.
- Các tình trạng khác được kết hợp với suy sinh dục thứ phát bao gồm chán ăn tâm thần, đái tháo đường và ngừng thở khi ngủ do tắc nghẽn [1].
- Khi đã loại trừ được tất cả các nguyên nhân của suy sinh dục với giảm kích tố hướng sinh dục, có thể nghĩ tới chẩn đoán suy sinh dục giảm kích tố hướng sinh dục vô căn mắc phải [31].
Suy sinh dục kết hợp (nguyên phát và thứ phát):
- Tăng sản thượng thận bẩm sinh (CAH) có thể dẫn tới suy sinh dục nguyên phát nếu có tình trạng khối u còn sót lại của thượng thận ở tỉnh hoàn (testicular adrenal rest tumor). Sản xuất dư thừa androgen thượng thận do điều trị kém hoặc không thỏa đáng bằng glucocorticoid đối với tình trạng thiếu hụt 21-hydroxylase sẽ gây ức chế tiết gonadotropin theo cơ chế điều hòa ngược âm của steroid sinh dục và gây suy sinh dục thứ phát [1].
- Các bệnh lý toàn thân, như suy thận (suy tinh hoàn, tăng prolactin máu), suy gan (suy tinh hoàn và ức chế trục dưới đồi tuyến yên), bệnh hồng cầu hình liềm, thalassemia, các bệnh lý mạn tính, nhiễm độc giáp, nhiễm HIV và hội chứng suy giảm miễn dịch mắc phải.
- Nhiễm Sắt có thể gây giảm chọn lọc kích tố hướng sinh dục do lắng đọng sắt tại các tế bào tuyến yên, song cũng có thể gây suy sinh dục nguyên phát do tình trạng lắng đọng sắt tại tinh hoàn.
- Béo phì có thể gây hạ thấp nồng độ testosteron không chỉ do gây tăng gắn nhân thơm của estrogen ở các mô mỡ và làm giảm SHBG, mà còn do tác dụng kết hợp của các chất trung gian viêm, chuyển hóa và nội tiết ở các mức khác nhau trên trục dưới đồi tuyến yên tinh hoàn [1,32].
- Sử dụng rượu Ethanol làm giảm nồng độ testosteron do rượu gây ức chế tổng hợp testosteron và làm suy giảm trục dưới đồi tuyến yên [33].
1.5 Sinh lý bệnh
Tinh hoàn có hoạt động chức năng như một phần của trục dưới đồi tuyến yên tuyến sinh dục.
Nơi tạo nhịp tiết của vùng dưới đồi nằm tại các nhân hình cánh cung là nơi phóng thích GnRH vào hệ thống cửa dưới đồi tuyến yên.
Đáp ứng với các nhịp tiết GnRH, thùy trước tuyến yên sẽ tiết các gonadotropin FSH và LH, các hormon này có nhiệm vụ kích thích hoạt động của tuyến sinh dục.
LH kích thích các tế bào Leydig theo nhịp để sản xuất testosteron. Một tinh hoàn người lớn sản xuất vào khoảng 7 mg testosteron mỗi ngày.
FSH kiểm soát tình trạng sinh tinh trùng và kích thích tổng hợp protein gắn với androgen (ABP) của các tế bào Sertoli trong các ống sinh tinh. LH hỗ trợ quá trình sản xuất tinh trùng thông qua chế tiết testosteron tại chỗ. Cả FSH và testosteron đều cần thiết để kích thích quá trình sinh tinh trùng về số lượng.
Chế tiết Gn RH được điều hòa âm bởi testosteron.
Chế tiết LH được điều hòa âm bởi testosteron, estradiol và dihydrotestosteron (DHT).
FSH chịu tác động điều hòa ngược âm của inhibin B và testosteron. 60% lượng testosteron vận chuyển trong huyết tương được gắn với SHBG, 13% dưới dạng tự do và phần còn lại được gắn với albumin. Cả testosteron tự do và testosteron gắn với Albumin có tính sinh khả dụng [34]. Nồng độ SHBG lưu hành trong tuần hoàn (vì vậy là nồng độ testosteron toàn phần) có thể bị tăng lên trong viêm gan mạn, xơ gan, cường giáp, nhiễm HIV, sử dụng estrogen, dùng thuốc chống co giật, tuổi tác [1]. Giảm nồng độ SHBG kết hợp với béo phì, đái tháo đường typ 2, các tình trạng nồng độ protein máu thấp (hội chứng thận hư), suy giáp, to đầu chi, thiếu hụt SHBG có tính gia đình, cường insulin, dùng glucocorticoid, progestin và dùng androgen [1].
Khoảng 6 8% testosteron được chuyển đổi thành DHT có hiệu lực mạnh hơn nhờ xúc tác của 5areductase ở tuyến tiền liệt, tinh hoàn, gan, thận và da. Một tỷ lệ nhỏ (0,2%) testosteron được chuyển đổi thành estradiol bởi aromatase.
Các tác dụng của testosteron là tác động kết hợp của testosteron cộng với các chất chuyển hóa của nó có hoạt tính androgen (DHT) và estrogen (estradiol).
Testosteron được chuyển đổi thành DHT bởi 5areductase. Cả hai chất chuyển hóa gắn với cùng một thụ thể androgen, song DHT có hiệu lực mạnh hơn. Chỉ cần testosteron là đủ để điều hòa kích tố hướng sinh dục, kích thích sinh tinh trùng và gây nam hóa ống dẫn Wolffian, trong khi DHT cần thiết trong vai trò trung gian đối với tình trạng nam hóa của cơ quan sinh dục ngoài trong quá trình hình thành phôi thai và làm hoàn thiện đầy đủ quá trình nam hóa xảy ra ở tuổi dậy thì nam. Estradiol ức chế tiết gonadotropin và thúc đẩy trưởng thành của đầu xương ở nam giới tuổi vị thành niên.
Suy sinh dục nguyên phát xảy ra nếu các tinh hoàn không sản xuất đủ lượng steroid sinh dục để ức chế tiết LH và FSH trở lại mức bình thường. Suy sinh dục thứ phát có thể là hậu quả của tình trạng suy sản xuất GnRH theo nhịp đều đặn của vùng dưới đồi hoặc từ tình trạng tuyến yên mất khả năng đáp ứng với chế tiết của LH và/hoặc FSH.
2 CHẨN ĐOÁN
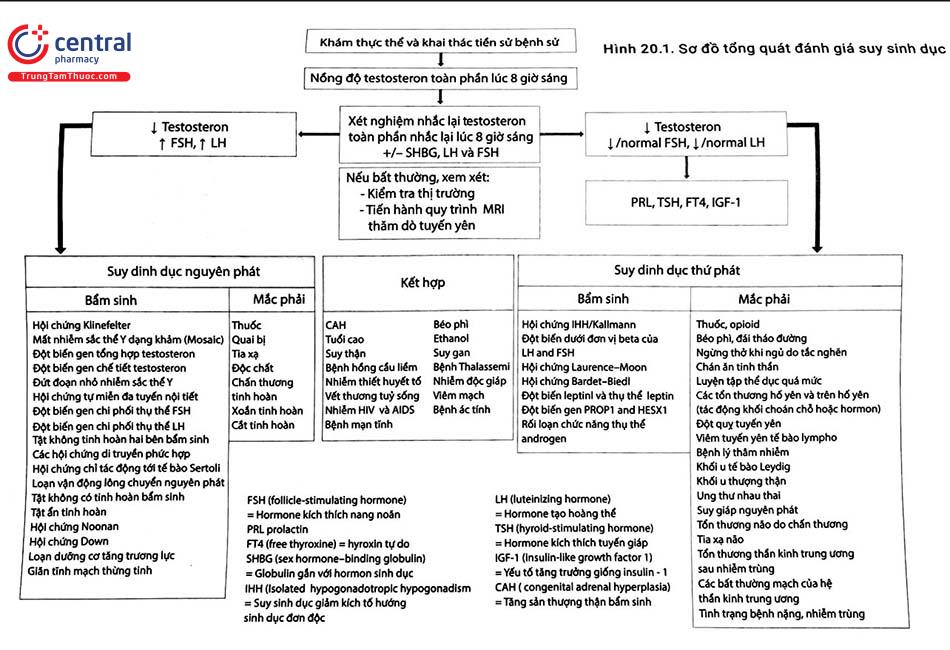
Chẩn đoán dựa trên khai thác kỹ tiền sử, bệnh sử, khám thực thể toàn diện và làm các xét nghiệm cận lâm sàng. Sơ đồ tổng quát đánh giá suy sinh dục được trình bày trong Hình 20.1.
Nồng độ testosteron cao vào buổi sáng và có mức thấp nhất vào buổi trưa. Biên độ dao động theo nhịp ngày đêm này giảm dần theo tuổi. Dao động nồng độ testosteron theo nhịp ngày đêm cần được xem xét khi tiến hành phân tích kết quả [35].
Nên tiến hành kiểm tra nồng độ testosteron toàn phần vào buổi sáng, lúc đói và lý tưởng là trong khoảng thời gian từ 8 đến 10 giờ sáng. Một nam có nồng độ testosteron toàn phần dưới 300 ng/dL nhiều khả năng bị suy sinh dục, tuy vậy nồng độ này cần được kiểm tra nhắc lại. Khi nồng độ trong khoảng 200 400 ng/dL nên được xét nghiệm lại kèm theo định lượng nồng độ testosteron tự do.
Định lượng nồng độ testosteron tự do có thể hữu ích nếu nghi ngờ có bất thường trong quá trình testosteron gắn với SHBG. Định lượng testosteron tự do phải được tiến hành bằng kỹ thuật thẩm tách cân bằng mà không phải là các phương pháp tương đương hay tương tự do các phương pháp khác có thể cho các thông tin sai lầm [36].
Thức ăn, nhất là uống Glucose sẽ làm giảm nồng độ testosteron, vì vậy cần lấy mẫu máu xét nghiệm lúc đói [37].
2.1 Biểu hiện lâm sàng
Các biểu hiện lâm sàng phụ thuộc vào tình trạng suy giảm gây tác động tới quá trình sinh tinh trùng hay chế tiết testosteron hoặc cả hai. Nó cũng phụ thuộc vào thời gian bắt đầu xuất hiện hay khởi phát khiếm khuyết.
Suy giảm quá trình sinh tinh trùng thường dẫn tới giảm số lượng tinh trùng và kích thước tinh hoàn.
Giảm sản xuất testosteron trong 3 tháng đầu của thai kỳ dẫn tới dẫn nam hóa không hoàn toàn đi từ tình trạng thiếu hụt nghiêm trọng gây hợp nhất môi sau cơ quan sinh dục đến tình trạng thiếu hụt nhẹ dẫn đến tật lỗ tiểu thấp. Thiếu hoàn toàn testosteron trong giai đoạn này gây ra tình trạng cơ quan sinh dục ngoài kiểu nữ (cả âm vật và môi sinh dục).
Nếu thiểu hụt testosteron xảy ra trong 3 tháng cuối của thai kỳ, sẽ dẫn tới dương vật nhỏ và tinh hoàn ẩn.
Nếu sản xuất testosteron bị ức chế trước tuổi dậy thì, trẻ nam sẽ không xuất hiện dậy thì (trung bình ở tuổi 14) hoặc dậy thì đầy đủ (hoàn chỉnh trong 3 đến 4 năm).
Thiếu hụt testosteron sau tuổi dậy thì dẫn tới giảm ham muốn tình dục, giảm khối cơ, mọc lông tóc, nhiệt huyết, khí sắc, độ tập trung, hematocrit và khối xương. Giảm ham muốn tình dục và mệt mỏi xuất hiện sớm, trong khi các triệu chứng khác phải sau nhiều năm mới biểu hiện. Suy sinh dục trong thời gian dài ở nam được biểu hiện bằng giảm phát triển lông và râu ở mặt (phân bố lông và râu kiểu nữ) và xuất hiện các nếp nhăn ở góc miệng và mắt. Bệnh nhân người lớn cũng có thể bị vô sinh.
Các bệnh nhân nam bị suy sinh dục vẫn có thể có hoạt động cương dương về đêm ở một mức nào đó. Tuy nhiên, độ cương cứng của dương vật không đủ để cho phép họ có thể đưa dương vật vào âm đạo của bạn tình [38].
Suy sinh dục nguyên phát nhiều khả năng hơn kết hợp với vú to nam giới. Nồng độ FSH và LH tăng cao bất thường trong huyết thanh kích thích enzym aromatase tinh hoàn tăng sự chuyển đổi testosteron thành estradiol, gây tăng nồng độ estradion một cách tương đối so với nồng độ testosteron.
2.1.1 Khai thác tiền sử bệnh
Tiền sử phải bao gồm khai thác các mốc phát triển quan trọng của tính dục, với sự nhấn mạnh về phát triển giới tính, các triệu chứng hiện tại và những thông tin liên quan với nguyên nhân có thể gặp. Tiền sử về cơ quan sinh dục không rõ ràng (dương vật nhỏ, tinh hoàn ẩn hay lạc chỗ), suy hay chậm dậy thì hoặc giảm ham muốn tình dục, chức năng sinh dục và/hoặc tính năng động cung cấp bằng chứng về thời gian khởi phát của tình trạng suy sinh dục.
Cần khai thác về tốc độ khởi phát và tiến triển của triệu chứng, bệnh nhân có hay không tình trạng cương dương vào buổi sáng sớm, đau đầu, mất ngửi, thay đổi giọng nói, thị lực, sức mạnh của cơ hoặc phát triển lông tóc.
Nên hỏi bệnh nhân về các bệnh lý toàn thân, chấn thương, loại thuốc và các điều trị có thể là nguyên nhân gây ra tình trạng này.
Bệnh nhân nên được sàng lọc để phát hiện các triệu chứng ngừng thở khi ngủ.
Hỏi về tiền sử bị các bệnh lý đồng mắc khác như hội chứng chuyển hóa, đái tháo đường, loãng xương, gãy xương và bệnh mạch vành. Cũng cần khai thác tiền sử dùng opiat của bệnh nhân.
2.1.2 Khám thực thể
Cần tiến hành thăm khám thực thể toàn diện để tìm kiếm các bất thường phát triển, các vấn đề về thị lực, phân bố lông tóc bất thường và biểu hiện tỷ lệ cơ thể giống như người bị cắt tinh hoàn (phần dưới cơ thể [từ chân tới xương mu] dài hơn 2 cm so với phần trên cơ thể [từ xương mu tới đỉnh đầu]) và sải cánh tay dài hơn chiều cao từ 5 cm trở lên). Tỷ lệ này xảy ra là do tăng chiều dài của các xương dài và chậm đóng các đầu xương trung gian qua sự hiện diện của GH và sự thiếu hụt chất chuyển hóa của testosteron có hoạt tính estrogen (estradiol) [1].
Khám cơ quan sinh dục ngoài bao gồm đo kích thước tinh hoàn (bình thường 4 đến 7 cm), thể tích tinh hoàn (bình thường 15 30 mL) và đánh giá giai đoạn Tanner đối với trẻ vị thành niên. Giảm kích thước tinh hoàn được thấy rõ hơn trong suy sinh dục xảy ra trước tuổi dậy thì so với suy sinh dục xảy ra sau tuổi dậy thì. Cũng cần ghi nhận độ cứng chắc của tinh hoàn khi sờ nắn (hai tinh hoàn phải chắc nhưng không được quá cứng hoặc quá mềm). Điển hình, tinh hoàn rắn chắc thường kết hợp với hội chứng Klinefelter do tình trạng hyalin hóa hoặc xơ hóa. Tinh hoàn nhỏ, có tính đàn hồi như Cao Su được thấy đặc trưng ở nam khi bắt đầu dậy thì, trái lại teo tinh hoàn sau tuổi dậy thì gây ra tinh hoàn có tính chất mềm hoặc có mật độ xốp.
Vú to nam giới có thể được thấy, cũng có thể thấy tăng khối mỡ và giảm khối cơ trong cơ thể.
Các triệu chứng thực thể không phải luôn biểu hiện ở người trưởng thành, do vài đặc tính sinh dục phụ, như giảm khối lượng cơ có thể mất hằng năm mới xuất hiện. Trong tình huống đó, đánh giá các xét nghiệm cận lâm sàng một cách phù hợp có thể hữu ích.
2.2 Tiêu chuẩn chẩn đoán
Tiền sử và khám thực thể sẽ gợi ý suy sinh dục và các dữ liệu cận lâm sàng sẽ cho biết nồng độ testosteron thấp rõ rệt, thường dưới 300 ng/dL. Phân loại thêm nữa thành chẩn đoán suy sinh dục nguyên phát, thứ phát hoặc kết hợp là điều cần thiết. Chẩn đoán suy dinh dục khởi phát muộn được tiến hành theo cách tương tự.
2.3 Chẩn đoán phân biệt
Bệnh nhân bị các bệnh lý khác có thể có biểu hiện bằng các triệu chứng cơ năng và dấu hiệu tương tự. Bệnh nhân bị đau đầu, có các vấn đề thị lực, vú tiết sữa, phù gai thị hoặc đĩa thị nhợt màu phải đặt ngay nghi ngờ có khối u tuyến yên. Tình trạng khó chịu, mệt mỏi, chán ăn và sút cân rất không đặc hiệu và có thể được gặp trong tình trạng suy tuyến yên và một loạt các bệnh lý nội khoa khác.
2.4 Chẩn đoán cận lâm sàng
2.4.1 Cận lâm sàng
Đánh giá cận lâm sàng ban đầu phải bao gồm định lượng nồng độ testosteron, FSH, LH và prolactin. Nếu nồng độ testosteron thấp với tăng FSH và LH chứng tỏ bệnh nhân bị suy sinh dục nguyên phát, trong khi nồng độ testosteron thấp với nồng độ FSH và LH bình thường hoặc thấp chỉ dẫn họ bị suy sinh dục thứ phát.
Phân tích tinh dịch là cách tốt nhất để phân tích số lượng tinh trùng, thường được chỉ định cho những nam giới mong muốn có con. Thăm dò này nên được tiến hành sau khi yêu cầu bệnh nhân không giao hợp từ 1 đến 3 ngày, mẫu bệnh phẩm phải được xét nghiệm trong vòng 2 giờ sau khi lấy. Tinh trùng trong mẫu bệnh phẩm được phân tích về số lượng, tính di động và hình thái học. Nhìn chung, các thông số khi phân tích mẫu tinh dịch bình thường sẽ có số lượng tinh trùng > 15 × 10/mL, dưới 32% có chuyển động linh hoạt và trên 4% có hình thái học bình thường (có thể cho phép các giới hạn thấp hơn đối với bệnh nhân mong muốn được áp dụng kỹ thuật sinh sản nhân tạo để có con) [39]. Các kết quả bất thường có thể do gần đây bị sốt, chấn thương hoặc tiếp xúc với các thuốc gây suy giảm tạm thời tình trạng sinh tinh trùng của bệnh nhân.
Số lượng tinh trùng dưới ngưỡng bình thường và FSH huyết thanh trên ngưỡng trong bệnh cảnh nồng độ testosteron huyết thanh và nồng độ LH bình thường chỉ dẫn tổn thương ống sinh tinh (hậu quả là mất điều hoà ngược của inhibin lên tiết FSH), trong khi sản xuất testosteron của tế bào Leydig vẫn duy trì bình thường.
Nếu nghi ngờ bị suy sinh dục thứ phát nên tiến hành xét nghiệm prolactin, TSH, FT4 tự do, yếu tố tăng IGF1 như một thành phần đại diện cho GH) và nồng độ cortisol máu (lúc 8 giờ sáng hoặc test kích thích bằng ACTH).
Các xét nghiệm cận lâm sàng khác có thể được chỉ định cho bệnh nhân nếu nghi ngờ chẩn đoán nhiễm HIV, bệnh thận giai đoạn cuối, nhiễm thiết huyết tố, bệnh tăng mô bào tế bào Langerhans hoặc bệnh sarcoid bị nghi ngờ.
2.4.2 Hình ảnh học
Thăm dò hình ảnh bằng MRI được chỉ định nếu thấy bệnh nhân có nồng độ testosteron và nồng độ LH thấp hoặc nồng độ prolactin tăng cao, các hormon tuyến yên khác bất thường, thị trường mắt bất thường hoặc các bất thường thần kinh khác. Trường hợp chụp MRI bị chống chỉ định, chụp CT sọ não có hoặc không tiêm thuốc cản quang (mặc dù có chất lượng thấp hơn) có thể được sử dụng để phát hiện các tổn thương lớn.
Đánh giá mật độ xương mỗi 2 năm/lần được khuyến cáo ở các nam giới bị suy sinh dục, định lượng nồng độ testosteron huyết thanh phải được thực hiện ở tất cả các nam giới có tỷ trọng khoáng của xương thấp hơn mức bình thường.
3 ĐIỀU TRỊ
3.1 Các thuốc điều trị
Testosteron chỉ nên được chỉ định cho nam giới có suy sinh dục khi được chứng minh bằng triệu chứng cơ năng và thực thể phù hợp với thiếu androgen và nồng độ testosteron huyết thanh dưới ngưỡng bình thường rõ rệt. Làm tăng nồng độ testosteron huyết thanh ở nam giới có triệu chứng gợi ý suy sinh dục nhưng có nồng độ testosteron bình thường sẽ thường không làm thuyên giảm triệu chứng.
Điều trị thay thế testosteron được chỉ định cho cả suy sinh dục nguyên phát và thứ phát. Sau đây là liều khởi đầu và các khuyến cáo về dạng bào chế thuốc [4].
- Testosteron enanthat/cypionat tiêm bắp 75 100 mg/tuần hoặc 150 200 mg x 2 tuần/lần.
- Testosteron dạng gel bôi 1% (AndroGel hoặc Testim), 5 10 g đường bôi tại chỗ hằng ngày trên các vùng da được che phủ và không thuộc bộ phận sinh dục, thường là ở vùng phía trên cánh tay.
- Các miếng dán testosteron thẩm thuốc qua da (Androderm), 1 2 miếng dán 5 mg/ngày dùng vào ban đêm trên da vùng lưng, đùi hoặc phần trên cánh tay, cách xa các vùng tỳ đè.
- Miếng dán ở vùng bìu, 6 mg/ngày (cần cạo sạch lông vùng sinh dục và miếng dán có thể bong ra sau 24 giờ).
- Bioadhesive buccal tablet (Striant), 30 mg x mỗi 12 giờ/lần được dùng trên niêm mạc miệng.
- Các viên nhỏ testosteron được cấy dưới da trong từng khoảng thời gian 3 6 tháng, liều và phác đồ dùng thuốc thay đổi theo dạng thuốc được bào chế.
- Testosteron undecanoat đường uống, testosteron undecanoat dạng tiêm, testosteroneinadhesive matrix miếng dán và testosteron dạng viên nhỏ hiện có trên thị trường để sử dụng.
Nói chung, dạng gel có giá thành đắt nhất trong khi dạng tấm dán và ester tiêm có giá rẻ nhất. Có thể xảy ra tình trạng di chuyển thuốc dạng gel qua da giữa bệnh nhân với bạn tình hoặc trẻ em có tiếp xúc gần, cần tránh điều này bằng cách rửa sạch trước khi bệnh nhân có tiếp xúc gần gũi với người khác.
Các miếng dán testosteron thẩm thuốc qua da có thể gây phát ban da và ngứa, vì vậy có thể cần bôi cùng các kem corticosteroid.
Bệnh nhân nam được điều trị bằng testosteron đường tiêm sẽ có tình trạng dao động lớn về nồng độ testosteron huyết tương gây xuất hiện các tác động trên cảm xúc và sinh lý của bệnh nhân. Các tác động này bao gồm căng đau vú, tăng động ở mức nồng độ đỉnh, mệt, trầm cảm hoặc giận dữ khi nồng độ testosteron ở mức đáy. Vì vậy, khuyến cáo nên bắt đầu điều trị với các liều thấp hơn, nhất là đối với bệnh nhân nam cao tuổi, sau đó điều chỉnh tăng liều lên dần để làm giảm các dao động khí sắc của bệnh nhân.
Các điều trị thuốc khác được sử dụng khi bệnh nhân mong muốn có con bao gồm hCG, hCG kết hợp với FSH và dùng GnRH theo nhịp [41,42]. Các phương pháp này kích thích tinh hoàn sản xuất cả testosteron và tinh trùng.
Clomiphen citrat, một chất đối kháng estrogen làm giảm ức chế hormon hướng sinh dục do estrogen gây nên ở mức dưới đồi, dẫn tới gây tăng tiết testosteron. Vì vậy, có thể dùng thuốc này để điều trị suy sinh dục với giảm gonadotropin, liều dùng trong khoảng từ 25 mg x 3 lần/tuần đến 50 mg/ngày [4345]. Clomiphen gần đây chỉ được FDA phê chuẩn để gây sinh tinh trùng, song thuốc được dùng theo kiểu không chính thức (offlabel) để điều trị suy sinh dục. Mật độ xương là một mối quan tâm về lý thuyết khi dùng clomiphen vì thuốc là một chất đối kháng estrogen, nhưng hiện nay vẫn chưa có các nghiên cứu liên quan đến vấn đề này được thực hiện.
3.2 Các điều trị không dùng thuốc khác
Điều trị thay đổi lối sống cũng được chỉ định trong điều trị cho các nam giới bị suy sinh dục. Vẫn còn có các tranh cãi là việc không hoạt động thể lực, uống rượu và hút thuốc có làm giảm nồng độ testosteron hay không.
Cần phẫu thuật chỉnh sửa khẩn cấp nếu phát hiện thấy có tình trạng tinh hoàn lạc chỗ hay ẩn tinh hoàn.
Khối u tuyến yên hoặc dưới đồi có thể cần điều trị phẫu thuật hoặc tia xạ hoặc điều trị nội khoa đối với u tế bào tiết prolactin.
Nếu nghi ngờ có tình trạng suy sinh dục do nghiện opiat, cai opiat có thể phục hồi được chức năng tuyến sinh dục trở lại bình thường.
4 CÁC TRƯỜNG HỢP ĐẶC BIỆT
Xem xét sử dụng cho bệnh nhân hormon hướng sinh dục kết hợp với các phương pháp thụ tinh nhân tạo.
Chỉ định áp dụng liệu pháp testosteron cho nam giới lớn tuổi bị suy sinh dục nên dựa trên tính cá thể hóa và chỉ thực hiện sau khi đã thảo luận kỹ lưỡng với bệnh nhân về những điều không chắc chắn liên quan với nguy cơ và lợi ích của điều trị bằng testosteron [40].
Điều trị testosteron trong một thời gian ngắn có thể được xem xét như một điều trị bổ sung ở các nam giới bị nhiễm HIV có nồng độ testosteron thấp, sút cân để thúc đẩy duy trì trọng lượng cơ thể, lấy lại khối thịt nạc của cơ thể và sức mạnh của cơ hoặc đối với nam giới bị suy sinh dục đang dùng glucocorticoid liều cao nhằm thúc đẩy việc bảo tồn khối thịt nạc của cơ thể và đậm độ khoáng của xương [40].
5 KIỂM TRA VÀ THEO DÕI [40]
Nên kiểm tra nồng độ testosteron huyết thanh 3 6 tháng sau khi bắt đầu điều trị. Xét nghiệm này nên được kiểm tra giữa các lần tiêm ở bệnh nhân sử dụng testosteron dạng tiêm. Có thể điều chỉnh liều dùng để duy trì nồng độ testosteron toàn phần ở khoảng giữa của giới hạn bình thường (400 700 ng/dL). Bệnh nhân được điều trị bằng miếng dán testosteron, phải kiểm tra nồng độ testosteron 3 12 giờ sau khi dán thuốc. Khi dùng thuốc dạng gel hoặc viên nén đặt trong miệng, có thể định lượng nồng độ testosteron huyết thanh vào bất kỳ lúc nào và nên duy trì ở khoảng giữa của giới hạn bình thường.
Đối với nam giới sau tuổi dậy thì, điều trị bằng liều testosteron tối thiểu để cải thiện triệu chứng giảm ham muốn tình dục, suy sinh dục và mức năng động trong hoạt động hằng ngày là điều hợp lý.
Trong suy sinh dục nguyên phát, có thể được sử dụng tiêu chí bình thường hóa nồng độ LH huyết thanh như một chỉ dấu đại diện để xác nhận điều trị có thỏa đáng hay không.
Bệnh nhân đang dùng testosteron nên được theo dõi để phát hiện các tác dụng phụ tiềm tàng bao gồm đa hồng cầu, tăng sản tuyến tiền liệt lành tính, ung thư tuyến tiền liệt, xuất hiện hoặc diễn biến tồi đi của tình trạng ngừng thở khi ngủ. Các tác dụng phụ thứ yếu khác là trứng cá/da dầu, giảm sản xuất tinh trùng hoặc vô sinh.
Hemoglobin và hematocrit nên được kiểm tra vào lúc bắt đầu điều trị (giá trị cơ sở) và theo dõi sau điều trị từ 3 6 tháng, sau đó hằng năm để sàng lọc xuất hiện tình trạng đa hồng cầu. Nếu hematocrit tăng trên 54%, cần ngừng điều trị thay thế bằng testosteron tới khi hematocrit giảm xuống mức an toàn, sau đó có thể bắt đầu điều trị lại bằng testosteron với liều thấp hơn. Bệnh nhân có thể cần được đánh giá thêm về tình trạng giảm oxy máu và ngừng thở khi ngủ.
Tình trạng ngừng thở khi ngủ do tắc nghẽn có thể diễn biến tồi đi trong khi điều trị thay thế bằng testosteron. Mỗi lần bệnh nhân tới tái khám, nên đánh giá lại các triệu chứng của ngừng thở khi ngủ do tắc nghẽn như buồn ngủ vào thời gian ban ngày và ngừng thở có người chứng kiến.
Nên thực hiện đánh giá tỷ trọng hay đo đậm độ xương sau khi tiến hành điều trị testosteron 1 2 năm nếu bệnh nhân có biểu hiện loãng xương hoặc gãy xương do chấn thương nhẹ.
Nên tiến hành thăm khám tuyến tiền liệt qua trực tràng bằng ngón tay và xét nghiệm kháng nguyên đặc hiệu tuyến tiền liệt (PSA) ở tất cả nam giới từ 40 tuổi trở lên có PSA ở mức 0,6 ng/mL hoặc cao hơn, trước khi bắt đầu điều trị testosteron và ở thời điểm 3 đến 6 tháng sau điều trị, sau đó theo các hướng dẫn dựa trên bằng chứng cho sàng lọc ung thư tuyến tiền liệt. Sử dụng PSA như xét nghiệm sàng lọc và theo dõi ung thư tuyến tiền liệt hiện còn rất nhiều tranh cãi. Nên thảo luận rõ ràng với bệnh nhân về lợi ích và nguy cơ.
Nên tránh điều trị testosteron cho bệnh nhân bị ung thư vú, ung thư tuyến tiền liệt, nồng độ hematocrit khoảng 50% và khi có tình trạng ngừng thở khi ngủ nặng song không được điều trị, bệnh nhân có triệu chứng nặng của đường tiết niệu thấp và suy tim kiểm soát kém và các đối tượng mong muốn sinh con.
Nên tránh điều trị testosteron và khuyến cáo tham vấn chuyên khoa tiết niệu ở những bệnh nhân có khối u sờ thấy được ở tuyến tiền liệt, PSA > 4 ng/mL hoặc PSA > 3 ng/mL kèm với các yếu tố nguy cơ của ung thư tuyến tiền liệt như người Mỹ gốc Phi và những người thân thế hệ F1 một mắc ung thư tuyến tiền liệt trước 65 tuổi [40,46].
6 KẾT CỤC VÀ TIÊN LƯỢNG
Làm bình thường hóa nồng độ testosteron sẽ giúp cải thiện triệu chứng gây tình trạng nam hóa ở bệnh nhân sau 3 đến 6 tháng [3].
Tăng khối nạc của cơ thể, thể tích tuyến tiền liệt, tình trạng tạo hồng cầu, năng lượng và chức năng tình dục xảy ra trong vòng 3 6 tháng đầu điều trị [3].
Mật độ khoáng của xương đạt tới giá trị đỉnh tối đa sau 24 tháng.
10% bệnh nhân bị suy sinh dục giảm kích tố hướng sinh dục đơn độc (IHH) (bao gồm hội chứng Kallmann) mà trước đây được cho rằng cần điều trị suốt đời, có thể thuyên giảm bệnh một cách bền vững sau khi ngừng điều trị hormon. Do đó, thử ngừng điều trị hormon một thời gian ngắn để đánh giá khả năng phục hồi suy sinh dục giảm kích tố hướng sinh dục đơn độc (IHH) sau khi đạt được nam hoá hoàn toàn có thể là một tiếp cận hợp lý [47].
Cho dùng hCG/gonadotropin ở người mãn kinh (hMG) trong IHH có thể làm tăng sản xuất tinh trùng ở 71% những người có tinh hoàn lớn (thể tích tinh hoàn >4 mL) nhưng chỉ có hiệu quả ở 36% những người có tinh hoàn nhỏ (thể tích tinh hoàn <4mL) [48].
7 Case lâm sàng: hội chứng klinefelter
Một trẻ trai vị thành niên 13 tuổi hơi cao hơn so với tuổi đến kiểm tra sức khỏe. Người mẹ nói rằng bệnh nhân dường như chưa “đủ lớn” và thiếu an toàn so với những bé trai cùng tuổi. Thành tích học tập ở trường của cậu bé dưới mức trung bình, và năm nay cậu bé đã được bắt đầu lớp giáo dục đặc biệt. Thăm khám ghi nhận tứ chi của cậu bé dài hơn so với bình thường, và cậu bé cảm thấy xấu hổ vì nữ hóa tuyến vú. Tanner giai đoạn 1 với tuyến sinh dục nhỏ.(n(Clinical Cases, tải bản PDF tại đây)n)
1. Chẩn đoán thích hợp nhất là gì?
2. Xét nghiệm chẩn đoán?
Tóm tắt: Một trẻ trai vị thành niên 13 tuổi chưa “đủ lớn” bị thiểu năng sinh dục, chi dài, nữ hóa tuyến vú và chậm phát triển.
- Chẩn đoán thích hợp nhất: Hội chứng Klinefelter, hội chứng ba nhiễm sắc thể thường do không phân ly NST từ bố hơn là từ mẹ, ảnh hưởng trong 600-900 trẻ trai.
- Xét nghiệm chẩn đoán: Phân tích NST.
7.1 Phân tích
7.1.1 Mục tiêu
1. Hiểu về các dấu hiệu và triệu chứng của hội chứng Klinefelter.
2. Đánh giá các nguyên nhân gây chậm phát triển tinh thần ở trẻ.
3. Học về các dấu hiệu và triệu chứng của hội chứng liên quan tới mất hoặc thêm NST giới tính.
7.1.2 Xem xét
Mẹ của đứa trẻ này phát hiện vấn đề phát triển và hành vi của con mình không giống với những đứa trẻ khác. Trường học gần đây đã xác định nhu cầu giáo dục đặc biệt cho cậu bé, đặc biệt là giáo dục ngôn ngữ. Khai thác bệnh sử kĩ lưỡng (bao gồm hiệu suất học tập và các vấn đề hành vi) và thăm khám cung cấp các manh mối chẩn đoán. Nguyên nhân của bệnh lý ảnh hưởng đến kết cục tâm lý xã hội, liệu pháp điều trị trong tương lai, và quyết định kế hoạch hóa gia đình.
7.2 Tiếp cận lâm sàng
Nguyên nhân gây MR bao gồm các bất thường phôi giai đoạn sớm và đã biết trước (quái thai, bất thường NST, rối loạn chức năng bánh nhau, dị dạng CNS); tổn thương não thai nhi (nhiễm trùng, ngộ độc, các vấn đề bánh nhau); các vấn đề chu sinh (sinh non, rối loạn chuyển hóa, nhiễm trùng); tổn thương não sau sinh (nhiễm trùng, chấn thương, rối loạn chuyển hóa, ngộ độc, dinh dưỡng kém); và những khó khăn trong gia đình sau sinh (nghèo đói, tương tác kém giữa người chăm sóc – đứa trẻ, bố mẹ bị bệnh tâm thần). Một nhóm “căn nguyên không xác định” bao gồm đứa trẻ MR không thuộc các nhóm trên.
Bệnh sử đứa trẻ có thể bị MR bao gồm đánh giá các kỹ năng tâm lý xã hội và hỏi kĩ đánh giá ở trường. Chẩn đoán sau cùng có thể cần bài test xác định IQ dưới mức quy định, chẳng hạn như 80. Việc xác định xem có làm bài test hay không nên dựa vào biểu hiện khám lâm sàng, tiền sử phát triểnvà đi học, mối bận tâm của gia đình và giáo viên. Trẻ trai với hội chứng Klinefelter thường chậm phát triển, đặc biệt là nhận thức lời nói, kém khả năng đọc, đánh vần và toán học; IQ tổng thể có thể bình thường, nhưng IQ lời nói có phần giảm đi. Ở các biến thể có nhiều NST X, tỉ lệ mắc và mức độ nặng của MR tăng lên. Bé trai với hội chứng Klinefelter thường không được phát hiện cho đến tuổi dậy thì vì biểu hiện lâm sàng tiềm ẩn. Chẩn đoán nên được xem xét ở tất cả bé trai (bất kể độ tuổi nào) có tình trạng MR, hoặc các vấn đề tâm lý xã hội, vấn đề học đường.
Các biểu hiện trên thăm khám ở những bệnh nhân MR không đặc hiệu bao gồm kích thước vùng chẩm, màu tóc bất thường, mắt khác biệt, dị dạng tai hoặc mũi, bất thường kích thước hàm, hình dạng miệng. Xương bàn tay bàn chân ngắn, chồng lấp hoặc thừa ngón, và bất thường nếp lòng bàn tay hoặc móng tay. Da có dát café au lait hoặc nốt sáng màu, và bất thường kích thước cơ quan sinh dục. Bệnh nhân MR trong hội chứng Klinefelter thường cao, gầy và chi dài. Tinh hoàn và đôi khi dương vật nhỏ so với tuổi, nhưng những phát hiện này có thể không rõ ràng cho đến tuổi dậy thì. Nam giới trưởng thành trong hội chứng Klinefelter phát triển nữ hóa tuyến vú, lông mặt thưa thớt, và vô tinh. Tỷ lệ ung thư vú (cũng như một số bệnh ung thư huyết học) tăng trong hội chứng Klinefelter.
Xét nghiệm ở đứa trẻ MR dựa vào biểu hiện lâm sàng và các mốc phát triển. Phân tích NST thường được đưa vào để đánh giá đứa trẻ MR; đối với hội chứng Klinefelter, một phân tích như vậy sẽ cho thấy thừa NST X trong vật chất di truyền. Các xét nghiệm khác trong MR có thể bao gồm nước tiểu, acids hữu cơ và amin trong huyết thanh, nồng độ các chất trong huyết thanh bao gồm NH3, chì, Kẽm, đồng, và xét nghiệm nhiễm trùng bẩm sinh. Hình ảnh học có thể bao gồm CT đầu, MRI hoặc EEG.
Quản lý đứa trẻ MR bao gồm giáo dục đặc biệt, can thiệp giai đoạn sớm, dịch vụ xã hội, và can thiệp tâm lý. Can thiệp sâu hơn đối với đứa trẻ có bệnh lý nền có thể bao gồm điều chỉnh chế độ ăn, tham vấn di truyền.
7.3 Câu hỏi lượng giá
Ghép các rối loạn di truyền (A-E) với biểu hiện lâm sàng [Câu hỏi 5.1-5.3]:
A. Fragile X syndrome
B. Klinefelter syndrome (XXY)
C. Turner syndrome (XO)
D. XXX syndrome
E. XYY male
5.1. Một thanh niên phạm tội đã được chế tài khi khám kĩ phát hiện mụn trứng cá nặng, ngực hơi lõm, răng to, trán dô, mặt dài và ngón tay dài. Gia đình của cậu bé nói rằng cậu bé kém phát triển kĩ năng vận động tinh (như cầm bút), nóng nảy và chỉ số IQ thấp hơn bình thường.
5.2. Nam thanh niên 14 tuổi cao gầy không có dấu hiệu dậy thì. Cậu bé chậm phát triển kỹ năng nói và luôn học kém hơn ở trường so với các anh chị em trong nhà. Cậu bé nhút nhát, và giáo viên nói rằng hành động của cậu bé chưa trưởng thành. Khám ghi nhận vú phát triển, chi dài, giảm tỉ lệ thân trên-thân dưới. Tinh hoàn và dương vật nhỏ.
5.3. Một trẻ gái vị thành niên 15 tuổi vô kinh nguyên phát được ghi nhận là thấp hơn bách phân vị thứ 5th về chiều cao. Cô bé bị tăng huyết áp, đường viền tóc phía sau thấp, tai đóng thấp và da thừa vùng gáy.
5.4. Một bé trai 7 tuổi chậm phát triển tinh thần được sinh ra ở thai kỳ 26 tuần có mẹ 28 tuổi không được chăm sóc tiền sản đầy đủ. Đánh giá MR ở đứa trẻ này liên quan tới điều nào sau đây?
A. U não
B. Bất thường NST
C. Biến chứng của sinh non
D. Nhiễm trùng bẩm sinh với cytomegalovirus
E. Tăng nồng độ chì trong huyết thanh
7.4 Đáp án
5.1. E. Những bé trai XYY thường có tính khí nóng nảy. Các biểu hiện khác bao gồm tai dài và không đối xứng, tăng chiều dài so với chiều rộng của bàn tay, bàn chân và hộp sọ, ngực hơi lõm. Từ 5-6 tuổi, đứa trẻ có khuynh hướng cao hơn những trẻ cùng tuổi và bắt đầu có những hành vi hung hăng hay thách thức.
5.2. B. Hội chứng Klinefelter, bổ sung testosterone cho phép trẻ trai phát triển bình thường hơn, mặc dù không sản xuất tinh trùng; tỉ lệ mắc ung thư vú gần bằng với nữ giới.
5.3. C. Hội chứng Turner cũng bao gồm tăng khoảng cách hai đầu núm vú và ngực rộng; nề bàn tay và bàn chân từ giai đoạn sơ sinh; bệnh tim bẩm sinh (hẹp eo động mạch chủ hoặc van động mạch chủ hai mảnh); thận hình móng ngựa; nhược giáp; và giảm thính lực. Phát triển tinh thần thường bình thường.
5.4. C. Sinh non, đặc biệt là sớm hơn 28 tuần, liên quan đến biến chứng (như xuất huyết não thất) có thể gây chậm phát triển tinh thần và IQ thấp.
7.5 Đúc Kết Lâm Sàng
- Trẻ trai với hội chứng Klinefelter (XXY) có chậm phát triển tinh thần, cao gầy, nữ hóa tuyến vú, tay dài, chân dài và nhược sinh dục.
- Nam giới XYY có tính khí nóng nảy (chống đối xã hội), kém phát triển vận động tinh, tăng trưởng nhanh giữa thời thơ ấu, răng to, trán dô, tai không đối xứng và mụn trứng cá nặng lúc dậy thì.
- Trẻ gái với hội chứng Turner (45, XO) có tầm vóc thấp, vô kinh, nếp da thừa vùng gáy, viền tóc phía sau thấp, ngực rộng hai đầu núm vú xa nhau, và hẹp eo động mạch chủ. Tăng huyết áp, khả năng do bất thường thận (thận hình móng ngựa).
- Hội chứng Fragile X, là dạng thường gặp nhất trong MR di truyền, được tìm thấy chủ yếu ở trẻ trai và có thể được chẩn đoán ở những bệnh nhân MR (đặc biệt là nam giới) có đầu to, mặt dài, tai to và tinh hoàn lớn.
8 TÀI LIỆU THAM KHẢO
1. Matsuomoto AM, Bremer WJ. Testicular disorder. In: Melmed S, Polonsky K, Larsen PR, Kronen- berg H, eds. Williams Textbook of Endocrinology. 12th ed. Phil- adelphia, PA: Elsevier/Saunders; 2011:688-777.
2. Bhasin S, Storer TW, Berman N, et al. Testosterone replac ment increases fat-free mass and muscle size in hypogonadal men. J Clin Endocrinol Metab 1997;82(2): 407-413.
3. Snyder PJ, Peachey H, Berlin JA, et al. Effects of testosterone replacement in hypogonadal men. J Clin Endocrinol Metab 2000;85(8):2670-2677.
4. Morales A, Schulman CC, Tostain J, CW Wu F. Testosterone deficiency syndrome (TDS) needs to be named appropriately-the importance of accurate terminology. Eur Urol 2006;50(3):407-409.
5. Wu FC, Tajar A, Beynon JM, et al. Identification of late-onset hypogonadism in middle-aged and elderly men. N Engl J Med 2010;363(2):123–135.
6. Araujo A, Esche G, Kupelian V, et al. Prevalence of symptomatic androgen deficiency in men. J Clin Endocrinol Metab 2007;92(11):4241-4247.
7. Feldman HA, Longcope C, Derby CA, et al. Age trends in the level of serum testosterone and other hormones in middle-aged men: Lon- gitudinal results from the Massachu- setts male aging study. J Clin Endo- crinol Metab 2002;87(2):589–598.
8. Harman SM, Metter EJ, Tobin JD, Pearson J, Blackman MR. Longitudinal effects of aging on serum total and free testosterone levels in healthy men. Baltimore Longitudinal Study of Aging. J Clin Endocrinol Metab 2001;86(2): 724-731.
9. Giltay JC, Maiburg MC. Klinefelter syndrome: Clinical and molecular aspects. Expert Rev Mol Diagn 2010;10(6):765–776.
10. Geffner ME, Kaplan SA, Bersche N, et al. Insulin resistance in Klinefelter syndrome. J Pediatr Endocrinol 1987;2:173.
11. Scofield RH, Bruner GR, Namjou B, et al. Klinefelter's syndrome (47,XXY) in male systemic lupus erythematosus patients: support for the notion of a gene-dose effect from the X chromosome. Arthritis Rheum 2008;58(8):2511-2517.
12. Völkl TM, Langer T, Aigner T, et al. Klinefelter syndrome and medias- tinal germ cell tumors. Am J Med Genet A 2006;140(5):471–481.
13. Weiss JR, Moysich KB, Swede H. Epidemiology of male breast cancer. Cancer Epidemiol Biomarkers Prev 2005;14(1):20–26.
14. Swerdlow AJ, Schoemaker MJ, Higgins CD, Wright AF, Jacobs PA. Cancer incidence and mortality in men with Klinefelter syndrome: a cohort study. J Natl Cancer Inst 2005;97(16):1204–1210.
15. Telvi L, Lebbar A, Del Pino O, Bar- bet JP, Chaussain JL. 45,X/46,XY mosaicism: Report of 27 cases. Pediatrics 1999;104(2):304–308.
16. Bianco B, Lipay M, Guedes A, Oliveira K, Verreschi IT. SRY gene increases the risk of developing gonadoblastoma and/or nontu- moral gonadal lesions in Turner syndrome. Int J Gynecol Pathol 2009;28(2):197-202.
17. van Brakel J, Kranse R, de Muinck Keizer-Schrama SM, et al. Fertility potential in a cohort of 65 men with previously acquired undescended testes. J Pediatr Surg 2014;49(4):599–605.
18. Simoni M, Gromoll J, Höppner W, et al. Mutational analysis of the follicle-stimulating hormone (FSH) receptor in normal and infertile men: identification and characteri- zation of two discrete FSH receptor isoforms. J Clin Endocrinol Metab 1999;84(2):751–755.
19. Latronico A, Anasti J, Arnhold IJ, et al. Brief report: testicular and ovarian resistance to luteinizing hormone caused by inactivating mutations of the luteinizing hormone-receptor gene. N Engl J Med 1996;334(8):507–512.
20. Harper P, Penny R, Foley TP Jr, Migeon CJ, Blizzard RM. Gonadal function in males with myotonic dystrophy. J Clin Endocrinol Metab 1972; 35 (6): 852–856.
21. Rousso I, Iliopoulos D, Athanasi- adou F, Zavopoulou L, Vassiliou G, Voyiatzis N. Congenital bilateral anorchia: hormoneal, molecular and imaging study of a case. Genet Mol Res 2006;5(4):638-642.
22. Danesi R, La Rocca RV, Cooper MR, et al. Clinical and experimental evidence of inhibition of testosterone production by suramin. J Clin Endocrinol Metab 1996;81(6):2238-2246.
23. Eckman A, Dobs A. Drug-induced gynecomastia. Expert Opin Drug Saf 2008;7(6):691-702.
24. Quinton R, Duke VM, Robertson A, et al. Idiopathic gonadotrophin deficiency: genetic questions addressed through phenotypic characterization. Clin Endocrinol (Oxf) 2001;55(2):163–174.
25. Strobel A, Issad T, Camoin L, Ozata M, Strosberg AD. A leptin missense mutation associated with hypogonadism and morbid obesity. Nat Genet 1998;18(3):213–215.
26. Davis SW, Castinetti F, Carvalho LR, et al. Molecular mechanisms of pituitary organogenesis: In search of novel regulatory genes. Mol Cell Endocrinol 2010;323(1):4–19.
27. Hohl A, Mazzuco TL, Coral MH, Schwarzbold M, Walz R. Hypogonadism after traumatic brain injury. Arq Bras Endocrinol Metabol 2009; 53 (8): 908–914.
28. Agha A, Thompson CJ. Anterior pituitary dysfunction following traumatic brain injury (TBI). Clin Endocrinol (Oxf) 2006;64(5): 481-488.
29. Kelly DF, Gonzalo IT, Cohan P, Berman N, Swerdloff R, Wang C. Hypopituitarism following traumatic brain injury and aneu- rysmal subarachnoid hemorrhage: A preliminary report. J Neurosurg 2000;93(5):743–752.
30. Odell WD. Testosterone treatment of men treated with glucocorticoids. Arch Intern Med 1996; 156 (11):1133–1134.
31. Nachtigall LB, Boepple PA, Pralong FP, Crowley WF Jr. Adult-onset idiopathic hypogonad- otropic hypogonadism-a treatable form of male infertility. N Engl J Med 1997;336(6):410-415.
32. Wang C, Jackson G, Jones TH, et al. Low testosterone associated with obesity and the metabolic syndrome contributes to sexual dysfunction and cardiovascular disease risk in men with type 2 diabetes. Diabetes Care 2011; 34 (7): 1669-1675.
33. Emanuele MA, Emanuele N. Alcohol and the male reproductive system. Alcohol Res Health 2001; 25(4):282-287.
34. Carruthers M, Trinick TR, Wheeler MJ. The validity of androgen assays. Aging Male 2007;10(3): 165-172.
35. Brambilla DJ, Matsumoto AM, Araujo AB, McKinlay JB. The effect of diurnal variation on clinical measurement of serum testosterone and other sex hormone levels in men. J Clin Endocrinol Metab 2009;94(3):907–913.
36. Vermeulen A, Verdonck L, Kaufman JM. A critical evaluation of simple methods for the estimation of free testosterone in serum. J Clin Endocrinol Metab 1999;84(10):3666-3672.
37. Caronia LM, Dwyer AA, Hayden D, Amati F, Pitteloud N, Hayes FJ. Abrupt decrease in serum testoster- one levels after an oral glucose load in men: implications for screening for hypogonadism. Clin Endocrinol (Oxf) 2013; 78 (2): 291–296.
38. Kwan M, Greenleaf WJ, Mann J, Crapo L, Davidson JM. The nature of androgen action on male sexuality: a combined laboratory-self-re- port study on hypogonadal men. J Clin Endocrinol Metab 1983; 57 (3):557–562.
39. Cooper TG, Noonan E, von Eckard- stein S, et al. World Health Organi- zation reference values for human semen characteristics. Hum Reprod Update 2010;16(3):231-245.
40. Bhasin S, Cunningham GR, Hayes FJ, et al. Testosterone therapy in men with androgen deficiency syndromes: An Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2010; 95(6):2536-2559.
41. Han TS, Bouloux PM. What is the optimal therapy for young males with hypogonadotropic hypogonadism. Clin Endocrinol (Oxf) 2010; 72(6): 731–737.
42. Silveira LF, Latronico AC. Approach to the patient with hypogonadotropic hypogonadism. J Clin Endocrinol Metab 2013;98(5):1781-1788.
43. Liel Y. Clomiphene citrate in the điều trị of idiopathic or functional hypogonadotropic hypogonadism in men: a case series and review of the literature. Endocr Pract 2017;23(3):279–287.
44. Bardin CW, Ross GT, Lipsett MB. Site of action of clomi- phene citrate in men: a study of the pituitary-Leydig cell axis. J Clin Endocrinol Metab 1967; 27(11):1558–1564.
45. Ioannidou-Kadis S, Wright PJ, Neely RD, Quinton R. Complete reversal of adult-onset isolated hypogonadotropic hypogonadism with clomiphene citrate. Fertil Steril 2006;86(5):1513.e5-e9.
46. Wolf AM, Wender RC, Etzioni RB, et al. American Cancer Society Prostate Cancer Advisory Com- mittee. American Cancer Society guideline for the early detection of prostate cancer: update 2010. CA Cancer J Clin 2010;60(2):70-98.
47. Raivio T, Falardeau J, Dwyer A, et al. Reversal of idiopathic hypogonad- otropic hypogonadism. N Engl J Med 2007;357(9):863–873.
48. Miyagawa Y, Tsujimura A, Matsumiya K, et al. Outcome of gonadotropin therapy for male hypogonadotropic hypogonadism at university affiliated male infertility centers: A 30-year retrospective study. J Urol 2005;173(6):2072-2075.

