Sửa van hai lá qua đường ống thông trong tim mạch can thiệp
Nguồn: Sách tim mạch can thiệp
Chủ biên: PGS.TS.BS. Phạm Mạnh Hùng
PGS.TS.BS. Phạm Mạnh Hùng
TS.BSNT. Phan Tuấn Đạt
ThS.BSNT. Phạm Nhật Minh
PGS.TS.BS. Nguyễn Ngọc Quang
Trungtamthuoc.com - Bệnh lý hở van hai lá là một trong những bệnh lý điển hình trong chuyên ngành tim mạch can thiệp. Và bệnh lý hở van hai lá này cần được thực hiện thủ thuật để chữa trị khắc phục tình trạng tiêu cực như thủ thuật sửa van hai lá qua đường ống thông. Bài viết dưới đây Trung Tâm Thuốc Central Pharmacy sẽ tổng hợp các kiến thức, vấn đề về thủ thuật sửa van hai lá qua đường ống thông.
1 Đại cương và dịch tễ học
Ở các nước phát triển, bệnh hở van hai lá đứng thứ hai trong số các bệnh van tim, chỉ sau hẹp van động mạch chủ và ảnh hưởng đến 9,3% dân số trên 75 tuổi. Các nghiên cứu dịch tễ học đã chỉ ra rằng tỷ lệ mắc hở hai lá vừa đến nhiều tăng theo tuổi, với hơn 2-2,5 triệu bệnh nhân ở Hoa Kỳ vào năm 2000 và dự kiến sẽ tăng gấp đôi vào năm 2030 do tuổi thọ tăng. Tại Hoa Kỳ, tỷ lệ mắc bệnh van tim đang tăng với tỷ lệ 0,7% ở bệnh nhân từ 18 đến 44 tuổi và 13,3% ở bệnh nhân trên 75 tuổi. Ở châu Âu, tình hình cũng tương tự, với tỷ lệ mắc bệnh hở van hai lá đang gia tăng, mặc dù tỷ lệ mắc bệnh thấp khớp giảm.
Trong những năm trở lại đây, số người bệnh hở van hai lá tiên phát (do bệnh lý bản thân của hệ thống van) có xu hướng giảm đi, tuy nhiên số lượng bệnh nhân hở van hai lá thứ phát (hở hai lá do hậu quả của giãn buồng tim) lại có xu hướng gia tăng ngày càng nhanh chóng. Số bệnh nhân hở van hai lá vừa – nhiều chiếm 15-20% số bệnh nhân suy tim và 12% bệnh nhân hội chứng vành cấp trong vòng 30 ngày, trong khi hở van hai lá mọi mức độ gặp ở 25-50% bệnh nhân hội chứng vành cấp, bao gồm cả nhồi máu cơ tim ST chênh lên và nhồi máu cơ tim không ST chênh lên. Ở những bệnh nhân mắc bệnh thiếu máu cơ tim mạn tính và ổn định có rối loạn chức năng thất trái, hở van hai lá do thiếu máu cục bộ thậm chí còn gặp nhiều hơn, vượt quá 50%. Hở hai lá nhiều đôi khi còn gặp ở một số bệnh cảnh lâm sàng tưởng chừng như đơn giản như THA, ĐTĐ hay hội chứng chuyển hóa… không được kiểm soát. Do đó, mặc dù các bệnh về van tim có tỷ lệ mắc thấp hơn so với hội chứng vành cấp hoặc suy tim, nhưng mối liên quan giữa các bệnh này, đặc biệt là giữa bệnh mạch vành và hở van hai lá chức năng cho thấy nhu cầu ngày càng gia tăng của việc chẩn đoán và điều trị các bệnh lý van hai lá. Nếu như can thiệp qua da trong xử lý bệnh lý hẹp hai lá đã dần trở thành thường quy thì can thiệp qua da để xử trí bệnh lý hở van hai lá đang ngày càng phát triển và mở rộng trong những năm trở lại đây.
2 Giải phẫu và hình thái van hai lá
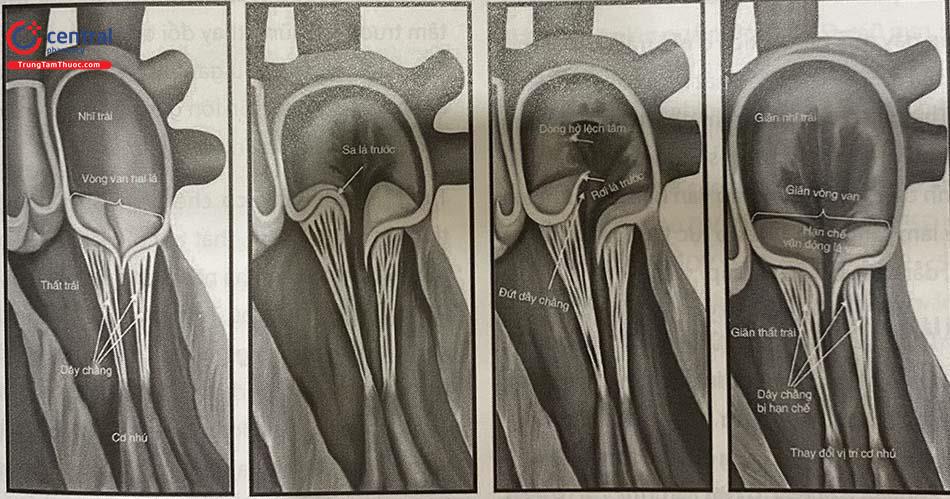
Van hai lá rất phức tạp và có sự tham gia đồng bộ của một số cấu trúc giải phẫu bao gồm lá van, dây chằng, cơ nhú, vòng van và cơ thất trái để tạo điều kiện cho dòng chảy một chiều của máu từ tâm nhĩ trái vào tâm thất trong thì tâm trương, và ngăn ngừa dòng trào ngược trong thì tâm thu (Hình 41.1). Thay đổi giải phẫu ở mọi mức độ có thể gây ra các rối loạn chức năng tiềm tàng, đặc biệt là bất thường đóng van và dòng trào ngược.
Van hai lá bao gồm lá trước (phía động mạch chủ) và sau (phía thành), với ba phân vùng (A1 A2 A3, P1 P2 P3) được tính từ phía bên vào phía trong của tim (Hình 41.2). Lá sau có rãnh phân chia rõ hơn dọc theo phía bờ tự do, tách riêng ba phần. Vòng van hai lá có cấu trúc hình yên ngựa bao gồm các mô sợi gắn vào lá van hai lá. Phần trước của vòng van hai lá gắn vào các vùng tam giác sợi có chứa mô dẫn truyền trong khi phần sau ít phát triển hơn, chứa nhiều cơ hơn và dễ bị giãn. Hở van hai lá là bệnh van tim phổ biến nhất ở người lớn. Hai lá van đóng không kín và mất đối xứng về vị trí của hai lá van sẽ dẫn đến hở van hai lá các mức độ khác nhau. Xác định nguyên nhân gây hở van hai lá chức năng có thể hỗ trợ xây dựng chiến lược điều trị thích hợp.
3 Sinh lý bệnh hở van hai lá
Trong quá trình tìm hiểu nguyên nhân của hở van hai lá, bước đầu tiên cần đánh giá hở van hai lá là “nguyên phát” (có liên quan đến bất thường giải phẫu của lá van và/hoặc dây chằng) hay “thứ phát hoặc chức năng” (thường liên quan đến di động hạn chế của lá van do giãn vòng van trong bệnh cảnh giảm vận động đồng đều hoặc rối loạn vận động các thành thất trái) thường là bước đầu tiên (Bảng 41.1, hình 41.1, 41.2).
Trong hở van hai lá chức năng, hình dạng thất trái gần với hình cầu hơn, dẫn đến co rút lại các cơ nhú và dây chằng cùng với sự tách xa của các lá van. Trong hầu hết các trường hợp, hở van hai lá nặng dần lên theo thời gian và diễn ra tương đối mạn tính. Một số ít trường hợp có thể xảy ra cấp tính khi hở van hai lá nhiều do đứt dây chằng hoặc cơ nhú trong hội chứng vành cấp hay viêm nội tâm mạc nhiễm khuẩn. Ở các nước phát triển, sinh bệnh học phổ biến nhất của hở van hai lá thường là do thoái hóa van dẫn đến tỉ lệ lớn của sa van hai lá trong cộng đồng, có thể là thoái hóa myxomatous hoặc giãn dây chằng.
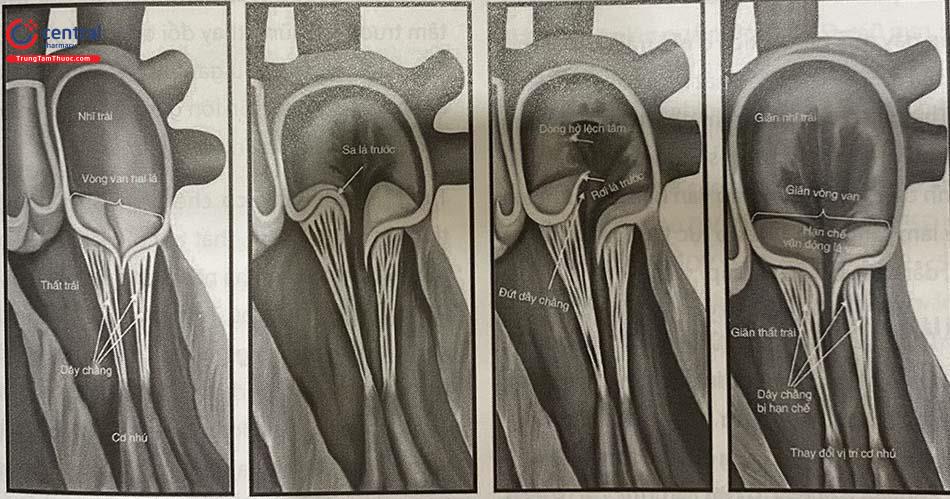
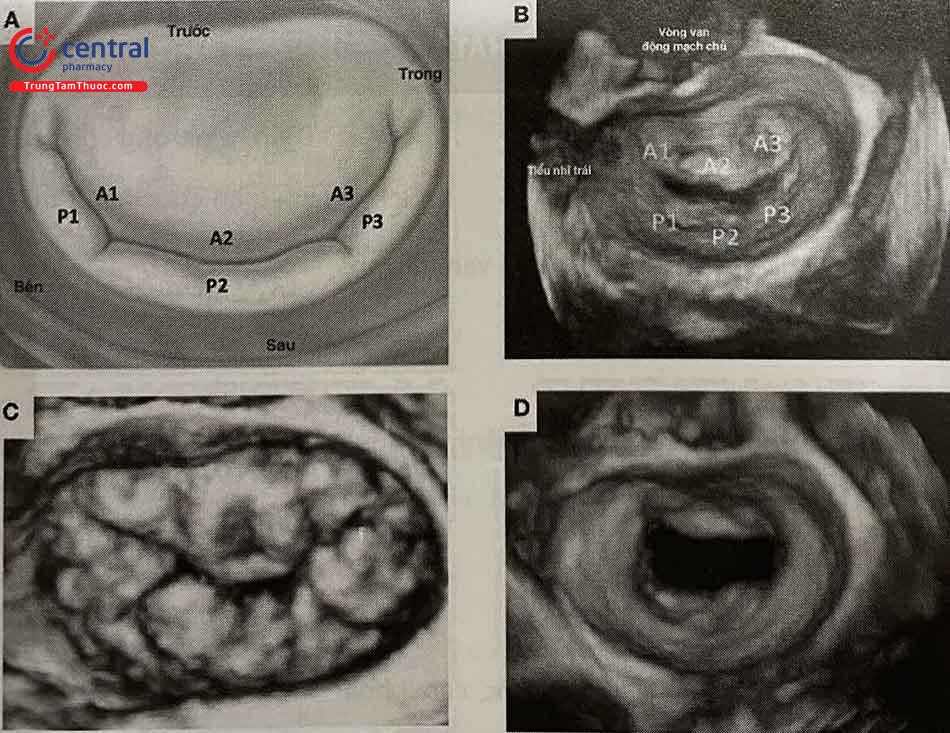
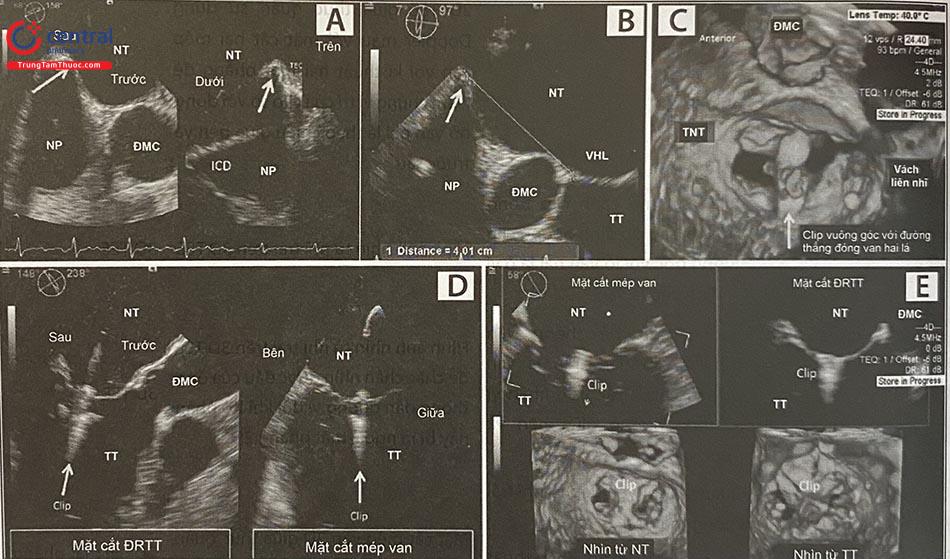
Hình A: Sơ đồ giải phẫu van hai lá. Hình B: Hình ảnh van hai lá trên siêu âm tim 3D qua thực quản, nhìn từ nhĩ trái. Hình C: Hình ảnh sa nhiều lá van trên siêu âm tim 3D qua thực quản (Bệnh Barlow). Hình D: Hình ảnh đóng van không kín ở vùng giữa trong thì tâm thu gây hở van hai lá nhiều
3.1 Hở van hai lá cấp
Hở van hai lá cấp gây quá tải thể tích ở nhĩ trái và thất trái, tăng tiền gánh của thất và thể tích nhát bóp theo định luật Frank-Starling. Thêm vào đó, áp lực thành thất trái thì tâm thu và hậu gánh giảm làm tăng phân số tống máu (EF) thất trái. Tăng cấp tính thể tích từ dòng hở van hai lá khi nhĩ trái giãn nở kém sẽ làm tăng đáng kể áp lực trong nhĩ trái và tĩnh mạch phổi, dẫn đến phù phổi cấp.
3.2 Hở van hai lá mạn tính
Khi bệnh nhân chuyển từ hở van hai lá cấp sang giai đoạn mạn tính, thất trái giãn và thay đổi từ buồng tim nhỏ tăng vận động trong giai đoạn cấp sang buồng tim giãn to. Trong quá trình chuyển đổi này, sự tái cấu trúc các sợi cơ tim dẫn đến phì đại thất trái lệch tâm. Trong giai đoạn còn bù của hở van hai lá mạn, thất trái vẫn có thể duy trì áp lực thành tim bình thường, thể tích nhát bóp cao và cung lượng tim được duy trì bằng việc tăng thể tích thất trái cuối tâm trương. Những thay đổi tạm thời của cấu trúc thất trái làm tiền gánh và hậu gánh trở về bình thường. Trong giai đoạn này, nhĩ trái giãn lớn giúp cải thiện khả năng giãn của nhĩ và giảm áp lực tĩnh mạch phổi.
Tuy nhiên, khi các cơ chế bệnh sinh tiếp tục tiến triển, thường sau vài năm, thất trái sẽ giãn nhiều hơn, hậu gánh tăng và cuối cùng khả năng co bóp của thất trái giảm dẫn đến tình trạng mất bù. Trong khi bệnh nhân thường không có triệu chứng trong giai đoạn còn bù, người ta càng tập trung tìm hiểu thời điểm để can thiệp vào van hai lá sớm để ngăn ngừa giai đoạn mất bù. Các thử nghiệm gần đây về sửa van hai lá qua da lại gợi lại các mối quan tâm về sự tương tác giữa các rối loạn chức năng thất trái và mức độ hở van hai lá, nhằm xác định kiểu hình nhạy hơn với các điều trị can thiệp.
Bảng 41.1. Các đặc điểm dựa trên sinh bệnh học của hở van hai lá
| HỞ VAN HAI LÁ TIÊN PHÁT | HỞ VAN HAI LÁ THỨ PHÁT | |
|---|---|---|
| Tỉ lệ mắc | Cao hơn chủ yếu do sa van | Thấp hơn trong cộng đồng |
| Cơ chế | Bệnh lý của ≥ 1 thành phần của van (lá van, dây chằng, cơ nhú, vòng van). | Rối loạn chức năng thất trái làm thay đổi vị trí cơ nhú, mất đồng bộ thất trái, dẫn đến hạn chế vận động lá van và giãn vòng van. Lá van và cấu trúc dây chằng bình thường (hoặc gần bình thường). |
| Các bệnh lý liên quan | Van thoái hóa myxomatous – bệnh Barlow, bệnh thiếu Fibroelastic. Bệnh van tim do thấp. Viêm nội tâm mạc. Xạ trị, bệnh mô liên kết, do thuốc, Canxi hóa vòng van. | Bệnh cơ tim giãn. Hở van hai lá do thiếu máu cục bộ sau nhồi máu cơ tim. Bệnh cơ tim phì đại. |
| Phân loại cơ chế theo Carpentier* | Type I (thủng lá van hoặc xẻ van). Type II (sa van). Type IIIa (bệnh van tim do thấp, do thuốc, canxi hóa vòng van). | Type I (hở van hai lá do nhĩ, bệnh tim không thiếu máu cục bộ). Type IIIb (bệnh tim thiếu máu cục bộ, rối loạn chức năng thất trái và hạn chế vận động lá van thì tâm thu). |
*Type I: lá van vận động bình thường. Type II: lá van vận động quá mức. Type IIIa: lá van vận động hạn chế thì tâm trương. Type IIIb: lá van vận động hạn chế thì tâm thu.
3.3 Diễn biến tự nhiên của bệnh
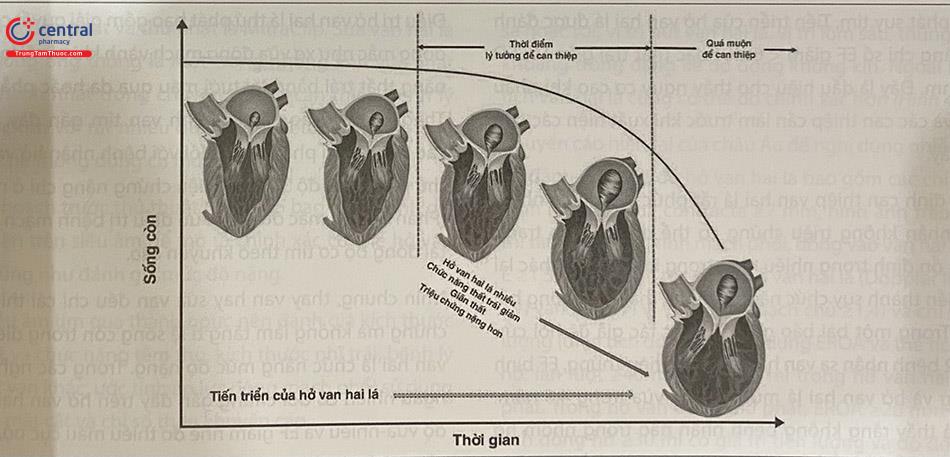
Hở van hai lá nhiều mà không được điều trị có tiên lượng xấu cho dù cơ chế bệnh sinh là gì. Ngoài việc giảm tỉ lệ sống còn, các dữ liệu còn chỉ ra rằng bệnh làm giảm chất lượng cuộc sống và thời gian phụ thuộc tăng lên do gánh nặng của rung nhĩ và suy tim do hở van hai lá nhiều. Các yếu tố làm xấu hơn kết cục của bệnh nhân hở van hai lá nhiều có thể xem ở bảng 41.2. Tiến triển của hở van hai lá đến giai đoạn còn bù mạn tính và mất bù có thể diễn ra trong vài năm đến hàng thập kỷ, phụ thuộc vào mức độ hở van hai lá và các thay đổi về cấu trúc của tim. Khuyến cáo của Hội tim mạch Hoa Kỳ và Trường môn tim mạch Hoa Kỳ (ACC/AHA) về quản lý bệnh nhân có bệnh van tim năm 2014 và 2017 mô tả quá trình diễn biến tự nhiên đến tình trạng nặng hơn bằng cách định nghĩa các giai đoạn đánh giá trên lâm sàng dựa trên kết hợp của tình trạng chức năng của bệnh nhân và các dữ liệu về huyết động học, như trong bảng 41.3.
Giai đoạn còn bù của hở van hai lá được coi là nhẹ khi thất trái không giãn quá mức (LVEDD <60 mm, LVESD <40 mm, LVEDV <110 ml/m2, LVESV <45 ml/m2 và EF >60%), ít gánh nặng về rối loạn nhịp và không có triệu chứng khi gắng sức nhẹ – vừa. Giai đoạn mất bù dựa trên sự xuất hiện các triệu chứng suy tim và các chỉ số của thất trái không còn tối ưu do mất cơ chế bù (LVEDD >70 mm, LVESD >47 mm, LVEDV >160 ml/m2, LVEDV >60 ml/m2, LVEF <50%). Giai đoạn chuyển đổi giữa hai kiểu hình bệnh này vẫn chưa được tìm hiểu rõ ràng với những thay đổi về cấu trúc ở mức trung bình và các triệu chứng khác khau nhưng đây được coi là giai đoạn tập trung để tìm ra thời điểm lý tưởng để can thiệp vào van hai lá giúp làm chậm tiến triển của hở van hai lá cũng như tái cấu trúc thất trái (Hình 41.3).
Bảng 41.2. Các yếu tố liên quan đến kết cục xấu của hở van hai lá vừa – nhiều
– Xuất hiện các triệu chứng suy tim (Tỉ lệ sống còn thấp hơn ở nhóm NYHA III/IV). – Rối loạn chức năng thất phải*. – Hở van ba lá nhiều*. – Cơ chế bệnh sinh do hở chức năng. – Các chỉ số trên siêu âm tim: • Diện tích hở van hiệu dụng ≥40 mm2 (Hở van hai lá tiên phát) • Diện tích hở van hiệu dụng ≥20 mm2 (Hở van hai lá thứ phát) • LVEF <60% (Rối loạn chức năng tâm thu thất trái) * Khi đánh giá với hở van hai lá chức năng |
Bảng 41.3. Các giai đoạn hở van hai lá tiên phát mạn tính và thứ phát
| GIAI ĐOẠN | ĐỊNH NGHĨA | HUYẾT ĐỘNG HỌC CỦA VAN | TRIỆU CHỨNG |
|---|---|---|---|
| A | Có nguy cơ hở van hai lá | – Không có dòng hở hoặc dòng hở nhỏ ở trung tâm có diện tích < 20% nhĩ trái – VC < 0,3 cm | Không có dòng hở hoặc dòng hở nhỏ ở trung tâm có diện tích < 20% nhĩ trái |
| B | Hở van hai lá tiến triển | – Dòng hở ở trung tâm có diện tích 20-40% nhĩ trái hoặc dòng hở lệch tâm thì tâm thu muộn – Rvol < 60 ml – RF < 50% – ERO < 0,4 cm2 – Phân độ 1 hoặc 2+ trên hình ảnh chụp mạch | VC < 0,3 cm |
| C | Hở van hai lá nhiều không triệu chứng | – Dòng hở ở trung tâm có diện tích 40% nhĩ trái hoặc dòng hở lệch tâm toàn thì tâm thu – Rvol ≥ 60 ml – RF ≥ 50% – ERO ≥ 0,4 cm2 – Phân độ 3 hoặc 4+ trên hình ảnh chụp mạch | Không |
| D | Hở van hai lá nhiều có triệu chứng | – Dòng hở ở trung tâm có diện tích 40% nhĩ trái hoặc dòng hở lệch tâm toàn thì tâm thu – Rvol ≥ 60 ml – RF ≥ 50% – ERO ≥ 0,4 cm2 – Phân độ 3 hoặc 4+ trên hình ảnh chụp mạch | Giảm khả năng gắng sức khó thở khi gắng sức |
VC: Vena Contracta; RVol: thể tích dòng hở; RF: phân số dòng hở; ERO: diện tích dòng hở hiệu dụng
4 Quản lý bệnh nhân hở van hai lá
Để hiểu được cách lựa chọn bệnh nhân, chúng ta nên hiểu rõ các giai đoạn của hở van hai lá và mối liên quan đến mức độ nặng của bệnh. Giai đoạn A và B đại diện cho tình trạng bệnh nhẹ – vừa tức là bệnh nhân cần được theo dõi và khám định kỳ trong khi giai đoạn C và D đại diện cho hở van hai lá nhiều không có hoặc có triệu chứng. Phân loại nhỏ của giai đoạn C phụ thuộc vào chức năng và kích thước thất trái (C1 – LVEF > 60% và LVESD ≤ 40 mm; C2- LVEF ≤ 60% và LVESD > 40 mm). Hở van hai lá nhiều mạn tính (tiên phát hoặc thứ phát) được định nghĩa là khi có sự kết hợp của các tiêu chuẩn trên siêu âm như sau: dòng hở trung tâm >40% nhĩ trái hoặc dòng chảy lệch tâm toàn tâm thu, vena contracta ≥ 0,7 cm, thể tích dòng hở ≥ 60 ml, phân số dòng hở ≥ 50% và diện tích dòng hở hiệu dụng (EROA) ≥ 0,4 cm2. Phân loại tương ứng trên chụp mạch của hở van hai lá nhiều là 3-4+.
Phương pháp điều trị hiệu quả duy nhất đối với hở van hai lá tiên phát là sửa hoặc thay van. Dựa trên khuyến cáo của AHA/ACC năm 2017 cập nhật của năm 2014, quyết định can thiệp đối với hở van hai lá tiên phát mạn tính phụ thuộc vào mức độ nặng, triệu chứng, kích thước và chức năng thất trái, áp lực động mạch phổi khi nghỉ và khi gắng sức, rung nhĩ mới xuất hiện, khả năng sửa van thành công và lựa chọn của bệnh nhân. Các can thiệp đối với hở van hai lá chức năng mạn tính mức độ nhiều chưa được nghiên cứu nhiều, do đó chưa có các khuyến cáo mạnh mẽ về phẫu thuật van hai lá. Các khuyến cáo vẫn chưa cập nhật được các dữ liệu gần đây về sử dụng các liệu pháp can thiệp qua da như MitraClip trong hở van hai lá chức năng có thể cải thiện kết cục của một số bệnh nhân nhất định có hở van hai lá chức năng mức độ nhiều.
4.1 Quản lý hở van hai lá cấp
Phẫu thuật cấp cứu được khuyến cáo cho tất cả các bệnh nhân hở van hai lá cấp mức độ nhiều có triệu chứng. Đồng thời cũng có thể sử dụng các thuốc giãn mạch hoặc các dụng cụ qua da như bơm bóng đối xung động mạch chủ hoặc Impella để tạm thời ổn định tình trạng bệnh nhân trong lúc chờ phẫu thuật. Trong bệnh cảnh cấp của các bệnh nhân này, sửa van được ưu tiên hơn thay van, tuy nhiên khả năng sửa van thường bị hạn chế do có nhiều tình trạng bệnh tác động lên bộ máy van hai lá. Vai trò của sửa van qua đường ống thông đối với hở van hai lá cấp sẽ được bàn luận phần sau.
4.2 Quản lý hở van hai lá mạn tính
4.2.1 Hở van hai lá tiên phát
Các thuốc điều trị có rất ít hoặc không có tác dụng trong điều trị hở van hai lá tiên phát, tuy nhiên, một số thuốc vẫn được khuyến cáo sử dụng trong trường hợp có tăng huyết áp hoặc suy tim EF giảm. Phẫu thuật là lựa chọn chính để điều trị hở van hai lá tiên phát. Can thiệp khi hở van hai lá đã mất bù thường kèm với tỉ lệ tử vong và mắc bệnh cao do tái phát suy tim. Tiến triển của hở van hai lá được đánh dấu bằng chỉ số EF giảm < 60% hoặc thất trái giãn LVESD 40 mm. Đây là dấu hiệu cho thấy nguy cơ cao khi phẫu thuật và các can thiệp cần làm trước khi xuất hiện các dấu hiệu này.
Quyết định can thiệp van hai lá rất phức tạp do có nhiều bệnh nhân không triệu chứng có thể duy trì tình trạng này và ổn định trong nhiều năm trong khi một số khác lại tiến triển thành suy chức năng tâm thu thất trái không hồi phục. Trong một bài báo gần đây, các tác giả đã hồi cứu trên 82 bệnh nhân sa van hai lá không triệu chứng, EF bình thường và hở van hai lá mức độ nhẹ-vừa trong 4,5 năm. Tác giả thấy rằng không bệnh nhân nào trong nhóm hở nhẹ tiến triển thành hở nhiều, trong khi 50% hở vừa nặng lên thành hở nhiều. Không một chỉ số lâm sàng hay siêu âm nào có thể dự báo điều này ngoài đường kính vòng van 39,6 mm (độ nhạy 100% và độ đặc hiệu 63,8). Vẫn còn nhiều tranh cãi về vai trò của các biến trên lâm sàng như giới nam, tuổi cao, rung nhĩ, cân nặng lớn và tăng huyết áp hay chỉ số trên siêu âm như van dày trong dự báo tiến triển của bệnh. Tóm lại, không có một yếu tố nào có thể dự báo rõ ràng bệnh nhân sẽ tiến triển nặng hơn. Do đó, phương thức quản lý tiêu chuẩn là phải là theo dõi định kỳ bằng khám lâm sàng và siêu âm kết hợp với thuốc điều trị nội khoa.
So với thay van thì sửa van được yêu thích hơn vì có tỉ lệ tử vong trong phẫu thuật thấp, tỉ lệ sống còn dài hạn cao hơn và ít biến chứng liên quan đến van như chảy máu, viêm nội tâm mạc. Việc sửa van sớm cho thấy hiệu quả tương tự như với nhóm chứng có cùng độ tuổi, giúp mở rộng lợi ích cho cả các bệnh nhân không có hoặc ít triệu chứng thích hợp với sửa van và có nguy cơ phẫu thuật thấp.
4.2.2 Hở van hai lá thứ phát
Thuốc điều trị kết hợp ức chế thụ thể Angiotensin Neprilysin, ức chế men chuyển, ức chế thụ thể angiotensin, chẹn beta, đối kháng thụ thể Mineralocorticoid và lợi tiểu được khuyến cáo trong quản lý suy tim EF giảm và hở van hai lá nhiều. Điều trị tái đồng bộ cơ tim cho một số bệnh nhân chọn rối loạn chức năng thất trái và rối loạn đồng bộ thất biểu hiện bằng phức hợp QRS giãn rộng trên điện tâm đồ giúp cải thiện hở van hai lá thứ phát. Điều trị tái đồng bộ cơ tim giảm đáng kể LVESD, LVEDD và mức độ hở van hai lá ở các bệnh nhân có đáp ứng.
Điều trị hở van hai lá thứ phát bao gồm giải quyết các bệnh đồng mắc như xơ vữa động mạch vành khi có rối loạn chức năng thất trái bằng tái tưới máu qua da hoặc phẫu thuật. Theo khuyến cáo về các bệnh van tim gần đây, khuyến cáo về điều trị phẫu thuật đối với bệnh nhân hở van hai lá thứ phát mức độ 3-4+ có triệu chứng nặng chỉ ở mức yếu (Phân độ IIb), mặc dù đã tối ưu điều trị bệnh mạch vành và tái đồng bộ cơ tim theo khuyến cáo.
Nhìn chung, thay van hay sửa van đều chỉ cải thiện triệu chứng mà không làm tăng tỉ lệ sống còn trong điều trị hở van hai lá chức năng mức độ nặng. Trong các nghiên cứu ngẫu nhiên có đối chứng gần đây trên hở van hai lá mức độ vừa-nhiều và EF giảm nhẹ do thiếu máu cục bộ, điều trị sửa van hoặc thay dây chằng van hai lá không mang lại lợi ích dài hạn đối với kết cục của bệnh nhân cũng như không có bằng chứng làm đảo ngược quá trình tái cấu trúc thất trái. Trong hai năm, phân tích dưới nhóm đã chứng minh được hiệu quả đảo ngược quá trình tái cấu trúc rõ nhất ở nhóm bệnh nhân sửa van nhưng không tái phát hở van hai lá.
Ngược lại, điều trị bằng MitraClip ở một nhóm bệnh nhân hở van hai lá thứ phát không tương xứng mức độ nhiều giúp cải thiện kết cục bao gồm tỉ lệ sống còn. Quản lý hở van hai lá chức năng nhĩ vẫn chưa được nghiên cứu đầy đủ và cơ chế tiên phát của nó có liên quan đến tái cấu trúc nhĩ do rung nhĩ. Các biện pháp trực tiếp làm giảm hoặc đảo ngược quá trình giãn tâm nhĩ trong rung nhĩ như kiểm soát nhịp hoặc đốt lạnh có thể có lợi nhưng mức độ vượt trội của các phương pháp này so với kiểm soát tần số trong đảo ngược tái cấu trúc tâm nhĩ vẫn chưa được nghiên cứu.
4.3 Lựa chọn bệnh nhân cho sửa van hai lá qua đường ống thông
Sửa van hai lá qua da là một cách tiếp cận điều trị ít xâm lấn ở một số bệnh nhân hở van hai lá đáng kể có triệu chứng. Khuyến cáo có một đội bác sĩ tim đa chuyên ngành (bao gồm bác sĩ tim mạch chung, bác sĩ can thiệp tim mạch, phẫu thuật viên tim mạch, chuyên gia về chẩn đoán hình ảnh, chuyên gia về suy tim và bác sĩ gây mê tim) để đánh giá và chăm sóc trực tiếp cho các ứng cử viên tiềm năng cho sửa van hai lá qua da. Có nhiều dụng cụ sửa van hai lá qua đường ống thông theo các cơ chế khác nhau đang được phát triển. Tuy vậy, hiện mới có dụng cụ sửa van bằng cơ chế kẹp hai bờ van (Mitra Clip) được ứng dụng rộng rãi trên lâm sàng và đã được FDA công nhận trong điều trị hở van hai lá tiên phát và thứ phát là MitraClip. Sửa van hai lá qua đường ống thông là một trong những lĩnh vực phát triển nhanh nhất trong chuyên ngành can thiệp bệnh lý cấu trúc tim với rất nhiều dữ liệu về hiệu quả và an toàn của các hệ thống dụng cụ mới.
Lập kế hoạch trước thủ thuật MitraClip bao gồm đánh giá toàn diện trên siêu âm để mô tả chính xác cơ chế hở van hai lá cũng như đánh giá mức độ nặng.
Trên siêu âm tim qua thành ngực nên đánh giá kích thước hai thất và chức năng tâm thu, kích thước nhĩ trái, bệnh lý của các van khác, ước tính áp lực động mạch phổi sử dụng các các mặt cắt và chỉ số theo khuyến cáo.
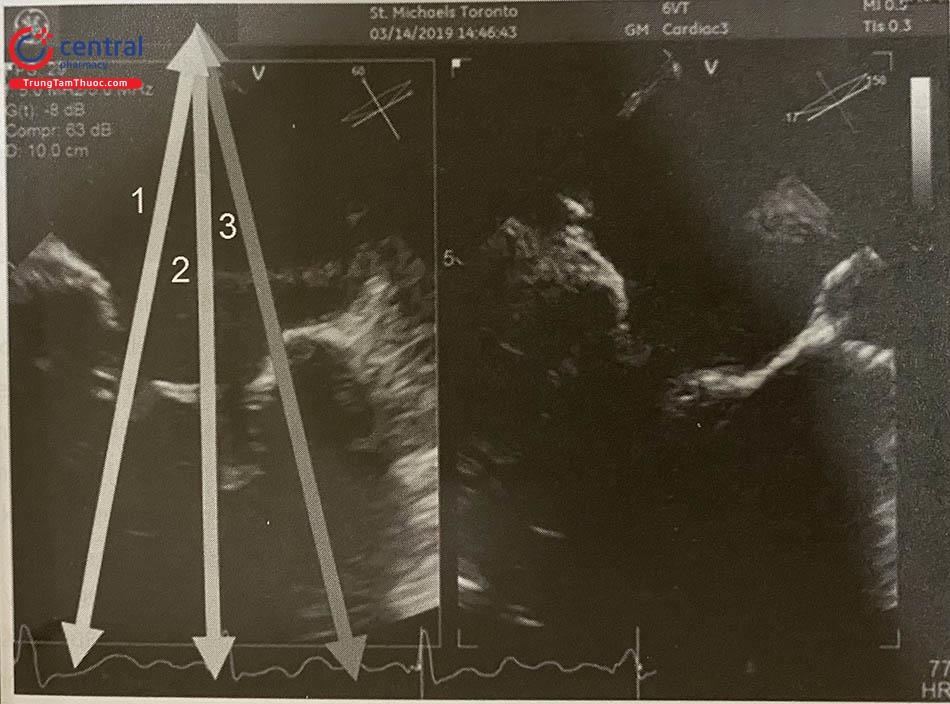
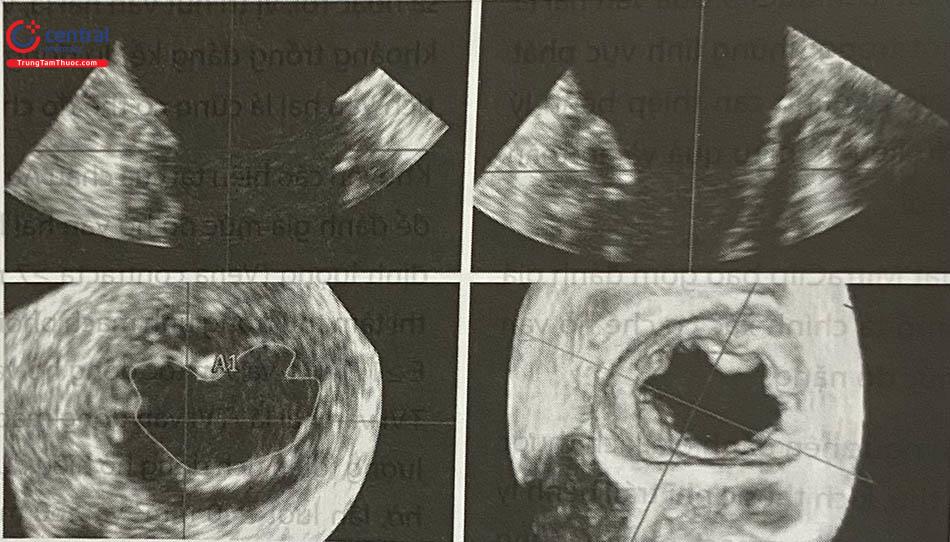
Siêu âm tim qua thực quản là công cụ chính để sàng lọc can thiệp hở van hai lá do nó có vai trò quan trọng trong hướng dẫn trong can thiệp. Cần đánh giá cẩn thận cơ chế hở van hai lá và định lượng mức độ hở van hai lá. Ngoài các mặt cắt tiêu chuẩn trên 2D, sử dụng các mặt cắt khác đặc biệt có ích để xác định các bất thường về giải phẫu. Sử dụng nhiều mặt cắt cho phép có được cái hình một cách hệ thống về tất cả các vùng của van hai lá, từ phía trong đến phía bên (Hình 41.4). Có thể sử dụng 3D để nhìn van hai lá từ phía nhĩ (phía nhìn của phẫu thuật viên) và các cấu trúc liền kề. Từ đó có thể dễ dàng thấy các vùng lá van sa hoặc rơi, vị trí nứt van hai lá, vị trí lõm sâu, thủng van và khoảng trống đáng kể do đóng không kín. Ngoài ra, diện tích van hai lá cũng có thể đo chính xác hơn (Hình 41.5).
Khuyến cáo hiện tại của châu Âu đề nghị dùng nhiều chỉ số để đánh giá mức độ hở van hai lá bao gồm các chỉ số bán định lượng (Vena contracta ≥7 mm, hình ảnh trào ngược thì tâm thu trong tĩnh mạch phổi, dòng vào van hai lá sóng E ≥1,5 m/s, và vận tốc dòng hở van hai lá (Doppler liên tục) TVI van hai lá /TVI van động mạch chủ ≥1,4) và chỉ số định lượng (diện tích dòng hở hiệu dụng EROA và thể tích dòng hở, lần lượt ≥40 mm2 và ≥60 ml trong hở van hai lá tiên phát. Trong hở van hai lá thứ phát, EROA ≥20 mm2 và thể tích dòng hở ≥30 ml có giá trị tiên lượng và do đó có thể xác định hở van hai lá nhiều trong khuyến cáo của châu Âu nhưng trong khuyến cáo của Hiệp hội siêu âm Hoa Kỳ thì không). Định lượng mức độ hở van hai lá cần được tính bằng phương pháp PISA trên 2D và 3D hoặc ưu tiên diện vena contracta trên 3D.
Nhóm Heart team cần xem xét cả siêu âm tim qua thành ngực và qua thực quản để xác định bệnh nhân đủ điều kiện thực hiện thủ thuật cũng như xác định đường vào. Cần thống nhất về vị trí chính xác để thả dụng cụ, số dụng cụ, chiến lược điều trị, đặc biệt là những trường hợp có giải phẫu khó như trong Bảng 41.4.
Bảng 41.4. Những đặc điểm giải phẫu cần đánh giá để sửa van hai lá qua da
| THUẬN LỢI | KHÔNG THUẬN LỢI/CHỐNG CHỈ ĐỊNH |
|---|---|
– Hở van hai lá vừa-nhiều hoặc nhiều – Tổn thương ở A2-P2 – Độ rộng sa van < 15 mm – Khoảng trống rơi van < 10 mm – Diện tích van hai lá > 4 cm2 – Chiều dài di động của lá sau ≥ 7 mm | – Tổn thương mép van – Lá sau ngắn (< 5 mm) – Diện tích van hai lá < 3,5 cm2 – Canxi nặng vùng kẹp lá van – Thủng lá van – hẹp van hai lá với chênh áp trung bình ≥ 5mm tại thời điểm bắt đầu – Viêm nội tâm mạc đang hoạt động hoặc bệnh tim do thấp |
Các chống chỉ định của MitraClip gồm không dung nạp liệu pháp chống đông trong thủ thuật và các thuốc kháng tiểu cầu sau thủ thuật, viêm nội tâm mạc trên van hai lá đang hoạt động, bệnh van hai lá do thấp, hẹp van hai lá do mọi nguyên nhân và huyết khối trong tĩnh mạch đùi dùng để mở đường vào, tĩnh mạch chủ dưới hoặc các cấu trúc ngoài tim ở bên trái.
Khuyến cáo cập nhật 2020 của Hội Tim mạch Hoa Kỳ về chỉ định can thiệp sửa van hai lá qua đường ống thông:
| LOẠI | BẰNG CHỨNG | KHUYẾN CÁO |
|---|---|---|
| IIa | B-NR | Ở bệnh nhân Hở van hai lá nguyên phát có triệu chứng nặng (NYHA III hoặc IV) và nguy cơ phẫu thuật cao, kẹp van qua đường ống thông là biện pháp được khuyến cáo nếu giải phẫu van phù hợp cho thủ thuật và kỳ vọng sống trên 1 năm. |
| IIa | B-R | Ở bệnh nhân Hở hai lá thứ phát có giảm chức năng thất trái (LVEF < 50%) có triệu chứng dai dẳng (NYHA II, III hoặc IV) trong khi vẫn được điều trị nội khoa tối ưu suy tim, kẹp van qua đường ống thông được khuyến cáo ở những bệnh nhân có giải phẫu phù hợp trên siêu âm tim qua thực quản, LVEF giữa 20% và 50%, đường kính thất trái cuối thì tâm thu (LVESD) ≤ 70 mm, và áp lực động mạch phổi ≤70 mmHg. |
Tháng 4/2022, Khuyến cáo cập nhật về suy tim của hội Tim mạch Hoa Kỳ cũng đã đưa ra khuyến cáo về can thiệp sửa van hai lá bằng kỹ thuật kẹp hai bờ van ở bệnh nhân suy tim có hở hai lá thứ phát:
| IIa | B-R | Ở bệnh nhân suy tim mức độ C trở lên có kèm theo hở hai lá thứ phát. Sửa van hai lá qua đường ống thông bằng kỹ thuật kẹp hai bờ van được khuyến cáo trên những bệnh nhân có phù hợp (mức độ khó thở NYHA II-III, hở nhiều van hai lá do thứ phát, LVEF giữa 20% và 50%, đường kính thất trái cuối thì tâm thu (LVESD) ≤ 70 mm, và áp lực động mạch phổi ≤ 70 mmHg) |
5 Mô tả dụng cụ sửa van hai lá qua đường ống thông
Dụng cụ kẹp hai bờ van hai lá (MitraClip của hãng Abbott, Hoa Kỳ) là dạng kẹp (clip), có hai cánh tay và hoạt động bằng cách kẹp gần các bờ của các vùng của lá van trước và sau van hai lá (Hình 41.6) ở những bệnh nhân bị hở van hai lá nhiều. Đây là một kĩ thuật dựa trên ống thông, được thiết kế dựa trên nguyên lý của phẫu thuật tim mở của Alfieri khi khâu dính giữa hai bờ van để làm giảm mức độ hở van. MitraClip đã được CE-Mark chấp nhận ở châu Âu năm 2008 và được FDA chấp nhận năm 2013 cho điều trị hở van hai lá tiên phát và năm 2019 cho hở van hai lá thứ phát.
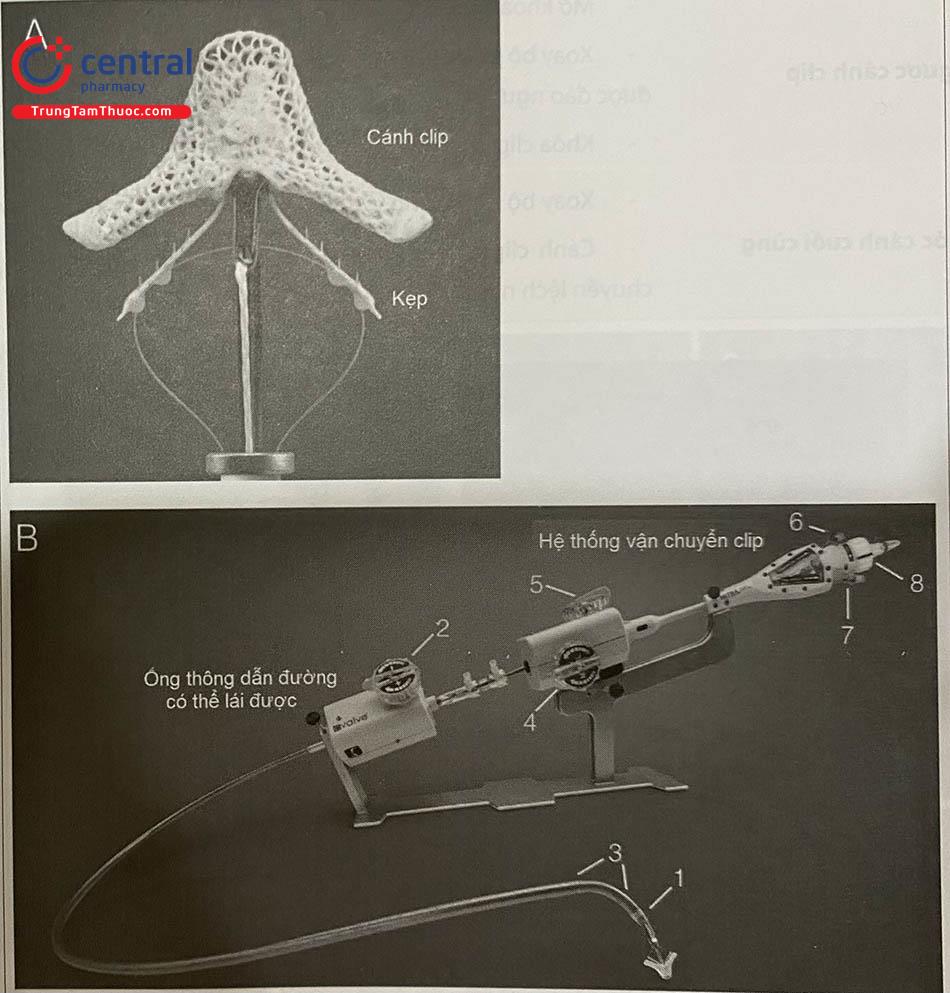
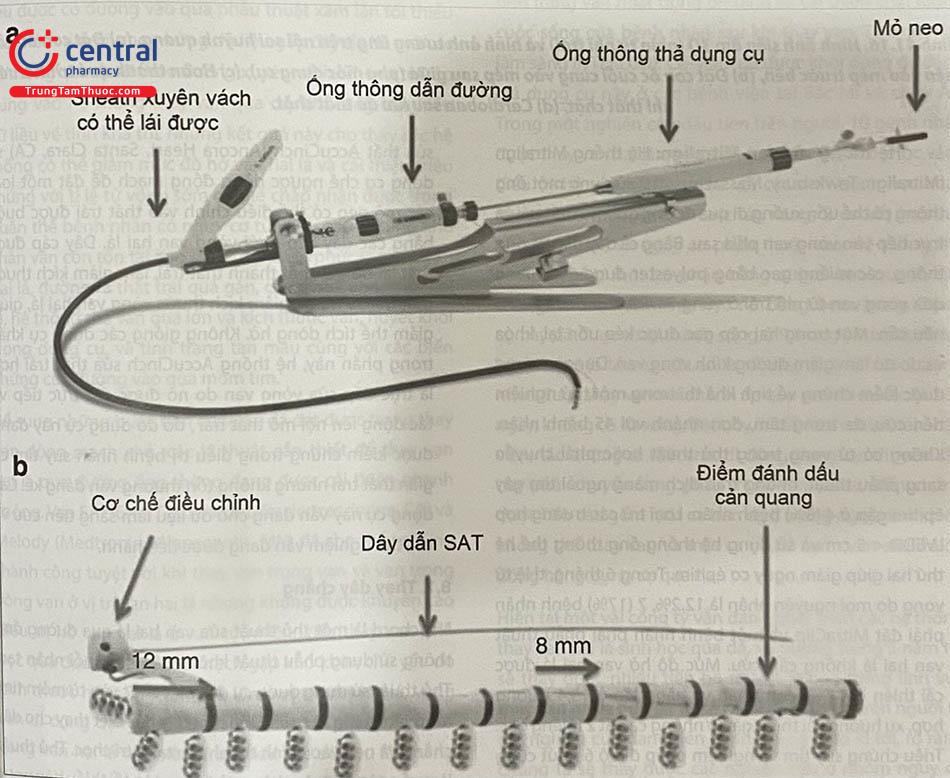
Hệ thống MitraClip là một dụng cụ dựa trên đường ống thông được thiết kế để sửa van hai lá kiểu bờ-bờ khi tim vẫn đang đập và thay thế cho phương pháp phẫu thuật thông thường. MitraClip sử dụng một hệ thống ống thông ba trục gồm 2 phần khác nhau, là phần ống thông dẫn đường có thể lái được (steerable guide catheter – SGC) và hệ thống vận chuyển clip (clip delivery system – CDS). CDS gồm ba bộ phận chính: tay cầm ống thông vận chuyển dụng cụ, tay cầm có thể lái được, và dụng cụ MitraClip. SGC có kích thước đầu gần là 24 Fr và đầu xa là 22 Fr và có kèm theo một bộ phận que nong dạng ống nhọn có thể hiện trên hình ảnh siêu âm. Bộ phận nong cho phép đưa SGC vào tĩnh mạch đùi và nhĩ trái (qua chọc vách liên nhĩ). Một núm ở đầu gần ống thông dẫn đường cho phép uốn cong đầu xa. Khi đã định vị bằng SGC, CDS sẽ được sử dụng để đưa MitraClip vào và thực hiện định hướng trong không gian để xác định vị trí chính xác của dụng cụ ở giữa các lá van. MitraClip gắn vào đầu xa của CDS và có 2 núm để điều chỉnh theo hướng trong-bên và trước-sau. MitraClip là một dụng cụ làm bằng coban/chromium với 2 cánh, bọc bằng lớp vải Polyester và gắn vào đầu ống thông vận chuyển dùng một lần. Phần bên trong của clip có hai kẹp di động gắn liền kề với mỗi cánh để đảm bảo giữ chặt lá van khi “kẹp” được lá van khi đóng các cánh. Clip có hệ thống khóa để giữ trạng thái đóng clip. Mở, đóng, khóa và tháo clip đều được điều khiển bằng hệ thống tay cầm ống thông vận chuyển được đặt khéo léo trên một bộ phận hỗ trợ bên ngoài gọi là “bộ phận ổn định” đặt bên ngoài bệnh nhân.
Ba bộ phận của CDS cho phép MitraClip đóng/mở và khóa/ mở khóa gọi là bộ phận định vị cánh, cần khóa và cần kẹp. Bộ phận định vị cánh là một nút điều khiển cho phép mở hoặc đóng các cánh của clip khi quay dọc theo hướng cụ thể. Cần kẹp có tác dụng nâng cao (ở vị trí thẳng đứng) và hoặc hạ thấp (nếu đã hoàn toàn xoay về phía tay cầm ống thông) các kẹp qua đường kẹp trong clip. Cần khóa giúp mở khóa các cơ chế cho phép mở các cánh của clip (ở vị trí thẳng đứng) hoặc đóng (khi đã xoay hoàn toàn về phía tay cầm ống thông). Bảng 41.5 tóm tắt các thao tác chính được thực hiện với CDS trong thủ thuật để đạt được góc cánh mong muốn. Tóm lại, mở các cánh clip bằng cách xoay bộ phận định vị cánh theo chiều mở khi cần khóa đang ở vị trí thẳng đứng (vị trí mở khóa), khi xoay bộ phận định vị cánh theo chiều mở với cần khóa đã xoay hoàn toàn sẽ khiến ống thông vận chuyển lệch nhẹ gọi là “góc cánh clip”.
Cơ chế điều khiển thêm (nút A/P (trước/sau), M/L (trong/ bên) và +/-) cho phép di chuyển đầu clip trong không gian trong thủ thuật.
Cuối cùng, bộ phận ổn định và miếng Silicon cũng là những phụ kiện có ích cho thủ thuật. Bộ phận ổn định hỗ trợ và ổn định SGC và CDS, trong khi miếng silicon giúp tránh được sự di chuyển của bộ phận ổn định-SGC-CDS và hỗ trợ toàn bộ hệ thống trong suốt thủ thuật.
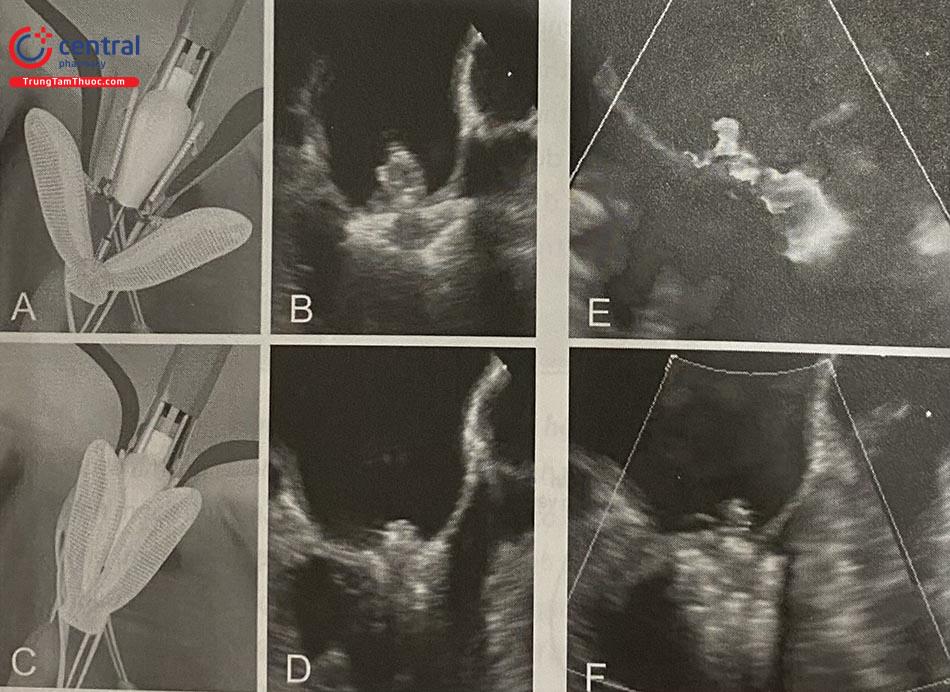
Gần đây, các kỹ thuật mới đã đưa ra dụng cụ MitraClip NT. So với các phiên bản trước, MitraClip NT có những thay đổi về chất liệu và hình thái để tạo thuận lợi cho việc lái dụng cụ và thao tác trong không gian. Một thay đổi đáng chú ý là hình thái và chức năng của bộ phận kẹp trong clip. Thay đổi về chất liệu kẹp (từ elgiloy sang nitinol) làm tăng góc thả kẹp (từ 850 lên >1200), tạo điều kiện cho việc tóm các lá van hiệu quả và bền hơn.
4.2.2.1 Dụng cụ mới nhất: MitraClip XTR
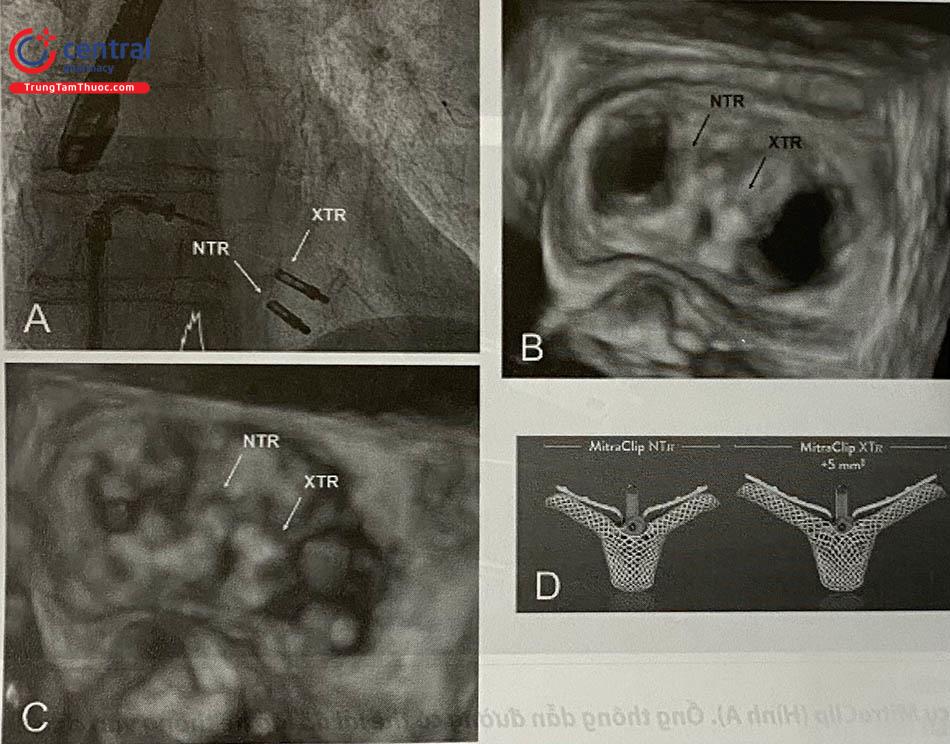
Hiện nay đã có phiên bản mới của clip là MitraClip XTR. Dụng cụ này tương tự như thế hệ đầu tiên và phiên bản NT là gồm một ống thông dẫn đường có thể lái 24 Fr và một hệ thống vận chuyển clip có thể lái (CDS). MitraClip XRT có độ rộng của diện kẹp van dài hơn 5 mm do có cánh dài hơn (22 so với 17 mm của NTR). Vùng chuyển tiếp giữa sheath vận chuyển và CDS đã được củng cố thêm để cải thiện tính ổn định khi xoay CDS. Phần tay cầm có thể lái cũng tham gia nhiều hơn vào thao tác xoay nút M. Chiều dài hiệu dụng của hệ thống tăng thêm 1,5 cm và thay đổi cơ chế và chất liệu của khóa cho phép quá trình hoạt động của hệ thống ở vị trí “mở khóa”. Cuối cùng phần kẹp bằng Elgiloy được thay bằng Nitinol cho phép kẹp sâu hơn và tóm các lá van nhanh hơn. Cuối cùng, MitraClip XTR cho phép việc tóm lá van dễ hơn và nhanh hơn, giảm số clip cần dùng và mở rộng chỉ định điều trị cho các bệnh nhân có đặc điểm giải phẫu ít thuận lợi hơn.
Mặt khác, khả năng kẹp được nhiều mô hơn giúp tăng thêm áp lực lên các lá van tập trung ở đầu các cánh của clip. Điều này có thể gây tổn thương cho lá van, đặc biệt ở bệnh nhân có lá van vôi hóa nhiều, dễ rách hoặc mỏng. Hơn nữa, do tăng chiều dài cánh clip, nguy cơ bị kẹt ở hệ thống dưới van cũng cao hơn, đặc biệt khi điều trị tổn thương ở mép van. Theo một nghiên cứu đa trung tâm mới xuất bản gần đây với 107 bệnh nhân điều trị bằng MitraClip XTR, tỉ lệ thủ thuật thành công với mức độ hở van hai lá ≤2+ là 93% và ≤1+ là 77%. Tuy nhiên có 4 bệnh nhân bị tổn thương van đòi hỏi phải phẫu thuật sửa van trong cùng một bệnh viện. Do đó, việc sử dụng hệ thống XTR cần được đánh giá dựa trên giải phẫu của từng cá thể riêng biệt hơn là sử dụng như một chiến lược mặc định. Mặc dù cần đánh giá thêm nhưng việc kết hợp các clip có kích thước khác nhau cũng là một lựa chọn điều trị có giá trị ở bệnh nhân có diện tích van/chênh áp qua van ở ngưỡng ranh giới (Hình 41.7). Hi vọng trong tương lai các thủ thuật với MitraClip cho phép kẹp riêng từng lá van.
Bảng 41.5. Các thao tác chính trong quá trình kẹp clip
| VỊ TRÍ CÁNH CLIP MONG MUỐN | THAO TÁC |
|---|---|
| Mở cánh clip |
|
Đóng cánh clip |
|
| Đảo ngược cánh clip |
|
| Xác định góc cánh cuối cùng |
|
6 Quy trình kỹ thuật Mitraclip
Các thủ thuật qua da có thể thực hiện ở bệnh nhân được gây mê toàn thân dưới hướng dẫn của siêu âm tim qua thành ngực, qua thực quản và chụp mạch trong phòng can thiệp tim. Thủ thuật MitraClip bao gồm các bước sau khi chọc mạch qua tĩnh mạch đùi (Hình 41.8):
Bước 1: Chọc vách – trong hở van hai lá tiên phát, diện chọc mạch cần ở trên vòng van hai lá khoảng 5 cm để cho phép điều chỉnh ống thông và clip. Trong hở van hai lá chức năng, diện chọc mạch cần ở phía sau và gần với mặt phẳng vòng van (khoảng 3,5 cm phía trên mặt phẳng vòng van) vì di động hạn chế của lá van khi đóng van nằm dưới mặt phẳng vòng van.
Bước 2: Đưa ống thông dẫn đường và hệ thống thả van vào nhĩ trái – sử dụng một ống thông cứng đưa vào nhĩ trái và đổi các dụng cụ xuyên vách thành ống thông dẫn đường. Sau đó, đưa hệ thống thả van vào ống thông dẫn đường và đưa clip vào buồng nhĩ trái.
Bước 3: Định vị MitraClip vào thất trái, ngay dưới lá van hai lá – điều chỉnh hệ thống thả van cho đến khi nó ở ngay trên gốc của dòng hở, mở hai cánh sao cho nó vuông góc với diện đóng van và đưa về phía buồng thất ngay dưới bờ van.
Bước 4: Kẹp các bờ van, kiểm tra lại vị trí và thả clip – đóng clip đến 1200 và kéo lại cho đến khi lá van nằm hoàn toàn trong cánh clip. Đóng clip dần dần trong khi tiếp tục đánh giá vị trí, mức độ kẹp lá van và mức độ hở van. Trước khi quyết định tháo để thả clip, cần đánh giá lại và định vị lại clip cho được vị trí tối ưu nhất. Sau khi chắc chắn đã giảm được đáng kể mức độ hở van, thả clip hoàn toàn khỏi hệ thống thả van và rút các ống thông ra.
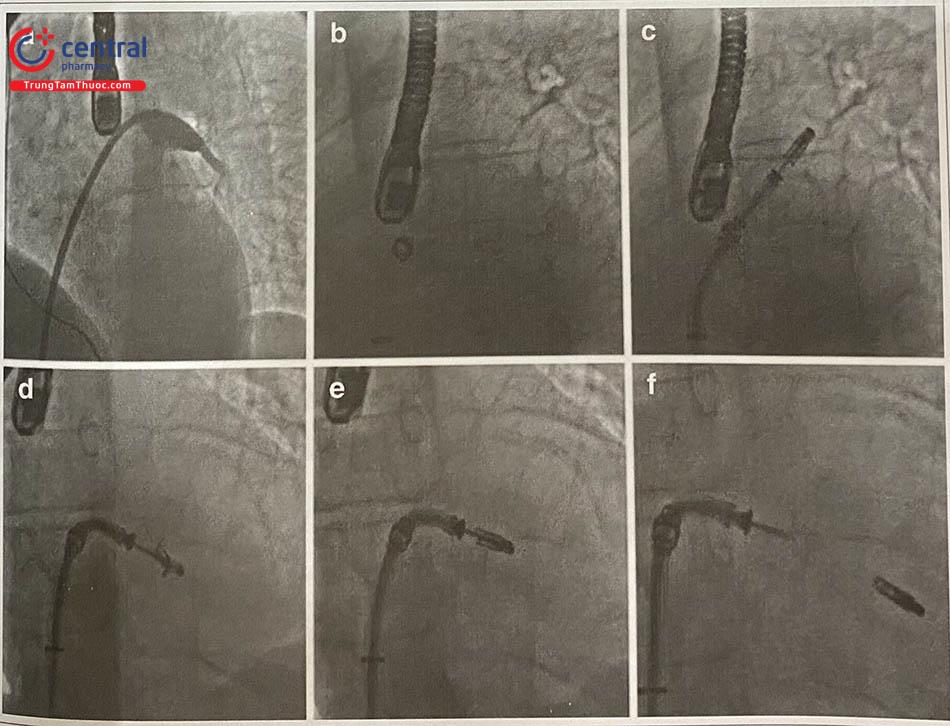
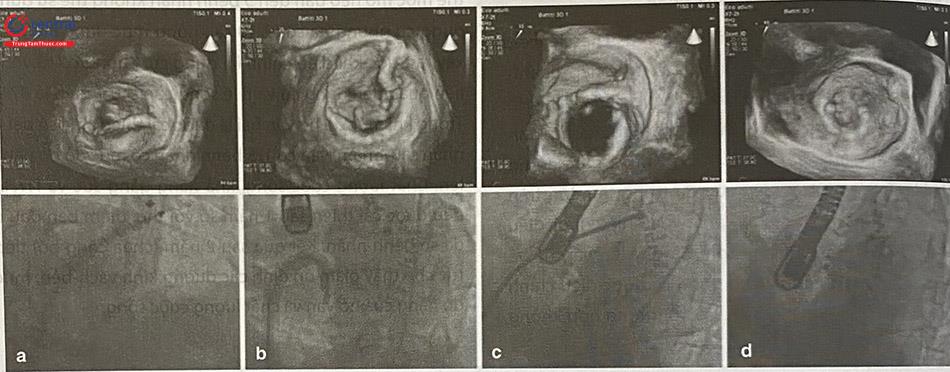
Hình (A): Khi sheath 8Fr vào nhĩ trái, tiếp tục đưa một ống thông vào tĩnh mạch phổi và một dây dẫn đường cứng được đặt trong nhĩ trái sau khi đã chụp tĩnh mạch. Hình (B): Ống thống dẫn đường có thể lái (SGC) 24 Fr được đưa vào nhĩ trái, và nong thật chậm và cẩn thận để tránh bọt khí. Hình (C): Hệ thống vận chuyển clip (CDS) được đưa vào nhĩ trái, và đầu xa được điều khiển trong tâm nhĩ sao cho hệ thống nằm ở trung tâm và vuông góc với đường thẳng tạo bởi diện đóng van của van hai lá. Hình (D): Khi hệ thống đã thẳng hàng, clip với hai cánh mở được đưa vào thất trái, và kẹp các lá van dưới hướng dẫn của siêu âm tim qua thực quản. Hình (E): Khi đã tạo được hai lỗ van, sử dụng siêu âm để xác nhận mức độ giảm của hở van hai lá và hai lá van đã được kẹp tối ưu và ổn định, sau đó đóng clip, khóa và thả clip, rút SGC và CDS ra (Hình F).
Trong trường hợp vẫn còn hở van tồn lưu, có thể sử dụng thêm 1 clip nữa ở vị trí dòng hở nhưng cần đảm bảo không có tình trạng hẹp van hai lá mới xuất hiện. Toàn bộ thủ thuật được thực hiện với Heparin đường tĩnh mạch, cần liên tục kiểm tra thời gian đông máu hoạt hóa (mục tiêu > 250s).
Sau khi kẹp clip, bệnh nhân cần uống Aspirin 100 – 325 mg/ ngày trong 6-12 tháng và Clopidogrel 75mg hàng ngày trong 30 ngày. Các khuyến cáo này được dựa trên thời gian ước lượng đến khi hình thành lớp nội mô trên dụng cụ.
Bảng 41.6. Vai trò của siêu âm tim trong hướng dẫn thủ thuật can thiệp MitraClip
| CÁC BƯỚC | VAI TRÒ HƯỚNG DẪN QUAN TRỌNG CỦA SIÊU ÂM | CÁC MẶT CẮT | KĨ THUẬT SIÊU ÂM ƯU TIÊN |
|---|---|---|---|
| 1. Chọc vách liên nhĩ | Xác nhận vị trí: giữa sau/sau trên | Mặt cắt hai tĩnh mạch giữa thực quản (Góc 900-1100) để định vị theo hướng giữa sau/sau trên. Mặt cắt trục ngắn giữa thực quản để quan sát vị trí chọc vào vách liên nhĩ | 2D TEE, 3D TEE |
| 2. Đưa ống thông dẫn đường vào nhĩ trái | Xác nhận khoảng cách: 4 cm phía trên vòng van | Mặt cắt bốn buồng giữa thực quản để đo khoảng cách giữa vị trí chọc vách liên nhĩ và vòng van hai lá | 2D TEE, 3D TEE |
| 3. Đưa hệ thống vận chuyển MitraClip vào nhĩ trái | Quan sát hệ thống clip ra khỏi ống thông dẫn đường để đảm bảo không tổn thương các cấu trúc giải phẫu xung quanh | 2D TEE, bắt đầu từ mặt cắt hai tĩnh mạch giữa thực quản và quay đầu dò. | 2D TEE |
| 4. Định vị thẳng hàng MitraClip trong nhĩ trái | Điều chỉnh mở clip vuông góc với mép van trong nhĩ trái Quan sát vị trí clip so với dòng hở van hai lá | 3D TEE để thấy toàn bộ van hai lá nhìn từ nhĩ trái để đảm bảo thấy được đầu của ống thông dẫn đường, đôi khi sẽ bị ra ngoài mặt phẳng 2D 2D TEE giữa thực quản sử dụng Doppler màu với mặt cắt hai mép van với kĩ thuật hai mặt phẳng để kiểm chứng vị trí của clip so với dòng hở van hai lá theo chiều giữa bên và trước sau. | 3D TEE, 2D hai mặt phẳng |
| 5. Mở cánh MitraClip trong nhĩ trái | Quan sát mở cánh clip trong nhĩ trái, sau đó định hướng clip vuông góc với lỗ van hai lá ở vị trí định kẹp lá van | Hình ảnh nhìn từ nhĩ trái trên 3D TEE | 3D TEE |
| 6. Định vị chính xác MitraClip ở trên các lá van | Hướng dẫn hệ thống vận chuyển clip đến trên lá van ở vị trí chính xác, xác nhận vị trí theo hướng giữa bên và trước sau | Hình ảnh nhìn từ nhĩ trái trên 3D TEE để chắc chắn nhìn được đầu của ống thông dẫn đường vì đôi khi bộ phận này bị ra ngoài mặt phẳng 2D | 3D TEE |
7. Định vị MitraClip trong thất trái dưới lá van | Quan sát chuyển tiếp từ nhĩ trái xuống thất trái Lập tức trao đổi với phẫu thuật viên chính về những thay đổi so với hướng đi ban đầu | Mặt cắt mép van 2D giữa thực quản với kĩ thuật hai mặt phẳng | 2D hai mặt phẳng |
| 8. Kẹp các lá van | Kiểm chứng cả hai lá van trước và sau đã được kẹp một cách tối ưu khi kéo clip khỏi thất trái về phía các lá van | Mặt cắt mép van 2D giữa thực quản hoặc ba buồng với kĩ thuật hai mặt phẳng để kiểm chứng đã kẹp cả hai lá van trong cánh clip. Hình ảnh 3D nhìn từ nhĩ trái để quan sát cầu mô giữa các lá van | 2D hai mặt phẳng, 3D TEE |
9. Kiểm chứng mức độ hở van hai lá đã giảm | Khi đóng các cánh clip, kiểm chứng mức độ hở van hai lá đã giảm | 2D Doppler màu, dùng nhiều mặt cắt để nhìn rõ nhất mức độ giảm hở van hai lá | 2D hai mặt phẳng, 3D TEE |
| 10. Thành công về mặt thủ thuật | Đánh giá (các) diện tích van hai lá còn lại. Đánh giá chênh áp qua van. Rút hệ thống vận chuyển clip và ống thông dẫn đường. Đánh giá dòng chảy qua vách liên nhĩ. | 2D Doppler màu và 3D Doppler màu để đo EROA từ các mặt cắt giữa thực quản. Doppler xung đánh giá dòng trào ngược trong tĩnh mạch phổi. Doppler liên tục đo chênh áp tối đa qua van hai lá. Đo diện tích van hai lá mới trên 3D. | 2D hai mặt phẳng, 3D TEE |
| 11. Lặp lại quy trình với clip thứ hai nếu cần | Định vị clip thứ hai so với clip thứ nhất |
EROA: diện tích dòng hở hiệu dụng; TEE: siêu âm tim qua thực quản.
7 Biến chứng của Mitraclip
Nguy cơ biến chứng sau MitraClip thấp tương đương với phẫu thuật mở sửa van và thủ thuật được dung nạp tốt. Các biến chứng bao gồm chảy máu vị trí đường vào, clip chỉ kẹp được một lá van, huyết khối trong tim và làm tăng mức độ hẹp van hai lá.
Trong nghiên cứu lớn đầu tiên đánh giá khả năng sử dụng MitraClip, nghiên cứu EVEREST II, các biến chứng nặng như tử vong và đột quỵ não lớn tương tự giữa nhóm bệnh nhân điều trị bằng MitraClip và nhóm phẫu thuật van hai lá. Mặt khác, các bệnh nhân phẫu thuật cần truyền nhiều máu hơn và thời gian hô hấp nhân tạo lâu hơn trong khi nhóm MitraClip có tỉ lệ rung nhĩ mới và suy thận cao hơn.
Tỉ lệ biến chứng trong 30 ngày thường trong khoảng 15-19% sau sửa van hai lá qua đường ống thông. Chảy máu chủ yếu xảy ra quanh thủ thuật ở vị trí chọc mạch đường vào do các ống thông có kích thước lớn.
Biến chứng clip chỉ kẹp được một lá van gặp nhiều nhất trong vòng một năm sau thủ thuật nhưng tỉ lệ chỉ <5%.
Huyết khối trong dụng cụ và kẹp chặt toàn bộ van hay gây hẹp van hai lá đáng kể về mặt huyết động là rất hiếm.
Nguy cơ viêm nội tâm mạc do MitraClip còn chưa rõ vì đa số các dữ liệu là báo cáo ca bệnh và việc sử dụng kháng sinh dự phòng đối với bệnh nhân MitraClip còn nhiều tranh cãi.
8 Kết quả can thiệp qua các nghiên cứu và ứng dụng trên lâm sàng
Mặc dù có các tiêu chuẩn tương đối nghiêm ngặt ở trên, các nghiên cứu trước đây đã chứng minh tỉ lệ thành công cao của MitraClip ở những bệnh nhân phức tạp hơn bao gồm giãn thất trái, chức năng tâm thu thất trái giảm nhiều và bệnh nhân không đạt các tiêu chuẩn về chiều sâu vùng đóng van, chiều dài vùng đóng van và khoảng trống của vùng rơi lá van. Độ bền của thủ thuật sửa van đã được khẳng định trong khi theo dõi trung hạn (1-3,5 năm) phụ thuộc vào các nghiên cứu, tuy nhiên, nguy cơ tái can thiệp cao hơn ở những trường hợp không đạt tiêu chuẩn EVEREST.
Giữa năm 2018, FDA Hoa Kỳ đã phê chuẩn thế hệ thứ ba của hệ thống MitraClip với hệ thống lái tiên tiến, khả năng điều hướng và định vị clip tốt hơn để cải thiện khả năng thả van và độ chính xác của dụng cụ. Dụng cụ MitraClip NTR mới sử dụng clip có kích thước gốc với hệ thống thả van tiên tiến, và MitraClip XTR sử dụng clip có cánh dài hơn 3 mm và kéo dài vùng kẹp van thêm 5 mm so với NTR (Hình 41.6). Những cải tiến này đã giúp các trường hợp lá van có cấu trúc giải phẫu khó có khả năng thành công cao hơn.
8.1 Hở van hai lá tiên phát mạn tính
Cập nhật khuyến cáo về các bệnh van tim của AHA/ACC năm 2017 đề nghị sử dụng MitraClip điều trị hở van hai lá tiên phát mức độ nhiều mạn tính (3-4+) cho các bệnh nhân có triệu chứng nặng (NYHA III – IV) dù đã sử dụng các thuốc tối ưu theo khuyến cáo (giai đoạn D) và có giải phẫu van hai lá thích hợp, kỳ vọng sống hợp lý và nguy cơ phẫu thuật rất cao do nhiều bệnh đồng mắc (Bảng 41.7). Đối với trường hợp hở van hai lá tiên phát đáp ứng đủ các tiêu chuẩn, bước tiếp theo là gửi đến nhóm Heart team để đánh giá tính khả thi và nguy cơ tiềm tàng so với lợi ích của thủ thuật. Đa số các khuyến cáo được đưa ra dựa trên các dữ liệu từ nghiên cứu EVEREST II.
Bảng 41.7. Các yếu tố quyết định nguy cơ phẫu thuật rất cao ở bệnh nhân hở van hai lá tiên phát có kế hoạch làm MitraClip
Điểm ước lượng nguy cơ tử vong trong 30 ngày do phẫu thuật theo Hội Phẫu thuật lồng ngực (STS) ≥8% Động mạch chủ dễ vỡ hoặc vôi hóa nhiều Thể trạng bệnh nhân yếu Bệnh gan nặng Tăng áp lực động mạch phổi nhiều Rối loạn chức năng thất phải với hở van ba lá nhiều Khác – đang điều trị hóa chất cho bệnh ác tính, chảy máu lớn, bất động, AIDS, mất trí nhớ nghiêm trọng |
Trong nghiên cứu EVEREST II, 279 bệnh nhân hở van hai lá độ 3+ đến 4+ được lựa chọn ngẫu nhiên theo tỉ lệ 2:1 vào nhóm sửa van đường ống thông, tức là MitraClip (184 bệnh nhân), hoặc phẫu thuật van hai lá (95 bệnh nhân). Trong số các bệnh nhân phẫu thuật, 86% sửa van và số còn lại là thay van. Bệnh nhân phải đạt ít nhất 3 tiêu chuẩn về hở van hai lá vừa-nhiều (3+) hoặc nhiều (4+) trên siêu âm. Tất cả các bệnh nhân đều phải có dòng hở chính xuất phát từ vị trí đóng không kín ở vùng giữa của hai lá van tại thời điểm nhận vào nghiên cứu. Khoảng 3/4 bệnh nhân được nhận vào nghiên cứu có van hai lá thoái hóa.
Kết cục chính tổng hợp về độ an toàn là không tử vong, không phải phẫu thuật vì rối loạn chức năng van hai lá và không có hở van hai lá tồn lưu ≥ độ 3. Trong 12 tháng, tỉ lệ kết cục chính cao hơn ở nhóm phẫu thuật (73% so với 55%) do tỷ lệ phải phẫu thuật van hai lá sau MitraClip do rối loạn chức năng van là khá cao (20 so với 2%). Tỷ lệ tử vong và hở van hai lá tồn lưu ≥ độ 3 là tương tự giữa hai nhóm, lần lượt là khoảng 6% và 20%. Biến chứng chính sau 30 ngày gặp nhiều hơn ở nhóm phẫu thuật, chủ yếu là do tỷ lệ cao phải truyền máu ≥2 đơn vị ở bệnh nhân phẫu thuật. Dữ liệu 5 năm công bố gần đây cho thấy bệnh nhân làm MitraClip có tỉ lệ phải phẫu thuật lại van hai lá và hở van hai lá tồn lưu cao hơn so với nhóm phẫu thuật, nhưng không có sự khác biệt về tử vong nói chung (Bảng 41.8). Các dữ liệu này tiếp tục ủng hộ cho tính an toàn của MitraClip trong điều trị hở van hai lá tiên phát, nhưng cũng nhấn mạnh vào việc cần thiết phải lựa chọn bệnh nhân phù hợp vì có hơn 1/4 bệnh nhân phải phẫu thuật lại van hai lá sau 5 năm làm MitraClip. Đa số các ca phải phẫu thuật lại xảy ra vào năm đầu tiên sau thủ thuật, góp phần cho thấy độ tin cậy về khả năng duy trì của các ca MitraClip thành công.
Lợi ích về chất lượng cuộc sống ở nhóm MitraClip được ghi nhận từ sớm và duy trì trong suốt thời gian theo dõi tiếp theo trong EVEREST II, trong đó tỉ lệ NYHA III/IV giảm xuống còn 5,7% sau 4 năm so với 45% ở thời điểm ban đầu. Những cải thiện về chất lượng cuộc sống và giảm tỷ lệ nhập viện do suy tim cũng gặp ở nhóm có nguy cơ phẫu thuật van hai lá rất cao. Theo nghiên cứu EVEREST II ban đầu vào theo dõi sau đó, một lợi ích khác của việc can thiệp van hai lá đúng lúc là giúp đảo ngược quá trình tái cấu trúc thất trái và giảm thể tích thất và nhĩ trái do giảm mức độ hở van hai lá khi sử dụng MitraClip. Các nghiên cứu kiểm tra việc sử dụng MitraClip rộng rãi lấy nhóm hở van hai lá tiên phát làm chủ yếu cho thấy tỉ lệ thành công của thủ thuật cao với tỉ lệ hở van hai lá tồn lưu < độ 3 là >90%, tỷ lệ tử vong trong bệnh viện <3% và tỉ lệ biến chứng nặng chung trong 30 ngày là 10-15%. Dựa vào các kết quả ban đầu này, cùng với các kết quả tốt trong điều trị hở van hai lá do thoái hóa trong suốt thời gian qua cũng như các tiến bộ trong chẩn đoán hình ảnh tim mạch cho phép đánh giá tốt hơn các đặc điểm về giải phẫu, đã có một sự tranh cãi về việc sử dụng rộng rãi hơn trên lâm sàng ở các bệnh nhân có nguy cơ phẫu thuật dưới mức rất cao. Việc lựa chọn các bệnh nhân như vậy cần dựa trên từng cá thể và tiếp cận của nhóm Heart Team.
Bảng 41.8. Các nghiên cứu về MitraClip điều trị bệnh nhân hở van hai lá nhiều.
| NGHIÊN CỨU | THIẾT KẾ | NHÓM SO SÁNH | SINH BỆNH HỌC HỞ VAN HAI LÁ | KẾT CỤC NGHIÊN CỨU |
|---|---|---|---|---|
| Feldman và cộng sự EVEREST II Kết quả sau 5 năm | Tiến cứu, đa trung tâm, ngẫu nhiên có đối chứng | 2:1 MitraClip (n =178) so với phẫu thuật (n=80) | 73% tiên phát, 27% chức năng | 44,2 với. 64,3% (p = 0,01)* 12,3 với 1,8% (p = 0,02)§ 27,9 với 8,9% (p = 0,003)€ 20,8 và 26,8% (p = 0,4) ¥ |
| Stone và cộng sự COAPT | Tiến cứu, đa trung tâm, ngẫu nhiên có đối chứng | 1:1 MitraClip (n = 302) so với điều trị nội khoa (n=312) | 100% chức năng với giảm chức năng thất trái | 35,8 với 67,9% (p < 0,001)** 5,2 với 53,1% (p < 0,001)§§ 29,1 với 46,1% (p < 0,001) ¥¥ |
Obadia và cộng sự MITRA-FR | Tiến cứu, mở nhãn, đa trung tâm, ngẫu nhiên có đối chứng | 1:1 MitraClip (n =152) so với điều trị nội khoa (n=152) | 100% chức năng với giảm chức năng thất trái | 54,6 với 51,3% (p = 0,53)*** 48,7 với 47,4% (p > 0,05)§§§ 24,3 với 22,4% (p > 0,05) ¥¥¥ |
*Kết cục tổng hợp: không tử vong, không phẫu thuật lại, không có hở van hai lá tồn lưu độ 3+ hoặc 4+ theo phân tích điều trị.
Tỉ lệ hở van hai lá tồn lưu ≥ 3+.
€ Tỉ lệ phẫu thuật lại.
¥ Tỉ lệ tử vong sau 5 năm theo phân tích điều trị.
**Nhập viện vì suy tim trong 24 tháng.
§ Tỉ lệ hở van hai lá tồn lưu ≥ 3+ trong 12 tháng.
¥¥ Tử vong do mọi nguyên nhân trong 24 tháng
***Kết cục tổng hợp chính: tử vong do mọi nguyên nhân hoặc nhập viện do suy tim không theo kế hoạch trong 12 tháng.
§§ Nhập viện do suy tim không theo kế hoạch trong 12 tháng.
¥¥¥Tử vong do mọi nguyên nhân trong 12 tháng.
8.2 Hở van hai lá thứ phát mạn tính
Hai nghiên cứu ngẫu nhiên có nhóm chứng lớn đã được thực hiện riêng biệt để so sánh hiệu quả của sửa van hai lá qua da với MitraClip và điều trị nội khoa ở những bệnh nhân hở van hai lá thứ phát mức độ đáng kể và rối loạn chức năng thất trái (Bảng 41.8). Những nghiên cứu này cho kết quả trái ngược nhau. Sự khác biệt này có thể giải thích ở mức độ nào đó bằng những khác biệt về thiết kế nghiên cứu và lựa chọn bệnh nhân.
4.2.2.2 Đánh giá kết quả về tim mạch của điều trị qua da với MitraClip ở bệnh nhân suy tim có hở van hai lá chức năng (Nghiên cứu COAPT)
Nghiên cứu tuyển chọn 614 bệnh nhân có rối loạn chức năng thất trái (EF 20-50%) và hở van hai lá thứ phát mức độ vừa-nhiều hoặc nhiều vẫn còn triệu chứng dù đã dùng liều tối đa các thuốc điều trị. Trong số các bệnh nhân được tuyển chọn, 302 người được đưa vào nhóm MitraClip (kết hợp với điều trị nội khoa theo khuyến cáo) và 312 người thuộc nhóm chứng chỉ điều trị nội khoa theo khuyến cáo. Nghiên cứu loại trừ các bệnh nhân có LVESD >7 cm. Thủ thuật với MitraClip thành công trong 98% các bệnh nhân thuộc nhóm điều trị với 95% bệnh nhân ra viện có mức độ hở van hai lá tồn lưu < độ 3 trên siêu âm. Tương tự sau 12 tháng, 94,8% bệnh nhân có mức độ hở van hai lá < độ 3 ở nhóm điều trị so với 46,9% ở nhóm chứng. Kết cục lâm sàng của nghiên cứu được cải thiện có ý nghĩa ở nhóm điều trị so với nhóm chứng, như tỉ lệ tử vong sau 2 năm (29,1% so với 46,1%) và tỷ lệ nhập viện do suy tim trong 2 năm (35,8% so với 67,9% mỗi năm). Điều thú vị là không có sự khác biệt về tử vong giữa hai nhóm trong thời gian 12 tháng. Các phương pháp khác để đo lường chất lượng cuộc sống như NYHA I hoặc II (72,2% so với 49,6%) và thay đổi điểm trung bình của bộ câu hỏi về bệnh cơ tim Kansas City (+12,5 so với -3,6 điểm) đều tốt hơn ở nhóm MitraClip so với nhóm điều trị nội khoa. Cũng có bằng chứng cho thấy có sự đảo ngược quá trình tái cấu trúc thất trái trong 12 tháng ở nhóm điều trị so với nhóm chứng (thay đổi LVEDV trung bình từ thời điểm ban đầu -3,7 ml so với +17,1 ml). Sau 12 tháng, 3,4% bệnh nhân MitraClip gặp biến chứng (bao gồm clip chỉ kẹp một lá van, huyết khối dụng cụ, viêm nội tâm mạc hoặc hẹp van hai lá cần phải phẫu thuật, sử dụng thiết bị hỗ trợ thất trái, thay tim, và biến chứng của phải phẫu thuật tim không theo kế hoạch).
8.3 Sửa van hai lá qua da với MitraClip cho hở van hai lá chức năng/thứ phát (Nghiên cứu MITRA-FR)
Nghiên cứu tuyển chọn 304 bệnh nhân có triệu chứng có rối loạn chức năng thất trái (EF 15-40%) và hở van hai lá vừa đến nhiều được điều trị bằng sửa van hai lá qua da kết hợp với điều trị nội khoa (n=152) hoặc điều trị nội khoa đơn thuần (n=152).Thủ thuật đặt MitraClip thành công ở 95,8% bệnh nhân ở nhóm điều trị với 91,9% có hở van hai lá tồn lưu < độ 3 khi ra viện và ~82% sau 12 tháng. Tỉ lệ tử vong (24,3% so với 22,4%) và nhập viện vì suy tim không theo kế hoạch (48,7% so với 47,4%) sau 12 tháng tương tự giữa hai nhóm điều trị và nhóm chứng. Bệnh nhân có NYHA I hoặc II (chiếm ~65-70%) và điểm chất lượng cuộc sống EQ-5D trung bình (60,8 so với 58,6) cũng tương tự giữa hai nhóm sau 12 tháng. Cải thiện về NYHA so với thời điểm ban đầu gặp ở cả hai nhóm. Sự khác biệt về LVEDD, LVEDV, LVESD và LVESV trung vị so với thời điểm ban đầu là rất ít ở hai nhóm sau 12 tháng. Trong nhóm can thiệp, 14,6% có biến chứng liên quan đến MitraClip (bao gồm không đặt được dụng cụ, biến cố mạch máu hoặc xuất huyết có ý nghĩa, tổn thương vách liên nhĩ, sốc tim cần phải dùng thuốc vận mạch, thuyên tắc trong tim, ép tim, và phải phẫu thuật tim cấp cứu).
4.2.2.3 COAPT so với MITRA-FR
Mặc dù hai nghiên cứu có nhiều điểm chung trong thiết kế nghiên cứu cũng như tỉ lệ các biến cố báo hiệu quần thể bệnh nhân tuyển chọn có nguy cơ cao nhưng vẫn có những khác biệt quan trọng dẫn đến kết quả khác nhau. Một trong số đó là tiêu chuẩn được sử dụng để định nghĩa mức độ nặng của hở van hai lá. MITRA-FR sử dụng khuyến cáo về van tim của ACC/AHA 2014 và ESC, trong khi đó khuyến cáo này phân loại sai hở van hai lá chức năng mức độ vừa thành mức độ nhiều. Chúng tôi đã đưa ra một số khác biệt tại thời điểm ban đầu giữa hai nhóm can thiệp của hai nghiên cứu trong Bảng 41.9. Tóm lại, so với những bệnh nhân trong MITRA-FR, bệnh nhân trong COAPT có:
- Nhiều trường hợp hở van hai lá mức độ nhiều.
- Ít tình trạng tái cấu trúc thất trái.
- Kháng trị với điều trị nội khoa dẫn đến ít khả năng cải thiện ở nhóm chứng.
- Suy tim có thể đóng góp nhiều hơn vào tình trạng rối loạn chức năng van tim hơn là suy chức năng thất.
- Hiệu quả thủ thuật được cải thiện và ít hở van hai lá tồn lưu (< độ 3), và theo dõi dài hơn khi khác biệt chỉ xuất hiện trong khoảng thời gian sau 12 tháng.
Thông tin bổ sung về điều trị nội khoa theo khuyến cáo, điều chỉnh liều thuốc và tối ưu hóa CRT (liệu pháp tái đồng bộ cơ tim) cũng làm rõ thêm sự khác biệt giữa hai nghiên cứu. Việc xác nhận đáp ứng lâm sàng đối với MitraClip của nhóm hở van hai lá nhiều tương xứng so với không tương xứng có thể thực hiện bằng cách tổng hợp thông tin từ các nghiên cứu này và xác định mức độ đáp ứng của các nhóm kiểu hình khác nhau. Các dữ liệu theo dõi dọc của MITRA-FR và các nghiên cứu ngẫu nhiên có nhóm chứng được thiết kế tốt với các tiêu chuẩn khác biệt về hình thái sẽ giúp chúng ta hiểu rõ hơn về sửa van hai lá qua da trong hở van hai lá thứ phát và giúp cho việc tìm hiểu thời điểm thích hợp để can thiệp. Việc dùng hai clip và sử dụng các thủ thuật qua da khác nhằm tối ưu hóa các bất thường giải phẫu của van hai lá (như thay dây chằng, thay đổi hình thái thất hoặc nhĩ) có làm thay đổi tình trạng hở van hai lá hay không vẫn còn đang được nghiên cứu và từ đó có thể có khả năng mở rộng nhóm bệnh nhân hưởng lợi từ các thủ thuật kết hợp như vậy.
Bảng 41.9. Các đặc điểm ban đầu trong COAPT và MITRA-FR (nhánh MitraClip)
| BIẾN | COAPT (n = 302) | MITRA-FR (N = 152) |
|---|---|---|
| Tỉ lệ kẹp clip thành công (đã kẹp/cố gắng kẹp) | 98% (287/293) | 95,8% (138/144) |
Tiêu chuẩn lựa chọn về mức độ hở van hai lá thứ phát* Thể tích dòng hở | >45ml ≥0,3 cm2 ≥3+ | >30 ml >0,2 cm2 ≥3+ |
| Tuổi – năm (trung bình ± độ lệch chuẩn) | 71,7 ± 10,1 | 71,7 ± 10,1 |
| Giới nam | 66,6% | 78,9% |
| NYHA III/IV | 57% | 63,1% |
| Tiền sử nhồi máu cơ tim | 51,7% | 49,3% |
| Tiền sử rung nhĩ | 57,3% | 34,5% |
| Loại bệnh cơ tim Do thiếu máu cục bộ Không do thiếu máu cục bộ | 60,9% 39,1% | 62,5% 37,5% |
Các thuốc tại thời điểm ban đầu ACEI, ARB hoặc ARNI | 71,5% 91,1% 50,7% 89,4% 46,4% | 83,0% 88,2% 56,6% 89,4% 46,4% |
| Tiền sử tái đồng bộ cơ tim | 38,1% | 30,5% |
| Peptid lợi tiểu nhóm B (pg/ml) | 1014 (Trung bình) | 765 (Trung bình) |
| Kẹp ≥ 2 clip | 61,8% | 54,3% |
| Diện tích dòng hở hiệu dụng (cm2) | 0,41 ± 0,15 | 0,31 ± 0,1 |
| Thể tích cuối tâm trương thất trái trung bình (ml)** | 194 | 254 |
| Phân số tống máu thất trái (%) | 31,3 ± 9,1 | 33,3 ± 6,5 |
*Xác nhận tại một phòng siêu âm gốc trước khi tuyển chọn vào nhóm hở van hai lá vừa-nhiều hay nhiều.
**Tính thể tích cuối tâm trương thất trái trong MITRA-FR dựa trên thể tích tính theo diện tích da 136,2 ml/m2. ACEI: ức chế men chuyển; ARB: ức chế thụ thể Angiotensin II; ARNI: ức chế thụ thể Neprilysin.
8.4 Hở van hai lá tương xứng so với hở van không tương xứng với giãn thất trái
Có lẽ hở van hai lá thứ phát là một nhóm bệnh khá phong phú trong một số trường hợp, hở van hai lá có thể được giải thích bởi những thay đổi về hình thái ảnh hưởng đến thất trái như khi giãn đồng đều thất và một số khác hở van hai lá là do tái cấu trúc trong thất trái ảnh hưởng đến bộ máy van hai lá hơn là do giảm đồng đều chức năng thất trái. Trong một bài báo gần đây, Grayburn và Packer đã miêu tả EROA phụ thuộc như thế nào vào LVEDV và LVEF, như ở những bệnh nhân có LVEF ~30% và giãn thất trái (LVEDV 200-250ml), EROA thường chỉ khoảng 0,2 cm2 và đây chỉ là mức hở van hai lá vừa, chứ không phải nhiều. Trong những ca như vậy, can thiệp vào van hai lá khả năng cao là không mang lại lợi ích cho bệnh nhân. Trường hợp này, mức độ hở van hai lá tương xứng với mức độ giãn thất trái. Các tác giả cũng đưa ra một quan điểm trong đó mức độ nặng của hở van hai lá được xác định bằng cách đánh giá tổng thể EROA, LVEDV và LVEF. Những trường hợp đáp ứng với điều trị can thiệp van hai lá là những người có mức độ hở van nhiều hơn mức dự báo và mức độ hở van không tương xứng với mức độ giãn thất trái. Những người này thường có thất trái ít giãn hơn và EROA lớn hơn khá nhiều, trong đó tỉ lệ EROA và LVEDV cao hơn so với nhóm hở van hai lá tương xứng (Hình 41.10).

Kích thước thất trái bình thường với hở van hai lá nhẹ. (B) Tiến triển đến hở van hai lá vừa và chức năng thất trái giảm nhẹ.
(C) Thất trái hồi phục với hở van hai lá nhẹ sau điều trị nội khoa. (D) Tiến triển của giảm chức năng thất trái với thất trái giãn nhẹ-vừa và hở van hai lá nhiều dù đã điều trị nội khoa. (E) Cải thiện chức năng thất trái sau MitraClip, đảo ngược tái cấu trúc thất trái và giảm hở van hai lá tồn lưu. (F) Tiến triển của giảm chức năng thất trái với thất trái vừa-nhiều và hở van hai lá nhiều dù đã điều trị nội khoa. (G) Sau MitraClip không có thay đổi về kích thước và chức năng thất trái dù giảm mức độ hở van hai lá tồn lưu. (H) Những thay đổi về cấu trúc trong (D, F) thể hiện kiểu hình khác nhau hoặc chỉ là tiến triển của quá trình bệnh nặng thêm. GDMT: điều trị nội khoa theo khuyến cáo; CRT: liệu pháp tái đồng bộ cơ tim.
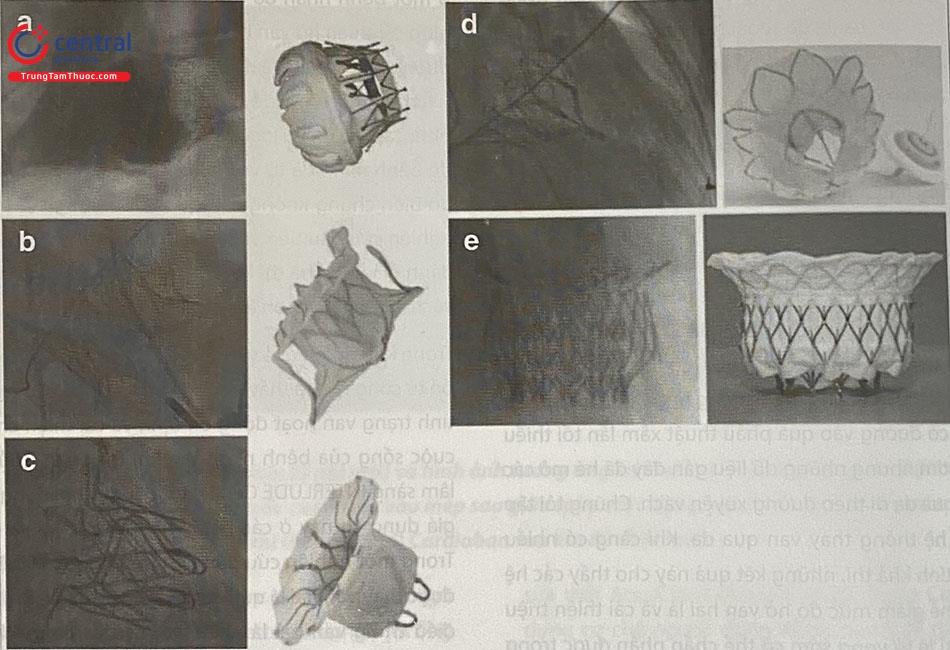
8.5 Một số kỹ thuật sửa van hai lá qua đường ống thông khác đang được phát triển
Có khá nhiều bệnh nhân hở van hai lá nhiều không đạt đủ tiêu chuẩn về giải phẫu để sửa van bằng MitraClip. Có một số dụng cụ trong lĩnh vực can thiệp qua da có tiềm năng có thể áp dụng trong hở van hai lá mạn tính, cho phép thực hiện một số chỉnh sửa tương tự như phẫu thuật truyền thống, ở một cá nhân hoặc kết hợp .
Hiện nay có bốn dụng cụ tiếp cận qua đường ống thông chính:
- Sửa van bờ-bờ (kiểu Alfieri) (MitraClip, hệ thống PASCAL TMVr),
- Đặt vòng van hai lá qua da gián tiếp qua xoang vành hoặc trực tiếp ngược dòng từ thất trái (Carillon, Cardioband, Millipede, Mitralign, ARTO),
- Thay dây chằng (NeoChord, Harpoon Cords) và
- Thay van hai lá qua da (van Sapien-XT, Melody, CardiaAQ, Caisson valve, .v.v.).
Trong các kĩ thuật qua đường ống thông này, chỉ hai kỹ thuật đầu đã được kiểm tra tốt với các chiến lược sửa van hai lá qua da. Đa số các kĩ thuật khác như thay dây chằng hay thay van hai lá đều tiếp cận theo đường mỏm tim thông qua phẫu thuật mở ngực bên tối thiểu.
8.5.1 Sửa van kẹp clip bờ – bờ
Sửa van hai lá qua đường ống thông PASCAL: hệ thống PASCAL TMVr (Edwards Lifesciences, Irvine, CA) được thiết kế để khắc phục những thiếu sót của MitraClip bằng cách tạo điều kiện để dễ dàng điều khiển trong nhĩ trái, kích thước dụng cụ lớn hơn, cánh clip rộng hơn với miếng đệm trung tâm ở phía trong để giảm mức độ hở van hai lá bằng cách tối đa diện đóng của lá van, có thể kẹp lần lượt từng lá van và kéo dài dụng cụ giúp việc điều chỉnh ở phía dưới lá van an toàn hơn. Dụng cụ được cấy thông qua đường vào tĩnh mạch (đùi) và cần chọc vách tương tự như MitraClip. Trong thử nghiệm đầu tiên ở người, PASCAL TMVr được sử dụng trên 23 bệnh nhân với hở van hai lá nhiều có triệu chứng (NYHA III-IV), sinh bệnh học do thoái hóa, chức năng hoặc cả hai, và nguy cơ phẫu thuật rất cao. Các bệnh nhân này không được coi là ứng cử viên phù hợp cho MitraClip do cấu trúc giải phẫu phức tạp (lá sau ngắn, diện đóng không kín lớn, giãn vòng van nhiều > 61mm) hoặc không có đủ chỉ định đã được cho phép. Thủ thuật thành công ở 22/23 bệnh nhân (96%), hở van hai lá tồn lưu < độ 3 gặp ở 96% bệnh nhân và 95% bệnh nhân giảm NYHA ≤ II. Trong 30 ngày sau thủ thuật, 3 bệnh nhân (13%) tử vong. Biến chứng liên quan trực tiếp đến thủ thuật gặp ở 2 ca (9%) gồm chảy máu nhỏ và đột quỵ não thoáng qua. Dụng cụ này đã mở rộng lựa chọn bệnh nhân có thể sửa van, đặc biệt là trong trường hợp lá sau ngắn và khoảng trống rơi van lớn. Ngoài ra cũng cần thêm các dữ liệu về độ bền và các nghiên cứu đối đầu với các thế hệ mới hơn của MitraClip trong tương lai.
Các dụng cụ sửa vòng van gián tiếp
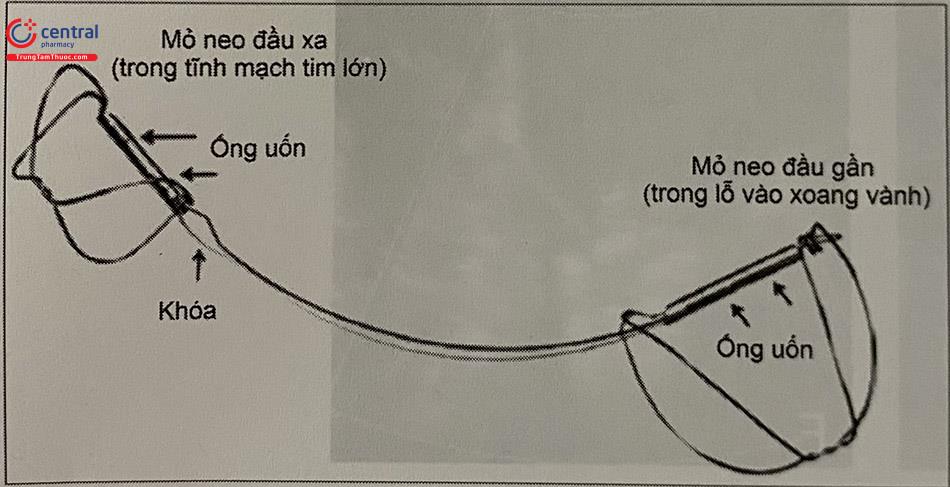
Hệ thống vòng van hai lá CARILLON: hệ thống này (Cardiac Dimensions, Inc., Kirkland, Washington) bao gồm một dụng cụ cấy ghép độc quyền với một hệ thống phân phối qua đường ống thông từ tĩnh mạch cổ để điều trị hở van hai lá chức năng. Đây là một dụng cụ sửa vòng van gián tiếp bao gồm hai mỏ neo nitinol tự nở và một đoạn đường cong nối giữa hai mỏ neo. Trong đó, mỏ neo đầu gần được đặt ở gần lỗ vào xoang vành và mỏ neo đầu xa đặt trong tĩnh mạch tim lớn. Sau khi thả, dụng cụ sẽ uốn vùng mô gần van vòng van hai lá, làm giảm giãn vòng van và mức độ hở van hai lá bằng cách kéo gần lá trước và lá sau. Chụp động mạch vành để đánh giá mức độ ép vào động mạch mũ do dụng cụ được thả gần động mạch này. Các kĩ thuật hiện nay cho phép có thể tháo và điều chỉnh lại vị trí của dụng cụ trong cùng một thì can thiệp hoặc tháo hẳn dụng cụ cũ để thả một dụng cụ mới nếu cần.
Thử nghiệm đầu tiên của hệ thống này, AMADEUS và TITAN, cho thấy có sự cải thiện về triệu chứng, chất lượng cuộc sống, mức độ hở van hai lá và có bằng chứng về đảo ngược quá trình tái cấu trúc thất trái khi điều trị các bệnh nhân hở van hai lá chức năng mức độ nhiều có triệu chứng và nguy cơ phẫu thuật cao. Dụng cụ thế hệ đầu có các đặc điểm tương đối an toàn nhưng có 25% các ca ghi nhận hình ảnh gãy không triệu chứng ở đoạn có dạng dây của mỏ neo đầu gần do bị kéo quá căng. TITAN II là một nghiên cứu tiến cứu, một nhánh, đa quốc gia để đánh giá tính an toàn của dụng cụ Carillon thế hệ mới với thiết kế giảm nhẹ áp lực lên phần dạng dây của mỏ neo đầu gần. Tình trạng gãy dụng cụ gặp ở 1/36 (2,8%) ca làm thay đổi vị trí dụng cụ đã được tháo/thả lại. Kết cục chính là tác dụng phụ nghiêm trọng trong 30 ngày gặp ở 2,8% trường hợp do một ca đột tử không liên quan đến rối loạn nhịp vào ngày thứ 17 sau thủ thuật. Tỉ lệ tử vong sau 1 năm là 23% (7 trong 30 bệnh nhân) và không có trường hợp tử vong nào được cho là có liên quan đến dụng cụ. Từ khía cạnh hiệu quả, TITAN II cho thấy các lợi ích về lâm sàng và trên siêu âm tương tự như TITAN với giảm mức độ hở van hai lá, giảm kích thước vòng van, cải thiện NYHA và có xu hướng giảm kích thước thất tức là đảo ngược quá trình tái cấu trúc. Hiện nay, dụng cụ Carillon cải tiến sử dụng trong TITAN II đang được đánh giá trong một nghiên cứu ngẫu nhiên, mù đôi, đa trung tâm và có nhóm chứng (REDUCE FMR).
Dụng cụ ARTO: liệu pháp giảm vòng van qua đường ống thông MVRx ARTO (MVRX, Inc., Belmont, California) là một hệ thống sửa vòng van gián tiếp gồm hai mỏ neo đưa vào qua đường tĩnh mạch: một mỏ neo ở vách liên nhĩ và mỏ neo kia trong xoang vành giúp giảm đường kính trước sau của vòng van hai lá. Thủ thuật được thực hiện khi gây mê toàn thân. Thử nghiệm MV RepaIr Clin- ical (MAVERIC) là một nghiên cứu tiến cứu, một nhánh đánh giá tính an toàn và hoạt động của dụng cụ trên bệnh nhân hở van hai lá chức năng. Những kết quả ban đầu đầy hứa hẹn với 11 trong tổng 31 bệnh nhân và cần chờ các dữ liệu đầy đủ được công bố.
MagneCaths trong tĩnh mạch tim lớn và nhĩ trái liên kết bằng từ tính phía sau vùng P2 của lá (b) Cận cảnh liên kết từ tính của MagneCath nhĩ trái và tĩnh mạch tim lớn. Mỗi ống thông từ tính có một hình dạng và ống thông đặc biệt để định hướng và nhận dây thông. (c) Dây thông (mũi tên) được đẩy từ MagneCath tĩnh mạch tim lớn vào MagneCath nhĩ trái. Các MagneCath được chỉnh để hướng dây thông đi từ tĩnh mạch tim lớn vào nhĩ trái qua vách nhĩ một cách an toàn. (d) Sau khi dùng một ống thông chuyển đổi, dây hướng dẫn dạng vòng được đặt xuyên qua nhĩ trái. Dây hướng dẫn này sẽ định hướng cho vị trí của mỏ neo tĩnh mạch tim lớn (T-bar) và mỏ neo vách. (e) Hệ thống MVRx được đặt vào vị trí trước khi được kéo căng. T-Bar, mũi tên đơn; mỏ neo vách, mũi tên đôi. (f) Kéo căng cầu nối làm giảm đường kính trước sau của vòng van hai lá (mũi tên) và giảm mức độ hở van hai lá chức năng; khi đã xác định vị trí cuối cùng, cắt chỉ khâu và giữ chặt bằng một khóa chỉ.
Hệ thống buộc vòng van hai lá qua đường ống thông: trong thủ thuật buộc vòng van hai lá (Tau-PNU Medical Co, Ltd., Pusan, Korea), đường vào sử dụng cả tĩnh mạch đùi và tĩnh mạch dưới đòn trái (thông qua một túi tương tự như máy tạo nhịp). Việc buộc vòng van sử dụng một dây hướng dẫn đi vào xoang vành và tĩnh mạch tim lớn, xuyên qua vách liên thất từ tĩnh mạch liên thất trước để vào thất phải, kéo dây từ đường ra thất phải và tạo thành một vòng quanh mặt phẳng vòng van hai lá. Thay dây dẫn bằng một dụng cụ kéo căng có chứa các yếu tố bảo vệ động mạch vành để tránh ép vào mạch vành mà vẫn ép chặt được vòng van hai lá và cải thiện diện đóng của lá van. Dụng cụ khóa sức căng được đặt trong túi dưới đòn bên trái. Thủ thuật thực hiện khi gây mê toàn thân hoặc an thần mức độ trung bình. Nghiên cứu đầu tiên thực hiện trên người đã được tiến hành trên 5 bệnh nhân, và thành công trong 4/5 ca nhưng phải hủy 1 ca vì giải phẫu không thích hợp. Dụng cụ này giúp giảm ngay mức độ hở van hai lá và duy trì cho đến 6 tháng và cũng giảm thể tích nhĩ trái và thất trái theo thời gian. Biến chứng liên quan đến dụng cụ gồm tắc động mạch vành, block nhánh mới và phải thực hiện thủ thuật định vị lại. Khi đang có rất nhiều đột phá trong lĩnh vực sửa vòng van hai lá gián tiếp để giảm mức độ hở van hai lá, giải phẫu xoang vành và các nhánh tĩnh mạch có vẻ đóng vai trò lớn làm hạn chế tính khả thi của một số thủ thuật áp dụng ở một tỉ lệ đáng kể bệnh nhân cần điều trị.
Bảng 41.10. Các kỹ thuật trong sửa van hai lá qua đường ống thông đang được phát triển
| DỤNG CỤ | ĐƯỜNG VÀO | CHỌC VÁCH | SINH BỆNH HỌC HỞ VAN HAI LÁ | CƠ CHẾ |
|---|---|---|---|---|
Sửa van kẹp clip bờ-bờ MitraClip | Tĩnh mạch đùi Tĩnh mạch đùi | Có Có | Tiên phát, thứ phát Tiên phát, thứ phát | Kẹp clip giữa hai bờ van. Tạo thành hai lỗ van để giảm mức độ hở van |
Sửa vòng van gián tiếp
MVRx ARTO Buộc vòng van hai lá | Tĩnh mạch cổ trong Tĩnh mạch cổ trongvà tĩnhmạch đùi Tĩnh mạch dưới đòn + Tĩnh mạchđùi | Giảm hở van bằng cách giảm vòng van qua xoang vành. Do ở gần động mạch mũ nên có thể biến chứng gây chèn ép động mạch vành | ||
Sửa vòng van trực tiếp Cardioband Mitralign Accucinch (Ventricu- Millipede | Tĩnh mạch đùi Động mạch đùi Động mạch đùi Tĩnh mạch đù | Có Không Không Có | Thứ phát Thứ phát Thứ phát Thứ phát | Trực tiếp gắn và giảm vòng van hai lá để giảm hở van. Có thể đặt vào trong thành thất trái đối với một vài dụng cụ |
Thay dây chằng NeoChord | Qua mỏm tim không có tim phổi nhân tạo | Không | Tiên phát | Gắn vào dây chằng gây sa lá van hoặc rơi lá van để giảm hở van hai lá |
Thay van qua ống thông Sapien-XT | Qua mỏm timkhông có tim phổi Tĩnh mạch đùi | Không Có Có | Tiên phát, thứ phát Rối loạn chức năng van sinh học Tiên phát, thứ phát | Thay van sinh học qua ống thông, có thể là van trong van, van trong vòng van hoặc van trong van tự nhiên để làm giảm hở van hai lá |
8.6 Các dụng cụ sửa vòng van trực tiếp
Cardioband: Dụng cụ Cardioband (Edwards Lifesciences, Irvine, CA) đưa các mỏ neo được khâu trực tiếp quanh vòng van hai lá để kết nối với dụng cụ sửa van. Hệ thống này cho phép điều chỉnh sức ép theo đường kính vách-bên, làm giảm kích thước vòng van và mức độ hở van hai lá. Trong một nghiên cứu đa trung tâm lớn trên 60 bệnh nhân hở van hai lá thứ phát vừa-nhiều được điều trị bằng Cardioband, kết quả sớm đã dấy lên vấn đề về thiết kế của dụng cụ khiến cho dụng cụ được điều chỉnh lại ngay giữa chừng nghiên cứu. Có 10 trường hợp không thể móc mỏ neo dẫn đến 5 bệnh nhân không thể sử dụng dụng cụ nhưng đa số (9/10 ca không móc được mỏ neo) xảy ra trước khi điều chỉnh lại dụng cụ. Không có tử vong liên quan đến dụng cụ và tỉ lệ sống còn sau 1 năm là 87%. Trong khi mức độ hở van hai lá được cải thiện ở đa số bệnh nhân sau 1 năm, vẫn có 1/5 bệnh nhân có mức độ hở nặng lên. Chất lượng cuộc sống, khả năng gắng sức và NYHA đều được cải thiện sau 1 năm so với thời điểm ban đầu ở đa số bệnh nhân. Kết quả sau 2 năm (chưa công bố) tiếp tục cho thấy giảm ổn định các đường kính vách-bên, mức độ nặng của hở van và chất lượng cuộc sống.
Dụng cụ cấy, ống chỉ, và các mỏ neo kim loại.
Hệ thống sửa van Mitralign: Hệ thống Mitralign (Mitralign, Tewksbury, Massachusetts) sử dụng một ống thông có thể uốn xuống đi qua đường đùi vào thất trái và trực tiếp vào vòng van phía sau. Bằng cả dây dẫn và ống thông, các miếng gạc bằng polyester được đặt ngang qua vòng van từ nhĩ trái ở vùng P1/P2, sau đó là P2/P3 nếu cần. Một trong hai cặp gạc được kéo uốn lại, khóa và do đó làm giảm đường kính vòng van. Dụng cụ đang được kiểm chứng về tính khả thi trong một thử nghiệm tiến cứu, đa trung tâm, đơn nhánh với 45 bệnh nhân. Không có tử vong trong thủ thuật hoặc phải chuyển sang phẫu thuật, nhưng tràn dịch màng ngoài tim gây ép tim gặp ở 4 (8%) bệnh nhân. Loại trừ các trường hợp LVEDD < 5 cm và sử dụng hệ thống ống thông thế hệ thứ hai giúp giảm nguy cơ ép tim. Trong 6 tháng, tỉ lệ tử vong do mọi nguyên nhân là 12,2%, 7 (17%) bệnh nhân phải đặt MitraClip và một bệnh nhân phải phẫu thuật van hai lá không cấp cứu. Mức độ hở van hai lá được cải thiện ở 50% bệnh nhân và nặng lên ở 15,4 trường hợp, xu hướng cải thiện gặp ở những ca đặt 2 miếng gạc. Triệu chứng suy tim và nghiệm pháp đi bộ 6 phút cũng được cải thiện sau 6 tháng so với thời điểm ban đầu. Hiện nay dụng cụ chưa được sử dụng trong thương mại.
Các dụng cụ mới hơn: Vòng Millipede IRIS là một vòng van có dạng zigzag nửa cứng, với 8 mỏ neo bằng thép không gỉ hình xoắn ốc được móc trực tiếp vào vòng van hai lá. Dụng cụ có 8 thanh trượt để điều khiển dụng cụ và giảm kích thước vòng Hệ thống
sửa thất AccuCinch (Ancora Heart, Santa Clara, CA) sử dụng cơ chế ngược dòng động mạch để đặt một loạt các mỏ neo có thể điều chỉnh vào thất trái được buộc bằng các dây cáp dưới vòng van hai lá. Dây cáp được thắt lại để giữ chặt thành thất trái, làm giảm kích thước thất trái và do đó giảm kích thước vòng van hai lá, giúp giảm thể tích dòng hở. Không giống các dụng cụ khác trong phần này, hệ thống AccuCinch sửa thất trái hơn là trực tiếp sửa vòng van do nó được đặt trực tiếp và tác động lên nội mô thất trái , do đó dụng cụ này đang được kiểm chứng trong điều trị bệnh nhân suy tim có giãn thất trái nhưng không tổn thương van đáng kể. Các dụng cụ này vẫn đang chờ dữ liệu lâm sàng tiến cứu và các thử nghiệm vẫn đang được tiến hành.
8.7 Thay dây chằng
Neochord là một thủ thuật sửa van hai lá qua đường ống thông sử dụng phẫu thuật không cần tim phổi nhân tạo. Thủ thuật sử dụng dụng cụ đặc biệt chọc vào từ mỏm tim, móc vào lá van bị sa và luồn một dây đặc biệt thay cho dây chằng và neo vào chính thành tim tại vị trí chọc. Thủ thuật làm cần gây mê toàn thân, mở đường vào tối thiểu bên ngực trái, tim vẫn đập. Một số nghiên cứu về tính an toàn và hiệu quả của hệ thống trong giảm mức độ hở van hai lá đã được công bố. Một dụng cụ tương tự là hệ thống sửa van hai lá Harpoon, trong đó dây chằng nhân tạo được móc vào lá van để thay cho dây chằng tự nhiên qua phẫu thuật không tim phổi nhân tạo qua mỏm tim và kĩ thuật ống thông.
Thay dây chằng được sử dụng thường xuyên hơn trong điều trị bệnh van hai lá do thoái hóa và hiện nay chưa có hệ thống qua đường tĩnh mạch hay động mạch nào tương tự các kĩ thuật này.
8.8 Thay van hai lá qua đường ống thông
Không giống như thay van động mạch chủ qua đường ống thông, thay van hai lá qua đường ống thông vãn là một thách thức rất lớn do cấu trúc đặc biệt của van hai lá. Đã có một vài nghiên cứu chứng minh tính khả thi của việc thay van hai lá qua da sử dụng van sinh học để điều trị các trường hợp hở van hai lá có triệu chứng mà nguy cơ phẫu thuật cao. Những van mới qua đường ống thông này đa số đều được có đường vào qua phẫu thuật xâm lấn tối thiểu qua mỏm tim nhưng những dữ liệu gần đây đã hé mở các hệ thống qua da đi theo đường xuyên vách. Chúng tôi tập trung vào hệ thống thay van qua da. Khi càng có nhiều dữ liệu về tính khả thi, những kết quả này cho thấy các hệ thống có thể giảm mức độ hở van hai lá và cải thiện triệu chứng với tỉ lệ tử vong sớm có thể chấp nhận được trong quần thể bệnh nhân có nguy cơ tử vong cao. Những khó khăn vẫn còn tồn tại bao gồm giải phẫu phức tạp của van hai lá, đường ra thất trái quá gần, canxi hóa vòng van hai lá, hệ thống thả van quá lớn và kích thước van, huyết khối trong dụng cụ, và tình trạng tan máu cùng với các biến chứng của đường vào qua mỏm tim.
Bổ sung những bước tiến đáng kể đã đạt được trong thay van động mạch chủ, các kĩ thuật cần thiết để thay van hai lá qua đường ống thông đang được cải thiện nhanh chóng. Van SAPIEN-XT (Edwards Lifesciences, Irvine, CA) và Melody (Medtronic, Minneapolis, MN) đã cho thấy những thành công tuyệt vời khi thay van trong van và van trong vòng van ở vị trí van hai lá nhưng không được khuyến cáo điều trị hở van hai lá ở van tự nhiên. Việc thay van sinh học qua đường vào động mạch gặp khó khăn chủ yếu do kích thước hệ thống van quá lớn ở vị trí van hai lá, vòng van di động dạng chữ D và thiếu các bộ phận hỗ trợ từ vòng van hai lá tự nhiên. Trong khi các dữ liệu lâm sàng còn ít, thay van hai lá qua da ở van tự nhiên đã được thực hiện thành công ở một số ca. Van CardiaAQ (CardiAQ Valve Technologies, Inc. Winchester, MA) có các lá van làm từ màng ngoài tim của lợn trên một giá đỡ tự nở làm bằng nitinol. Loại van này đã được thay qua đường chọc vách ở một bệnh nhân 86 tuổi có nguy cơ phẫu thuật cao và giúp cải thiện hở van hai lá. Bốn đường vào riêng biệt qua đường mạch máu đã được sử dụng, 2 từ động mạch đùi và 2 từ tĩnh mạch đùi để tạo điều kiện thực hiện các kĩ thuật phức tạp với nhiều loại ống thông và hệ thống thả van. Sau đó bệnh nhân đã tử vong trong ngày thứ 3 sau thủ thuật do biến chứng không liên quan đến dụng cụ. Trong một nghiên cứu đầu tiên về loại van này, nghiên cứu PRELUDE đánh giá tính khả thi khi thay van qua đường đùi và chọc vách của van Caisson (LivaNova, Maplegrove, MN) ở người.
Trong khi các kết quả vẫn chưa được công bố, những tuyên bố từ công ty cho thấy những kết quả rất đáng khích lệ với tình trạng van hoạt động ổn định và cải thiện chất lượng cuộc sống của bệnh nhân sau khi thay van. Thử nghiệm lâm sàng INTERLUDE CE-Mark đã được khởi động để đánh giá dụng cụ này ở các bệnh viện tại Bắc Mĩ và châu Âu. Trong một nghiên cứu đầu tiên trên người, 10 bệnh nhân được thay van hai lá qua da sử dụng đường vào chọc vách điều trị hở van hai lá nhiều với các sinh bệnh học khác nhau (4 ca thoái hóa, 4 ca chức năng, 2 ca kết hợp hai nguyên nhân) và nguy cơ phẫu thuật cao. Hệ thống thả van bao gồm một bộ phận bằng nitinol bao quanh dây chằng, và một van sinh học nở bằng bơm bóng. Dụng cụ này đã được thay thành công ở 9 trong 10 bệnh nhân. hở van hai lá tồn lưu đa số là rất nhẹ (≤ 1+) ở cả 9 bệnh nhân được thay van với chênh áp qua van tối thiểu. Sau 30 ngày, không có tử vong, đột quỵ, nhồi máu cơ tim, tái nhập viện, tắc đường ra thất trái, di động dụng cụ, thuyên tắc, hay phải chuyển sang phẫu thuật van hai lá. Biến chứng được báo cáo gồm một ca tràn dịch màng ngoài tim khiến không thể thay van và một ca có hở cạnh van sau đó đã đóng bằng dụng cụ qua da.
Hiện tại một vài công ty vẫn đang phát triển các hệ thống thay van hai lá sinh học qua da, xu hướng trong 5 năm tới sẽ thấy được nhiều tiến bộ nhanh chóng trong lĩnh vực thay van hai lá qua da và sẽ có nhiều dữ liệu trên người từ các nghiên cứu đang tiến hành. Trong thập kỉ tới, rõ ràng chúng ta sẽ thấy được các nghiên cứu ở nhóm nguy cơ phẫu thuật thấp – trung bình khi các kĩ thuật qua đường ống thông càng ngày càng phát triển và đạt được nhiều thành công lớn hơn.
9 Theo dõi sau can thiệp
9.1 Theo dõi bệnh nhân sau can thiệp
Bệnh nhân được theo dõi các dấu hiệu lâm sàng sau khi kết thúc thủ thuật (nhịp tim, huyết áp …), nhằm phát hiện các tai biến như chảy máu, tụ máu vị trí chọc mạch, tràn máu màng tim, hở van hai lá tiến triển.
Dự phòng viêm nội tâm mạc nhiễm khuẩn nếu có hở van hai lá hoặc van động mạch chủ từ vừa đến nhiều.
Uống aspirin 100 – 325 mg/ngày trong 6-12 tháng và clopidogrel 75mg hàng ngày trong 30 ngày đầu.
9.2 Theo dõi bệnh nhân lâu dài
Bệnh nhân được khám lâm sàng và siêu âm Doppler tim sau nong van và tái khám theo định kỳ (1 tháng, 3 tháng, 6 tháng và 1 năm sau khi can thiệp).
Khi tái khám định kỳ bệnh nhân được khám lâm sàng, làm điện tâm đồ và siêu âm
10 Tài liệu tham khảo
1. Witte KK, Lipiecki J, Siminiak T, et al. The REDUCE FMR trial: a randomised sham-controlled study of percutaneous mitral annuloplasty in functional mitral regurgitation. JACC Heart Fail 2019;7:945–55.
2. Lipiecki J, Kaye DM, Witte KK, et al. Long-term survival following transcatheter mitral valve repair: pooled analysis of prospective trials with the Carillon device. Cardiovasc Revasc Med 2020;21:712–6.
3. Rogers JH, Thomas M, Morice M-C, et Treatment of heart failure with associated functional mitral regurgitation using the ARTO system: initial results of the first-in-human MAVERIC trial (mitral valve repair clinical trial). JACC Cardiovasc Interv 2015;8:1095–104.
4. Erglis A, Thomas M, Morice M-C, et The ARTO transcatheter mitral valve repair system. EuroIntervention 2015;11 Suppl W:W47–8.
5. Erglis A, Narbute I, Poupineau M, et Treatment of secondary mitral regurgitation in chronic heart failure. J Am Coll Cardiol 2017;70:2834–5.
6. De Backer O, Wong I, Taramasso M, Maisano F, Franzen O, Søndergaard L. Transcatheter mitral valve repair: an overview of current and future devices. Open Heart. 2021 Apr;8(1):e001564.
7. Noack T, Kiefer P, Besler C, Lurz P, Leontyev S, Abdel-Wahab M, Holzhey DM, Seeburger J. Transcatheter mitral valve repair: review of current techniques. Indian J Thorac Cardiovasc Surg. 2020 Jan;36(Suppl 1):53-63.
8. Fiorilli PN, Herrmann HC, Szeto Transcatheter mitral valve replacement: latest advances and future directions. Ann Cardiothorac Surg. 2021 Jan;10(1):85-95.
9. Ramlawi B, Skiles J, Myers D, Ali O, Viens C. Transcatheter mitral repair: MitraClip technique. Ann Cardiothorac Surg. 2018 Nov;7(6): 824-826.
10. Demir OM, Bolland M, Curio J, Søndergaard L, Rodés-Cabau J, Redwood S, Prendergast B, Colombo A, Chau M, Latib A. Transcatheter Mitral Valve Replacement: Current Evidence and Interv Cardiol. 2021 May 1;16:e07.
11. Xiling Z, Puehler T, Sondergaard L, Frank D, Seoudy H, Mohammad B, Müller OJ, Sellers S, Meier D, Sathananthan J, Lutter G. Transcatheter Mitral Valve Repair or Replacement: Competitive or Complementary? J Clin 2022 Jun 13;11(12):3377.

