Sử dụng siêu âm để hỗ trợ quyết định truyền dịch trong lâm sàng ở bệnh nhân nặng như thế nào?
Oliver Hunsicker, Filippo Sanfilippo and Pieter R. Tuinman
Người Dịch: BS Nguyễn Thanh Tuấn – Khoa ICU Bệnh viện Hữu Nghị Đa Khoa Nghệ An
Xem và tải PDF tại đây
Truyền dịch là 1 can thiệp quan trọng phổ biến trong chăm sóc tích cực, và dịch nên được xem như thuốc với các chỉ định cụ thể. [1]. Thông thường, mục đích của liệu pháp dịch tập trung chủ yếu vào tăng cung lượng tim. Tuy nhiên, truyền dịch có thể có các tác hại, như sung huyết phổi, phù nề mô kẽ các tạng, làm rối loạn chức năng cơ quan nặng hơn. Trong bối cảnh này, siêu âm trong chăm sóc tích cực (critical care ultrasound - CCUS) giúp đánh giá lợi ích và nguy cơ của truyền dịch. Chúng tôi mô tả việc sử dụng CCUS để hỗ trợ các quyết định lâm sàng liên quan đến việc truyền dịch, tập trung chủ yếu vào giai đoạn tối ưu hóa và ổn định của bệnh nhân nặng.
1 Một khuôn khổ cho việc ra quyết định truyền dịch trên lâm sàng
Nên cân nhắc liệu pháp truyền dịch khi có dấu hiệu giảm tưới máu mô. Trong bối cảnh đó, CCUS cung cấp 3 công cụ chính - siêu âm tim chăm sóc đặc biệt (CCE), siêu âm phổi (LUS) và siêu âm sung huyết tĩnh mach (VExUS) - những thứ mà khi kết hợp có thể giúp trả lời những câu hỏi quan trọng về lợi ích và nguy cơ của truyền dịch Một phương pháp tiếp cận toàn diện từng bước để đưa ra quyết định lâm sàng được cung cấp (hình. 1):
1.1 Có dấu hiệu giảm thể tích rõ rệt hay không?
CCE cho phép đánh giá nhanh tình trạng giảm thể tích rõ rệt (thậm chí bằng mắt) bằng cách đánh giá thể tích cuối tâm trương và chức năng tâm thu thất trái (LV)
Khi không có mặt giãn thất phải (RV), diện tích cuối tâm trương LV (LVEDA) < 10 cm2 ở mặt cắt cạnh ức trục ngắn (hoặc dưới sườn) ở mức độ cơ nhú cùng với sự xóa bỏ thể tích cuối tâm thu (2 thành thất hôn nhau - “kissing walls”) chỉ điểm mạnh mẽ cho tình trạng giảm thể tích [2]. LVEDA có thể giúp phân biệt giữa tình trạng giảm thể tích (LVEDA giảm) với giãn mạch (LVEDA bình thường). Ngoài ra, giảm thể tích rõ rệt có thể xác nhận khi đường kính tĩnh mạch chủ dưới cuối thì thở ra (IVCee) ≤ 10 mm[3]. CCE nâng cao có thể phát hiện tắc nghẽn đường ra thất trái (LVOT) ở 1 vài bệnh nhân giảm thể tích rõ rệt [4]. Ở những trường hợp giảm thể tích rõ rệt và đe dọa suy sụp huyết động, nên truyền dịch ngay lập tức để khôi phục tưới máu mà không trì hoãn đánh giá nguy cơ truyền dịch hoặc các test đáp ứng truyền dịch.
1.2 Có dấu hiệu của bệnh lý tim nghiêm trọng không?
Ở những bệnh nhân không có tình trạng giảm thể tích rõ rệt, CCE cho phép sàng lọc những vấn đề tim mạch liên quan với tăng nguy cơ phù phổi hoặc sung huyết hệ thống, ví dụ giãn thất phải RV (tỉ số RV/LV cuối tâm trương > 0.6), bệnh van tim nặng, hoặc tăng áp lực đổ đầy LV (LVFP). Với CCE cơ bản, LVEF giảm nặng thường cho thấy tăng LVFP. Phì đại nhĩ trái và vách liên nhĩ cong về bên phải cố định gợi ý mạnh mẽ tình trạng LVFP tăng cao mãn tính, nếu loại trừ tình trạng như rối loạn nhịp nhĩ hoặc bệnh van 2 lá. Bằng cách sử dụng CCE nâng cao, Doppler thông thường và mô ở mức van hai lá cung cấp các phép đo bán LVFP định lượng. “Luật 8”, có nghĩa là tỷ lệ của vận tốc dòng chảy sớm qua van hai lá so với vận tốc sóng chuyển động trong cơ tim vào giai đoạn sớm của thì tâm trương (E/e’)>8 và/hoặc e’ ≤ 8 cm/s, có thể giúp xác định bệnh nhân nào có thể tăng LVFP [5]. Tỉ lệ vận tốc dòng chảy qua van 2 lá sớm/muộn (E/A)> 1.8 thường xác nhận LVFP tăng cao với độ đặc hiệu cao [6].
1.3 Có dấu hiệu sung huyết phổi hay không?
LUS cho phép đánh giá sâu hơn nguy cơ sung huyết phổi [7]. Kiểu hình A-profile 2 bên (< 3 B-lines/mỗi trường siêu âm), cho thấy LVFP thấp với mức độ chắc chắn cao. Trong trường hợp này, nếu truyền dịch, nguy cơ sung huyết phổi sẽ thấp. Ngược lại, trong trường hợp kiểu hình B-profile 2 bên (≥ 3 B-lines), khoảng giá trị LVFP mong đợi có thể rộng hơn [8]. Sự phân bố kiểu hình B-profile đồng nhất với đường màng phổi trơn tru gợi ý phù phổi thủy tĩnh, trong khi sự phân bố không đồng nhất với các bất thường về màng phổi gợi ý phù phổi do tăng tính thấm. [9]. Do đó, kiểu hình B – profile phân bố không đồng nhất 2 bên và đường màng phổi bất thường, mặc dù không đưa ra kết luận về nhu cầu truyền dịch, nhưng lại cho thấy nguy cơ gây phù nề tăng thêm sau khi truyền dịch. Ngoài ra, cần xem xét tràn dịch màng phổi 2 bên mức độ trung bình - nhiều trước khi truyền dịch, vì nó có liên quan đến LVFP cao hơn ở những bệnh nhân có LVEF giảm. [10].
1.4 Có dấu hiệu sung huyết hệ thống hay không?
VExUS là một công cụ mới nổi để xác định và định lượng tình trạng sung huyết tĩnh mạch toàn thân, một dấu hiệu thay thế cho tình trạng tăng hậu gánh các cơ quan - thứ có thể làm suy giảm chức năng cơ quan do giảm tưới máu mô [11]. Trong trường hợp IVCee ≥ 20 mm, ít nhất 2 trong số các dấu hiệu sau đây gợi ý nguy cơ cao bị sung huyết toàn thân: Sự đảo ngược áp lực trong thì tâm thu ở tĩnh mạch gan, sự biến thiên > 50% trong chu kỳ tim ở tĩnh mạch cửa, hoặc sự ngừng áp lực khi chỉ thấy pha tâm trương ở tĩnh mạch thận. Vì VExUS ghi lại sự tương tác động giữa áp lực tĩnh mạch thượng nguồn và áp lực nhĩ phải, nó có thể giúp việc quản lý dịch được cá thể hóa hơn. Mặc dù chưa có bằng chứng thuyết phục, việc tích hợp VExUS vào quá trình ra quyết định lâm sàng có thể cung cấp thêm thông tin chi tiết mà không gây hại rõ ràng khi được sử dụng một cách thận trọng.
1.5 Hiệu quả mong đợi của bolus dịch là gì?
Sau khi loại trừ tình trạng giảm thể tích máu rõ ràng, và đánh giá sự hiện diện của các tình trạng có thể cần thận trọng khi truyền dịch (bệnh lý thất trái hoặc thất phải, tình trạng sung huyết phổi và/hoặc toàn thân), các nhà lâm sàng nên cân nhắc hiệu quả của việc bolus dịch bằng việc đáp ứng truyền dịch, thay vì tuân thủ cứng nhắc các ngưỡng đã công bố với từng tham số. sự thay đổi tích phân vận tốc - thời gian (VTI) của LVOT phản ánh trực tiếp những thay đổi về thể tích nhát bóp và có thể được sử dụng trong nhiều test chức năng khác nhau để đánh giá hiệu quả dự kiến của một lần bolus dịch. Về vấn đề này, mức độ tăng LVOT-VTI trong test nâng chân thụ động (PLR) có thể phản ánh trực tiếp hiệu quả dự kiến của việc truyền dịch. Một cách khác, tổng các thay đổi tuyệt đối của LVOT-VTI trong khi thực hiện kết hợp test tắc nghẽn cuối thì hít vào và tắc nghẽn cuối thì thở ra liên tiếp [12, 13], hoặc biến thiên Tĩnh mạch chủ trên theo hô hấp, là những phương án thay thế hợp lệ để dự đoán hiệu quả của bolus dịch [14]
2 Tích hợp lâm sàng
CCUS có thể giúp bác sĩ lâm sàng chăm sóc tích cực cân bằng tốt hơn lợi ích và nguy cơ của liệu pháp dịch nhờ giải quyết các câu hỏi lâm sàng quan trọng theo 1 cấu trúc. Ở những bệnh nhân không có dấu hiệu rối loạn chức năng tâm thu nặng nề, tăng LVFP, hoặc sung huyết, truyền dịch thường an toàn nếu chỉ định. Tuy nhiên, trong trường hợp có những dấu hiệu này, quyết định truyền dịch cần phải tính đến cả tác hại tiềm ẩn và lợi ích có thể có khi bolus dịch, không chỉ xem xét khái niệm cổ điển về khả năng đáp ứng dịch theo ngưỡng cố định. Thực tế, các quyết định sử dụng dịch phải xem xét toàn bộ bối cảnh lâm sàng của bệnh nhân.
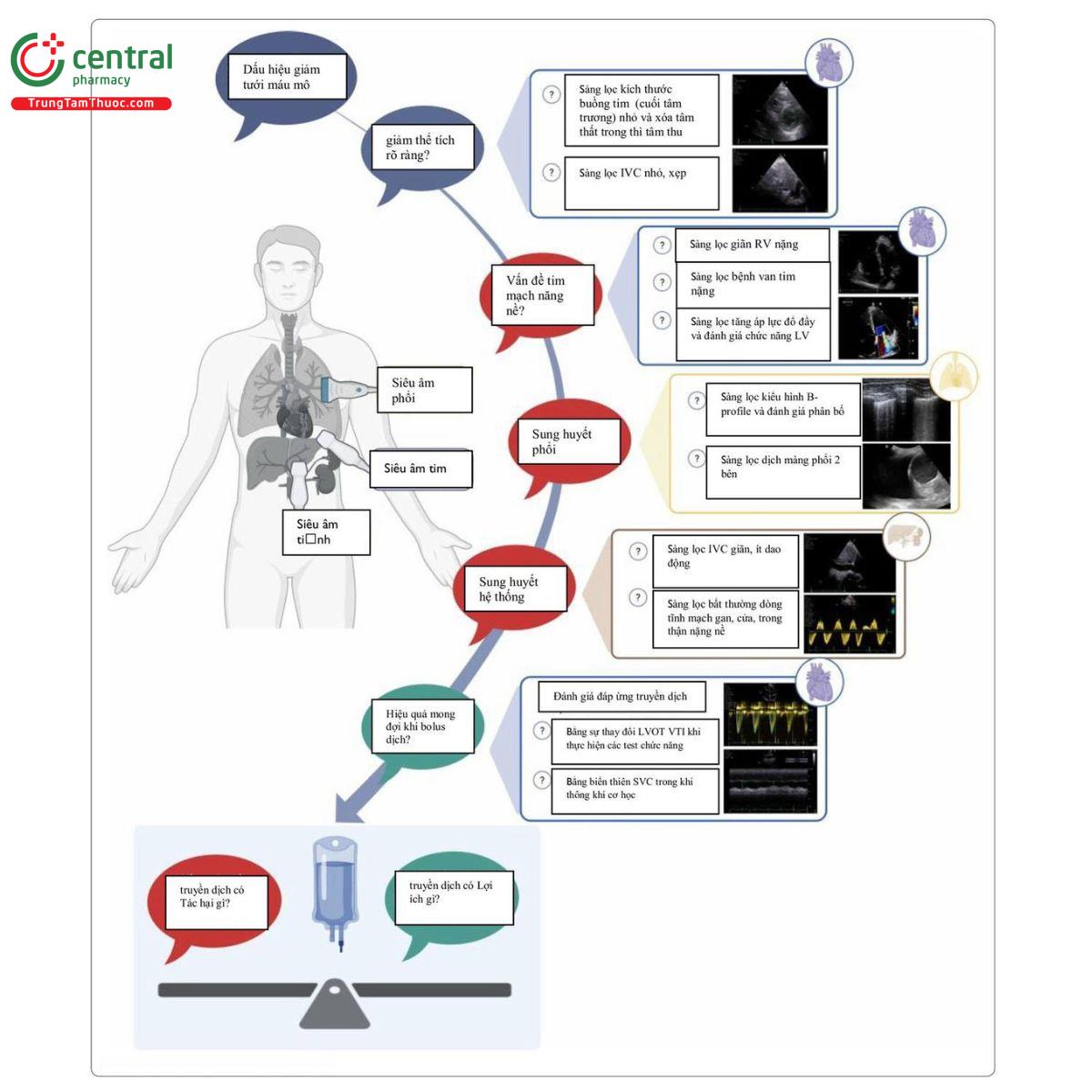
Hình 1. Một phương pháp tiếp cận toàn diện từng bước về việc sử dụng siêu âm chăm sóc tích cực (CCUS) để hỗ trợ các quyết định lâm sàng liên quan đến việc truyền dịch. Truyền dịch tĩnh mạch chỉ nên được xem xét như một lựa chọn điều trị khi có dấu hiệu giảm tưới máu mô. CCUS được sử dụng để trả lời các câu hỏi lâm sàng (ô thoại). Nếu không có tình trạng giảm thể tích máu rõ ràng, các câu hỏi lâm sàng về đánh giá rủi ro (ô thoại màu đỏ) và lợi ích tiềm năng của truyền dịch (ô thoại màu xanh lá cây) sẽ được trả lời. Sau đó, cần cân nhắc các rủi ro tiềm ẩn so với lợi ích tiềm năng để hỗ trợ việc ra quyết định lâm sàng liên quan đến truyền dịch ở bệnh nhân nguy kịch tại giường bệnh. *Lưu ý, nên lấy giá trị trung bình ít nhất 3 lần đo LVOT-VTI trước và sau các test như PLR để đảm bảo đủ chính xác [15]. Trong trường hợp không có cửa sổ mỏm tim đầy đủ, VTI thu thập từ đường ra thất phải (RVOT-VTI) dưới mặt cắt cạnh ức trục ngắn cải tiến (hoặc cuối cùng là mặt cắt dưới sườn cải tiến) có thể là một phương pháp thay thế để đánh giá hiệu quả tăng SV dự kiến của bolus dịch.
IVC, tĩnh mạch chủ dưới; LV, thất trái; LVOT, đường ra thất trái; RV, thất phải; VTI, tích phân vận tốc - thời gian.
Created in BioRender. Hunsicker, O. (2025) htps;//BioRender.com/fefeSx7
3 Author details
1Department of Anaesthesiology and Intensive Care Medicine CCM/CVK, Charité Universitätsmedizin Berlin, corporate member of Freie Universität Berlin and Humboldt-Universität zu Berlin, Berlin, Germany. 2 Department of Surgery and Medical-Surgical Specialties, Section of Anesthesia and Inten- sive Care, University of Catania, Catania, Italy. 3 Department of Intensive Care Medicine, Amsterdam University Medical Centre, Amsterdam, The Nether- lands. Amsterdam Cardiovascular Sciences Research Institute, Amsterdam University Medical Centre, Amsterdam, The Netherlands. 5 Amsterdam Insti- tute for Immunology and Infectious Diseases, Amsterdam, The Netherlands.
Funding
Open Access funding enabled and organized by Projekt DEAL.
Declarations
Conhicts of interest
The authors have no conhict of interest.
Open Access
This article is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License, which permits any non-commercial use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made. The images or other third party material in this article are included in the article's Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article's Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder. To view a copy of this licence, visit http://creativecommons.org/ licenses/by-nc/4.0/.
4 Publisher's Note
Springer Nature remains neutral with regard to jurisdictional claims in pub- lished maps and institutional affiliations.
Received: 26 July 2025 Accepted: 11 August 2025 Published online: 25 August 2025
References
1.Malbrain M, Van Regenmortel N, Saugel B et al (2018) Principles of huid management and stewardship in septic shock: it is time to consider the four D's and the four phases of huid therapy. Ann Intensive Care 8(1):66. https://doi.org/10.1186/s13613-018-0402-x
2.De Backer D, Aissaoui N, Cecconi M et al (2022) How can assessing hemo- dynamics help to assess volume status? Intensive Care Med 48(10):1482- 1494. https://doi.org/10.1007/s00134-022-06808-9
3.Vieillard-Baron A, Evrard B, Repesse X et al (2018) Limited value of end-expiratory inferior vena cava diameter to predict huid responsiveness impact of intra-abdominal pressure. Intensive Care Med 44(2):197-203.https://doi.org/10.1007/s00134-018-5067-2
4.Slama M, Tribouilloy C, Maizel J (2016) Left ventricular outhow tract obstruction in ICU patients. Curr Opin Crit Care 22(3):260–266. https://doi. org/10.1097/MCC.0000000000000304
5.Bowcock EM, McLean A (2022) Bedside assessment of left atrial pressure in critical care: a multifaceted gem. Crit Care 26(1):247. https://doi.org/10. 1186/s13054-022-04115-9
6.Mercado P, Maizel J, Marc J et al (2021) Doppler echocardiographic indi-ces are specific but not sensitive to predict pulmonary artery occlusion pressure in critically ill patients under mechanical ventilation. Crit Care Med 49(1):e1-e10.https://doi.org/10.1097/CCM.0000000000004702
7.Winkler MH, Touw HR, van de Ven PM, Twisk J, Tuinman PR (2018) Diagnostic accuracy of chest radiograph, and when concomitantly studiedlung ultrasound, in critically Ill patients with respiratory symptoms: a systematic review and meta-analysis. Crit Care Med 46(7):e707-e714. https://doi.org/10.1097/CCM.0000000000003129
8.Lichtenstein DA, Meziere GA, Lagoueyte JF, Biderman P, Goldstein I, Gepner A (2009) A-lines and B-lines: lung ultrasound as a bedside tool for predicting pulmonary artery occlusion pressure in the critically ill. Chest 136(4):1014–1020. https://doi.org/10.1378/chest.09-0001
9.Heldeweg MLA, Smit MR, Kramer-Elliott SR et al (2022) Lung ultrasound signs to diagnose and discriminate interstitial syndromes in ICU patients: a diagnostic accuracy study in two cohorts. Crit Care Med 50(11):1607- 1617. https://doi.org/10.1097/CCM.0000000000005620
10. Glargaard S, Deis T, Abild-Nielsen AG et al (2024) Pleural effusion and invasive hemodynamic measurements in advanced heart failure. Circ Heart Fail 17(9):e011253. https://doi.org/10.1161/CIRCHEARTFAILURE.123. 011253
11. Rola P, Haycock K, Spiegel R, Beaubien-Souligny W, Denault A (2024) VEXUS: common misconceptions, clinical use and future directions. Ultrasound J 16(1):49. https://doi.org/10.1186/s13089- 024-00395-0
12. Jozwiak M, Depret F, Teboul JL et al (2017) Predicting huid responsivenessin critically Ill patients by using combined end-expiratory and end-inspir-atory occlusions with echocardiography. Crit Care Med 45(11):e1131-e1138. https://doi.org/10.1097/CCM.0000000000002704 13. Monnet X, De Backer D, Pinsky MR (2025) Using the ventilator to predict huid responsiveness. Intensive Care Med 51(1):150-153. https://doi.org/ 10.1007/s00134-024-07708-w
14. Vignon P, Repesse X, Begot E et al (2017) Comparison of echocar- diographic indices used to predict huid responsiveness in ventilated patients. Am J Respir Crit Care Med 195(8):1022-1032. https://doi.org/10. 1164/rccm.201604-0844OC
15. Jozwiak M, Mercado P, Teboul JL et al (2019) What is the lowest change in cardiac output that transthoracic echocardiography can detect? Crit Care 23(1):116. https://doi.org/10.1186/s13054-019-2413-x

