Siêu âm tim trong tim mạch can thiệp - Hướng dẫn cho phẫu thuật
Nguồn: Sách Tim mạch can thiệp
Chủ biên
PGS.TS.BS.Phạm Mạnh Hùng
Tác giả
ThS.BSNT.Phạm Tuấn Việt
TS.BSNT.Đỗ Kim Bảng
PGS.TS.BS.Phạm Mạnh Hùng
TS.BSNT.Nguyễn Minh Hùng
ThS.BSNT.Nguyễn Đỗ Quân
TS.BS.Nguyễn Thị Thu Hoài
Siêu âm tim trong tim mạch can thiệp giúp tăng tỷ lệ thành công trong phẫu thuật tim mạch. Siêu âm tim bao gồm những gì? Hãy cùng Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) tìm hiểu trong bài viết sau đây.
Đại cương
Trong hơn hai thập niên vừa qua, các kỹ thuật can thiệp tim mạch qua đường ống thông có sự phát triển mạnh mẽ và mở rộng sang nhóm bệnh lý tim cấu trúc. Nhờ đó, nhiều bệnh nhân có chỉ định phẫu thuật tim mở có thể được điều trị một cách ít xâm lấn hơn bằng cách can thiệp qua da tại đơn vị can thiệp tim mạch. Sự phát triển nhanh chóng của can thiệp tim mạch ngoài can thiệp mạch vành xuất phát từ tiến bộ của các kỹ thuật, dụng cụ can thiệp, kỹ năng của bác sĩ can thiệp và đặc biệt là những bước tiến trong chẩn đoán hình ảnh tim mạch bao gồm siêu âm tim.
Một cách kinh điển, các thủ thuật can thiệp tim mạch được thực hiện dưới hướng dẫn của màn huỳnh quang tăng sáng. Ưu điểm của kỹ thuật này là khả năng thể hiện rõ hình ảnh của các dụng cụ cản quang như dây dẫn, catheter và dụng cụ can thiệp, giúp bác sĩ can thiệp có thể điều khiển, định vị dụng cụ chính xác. Tuy nhiên, chiếu huỳnh quang có một số nhược điểm không thể tránh khỏi, bao gồm: (1) hình chiếu trên màn huỳnh quang chỉ là hình ảnh 2D của cấu trúc tim 3D phức tạp; (2) không thể hiện được hình ảnh chính xác của mô mềm và các cấu trúc tim đích cần can thiệp (VD: van hai lá, van động mạch chủ, tiểu nhĩ trái); (3) phơi nhiễm với tia X; và (4) phải sử dụng thuốc cản quang tiêm tĩnh mạch.
Với sự phát triển của khoa học công nghệ, nhiều kỹ thuật chẩn đoán hình ảnh ra đời như chụp cắt lớp vi tính, chụp cộng hưởng từ tim không chỉ giúp chẩn đoán chính xác bệnh tim cấu trúc mà còn cung cấp những thông tin quan trọng để lựa chọn bệnh nhân, lên kế hoạch can thiệp và hướng dẫn trong can thiệp. Mặc dù không phải là kỹ thuật đi đầu về công nghệ, siêu âm tim vẫn là lựa chọn đầu tay để hướng dẫn trong can thiệp bệnh lý tim cấu trúc bởi nhiều ưu điểm vượt trội so với các phương tiện chẩn đoán hình ảnh khác hiện đại hơn. Thật vậy, siêu âm tim có tính cơ động cao, có thể thực hiện tại giường và thực hiện nhiều lần với chi phí không tốn kém, không phơi nhiễm với tia X, không cần tiêm thuốc cản quang chứa iod hoặc Gadolinium với khả năng cung cấp hình ảnh giải phẫu và sinh lý tim theo thời gian thực – một điểm bổ sung quan trọng với hình chiếu huỳnh quang. Đặc biệt, kỹ thuật siêu âm tim 3D thời gian thực ra đời đã trở thành công cụ đắc lực hướng dẫn trong quá trình can thiệp, đánh giá hiệu quả sau can thiệp cũng như phát hiện sớm biến chứng.
Nhiều nghiên cứu cho thấy tính an toàn, tỷ lệ thành công và biến cố của thủ thuật được cải thiện một cách có ý nghĩa dưới hướng dẫn của siêu âm tim trong khi thời gian làm can thiệp và thời gian chiếu tia được rút ngắn.
Siêu âm tim qua thành ngực (2D hoặc 3D), siêu âm tim qua thực quản (2D hoặc 3D) và siêu âm tim với đầu dò trong buồng tim (ICE) là những kỹ thuật siêu âm tim đã và đang được sử dụng để hướng dẫn trong phẫu thuật hoặc can thiệp tim mạch trên thế giới. Nội dung của chương này giới thiệu tới bạn đọc những điểm cơ bản của các kỹ thuật siêu âm tim nói trên, ưu điểm và nhược điểm của từng kỹ thuật cũng như vai trò của chúng trong một số can thiệp bệnh tim cấu trúc tiêu biểu.
1 Các kỹ thuật siêu âm tim hỗ trợ trong can thiệp tim mạch
1.1 Các kỹ thuật siêu âm tim truyền thống
1.1.1 Siêu âm tim qua thành ngực 2D (2D-TTE)
Siêu âm tim qua thành ngực 2D là kỹ thuật siêu âm tim cơ bản nhất trong thăm dò hình ảnh tim mạch. Đầu dò siêu âm tim qua thành ngực 2D được sử dụng chủ yếu hiện nay là đầu dò rẻ quạt điện tử (phased-array) với các mode siêu âm tim cơ bản: M-mode, 2D (B-mode) và siêu âm doppler (doppler xung, doppler liên tục, doppler màu và doppler mô cơ tim).
Ưu điểm của siêu âm tim qua thành ngực 2D bao gồm:
- Không xâm lấn.
- Không có chống chỉ định.
- Tính khả dụng
- Cơ động, có thể thực hiện tại giường bệnh hoặc tại phòng can thiệp.
- Có thể làm lại nhiều lần.
- Chi phí không tốn kém.
- Không phơi nhiễm với tia X.
Tuy nhiên, nhược điểm của siêu âm tim qua thành ngực 2D là khả năng thăm dò hình ảnh hạn chế nếu chất lượng hình ảnh siêu âm không tối ưu (bệnh nhân béo, bị bệnh phổi kèm theo, bệnh nhân thở máy), hạn chế đánh giá chi tiết các cấu trúc nhỏ như các van tim, tiểu nhĩ trái… đặc biệt ở bệnh nhân người lớn.

Dựa trên các thế mạnh và nhược điểm của siêu âm tim qua thành ngực 2D, kỹ thuật này được chỉ định một cách thường quy trước các can thiệp tim mạch để bước đầu đánh giá bệnh lý tim cấu trúc, ảnh hưởng huyết động của các bệnh lý trên và chức năng tim. Tuy nhiên, để lên kế hoạch can thiệp và lựa chọn bệnh nhân, cần chỉ định các thăm dò hình ảnh tim mạch chuyên sâu hơn như siêu âm tim qua thực quản 2D/3D, cắt lớp vi tính đa dãy đầu dò (MSCT) hoặc cộng hưởng từ (MRI) tim để đánh giá chi tiết cấu trúc giải phẫu cần can thiệp.
Trong hướng dẫn can thiệp các bệnh lý tim cấu trúc, hiện nay siêu âm tim qua thành ngực 2D vẫn được sử dụng trong can thiệp làm mỏng vách liên thất bằng cồn, thay van động mạch chủ qua da (Transcatheter Aortic Valve Implantation hay TAVI), nong van hai lá bằng bóng qua da hoặc sinh thiết cơ tim. Tuy nhiên, các mặt cắt siêu âm 2D qua thành ngực hạn chế khả năng theo dõi vị trí và đường đi của dây dẫn, catheter và dụng cụ can thiệp. Dù hình ảnh siêu âm tim có chất lượng tốt, bản chất hình ảnh 2D chỉ là các lát cắt mỏng qua cấu trúc tim nên các catheter, dây dẫn hoặc dụng cụ can thiệp có thể xuất hiện một phần hoặc đi ra ngoài mặt phẳng đang khảo sát. Vai trò của siêu âm tim qua thành ngực 2D trong can thiệp chủ yếu để đánh giá hiệu quả tức thời ngay sau can thiệp (VD: vị trí của dụng cụ bít thông liên nhĩ và shunt tồn lưu sau khi thả dụng cụ, vị trí của van động mạch chủ sinh học trong TAVI và mức độ hở cạnh van) và phát hiện sớm các biến chứng nguy hiểm như tràn dịch màng ngoài tim, hở van tim cấp.
Sau can thiệp, siêu âm tim qua thành ngực 2D được chỉ định thường quy để theo dõi định kỳ dài hạn cho bệnh nhân.
1.1.2 Siêu âm tim qua thực quản 2D (2D-TEE)
Siêu âm tim qua thực quản 2D là kỹ thuật ghi hình siêu âm tim với đầu dò siêu âm tim 2D được đưa vào thực quản để ghi hình ảnh siêu âm tim từ phía sau thay vì đặt đầu dò siêu âm tim trên thành ngực (ghi hình siêu âm tim từ phía trước). Do đầu dò siêu âm với tần số cao nằm gần các cấu trúc tim và tránh được khí trong phổi, siêu âm tim qua thực quản 2D có khả năng cung cấp hình ảnh cấu trúc tim với độ phân giải cao đặc biệt là các cấu trúc tim nằm phía sau ở gần thực quản (van hai lá, nhĩ trái, tiểu nhĩ trái), hạn chế các hiện tượng ảnh giả so với siêu âm tim qua thành ngực. Hiện nay, đầu dò siêu âm tim qua thực quản 2D là đầu dò tổ hợp pha (phased array) linh hoạt (flexible transducer) được điều khiển bằng các núm xoay dạng bánh xe răng cưa trên phần tay cầm và các thao tác của bác sĩ siêu âm.
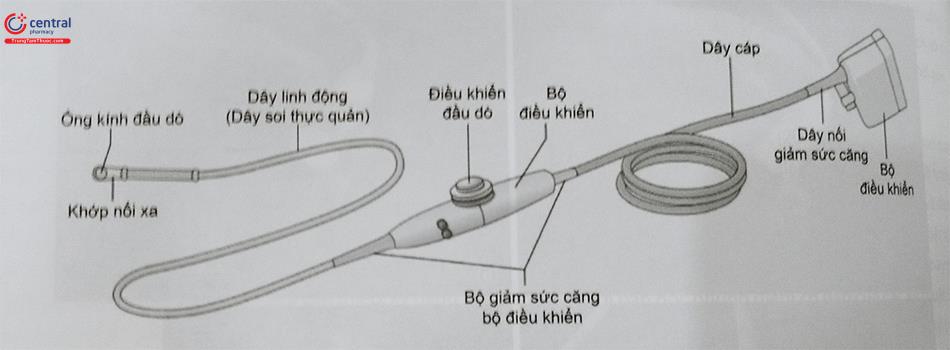
Chú thích. Cable: dây cáp; Control housing: bộ điều khiển; Connector strain relief: dây nối giảm sức căng; Control housing strain relief: bộ giảm sức căng bộ điều khiển; Transducer controls: điều khiển đầu dò; Flexible shaft (gastroscope): dây linh động (dây soi thực quản); Transducer lens: ống kính đầu dò; Distal tip: khớp nối xa.
Khác với siêu âm tim qua thành ngực 2D, siêu âm tim qua thực quản 2D có các chỉ định (Bảng 15.1), chống chỉ định (Bảng 15.2) và các biến cố tiềm tàng. Do bản chất là một kỹ thuật bán xâm lấn, khi tiến hành siêu âm tim qua thực quản 2D, bệnh nhân cần được gây mê toàn thân hoặc gây ngủ. Khi sử dụng siêu âm tim 2D qua thực quản trong hướng dẫn can thiệp tim mạch, bệnh nhân được gây mê toàn thân và đặt nội khí quản.
Ưu điểm của siêu âm tim qua thực quản 2D:
- Cung cấp hình ảnh siêu âm tim với độ phân giải cao, đặc biệt là các cấu trúc nằm gần thực quản, đặc biệt khi hình ảnh siêu âm tim qua thành ngực không rõ.
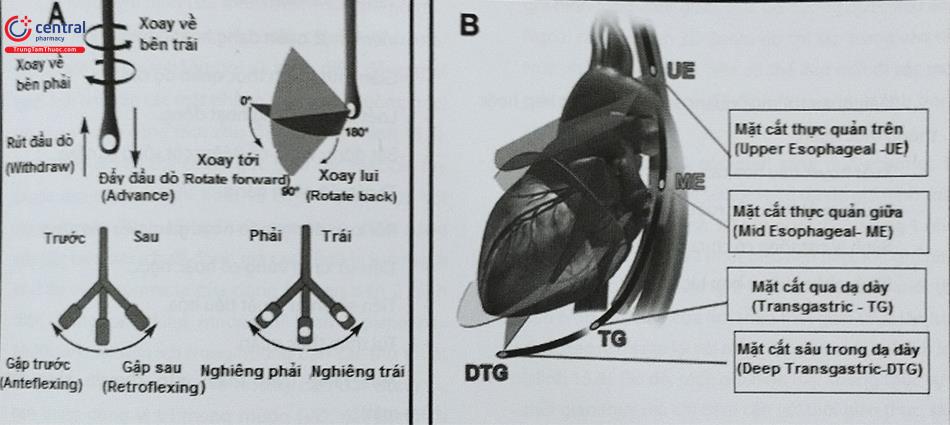
- Bác sĩ siêu âm có thể điều khiển đầu dò một cách linh hoạt (Hình 3) để ghi hình cấu trúc tim ở các độ sâu khác nhau trong thực quản và dạ dày, ở các góc và các hướng khác nhau.
- Đánh giá chi tiết giải phẫu các cấu trúc cần can thiệp như van hai lá, van động mạch chủ và tiểu nhĩ trái để lựa chọn bệnh nhân phù hợp với can thiệp và lên kế hoạch can thiệp.
- Phát hiện hoặc loại trừ huyết khối nhĩ trái, tiểu nhĩ trái trước can thiệp bệnh tim cấu trúc hoặc can thiệp điện sinh lý tim.
- Hướng dẫn đường đi của catheter, dây dẫn và dụng cụ can thiệp. Đánh giá mức độ tiếp xúc của catheter triệt đốt với mô trong can thiệp rối loạn nhịp.
- Đánh giá hiệu quả tức thời sau can thiệp đặc biệt là các can thiệp van hai lá, van động mạch chủ, bít thông liên nhĩ, còn lỗ bầu dục (PFO), bít tiểu nhĩ trái bằng dụng cụ, thay van động mạch chủ qua đường ống thông.
Nhược điểm của siêu âm tim qua thực quản 2D:
- Bệnh nhân cần nhịn ăn ít nhất 6h trước khi làm siêu âm tim qua thực quản.
- Nguy cơ tổn thương thực quản và đường tiêu hóa cao khi thao tác điều khiển đầu dò siêu âm trong thực quản, biến chứng nặng có thể gây thủng thực quản.
- Quá trình làm siêu âm có thể gây khó chịu cho bệnh nhân nếu không gây mê hoặc gây ngủ, đặc biệt khi lấy các mặt cắt sâu qua dạ dày.
- Mặc dù cung cấp hình ảnh siêu âm tim có độ phân giải cao hơn so với siêu âm tim qua thành ngực, các mặt cắt siêu âm tim qua thực quản 2D vẫn chỉ là các lát cắt mỏng của cấu trúc tim 3D phức tạp. Điều này hạn chế khả năng định vị và theo dõi đường đi của catheter, dây dẫn và dụng cụ trong can thiệp bởi các dụng cụ này có thể bị rơi ra khỏi mặt cắt đang khảo sát.
- Siêu âm tim qua thực quản 2D trong can thiệp đòi hỏi phải gây mê toàn thân và đặt nội khí quản, kéo theo các biến chứng liên quan tới gây mê và thở máy.
- Đầu dò siêu âm tim qua thực quản có thể ảnh hưởng đến trường quan sát của bác sĩ can thiệp trên màn tăng sáng, đôi khi cần kéo đầu dò lên cao rồi đặt lại.
Trước đây siêu âm tim qua thực quản 2D được sử dụng như một công cụ đắc lực trong hướng dẫn can thiệp tim mạch. Hiện nay với tiến bộ của khoa học công nghệ, các kỹ thuật siêu âm tim hiện đại đặc biệt là siêu âm tim qua thực quản 3D thời gian thực và siêu âm tim với đầu dò trong buồng tim đang từng bước thay thế siêu âm tim qua thực quản 2D trong lĩnh vực này.
Bảng 1. Chỉ định siêu âm tim qua thực quản
| Đánh giá các cấu trúc tim khi siêu âm tim qua thành ngực chưa cung cấp đủ thông tin | Đánh giá chi tiết giải phẫu của nhĩ trái, tiểu nhĩ trái, động mạch chủ, van nhân tạo, hở cạnh van hoặc áp xe cạnh van. |
| Hướng dẫn trong phẫu thuật tim | Tất cả các phẫu thuật tim mở có liên quan tới các van tim và động mạch chủ; một số phẫu thuật bắc cầu nối chủ vành; một số phẫu thuật ngoài tim nhưng cần thông tin về các cấu trúc và bệnh lý tim. |
| Hướng dẫn trong can thiệp tim mạch qua đường ống thông | Các can thiệp van tim, can thiệp bít tiểu nhĩ trái, can thiệp bít thông liên nhĩ hoặc thông liên thất. |
| Chẩn đoán bệnh tim mạch ở bệnh nhân nặng tại đơn vị Hồi sức tích cực | Bệnh nhân thở máy có nguy cơ bị bệnh lý tim mạch ảnh hưởng tới chiến lược điều trị tại đơn vị Hồi sức tích cực. |
Bảng 2. Chống chỉ định siêu âm tim qua thực quản
| Chống chỉ định tuyệt đối | Chống chỉ định tương đối |
| Liên quan tới thực quản: u, túi thừa, chít hẹp hoặc thủng thực quản. | Thực quản Barrett |
| Xuất huyết tiêu hóa cao đang hoạt động. | Tiền sử rối loạn nuốt. |
| Thủng ruột hoặc tắc ruột. | Viêm thực quản đang hoạt động. |
| Bệnh lý cột sống cổ chưa ổn định. | Giãn tĩnh mạch thực quản độ |
| Bệnh nhân không hợp tác. | Loét dạ dày đang hoạt động. |
| Bất động vùng cổ (Viêm cột sống cổ nặng…). | |
| Thoát vị hoành nặng. | |
| Rối loạn đông máu hoặc giảm tiểu cầu nặng. | |
| Tiền sử xạ trị vùng cổ hoặc ngực. | |
| Tiền sử phẫu thuật tiêu hóa. | |
| Túi thừa thực quản. | |
| Mất răng (cần tham vấn chuyên khoa răng hàm mặt). |
1.2 Các kỹ thuật siêu âm tim hiện đại và chuyên sâu
1.2.1 Siêu âm tim 3D
Siêu âm tim 3D là thành tựu của công nghệ phát triển đầu dò siêu âm tim và kỹ thuật tin học. Ghi hình siêu âm tim 3D được đánh dấu với sự ra đời của đầu dò siêu âm tim ma trận toàn phần (fully sampled matrix array) với khả năng xử lý hình ảnh tiên tiến và các thuật toán dựng hình hiện đại cho phép ghi hình cấu trúc tim 3D thời gian thực trong thời gian ghi hình ngắn với độ phân giải không gian và thời gian vượt trội.
Hiện nay đầu dò siêu âm tim 3D ma trận được cấu thành từ khoảng 3000 chấn tử đơn được kết nối với nhau và hoạt hóa đồng thời (ma trận toàn phần) với dải tần số 2 – 4 Mhz (siêu âm tim 3D qua thành ngực) hoặc 5 – 7 Mhz (siêu âm tim 3D qua thực quản). Để tạo ra được chùm siêu âm trong không gian 3 chiều, các chấn tử siêu âm được sắp xếp thành các hàng và cột trong đầu dò tạo thành mạng lưới hình vuông (dạng ma trận) (Hình 4). Bằng cách hoạt hóa điện tử các tinh thể áp điện trong các chấn tử, các đường quét siêu âm được phát ra theo 3 trục không gian (x, y, z) để ghi lại một khối hình ảnh cấu trúc tim dạng kim tự tháp. Các thế hệ đầu dò hiện đại cho phép phối hợp ghi hình siêu âm tim 2D và 3D linh hoạt trong cùng một lần thăm khám.
So với siêu âm tim 2D truyền thống, thế mạnh của siêu âm tim 3D là các mode ghi hình linh hoạt và đa năng cùng nhiều tính năng hậu xử lý hình ảnh thông minh, hiện đại không chỉ giúp chẩn đoán bệnh lý chính xác mà còn rất hữu dụng trong hướng dẫn can thiệp tim mạch.
Các mode ghi hình của siêu âm tim 3D bao gồm:
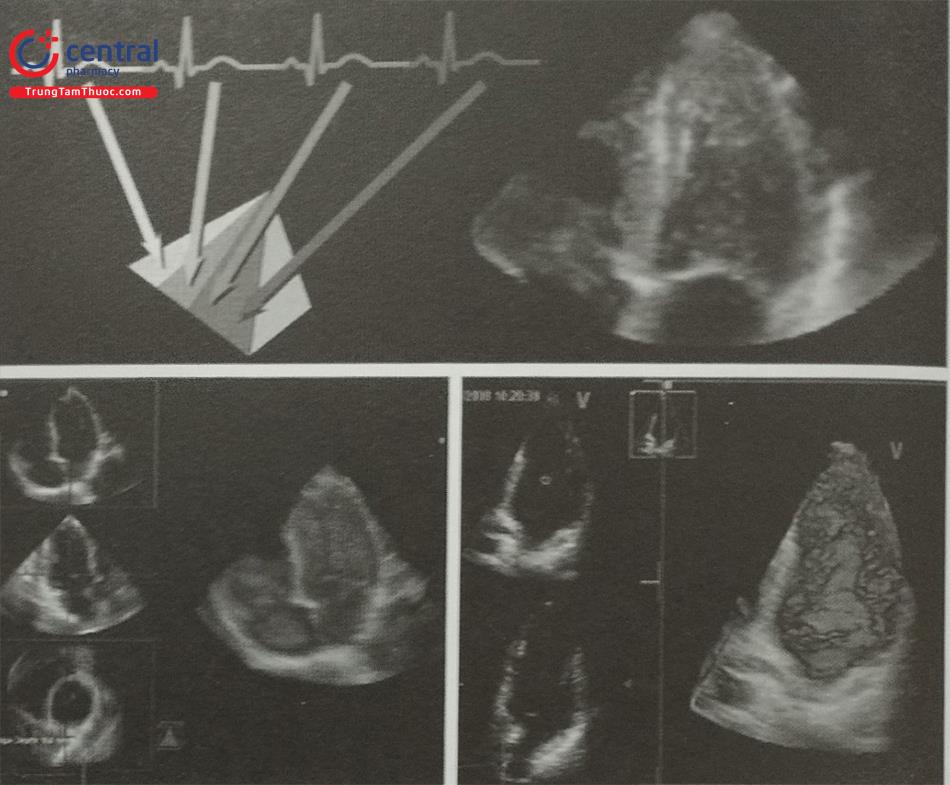
- Ghi hình đồng thời nhiều mặt cắt 2D (X-plane/ Multiplane): là chức năng ghi và trình diễn đồng thời hình ảnh tim trên các mặt phẳng trực giao (vuông góc) với nhau trong cùng một chu chuyển tim (Hình 15.5). Bác sĩ siêu âm có thể chỉnh góc giữa các mặt cắt tùy thuộc vào cấu trúc ghi hình và có thể phối hợp với doppler màu (Hình 15.6). Trước can thiệp, chức năng này đặc biệt hữu ích để đánh giá các bệnh lý tim mạch như đo vena contracta của dòng hở van trên 2 bình diện. Trong can thiệp mode ghi hình X-plane hay Multiplane rất hữu ích trong hướng dẫn các thủ thuật như chọc vách liên nhĩ, và hướng dẫn đặt dụng cụ can thiệp đúng vị trí mong muốn (VD: đặt dụng cụ mitraclip vuông góc với diện áp của van hai lá).
- Ghi hình 3D thời gian thực (Live 3D): Là cách ghi hình ảnh 3D của cấu trúc tim theo thời gian thực qua từng nhát bóp với sector hẹp (Hình 7). Do mật độ đường quét khá cao trong diện nhỏ của sector 3D, hình ảnh Live 3D có độ phân giải không gian và thời gian vượt trội. Vì vậy, mode Live 3D thường được sử dụng để ghi hình các cấu trúc nhỏ như các van tim và đặc biệt hữu ích trong hướng dẫn can thiệp tim mạch bởi khả năng ghi hình thời gian thực. Tuy nhiên do khối hình ảnh thu được có dạng kim tự tháp, cần xử lý cắt gọt hình ảnh (crop) để thu được hình ảnh trực diện (enface view) của cấu trúc cần khảo sát. Các thế hệ máy siêu âm tim 3D mới cho phép ghi hình Live 3D với góc quét rộng hơn mà vẫn giữ được độ phân giải không gian và thời gian tốt.
- Ghi hình 3D khu trú với góc quét rộng (3D zoom): Là cách ghi hình ảnh phóng đại của một cấu trúc tim nhất định hay một khối thể tích hình ảnh nhất định (Hình 8). Bác sĩ siêu âm có thể tùy chỉnh kích thước vùng cần khảo sát bằng tay để thu được trọn vẹn hình ảnh của cấu trúc cần quan tâm (VD: van hai lá) và lược bỏ những phần hình ảnh không cần thiết. Vì vậy, 3D Zoom là mode ghi hình thường được sử dụng nhất khi làm siêu âm tim qua thực quản 3D để đánh giá các cấu trúc nhỏ trong buồng tim như van hai lá, tiểu nhĩ trái…
Ưu điểm của hình ảnh 3D Zoom là độ phân giải không gian khá cao nếu ghi hình trong 1 nhát bóp và tránh hiện tượng ảnh giả nối hình (stitched artifact). Tuy nhiên, nhược điểm của mode ghi hình này là độ phân giải không gian và thời gian có thể bị giảm nếu sector ghi hình rộng (làm giảm mật độ đường quét siêu âm). Ngoài ra, hình ảnh 3D Zoom do chỉ tập trung vào cấu trúc nhỏ cần khảo sát nên có thể làm mất đi các mốc giải phẫu xung quanh để định hướng hình ảnh trong không gian.
- Ghi hình tim 3D góc quét rộng (full volume): Là mode ghi hình 3D với sector rộng đủ để ghi hình toàn bộ tim. Có thể ghi hình 3D góc quét rộng trong 1 nhát bóp hoặc trong nhiều nhát bóp liên tiếp. Khi ghi hình nhiều nhát bóp (thường 2- 6 nhát bóp) các khối thể tích hình ảnh nhỏ của tim theo thời gian thực lần lượt được tạo ra rồi ráp lại với nhau thành 1 khối thể tích lớn (Hình 9). Do đó, cách ghi hình này không thực sự là thời gian thực mà chỉ tiệm cận với thời gian thực. Một nhược điểm của ghi hình nhiều nhát bóp là ảnh giả nối hình tại nơi các khối thể tích nhỏ được ráp với nhau do chuyển động của tim, di động lồng ngực khi hô hấp và bệnh nhân có nhịp tim không đều. Ghi hình góc quét rộng trong 1 nhát bóp có thể khắc phục nhược điểm này nhưng độ phân giải không gian của hình ảnh bị giảm. Ứng dụng của mode ghi hình 3D góc quét rộng là đánh giá thể tích các buồng tim (thất trái, thất phải, nhĩ phải). Trên siêu âm tim qua thực quản 3D, có thể dùng mode góc quét rộng để ghi hình nhiều van tim cùng lúc hoặc các cấu trúc kích thước lớn như các khối bất thường trong buồng
- Ghi hình 3D màu: Là sự phối hợp siêu âm doppler màu trên hình ảnh Đây là công cụ hữu ích để đánh giá các dòng hở van, hở cạnh van đặc biệt trong trường hợp dòng hở lệch tâm. Có thể phối hợp doppler màu trên hình ảnh 3D Zoom (Hình 5), Live 3D, Multiplane (Hình 6) hoặc góc quét rộng. Nhược điểm của 3D màu là độ phân giải thời gian thấp.
Các trình diễn hình ảnh 3D hậu xử lý:
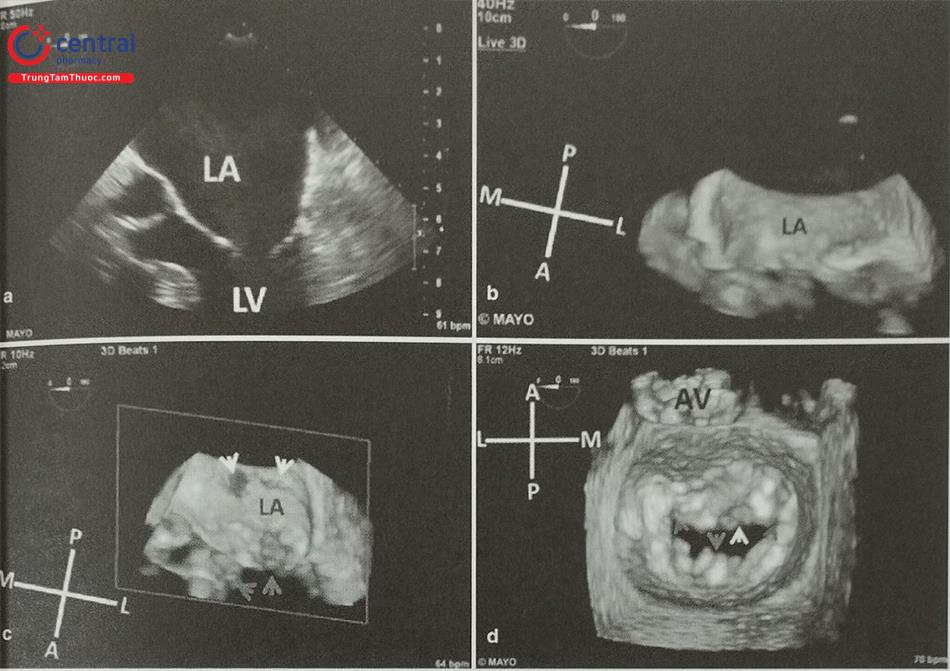
Hình khối kết xuất (volume rendered image): thể hiện hình ảnh 3D nhìn trực diện vào cấu trúc cần khảo sát, có thể lựa chọn hướng nhìn từ 2 phía của cấu trúc. VD: hình ảnh trực diện của van hai lá nhìn từ mặt nhĩ (góc nhìn của phẫu thuật viên) hoặc mặt thất, hình ảnh của lỗ thông liên nhĩ nhìn từ phía nhĩ trái hoặc nhĩ phải.
- Hình khối bề mặt (surface rendered image): là hình ảnh cấu trúc dưới dạng khối đặc, thường được sử dụng để thể hiện hình ảnh các buồng tim như nhĩ trái, thất trái, thất phải để đánh giá thể tích và chức năng các buồng tim.
- Cắt lát 2D đa dãy (multislice): nhiều lát cắt 2D trên 3 mặt phẳng trực giao (đứng dọc, đứng ngang, nằm ngang) của cùng khối hình 3D hoặc nhiều lát cắt 2D song song, thường sử dụng để đánh giá rối loạn vận động vùng thất trái.
Ngoài ra các phần mềm hậu xử lý hình ảnh hiện đại từ các nhà sản xuất máy siêu âm với các tính năng thông minh cho phép đo đạc lượng hóa nhanh kích thước, chức năng các buồng tim, xây dựng mô hình tham số của các van tim và tính toán nhanh các thông số cần thiết để lựa chọn bệnh nhân trước can thiệp (Hình13).
(Chú thích: LA: nhĩ trái; LV: thất trái; AV: Van động mạch chủ)

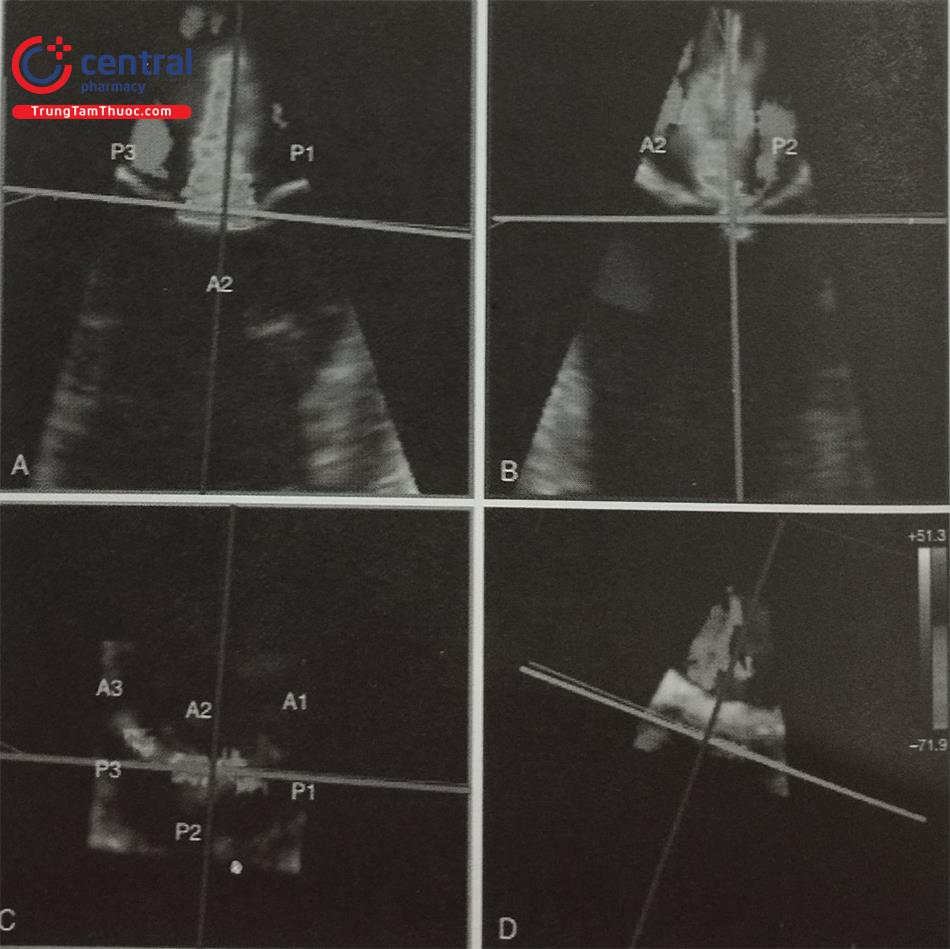
Chú thích : A1,A2,A3: Các vùng lá trước van hai lá ; P1, P2, P3: Các vùng lá sau van hai lá
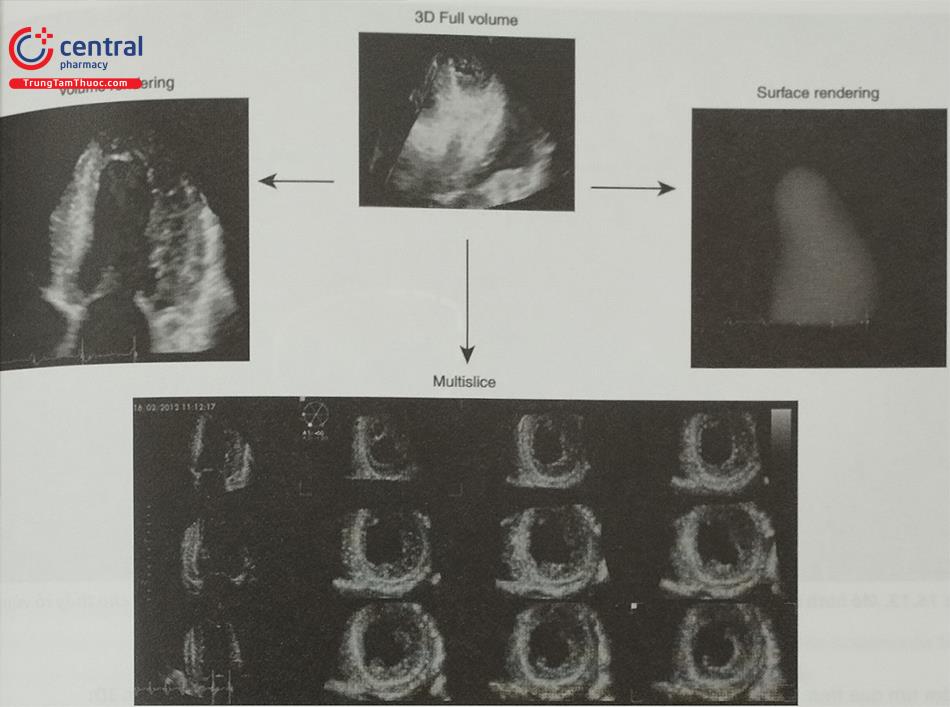
Chú thích: Kết xuất hình khối (volume rendering), kết xuất bề mặt (Surface render) và cắt lát 2D đa dãy (multislice).

Siêu âm tim qua thực quản 3D chủ yếu được sử dụng để chẩn đoán và hướng dẫn trong can thiệp tim mạch ở bệnh nhân người lớn còn siêu âm tim qua thành ngực 3D chủ yếu được sử dụng ở trẻ em.
Trong lĩnh vực can thiệp tim mạch, ưu điểm của siêu âm tim 3D so với siêu âm tim 2D truyền thống bao gồm:
- Các mode ghi hình phong phú và linh hoạt, kết hợp ghi hình 2D và 3D trong cùng một lần siêu âm.
- Đánh giá chính xác thể tích, chức năng các buồng tim và đo đạc chính xác các thông số trước can thiệp vì không dùng các phép gán hình học như siêu âm tim Ví dụ: siêu âm tim 2D đánh giá diện tích vòng van hai lá, vòng van động mạch chủ bằng phép gán hình học coi các vòng van có hình tròn và áp dụng công thức tính diện tích hình tròn từ đường kính vòng van 2D. Siêu âm tim 3D cho phép dựng hình vòng van hai lá, van động mạch chủ trực diện, cho thấy vòng van có hình elip và đo trực tiếp các đường kính, diện tích và chu vi vòng van trên hình ảnh 3D hoặc MPR.
- Ghi hình ảnh cấu trúc tim 3D thời gian thực nên cho phép theo dõi chính xác hơn vị trí, đường đi của dụng cụ can thiệp trong các buồng tim, hạn chế biến chứng do catheter đi lạc chỗ.
Nhược điểm của siêu âm tim 3D:
- Độ phân giải thời gian thấp hơn hình ảnh 2D
- Dễ bị các hiện tượng ảnh giả: ảnh giả nối hình (stitched artifact), ảnh giả khuyết hình (drop-out) … có thể ảnh hưởng tới quá trình hướng dẫn trong can thiệp nếu bác sĩ siêu âm chưa có kinh nghiệm.
- Siêu âm tim qua thực quản 3D có chống chỉ định và một số nhược điểm tương tự như siêu âm tim qua thực quản 2D, bao gồm: bệnh nhân cần được gây mê toàn thân và đặt nội khí quản, đầu dò siêu âm tim qua thực quản có thể ảnh hưởng đến trường quan sát của bác sĩ can thiệp trên màn tăng sáng, nguy cơ tổn thương thực quản và đường tiêu hóa cao khi điều khiển đầu dò.
- Máy siêu âm tim và đầu dò siêu âm tim 3D có thể không phổ biến như siêu âm tim
- Bác sĩ siêu âm cần có quá trình được đào tạo và thực hành để sử dụng thành thạo các mode trong siêu âm tim 3D và phối hợp với bác sĩ can thiệp trong quá trình làm thủ thuật.
- Một số bác sĩ can thiệp tim mạch chưa quen thuộc với hình ảnh siêu âm tim 3D so với hình ảnh siêu âm tim 2D truyền thống.
1.2.2 Siêu âm tim với đầu dò trong buồng tim (ICE)

Siêu âm tim với đầu dò siêu âm trong buồng tim (Intracardiac echocardiography – ICE) là kỹ thuật siêu âm tim sử dụng đầu dò gắn tại đầu tận của một catheter và được đưa vào tim phải theo đường tĩnh mạch đùi. Khác với cách ghi hình siêu âm từ ngoài tim của siêu âm tim qua thành ngực hoặc siêu âm tim qua thực quản, ICE ghi hình tim trực tiếp từ bên trong các buồng tim với khả năng cung cấp hình ảnh cấu trúc tim theo thời gian thực với độ phân giải vượt trội bởi đầu dò siêu âm có tần số cao và nằm rất gần các cấu trúc cần khảo sát.
Hiện nay có 2 loại catheter ICE được sử dụng trên lâm sàng:
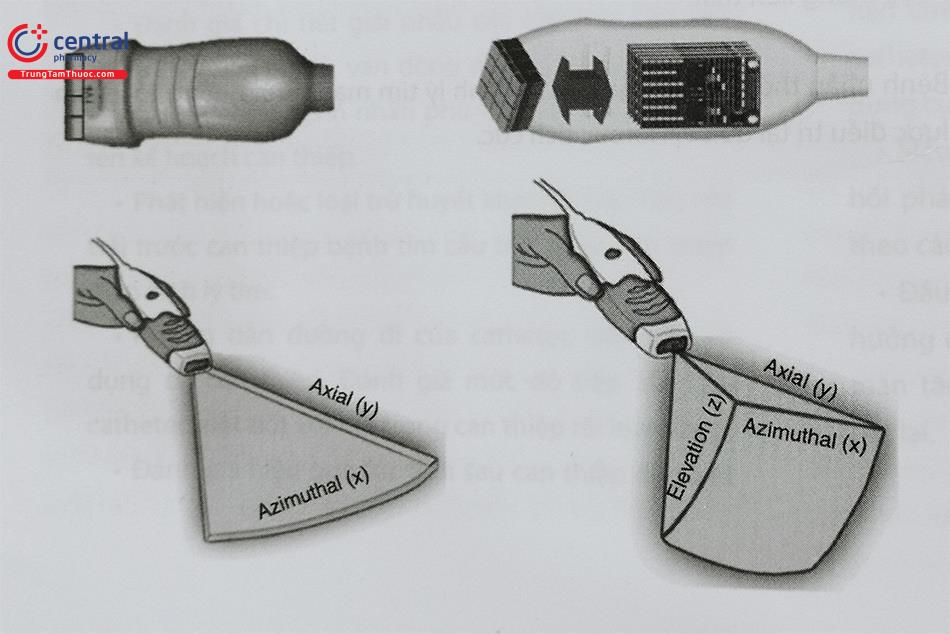
- Catheter xoay (rotational ICE): cấu tạo bởi một tinh thể áp điện được gắn vào đầu tận của một catheter có kích thước 6 – 10 Đầu dò ICE xoay cơ học có thể cung cấp các lát cắt khi quay 360O vuông góc với trục của catheter. Tần số của đầu dò từ 9 – 12 Mhz nên hình ảnh có độ phân giải cao nhưng chỉ ghi hình được các cấu trúc gần (cách đầu dò 6 – 8 cm), hạn chế đánh giá các cấu trúc nằm ở trường xa của chùm siêu âm.
- Catheter tổ hợp pha (Phased-array ICE): Được cấu tạo từ 64 chấn tử mang tinh thể áp điện gắn vào đầu tận của catheter 8-10 Fr, bác sĩ can thiệp có thể điều khiển lái catheter theo các hướng trước, sau, phải, trái. Loại đầu dò này cung cấp hình ảnh siêu âm dạng hình chêm tương tự như trên máy siêu âm tim truyền thống. So với đầu dò ICE kiểu xoay cơ học, đầu dò tổ hợp pha có nhiều ưu điểm, đặc biệt là khả năng ghi hình các cấu trúc ở xa (cách đầu dò 15 cm), dễ điều khiển, có khả năng ghi hình doppler màu và phổ doppler. Hiện nay, đầu dò ICE tổ hợp pha được ưu tiên lựa chọn trong hướng dẫn can thiệp tim mạch so với đầu dò kiểu xoay cơ học.
So với siêu âm tim qua thực quản 2D/3D, ưu điểm của siêu âm đầu dò trong buồng tim (ICE) trong hướng dẫn can thiệp tim mạch là:
- Ghi hình trực tiếp các cấu trúc tim với độ phân giải cao.
- Không cần gây mê toàn thân và đặt nội khí quản, bệnh nhân thường dung nạp tốt.
- Bác sĩ can thiệp chủ động điều khiển catheter mang đầu dò siêu âm tim để ghi hình trong quá trình can thiệp.
- Rút ngắn thời gian chiếu
- Tuy nhiên ICE cũng có một số nhược điểm:
- Là kỹ thuật xâm lấn, cần thêm đường vào mạch máu kèm theo nguy cơ biến cố mạch máu tại đường vào.
- Catheter mang đầu dò siêu âm có thể va chạm với catheter và các dụng cụ can thiệp trong quá trình làm thủ thuật.
- Hiện tại các đầu dò ICE chỉ có khả năng ghi hình tim 2D, đầu dò ICE 3D đang trong quá trình thử nghiệm.
- Giá thành cao do catheter gắn đầu dò siêu âm chỉ sử dụng được một lần.
- Không sẵn có tại các đơn vị tim mạch như siêu âm tim qua thành ngực hoặc siêu âm tim qua thực quản.
- Có nguy cơ gây rối loạn nhịp nhĩ thoáng qua khi điều khiển lái catheter trong buồng tim.
Do tính chất xâm lấn và chi phí cao, ICE được chỉ định trong hướng dẫn can thiệp điện sinh lý tim hoặc bệnh tim cấu trúc mà không được sử dụng với mục đích chẩn đoán một cách thường quy như siêu âm tim qua thành ngực hoặc siêu âm tim qua thực quản. Hiện nay, tại nhiều trung tâm Tim mạch, ICE là công cụ đắc lực để hướng dẫn chọc vách liên nhĩ trong can thiệp và theo dõi hướng dẫn các can thiệp bệnh lý tim cấu trúc như nong van hai lá, kẹp sửa van hai lá qua đường ống thông, thay van động mạch chủ qua da… và các can thiệp triệt đốt rối loạn nhịp nhĩ và thất.
1.2.3 Lồng ghép hình ảnh siêu âm tim với chiếu huỳnh quang (Fluoroscopic-echocardiographic imaging)
Lồng ghép hình ảnh (Fusion-Imaging) được định nghĩa là kết hợp hai phương thức chẩn đoán hình ảnh trong cùng một hình ảnh duy nhất để gia tăng giá trị chẩn đoán của hình ảnh. Xét về phương diện ưu và nhược điểm của từng phương tiện chẩn đoán hình ảnh riêng lẻ trong hướng dẫn can thiệp tim mạch, lồng ghép hình ảnh là kỹ thuật mới đầy hứa hẹn trong đơn vị can thiệp nhằm nâng cao tính an toàn, tỷ lệ thành công của thủ thuật và hạn chế biến chứng. Hiện nay có hai hệ thống lồng ghép hình ảnh được sử dụng trong can thiệp tim mạch: Lồng ghép hình ảnh siêu âm tim với chiếu huỳnh quang (echocardiography -fluoroscopy fusion imaging) và lồng ghép hình ảnh chụp cắt lớp vi tính với chiếu huỳnh quang (computed -fluoroscopy fusion imaging).
Lồng ghép hình ảnh siêu âm tim với chiếu huỳnh quang (echocardiography – fluoroscopy fusion imaging) là kỹ thuật phối hợp hình ảnh điện quang thời gian thực (live X-ray) với hình ảnh siêu âm tim thời gian thực (live echo) trên cùng một hình ảnh duy nhất. Hệ thống đồng thời trình diễn hình ảnh siêu âm 2D hoặc 3D và hình chiếu huỳnh quang bằng cách tự động định vị đầu dò siêu âm tim qua thực quản trên màn tăng sáng theo quy trình 2 bước.
Bước 1: hệ thống định vị đầu dò siêu âm tim qua thực quản bằng cách quét trên toàn bộ khung hình chiếu huỳnh quang để tìm kiếm đầu dò siêu âm bằng kỹ thuật dựa trên hình dạng của vật thể đích.
Bước 2: là quá trình đánh dấu hay đúng hơn là quá trình cập nhật liên tục vị trí của đầu dò siêu âm. Các hình ảnh thu được sẽ được hiển thị đồng thời trên 4 góc của màn hình (Hình 16):
- Khung hình siêu âm (echo view) hiển thị hình ảnh siêu âm tim chỉ do bác sĩ siêu âm điều khiển và xử lý.
- Khung hình tự do (free view): hiển thị hình ảnh siêu âm nhưng bác sĩ siêu âm hoặc bác sĩ can thiệp có thể xử lý bằng các thao tác xoay, cắt gọt, phóng đại bằng hệ thống điều khiển vô khuẩn bên cạnh bàn can thiệp.
- Khung hình C-arm (C-arm view): hình ảnh siêu âm được đặt cùng hướng với C-arm.
- Khung hình điện quang (X-ray view): chỉ hiển thị hình chiếu huỳnh quang.
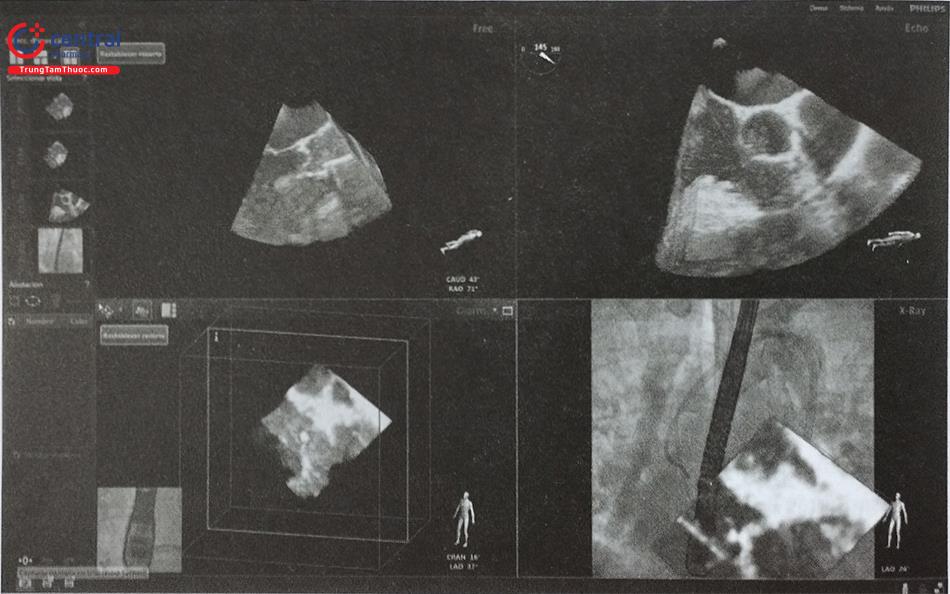
Chú thích: Khung hình siêu âm (echoview), khung hình tự do (free view); khung hình C-arm (C-arm view); khung hình điện quang (X-ray view)
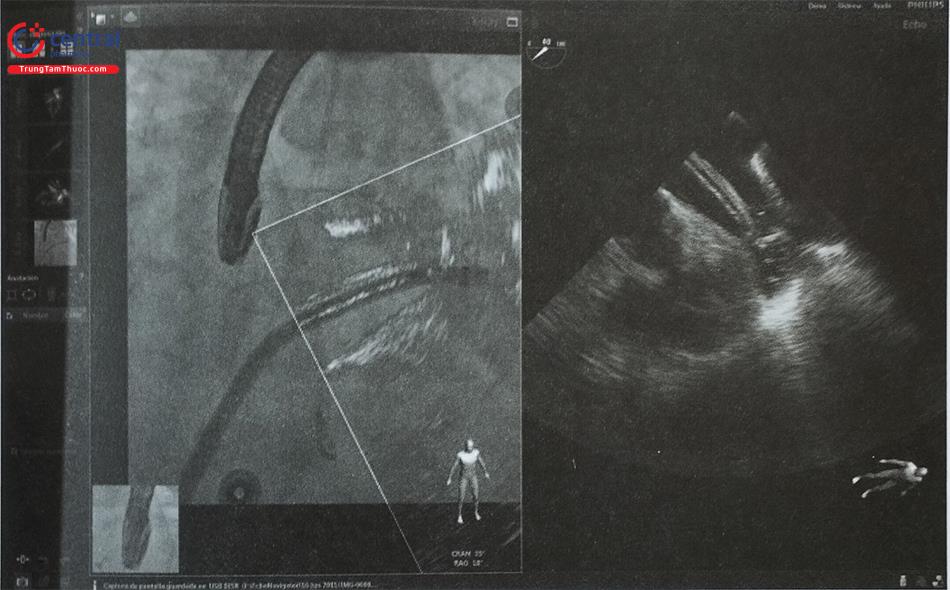
Khi hình ảnh siêu âm và hình ảnh chiếu huỳnh quang được hợp nhất (lồng ghép), bác sĩ can thiệp có thể sử dụng nhiều công cụ xử lý hình ảnh. Hệ thống cho phép đặt các chỉ dấu (marker) tại các vùng giải phẫu cần quan tâm trên hình ảnh siêu âm tim thời gian thực; các chỉ dấu này sẽ được tự động hiển thị và cập nhật liên tục trên hình chiếu huỳnh quang thời gian thực để hướng dẫn quá trình can thiệp (Hình 15.17). Có thể tùy biến các chỉ dấu tham chiếu bằng màu sắc hoặc nhãn, nhờ đó các vùng giải được đánh dấu ngay từ khi bắt đầu quá trình can thiệp giúp tiết kiệm thời gian và tạo thuận cho thủ thuật. Hình ảnh siêu âm tim 2D hoặc 3D có thể được đặt chồng lên hình chiếu huỳnh quang và thay đổi theo thời gian thực, theo từng bước trong quá trình can thiệp. Thêm vào đó, bác sĩ can thiệp có thể điều chỉnh gain và cường độ hình ảnh của mỗi phương thức để lựa chọn hình ảnh siêu âm rõ hơn hay hình chiếu huỳnh quang rõ hơn bằng cách thay đổi mức độ xuyên thấu (transparency) của hình ảnh (Hình 15.18). Trong trường hợp sử dụng hình ảnh 3D, cần xử lý cắt gọt hình ảnh để nâng cao tính đồng bộ giữa hình ảnh siêu âm và chiếu huỳnh quang.
Lồng ghép hình ảnh siêu âm với chiếu huỳnh quang giúp khắc phục nhược điểm của từng kỹ thuật riêng lẻ, nâng cao khả năng phối hợp của bác sĩ can thiệp và bác sĩ siêu âm. Tuy nhiên hệ thống này vẫn chưa khả dụng ở một số trung tâm tim mạch.
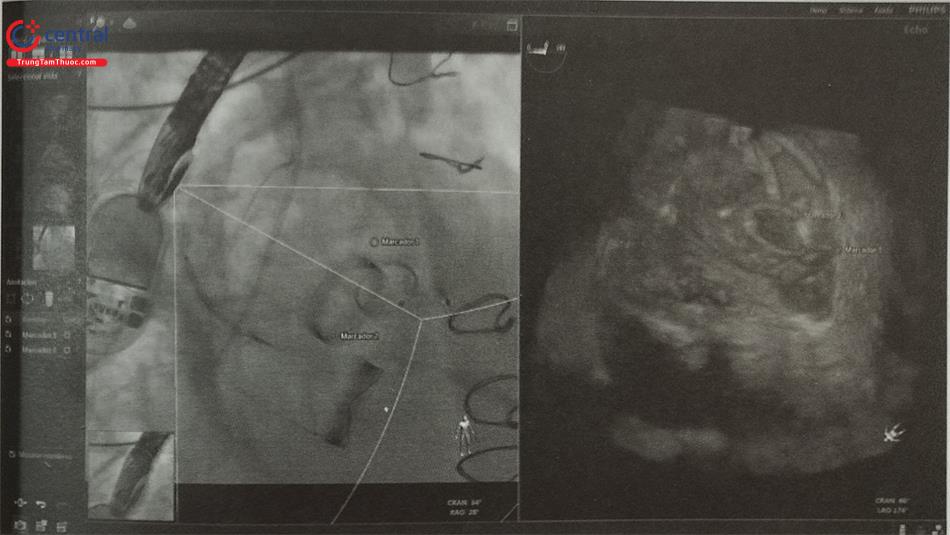
Chú thích: Các chỉ dấu (marcador 1, 2) trên hình ảnh siêu âm tim 3D (bên phải) cũng xuất hiện trên hình chiếu huỳnh quang (bên trái) giúp bác sĩ can thiệp dễ dàng định vị hai tổn thương rò cạnh van hai lá nhân tạo.
1.3 Các kỹ thuật siêu âm tim khác
Siêu âm tim gắng sức: Được chỉ định để đánh giá sống còn cơ tim hoặc đánh giá mức độ hẹp van hai lá, hẹp van động mạch chủ hoặc mức độ tắc nghẽn đường ra thất trái trong bệnh cơ tim phì đại. Không sử dụng trong hướng dẫn can thiệp.
Siêu âm tim cản âm: Thường được sử dụng với mục đích chẩn đoán trước can thiệp, ví dụ: Siêu âm tim cản âm bằng nước muối sinh lý được tạo bọt được chỉ định để phát hiện các luồng shunt bất thường trong tim. Siêu âm tim với chất cản âm chuyên dụng được sử dụng để đánh giá chức năng thất trái hoặc phát hiện huyết khối trong buồng thất trái. Trong can thiệp tim mạch, siêu âm tim với chất cản âm chuyên dụng được bơm vào mạch vành được sử dụng để hướng dẫn can thiệp làm mỏng vách liên thất bằng cồn trong bệnh cơ tim phì đại tắc nghẽn.
Siêu âm đánh dấu mô cơ tim: được sử dụng với mục đích chẩn đoán, không dùng trong hướng dẫn can thiệp tim mạch.
1.4 Lựa chọn kỹ thuật siêu âm tim trong hướng dẫn can thiệp tim mạch
Việc lựa chọn kỹ thuật siêu âm tim để hướng dẫn quá trình can thiệp tim mạch qua đường ống thông phụ thuộc vào bản thân thủ thuật can thiệp và trang thiết bị hiện có của đơn vị. Đối với can thiệp bệnh lý tim cấu trúc, siêu âm tim qua thực quản, đặc biệt là siêu âm tim qua thực quản 3D là công cụ hướng dẫn phù hợp với hầu hết các thủ thuật can thiệp từ tầng nhĩ (bít thông liên nhĩ, còn lỗ bầu dục (PFO), chọc vách liên nhĩ, bít tiểu nhĩ trái), tầng thất (bít thông liên thất, giả phình thành thất trái) và các can thiệp van tim (Mitraclip, thay van động mạch chủ qua đường ống thông (TAVI), bít rò cạnh van nhân tạo…). Ngoài ra, siêu âm với đầu dò trong buồng tim (ICE) phù hợp để hướng dẫn chọc vách liên nhĩ trong can thiệp điện sinh lý và tim cấu trúc, bít thông liên nhĩ, TAVI, Mitraclip và bít tiểu nhĩ trái.
Với sự tiến bộ của kỹ thuật và dụng cụ can thiệp, lựa chọn siêu âm tim trong can thiệp có thể thay đổi theo thời gian. Ví dụ: Trước đây, can thiệp thay van động mạch chủ qua đường ống thông phụ thuộc vào hướng dẫn của siêu âm tim qua thực quản nhưng hiện nay kỹ thuật này được thực hiện chủ yếu dưới màn tăng sáng và chỉ cần siêu âm tim qua thành ngực chờ để đánh giá hiệu quả tức thì sau can thiệp và phát hiện biến chứng. Bảng 15.3 tóm tắt vai trò của các kỹ thuật siêu âm tim trong một số can thiệp bệnh tim cấu trúc.
Bảng 3. Vai trò của các kỹ thuật siêu âm tim trong can thiệp bệnh lý tim cấu trúc.
| Can thiệp | Lên kế hoạch trước can thiệp | Hướng dẫn can thiệp | Đánh giá sau can thiệp |
| TAVI | TTE, CT | TEE (có thể dùng) | TTE |
| Mitraclip | TTE, 3D TEE | 3D TEE (rất cần thiết) | TTE, TEE |
| Nong van hai lá bằng bóng | TTE và TEE | TEE hoặc ICE | TTE |
| Bít rò cạnh van nhân tạo | 3D TEE | 3D TEE (rất cần thiết) | TTE, TEE |
| Bít TLN/PFO | TTE, 3D TEE | TEE hoặc ICE | TTE, TEE |
Làm mỏng vách liên thất bằng cồn Thay van động mạch phổi qua catheter | TTE TTE, MSCT | TTE hoặc TEE TEE (có thể dùng) | TTE TTE |
| Bít tiểu nhĩ trái | TEE, MSCT | TEE (rất cần thiết) | TEE |
(Chú thích: TTE: siêu âm tim qua thành ngực, TEE: siêu âm tim qua thực quản, 3DTEE: siêu âm tim qua thực quản 3D; ICE: siêu âm tim với đầu dò trong buồng tim, MSCT; chụp cắt lớp vi tính đa dãy).
2 Vai trò của siêu âm tim trong một số can thiệp bệnh lý tim cấu trúc
2.1 Can thiệp tại tầng nhĩ
2.1.1 Chọc vách liên nhĩ
Chọc vách liên nhĩ (transseptal puncture) là kỹ thuật tạo ra một đường thông trực tiếp để đưa dụng cụ can thiệp từ tĩnh mạch hệ thống sang nhĩ trái. Đây là bước đầu tiên, rất quan trọng trong nhiều can thiệp bệnh tim cấu trúc (bít tiểu nhĩ trái, các can thiệp van hai lá, bít hở cạnh van nhân tạo) và điện sinh lý tim (triệt đốt rung nhĩ, triệt đốt cuồng nhĩ trong nhĩ trái).
Chiếu huỳnh quang là phương thức truyền thống để hướng dẫn chọc vách liên nhĩ. Tuy nhiên, trong nhiều năm trở lại đây, các kỹ thuật can thiệp bệnh tim cấu trúc phức tạp ra đời, trong đó chọc vách liên nhĩ là bước đầu tiên, có vai trò then chốt quyết định thành công của thủ thuật (Bảng 4). Chọc vách liên nhĩ ở vị trí không phù hợp có thể hạn chế khả năng lái và điều khiển dụng cụ can thiệp (guidewire, catheter) trong các bước tiếp theo, làm quá trình can thiệp khó khăn thậm chí thất bại. Thêm vào đó, chọc vách liên nhĩ không đúng vị trí có thể dẫn tới tràn máu màng ngoài tim gây ép tim cấp, một biến chứng đe dọa đến tính mạng của người bệnh.
Bảng 4. Vị trí chọc vách liên nhĩ trong một can thiệp bệnh tim cấu trúc
| Can thiệp | Vị trí chọc vách liên nhĩ |
| 3 bước (3 mặt cắt) thường quy: | Mặt cắt qua 2 tĩnh mạch chủ: Vị trí chọc vách liên nhĩ tối ưu nằm phía trên điểm giữa của vách liên nhĩ Mặt cắt trục ngắn qua động mạch chủ: Vị trí chọc vách liên nhĩ tối ưu nằm phía sau điểm Mitraclip giữa của vách liên nhĩ. Với dụng cụ can thiệp thế hệ mới (Mitraclip NT) vị trí chọc vách cần lùi ra sau nhiều hơn. Mặt cắt 4 buồng: đo khoảng cách (chiều cao) từ vị trí chọc vách liên nhĩ tới mặt phẳng vòng van hai lá từ 3,5-5 cm. Khoảng cách này cao hơn trong hở trung tâm và thấp hơn trong hở lệch tâm. |
| Bít tiểu nhĩ trái | Vị trí chọc vách liên nhĩ tối ưu ở sau dưới hố bầu dục do ở đa số bệnh nhân, hố bầu dục nằm ở sau trên so với lỗ tiểu nhĩ trái. |
| Bít hở cạnh van hai lá | Nếu dòng hở ở phía trong (medial), vị trí chọc vách liên nhĩ ở phía sau trên hố bầu dục nhân tạo |
Siêu âm tim qua thực quản và siêu âm trong buồng tim có thể cung cấp hình ảnh giải phẫu chi tiết của vách liên nhĩ, giúp bác sĩ can thiệp lựa chọn vị trí chọc vách liên nhĩ tối ưu trong từng trường hợp can thiệp tim cấu trúc. Sử dụng siêu âm tim để hướng dẫn chọc vách liên nhĩ giúp nâng cao độ an toàn và rút ngắn thời gian làm thủ thuật, đặc biệt trong trường hợp bác sĩ can thiệp chưa có nhiều kinh nghiệm.
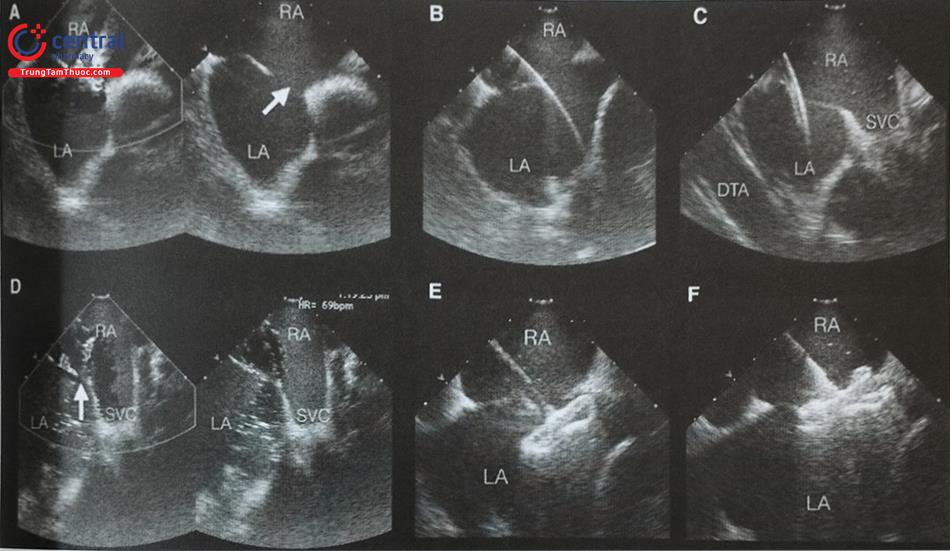
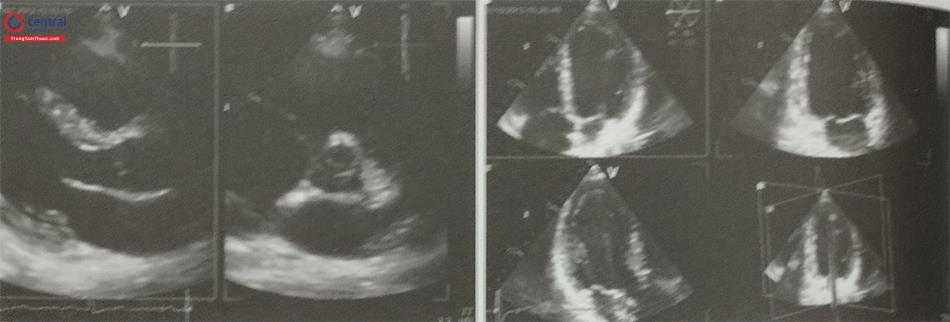
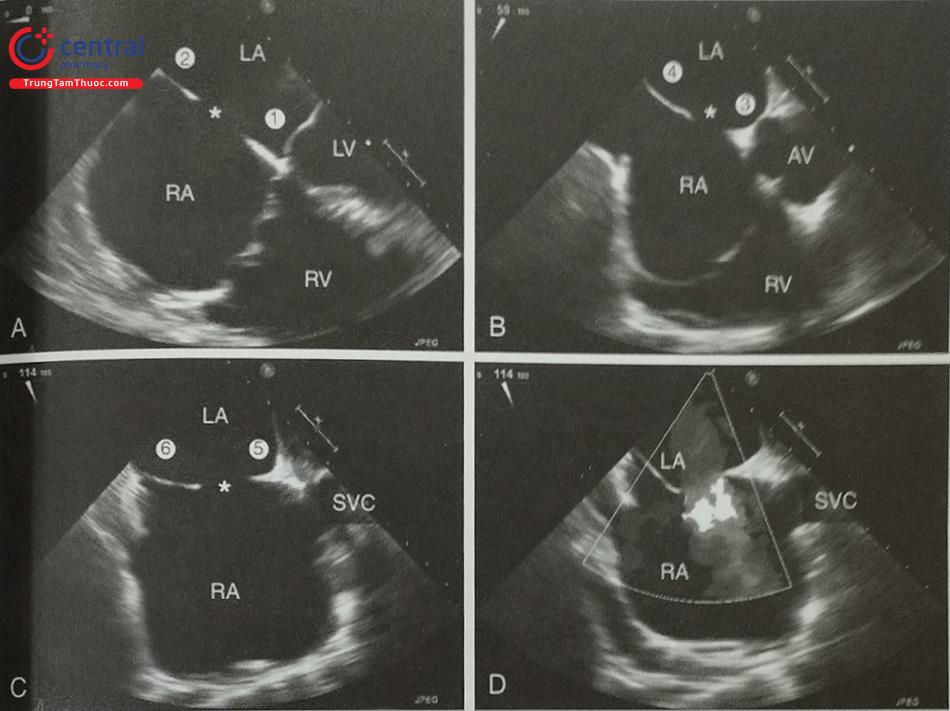
Khi sử dụng siêu âm tim qua thực quản hướng dẫn chọc vách liên nhĩ, bệnh nhân cần được gây ngủ hoặc gây mê toàn thân. Trên siêu âm tim 2D qua thực quản, cần ghi hình nhiều mặt cắt siêu âm để lựa chọn vị trí chọc vách liên nhĩ chính xác. Mặt cắt qua 2 tĩnh mạch chủ (mặt cắt 80-110O giữa thực quản) ghi hình vách liên nhĩ theo chiều trên – dưới với các cấu trúc: tĩnh mạch chủ trên, tĩnh mạch chủ dưới, nhĩ phải, nhĩ trái và vách liên nhĩ (Hình 15.19a). Mặt cắt trục ngắn qua gốc động mạch chủ (mặt cắt 30-45O giữa thực quản) ghi hình vách liên nhĩ theo chiều trước – sau (van động mạch chủ ở phía trước) (Hình 15.19b). Do đó, trình diễn đồng thời 2 mặt cắt trên (biplane) là cách tốt nhất để xác định vị trí chọc vách liên nhĩ. Ví dụ: trong can thiệp kẹp sửa van hai lá qua đường ống thông, cần chọc vách liên nhĩ ở vị trí sau trên (xa động mạch chủ và tĩnh mạch chủ dưới).
Ngoài ra, mặt cắt 4 buồng (0O giữa thực quản) rất hữu ích để đo khoảng cách (chiều cao) từ vị trí chọc vách liên nhĩ tới mặt phẳng vòng van hai lá (trong các can thiệp bệnh lý van hai lá) (Hình 15.19c). Trước khi bác sĩ can thiệp đẩy kim chọc vách, cần xác định lại vị trí chọc vách một lần nữa. Tốt nhất, cần thấy được hình ảnh vách liên nhĩ bị đẩy thành hình chiếc lều (tenting) khi kim chọc vách đi từ nhĩ phải sang nhĩ trái thay vì hình ảnh đầu kim đơn thuần (Hình 20).
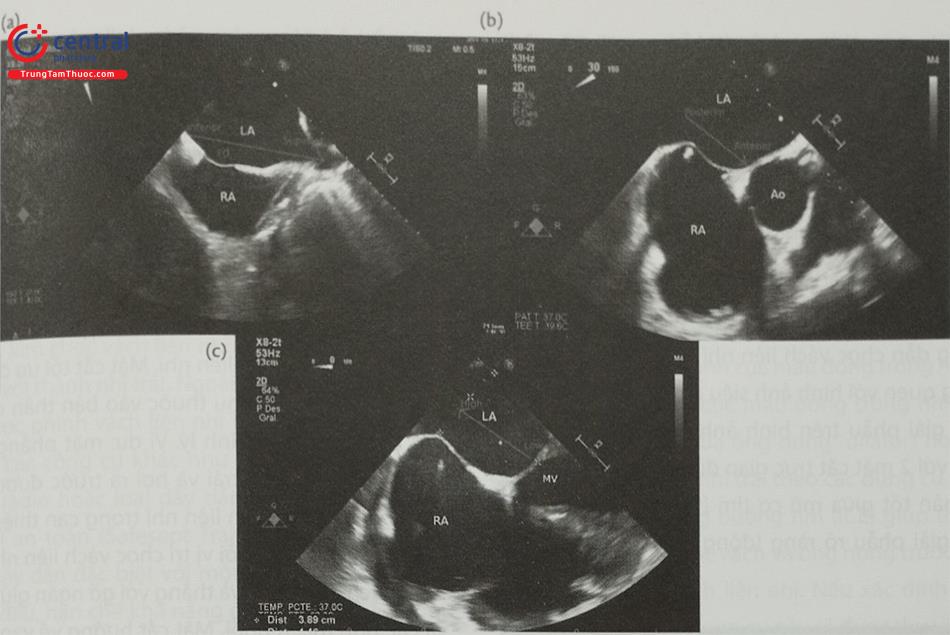
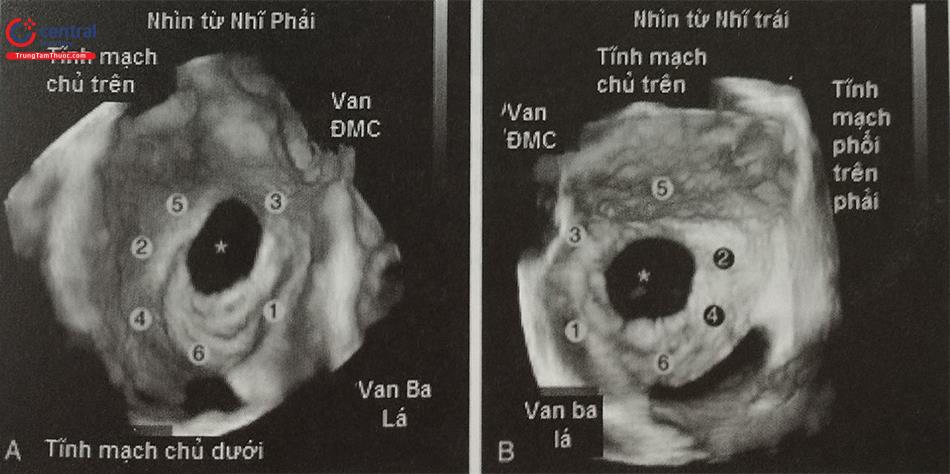
a- Mặt cắt qua 2 tĩnh mạch chủ (80-110O giữa thực quản) bộc lộ vách liên nhĩ theo chiều trên – dưới (superior – inferior). b- Mặt cắt trục ngắn qua gốc động mạch chủ (30-45O giữa thực quản) ghi hình vách liên nhĩ theo chiều trước – sau (anterior – posterior). c- mặt cắt 4 buồng (0O giữa thực quản) để đo khoảng cách (chiều cao) từ vị trí chọc vách liên nhĩ tới mặt phẳng vòng van hai lá. (Chú thích: LA: nhĩ trái; RA: nhĩ phải; MV: van hai lá; Ao: gốc động mạch chủ).
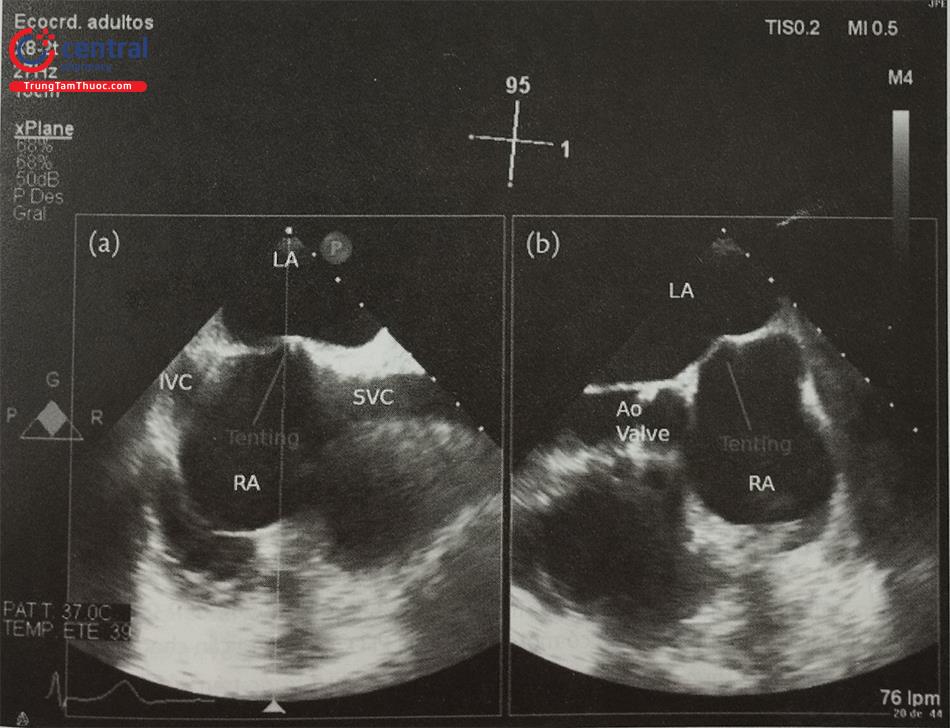
(Chú thích: LA: nhĩ trái; RA: nhĩ phải; MV: van hai lá; Ao: gốc động mạch chủ).
Siêu âm tim qua thực quản 3D có thể trình diễn hình ảnh vách liên nhĩ trên 2 mặt cắt trực giao bằng mode ghi hình X-plane (multiplane) (Hình 15.20) hoặc tái dựng hình ảnh 3D trực diện của vách liên nhĩ (Hình 15.21). Việc lựa chọn cách ghi hình nào tùy thuộc vào kinh nghiệm và yêu cầu của bác sĩ can thiệp và cần có sự phối hợp nhuần nhuyễn giữa bác sĩ siêu âm và bác sĩ can thiệp. Trên thực tế, không nhất thiết phải tái dựng hình ảnh 3D trực diện vách liên nhĩ để hướng dẫn chọc vách liên nhĩ bởi bác sĩ can thiệp có thể không quen với hình ảnh siêu âm tim 3D cũng như định hướng giải phẫu trên hình ảnh 3D. Ngược lại hình ảnh X-plane với 2 mặt cắt trực giao được ưa thích hơn bởi độ tương phản tốt giữa mô cơ tim (trắng) và máu (đen) và các mốc giải phẫu rõ ràng (động mạch chủ, các tĩnh mạch chủ).
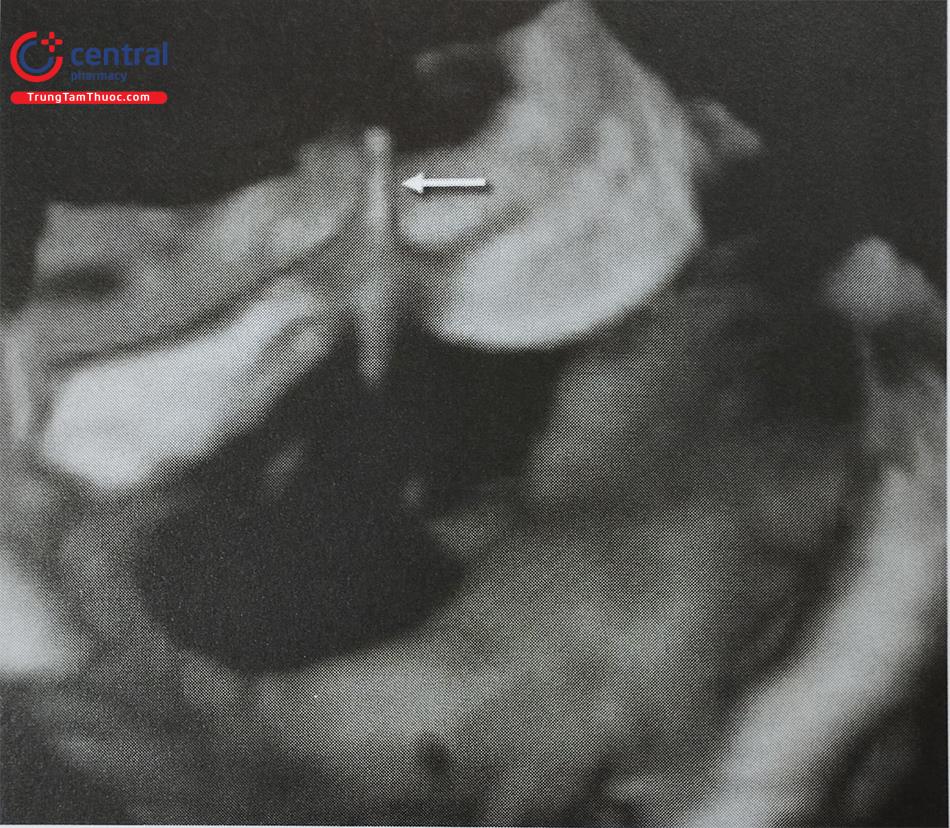
Chú thích: Mũi tên chỉ vào đầu catheter đã đi qua vách liên nhĩ sang nhĩ trái.
Siêu âm tim với đầu dò trong buồng tim (Intracardiac echocardiography)
Siêu âm tim đầu dò qua trong buồng tim (ICE) có một số ưu điểm so với siêu âm tim qua thực quản trong hướng dẫn chọc vách liên nhĩ:
- Bệnh nhân không cần được gây ngủ hoặc gây mê.
- Bác sĩ can thiệp có thể tự điều khiển catheter mang đầu dò siêu âm để ghi hình mà không cần bác sĩ siêu âm
- Độ phân giải không gian của hình ảnh siêu âm tốt.
Tuy nhiên, ICE cần có thêm đường vào tĩnh mạch đùi để đưa catheter mang đầu dò siêu âm vào buồng tim và chi phí cao so với siêu âm tim qua thực quản. Sau khi catheter ICE được đẩy vào buồng nhĩ phải, quá trình ghi hình siêu âm bắt đầu từ mặt cắt qua van ba lá (mặt cắt cơ sở) với hình ảnh van ba lá, buồng nhận và đường ra thất phải. Từ mặt cắt này, bác sĩ can thiệp cần xoay catheter ra sau để ghi hình vách liên nhĩ. Mặt cắt tối ưu để hướng dẫn chọc vách liên nhĩ phụ thuộc vào bản thân can thiệp tim cấu trúc hoặc điện sinh lý. Ví dụ: mặt phẳng ngang mức các tĩnh mạch phổi trái và hơi ra trước được sử dụng để hướng dẫn chọc vách liên nhĩ trong can thiệp triệt đốt cô lập tĩnh mạch phổi bởi vị trí chọc vách liên nhĩ nằm xa các tĩnh mạch phổi phải và thẳng với gờ ngăn giữa tiểu nhĩ trái và các tĩnh mạch phổi. Mặt cắt hướng về van hai lá ở phía trước lại phù hợp để hướng dẫn chọc vách liên nhĩ trong can thiệp triệt đốt nhịp nhanh thất hoặc nong van hai lá bằng bóng. Tuy nhiên, dù ở vị trí nào, mặt cắt tối ưu cần lấy được toàn bộ không gian giữa vách liên nhĩ và thành bên nhĩ trái.
Cần gập nhẹ catheter ICE ra sau để đầu dò ICE tách khỏi vách liên nhĩ và ghi được mặt cắt siêu âm toàn cảnh. Cần tránh lấy mặt cắt ra trước quá nhiều bao gồm cả gốc động mạch chủ bởi nguy cơ thủng gốc động mạch chủ khi chọc vách liên nhĩ. Ngược lại, mặt cắt hướng ra phía sau quá nhiều (lấy cả tĩnh mạch phổi dưới phải) làm tăng nguy cơ chọc nhầm vào thành sau nhĩ trái. Trong quá trình đưa kim chọc vách liên nhĩ, đầu dò ICE nằm trong nhĩ phải có thể ghi hình rõ nét hình ảnh vách liên nhĩ bị ấn thành hình lều khi đầu mút của ống nong (dilator) và kim được đẩy vào vách liên nhĩ. Khi ống nong đã xuyên qua vách, hình ảnh “lều” trùng xuống và có thể thấy hình ảnh đầu ống nong đi qua vách, nằm trong nhĩ trái. Có thể bơm bọt cản âm qua kim chọc vách liên nhĩ để đảm bảo đầu kim chọc vách đúng vị trí mong muốn trên hình ảnh ICE. Siêu âm ICE phối hợp doppler màu giúp phát hiện thấm lỗ bầu dục (PFO). Trong một số trường hợp có thể đưa dụng cụ can thiệp qua PFO mà không cần chọc vách liên nhĩ nhưng do PFO nằm ở vị trí trước trên của hố bầu dục, vị trí này có thể không phù hợp với một số can thiệp như Mitraclip.
Siêu âm tim với đầu dò trong buồng tim (ICE) có thể phát hiện các biến thể giải phẫu gây cản trở quá trình chọc vách liên nhĩ như phì đại mỡ tại vách liên nhĩ hoặc phình vách liên nhĩ. Trong trường hợp vách liên nhĩ bị phì đại mỡ, ICE có thể hướng dẫn xác định phần mỏng của hố bầu dục để đi qua vách liên nhĩ dễ dàng, tránh đưa kim vào vùng phì đại (Hình 22). Trong trường hợp bệnh nhân bị phình vách liên nhĩ, khi đẩy kim chọc vách có thể thấy vách liên nhĩ bị ấn thành hình lều và sa rất sâu vào nhĩ trái có thể áp sát các đường bao của tim, làm tăng nguy cơ thủng thành tim gây tràn máu màng tim ngay sau khi chọc vách liên nhĩ. ICE đặc biệt hữu ích trong tình huống này để theo dõi hướng đi của kim chọc vách liên nhĩ và khoảng cách giữa vách liên nhĩ với thành nhĩ trái. Ngoài ra, trong trường hợp phát hiện được phình vách liên nhĩ trên hình ảnh ICE, có thể sử dụng các công cụ khác như kim chọc vách bằng sóng tần số radio hoặc loại dây dẫn đặc biệt giúp chọc vách liên nhĩ an toàn (Safesept Transseptal Guide wire). Đây là một dây dẫn đặc biệt với một kim mềm dẻo cong hình chữ J ở đầu, hạn chế khả năng đâm thủng thành tim sau khi đi qua vách liên nhĩ.
Một thách thức khác khi chọc vách liên nhĩ là nhóm bệnh nhân đã được phẫu thuật/can thiệp bít thông liên nhĩ hoặc PFO. Kim chọc vách có thể dễ dàng xuyên qua miếng vá bằng màng ngoài tim hoặc Dacron nhưng miếng vá Gortex lại cứng hơn và rất khó xuyên thủng. Trong trường hợp có dụng cụ bít thông liên nhĩ, ICE giúp xác định vùng vách liên nhĩ tự nhiên không bị dụng cụ che phủ thường ở vùng sau dưới của vách liên nhĩ.
Một trong những vấn đề quan trọng khi chọc vách liên nhĩ là dự phòng hình thành cục máu đông trong nhĩ trái. Trong một số trường hợp cục máu đông trong nhĩ phải có thể bám vào đầu mút của ống nong (dilator) hoặc kim chọc vách và bị đẩy sang nhĩ trái theo các dụng cụ này. Siêu âm tim với đầu dò trong buồng tim (ICE) giúp theo dõi hình ảnh của đầu kim chọc vách và ống nong trước khi đưa kim chọc xuyên qua vách liên nhĩ. Nếu xác định có cục máu đông bám vào, các dụng cụ này sẽ được thu về và làm sạch trước khi tiến hành lại thủ thuật đồng thời kiểm tra lại thời gian ACT của bệnh nhân.
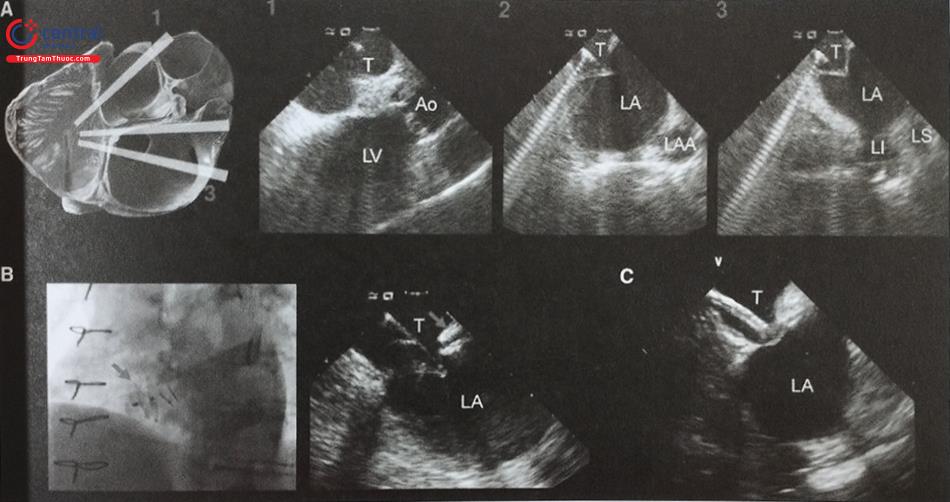
A – (1) Mặt cắt qua gốc động mạch chủ hướng ra phía trước quá nhiều làm tăng nguy cơ tổn thương động mạch chủ khi chọc vách liên nhĩ. (2) Mặt cắt lùi ra phía sau cắt qua tiểu nhĩ trái rất phù hợp để hướng dẫn chọc vách liên nhĩ trong can thiệp bít tiểu nhĩ trái hoặc nong van hai lá. (3) Mặt cắt lùi nhẹ ra phía sau cắt qua các tĩnh mạch phổi trái thường được sử dụng để hướng dẫn chọc vách liên nhĩ trong can thiệp triệt đốt rung nhĩ.
B – Chọc vách liên nhĩ ở bệnh nhân đã được bít thông liên nhĩ bằng dụng cụ (mũi tên). ICE giúp xác định vùng vách liên nhĩ không bị dụng cụ che phủ.
C – Chọc vách liên nhĩ ở bệnh nhân bị phì đại mỡ tại vách liên nhĩ. ICE giúp xác định phần mỏng để chọc vách liên nhĩ, tránh khu vực phì đại.
(Chú thích: T: dụng cụ chọc vách liên nhĩ; LA: nhĩ trái; LAA: tiểu nhĩ trái; LV: thất trái; Ao: động mạch chủ; LI; tĩnh mạch phổi dưới trái; LS: tĩnh mạch phổi trên trái)
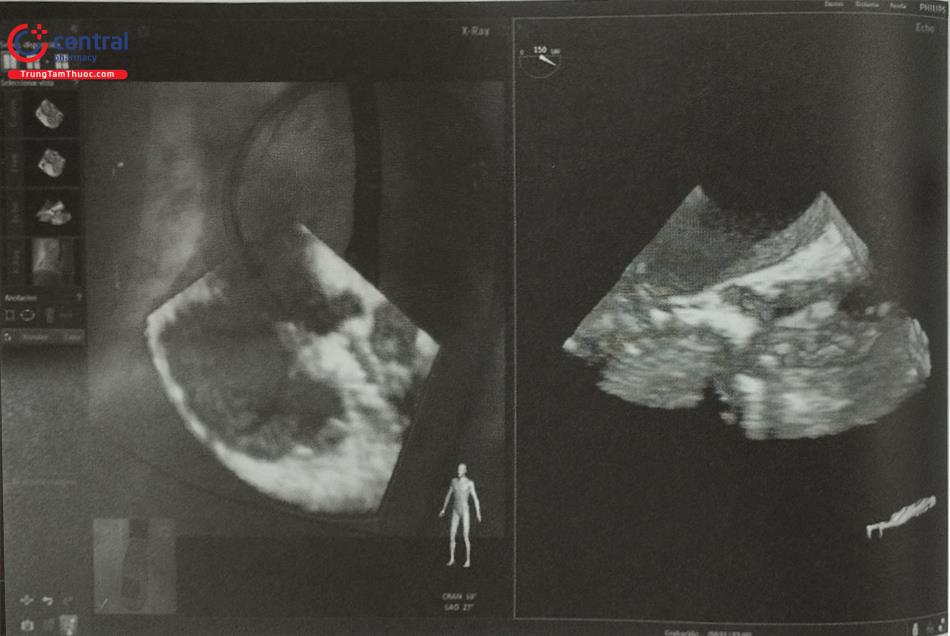
Lồng ghép hình ảnh siêu âm tim và chiếu huỳnh quang (echocardiographic-fluoroscopic fusion imaging) là kỹ thuật mới nhằm kết hợp ưu điểm của siêu âm tim qua thực quản 2D/3D với chiếu huỳnh quang trên một hình ảnh duy nhất (Hình 23). Khả năng định vị catheter và dụng cụ can thiệp tốt với thị trường rộng của chiếu huỳnh quang được phối hợp với hình ảnh chi tiết của mô mềm trên siêu âm tim qua thực quản giúp bác sĩ can thiệp dễ dàng xác định vị trí chọc vách liên nhĩ, phối hợp tay-mắt dễ dàng hơn bởi không cần cùng lúc quan sát và phiên giải hình ảnh siêu âm và chiếu huỳnh quang riêng biệt trên 2 thiết bị khác nhau, góc chiếu huỳnh quang được lựa chọn phù hợp với từng bệnh nhân.
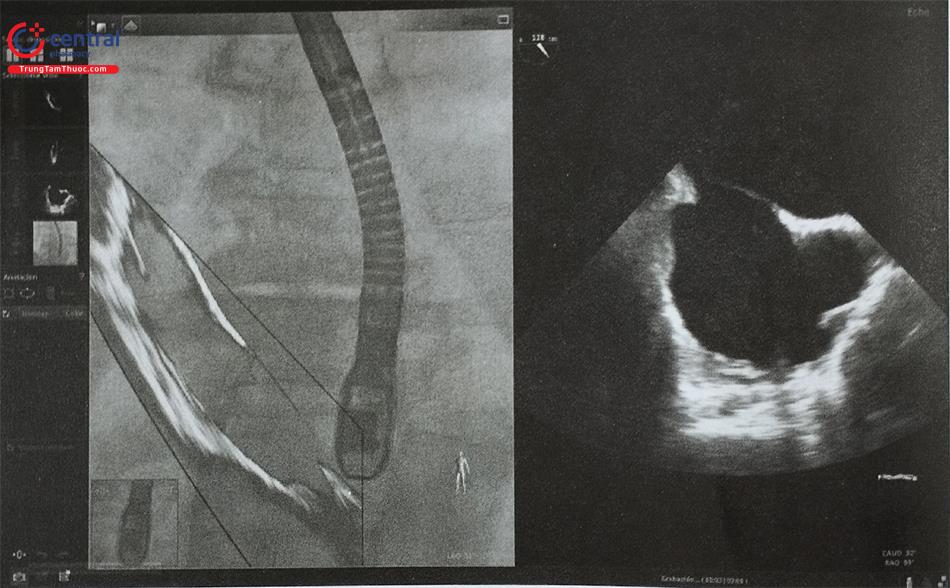
Chú thích: Hình ảnh siêu âm 2D cắt qua hai tĩnh mạch chủ (phải) được đặt chồng lên màn huỳnh quang (trái) cho thấy catheter đang hướng về vách liên nhĩ
2.1.2 Can thiệp bít tiểu nhĩ trái bằng dụng cụ qua đường ống thông
Can thiệp bít tiểu nhĩ trái bằng dụng cụ qua đường ống thông là liệu pháp điều trị thay thế cho những bệnh nhân rung nhĩ không do bệnh van tim nhưng bị chống chỉ định với các thuốc chống đông đường uống. Nhiều loại dụng cụ đã được thiết kế và cải tiến để bít tiểu nhĩ trái như dụng cụ Watchman (cổ điển hoặc FLX), dụng cụ bít tiểu nhĩ trái của Amplazer (Amplatzer Cardiac Plug hay ACP) thế hệ 1 và thế hệ 2 (Amulet), dụng cụ Wavecrest, dụng cụ Lariat. Đa số các loại dụng cụ bít tiểu nhĩ trái được đưa vào cơ thể qua đường chọc vách liên nhĩ hay tiếp cận bít tiểu nhĩ trái theo đường nội tâm mạc. Riêng can thiệp Lariat là phương pháp thắt tiểu nhĩ trái bằng cách tiếp cận từ cả 2 phía nội tâm mạc và thượng tâm mạc.
Các phương tiện chẩn đoán hình ảnh tim mạch như MSCT, siêu âm tim qua thực quản 3D có vai trò then chốt trong đánh giá đặc điểm giải phẫu tiểu nhĩ trái và loại trừ huyết khối tiểu nhĩ trái trước thủ thuật. Siêu âm tim qua thực quản 3D hoặc siêu âm tim với đầu dò trong buồng tim (ICE) có vai trò hướng dẫn trong can thiệp bít tiểu nhĩ trái bằng dụng cụ và phát hiện sớm các biến chứng. Sau đây chúng tôi sẽ trình bày chi tiết vai trò của siêu âm tim trong can thiệp bít tiểu nhĩ trái theo đường chọc vách liên nhĩ, cách tiếp cận thường sử dụng nhất với các dụng cụ như Watchman hoặc Amulet.
Trước can thiệp
Mặc dù MSCT được sử dụng ngày càng phổ biến, siêu âm tim qua thực quản 3D vẫn có vai trò quan trọng để phát hiện huyết khối tiểu nhĩ trái, đánh giá đặc điểm giải phẫu và đo đạc các kích thước của tiểu nhĩ trái trước can thiệp, đặc biệt có ý nghĩa trong trường hợp bệnh nhân bị chống chỉ định với thuốc cản quang như suy thận. Các vấn đề cần đánh giá bao gồm:
Đặc điểm giải phẫu tiểu nhĩ trái:
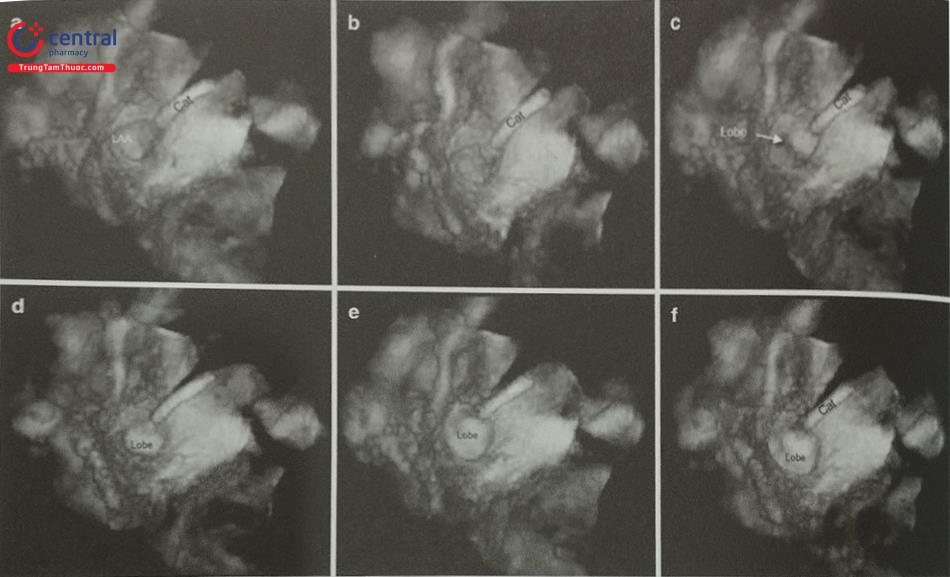
- Siêu âm tim qua thực quản, đặc biệt là siêu âm tim qua thực quản 3D thời gian thực giúp đánh giá chính xác hình dạng tiểu nhĩ trái, các thùy bên và phát hiện huyết khối tiểu nhĩ trái. Tiểu nhĩ trái có thể có nhiều hình dạng phức tạp với nhiều thùy bên (Hình 24) như hình ống phong tiêu, hình cánh gà, hình súp lơ, hình cây xương rồng, hình chiếc bốt (Hình nước Ý). Trong đó, tiểu nhĩ trái hình ống phong tiêu phù hợp để can thiệp bít bằng dụng cụ Watchman trong khi tiểu nhĩ trái hình chiếc bốt không phù hợp để can thiệp.
- Siêu âm tim qua thực quản 3D giúp phát hiện huyết khối nhỏ tại các góc khuất trong thùy bên của tiểu nhĩ trái và phân biệt huyết khối với cơ lược của tiểu nhĩ trái tốt hơn so với siêu âm tim qua thực quản 2D (Hình 25).

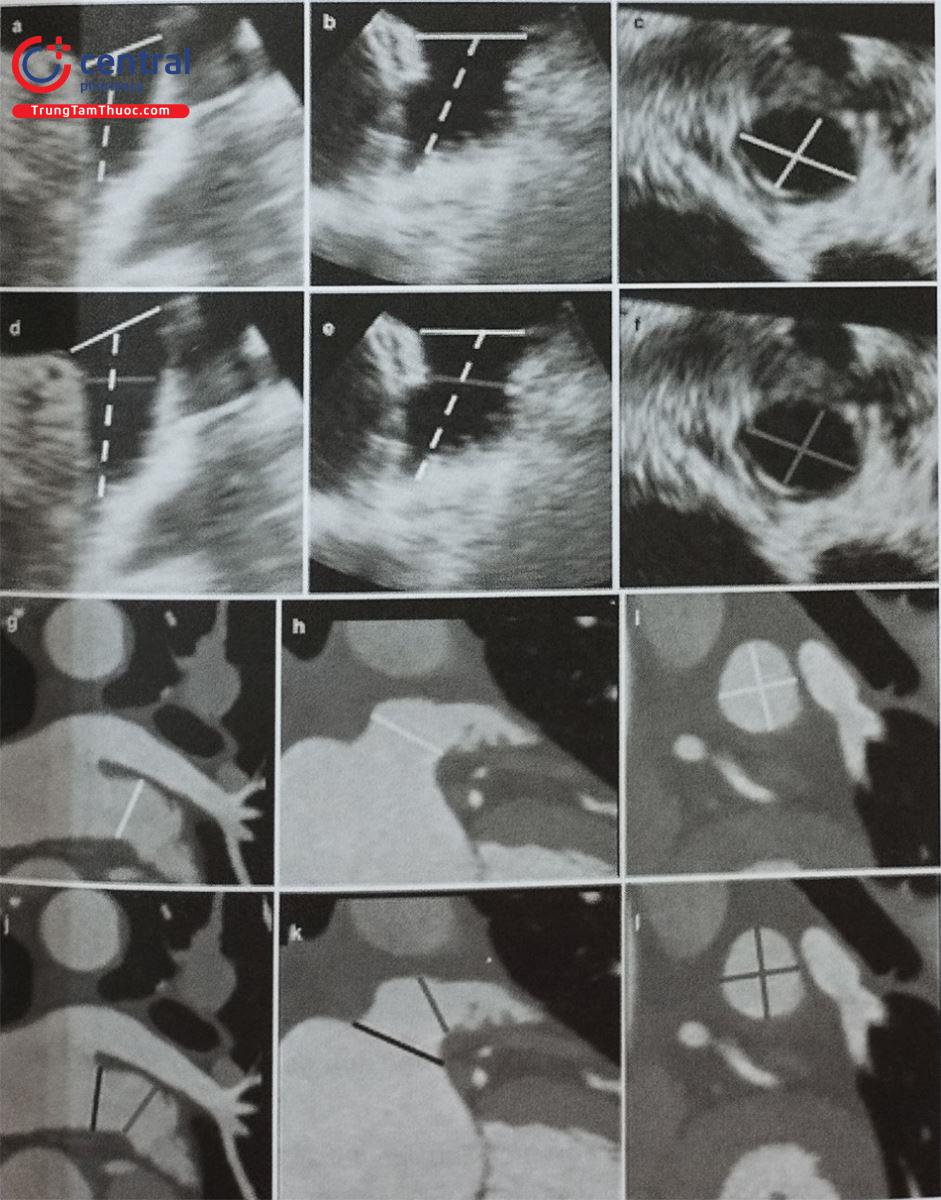
Hình ảnh siêu âm tim 3D nhìn trực diện tiểu nhĩ trái từ phía nhĩ trái. b- Khối hình 3D được xử lý cắt gọt (crop) bỏ đi nửa bên trái. c- Nửa còn lại của khối hình 3D được xoay theo trục Y để ghi hình tiểu nhĩ trái cắt dọc. d- Khối hình 3D được xoay theo trục Z để đặt đúng hướng giải phẫu của tiểu nhĩ trái với các thùy bên (mũi tên).
.jpg)
Đo đường kính diện bám (landing zone) của dụng cụ:
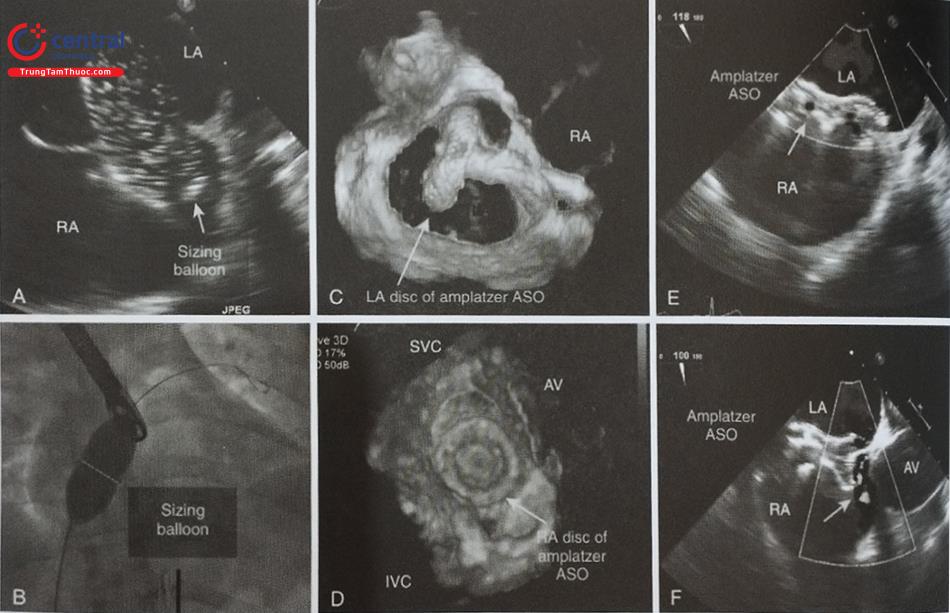
- Cần lưu ý lỗ giải phẫu của tiểu nhĩ trái khác với diện bám (landing zone) của dụng cụ bít. Diện bám là nơi dụng cụ bít được đặt trong lòng tiểu nhĩ trái. Do đó, đo đạc chính xác kích thước của diện bám có vai trò đặc biệt quan trọng để lựa chọn kích thước dụng cụ. Chọn dụng cụ bít có kích thước quá lớn (oversize) có thể gây thủng tiểu nhĩ dẫn tới tràn máu màng ngoài Ngược lại, sử dụng dụng cụ có kích thước không đủ (undersize) có thể dẫn tới rò quanh dụng cụ (tiểu nhĩ được bít không hoàn toàn) hoặc di lệch thậm chí rơi dụng cụ gây biến cố thuyên tắc.
- Để đo các đường kính lỗ tiểu nhĩ trái và diện bám của dụng cụ, cần lấy các mặt cắt giữa thực quản từ 0 tới 135O. Khuyến cáo nên đo các đường kính trên ít nhất 4 mặt cắt: 0O; 45O; 90O và 135O (Hình 26). Do diện bám thực tế thường có hình elip, siêu âm tim 2D qua thực quản có thể đo đường kính diện bám không chính xác bởi chỉ đo được 1 đường kính. Siêu âm tim 3D qua thực quản với phương thức tái dựng hình ảnh đa bình diện (Multiplanar Reconstruction hay MPR) cho phép đo đường kính lỗ vào tiểu nhĩ trái trên hình ảnh có chất lượng tốt nhất tại nhiều góc khác Bằng chức năng MPR, có thể chỉnh 2 trục dài của tiểu nhĩ trái trên 2 bình diện thẳng hàng để thu được hình ảnh thiết diện cắt ngang qua tiểu nhĩ trái cắt đúng qua vùng “landing zone” và đo chính xác các đường kính của vùng này (Hình 27). Đối với dụng cụ Watchman, đường kính diện bám đo ở ngang mức động mạch mũ tới gờ thành bên của tiểu nhĩ trái. Đối với dụng cụ Amulet, đường kính diện bám đo cách lỗ giải phẫu của tiểu nhĩ trái 10 -12 mm (dưới động mạch mũ) tới gờ thành bên của tiểu nhĩ trái (Hình 26 và 27).
- Ngoài ra, siêu âm tim 3D qua thực quản cho phép tái dựng hình ảnh 3D trực diện (enface view) của tiểu nhĩ trái nhìn từ lỗ vào để đo đường kính lỗ vào của tiểu nhĩ trái và diện bám (Hình 27). Các phần mềm hậu xử lý hình ảnh như “3D Auto LAA” của hãng Philips cho phép đo đạc nhanh các kích thước của tiểu nhĩ trái.
- Đường kính diện bám đo trên siêu âm tim 3D qua thực quản có kết quả rất gần với MSCT – phương pháp được coi là chuẩn vàng.
- Lưu ý trên siêu âm tim đường kính diện áp và lỗ tiểu nhĩ trái được đo vào thời điểm cuối tâm thu còn trên MSCT các đường kính được đo tại cuối thời điểm nhĩ co (cuối tâm trương) trong chu chuyển
- Tiền gánh có ảnh hưởng lớn tới kết quả đo do tiểu nhĩ trái có thành mỏng và dễ căng giãn. Đường kính lỗ tiểu nhĩ và diện bám của dụng cụ được đo khi bệnh nhân được gây mê toàn thân thường nhỏ hơn (khoảng 5 mm) so với lúc bệnh nhân tỉnh bởi các thuốc gây mê có tác dụng giãn mạch, làm giảm tiền gánh và hậu gánh. Về nguyên tắc, chỉ đánh giá lại kích thước tiểu nhĩ trái trong can thiệp khi áp lực nhĩ trái > 12 Nếu bệnh nhân có áp lực nhĩ trái thấp, cần truyền khoảng 500 – 1000 mL dịch đẳng trương để nâng áp lực nhĩ trái, đảm bảo kết quả đo chính xác.
Đo chiều sâu của tiểu nhĩ trái:
- Đối với dụng cụ Watchman, chiều sâu của tiểu nhĩ trái được đo từ lỗ tiểu nhĩ trái tới nơi sâu nhất của thùy chính vuông góc với diện bám. Do dụng cụ Watchman có chiều dài tương đương với chiều rộng, thùy chính của tiểu nhĩ trái cần có độ sâu tối thiểu tương đương với kích thước dụng cụ. Dụng cụ bít không được vượt quá lỗ tiểu nhĩ > 4 – 7 mm (Hình 26).
- Đối với dụng cụ Amulet, chiều sâu của tiểu nhĩ trái được đo từ lỗ tiểu nhĩ trái tới thành tiểu nhĩ trái vẽ vuông góc với lỗ tiểu nhĩ trái (Hình 26).
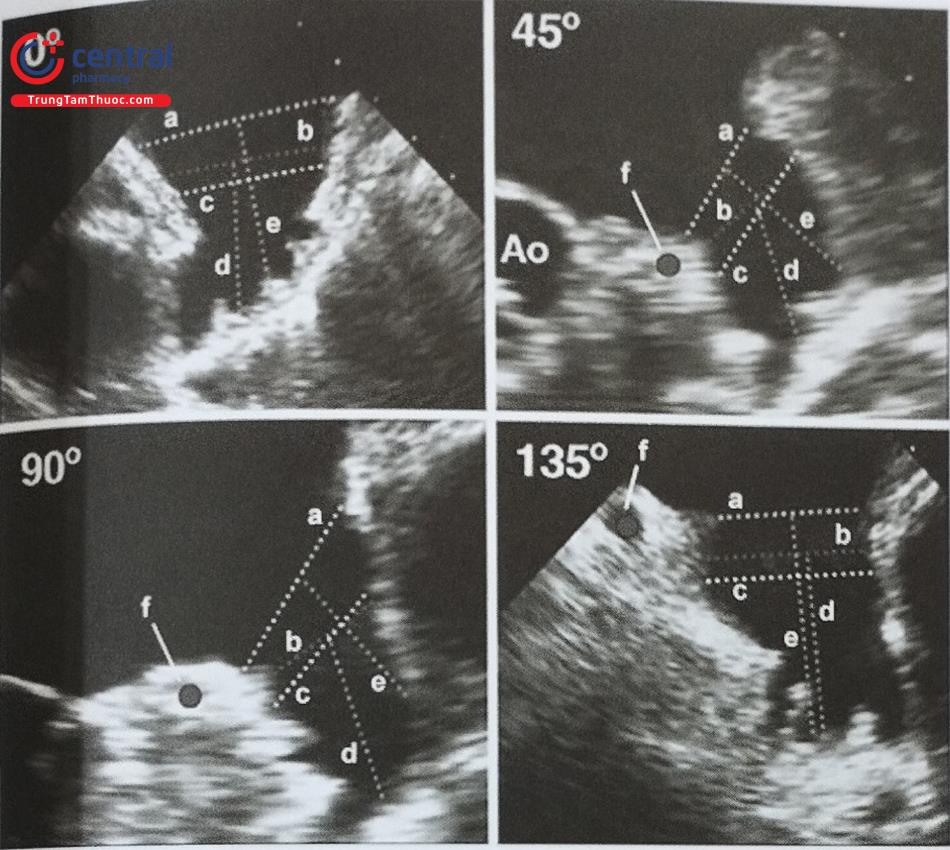
(1) Đường nét đứt a tương ứng với đường kính lỗ vào của tiểu nhĩ trái, đường nét đứt b tương ứng với đường kính diện bám của dụng cụ Watchman. (2) Đường kính diện bám của dụng cụ Watchman được đo ngang mức động mạch mũ (chấm f) tới gờ tĩnh mạch phổi trên trái. (3) Đường nét đứt c tương ứng với đường kính diện bám của dụng cụ Amulet. (4) Chiều sâu của thùy chính tiểu nhĩ trái được đo vuông góc với đường đo diện áp của dụng cụ (đường nét đứt d) hoặc đo dọc theo trục của tiểu nhĩ trái (đường nét đứt e).
Trong can thiệp
Chọc vách liên nhĩ
Vị trí chọc vách liên nhĩ lý tưởng trong can thiệp bít tiểu nhĩ trái bằng dụng cụ nằm ở phần sau dưới của hố bầu dục. Do đó cần ghi hình 2 mặt cắt trực giao từ giữa thực quản:
- Mặt cắt qua 2 tĩnh mạch chủ (60-90O): xác định vị trí chọc vách theo chiều trên dưới, nên chọc vách liên nhĩ từ điểm giữa tới phần dưới của vách liên nhĩ.
- Mặt cắt trục ngắn qua động mạch chủ (45O): xác định vị trí chọc vách liên nhĩ theo chiều trước – sau, nên chọc vách liên nhĩ ở phía sau (xa động mạch chủ).
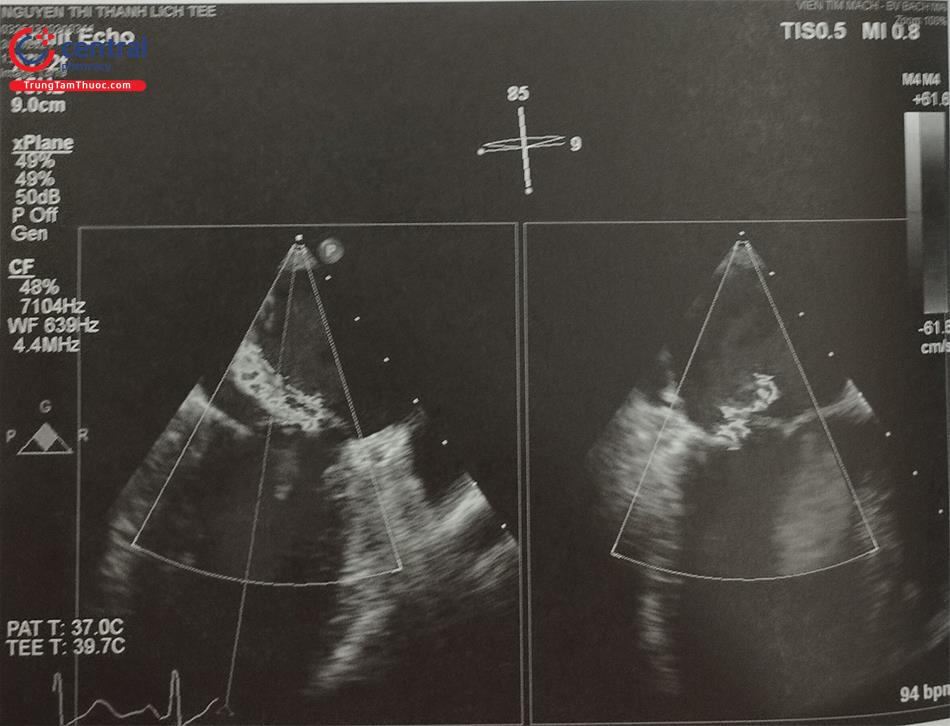
Siêu âm tim 3D qua thực quản với mode X-plane (hoặc multiplane) với khả năng trình diễn đồng thời 2 mặt cắt trực giao thời gian thực rất hữu ích trong hướng dẫn chọc vách liên nhĩ. Cần thấy được hình ảnh vách liên nhĩ bị ấn thành hình lều (tenting) khi catheter đẩy vào vách liên nhĩ. Ngoài ra, dựng hình ảnh 3D trực diện của vách liên nhĩ nhìn từ phía nhĩ phải hoặc nhĩ trái cho phép đánh giá chính xác vị trí của kim chọc vách và theo dõi quá trình kim chọc vách đi từ nhĩ phải sang nhĩ trái (Hình 28).
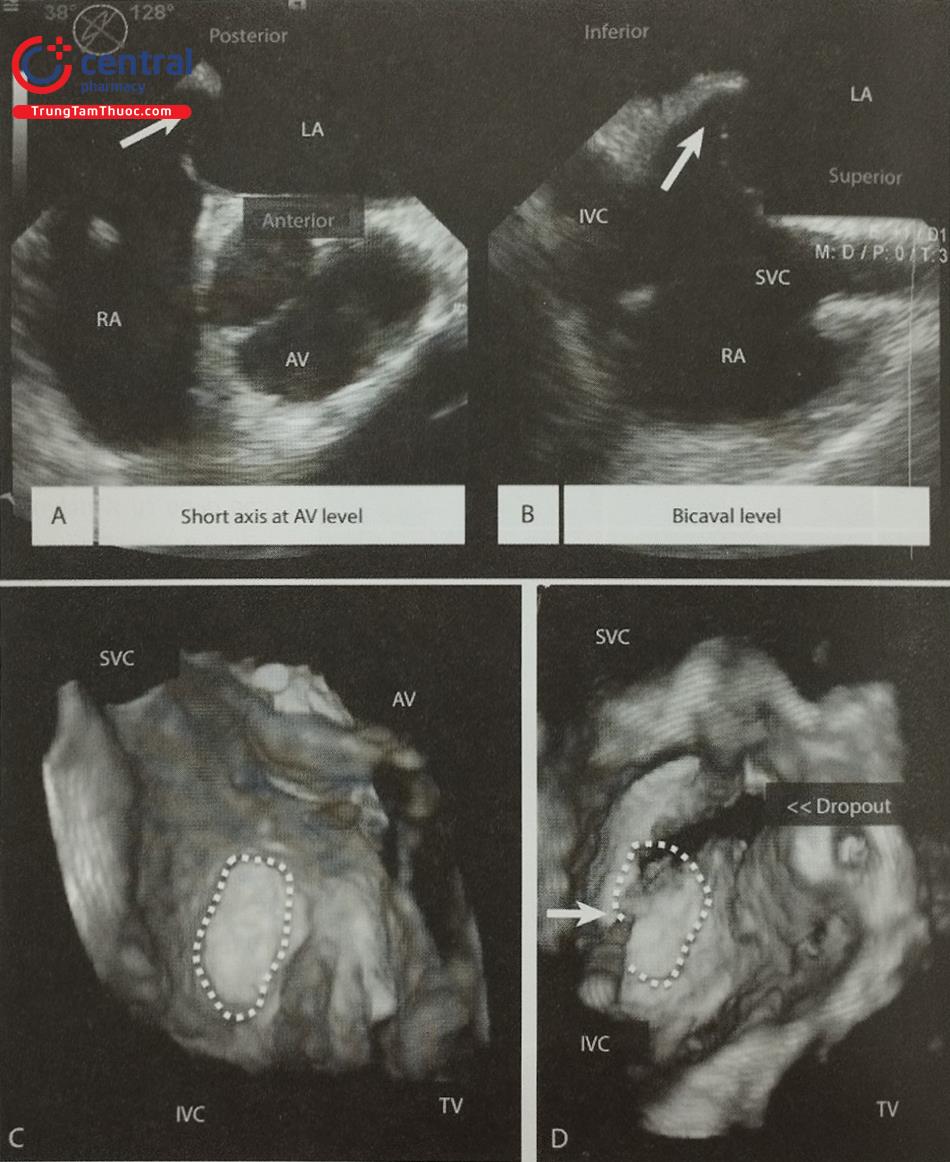
Lưu ý ảnh giả mất hình (dropout) trên hình D do catheter. Anterior: Trước; Posterior: Sau; Inferior: Dưới; Superior: Trên; RA: Nhĩ phải; LA: Nhĩ trái; AV: Van động mạch chủ ;IVC: Tĩnh mạch chủ dưới; SVC: Tĩnh mạch chủ trên; LA: Nhĩ trái.
Định vị dụng cụ
Sau khi chọc vách liên nhĩ thành công, catheter dẫn đường được đẩy vào nhĩ trái trên dây dẫn và sau đó được đưa vào tiểu nhĩ trái. Siêu âm tim qua thực quản 3D cho phép ghi hình tiểu nhĩ trái từ các góc khác nhau, đặc biệt là hình ảnh tiểu nhĩ trái trên trục dọc để đảm bảo đầu mút của catheter đã nằm trong tiểu nhĩ trái (Hình 29).
.jpg)
Thả dụng cụ
Quá trình thả dụng cụ có thể được theo dõi liên tục trên hình ảnh siêu âm tim 3D qua thực quản nhìn trực diện nhĩ trái từ mặt nhĩ. Trên hình ảnh này, dụng cụ bít nở dần cho tới khi lấp kín hoàn toàn tiểu nhĩ trái (Hình 30). Trước khi thả dụng cụ cần kiểm tra 4 tiêu chí (four PASS: Position, Anchor, Size, Seal) (Hình 32):
- Vị trí của dụng cụ: Vai trò của siêu âm tim 2D và 3D qua thực quản ở bước này là xác định vị trí của dụng cụ bít. Nếu dụng cụ bít nằm lệch trong tiểu nhĩ trái, cần đặt lại dụng cụ. Phần lớn nhất của dụng cụ nên ở ngay sát lỗ tiểu nhĩ và che phủ hoàn toàn lỗ tiểu nhĩ.
- Độ ổn định của dụng cụ: được bác sĩ can thiệp kiểm tra bằng nghiệm pháp giật (tug test).
- Đường kính tối đa của dụng cụ phải được đo trên nhiều góc. Kỳ vọng kích thước dụng cụ khi đặt trong tiểu nhĩ trái (in situ) nhỏ hơn 10 – 20% so với kích thước ban đầu.
- Mức độ bít kín tiểu nhĩ trái: Sử dụng hình ảnh siêu âm 2D với Doppler màu, hạ thấp ngưỡng Nyquist khoảng 30 cm/s để phát hiện rò quanh dụng cụ. Siêu âm tim 3D phối hợp với Doppler màu cũng có ích nhưng độ phân giải thời gian thấp. Nếu rò quanh dụng cụ < 5 mm, không cần chỉnh lại vị trí dụng cụ. Nếu rò quanh dụng cụ > 5 mm, bệnh nhân vẫn phải uống thuốc chống đông.
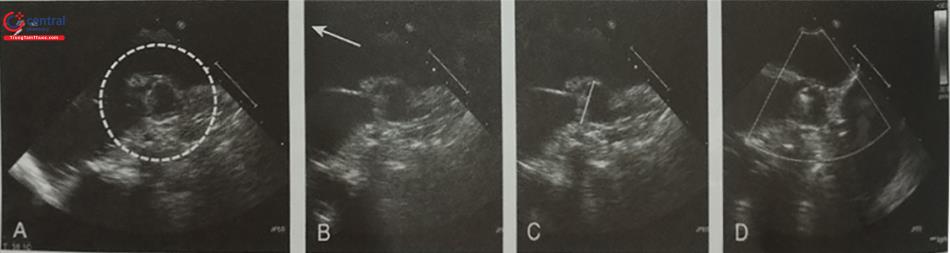
A- Vị trí dụng cụ (Position): Dụng cụ Watchman phải nằm hoàn toàn trong lỗ tiểu nhĩ trái. B- Độ ổn định chắc chắn của dụng cụ (Anchoring): dụng cụ không được di lệch khi làm nghiệm pháp giật (Tug test). C- Kích thước của dụng cụ (size): đo khoảng cách giữa 2 vai của dụng cụ trên 4 mặt cắt 0O; 45O; 90O và 135O. D- Mức độ bít kín tiểu nhĩ trái (seal): rò quanh dụng cụ < 5 mm.
Phát hiện biến chứng:
- Thủng nhĩ trái hoặc tiểu nhĩ trái: phải theo dõi liên tục để phát hiện tràn dịch màng ngoài tim trên siêu âm.
- Rơi dụng cụ gây biến cố thuyên tắc.
- Huyết khối hình thành trên dụng cụ.
- Rò quanh dụng cụ > 5 mm: tiểu nhĩ trái không được bít kín hoàn toàn.
- Shunt tồn lưu qua vách liên nhĩ.
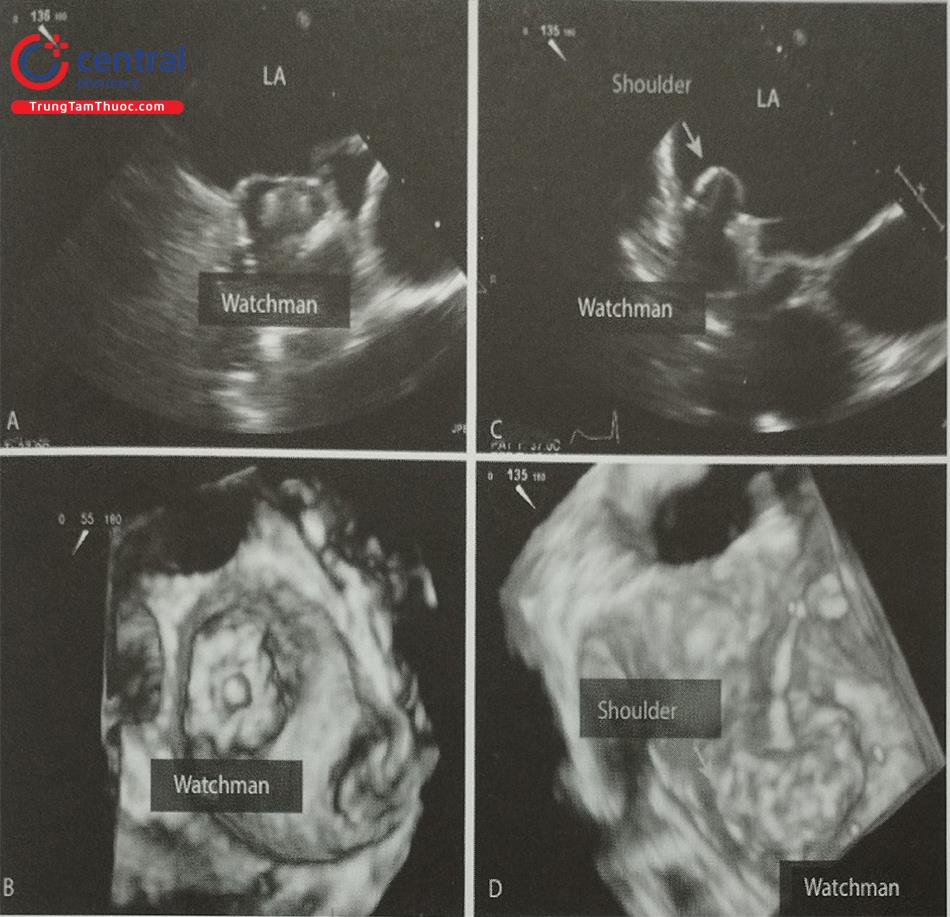
Chú thích: LA: Nhĩ trái; Shoulder: Phần vai dụng cụ
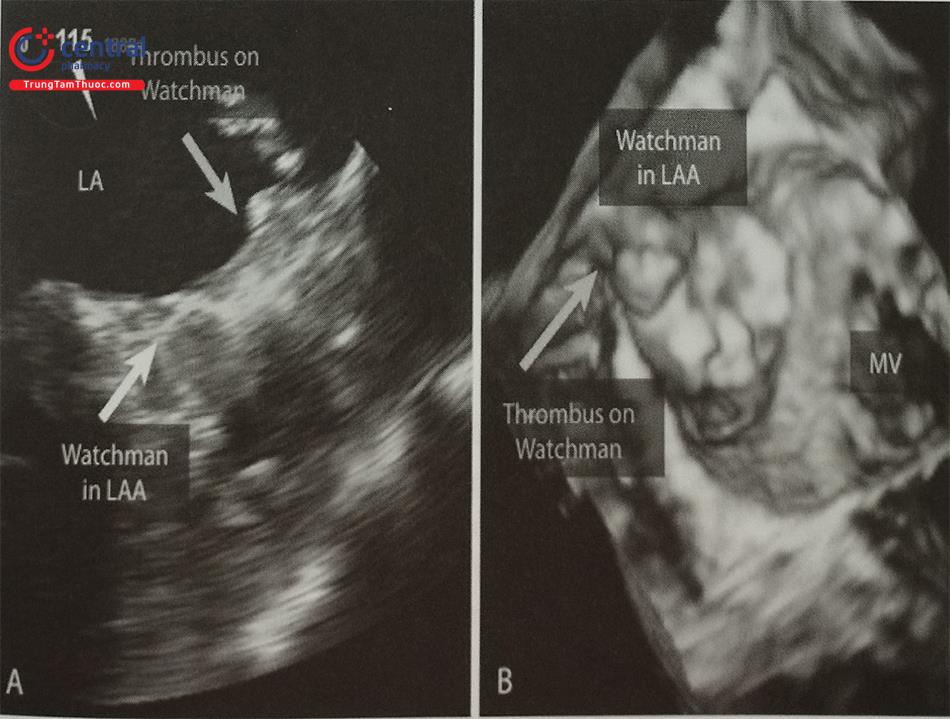
Chú thích: LAA: Tiểu nhĩ trái, MV: van hai lá; Thrombus: Huyết khối
Ngoài siêu âm tim qua thực quản, nhiều trung tâm sử dụng siêu âm tim với đầu dò trong buồng tim (ICE) để hướng dẫn trong can thiệp bít tiểu nhĩ trái bằng dụng cụ qua đường ống thông. Ưu điểm của ICE là bệnh nhân không cần gây mê toàn thân, chỉ cần gây ngủ và có thể ghi hình các cấu trúc tim khó bộc lộ trên hình ảnh siêu âm tim qua thực quản 2D truyền thống như xoang vành. Tuy nhiên, đối với can thiệp bít tiểu nhĩ trái bằng dụng cụ, ICE có một số hạn chế:
- Cần thêm 1 đường vào tĩnh mạch (thêm nguy cơ biến chứng mạch máu đường vào).
- Thị trường hẹp (đặc biệt là 3D ICE).
- Chuyển động của catheter ICE trong các buồng tim có thể kích phát rối loạn nhịp.
- Bác sĩ can thiệp cần được đào tạo để thao tác nhịp nhàng với ghi hình với catheter mang đầu dò ICE và catheter mang dụng cụ can thiệp.
- ICE đòi hỏi máy siêu âm chuyên dụng và chi phí đắt do catheter mang đầu dò siêu âm chỉ dùng một lần.
Ngoài ra, lồng ghép hình ảnh siêu âm tim 2D/3D qua thực quản lên màn tăng sáng (fusion imaging) giúp hướng dẫn thao tác lái và định vị catheter và dụng cụ can thiệp chính xác. Đây là kỹ thuật hiện đại và triển vọng giúp rút ngắn thời gian chiếu tia và thời gian làm thủ thuật.
Sau can thiệp
Làm lại siêu âm tim qua thực quản sau can thiệp 45 ngày nhằm phát hiện các biến chứng như rò quanh dụng cụ hoặc huyết khối trên dụng cụ.
2.1.3 Can thiệp bít thông liên nhĩ bằng dụng cụ
Thông liên nhĩ là một trong những bệnh tim bẩm sinh thường gặp nhất với tỷ lệ 1/1000. Thông liên nhĩ được chia thành 5 loại dựa trên vị trí của lỗ thông: thông liên nhĩ kiểu lỗ thứ hai (thường gặp nhất, chiếm 3/4 các trường hợp thông liên nhĩ), thông liên nhĩ kiểu lỗ thứ nhất, thông liên nhĩ thể xoang tĩnh mạch chủ trên hoặc chủ dưới và thông liên nhĩ thể xoang vành (xoang vành khuyết trần). Trong đó, chỉ thông liên nhĩ kiểu lỗ thứ hai mới có thể được đóng bằng dụng cụ qua đường ống thông nếu kích thước lỗ thông và các gờ quanh lỗ thông phù hợp. Chỉ định đóng thông liên nhĩ được tóm tắt trong bảng 5.
Bảng 5. Chỉ định đóng thông liên nhĩ kiểu lỗ thứ hai bằng phẫu thuật hoặc can thiệp ở người lớn
| Chỉ định | Mức độ I | Mức độ IIA | Mức độ IIB | Mức độ III |
| Triệu chứng | Có | Không | ||
| Giãn tim phải | Có | |||
| Qp/Qs | > 1,5 | < 1 (shunt phải –trái) | ||
| Áp lực động mạch phổi | < 50% huyết áp hệ thống | > 50% huyết áp hệ thống | > 2/3 huyết áp hệ thống | |
| Sức cản phổi | < 1/3 sức cản hệ thống | > 1/3 sức cản hệ thống | > 2/3 sức cản hệ thống | |
| Tím lúc nghỉ hoặc khi gắng sức | Không |
Can thiệp bít thông liên nhĩ bằng dụng cụ qua đường ống thông lần đầu được thực hiện từ giữa những năm 1970 và ngày nay trở thành phương pháp điều trị phổ biến nhất để bít thông liên nhĩ kiểu lỗ thứ hai. Để thủ thuật thành công và hạn chế biến chứng, siêu âm tim có vai trò không thể thiếu trước, trong và sau can thiệp.
Trước can thiệp
Siêu âm tim qua thành ngực và siêu âm tim qua thực quản 2D và 3D có vai trò chẩn đoán xác định, phân loại thông liên nhĩ cũng như đánh giá số lượng, kích thước, vị trí lỗ thông, chiều dài các gờ quanh lỗ thông, hướng của luồng shunt và ảnh hưởng huyết động do thông liên nhĩ. Tuy nhiên, chỉ siêu âm tim 3D qua thực quản cho phép ghi hình ảnh trực diện (enface view) của lỗ thông và đo đạc chính xác các đường kính của lỗ thông cũng như chiều dài các gờ quanh lỗ thông trong chu chuyển tim, khắc phục được các hạn chế của siêu âm tim 2D truyền thống. Đánh giá chính xác kích thước lỗ thông là bước then chốt để lựa chọn kích thước dụng cụ tránh các biến chứng liên quan tới kích thước dụng cụ quá nhỏ (undersize) hoặc quá lớn (oversize) như bít lỗ thông không kín hoàn toàn, rơi dụng cụ gây biến cố thuyên tắc, dụng cụ gây loét vào các cấu trúc lân cận.
Trong can thiệp bít thông liên nhĩ bằng dụng cụ, đường kính lỗ thông không quá 38 mm (theo khuyến cáo của Hoa Kỳ) hoặc 40 mm (theo khuyến cáo của châu Âu) khi sử dụng dụng cụ Amplatzer (StJude Medical) và không quá 18 mm nếu sử dụng dụng cụ Gore-Helex (Gore Medical). Ngoài ra các gờ quanh lỗ thông phải đủ dài để giữ được dụng cụ. Về mặt giải phẫu có 6 gờ quanh lỗ thông liên nhĩ theo chiều kim đồng hồ: gờ tĩnh mạch chủ trên, gờ động mạch chủ (gờ trước), gờ van nhĩ thất, gờ tĩnh mạch chủ dưới, gờ sau dưới và gờ sau trên.
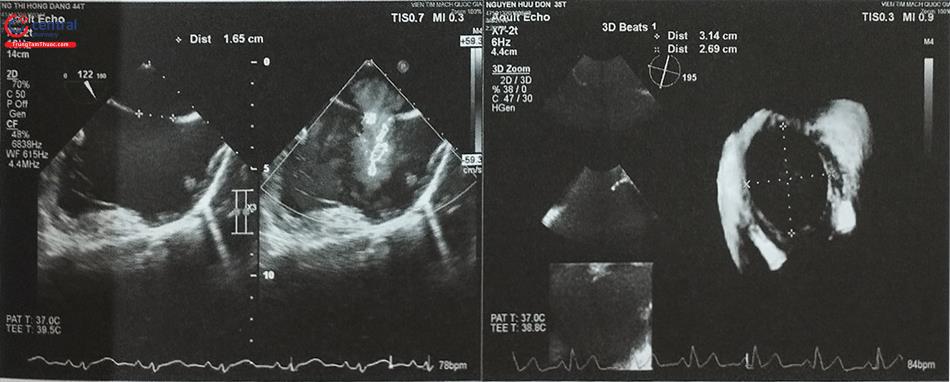
Để lựa chọn kích thước dụng cụ, có thể đo đường kính lỗ thông liên nhĩ trên thông tim bằng cách bơm bóng dần cho tới khi không còn dòng màu qua lỗ thông liên nhĩ trên hình ảnh siêu âm tim hay còn gọi là đường kính lỗ thông khi căng giãn (stretched diameter). Hiện nay, việc lựa chọn kích thước dụng cụ có thể dựa trên đường kính lỗ thông liên nhĩ khi không căng giãn (unstretched diameter) đo trên siêu âm tim qua thực quản 2D hoặc 3D (Hình 15.37, 38). Cần lưu ý sự khác biệt về đường kính tối đa của lỗ thông liên nhĩ đo theo hai phương pháp này. Trong trường hợp đo trên siêu âm, đường kính tối đa của lỗ thông nên cộng thêm 6 – 8 mm.
Trên siêu âm tim qua thực quản 2D, cần đánh giá hình ảnh lỗ thông liên nhĩ trên nhiều mặt cắt, ở mỗi mặt cắt cần đo đường kính tối đa của lỗ thông trong giai đoạn nhĩ co và chiều dài 2 gờ quanh lỗ thông (Hình 15.39): gờ van nhĩ thất và gờ sau trên trên mặt cắt 0O (mặt cắt 4 buồng); gờ van nhĩ thất và gờ sau dưới trên mặt cắt 60O (mặt cắt trục ngắn qua động mạch chủ); gờ tĩnh mạch chủ trên và gờ tĩnh mạch chủ dưới trên mặt cắt 100-120O (mặt cắt qua 2 tĩnh mạch chủ). Thuật ngữ “gờ đủ dài” (sufficient rim) chỉ độ dài tối thiểu của gờ quanh lỗ thông đủ để neo giữ dụng cụ. Đối với dụng cụ Amplatzer atrial occluder, chiều dài gờ động mạch chủ tối thiểu là 2 mm, các gờ khác là 5 mm; đối với dụng cụ Amplatzer multifenestrial atrial occluder, chiều dài tối thiểu của gờ tĩnh mạch chủ trên và gờ động mạch chủ là 9 mm. Không có gờ tĩnh mạch chủ dưới được coi là chống chỉ định can thiệp bít thông liên nhĩ bằng dụng cụ. Mặt khác, không có gờ động mạch chủ làm tăng đáng kể nguy cơ biến chứng làm loét các cấu trúc lân cận do dụng cụ, đặc biệt là dụng cụ Amplatzer.

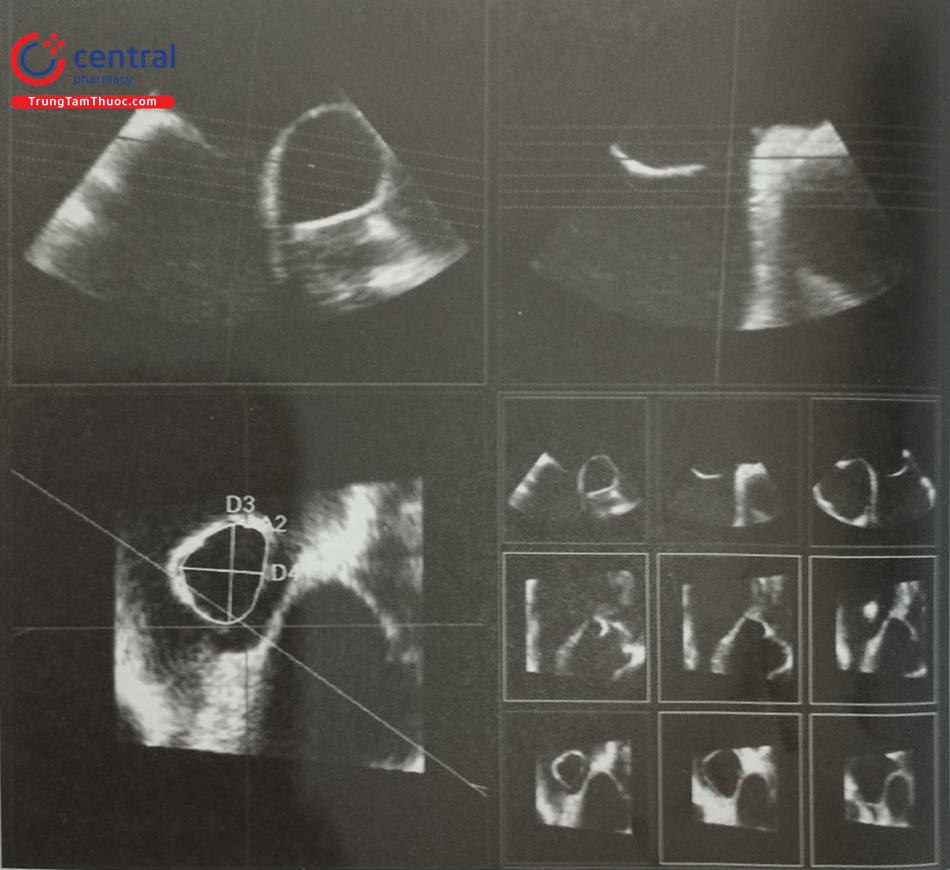
Siêu âm tim 3D qua thực quản là phương pháp đánh giá chính xác các đặc điểm của lỗ thông liên nhĩ (loại, kích thước, hình dạng, chiều dài các gờ). Có thể tái dựng hình ảnh trực diện của toàn bộ lỗ thông liên nhĩ nhìn từ phía nhĩ trái hoặc nhĩ phải và các gờ xung quanh lỗ thông được nằng mode 3D Zoom (Hình 15.40). Bằng cách nghiêng đầu dò lên trên và sang trái, bác sĩ siêu âm có thể đưa hình ảnh trực diện của lỗ thông liên nhĩ về đúng định hướng giải phẫu để dễ dàng phân tích các đặc điểm của lỗ thông. Trên hình ảnh siêu âm tim 3D qua thực quản, có thể dễ dàng đánh giá đường kính và hình dạng của lỗ thông liên nhĩ (Hình tròn, bầu dục hoặc không đều), vị trí lỗ thông tại hố bầu dục và các bất thường kèm theo như phình vách liên nhĩ (Hình 36, 37, 38, 40).
A- Gờ van nhĩ thất (1) và gờ sau trên (2) ở mặt cắt 4 buồng (0O) giữa thực quản. B- Gờ động mạch chủ (3) và gờ sau dưới (4) trên mặt cắt trục ngắn giữa thực quản qua gốc động mạch chủ. C- Gờ tĩnh mạch chủ trên (5) và gò tĩnh mạch chủ dưới (5) trên mặt cắt qua 2 tĩnh mạch chủ (110O) giữa thực quản. D- Mặt cắt qua 2 tĩnh mạch chủ phổi hợp với doppler màu cho thấy dòng shunt trái – phải qua lỗ thông liên nhĩ.
Chú thích: LA: nhĩ trái, RA: nhĩ trái; SVC: Tĩnh mạch chủ dưới; LV: Thất trái; SA: Van động mạch chủ, Hình * : Lỗ thông liên nhĩ
Trong can thiệp
Sau khi mở đường vào từ tĩnh mạch đùi, bác sĩ can thiệp đẩy bóng qua lỗ thông liên nhĩ và bơm dần bóng để đánh giá kích thước lỗ thông (Hình 15.41). Sau đó, catheter delivery được đẩy vào nhĩ phải, đi qua lỗ thông liên nhĩ sang nhĩ trái dưới hướng dẫn của màn huỳnh quang tăng sáng và siêu âm tim. Dụng cụ bít thông liên nhĩ được thu lại và đẩy qua catheter delivery. Đĩa phía nhĩ trái của dụng cụ được mở trước và nằm áp vào mặt nhĩ trái của lỗ thông.
Tiếp theo, đĩa phía nhĩ phải được mở để dụng cụ bám cố định vào lỗ thông liên nhĩ (Hình 41).
Có thể sử dụng siêu âm tim 2D hoặc 3D qua thực quản, siêu âm với đầu dò trong buồng tim (ICE) hoặc lồng ghép hình ảnh siêu âm với chiếu huỳnh quang để hướng dẫn can thiệp. Trên siêu âm tim 3D qua thực quản, đĩa nhĩ trái của dụng cụ nằm trong trường gần của chùm siêu âm nên dễ thấy hơn đĩa nhĩ phải nằm ở trường xa. Sau khi xác định dụng cụ đã nằm đúng vị trí phù hợp, bác sĩ can thiệp tiến hành thả dụng cụ khỏi hệ thống delivery.
A, B – Đo đường kính lỗ thông liên nhĩ bằng bóng trên hình ảnh siêu âm tim 2D và chiếu huỳnh quang để lựa chọn kích thước dụng cụ. C- Đĩa phía nhĩ trái của dụng cụ được mở trước rồi tới đĩa phía nhĩ phải (D). E – Dụng cụ bít nằm đúng vị trí, không có shunt tồn lưu trên siêu âm doppler màu. F- Shunt tồn lưu cạnh dụng cụ do dụng cụ chưa bít kín hoàn toàn lỗ thông.
Sau can thiệp
Ngay sau khi thả dụng cụ, siêu âm 2D hoặc 3D qua thực quản được sử dụng để kiểm tra lại vị trí dụng cụ, shunt tồn lưu và các biến chứng như tràn dịch màng ngoài tim. Thủ thuật được coi là thành công nếu hình ảnh siêu âm doppler màu không phát hiện dòng màu quanh dụng cụ (không có rò giữa phần rìa của dụng cụ và các gờ quanh lỗ thông liên nhĩ) (Hình 15.41). Ngược lại, shunt nhỏ trong dụng cụ trên hình ảnh siêu âm doppler màu được coi là bình thường, shunt này sẽ mất sau khi dụng cụ được nội mạc hóa hoàn toàn. Sau can thiệp, bệnh nhân cần được theo dõi định kỳ bằng siêu âm tim qua thành ngực để đảm bảo không có tình trạng di lệch dụng cụ, dụng cụ gây loét vào các cấu trúc lân cận và các biến chứng khác.

A- Hình ảnh thông liên nhĩ kiểu lỗ thứ hai trước can thiệp trên siêu âm 2D và doppler màu. B- Dây dẫn (guide wire) được đưa qua lỗ thông liên nhĩ vào tĩnh mạch phổi trên trái. C- Catheter được đẩy sang nhĩ trái trên dây dẫn. D- Đo đường kính lỗ thông liên nhĩ bằng bóng. Bóng được bơm dần đến khi không còn dòng màu qua lỗ thông liên nhĩ trên hình ảnh ICE. Đường kính lỗ thông liên nhĩ khi căng giãn được đo trên hình ảnh ICE hoặc chiếu huỳnh quang. E- Đĩa phía nhĩ trái của dụng cụ được mở trước. F- Mở đĩa phía nhĩ phải của dụng cụ. (LA: nhĩ trái; RA: nhĩ phải; SVC: tĩnh mạch chủ trên; DTA: động mạch chủ xuống)
2.2 Can thiệp tại tầng thất
2.2.1 Can thiệp làm mỏng vách liên thất bằng cồn trong điều trị bệnh cơ tim phì đại tắc nghẽn
Can thiệp làm mỏng vách liên thất bằng cách tiêm cồn vào nhánh vách của động mạch liên thất trước (LAD) là biện pháp điều trị thay thế phẫu thuật truyền thống dành cho bệnh nhân bị bệnh cơ tim phì đại tắc nghẽn có triệu chứng. Kỹ thuật này lần đầu được Sigwart thực hiện vào năm 1995 với mục đích tạo ra một vùng nhồi máu cơ tim tại phần gần của vách liên thất. Việc lựa chọn đúng nhánh động mạch nuôi vách của LAD có vai trò then chốt quyết định thành công của thủ thuật. Siêu âm tim với chất cản âm chuyên dụng tiêm vào động mạch vành giúp xác định diện cơ tim được tưới máu, giúp bác sĩ can thiệp lựa chọn đúng nhánh động mạch vành mục tiêu cần can thiệp. Tại nhiều trung tâm tim mạch, siêu âm tim qua thành ngực vẫn được lựa chọn để hướng dẫn can thiệp bởi nhiều ưu điểm: cơ động, không cần gây mê toàn thân và đặt nội khí quản và chi phí thấp. Ngoài ra, có thể lựa chọn siêu âm tim qua thực quản nếu cần đánh giá chi tiết giải phẫu van động mạch chủ và đường ra thất trái hoặc siêu âm tim với đầu dò trong buồng tim (ICE) để hướng dẫn can thiệp.
Trước can thiệp
Siêu âm tim có vai trò đặc biệt quan trọng để lựa chọn bệnh nhân phù hợp với can thiệp và loại trừ các bệnh lý tim đồng mắc khác buộc phải phẫu thuật. Siêu âm tim qua thành ngực thường được lựa chọn đầu tiên để đánh giá bệnh nhân bị bệnh cơ tim tim phì đại bởi ưu điểm của kỹ thuật này không cần gây mê toàn thân nên các thông số huyết động được đánh giá chính xác, không bị ảnh hưởng do tiền gánh, hậu gánh bị thay đổi khi dùng thuốc gây mê. Nhiệm vụ của siêu âm tim trước can thiệp làm mỏng vách liên thất bằng cồn trong bệnh cơ tim phì đại tắc nghẽn bao gồm:
- Chẩn đoán xác định và phân biệt bệnh cơ tim phì đại với các tình trạng phì đại cơ tim khác.
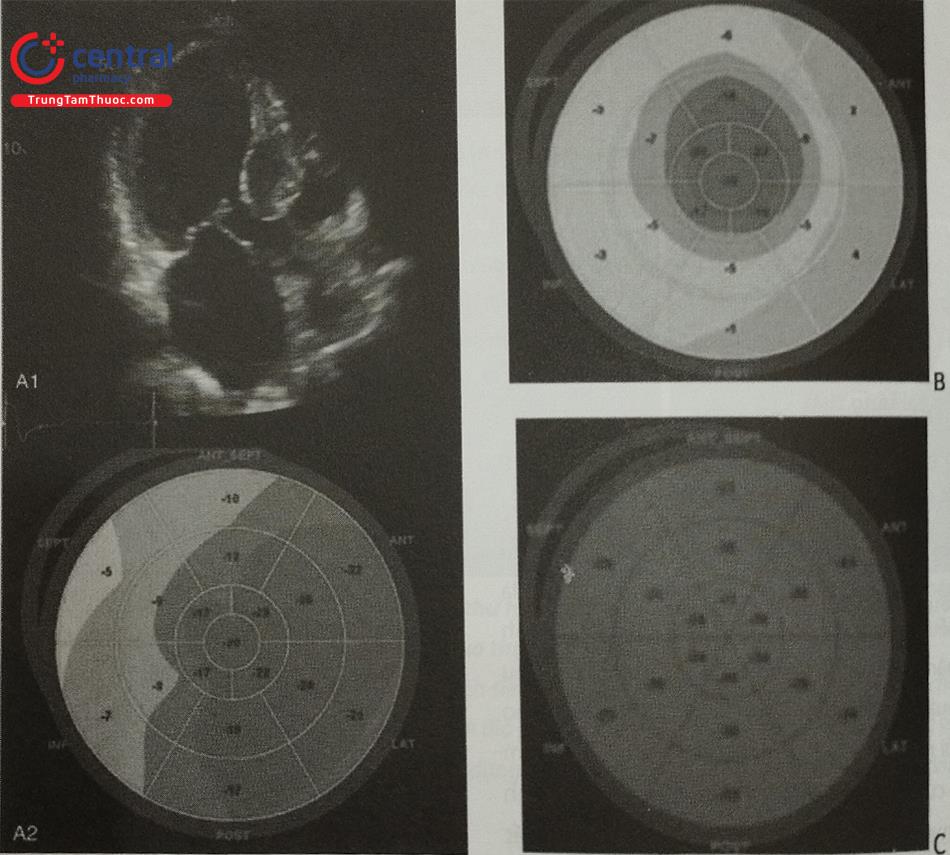
Một số trường hợp phì đại cơ tim như bệnh cơ tim do tăng huyết áp, bệnh cơ tim thâm nhiễm amyloid hoặc tim vận động viên có thể cho hình ảnh tương tự với bệnh cơ tim phì đại. Siêu âm tim qua thành ngực 2D kết hợp với đánh dấu mô cơ tim cho phép phân biệt các trường hợp trên với bệnh cơ tim phì đại thật sự dựa trên sự phân bố sức căng giữa các vùng cơ tim (Hình 15.43). Bệnh cơ tim phì đại thường có tình trạng giảm sức căng tại vùng cơ tim bị phì đại do quá trình xơ hóa cơ tim, trong khi bệnh cơ tim thâm nhiễm amyloid có hình ảnh đặc trưng là bảo tồn sức căng vùng mỏm tim và giảm dần sức căng dọc về phía đáy tim. Bệnh nhân bị bệnh cơ tim phì đại thường có buồng thất trái bé, rối loạn chức năng tâm trương thất trái và giãn nhĩ trái còn tim của vận động viên có thành thất trái dày nhưng buồng thất trái giãn đáp ứng với nhu cầu tăng cung lượng tim với chức năng tâm thu (bao gồm sức căng dọc thất trái) và chức năng tâm trương thất trái bình thường.
Tuy nhiên bệnh cơ tim phì đại cũng là một nguyên nhân gây đột tử ở vận động viên nếu không được chẩn đoán.
- Chẩn đoán xác định tình trạng tắc nghẽn đường ra thất trái.
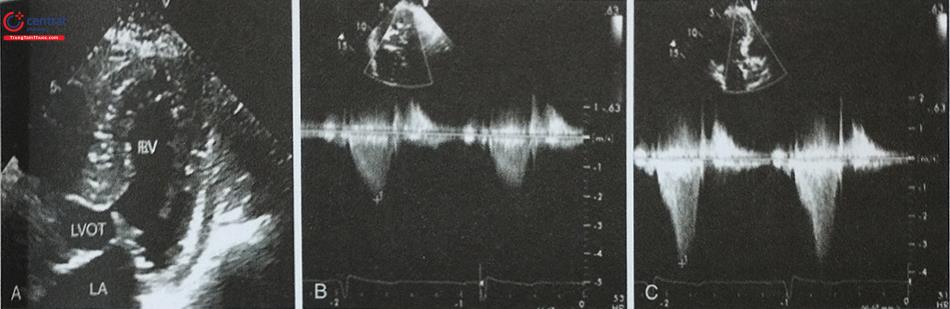
Ước tính khoảng 25% bệnh nhân bị bệnh cơ tim phì đại có tắc nghẽn đường ra thất trái lúc nghỉ nhưng tới 70% bệnh nhân bị tăng chênh áp qua đường ra thất trái khi gắng sức thể lực. Nếu bệnh nhân không có triệu chứng và siêu âm tim lúc nghỉ không ghi được chênh áp có ý nghĩa qua đường ra thất trái, cần làm các nghiệm pháp như nghiệm pháp Valsalva (Hình 44) hoặc siêu âm tim gắng sức thể lực để chẩn đoán tắc nghẽn đường ra thất trái liên quan tới gắng sức. Không làm siêu âm tim với Dobutamine.
Bảng 6. Phân loại huyết động trong bệnh cơ tim phì đại
| Chênh áp đỉnh qua đường ra thất trái lúc nghỉ | Chênh áp đỉnh qua đường ra thất trái sau gắng sức hoặc các nghiệm pháp động | |
| Không tắc nghẽn | < 30 mmHg | < 30 mmHg |
| Tắc nghẽn khi gắng sức hoặc sau khi làm nghiệm pháp | < 30 mmHg | ≥ 30 mmHg |
| Tắc nghẽn lúc nghỉ | ≥ 30 mmHg | |
Đánh giá mức độ phù hợp về giải phẫu để can thiệp:
Đặc điểm giải phẫu phù hợp để can thiệp làm mỏng vách liên thất bằng cồn là tắc nghẽn đường ra thất trái do phì đại vách liên thất vùng đáy tim kèm theo dấu hiệu SAM (lá trước của van hai lá bị dịch chuyển ra phía trước trong thì tâm thu). Bề dày vách liên thất tại vị trí tắc nghẽn nên ≥ 16 mm để hạn chế biến chứng thủng vách liên thất sau can thiệp do vách liên thất quá mỏng.
Cần loại trừ bệnh cơ tim phì đại khu trú tại các vùng khác của thất trái như vùng mỏm hoặc phì đại giữa buồng thất trái bởi can thiệp không mang lại lợi ích trong trường hợp này.
Cần đánh giá chi tiết bộ máy van hai lá. Do tính chất tắc nghẽn huyết động tại đường ra thất trái, mức độ hở hai lá có thể thay đổi từ rất nhẹ tới hở hai lá nhiều. Điểm quan trọng là phải xác định hoặc loại trừ bệnh lý van hai lá nguyên phát kèm theo.
Phải phân biệt tắc nghẽn đường ra thất trái do nguyên nhân khác nhưng cho hình ảnh tương tự như tắc nghẽn trong bệnh cơ tim phì đại. Ví dụ như bệnh cơ tim phì đại kèm theo màng ngăn dưới van động mạch chủ có thể che lấp tình trạng phì đại vách liên thất dù đôi khi có dấu hiệu SAM ngay dưới màng ngăn. Thêm vào đó, tình trạng tắc nghẽn đường ra thất trái cố định do màng ngăn không cải thiện sau can thiệp. Nếu bệnh nhân có hở chủ từ mức độ vừa trở lên cần nghi ngờ bệnh lý van động mạch chủ hoặc màng ngăn dưới van động mạch chủ và phải đánh giá chi tiết đường ra thất trái để xác định rõ nguyên nhân gây tắc nghẽn.
Trong can thiệp
Cần ghi lại hình ảnh siêu âm tim của bệnh nhân trên bàn can thiệp ngay trước khi tiến hành thủ thuật để có căn cứ so sánh đánh giá hiệu quả can thiệp và phát hiện biến chứng. Do bệnh nhân nằm ngửa, các mặt cắt từ mỏm trên siêu âm tim qua thành ngực thường được sử dụng (Hình 15.46). Ghi lại hình ảnh 2D và doppler màu trên các mặt cắt 4 buồng, 5 buồng, 2 buồng và 3 buồng từ mỏm. Lưu ý chất lượng hình ảnh đủ tốt để quan sát được viền nội mạc và cơ tim để so sánh đánh giá vận động vùng cơ tim trước và sau can thiệp. Ngoài ra, cần ghi hình rõ khoang màng ngoài tim, hình ảnh thất phải với toàn bộ chiều dài thành tự do và thành dưới thất trái. Đánh giá chênh áp qua đường ra thất trái trên doppler xung và doppler liên tục. Phổ doppler có đỉnh tâm thu đến muộn trong trường hợp tắc nghẽn đường ra thất trái do SAM, nếu phổ doppler có đỉnh đến sớm hoặc có dạng parabol cần nghi ngờ tắc nghẽn đường ra thất trái cố định do hẹp van hoặc hẹp dưới van động mạch chủ (Hình 15.45). Ghi lại hình ảnh doppler màu tại van hai lá, van động mạch chủ và đường ra thất trái để so sánh trong quá trình tiêm chất cản âm vào mạch vành để xác định diện cấp máu trước khi tiêm cồn vào động mạch nuôi vách liên thất.
Siêu âm tim với chất cản âm chuyên dụng như OptisonTM bơm vào động mạch vành trong can thiệp là phương pháp giúp nâng cao tỷ lệ thành công và hạn chế biến chứng của can thiệp. Nhánh mạch vành nuôi vách liên thất được lựa chọn để tiêm cồn được bác sĩ can thiệp cô lập bằng bóng. Khi đã lựa chọn được động mạch đích để can thiệp trên chụp mạch, chất cản âm sẽ được tiêm vào nhánh động mạch này ở đầu xa của bóng. Lấy 3 mL chất cản âm Optison pha với 7 mL nước muối sinh lý vô khuẩn tạo thành hỗn dịch cản âm. Lượng dịch cản âm sử dụng để đánh giá diện tưới máu của mạch vành thay đổi tùy thuộc vào giải phẫu mạch vành của người bệnh. Thông thường, có thể bơm 0,5 – 2 mL dịch cản âm vào động mạch vành tại đầu xa của bóng và ghi lại hình ảnh siêu âm tim qua thành ngực. Nếu sử dụng quá nhiều chất cản âm hoặc bơm chất cản âm quá mạnh có thể làm chất cản âm bị tràn ra toàn bộ buồng thất, khó xác định diện tưới máu của nhánh mạch vành nuôi vách liên thất.
Vai trò của bác sĩ siêu âm là xác định diện cơ tim được hiện hình rõ sau tiêm chất cản âm (thường là vách liên thất vùng đáy tim, nơi có SAM). Mặt cắt thường sử dụng là mặt cắt 5 buồng từ mỏm trên siêu âm tim qua thành ngực (Hình 46). Ngoài ra, có thể ghi hình nhanh các mặt cắt khác để đánh giá thành tự do thất phải, thành dưới thất trái và mỏm thất trái để đảm bảo không có tuần hoàn vành bàng hệ hoặc chất cản âm không tràn ra quanh bóng bởi đó là nguy cơ gây nhồi máu tại các vùng cơ tim khác khi tiêm cồn. Hình minh họa một trường hợp chất cản âm làm hiện hình cả các vùng cơ tim xa và/hoặc các vùng cơ tim không mong muốn bị nhồi máu khi tiêm cồn.

A- Hình ảnh siêu âm tim ngay trước can thiệp với mặt cắt 5 buồng từ mỏm trong thì tâm thu cho thấy phì đại vách liên thất vùng đáy tim và dấu hiệu SAM. B- Hình ảnh siêu âm tim qua thành ngực sau tiêm chất cản âm vào nhánh vách thứ nhất của LAD, chất cản âm làm hiện hình rõ vùng cách liên thất được tưới máu tương ứng với khu vực có SAM. C- Mặt cắt 2 buồng từ mỏm với doppler màu xác nhận vùng cơ tim ngấm chất cản âm là khu vực có tắc nghẽn tương ứng với dòng khảm màu. (Cần lấy thêm các mặt cắt khác để đảm bảo không có vùng cơ tim nào khác ngấm chất cản âm). D- Mặt cắt 3 buồng từ mỏm sau khi tiêm cồn vào nhánh vách thứ nhất của LAD. Kết quả can thiệp tạo ra một vùng cơ tim bị nhồi máu tăng âm (màu trắng) trên hình ảnh siêu âm tim. E- Chênh áp qua đường ra thất trái trước can thiệp (68 mmHg). F- Chênh áp qua đường ra thất trái sau can thiệp (12 mmHg).
Quyết định lựa chọn nhánh nuôi vách nào để tiêm cồn dựa trên hình ảnh siêu âm tim và chụp mạch, do đó cần có sự phối hợp tốt giữa bác sĩ siêu âm tim và bác sĩ can thiệp. Đôi khi không xác định được nhánh động mạch vành phù hợp để can thiệp do nhánh vách có thể tưới máu cho một vùng cơ tim rộng hoặc không thể cô lập nhánh vách mong muốn để tiêm cồn. Trong trường hợp này bắt buộc phải ngừng thủ thuật và lựa chọn biện pháp điều trị khác. Nhánh vách đầu tiên của động mạch liên thất trước thường được lựa chọn để tiêm cồn bởi nhánh này thường cấp máu cho vách liên thất vùng đáy nơi có SAM. Do biến thể giải phẫu của động mạch vành ở một số bệnh nhân, đôi khi phải tiêm cồn nhiều hơn 1 nhánh nuôi vách của LAD hoặc thậm chí phải tiêm cồn vào các nhánh bên của các nhánh nuôi vách.
Đánh giá hiệu quả tức thì ngay sau can thiệp cần ghi được hình ảnh diện cơ tim được gây nhồi máu sau tiêm cồn, thường thể hiện là một vùng sáng tăng âm kèm theo rối loạn vận động vùng trên siêu âm tim. Mức độ SAM thường cải thiện so với trước can thiệp, mức độ hở hai lá có thể cải thiện hoặc không thay đổi. Chênh áp qua đường ra thất trái giảm và trong trường hợp điển hình không còn thấy hình ảnh phổ doppler có đỉnh tâm thu đến muộn (Hình 46). Hiếm khi phải tiêm cồn vào nhiều hơn 1 nhánh vách của LAD để làm giảm tắc nghẽn đường ra thất trái. Siêu âm tim cản âm trước lần tiêm cồn thứ 2 có thể khó đánh giá do lần tiêm cồn đầu tiên đã tạo ra một vùng cơ tim tăng âm (sáng) nên khó xác định diện cơ tim được cản âm liền kề với diện cơ tim vừa bị nhồi máu. Cần đánh giá hình ảnh tỷ mỷ qua một vài lần tiêm chất cản âm với bác sĩ siêu âm có kinh nghiệm để phân biệt diện cơ tim mới được hiện hình nhờ chất cản âm khi tiêm vào nhánh vách thứ hai.
Siêu âm tim cũng là công cụ hữu ích giúp phát hiện biến chứng trong quá trình can thiệp như tràn dịch màng ngoài tim do thủng thành tim liên quan tới catheter hoặc sonde điện cực tạo nhịp, lóc tách động mạch vành gây nhồi máu cơ tim thể hiện bằng rối loạn vận động vùng tim mới xuất hiện không liên quan tới nhánh động mạch vành được tiêm cồn.
Sau can thiệp
Siêu âm tim sau can thiệp được tiến hành với quy trình tương tự như trước can thiệp để so sánh các hình ảnh tương ứng nhằm đánh giá hiệu quả can thiệp và phát hiện biến chứng. Hình ảnh diện cơ tim tăng âm sau khi tiêm cồn vào nhánh vách thường xuất hiện trong vòng vài giờ sau can thiệp. Cần đánh giá kỹ rối loạn vận động vùng và khảo sát doppler màu trong buồng thất trái cũng như tại đường ra thất trái. Chênh áp qua đường ra thất trái sau can thiệp thường diễn biến qua 3 giai đoạn: (1) Giảm chênh áp tức thì sau can thiệp sau đó (2) chênh áp tăng trở lại về mức trước can thiệp trong vài ngày rồi (3) chênh áp lại giảm trong vòng 3 tháng sau can thiệp. Cơ chế gây giảm chênh áp tức thời và giảm chênh áp bền vững khác nhau. Chênh áp giảm tức thời sau can tiêm cồn có thể liên quan tới rối loạn vận động vùng cơ tim thất trái tại vách liên thất sau tiêm cồn. Một số diện cơ tim nhỏ tại rìa vùng nhồi máu có thể bị đờ và phục hồi lại sau đó làm chênh áp tăng trở lại. Sau đó, chênh áp qua đường ra thất trái giảm dài hạn và triệu chứng tắc nghẽn được cải thiện có thể do tái cấu trúc thất trái tại vùng nhồi máu kèm theo giảm khối cơ thất trái, độ dày vách liên thất cùng các vùng cơ tim khác, mở rộng đường ra thất trái, cải thiện chức năng tâm trương và giảm SAM. Nếu trước can thiệp chênh áp qua đường ra thất trái chỉ xuất hiện khi làm các nghiệm pháp kích thích, cần tiến hành lại các nghiệm pháp này sau can thiệp để đảm bảo tắc nghẽn đường ra thất trái đã được cải thiện khi nghỉ cũng như khi làm nghiệm pháp.
2.2.2 Can thiệp bít giả phình thành thất trái
Giả phình thành thất trái là biến chứng hiếm gặp nhưng có thể đe dọa đến tính mạng sau nhồi máu cơ tim, phẫu thuật tim, chấn thương hoặc viêm nội tâm mạc nhiễm khuẩn. Điều trị nội khoa đơn thuần không có hiệu quả với tỷ lệ tử vong lên tới 50%. Mặc dù cho tới thời điểm hiện tại, phẫu thuật vẫn là liệu pháp điều trị được khuyến cáo để đóng giả phình thành thất trái, nguy cơ phẫu thuật rất cao bởi tình trạng rối loạn huyết động, mô cơ tim hoại tử tại chỗ giả phình và các bệnh lý đồng mắc của người bệnh. Gần đây, can thiệp đóng giả phình thành thất trái bằng dụng cụ qua đường ống thông được chấp nhận như một biện pháp điều trị thay thế cho phẫu thuật. Các phương tiện chẩn đoán hình ảnh tim mạch bao gồm siêu âm tim 3D có vai trò xác định vị trí, kích thước, hình dạng của tổn thương, hướng dẫn can thiệp và theo dõi sau can thiệp.
Trước can thiệp
Siêu âm tim có vai trò chẩn đoán xác định giả phình thành thất trái cũng như đánh giá vị trí, kích thước của khối giả phình. Thông thường siêu âm tim qua thành ngực đủ để chẩn đoán giả phình thành thất. Hình ảnh của khối giả phình trên siêu âm là một ổ trống âm khu trú thông với buồng thất trái qua một cổ hoặc ống hẹp (Hình 15.47). Tỷ lệ giữa cổ với đường kính tối đa của khối giả phình < 0,5 trong trường hợp điển hình (Hình 15.48). Đây là một trong những đặc điểm để phân biệt giả phình với phình thành thất thực sự (Bảng 15.7). Phình thành thất thực sự thường có tỷ lệ giữa cổ và đường kính tối đa > 0,5 nhưng cũng có một số trường hợp ngoại lệ. Do đó, khi nghi ngờ, đặc điểm chính xác nhất để phân biệt phình và giả phình là: thành của khối phình thực sự có đủ 3 lớp của tim trong khi thành khối giả phình chỉ có màng ngoài tim và tổ chức xơ, tại cổ khối giả phình có thể thấy hình ảnh cơ tim mất liên tục.
Siêu âm doppler xung và doppler màu có thể cho thấy hình ảnh dòng máu qua lại hai chiều giữa túi giả phình và buồng thất (máu đi từ buồng thất vào khối giả phình trong thì tâm thu và đi từ khối giả phình vào buồng thất trong thì tâm trương). Trong một số ít trường hợp, nếu chỉ thấy một ổ trống âm nằm gần thất trái mà không rõ liên quan với thất trái, siêu âm doppler màu hoặc tốt hơn là siêu âm tim với bọt cản âm chuyên dụng (Opstison, Definity) rất có ích để chẩn đoán xác định.
Trong những trường hợp khó khi hình ảnh siêu âm tim qua thành ngực không đủ tốt, cần nghi ngờ giả phình thành thất trái nếu chỉ thấy hình ảnh “tràn dịch màng ngoài tim khu trú”. Siêu âm tim qua thực quản (tốt nhất là siêu âm tim qua thực quản 3D) thời gian thực có thể đánh giá tốt hơn đặc điểm giải phẫu khối giả phình và sự thông thương với buồng thất trái. Siêu âm tim 3D hoặc các phương tiện chẩn đoán hình ảnh 3D như MSCT giúp lựa chọn dụng cụ bít.
Bảng 7. Một số đặc điểm phân biệt phình và giả phình thành thất trái trên siêu âm tim
| Phình | Giả phình | |
| Hình dạng | Cổ rộng | Cổ hẹp |
| Vị trí | Thường ở mỏm | Thường ở thành sau thất trái |
| Vận động | Vận động nghịch thường Cơ tim | Giãn ra trong thì tâm thu Màng ngoài tim |
| Thành Huyết khối | Đóng thành lớp | Huyết khối lấp đầy bên trong |
Trong can thiệp
Can thiệp bít giả phình thành thất trái bằng dụng cụ được hướng dẫn bằng siêu âm tim 2D/3D qua thành ngực hoặc qua thực quản phối hợp với màn tăng sáng. Khối giả phình có thể được tiếp cận từ phía buồng thất hoặc tiếp cận trực tiếp bằng cách chọc qua thành ngực. Cách tiếp cận và dụng cụ bít được lựa chọn dựa trên vị trí, kích thước, hình dạng của khối giả phình và kinh nghiệm của bác sĩ can thiệp. Những khối giả phình nhỏ có thể được bít bằng coil hoặc kết hợp dùng coil để lấp đầy khối giả phình với dụng cụ bít để đóng chỗ thông giữa khối giả phình và buồng thất trái.
Hình 49 mô tả một trường hợp giả phình lớn tại thành trước thất trái sau nhồi máu cơ tim. Hình ảnh CT cho thấy khối giả phình thông với buồng thất qua một cổ hẹp (mũi tên). Sau khi chẩn đoán xác định, khối giả phình được đóng bằng cách can thiệp qua catheter với hướng tiếp cận từ mỏm tim. Dưới hướng dẫn của siêu âm tim qua thực quản 3D thời gian thực, một kim chọc được đưa trực tiếp vào túi giả phình. Sau đó, dây dẫn và catheter lần lượt được đưa qua vị trí chọc rồi được đẩy vào buồng thất trái qua cổ túi giả phình. Dụng cụ bít Amplatzer (Abbott) sau đó được thả để đóng chỗ thông giữa túi phình và buồng thất trái. Trong khi các catheter được rút về, một dụng cụ Amplatzer khác được dùng để bít vị trí chọc vào khối giả phình lúc đầu.
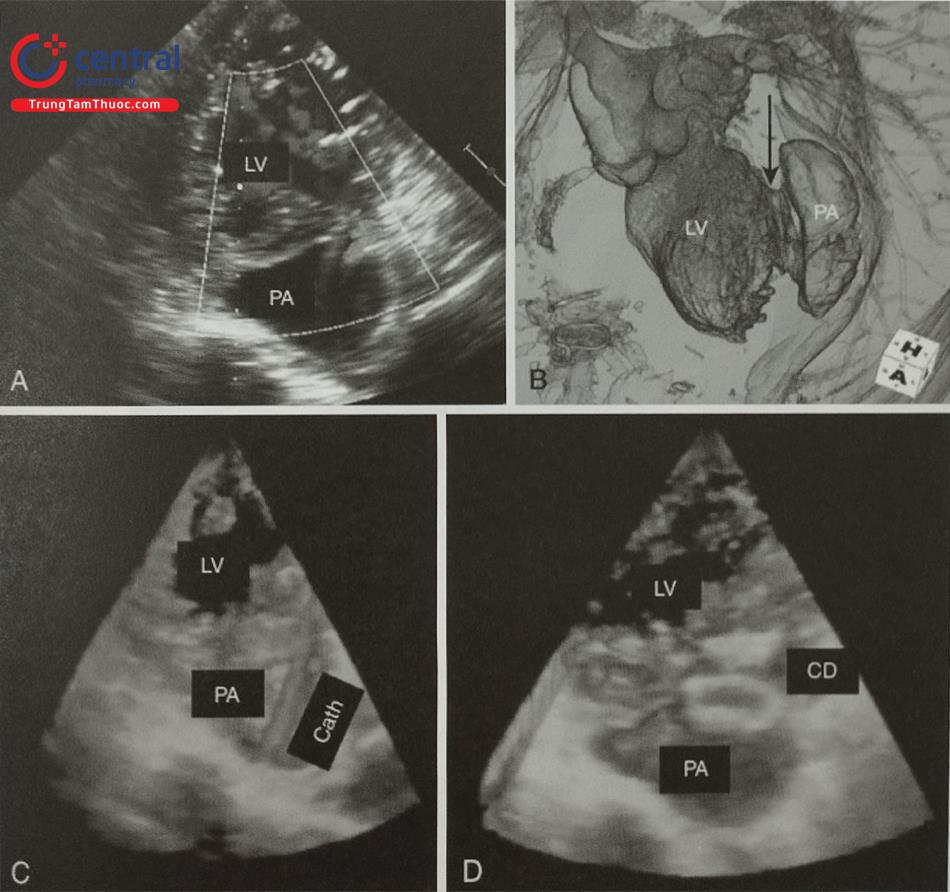
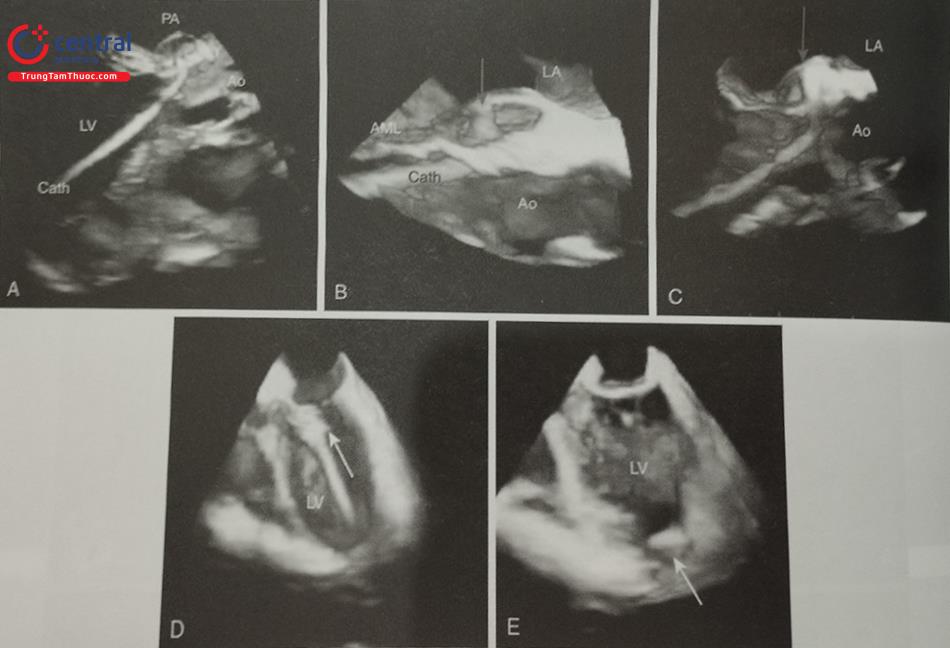
Hình 50 minh họa một trường hợp giả phình tại đường ra thất trái do viêm nội tâm mạc nhiễm khuẩn ở bệnh nhân thay van động mạch chủ nhân tạo. Siêu âm tim 2D và 3D cho thấy hình ảnh khối giả phình với kích thước 25 x 17 mm thông với đường ra thất trái qua một lỗ thủng nhỏ ở dải xơ liên tục giữa van hai lá và van động mạch chủ. Phổ siêu âm doppler xung xác định có dòng máu qua lại hai chiều giữa túi phình và đường ra thất trái. Dưới hướng dẫn của siêu âm, sau khi chọc mỏm thất trái, một dây dẫn rồi một catheter được đưa vào khối giả phình qua lỗ thông với đường ra thất trái. Sau đó nhiều coil được thả để lấp kín khối giả phình. Cuối cùng, một dụng cụ bít được thả để đóng lại vị trí chọc mỏm thất trái ban đầu.
2.2.3 Can thiệp bít thông liên thất bằng dụng cụ qua đường ống thông
Dựa trên nguyên nhân, thông liên thất được chia làm 2 nhóm: bẩm sinh và mắc phải. Thông liên thất mắc phải hiếm gặp hơn so với nhóm bẩm sinh, thường là biến chứng của nhồi máu cơ tim hoặc chấn thương tim. Dựa trên vị trí giải phẫu, thông liên thất cũng được chia thành: phần quanh màng (thông liên thất dưới mào hoặc dưới van động mạch chủ, phần cơ (phần cơ bè, phần buồng nhận hoặc phần phễu hay thông liên thất trên mào) và thông liên thất Gerbode (thông giữa thất trái – nhĩ phải). Trong đó, thông liên thất phần quanh màng là loại thường gặp nhất, thông liên thất phần cơ có thể do bẩm sinh hoặc mắc phải và có thể có 1 hoặc nhiều lỗ thông dạng “pho mát Thụy Sỹ”.
Chỉ định đóng thông liên thất được tóm tắt trong Bảng 8.
Theo các khuyến cáo hiện nay, thông liên thất chủ yếu được đóng bằng phương pháp phẫu thuật mặc dù các kỹ thuật can thiệp bít thông liên thất qua da đã và đang được phát triển. Trong đó, thông liên thất bẩm sinh ở phần cơ bè là loại thông liên thất phù hợp nhất để can thiệp qua da (Hình 51). Ngoài ra, có thể can thiệp bít thông liên thất phần cơ sau nhồi máu cơ tim (Hình 52) nhưng chưa có khuyến cáo chính thức (off-label). Các lỗ thông liên thất tồn lưu sau mổ, sau chấn thương (Hình 52) hoặc liên quan đến thầy thuốc (iatrogenic) sau phẫu thuật van động mạch chủ cũng có thể được bít bằng phương pháp can thiệp. Do vị trí giải phẫu nằm gần van động mạch chủ, thông liên thất phần quanh màng và thông liên thất kèm sa lá van động mạch chủ thường không phù hợp để can thiệp trừ khi nguy cơ phẫu thuật cao.
Nhiều loại dụng cụ bít thông liên thất qua đường ống thông đã được phát triển và thử nghiệm như dù Raskind,
dụng cụ Bard Clamshell, dụng cụ Button, coil Gianturco. Hiện nay dụng cụ bít thông liên thất phần cơ Amplatzer (ST Jude Medical) là loại dụng cụ duy nhất được sử dụng tại Hoa Kỳ. Dụng cụ bít thông liên thất phần quanh màng Amplatzer với 2 đĩa không đối xứng chỉ được sử dụng tại các nước khác.
Siêu âm tim có vai trò quan trọng trước, trong và sau can thiệp bít thông liên thất bằng dụng cụ qua đường ống thông.
Bảng 8. Chỉ định đóng thông liên thất ở người lớn
| Chỉ định | Mức độ I | Mức độ IIa | Mức độ IIb | Mức độ III |
| Quá tải thể tích thất trái | Có | |||
| Qp/Qs | > 1,5 | > 1,5 (vẫn còn shunt trái – phải) | < 1 (shunt phải –trái) | |
| Áp lực động mạch phổi | < 50% huyết áp hệ thống | > 50% huyết áp hệ thống | > 2/3 huyết áp hệ thống | |
| Sức cản phổi | < 1/3 sức cản hệ thống | > 1/3 sức cản hệ thống | > 2/3 sức cản hệ thống | |
| Trường hợp đặc biệt | ||||
| Hở chủ do thông liên thất | Nên phẫu thuật đóng lỗ thông liên thất phần quanh màng hoặc thông liên thất trên mào nếu hở chủ nặng lên do thông liên thất | |||
| Viêm nội tâm mạch nhiễm khuẩn do thông liên thất | Có thể phẫu thuật đóng lỗ thông liên thất nếu có tiền sử viêm nội tâm mạc nhiễm khuẩn do thông liên thất nếu không có chống chỉ định. |
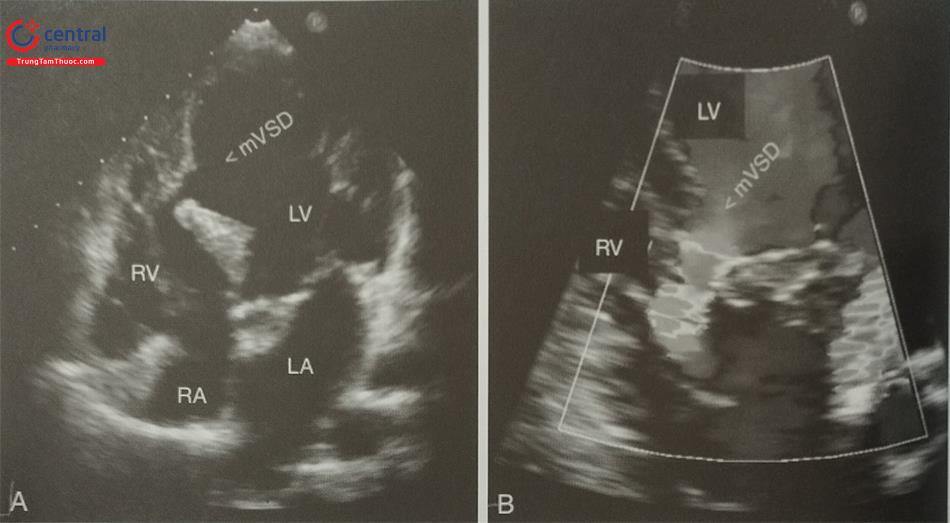
(Chú thích: LA: nhĩ trái; LV: thất trái; RA: nhĩ phải; RV: thất phải)
Trước can thiệp
Cả siêu âm tim qua thành ngực và siêu âm tim qua thực quản có vai trò chẩn đoán xác định, phân loại, đánh giá kích thước lỗ thông liên thất và ảnh hưởng huyết động của thông liên thất. Siêu âm tim 3D có thể cung cấp hình ảnh trực diện (enface view) của lỗ thông để đánh giá chính xác hơn hình dạng, kích thước lỗ thông so với siêu âm tim 2D truyền thống (Hình 15.53). Đo đạc chính xác kích thước lỗ thông liên thất có vai trò đặc biệt quan trọng để lựa chọn kích thước dụng cụ và hạn chế biến chứng như block dẫn truyền, tổn thương các van tim hoặc rơi dụng cụ gây biến cố thuyên tắc.
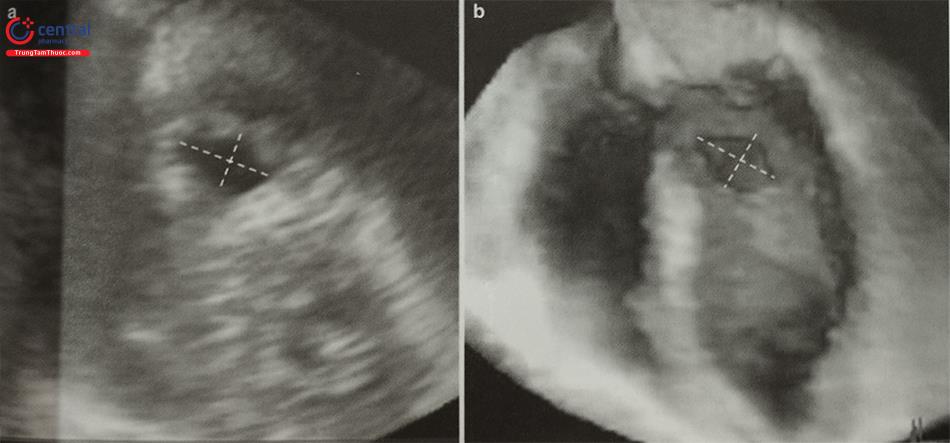
Trong can thiệp
Cùng với màn huỳnh quang tăng sáng, siêu âm tim quan thực quản 2D hoặc 3D hoặc siêu âm với đầu dò trong buồng tim (ICE) giúp hướng dẫn đường đi của catheter, dây dẫn và định vị dụng cụ. Sau khi chọc động mạch đường vào, một catheter được đưa vào thất trái theo kiểu ngược dòng qua van động mạch chủ cho tới khi đầu catheter đi qua lỗ thông liên thất. Tiếp theo, dụng cụ bít thông liên thất được đưa vào tim qua sheath delivery theo kiểu xuôi dòng qua tĩnh mạch chủ dưới từ đường vào tĩnh mạch đùi. Sau đó, bác sĩ can thiệp tạo vòng nối động tĩnh mạch và dụng cụ được đưa qua lỗ thông liên thất từ phía thất phải. Đĩa xa của dụng cụ được mở trước và áp vào mặt thất trái của lỗ thông. Đĩa gần của dụng cụ được mở sau đó để áp vào mặt thất phải lỗ thông.
Sau can thiệp
Ngay sau khi thả dụng cụ, siêu âm tim 2D và 3D với doppler màu được sử dụng để đánh giá thành công và biến chứng của thủ thuật. Can thiệp được coi là thành công nếu hoàn toàn không có dòng shunt quanh dụng cụ (không có rò giữa rìa của dụng cụ bít với gờ của lỗ thông liên thất). Ngược lại, shunt nhỏ trong dụng cụ trên hình ảnh siêu âm doppler màu được coi là bình thường, shunt này sẽ mất sau khi dụng cụ được nội mạc hóa hoàn toàn.
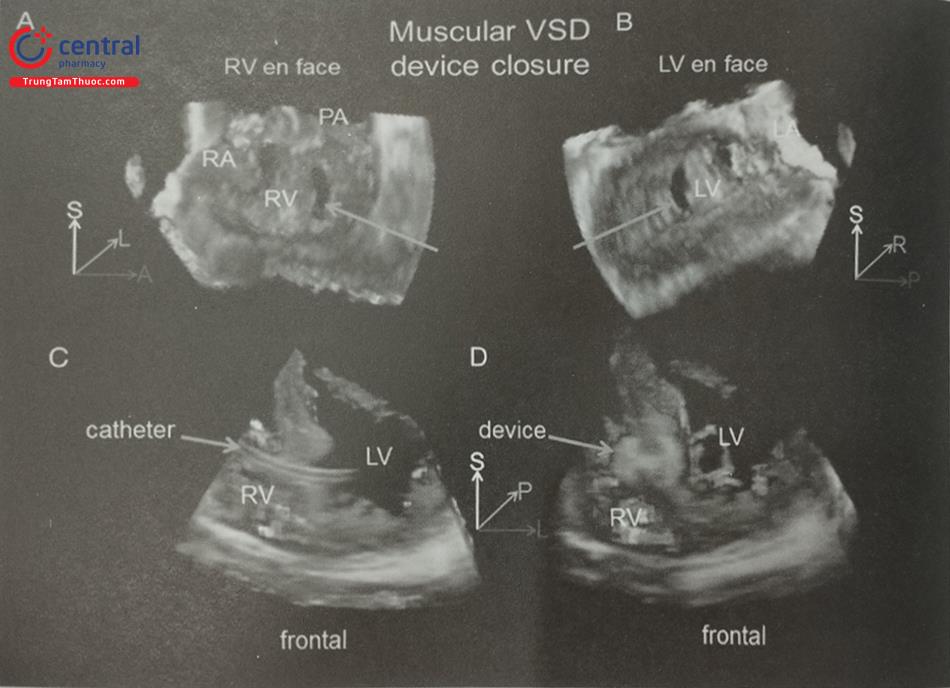
A- Hình ảnh trực diện của lỗ thông liên thất (mũi tên) nhìn từ phía thất phải. B- Hình ảnh trực diện của lỗ thông liên thất (mũi tên) nhìn từ phía thất trái. C- Catheter đi qua lỗ thông liên thất. D- Dụng cụ bít thông liên thất phần cơ sau khi thả.
Chú thích: RA: Nhĩ phải; RV: Thất phải; PA: Động mạch phổi; LV: Thất trái; Muscular VSD Device Closure: Dụng cụ đóng thông liên thất phần cơ.
2.3 Can thiệp các bệnh lý van tim
2.3.1 Nong van hai lá bằng bóng qua da
Hiện nay, hẹp van hai lá do thấp vẫn là bệnh lý phổ biến tại các nước đang phát triển. Can thiệp nong van hai lá qua da bằng bóng Inoue lần đầu được giới thiệu vào năm 1984 đã nhanh chóng trở thành phương pháp điều trị được ưu tiên lựa chọn dành cho bệnh nhân hẹp van hai lá khít do thấp tim, có triệu chứng với hình thái van hai lá phù hợp. Để đảm bảo kết quả nong van tối ưu, siêu âm tim đóng vai trò quan trọng trước can thiệp để lựa chọn bệnh nhân phù hợp, hướng dẫn trong can thiệp và phát hiện các biến chứng sớm trong hoặc sau can thiệp.
Trước can thiệp
Trước can thiệp nong van hai lá bằng bóng qua da, siêu âm tim có vai trò:
Chẩn đoán nguyên nhân hẹp hai lá:
- Siêu âm tim cần phân biệt hẹp hai lá do thấp (có dính mép van) với hẹp hai lá không do thấp bởi hẹp hai lá không do thấp thường không phù hợp để can thiệp nong van hai lá do không có tình trạng dính mép
- Các nguyên nhân gây hẹp hai lá không do thấp bao gồm: hẹp hai lá do thoái hóa với vôi hóa vòng van hai lá, bệnh tim carcinoid, hẹp hai lá liên quan đến xạ trị, hẹp hai lá bẩm sinh. Ngoài ra, một số nguyên nhân hiếm gặp hơn bao gồm: u nhĩ trái, amyloid, bệnh tim carcinoid, Lupus ban đỏ hệ thống.
- Trong đa số các trường hợp, tổn thương van hai lá do thấp dễ phân biệt với các nguyên nhân khác gây hẹp hai lá nhưng đôi khi khó phân biệt với hẹp hai lá do thoái hóa Siêu âm tim qua thành ngực 2D hoặc 3D có thể chẩn đoán nguyên nhân hẹp hai lá trong hầu hết các trường hợp. Siêu âm tim qua thực quản 2D hoặc 3D được chỉ định khi hình ảnh siêu âm tim qua thành ngực không rõ hoặc cần đánh giá thêm các vấn đề khác.
- Hẹp van hai lá nhân tạo sinh học do thoái hóa không có chỉ định nong van hai lá.
Đánh giá mức độ hẹp hai lá: Theo các khuyến cáo cập nhật nhất về quản lý và điều trị bệnh van tim của AHA/ACC (2020) và ESC (2021), chỉ bệnh nhân hẹp hai lá khít (Diện tích lỗ van hai lá (MVA) ≤ 1,5 cm2) được lựa chọn để can thiệp nong van hai lá qua Các thông số siêu âm tim để đánh giá mức độ hẹp hai lá bao gồm:
- Diện tích lỗ van hai lá đo bằng cách vẽ viền trực tiếp (planimetry): được coi là thông số tham chiếu chuẩn bởi không phụ thuộc vào dòng chảy qua van, khả năng giãn của nhĩ trái, thất trái cũng như tổn thương các van khác kèm Có thể đo trực tiếp diện tích lỗ van hai lá trên hình ảnh siêu âm tim qua thành ngực (Hình 55) hoặc siêu âm tim qua thực quản 2D/3D (Hình 57, 58). Siêu âm tim qua thành ngực có thể đánh giá không chính xác diện tích lỗ van nếu hình ảnh siêu âm tim mờ hoặc cắt không đúng qua chỗ hẹp nhất. Mặc dù ghi hình van hai lá rõ nét hơn siêu âm tim qua thành ngực, siêu âm tim 2D qua thực quản có hạn chế là chỉ đo được diện tích lỗ van hai lá ở mặt cắt sâu trong dạ dày và không đảm bảo cắt đúng qua chỗ hẹp nhất của van hai lá. Siêu âm tim qua thực quản 3D cho phép đo diện tích lỗ van hai lá với độ chính xác cao bằng cách vẽ viền trực tiếp diện tích lỗ van trên hình ảnh 3D tái dựng nhìn trực diện lỗ van hai lá từ mặt nhĩ hoặc mặt thất (Hình 56), hoặc đo trên hình ảnh đa bình diện MPR với các mặt cắt 2D trực giao để cắt đúng qua chỗ hẹp nhất của lỗ van (Hình 58).
- Chênh áp trung bình qua van hai lá đo trên siêu âm doppler liên tục: không phải là chỉ số tốt nhất để đánh giá mức độ hẹp hai lá mặc dù có độ tin cậy Ngoài mức độ hẹp hai lá, chênh áp qua van bị ảnh hưởng bởi nhiều yếu tố khác: tốc độ dòng chảy, tần số tim, cung lượng tim, các bệnh van tim khác đi kèm đặc biệt là hở hai lá. Chênh áp trung bình qua van hai lá thường từ 5 đến 10 mmHg trong hẹp hai lá khít.
- Thời gian bán giảm áp lực (PHT): là thời khoảng từ đỉnh chênh áp qua van hai lá đầu tâm trương tới khi chênh áp giảm còn 1/2 giá trị đỉnh (tính bằng ms). PHT thường ≥ 150 ms trong hẹp hai lá khít.
- Các thông số siêu âm tim khác bao gồm thể tích nhĩ trái và áp lực động mạch phổi. Trong hẹp hai lá khít, áp lực động mạch phổi tâm thu thường ≥ 50ms.
- Trong một số ít trường hợp cần chỉ định siêu âm tim gắng sức thể lực để chẩn đoán chính xác mức độ hẹp hai lá ở bệnh nhân siêu âm tim lúc nghỉ không tương xứng với triệu chứng lâm sàng hoặc bệnh nhân xuất hiện triệu chứng khi gắng sức. Ngoài ra, do một số bệnh nhân hẹp hai lá tự hạn chế hoạt động thể lực của bản thân để không bị khó thở, siêu âm tim gắng sức giúp đánh giá khách quan sự thay đổi về huyết động và triệu chứng trong trường hợp này. Cần so sánh chênh áp trung bình qua van hai lá và áp động mạch phổi tâm thu lúc nghỉ và ngay sau gắng sức và đối chiếu với triệu chứng xuất hiện khi gắng sức để xác định mức độ hẹp hai lá.
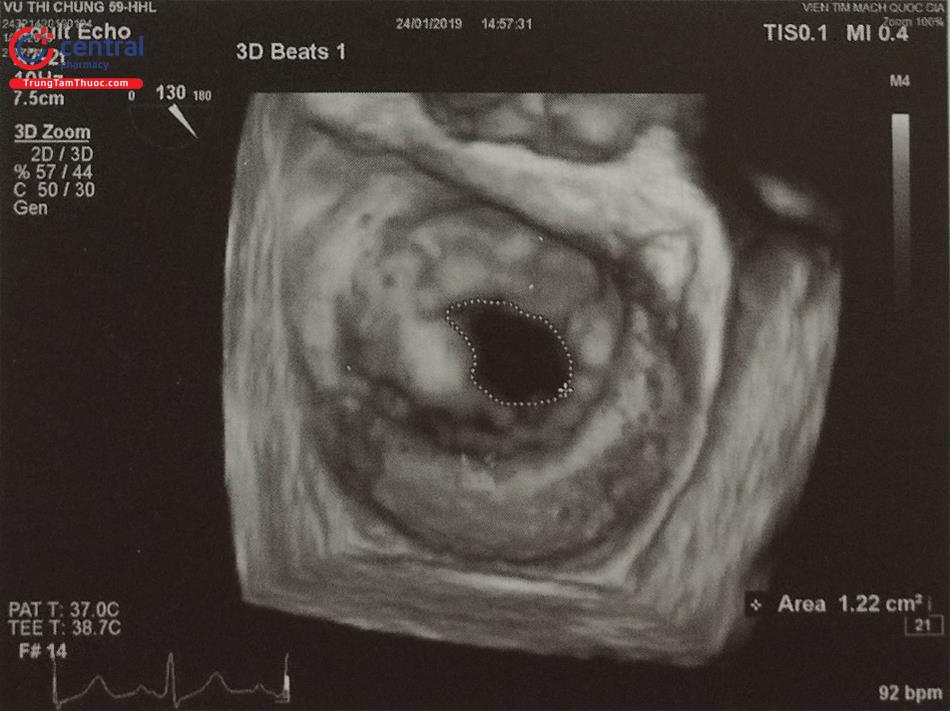
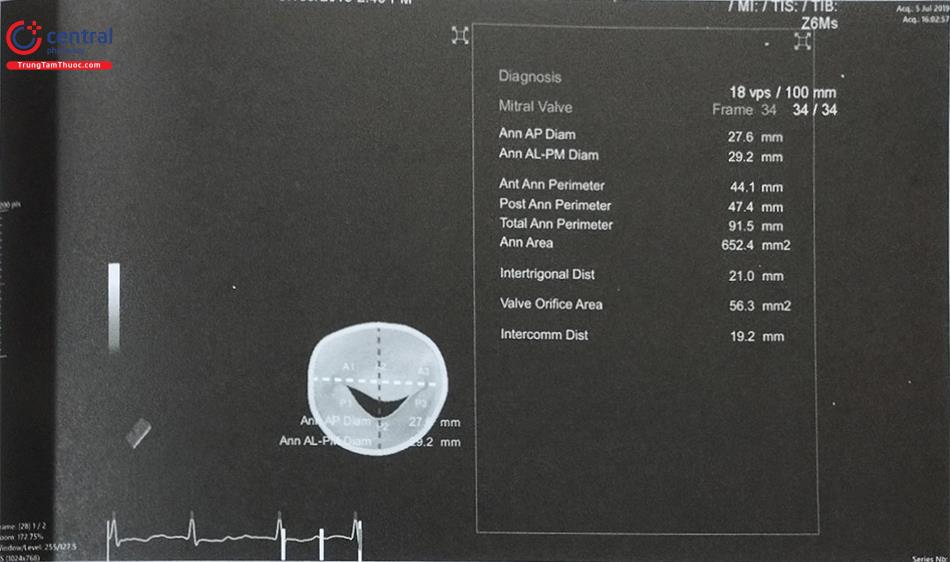
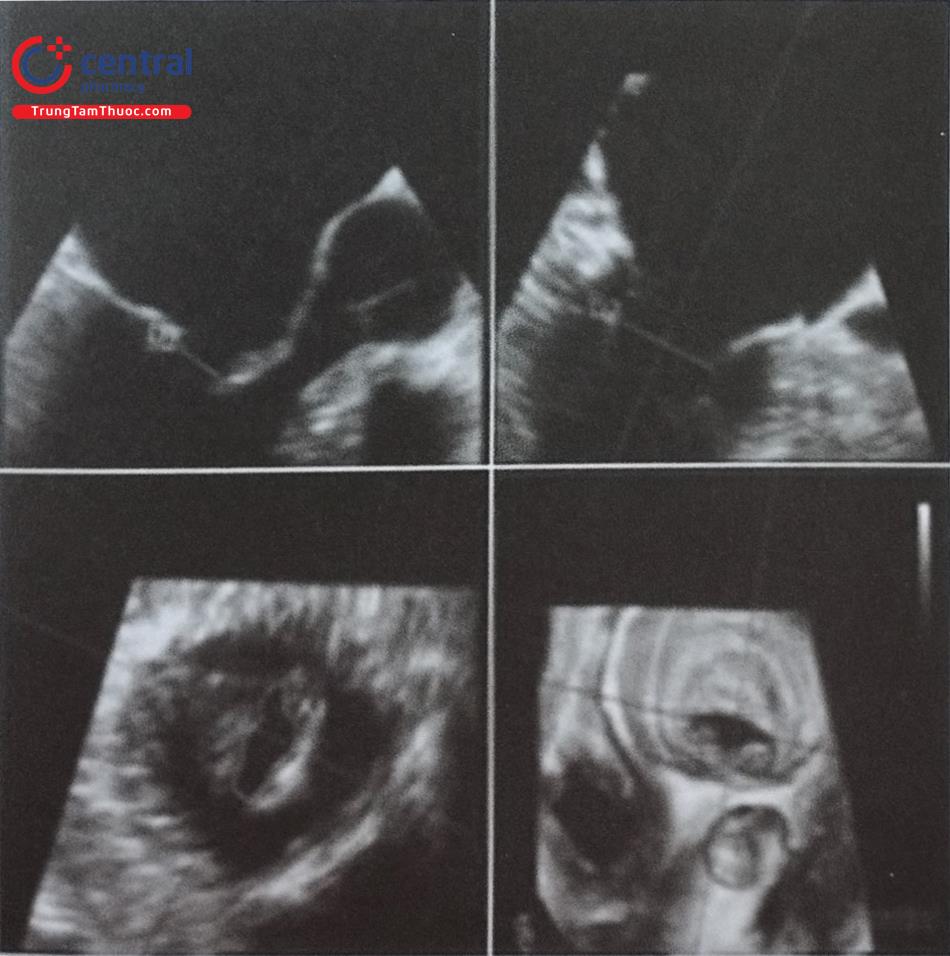
Đánh giá đặc điểm giải phẫu van hai lá:
- Hiệu quả và khả năng thành công của can thiệp nong van hai lá phụ thuộc nhiều yếu tố lâm sàng, huyết động và giải phẫu van hai lá. Các đặc điểm hình thái của van hai lá và bộ máy dưới van, bao gồm: độ di động và mềm mại của lá van, độ dày hai lá van, tình trạng dính mép van, vôi hóa bộ máy dưới van, và đặc biệt là diện tích vùng mép van và mức độ xơ/sẹo hóa vòng van đã được sử dụng trong nhiều thang điểm để mô tả mức độ tổn thương hậu thấp và xác định bệnh nhân phù hợp với can thiệp cũng như tiên đoán khả năng thành công của thủ thuật.
- Thang điểm thường được sử dụng nhất làm thang điểm Wilkins (Bảng 9) với các thông số đánh giá trên siêu âm tim 2D qua thành ngực bao gồm độ di động, độ dày, vôi hóa lá van, tổn thương bộ máy dưới van. Mỗi tiêu chí được cho điểm từ 1 đến 4 (tổng điểm từ 4 đến 16). Wilkins ≤ 8 điểm dự báo kết quả nong van tối ưu. Siêu âm tim 3D qua thực quản có thể đánh giá bộ máy dưới van hai lá với độ chính xác và tin cậy cao so với siêu âm tim
Bảng 9. Thang điểm Wilkins
| Điểm | Độ di động | Độ dày | Vôi hoá | Bộ máy dưới van |
| 1 | Các lá van di động tốt, chỉ hạn chế tại vùng đầu mút. | Độ dày lá van gần bình thường (4 – 5 mm). | Chỉ 1 vùng tăng âm. | Dày nhẹ ngay dưới các lá van. |
| 2 | Hạn chế di động tới phần giữa và gốc lá van. | Phần giữa lá van bình thường, dày đáng kể ở bờ lá van (5-8 mm). | Vôi hóa vùng bờ lá van. | Dày lan tới 1/3 chiều dày dây chằng. |
| 3 | Lá van vẫn di động ra trước trong thì tâm trương nhưng chủ yếu ở vùng đáy. | Dày lan rộng toàn bộ lá van (5 – 8 mm). | Vôi hóa tăng hâm lan tới phần giữa lá van. | Dày lan tới 2/3 chiều dài của dây chằng. |
| 4 | Lá van không di động hoặc di động tối thiểu trong thì tâm thu. | Dày nhiều toàn bộ mô lá van (> 8 – 10 mm). | Gần như toàn bộ mô lá van vôi hóa tăng âm nhiều. | Dày nhiều và co rút toàn bộ dây chằng, lan tới các cơ nhú. |
Padial và cộng sự hiệu chỉnh thang điểm Wilkins và đưa thêm mức độ vôi hóa mép van vào thang điểm để dự đoán tình trạng hở hai lá nhiều sau nong van (Bảng 15.10). Vôi hóa nặng cả hai mép van hoặc vôi hóa không đối xứng tại các mép van liên quan tới hở hai lá có ý nghĩa sau can thiệp. Tuy nhiên cả thang điểm Wilkins và thang điểm Padial đều dựa trên các thông số đánh giá hình thái van hai lá bán định lượng và phụ thuộc vào bác sĩ làm siêu âm nên có độ tin cậy thấp ở nhóm nguy cơ trung bình.
Bảng 10. Thang điểm Padial
| I-II. Độ dày van (đánh giá riêng từng lá van) |
| Các lá van gần như bình thường (dày 4- 5 mm) hoặc chỉ có một vùng bị dày. |
| Xơ và/hoặc vôi hóa toàn bộ lá van; không có vùng mỏng. |
| Xơ và/hoặc vôi hóa lá van không đều; có các vùng mỏng hơn chỉ bị dày nhẹ (5- 8 mm). |
| Xơ và/hoặc vôi hóa lá van không đều; có các vùng gần như bình thường (4- 5 mm) |
| III. Vôi hoá mép van |
| Xơ và//hoặc vôi hóa chỉ một mép van |
| Cả hai mép van bị tổn thương nhẹ |
| Vôi hóa cả hai mép van, một mép van tổn thương nặng |
| Vôi hóa cả hai mép van, cả hai mép van tổn thương nặng |
| IV. Tổn thương bộ máy dưới van |
| Dày nhẹ dây chằng dưới van |
| Dày 1/3 chiều dài dây chằng. |
| Dày 2/3 chiều dài dây chằng |
| Dày và co rút lan tỏa toàn bộ dây chằng tới tận các cơ nhú |

A- Các thông số trong thang điểm: diện tích lỗ van rất nhỏ (MVA ≤ 1 cm2), biên độ di động lá van tối đa (≤ 12 mm), tỷ lệ diện tích mép van ≥ 1,25 và tổn thương bộ máy dưới van. B- Đo biên độ di động lá van trên mặt cắt 4B từ mỏm. C- Đo tỷ lệ diện tích vùng mép van. Chú thích: LA: nhĩ trái; LV: thất trái; RA: nhĩ phải; RV: thất phải; CAR: tỷ lệ diện tích vùng mép van.
Nunes và cộng sự đề xuất một thang điểm mới với các thông số định lượng để nâng cao khả năng dự báo khả năng can thiệp thành công và tình trạng hở hai lá sau nong van. Các thông số trong thang điểm Nunes bao gồm: diện tích lỗ van hai lá rất nhỏ (MVA ≤ 1 cm2), biên độ di động lá van tối đa (≤ 12 mm), tỷ lệ diện tích mép van ≥ 1,25 và tổn thương bộ máy dưới van. Dựa trên tổng điểm, bệnh nhân được chia thành các nhóm nguy cơ: thấp (0 – 3 điểm); trung bình (4 – 5 điểm) và cao (6 – 11 điểm) với tỷ lệ nong van hai lá cho kết quả không tốt tương ứng là 16,9%; 56,3% và 73,8%. Một điểm lý thú là thang điểm Nunes có khả năng dự báo chính xác kết quả nong van tốt ở bệnh nhân có điểm Wilkins không tối ưu (9-11 điểm).
Tuy nhiên không có thang điểm nào bao gồm tình trạng hở hai lá trước can thiệp – một yếu tố dự báo kết quả sau nong van, đồng thời cũng là chống chỉ định nong van nếu mức độ hở vừa đến nhiều.
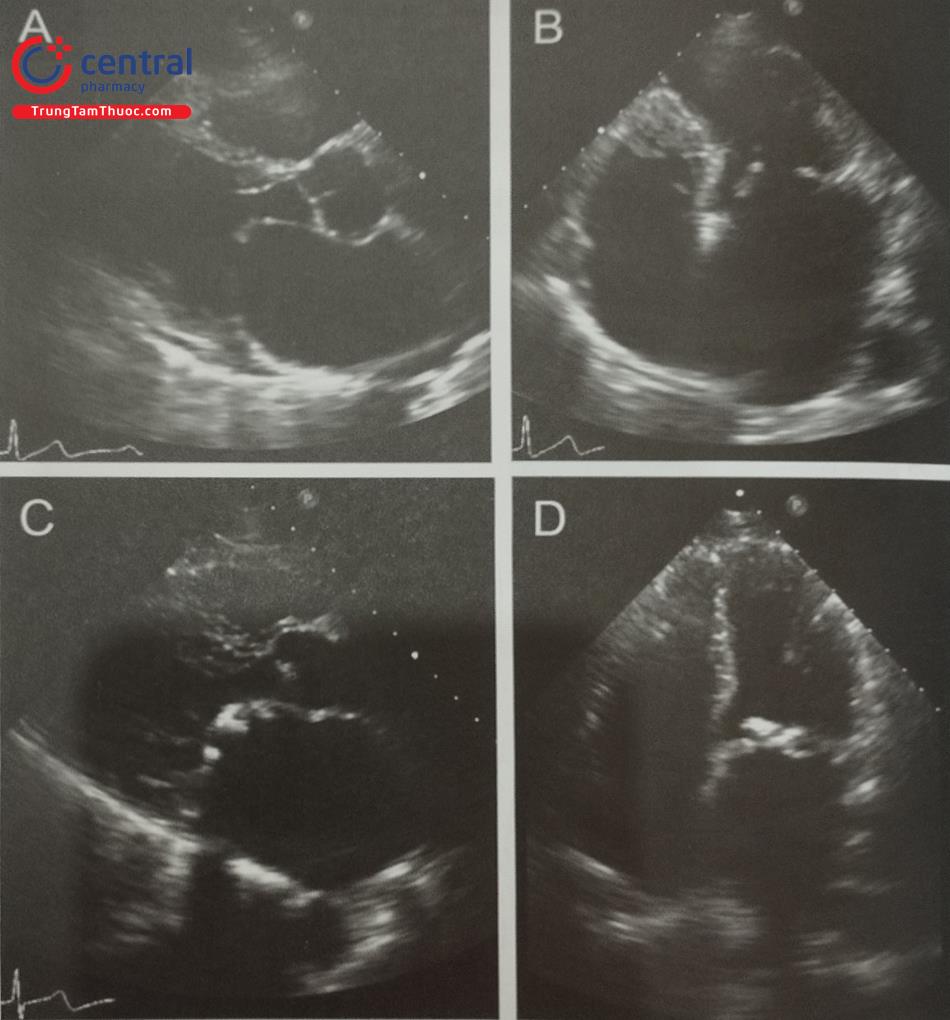
Loại trừ huyết khối nhĩ trái và các chống chỉ định của can thiệp nong van hai lá:
- Bệnh nhân hẹp hai lá khít có nguy cơ cao hình thành huyết khối trong nhĩ trái và tiểu nhĩ trái, đặc biệt nếu nhĩ trái giãn nhiều hoặc kèm theo rung nhĩ. Huyết khối nhĩ trái và tiểu nhĩ trái là chống chỉ định nong van hai lá. Siêu âm tim, đặc biệt là siêu âm tim 2D hoặc 3D qua thực quản có độ nhạy cao trong phát hiện huyết khối nhĩ trái và tiểu nhĩ trái. Siêu âm tim 3D qua thực quản giúp phân biệt huyết khối với các dải cơ lược trong tiểu nhĩ trái tốt hơn.
- Bệnh nhân hẹp hai lá do thấp thường kèm theo tổn thương các van tim khác. Hở hai lá từ mức độ vừa trở lên, tổn thương nặng van động mạch chủ và/hoặc van ba lá kèm theo là chống chỉ định can thiệp nong van hai lá bằng bóng.
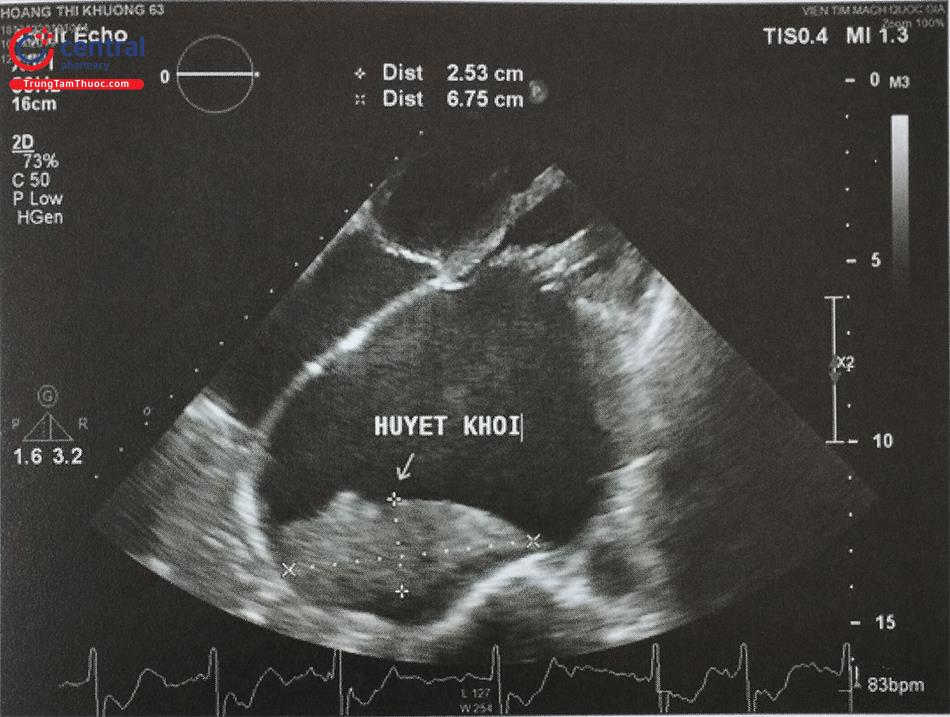
Trong can thiệp
Để hướng dẫn thủ thuật trong can thiệp nong van hai lá, bác sĩ siêu âm cần nắm được các bước trong quy trình can thiệp. Kỹ thuật nong van hai lá bằng bóng qua da thường được sử dụng nhất là can thiệp xuôi dòng theo đường tĩnh mạch (kỹ thuật nong van bằng bóng Inoue, kỹ thuật Cribier, nong van bóng kép) với các bước:
- Chọc vách liên nhĩ.
- Đưa catheter mang bóng nong trượt vào buồng nhĩ trái, đầu mút của catheter nằm đối diện lỗ van hai lá.
- Đưa bóng nong qua van hai lá xuống thất trái.
- Bơm phần xa của bóng nong và kéo về tới khi cảm thấy bóng đã chạm vào mặt thất của van hai lá.
- Bơm từ từ phần gần của bóng nong. Sau mỗi lần lên bóng, cần đánh giá lại mức độ hẹp hai lá và hở hai lá.
Tại các nước phương Tây, nơi tỷ lệ hẹp hai lá do thấp tim hiện nay còn rất thấp, can thiệp nong van hai lá bằng bóng qua da được thực hiện dưới hướng dẫn của siêu âm tim qua thực quản 2D/3D với gây mê toàn thân. Siêu âm tim qua thực quản 3D thời gian thực giúp hướng dẫn chọc vách liên nhĩ đúng vị trí, lái dây dẫn và catheter, đưa bóng nong van từ nhĩ trái xuống thất trái, giúp lựa chọn kích thước và vị trí bóng nong phù hợp trước và và trong quá trình lên bóng cũng như đánh giá hiệu quả tức thì ngay sau nong van. Nhiệm vụ của siêu âm tim trong hướng dẫn can thiệp nong van hai lá ở mỗi bước được tóm tắt trong Bảng 11.
Bảng 11. Tóm tắt vai trò của siêu âm tim trong các bước nong van hai lá
| Các bước can thiệp | Vai trò của siêu âm tim trong hướng dẫn can thiệp |
| Chọc vách liên nhĩ | Loại trừ huyết khối nhĩ trái và tiểu nhĩ trái ngay trước can thiệp. Vị trí chọc vách liên nhĩ: phần giữa hố bầu dục hoặc lệch nhẹ sang phía sau-dưới. Xác định vị trí chọc vách liên nhĩ trên siêu âm tim 2D qua thực quản bằng 3 mặt cắt giữa thực quản:
Nên dùng siêu âm tim 3D qua thực quản với mode X-plane hoặc multi plane để trình diễn đồng thời 2 mặt cắt (1) và (2) hoặc dựng hình ảnh 3D trực diện của vách liên nhĩ để hướng dẫn chọc vách liên nhĩ. Cần thấy rõ hình ảnh vách liên nhĩ bị đẩy thành hình chiếc lều để đảm bảo kim chọc vách ở đúng vị trí. |
| Định vị bóng | Thông thường, bác sĩ can thiệp sử dụng màn tăng sáng để hướng dẫn đưa bóng nong qua van hai lá xuống thất trái. Siêu âm tim qua thực quản 2D hoặc 3D có thể giúp hướng dẫn đưa bóng đúng vị trí tránh gây thủng tiểu nhĩ trái và định vị bóng nong chính xác giữa các lá van, hạn chế nguy cơ bóng bị vướng vào dây chằng dưới van. Thường quan sát rõ nhất dưới màn tăng sáng (bóng được bơm thuốc cản quang bên trong). |
| Lên bóng | Hình ảnh các mép van được tách hoàn toàn quan sát tốt nhất trên màn tăng sáng khi phần eo của bóng biến mất. |
| Đánh giá kết quả tức thì sau nong | Siêu âm tim 2D hoặc 3D qua thực quản giúp đảm bảo bóng ở đúng vị trí trước và trong khi nong. Nếu lên bóng ở vùng dưới van có thể làm đứt dây chằng gây hở hai lá cấp. Tiêu chuẩn đánh giá thủ thuật thành công bao gồm:
Nếu kết quả nong van chưa tối ưu có thể nong tiếp bằng cách bơm bóng từ từ mỗi 1-2 mm. Đánh giá lại hiệu quả và biến chứng sau mỗi lần lên bóng lại. |
| Tầm soát biến chứng | Nên đánh giá bằng siêu âm tim 2D hoặc 3D qua thực quản:
|

A; B- Vách liên nhĩ bị ấn thành hình lều khi catheter được đẩy về phía nhĩ trái. C; D- Catheter đã đi qua vách liên nhĩ sang nhĩ phải, vách liên nhĩ không còn hình lều.
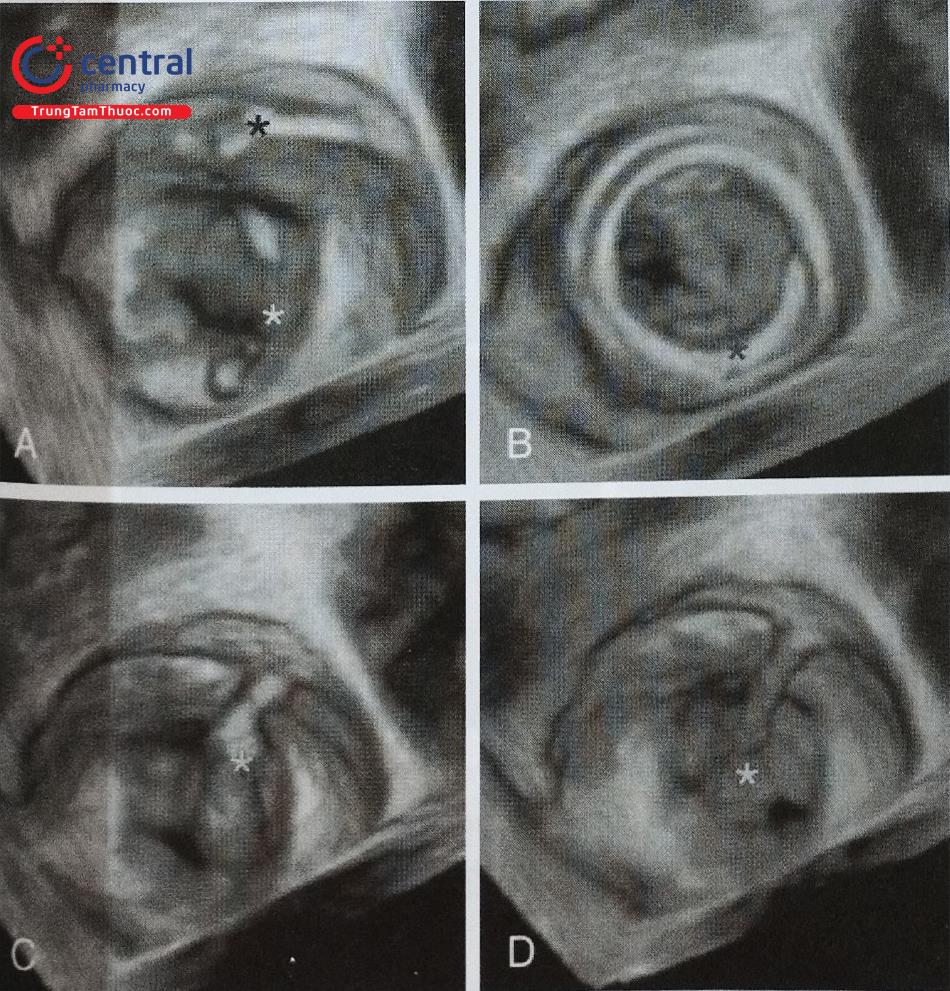
A- Catheter (*) được đẩy vào khoảng 2 cm trong nhĩ trái. Dây dẫn (*) nằm ở sàn nhĩ trái.
B- Bóng nong được đẩy từ từ vào nhĩ trái, tới mặt phẳng vòng van hai lá.
C- Catheter được thu về một phần, bóng nong (*) được đặt hướng về lỗ van hai lá.
D- Bóng nong (*) được đẩy qua lỗ van hai lá.
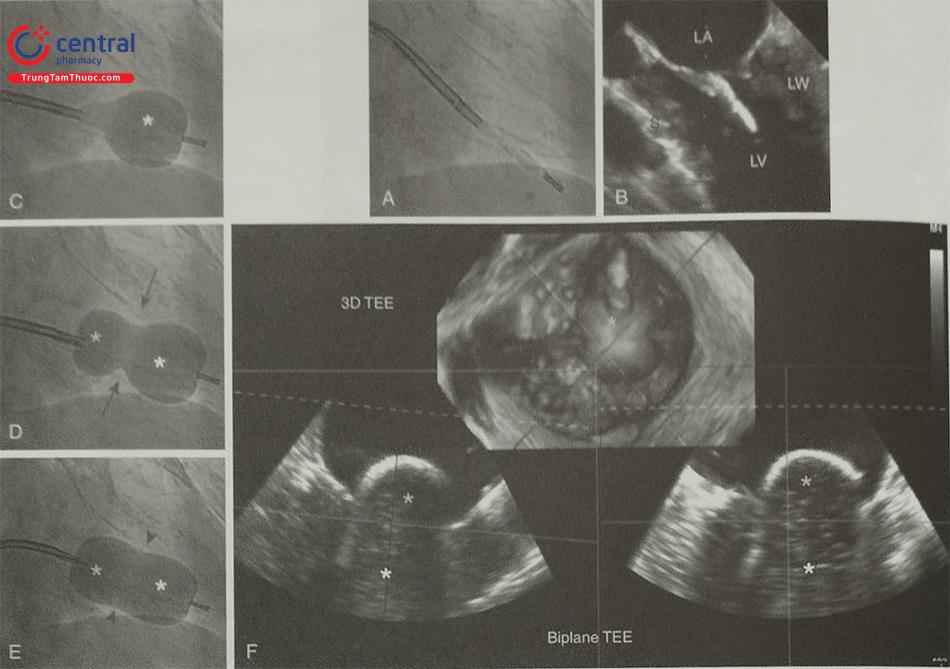
A; B- Catheter mang bóng nong được đẩy qua lỗ van hai lá xuống thất trái. C- Lên bóng lần 1: bóng nong được bơm ở phần xa (*). D- Lên bóng lần 2: Bóng nong được bơm ở phần gần (*) nhưng vẫn thấy eo của bóng trước khi tách mép van. E; F- Lên bóng lần 3: Bóng nong được bơm tối đa để tách hai mép van.
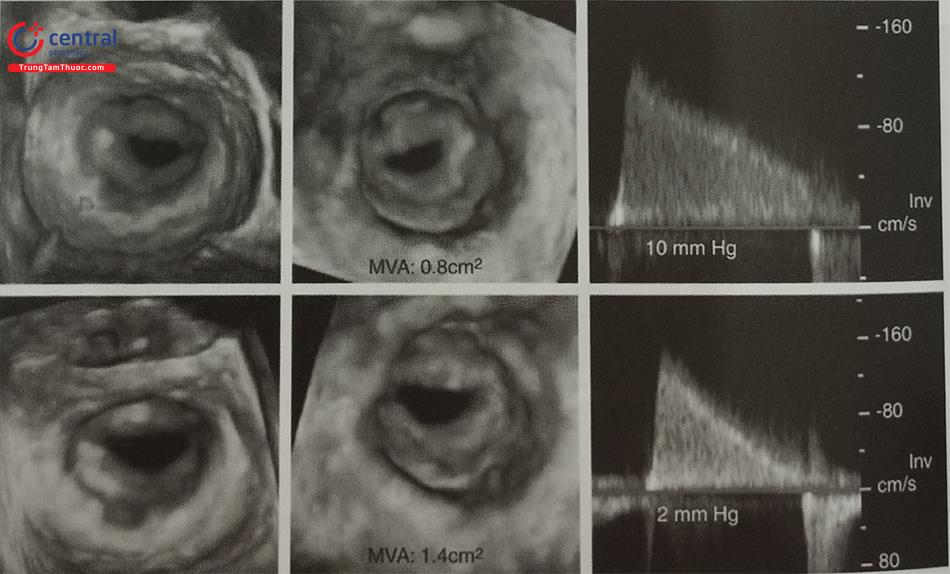
Ngoài siêu âm tim qua thực quản, siêu âm tim với đầu dò trong buồng tim (ICE) cũng là công cụ đắc lực trong hướng dẫn can thiệp nong van hai lá bằng bóng qua da.
Ngay trước khi can thiệp, có thể đánh giá lại mức độ hẹp hai lá, đặc điểm giải phẫu van hai lá và loại trừ huyết khối nhĩ trái và tiểu nhĩ trái trên hình ảnh ICE. Khi đầu catheter ICE nằm ở giữa nhĩ phải, xoay catheter khoảng 60-70O và hơi gập đầu dò ra trước để ghi hình vách liên nhĩ trên trục dài. Từ mặt cắt này, có thể đo chênh áp qua van hai lá bằng doppler liên tục và phát hiện hở hai lá bằng siêu âm doppler màu. Có thể ghi hình rõ hơn van hai lá, nhĩ trái, thất trái bằng cách đẩy catheter ICE xuống thất phải và xoay catheter để ghi hình mặt cắt thất phải trục dọc. Trên mặt cắt này có thể đánh giá tình trạng vôi hóa lá van, độ dày tổ chức dưới van và mức độ hở hai lá trên hình ảnh doppler màu.
Trong can thiệp: Quá trình chọc vách liên nhĩ được hướng dẫn trên mặt cắt trục dài của vách liên nhĩ. Sau khi dụng cụ can thiệp đã đi qua vách liên nhĩ sang nhĩ trái, xoay catheter ICE 60-70O để ghi hình tiểu nhĩ trái và phần thấp của vách liên nhĩ. Dưới hướng dẫn của ICE bóng nong được đẩy qua van hai lá xuống thất trái. Sau đó bóng được bơm lên dần để tách hai mép
Sau mỗi lần lên bóng, cần đánh giá lại mức độ hẹp và hở hai lá. Ngoài ra cần thận trọng đánh giá tình trạng dịch màng ngoài tim sau mỗi bước can thiệp trên các mặt cắt ICE ghi hình từ thất phải và nhĩ phải.
Sau can thiệp
Siêu âm tim qua thành ngực là phương tiện được lựa chọn để theo dõi định kỳ cho bệnh nhân với nhiệm vụ: đánh giá tình trạng hẹp hai lá, hở hai lá sau can thiệp, chức năng thất trái, áp lực động mạch phổi và shunt tồn lưu qua vách liên nhĩ.
2.3.2 Can thiệp kẹp sửa van hai lá bằng dụng cụ qua đường ống thông
Can thiệp kẹp sửa van hai lá qua đường ống thông được phát triển dựa trên kỹ thuật mổ khâu đính bờ lá trước và lá sau của van hai lá của Ottavio Alfieri. Hệ thống dụng cụ can thiệp kẹp sửa van hai lá qua đường ống thông đầu tiên được sử dụng là MitraClip (Abbott) và sau đó là PASCAL (Edwards Lifescience). Có nhiều nghiên cứu đánh giá tính an toàn và hiệu quả của hệ thống dụng cụ MitraClip trong điều trị hở hai lá, đặc biệt là nghiên cứu EVEREST I và EVEREST II. Siêu âm tim qua thực quản đa bình diện 2D hoặc 3D là phương pháp chuẩn vàng để đánh giá lựa chọn bệnh nhân trước can thiệp và hướng dẫn trong can thiệp. Trong phần này, chúng tôi sẽ trình bày vai trò của siêu âm tim trong can thiệp kẹp sửa van hai lá bằng hệ thống dụng cụ MitraClip, nguyên lý tương tự có thể áp dụng với dụng cụ PASCAL.
Trước can thiệp
Siêu âm tim có vai trò thiết yếu trong chẩn đoán bệnh lý van hai lá và lựa chọn bệnh nhân phù hợp với can thiệp MitraClip.
Ban đầu siêu âm tim qua thành ngực được sử dụng để chẩn đoán xác định và chẩn đoán mức độ hở hai lá. Tiếp theo, siêu âm tim qua thực quản 2D hoặc 3D được chỉ định để đánh giá chi tiết hình thái giải phẫu van hai lá, cơ chế và nguyên nhân hở hai lá và xác định bệnh nhân có đặc điểm hình thái van hai lá phù hợp với can thiệp. Với kinh nghiệm can thiệp kẹp sửa van hai lá qua đường ống thông được tích lũy theo thời gian, tiêu chuẩn hình thái van hai lá phù hợp để can thiệp được mở rộng đối với cả 2 nhóm hở hai lá nguyên phát và hở hai lá thứ phát (Bảng 12).
Bảng 12. Tiêu chuẩn hình thái van hai lá phù hợp để can thiệp kẹp sửa van qua đường ống thông (MVA: diện tích lỗ van hai lá)
| Hình thái van tối ưu | Hình thái van khó can thiệp | Hình thái van không phù hợp để can thiệp |
| Hở van tại vùng A2 hoặc P2 (vùng giữa các lá van) | Hở van tại vùng A1/P1 hoặc A3/P2 | Xẻ hoặc thủng lá van |
| Không vôi hóa các lá van | Vôi hóa lá van nhưng không vôi hóa tại vùng sẽ kẹp sửa. | Vôi hóa lá van tại vùng sẽ kẹp sửa. |
| MVA ≥ 4 cm2 | MVA 3 – 4 cm2 | MVA < 3 cm2 Chênh áp trung bình qua van hai lá > 5 mmHg |
| Chiều dài lá sau > 10 mm | Chiều dài lá sau 7 – 10 mm | Chiều dài lá sau < 7 mm |
| Độ sâu của diện áp (tenting height) < 11 mm | Phần diện áp bảo tồn > 2 mm | Độ sâu của diện áp ≥ 11 mm |
| Các lá van độ di động lá van bình thường | Hạn chế di động lá van trong thì tâm trương (Carpentier type IIIB) | Hạn chế di động lá van trong cả 2 thì tâm thu và tâm trương (Carpentier type IIIA) |
| Khoảng sa van (flail gap) < 10 mm | Độ rộng vùng sa van > 15 mm (nhưng đủ rộng để đặt nhiều clip) | Bệnh Barlow |
| Độ rộng vùng sa van < 15 mm | Sa van ở nhiều vùng |
Siêu âm tim qua thực quản 2D đã được sử dụng từ lâu để đánh giá toàn diện bộ máy van hai lá. Để đánh giá chi tiết các vùng của van hai lá, cần ghi hình nhiều mặt cắt (bạn đọc có thể tham khảo trong các khuyến cáo và tài liệu về siêu âm tim qua thực quản).
Siêu âm tim qua thực quản 3D có ưu điểm vượt trội so với siêu âm tim 2D qua thực quản với khả năng ghi hình van hai lá 3D nhìn trực diện từ mặt nhĩ (góc nhìn của phẫu thuật viên) (Hình 67). Từ hình ảnh 3D này có thể thấy các vùng khác nhau của lá van cùng với các mốc giải phẫu xung quanh. Hình ảnh siêu âm 3D qua thực quản kết hợp với doppler màu giúp định vị chính xác vị trí dòng hở và lượng hóa mức độ hở hai lá (Hình 68), đặc biệt trong trường hợp có nhiều dòng hở. Siêu âm tim 3D qua thực quản cho phép đo trực tiếp diện tích Vena contracta bằng hình ảnh tái dựng MRP thay vì chỉ đo đường kính Vena contracta trên 1 mặt cắt 2D (Hình 68). Điều này rất có giá trị khi vùng hội tụ dòng hở không phải dạng hình cầu hoặc có nhiều dòng hở. Thêm vào đó, sự phát triển của các phần mềm hậu xử lý hình ảnh 3D có chức năng xây dựng mô hình tham số của van hai lá và tính toán nhanh các thông số cần thiết phục vụ cho can thiệp (Hình 69).
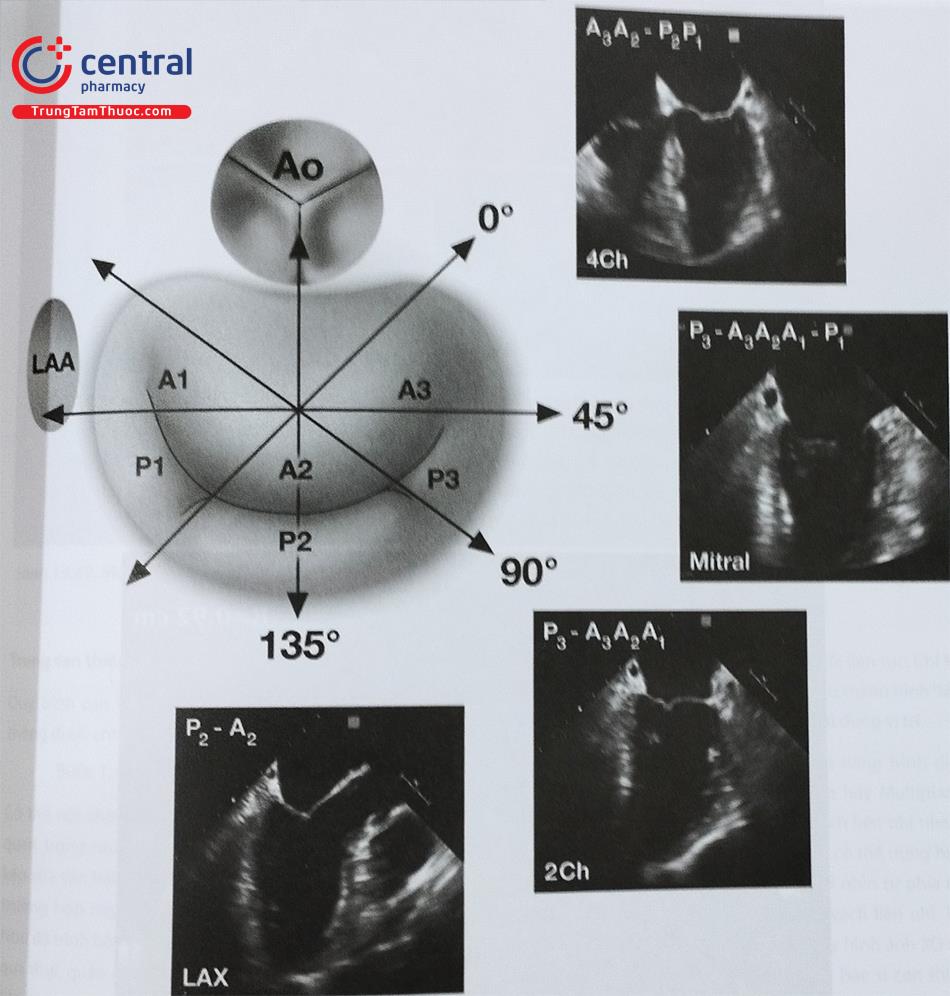
Hai rãnh xẻ nhỏ chia lá sau của van hai lá được chia thành 3 vùng P1, P2, P3 từ ngoài (gần tiểu nhĩ trái) vào trong, lá trước cũng được chia thành 3 vùng tương ứng A1, A2, A3. (Ao; động mạch chủ, LAA: tiểu nhĩ trái; LAX: mặt cắt trục dài; 2Ch: 2 buồng; 4Ch: 4 buồng).
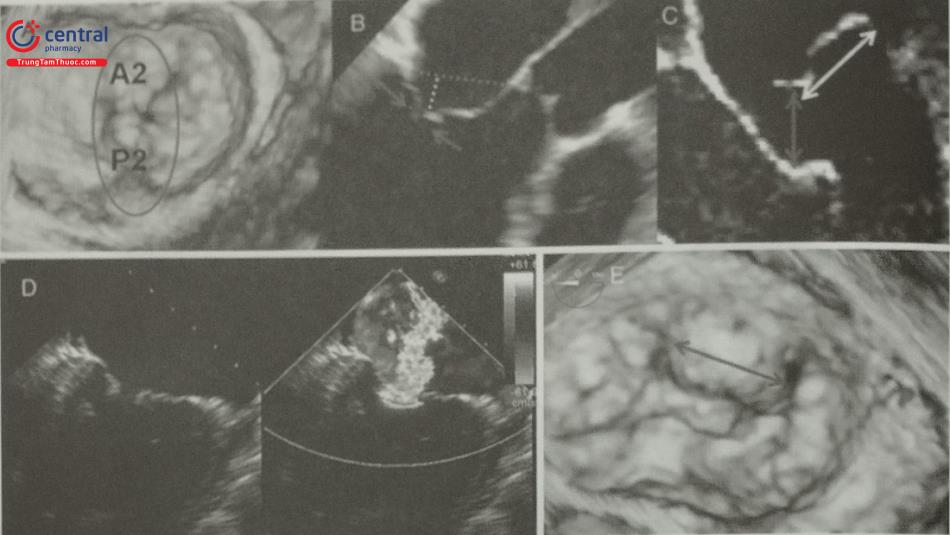
A- Hình ảnh siêu âm tim 3D nhìn trực diện van hai lá từ mặt nhĩ (góc nhìn của phẫu thuật viên) cho thấy van bị sa ở vùng giữa (A2 và P2). B- Đo độ sâu của diện áp trên siêu âm tim qua thực quản 2D. C- Đo chiều dài lá sau (mũi tên trắng) và khoảng sa van (mũi tên đen) trên siêu âm tim qua thực quản 2D. D- Xác định vị trí xuất phát của dòng hở trên siêu âm doppler màu. E- Đo trực tiếp độ rộng vùng sa van trên hình ảnh siêu âm tim 3D trực diện của van hai lá.

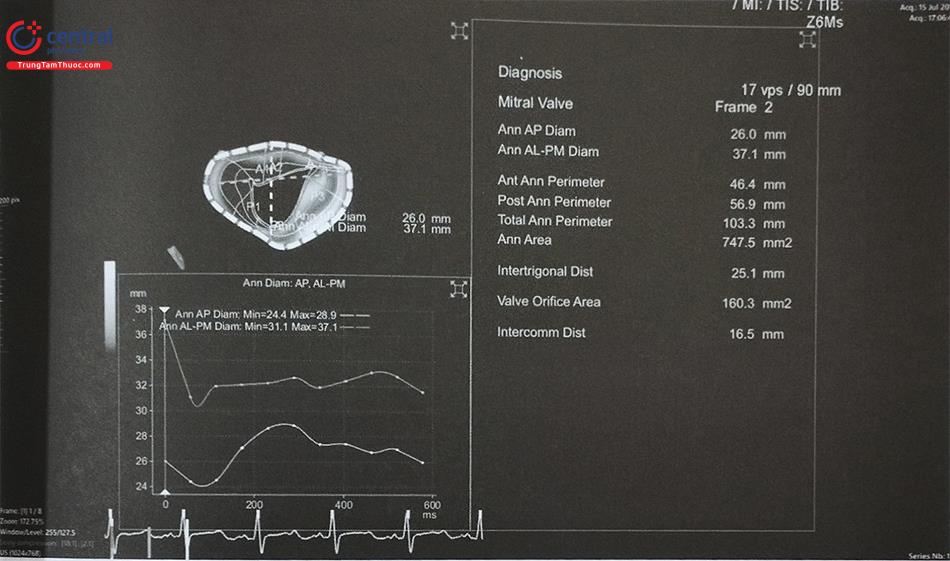
Trong can thiệp
Quy trình can thiệp kẹp sửa van hai lá qua đường ống thông được chia thành 7 bước chính:
Bước 1: Chọc vách liên nhĩ
Có thể nói chọc vách liên nhĩ là một trong những bước quan trọng nhất, quyết định thành công của can thiệp kẹp sửa van hai lá. Vị trí chọc vách liên nhĩ tốt nhất trong trường hợp này nằm ở phần sau trên của vách liên nhĩ. Như đã trình bày trong phần trước, các mặt cắt siêu âm 2D qua thực quản quan trọng nhất để hướng dẫn chọc vách liên nhĩ bao gồm:
Mặt cắt qua hai tĩnh mạch chủ (80-110O giữa thực quản) để lựa chọn vị trí chọc vách liên nhĩ theo chiều trên dưới.
Mặt cắt trục ngắn qua gốc động mạch chủ (30-45Ogiữa thực quản) để xác định vị trí chọc vách liên nhĩ theo chiều trước – Nên chọc vách liên nhĩ ra phía sau (xa động mạch chủ) để dễ đặt clip vuông góc với diện áp của van hai lá trong các bước tiếp theo. Cần lưu ý: do các mặt cắt siêu âm tim 2D chỉ là những lát cắt mỏng, catheter và kim chọc vách liên nhĩ có thể xuất hiện rồi biến mất trên các mặt cắt này, do đó cần ghi hình nhiều mặt cắt và theo dõi liên tục. Chỉ khi nhìn thấy vách liên nhĩ bị catheter ấn vào thành hình “lều” (tenting) mới đảm bảo chọc vách liên nhĩ đúng vị trí.
Siêu âm tim 3D qua thực quản với khả năng trình diễn đồng thời 2 mặt cắt trực giao (X-plane hay Multiplane) giúp hướng dẫn lựa chọn vị trí chọc vách liên nhĩ nhanh và chính xác hơn (Hình 15.70). Ngoài ra, có thể dựng hình ảnh 3D thời gian thực của vách liên nhĩ nhìn từ phía nhĩ phải hoặc nhĩ trái để hướng dẫn chọc vách liên nhĩ. Tuy nhiên, lựa chọn hình ảnh 2D X-plane hay hình ảnh 3D tùy thuộc vào kinh nghiệm và yêu cầu của bác sĩ can thiệp. Nhiều bác sĩ can thiệp có thể muốn sử dụng hình ảnh 2D trực giao hơn bởi:
Hình ảnh 2D có độ tương phản rõ hơn giữa mô vách liên nhĩ (màu trắng) và máu (màu đen) so với màu vàng và xanh trên hình ảnh 3D (Hình 72).
Đôi khi khó nhận ra hình ảnh vách liên nhĩ bị đẩy thành hình lều trên hình ảnh 3D do màu sắc của hình ảnh 3D dù hình ảnh 3D đã được xử lý cắt gọt tương tự như hình ảnh 2D (Hình 71d).
Hình ảnh siêu âm 3D dễ bị ảnh giả (artifact) hơn khi kim chọc vách hoặc catheter đẩy vào vách liên nhĩ.
Ngay khi thấy hình ảnh vách liên nhĩ bị ấn thành hình lều, cần chuyển sang mặt cắt 4 buồng (0O giữa thực quản) để đo khoảng cách từ vị trí chọc vách đến mặt phẳng vòng van hai lá trước khi đẩy kim chọc qua vách liên nhĩ (Hình 70):
Hở hai lá do thoái hóa: Vị trí chọc vách liên nhĩ tối ưu cách mặt phẳng vòng van hai lá 4 – 5 cm để bảo đảm đủ không gian thao tác lái và định vị dụng cụ trong bước tiếp theo (do trong hở hai lá do thoái hóa, lá van có thể bị sa rất sâu vào trong buồng nhĩ).
Hở hai lá cơ năng: Vị trí chọc vách liên nhĩ tối ưu ở phía dưới gần vòng van hai lá hơn (cách mặt phẳng vòng van khoảng 3,5 cm) do diện áp nằm dưới mặt phẳng vòng
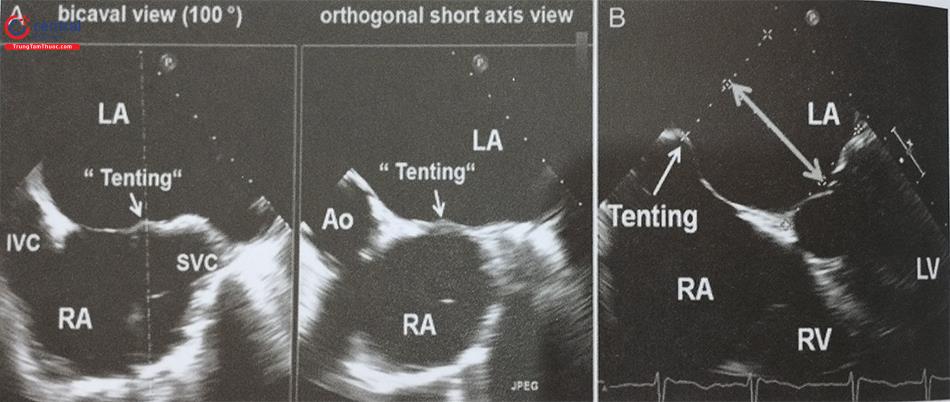
A- Hai mặt cắt trực giao giúp xác định vị trí chọc vách liên nhĩ được trình diễn đồng thời bằng mode X-plane. B- Mặt cắt 4 buồng giữa thực quản để đo khoảng cách từ vị trí chọc vách liên nhĩ (điểm vách liên nhĩ bị ấn thành hình lều đến mặt phẳng vòng van hai lá). (Ao: Động mạch chủ; LA: nhĩ trái; LV: thất trái; RA: nhĩ phải; RV: thất phải)
Lưu ý không chọc vách liên nhĩ qua lỗ bầu dục hoặc lỗ thông liên nhĩ bởi lỗ bầu dục nằm ra phía trước của vách liên nhĩ còn lỗ thông liên nhĩ thường có kích thước lớn nên khó cố định dụng cụ trong các bước tiếp theo.
Khi catheter đã nằm trong nhĩ trái, một dây dẫn siêu cứng (guide wire) được luồn vào tĩnh mạch phổi trên trái hoặc cuộn lại trong nhĩ trái (Hình 72). Ở bước này, cần chuyển sang mặt cắt ghi hình tĩnh mạch phổi trên trái để đảm bảo dây dẫn không bị đưa lạc chỗ vào tiểu nhĩ trái.

Hình ảnh trực diện của vách liên nhĩ nhìn từ phía nhĩ phải. Lưu ý hình ảnh bề mặt vách liên nhĩ bị đẩy lồi về phía nhĩ phải khi catheter bắt đầu ấn vào vách liên nhĩ. Một số bác sĩ can thiệp có thể không thấy rõ hình ảnh này do màu sắc của hình ảnh 3D khác với độ tương phản đen trắng trên hình ảnh siêu âm b, c- Hình ảnh 3D của vách liên nhĩ được xử lý cắt gọt trên trục dài (đường nét đứt màu trắng) qua vị trí chọc vách liên nhĩ (qua điểm vách liên nhĩ bị ấn thành hình lều). Hình ảnh 3D tiếp tục được xoay góc trên trục y và z để tạo ra hình ảnh tương tự như mặt cắt 2D qua 2 tĩnh mạch chủ dưới (d).
Bước 2: Đưa catheter dẫn đường vào nhĩ trái
Catheter dẫn đường và dụng cụ nong (dilator) được đẩy vào nhĩ trái trên dây dẫn (nằm trong tĩnh mạch phổi trên trái). Có thể nhận ra hình ảnh đặc trưng của dụng cụ nong với đầu mút hình nón trên siêu âm tim qua thực quản còn catheter dẫn đường có hình ảnh vòng tròn kép tăng âm ở đầu mút. Khi đẩy catheter cần theo dõi liên tục trên hình ảnh siêu âm tim qua thực quản 2D hoặc 3D và dưới màn tăng sáng để tránh gây thủng thành tự do của nhĩ trái.
Sau khi catheter đã được đưa vào nhĩ trái, que nong và dây dẫn lần lượt được rút về. Phải theo dõi vị trí catheter dẫn đường liên tục trên siêu âm để bảo đảm vị trí đầu catheter cách vách liên nhĩ 1-2 cm để hỗ trợ đưa hệ thống mang clip trong bước tiếp theo.
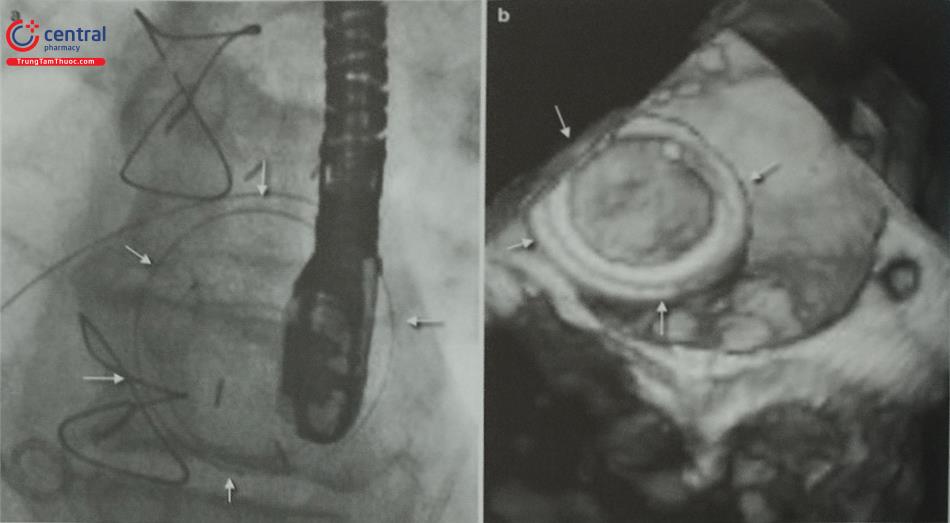
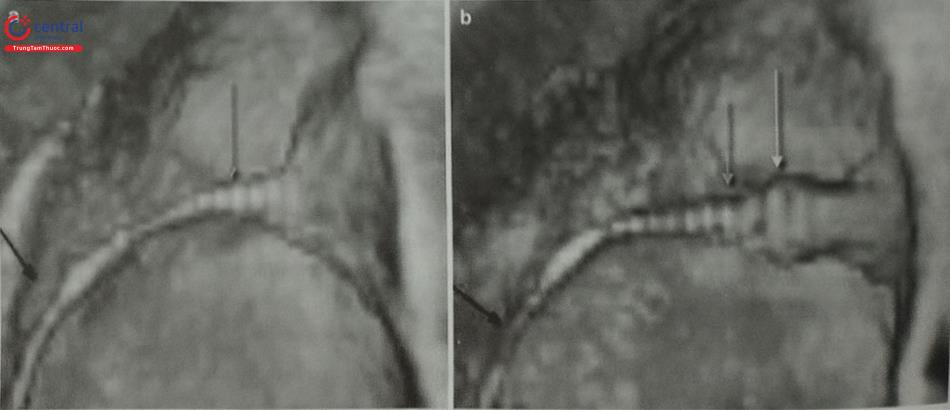
Mũi tên trắng chỉ vào vòng tròn cản quang trên đầu mút của catheter như một chỉ dấu trên màn huỳnh quang và hình ảnh siêu âm tim.
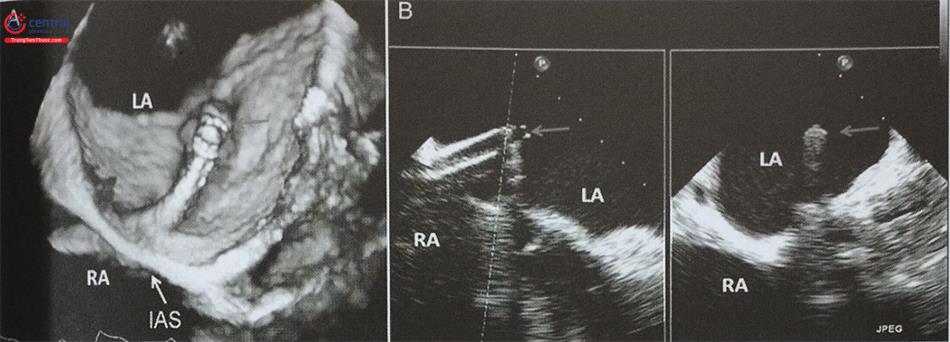
Bước 3: Đẩy hệ thống mang clip vào nhĩ trái
Hệ thống mang clip được đẩy qua catheter vào nhĩ trái dưới hướng dẫn của màn huỳnh quang tăng sáng. Siêu âm tim qua thực quản 2D và 3D giúp đảm bảo chắc chắn đầu mút của catheter dẫn đường đã đi qua vách liên nhĩ và hệ thống mang clip không làm tổn thương thành tự do của nhĩ. Cần theo dõi khoảng cách từ hệ thống mang clip tới thành tự do nhĩ trái trên siêu âm tim qua thực quản 2D hoặc 3D (Hình 75).
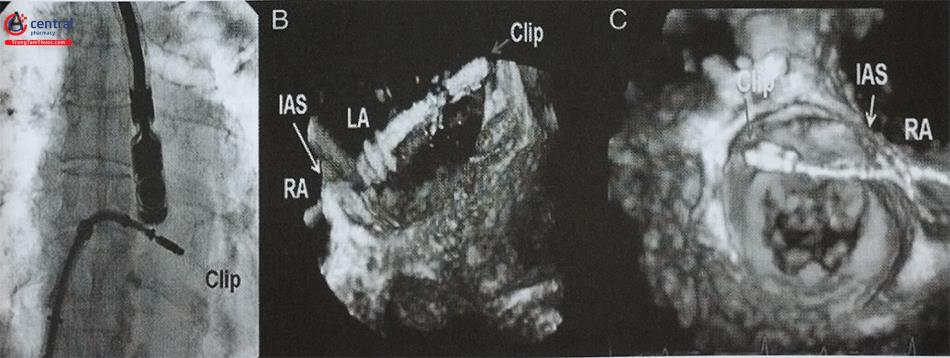
Bước 4: Lái và định vị clip ở trên van hai lá
Sau khi hệ thống mang clip đã nằm trong nhĩ trái, cần thao tác điều chỉnh để đặt clip ở phía trên van hai lá tại vị trí dòng hở lớn nhất trên 2 mặt cắt 2D trực giao: (1) Mặt cắt qua hai mép van (60O): theo dõi sự dịch chuyển của clip theo chiều vách – bên và (2) mặt cắt trục dài (120O): theo dõi sự dịch chuyển clip theo chiều trước – sau. Để đảm bao clip được đặt vuông góc với diện áp, phải quan sát được toàn bộ chiều dài hai ngành (arms) của clip trên mặt cắt trục dài và không thấy cả hai ngành của clip trên mặt cắt qua 2 mép van. Khi phối hợp với siêu âm doppler màu, cần thấy được clip chia đôi dòng hở hai lá trên cả 2 mặt cắt trực giao và đầu mút của clip hướng về vùng hội tụ của dòng hở.
Hình ảnh siêu âm 3D trực diện của van hai lá có thể giúp định vị clip và đảm bảo clip được đặt vuông góc với diện áp của van hai lá. Nếu ghi hình ảnh 3D khó khăn, có thể dùng mặt cắt qua dạ dày để hướng dẫn. Phối hợp linh hoạt hình ảnh siêu âm 2D và 3D qua thực quản giúp đảm bảo clip được định vị hợp lý trước khi đẩy clip xuống thất trái.

Bước 5: Đẩy dụng cụ MitraClip xuống thất trái
Có thể theo dõi liên tục quá trình đẩy clip xuống thất trái trên 2 mặt cắt siêu âm tim 2D qua thực quản trực giao: mặt cắt qua 2 mép van và mặt cắt trục dài. Các cánh tay của clip được khép lại trước khi đẩy clip xuống thất trái sau đó lại được mở ra khi bước này kết thúc. Lưu ý theo dõi chặt chẽ vị trí và hướng của clip bởi clip có thể bị xoay trong quá trình di chuyển từ nhĩ trái xuống thất trái. Các mặt cắt siêu âm tim quan trọng nhất ở bước này là mặt cắt qua 2 mép van và mặt cắt trục dài để đồng thời đánh giá vị trí của clip theo chiều trong – ngoài và trước – sau. Để trực tiếp đánh giá vị trí và hướng của clip so với van hai lá, nên dựng hình 3D trực diện của van hai lá nhìn từ mặt nhĩ hoặc mặt thất. Cách đơn giản nhất là giữ nguyên hình ảnh 3D trực diện của van hai lá nhìn từ mặt nhĩ và giảm gain 3D để thấy rõ các ngành của clip dù clip đã nằm trong thất trái. Hai mặt cắt trực giao qua 2 mép van và trục dài phối hợp với doppler màu giúp đảm bảo clip chia đôi dòng hở hai lá và các lá van vẫn di động tự do phía trên clip.
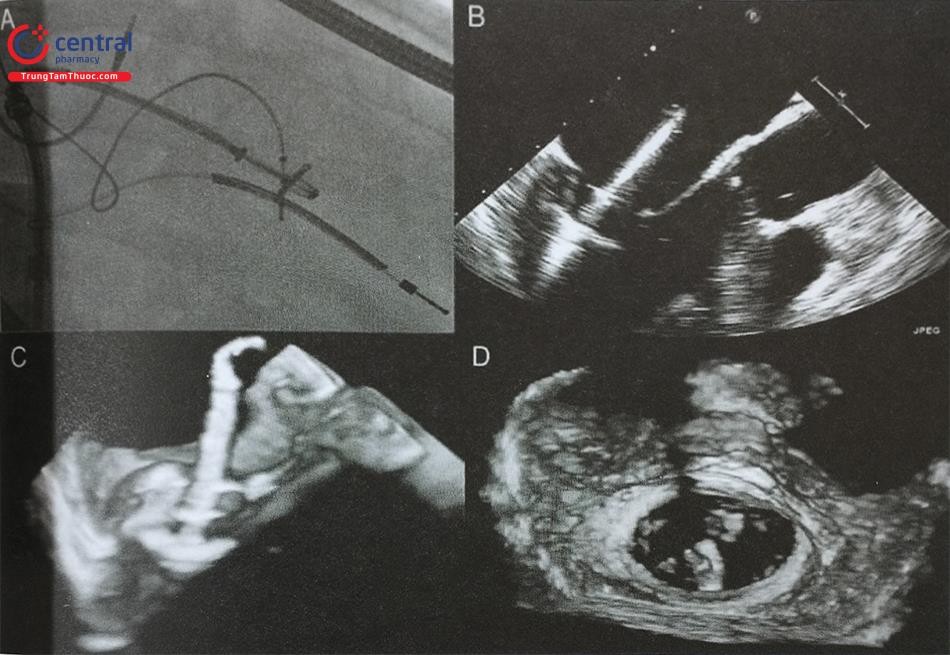
Bước 6: Kẹp mô van hai lá
Sau khi đã đặt clip ở vị trí và hướng phù hợp, quá trình mô van hai lá được kẹp giữa các cánh tay và gọng kẹp của clip được theo dõi trên siêu âm tim 2D qua thực quản tại mặt cắt trục dài (Hình 15.78, 15.79). Nên ghi hình động dài trong quá trình kẹp mô lá van. Khuyến cáo ban đầu chỉ nên đóng dụng cụ Mitraclip khoảng 60 – 90 độ và chỉ đóng dụng cụ hoàn toàn khi đảm bảo kẹp đủ mô của hai lá van và mức độ hở hai lá được cải thiện. Hình ảnh mô van lá sau được kẹp trong dụng cụ quan sát rõ nhất trên mặt cắt trục dài còn mô van lá trước quan sát rõ nhất trên mặt cắt 4 buồng giữa thực quản. Ngoài ra, mặt cắt qua 2 mép van cũng hỗ trợ thêm. Khi đảm bảo các lá van đã được kẹp trong dụng cụ và mức độ hở hai lá được cải thiện rõ, có thể đóng clip hoàn toàn.

A- Vị trí mô lá van được kẹp giữa các cánh tay và gọng kẹp của dụng cụ Mitraclip (mũi tên đen). B- Mặt cắt trục dài giữa thực quản cho thấy cả lá trước (AML) và lá sau (PML) của van hai lá được quan sát rõ phía trên clip. Hình ảnh mô hai lá van được kẹp đủ trong clip trên siêu âm tim qua thực quản 2D (C) và 3D (D).
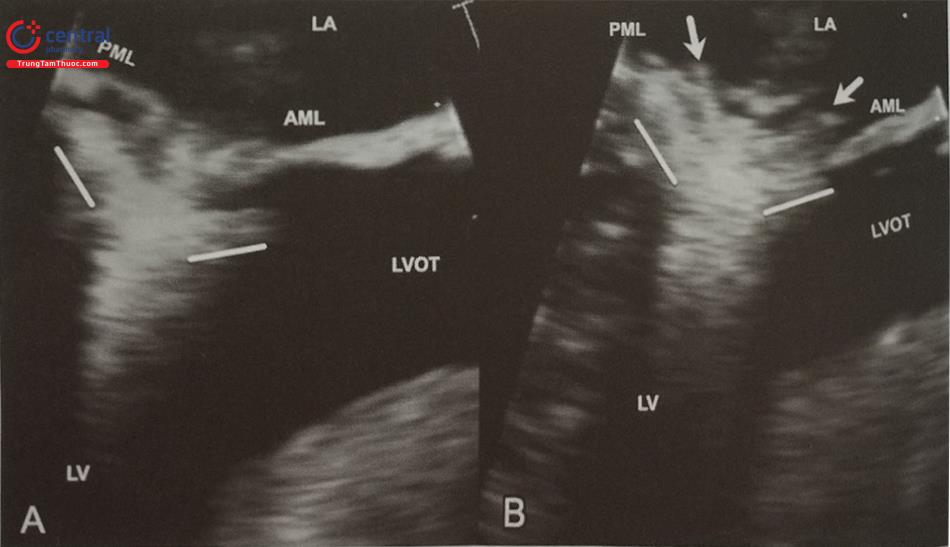
A- Trước khi kẹp, vẫn quan sát rõ lá trước (AML) và lá sau (PML) của van hai lá phía trên hai cánh tay của clip (đường kẻ đậm màu trắng). B- Trong quá trình đóng clip, mô lá van được kẹp giữa các cánh tay (đường kẻ đậm màu trắng) và gọng kẹp (mũi tên) của clip. (LA: nhĩ trái; LV: thất trái; LVOT: đường ra thất trái).
Bước 7: Đánh giá kết quả và thả dụng cụ
Sau khi đặt và đóng các ngành của clip, cần đánh giá 5 vấn đề quan trọng:
Sự thay đổi cấu trúc van hai lá, ví dụ: đầu mút vùng sa van đã được kẹp hoặc diện áp đã được cải thiện trong hở hai lá thứ phát. Nếu clip được đặt ở chính giữa sẽ tạo ra hai lỗ van đối xứng từ một lỗ van ban đầu. Nếu clip được đặt lệch về một bên, hai lỗ van mới có thể không đối xứng. Hình ảnh van hai lá với hai lỗ van sau khi kẹp clip có thể quan sát tốt nhất trên hình ảnh 3D trực diện nhìn từ mặt nhĩ hoặc mặt thất.
Đủ mô van được kẹp trong clip: ít nhất 9 mm mô van đối với dụng cụ MitraClip XT, ít nhất 4 mm mô van đối với dụng cụ MitraClip Cần đánh giá trên nhiều mặt cắt 2D và xem lại các hình ảnh ở gọng kẹp của clip.
Mức độ hở hai lá tồn lưu: Cần lưu ý tình trạng huyết động của bệnh nhân có thể khác với trước can thiệp do ảnh hưởng của thuốc gây mê. Hiện nay, đánh giá mức độ hở hai lá tồn lưu sau can thiệp vẫn là một vấn đề khó bởi diện tích hở có thể tăng lên khi có nhiều dòng hở dẫn tới đánh giá mức độ hở tồn lưu cao hơn thực tế, điều này thường xảy ra sau khi đặt clip. Đường kính vena contracta đo trên siêu âm tim 2D không đáng tin cậy khi có nhiều dòng hở còn EROA đo bằng phương pháp PISA chưa được chấp thuận để đánh giá hở hai lá tồn lưu sau can thiệp. Do đó để đánh giá mức độ hở hai lá tồn lưu cần phối hợp nhiều thông số như:
- Không còn hình ảnh đảo phổ tâm thu của dòng chảy tĩnh mạch phổi, sóng S trên phổ doppler xung của dòng chảy tĩnh mạch phổi rõ.
- Áp lực nhĩ trái giảm, thậm chí trở về bình thường.
- Nếu không có hở chủ, có thể đo thể tích hở hai lá tồn dư từ cung lượng qua đường ra thất trái (VTI ĐRTT x SĐRTT) và thể tích tống máu toàn bộ của thất trái (EDV – ESV). Có thể đo các thể tích thất trái bằng siêu âm tim 3D. (Trong đó VTI (Velocity Time Integral): Tích phân vận tốc theo thời gian; ĐRTT: Đường ra thất trái; S: Diện tích; EDV (End-diastolic volume): Thể tích cuối tâm trương; ESV (End-systolic volume): Thể tích cuối tâm thu).
Ngoài các thông số siêu âm tim, nên phối hợp với các thông số khác đo trên thông tim để đánh giá hở hai lá tồn lưu:
- Áp lực nhĩ trái (sóng v): áp lực nhĩ trái giảm hoặc thậm chí về bình thường.
- Thể tích nhát bóp đo trên thông tim phải bằng phương pháp pha loãng nhiệt hoặc đo bằng catheter
- Chụp buồng thất trái để đánh giá mức độ hở hai lá tồn lưu dựa trên đậm độ và mức độ lan của dòng thuốc cản quang vào nhĩ trái.
Tình trạng hẹp hai lá sau khi đặt clip: Trước khi thả clip cần đo diện tích lỗ van hai lá trên hình ảnh siêu âm tim 3D hoặc mặt cắt 2D qua dạ dày. Diện tích lỗ van hai lá > 2cm2 trước khi thả clip được cho là chấp nhận được và chênh áp trung bình qua van hai lá < 5 mmHg. Ảnh giả (artifact) do clip có thể ảnh hưởng tới việc đánh giá hiệu quả can thiệp trên siêu âm tim 2D qua thực quản.
Các biến chứng: clip bị vướng vào dây chằng dưới van hai lá, rơi dụng cụ, tràn dịch màng tim, thông liên nhĩ tồn lưu, tràn dịch màng ngoài tim.
Trong trường hợp cần đặt thêm clip, tốt nhất cần theo dõi và hướng dẫn định vị clip mới bằng siêu âm tim 3D qua thực quản kết hợp với màn tăng sáng.
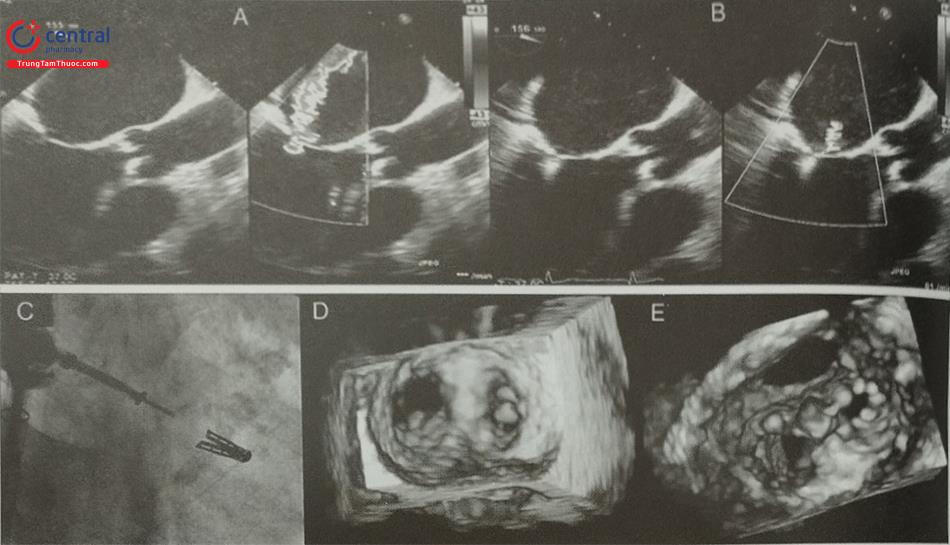
Mức độ hở hai lá sau can thiệp (B) có cải thiện so với trước can thiệp (A). Hai lỗ van mới được tạo ra từ một lỗ van ban đầu trên hình ảnh 3D trực diện nhìn từ mặt nhĩ (D) và mặt thất (E).
Sau can thiệp
Siêu âm tim qua thành ngực được sử dụng để theo dõi định kỳ cho bệnh nhân sau can thiệp với mục tiêu đánh giá vị trí của dụng cụ Mitraclip, mức độ hở hai lá, hẹp hai lá (nếu có) và kích thước chức năng thất trái cũng như áp lực động mạch phổi.
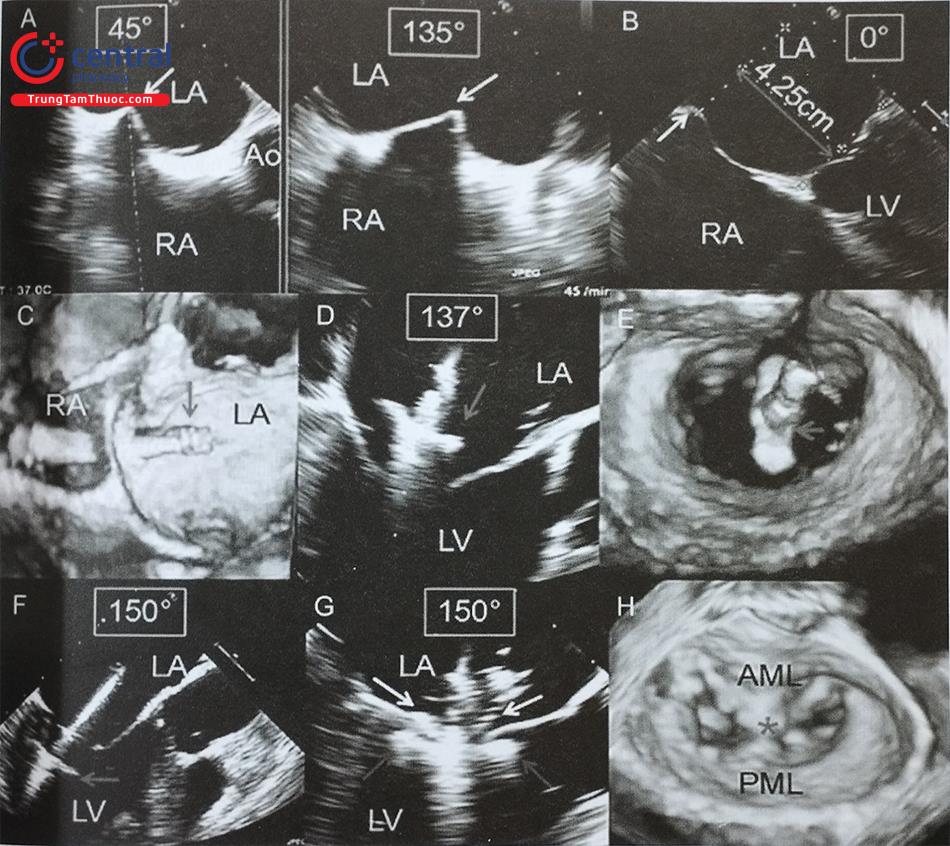
A- Chọc vách liên nhĩ với 2 mặt cắt trực giao X-plane. B- Đo khoảng cách từ vị trí chọc vách liên nhĩ đến mặt phẳng vòng van hai lá trên mặt cắt 4 buồng giữa thực quản. C- Đẩy catheter dẫn đường vào nhĩ trái dưới hướng dẫn của siêu âm tim 3D. D- Hệ thống mang clip được đẩy vào nhĩ trái, clip nằm trên van hai lá trên mặt cắt trục dài giữa thực quản. E- Định vị clip trên van hai lá để hai cánh tay clip vuông góc với diện áp của hai lá van trên hình ảnh 3D nhìn trực diện van hai lá từ mặt nhĩ. F- Clip đã được đẩy xuống thất trái, các lá van di động tự do trên clip trên mặt cắt trục dài giữa thực quản. G- Tiến hành kẹp mô van: Mô van lá trước và lá sau được kẹp giữa cánh tay (mũi tên xám) và gọng kẹp (mũi tên trắng) của clip trên mặt cắt trục dài giữa thực quản. H – Hình ảnh 3D trực diện của van hai lá nhìn từ mặt nhĩ với hai lỗ van mới được tạo ra sau khi thả clip. (LA: nhĩ trái; LV: thất trái; LVOT: đường ra thất trái; AML: lá trước van hai lá; PML: lá sau van hai lá)
2.3.3 Can thiệp thay van động mạch chủ qua đường ống thông
Can thiệp thay van động mạch chủ qua đường ống thông (TAVI) là biện pháp điều trị thay thế phẫu thuật truyền thống dành cho các bệnh nhân hẹp van động mạch chủ khít có triệu chứng nhưng nguy cơ phẫu thuật cao. Tới thời điểm hiện tại có 2 loại van nhân tạo chính được cấp phép sử dụng trong TAVI là van nở trên bóng (Edward Sapien) và van tự nở (CoreValve, EVOLUT). Để can thiệp thay van động mạch chủ qua đường ống thông đạt hiệu quả tối ưu và hạn chế biến cố cần có sự phối hợp nhuần nhuyễn của “Heart team” trong đó chẩn đoán hình ảnh tim mạch là mắt xích không thể thiếu. Năm 2011, Hội Siêu âm Tim Hoa Kỳ và Hội Siêu âm Tim Châu Âu đã đưa ra khuyến cáo về vai trò của siêu âm tim 3D qua thực quản trong TAVI.
Hiện nay, nhằm hạn chế việc bệnh nhân phải đặt nội khí quản và gây mê toàn thân cùng các biến cố kèm theo, với sự phát triển của MSCT và kỹ thuật can thiệp tim mạch, đa số các trung tâm thực hiện TAVI dưới hướng dẫn của màn tăng sáng với siêu âm tim qua thành ngực chờ để đánh giá hiệu quả tức thì và biến cố ngay sau thả dụng cụ. Tuy nhiên, siêu âm tim qua thực quản 3D thời gian thực vẫn có giá trị trong đánh giá bệnh lý van động mạch chủ trước can thiệp ở nhóm bệnh nhân không chụp được MSCT do chống chỉ định với thuốc cản quang đường tĩnh mạch hoặc hình ảnh MSCT không tối ưu. Trong hướng dẫn can thiệp, siêu âm tim qua thực quản 3D thời gian thực được chỉ định ở những trường hợp khó, phức tạp như van động mạch chủ ít vôi hóa khó quan sát trên màn tăng sáng, can thiệp đặt van trong van hoặc khi xảy ra biến cố (hở cạnh van nhân tạo có ý nghĩa, rơi dụng cụ gây biến cố thuyên tắc,…).
Trước can thiệp
Siêu âm tim trước TAVI có van trò quan trọng để lựa chọn bệnh nhân phù hợp với can thiệp. Các vấn đề cần đánh giá trên siêu âm tim bao gồm:
(1) Chẩn đoán xác định và chẩn đoán mức độ hẹp van động mạch chủ.
- Siêu âm tim qua thành ngực là lựa chọn đầu tay để chẩn đoán xác định, chẩn đoán mức độ hẹp van động mạch chủ và chẩn đoán nguyên nhân hẹp van động mạch chủ. Các thông số quan trọng để đánh giá mức độ hẹp van động mạch chủ bao gồm: diện tích van động mạch chủ đo viền trực tiếp trên hình ảnh siêu âm 2D/3D, vận tốc đỉnh qua van động mạch chủ, chênh áp trung bình qua van động mạch chủ.
- Cần phân biệt hẹp van động mạch chủ do thấp với hẹp van động mạch chủ do thoái hóa bởi hẹp van động mạch chủ do thấp không phù hợp với Các trường hợp hẹp trên van hoặc dưới van động mạch chủ cũng là chống chỉ định can thiệp.
- Trong một số trường hợp cần chỉ định siêu âm tim gắng sức với Dobutamine để phân biệt hẹp chủ khít thực sự với giả hẹp chủ ở bệnh nhân suy chức năng tâm thu thất trái nặng. Bạn đọc có thể tham khảo quy trình đánh giá hẹp van động mạch chủ trên siêu âm tim trong khuyến cáo của Hội Siêu âm tim Hoa Kỳ (American Society of Echocardiography hay ASE).
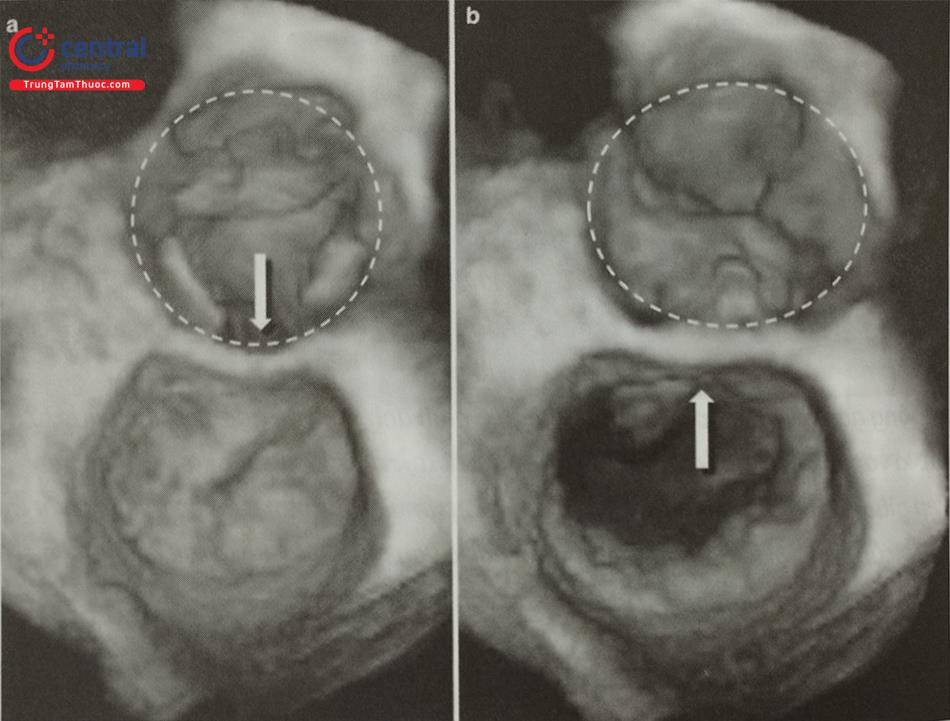
a- Trong thì tâm thu, dải xơ giữa van hai lá và van động mạch chủ bị đẩy về phía van hai lá (mũi tên) nên vòng van động mạch chủ trở nên tròn hơn. b- Trong thì tâm trương, hiện tượng ngược lại xảy ra, vòng van động mạch chủ có hình bầu dục.
(2) Đo kích thước vòng van động mạch chủ.
Kích thước vòng van động mạch chủ là thông số quan trọng liên quan đến lựa chọn kích thước van nhân tạo trong TAVI. Lựa chọn van TAVI có kích thước không phù hợp có thể dẫn đến các biến chứng như hở cạnh van hoặc bất tương xứng giữa kích thước van nhân tạo và người bệnh. Do vòng van động mạch chủ trên thực tế là một vòng ảo nối các điểm đáy của 3 lá van và có hình elip, cả siêu âm tim qua thành ngực và siêu âm tim qua thực quản 2D đều ước tính đường kính và diện tích vòng van thấp hơn thực tế. Trên siêu âm tim qua thành ngực 2D, đường kính vòng van động mạch chủ được đo trên mặt cắt trục dài cạnh ức, trung bình nhỏ hơn 1 mm so với đo trên siêu âm tim 2D thực quản. Đường kính vòng van đo trên siêu âm tim qua 2D thực quản trung bình nhỏ hơn 1,5 mm so với chụp cắt lớp vi tính đa dãy (MSCT). Siêu âm tim qua thực quản 3D thời gian thực với khả năng tái dựng hình ảnh 3D trực diện của van động mạch chủ và đường ra thất trái (Hình 83), cho phép đánh giá sự thay đổi động học về hình thái và kích thước của vòng van động mạch chủ và đường ra thất trái trong chu chuyển tim. Phần mềm hậu xử lý hình ảnh trên siêu âm tim 3D có khả năng tái dựng hình ảnh van động mạch chủ đa bình diện (MPR) cho phép bác sĩ siêu âm điều chỉnh để cắt đúng qua vòng van động mạch chủ để đo các kích thước vòng van chính xác nhất (Hình 15.84). Một chức năng khác của phần mềm hậu xử lý hình ảnh 3D là xây dựng mô hình tham số của van động mạch chủ và gốc động mạch chủ và tính toán nhanh các đường kính vòng van động mạch chủ (Hình 85).
Hiện nay, MSCT được coi là kỹ thuật chuẩn vàng để đo đạc đường kính vòng van động mạch chủ. Siêu âm tim 3D qua thực quản vẫn có ý nghĩa trong trường hợp bệnh nhân không chụp được MSCT do bệnh lý đồng mắc như suy thận nặng không dùng được thuốc cản quang đường tĩnh mạch. Kích thước vòng van động mạch chủ đo trên siêu âm tim 3D qua thực quản tương quan chặt chẽ với chụp MSCT.
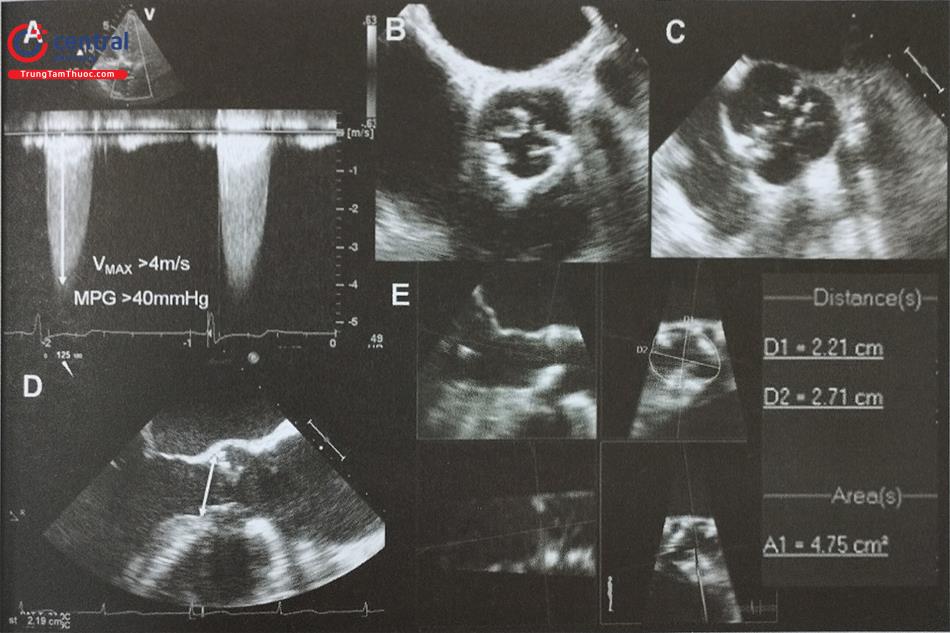
A- Chẩn đoán hẹp chủ khít nếu vận tốc đỉnh qua van động mạch chủ > 4 m/s hoặc chênh áp trung bình qua van > 40 mmHg trên phổ doppler liên tục. B, C- Van động mạch chủ ba lá van trên siêu âm tim qua thực quản 2D. D- Van động mạch chủ ba lá van trên siêu âm tim qua thực quản 3D. E- Đo kích thước vòng van động mạch chủ trên siêu âm tim qua thực quản 3D với chức năng MPR. Vòng van động mạch chủ có hình elip với đường kính D2 > D1. Nếu chỉ đo đường kính trên 1 mặt cắt có thể ước tính đường kính vòng van động mạch chủ thấp hơn thực tế và lựa chọn van nhân tạo có kích thước không phù hợp.
(3) Đánh giá hình thái giải phẫu van động mạch chủ
- Siêu âm tim, đặc biệt là siêu âm tim qua thực quản 2D hoặc 3D cần mô tả chi tiết giải phẫu van động mạch chủ bao gồm: Số lượng lá van, độ dày lá van, tình trạng dính mép van, độ di động và vôi hóa của lá van, hình dạng và độ đối xứng của van động mạch chủ khi mở, chiều dài của lá vành trái đến lỗ vào của động mạch vành trái.
- Van động mạch chủ hai lá van là chống chỉ định TAVI tương đối bở nguy cơ hở cạnh van nặng, tách thành động mạch chủ hoặc thuyên tắc do rơi dụng cụ.
- Van động mạch chủ vôi hóa nặng thường đi kèm với tình trạng hở cạnh van sau can thiệp hoặc bít tắc các lỗ vào của động mạch vành.
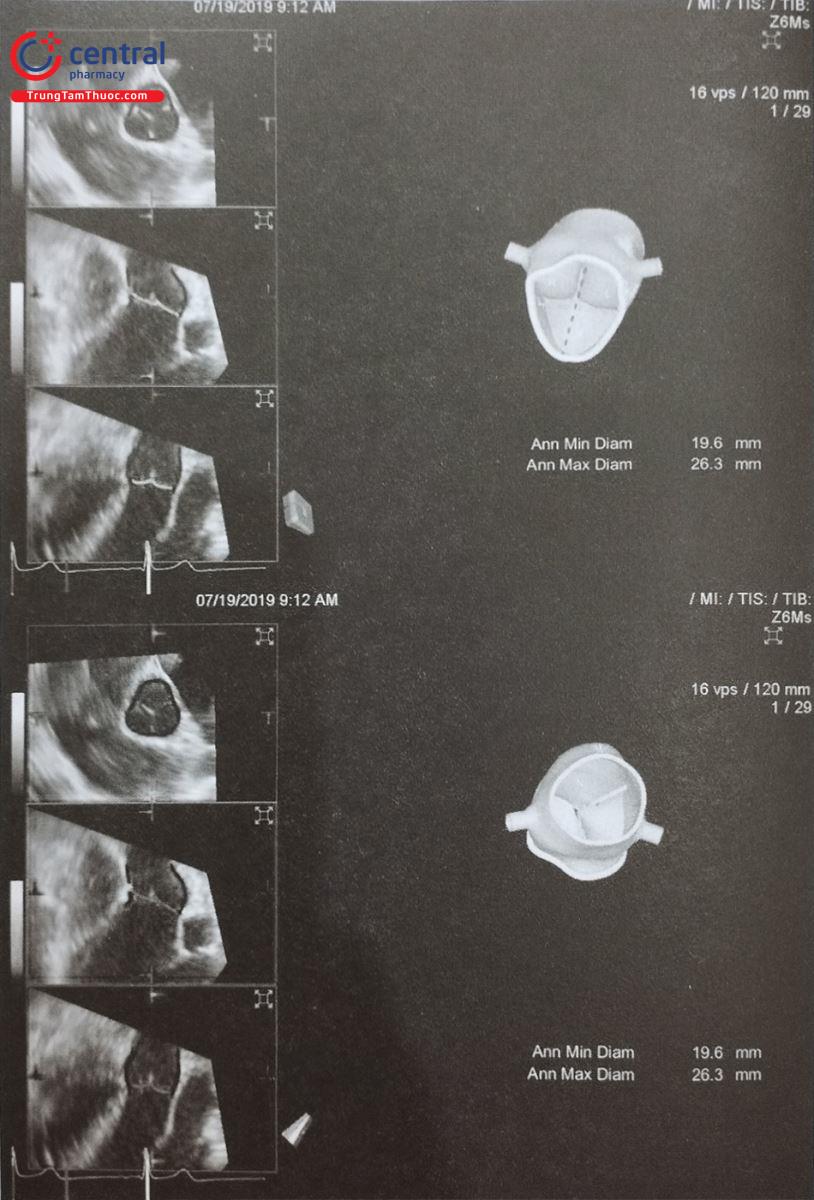
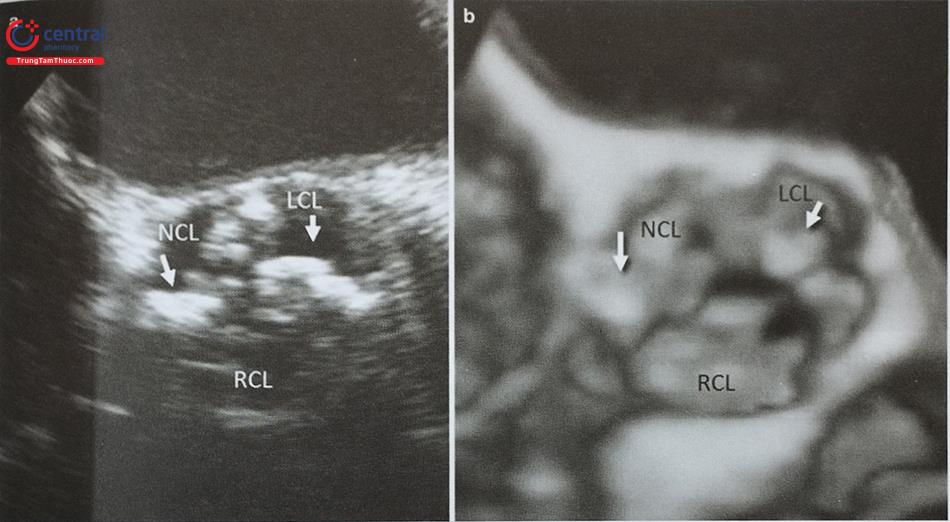
(4) Đánh giá giải phẫu gốc động mạch chủ và đo chiều cao từ mặt phẳng vòng van động mạch chủ đến lỗ vào của các động mạch vành.
Để đảm bảo van nhân tạo được thả thành công trong động mạch chủ, cần đánh giá toàn diện hình dạng và các kích thước gốc động mạch chủ. Đường kính gốc động mạch chủ tại xoang Valsalva, đường kính chỗ nối xoang ống và vị trí của các lỗ vào động mạch vành là các thông số liên quan tới việc lựa chọn van nhân tạo và vị trí đặt van.
Khoảng cách giữa mặt phẳng vòng van động mạch chủ và lỗ vào của các động mạch vành có ý nghĩa đặc biệt quan trọng. Đối với bệnh nhân dự kiến làm TAVI, khoảng cách này tối thiểu 10 – 11 mm để hạn chế nguy cơ bít tắc lỗ vào các động mạch vành gây nhồi máu cơ tim. Hiện nay, MSCT là phương tiện chủ yếu để đánh giá chiều cao từ mặt phẳng vòng van động mạch chủ đến lỗ vào của các động mạch vành. Siêu âm tim qua thực quản 3D là lựa chọn thay thế trong trường hợp MSCT bị chống chỉ định (Hình 15.87).
(5) Động mạch chủ ngực.
Giãn hoặc phình lớn động mạch chủ ngực là chống chỉ định can thiệp TAVI bằng CoreValve. Ngoài ra, xơ vữa lớn hoặc vôi hóa nặng tại quai động mạch chủ là chống chỉ định can thiệp theo đường ngược dòng, bắt buộc phải chuyển sang đường mỏm tim.
(6) Các tổn thương tim khác kèm
- Hở hai lá là vấn đề thường gặp ở bệnh nhân hẹp van động mạch chủ. Mức độ hở hai lá thường giảm sau Cần đánh giá chi tiết giải phẫu van hai lá, đặc biệt là dải xơ liên tiếp giữa van hai lá và van động mạch chủ trên siêu âm tim 3D qua thực quản trước và sau can thiệp bởi liên quan gần của 2 van tim về giải phẫu.
- Cần phát hiện tình trạng phì đại phần đáy vách liên thất (vách liên thất phồng) bởi đây có thể là yếu tố làm van nhân tạo dễ bị di lệch hoặc khó đặt van đúng vị trí mong muốn.
- Chức năng tâm thu thất trái và rối loạn vận động vùng cơ tim thất trái là các vấn đề thường quy phải đánh giá trước can thiệp để có cơ sở so sánh sau can thiệp nhằm đánh giá hiệu quả can thiệp và phát hiện biến chứng.
- Huyết khối buồng thất hoặc vôi hóa màng ngoài tim là chống chỉ định can thiệp TAVI theo đường mỏm tim.
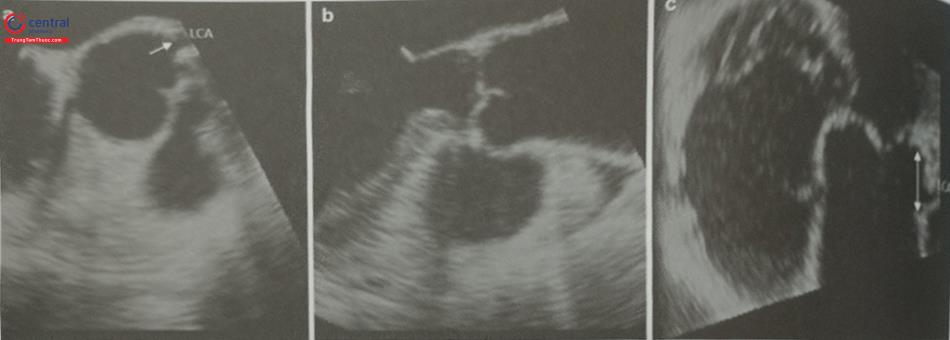
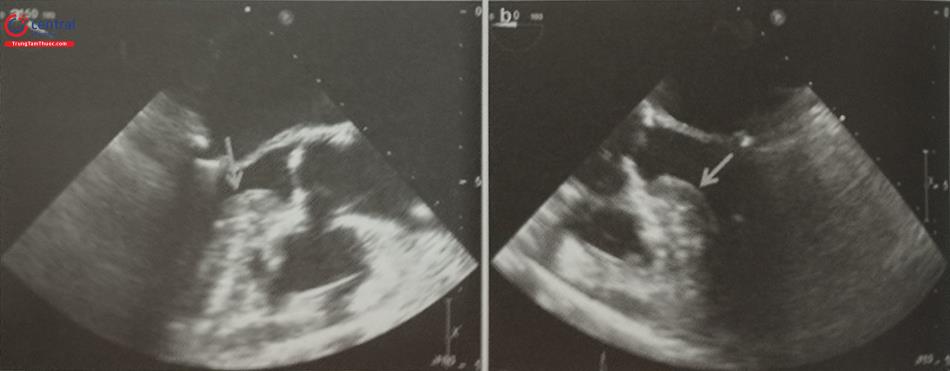
Trong can thiệp
Như đã trình bày, hiện nay TAVI được thực hiện chủ yếu dưới hướng dẫn của màn tăng sáng tại đa số các trung tâm tim mạch trên thế giới. Vai trò của siêu âm tim, đặc biệt là siêu âm tim 2D hoặc 3D qua thực quản trong hướng dẫn can thiệp TAVI ngày càng hạn chế bởi bệnh nhân cần được gây mê toàn thân và đặt nội khí quản, có thể dẫn tới các biến cố liên quan tới gây mê và thở máy. Thêm vào đó, đầu dò siêu âm tim qua thực quản có thể che hình ảnh chiếu huỳnh quang trong quá trình can thiệp. Đôi khi cần rút đầu dò siêu âm thực quản lên cao khi thả van rồi đặt lại đầu dò để đánh giá sau khi thả van.
Mặc dù vậy, siêu âm tim đặc biệt là siêu âm tim 3D qua thực quản vẫn là phương tiện hướng dẫn can thiệp TAVI được lựa chọn đầu tay trong các trường hợp khó như van động mạch chủ không vôi hóa nhiều, hạn chế quan sá trên chiếu huỳnh quang hoặc can thiệp đặt van trong van.
Vai trò hướng dẫn của siêu âm tim trong các bước can thiệp TAVI theo đường ngược dòng như sau:
(1) Đưa dụng cụ qua van động mạch chủ.
Bình thường, quá trình đưa dây dẫn (guide wire) và catheter đi qua lỗ van động mạch chủ được hướng dẫn dưới màn huỳnh quang tăng sáng. Tuy nhiên, siêu âm tim 3D qua thực quản có vai trò hướng dẫn trong các trường hợp gốc động mạch chủ giãn hoặc gập góc nhiều, khó đưa guidewire qua lỗ van động mạch chủ. Với độ phân giải không gian tốt, siêu âm tim 3D qua thực quản còn cho phép đánh giá và theo dõi vị trí của sonde điện cực tạo nhịp tạm thời và wire cứng trong buồng thất trái, hạn chế nguy cơ wire cứng bị mắc vào dây chằng dưới van hai lá.

(2) Nong van động mạch chủ bằng bóng
Siêu âm tim qua thực quản tốt hơn chiếu huỳnh quang trong xác định vị trí bóng nong van động mạch chủ và hiệu quả nong van. Đôi khi, bóng nong có thể bị di lệch khi lên bóng đặc biệt khi có phì đại vách liên thất vùng đáy tim hoặc chỗ nối xoang ống động mạch chủ hẹp.
Nên sử dụng mặt cắt trục dài giữa thực quản (110-120O) hoặc tốt hơn là ghi hình X-plane với 2 mặt cắt trực giao trục dài và trục ngắn qua van động mạch chủ bằng siêu âm tim qua thực quản 3D để theo dõi liên tục quá trình nong van bằng bóng (Hình 90). Do quá trình nong van động mạch chủ diễn ra dưới tác dụng của tạo nhịp nhanh, cần ghi hình ảnh siêu âm nhiều hơn 1 nhát bóp, khuyến cáo nên ghi hình siêu âm trong 10 giây để thu được toàn bộ hình ảnh khi bơm và làm xẹp bóng. Theo dõi liên tục quá trình nong van động mạch chủ dưới hướng dẫn của siêu âm giúp phát hiện sớm các biến chứng như vỡ vòng van động mạch chủ, tràn máu màng ngoài tim hoặc hở chủ nhiều.
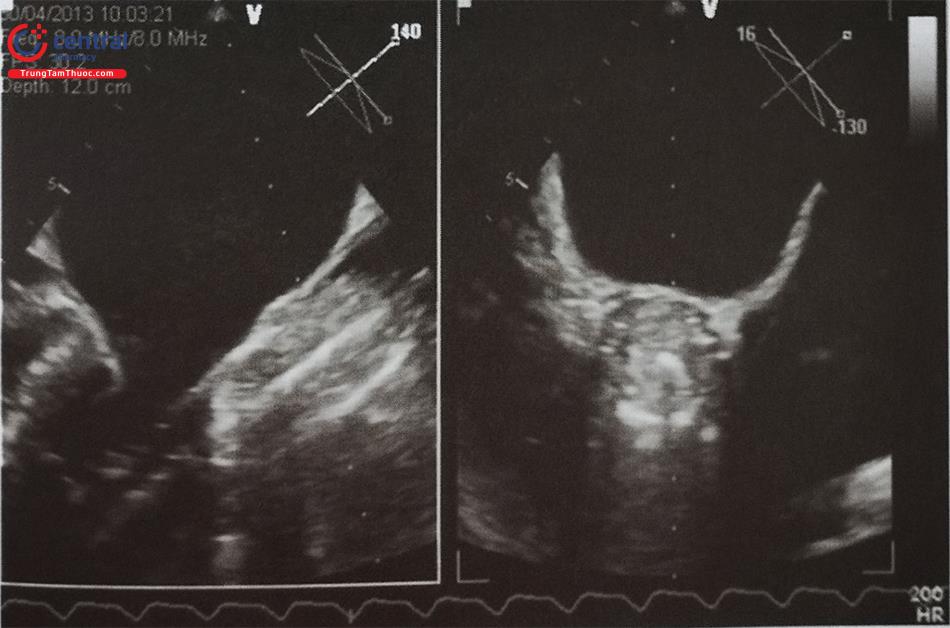
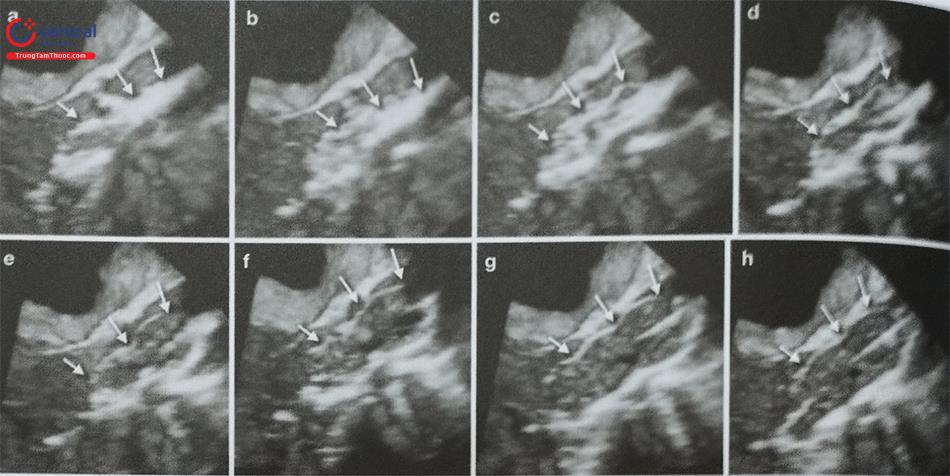
(3) Định vị và thả van nhân tạo
Đối với van tự nở, vị trí tối ưu của van là bờ phía thất của khung van nằm dưới mặt phẳng vòng van động mạch chủ 4 mm (thế hệ 1) hoặc 3 mm (thế hệ 2). Đối với van nở trên bóng, vị trí tối ưu của van là bờ phía thất của khung van nằm dưới mặt phẳng vòng van 4 mm.
Thả van quá sâu trong đường ra thất trái có thể chèn vào lá trước của van hai lá kèm theo tình trạng hở cạnh van ở phía trên phần “váy” của van nhân tạo (“supraskirtal” PVR). Ngược lại, thả van quá cao trong xoang Valsalva có thể làm tắc lỗ vào các động mạch vành, huyết khối phần xa của van nhân tạo và hở cạnh van ở phía dưới van. Lưu ý van có thể bị trượt lên trên trong đường ra thất trái khi thả. Ngoài ra, van cần được đặt thẳng trục với động mạch chủ trước khi lên bóng để tránh hở cạnh van xuất hiện sau khi thả van.

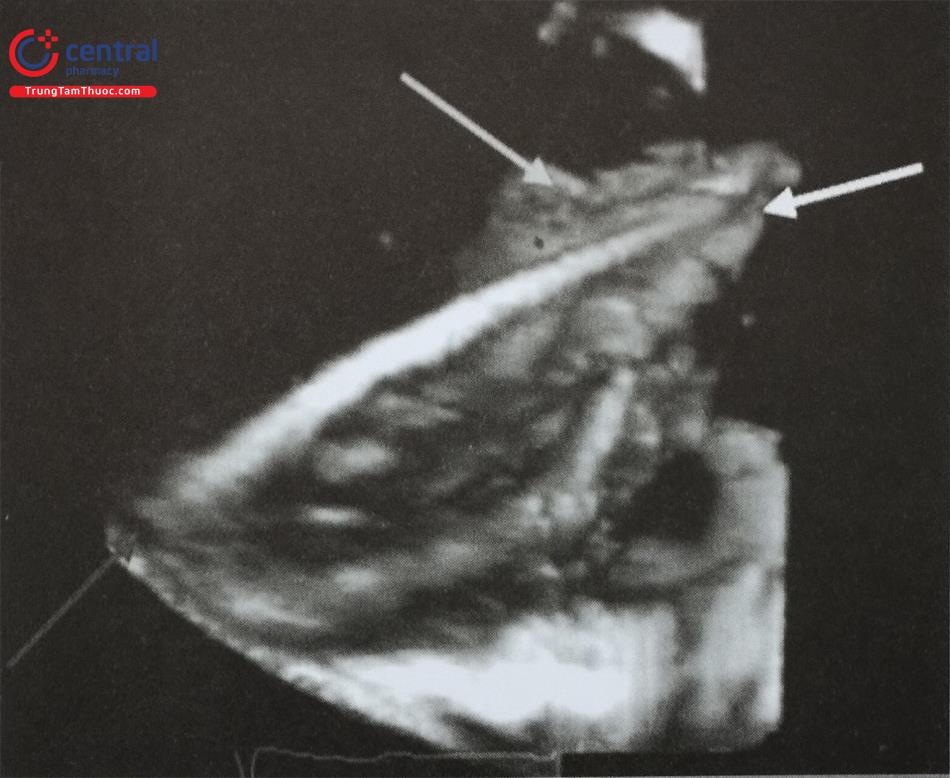
Trong trường hợp can thiệp TAVI theo đường mỏm tim, cần mở ngực tối thiểu tại vị trí trước bên lồng ngực, mở màng ngoài tim, xác định mỏm tim và dùng kim chọc mỏm thất trái. Sau đó, một sheath dẫn đường được đưa vào buồng thất trái và van nhân tạo sẽ được đặt theo kiểu xuôi dòng. Cần lựa chọn vị trí chọc tại mỏm thất để đặt van nhân tạo dễ dàng và tránh bộ máy van hai lá. Hình ảnh siêu âm tim tại mỏm thất khi bác sĩ can thiệp chọc mỏm từ phía thành ngực giúp đảm bảo vị trí chọc mỏm tối ưu. Ghi hình siêu âm liên tục để theo dõi quá trình đẩy kim chọc mỏm, dây dẫn và sheath qua mỏm tim để đảm bảo dụng cụ đi đúng hướng và tránh mắc vào dây chằng của van hai lá hoặc chọc vào vách liên thất.
(4) Đánh giá hiệu quả can thiệp và biến chứng ngay sau thả
Hoạt động của van nhân tạo:
- Siêu âm tim cần đánh giá vị trí van nhân tạo, hình dạng khung van và vận động các lá van. Vị trí của van được đánh giá trên mặt cắt trục dài cạnh ức (siêu âm tim qua thành ngực) hoặc mặt cắt trục dài giữa thực quản. Hình dạng của khung van được đánh giá trên các mặt cắt trục dài, trục ngắn hoặc hình ảnh tái dựng
- Sử dụng siêu âm doppler màu để phát hiện hở cạnh van cũng như vị trí và mức độ hở cạnh van. Sử dụng siêu âm doppler xung và doppler liên tục trên mặt cắt 5 buồng từ mỏm (siêu âm tim qua thành ngưc) hoặc mặt cắt sâu qua dạ dày (siêu âm tim qua thực quản) để đo chênh áp qua van và diện tích lỗ van nhân tạo bằng phương trình liên tục cũng như lượng hóa mức độ hở cạnh van.
- Hở cạnh van mức độ nhiều thường do van đặt không đúng vị trí hoặc lựa chọn van có kích thước quá nhỏ hoặc bơm bóng chưa đủ. Trong trường hợp này có thể cần đặt lại van thứ hai hoặc bơm bóng lại hoặc bít hở cạnh van bằng dụng cụ. Hở cạnh van nhỏ thường do các dây dẫn hoặc bất tương xứng giữa hình dạng của van nhân tạo (tròn) với vòng van động mạch chủ của bệnh nhân (hình elip).
- Thủ thuật được coi là thành công khi: van nhân tạo nằm đúng vị trí, diện tích lỗ van > 1,2 cm2, chênh áp trung bình qua van < 20 mmHg, vận tốc đỉnh < 3 m/s và không có hở cạnh van mức độ vừa trở lên.
- Các biến chứng: tràn máu màng ngoài tim do thủng thành tim, nhồi máu cơ tim do tắc lỗ vào động mạch vành, hẹp hai lá do van nhân tạo chèn vào lá trước, tách thành động mạch chủ, van nhân tạo di lệch, rơi dụng cụ gây biến cố thuyên tắc,…
Sau can thiệp
Cần siêu âm tim kiểm tra 24h sau can thiệp và sau đó siêu âm tim định kỳ sau 1, 6 và 12 tháng. Siêu âm tim định kỳ cần đánh giá chức năng van nhân tạo, chức năng thất trái, tình trạng hở trong van và hở cạnh van.
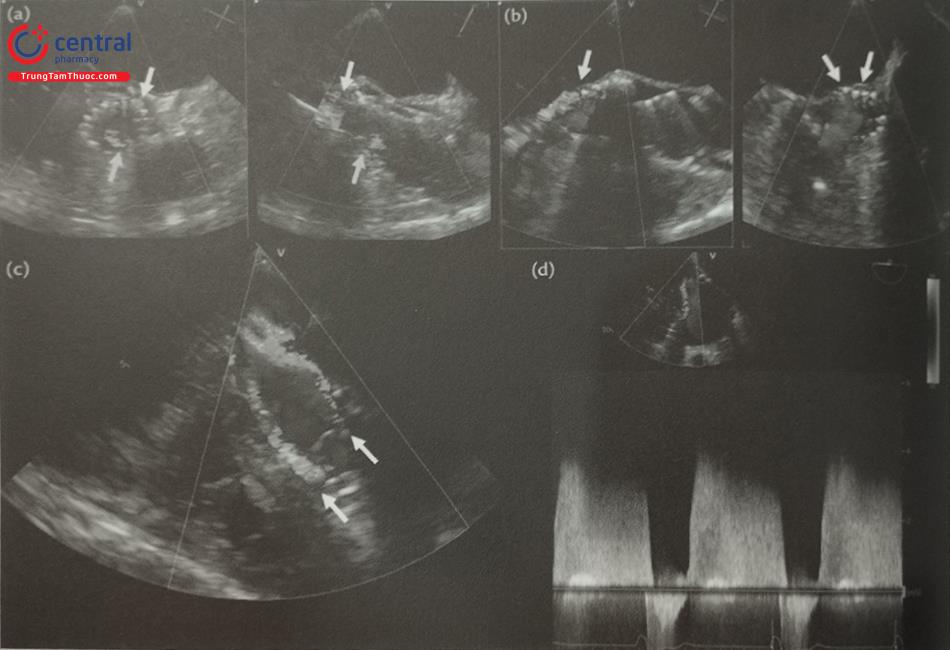
a- Cần phân biệt hở cạnh van (mũi tên trắng) và hở trong van (mũi trên xám) sau khi thả van nhân tạo. Nguyên nhân gây hở trong van thường gặp là do dây dẫn. b- Sử dụng mode ghi hình Xplane để đánh giá hở cạnh van đồng thời trên 2 mặt cắt trực giao trục dài và trục ngắn. c- Dòng hở cạnh van được quan sát rõ nhất trên mặt cắt qua dạ dày. d- Phổ doppler liên tục của dòng hở cạnh van.
Vai trò của siêu âm tim với đầu dò trong buồng tim (ICE) và lồng ghép hình ảnh siêu âm tim với chiếu huỳnh quang trong TAVI.
Tại một số trung tâm tim mạch, ICE được sử dụng thay thế siêu âm tim qua thực quản trong hướng dẫn can thiệp TAVI bởi nhiều ưu điểm như: không cần gây mê toàn thân, không che khuất hình ảnh trên màn tăng sáng, cung cấp hình ảnh siêu âm có độ phân giải cao và bác sĩ can thiệp có thể tự điều khiển catheter mang đầu dò siêu âm (cath- eter ICE). Trong quá trình can thiệp, ICE được sử dụng để:
(1) hướng dẫn đưa dây dẫn qua van động mạch chủ tự nhiên; (2) hướng dẫn định vị bóng nong van động mạch chủ đúng vị trí trước khi lên bóng và theo dõi trong quá trình lên bóng; (3) hướng dẫn đặt hệ thống mang van nhân tạo đúng vị trí; (4) theo dõi quá trình thả van nhân tạo và đánh giá chức năng van nhân tạo; (5) phát hiện biến chứng như tràn máu màng ngoài tim; và (6) đánh giá chức năng thất trái.
Ba mặt cắt cơ bản được sử dụng để hướng dẫn can thiệp TAVI bao gồm: mặt cắt trục dài qua gốc động mạch chủ, mặt cắt trục ngắn qua gốc động mạch chủ và mặt cắt trục dài qua thất trái. Để ghi hình mặt cắt trục dài qua gốc động mạch chủ, catheter ICE được đẩy tới chỗ nối của tĩnh mạch chủ trên và nhĩ phải, xoay ngược chiều kim đồng hồ và gập nhẹ ra trước. Từ vị trí này, đầu dò ICE ghi hình mặt cắt trục dài qua đường ra thất trái, van động mạch chủ, gốc động mạch chủ, chỗ nối xoang ống. Đây cũng là mặt cắt chủ đạo được sử dụng xuyên suốt quá trình làm can thiệp.
Mặt cắt trục ngắn qua gốc động mạch chủ được ghi hình sau khi thả van nhân tạo bằng cách nghiêng catheter ICE khoảng 90O về phía vòng van động mạch chủ khi đầu catheter nằm trong nhĩ phải. Mặt cắt này giúp đánh giá hở cạnh van nhân tạo khi phối hợp với doppler màu.
Mặt cắt trục dài qua thất trái được ghi hình bằng cách đẩy catheter ICE xuống thất phải và xoay catheter cùng chiều kim đồng hồ. Mặt cắt này vừa đánh giá vị trí của dây dẫn (wire) trước khi lên bóng, đánh giá chức năng thất trái và phát hiện tràn dịch màng ngoài tim.
Lồng ghép hình ảnh siêu âm tim qua thực quản 2D hoặc 3D lên màn tăng sáng là kỹ thuật hiện đại, đặc biệt hữu ích trong hướng dẫn TAVI ở bệnh nhân có van động mạch chủ ít vôi hóa. Hình ảnh siêu âm của các cấu trúc như vòng van động mạch chủ hoặc lỗ vào của các động mạch vành có thể được đặt chồng lên hình chiếu huỳnh quang giúp bác sĩ can thiệp dễ dàng thao tác lái dụng cụ đi đúng hướng và thả van ở vị trí phù hợp (Hình 97).
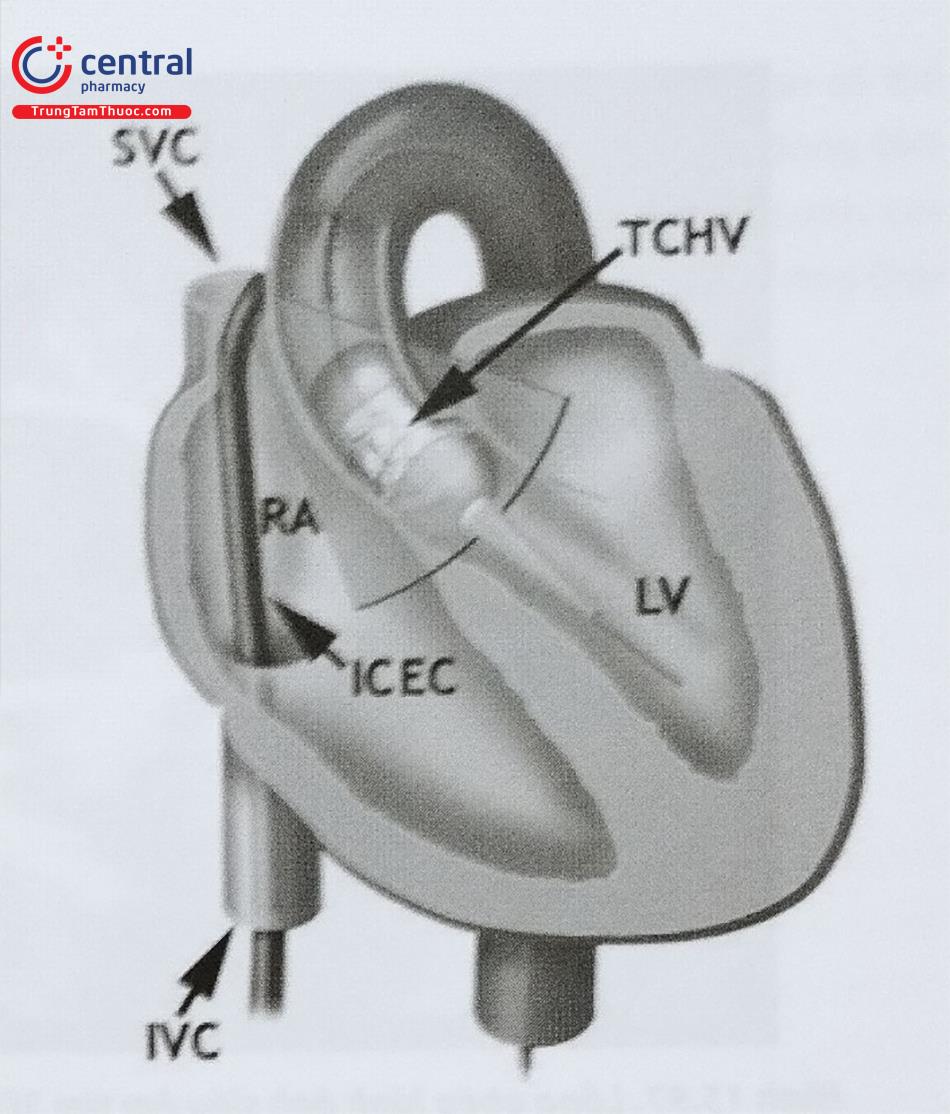
A- Đánh giá hẹp van động mạch chủ trước can thiệp; B- Đưa guidewire qua lỗ van động mạch chủ; C- Nong van động mạch chủ bằng bóng; D- Đánh giá tình trạng hở chủ sau nong van; E- Hệ thống mang van nhân tạo nở trên bóng được đưa vào động mạch chủ; vị trí van ở quá cao trước khi thả; F- Đánh giá hở cạnh van trên mặt cắt trục dài; G- Đánh giá hở cạnh van trên mặt cắt trục ngắn; H- Đánh giá chức năng thất trái và dịch màng ngoài tim trên mặt cắt qua thất trái. (Ao: động mạch chủ; LVOT: đường ra thất trái; PA: động mạch phổi; W: wire; RA; nhĩ phải; B: bóng nong; AV: van động mạch chủ; AR: hở chủ; BC: catheter mang bóng; PV: van nhân tạo; PVL: hở cạnh van; LV: thất trái; RV: thất phải; PML: điện cực tạo nhịp).

2.3.4 Can thiệp bít rò cạnh van nhân tạo bằng dụng cụ qua đường ống thông
Trước can thiệp
Để đánh giá chi tiết giải phẫu rò cạnh van nhân tạo chuẩn bị cho can thiệp, cần phối hợp nhiều phương tiện chẩn đoán hình ảnh:
- Siêu âm tim: là phương tiện chẩn đoán hình ảnh đầu tay được lựa chọn để chẩn đoán và lượng hóa mức độ hở cạnh van nhân tạo. Về các bước đánh giá chi tiết và các thông số lượng hóa mức độ rò cạnh van nhân tạo, bạn đọc có thể tham khảo thêm tại các khuyến cáo chi tiết của ASE và
- Chụp MSCT tim với cổng điện tâm đồ: là thăm dò hình ảnh tim mạch then chốt để đánh giá giải phẫu của lỗ rò cạnh van nhằm lên kế hoạch can thiệp bít lỗ rò bằng dụng cụ. MSCT cho phép đánh giá chính xác vị trí và kích thước của lỗ rò, hạn chế các biến chứng nguy hiểm như thuyên tắc do rơi dụng cụ hoặc kẹt van nhân tạo do dụng cụ chèn ép vào cánh
- In 3D: dựa trên hình ảnh siêu âm tim qua thực quản và MSCT, tạo ra mô hình 3D mô phỏng chính xác đặc điểm giải phẫu van nhân tạo của từng bệnh nhân cụ thể, vô cùng hữu ích để lên kế hoạch can thiệp, lựa chọn dụng cụ bít phù hợp và tiên lượng biến chứng.
Chuẩn bị can thiệp
Siêu âm tim qua thực quản ngay trước khi bắt đầu can thiệp rất cần thiết để xác nhận lại kết quả của các thăm dò hình ảnh tim mạch trước đó và loại trừ các chống chỉ định của can thiệp bao gồm: viêm nội tâm mạc đang hoạt động, van nhân tạo không ổn định (bong > 1/4 tới 1/3 chu vi vòng van, dấu hiệu van rung lắc mạnh “rocking valve”) và huyết khối buồng tim.
(1) Van hai lá
- Vị trí và số lượng rò cạnh van:
Do có độ phân giải hình ảnh cao, siêu âm tim 2D hoặc 3D qua thực quản có khả năng đánh giá giải phẫu chi tiết của lỗ rò cạnh van tốt hơn siêu âm tim qua thành ngực. Rò cạnh van có thể có 1 hoặc nhiều lỗ với nhiều hình dạng khác nhau. Do đó, cần xem xét hình ảnh rò cạnh van trên nhiều mặt phẳng siêu âm 2D khác nhau và trên hình ảnh 3D để đánh giá đầy đủ, chi tiết toàn bộ đường rò.
Mô hình mặt đồng hồ kinh điển trên hình ảnh siêu âm tim 3D trực diện của van hai lá nhân tạo nhìn từ mặt nhĩ thường được sử dụng để mô tả vị trí rò cạnh van (Hình 15.98). Trên hình ảnh này, van động mạch chủ nằm ở trước (thường ở hướng 11-12 giờ), vách lên nhĩ nằm ở hướng 9 giờ và tiểu nhĩ trái nằm ở hướng 3 giờ. Vị trí rò cạnh van được mô tả theo tương quan với các mốc giải phẫu trên. Rò cạnh van hai lá nhân tạo thường ở phía trước bên (hướng 10 – 11 giờ) hoặc phía sau giữa vòng van (hướng 5-6 giờ). Siêu âm tim 2D hoặc 3D qua thực quản có thể cho thấy rõ diện bong van (dehisced area) là một vùng trống âm nằm sát đường khâu vòng van. Siêu âm doppler màu có vai trò xác nhận tình trạng bong van thực sự (có dòng hở) mà không phải artifact khuyết hình (dropout) trên hình ảnh 2D hoặc 3D.
Trong những trường hợp khó, dòng hở cạnh van có thể không xuất hiện trong thì tâm thu mà chỉ có dòng tâm trương đi qua lỗ rò bởi trong thì tâm thu mô quanh van có thể che lấp lỗ rò cạnh van (Hình 15.99) nên không thấy dòng hở phụt ngược từ thất trái lên nhĩ trái.
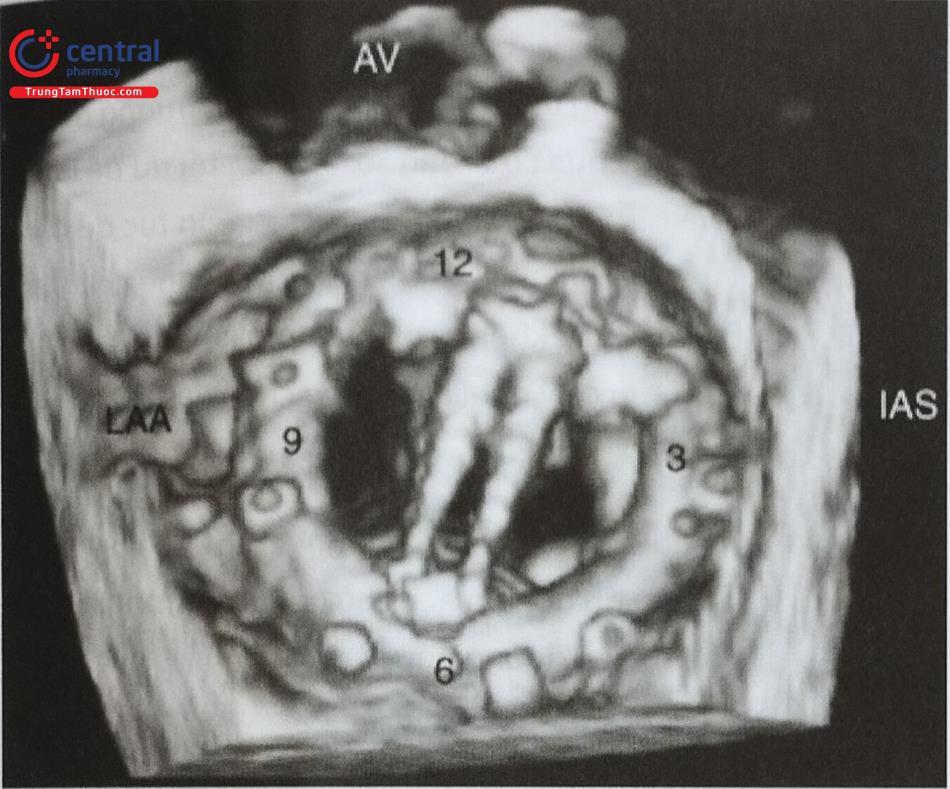

a- Dòng tâm trương (mũi tên) đi qua lỗ rò cạnh van hai lá nhân tạo trên siêu âm tim 2D qua thực quản với doppler màu. b- Trong thì tâm thu, không thấy dòng hở cạnh van phụt ngược từ thất trái về nhĩ trái do mô van đã che lấp lỗ rò. c- Hình ảnh siêu âm tim qua thực quản 3D nhìn trực diện van nhân tạo trong thì tâm trương thấy lỗ rò lớn ở vị trí 2h (mũi tên). d- Trong thì tâm thu, lỗ rò bị mô van bịt kín trên hình ảnh siêu âm tim qua thực quản 3D.
- Hình dạng, kích thước rò và mức độ hở cạnh van:
Cùng với vị trí rò cạnh van, đánh giá chính xác kích thước rò và mức độ hở cạnh van có ý nghĩa quan trọng trong can thiệp không chỉ giúp lựa chọn cách tiếp cận tổn thương (xuôi dòng, ngược dòng hay từ mỏm tim) mà còn liên quan đến lựa chọn loại dụng cụ, kích thước, số lượng dụng cụ can thiệp.
Để lựa chọn dụng cụ bít, cần đánh giá đường kính và độ dài thương tổn rò cạnh van. Ví dụ, dụng cụ bít thông liên nhĩ Amplatzer – ASO (Amplatzer septal occluder) có độ dài eo ngắn nên được sử dụng để bít các đường rò ngắn. Ngược lại dụng cụ bít thông liên thất phần cơ Amplatzer (Amplatzer muscular VSD occluder) hoặc dụng cụ bít ống động mạch Amplatzer (Amplatzer duct occluder) được sử dụng để bít các đường rò dài do những dụng cụ này có phần eo dài hơn. Đường kính tối đa của dụng cụ bít được lựa chọn dựa trên khoảng cách từ lỗ rò đến thanh giằng liền kề của van nhân tạo hoặc lá van nhân tạo để tránh tình trạng dụng cụ chèn vào cánh van gây rối loạn chức năng van. Các thương tổn rò cạnh van hai lá nhân tạo thường có hình liềm hoặc ống dài, ngoằn ngoèo nên rất khó can thiệp bằng các dụng cụ kích thước lớn bởi nguy cơ dụng cụ chèn vào đĩa van hoặc cánh van nhân tạo. Ngược lại, trong trường hợp này nên sử dụng nhiều dụng cụ nhỏ để bít rò cạnh van.
Đánh giá mức độ hở cạnh van phức tạp hơn so với van tự nhiên. Vùng gần của dòng hở thường bị bóng cản của van nhân tạo che khuất nên khó đo đạc các thông số. Diện tích lỗ hở hiệu dụng đo bằng phương pháp PISA chưa được chấp thuận để đánh giá hở cạnh van nhân tạo. Tuy nhiên nếu thấy vùng hội tụ dòng hở lớn, cần nghi ngờ hở cạnh van mức độ nhiều. Do đa số dòng hở cạnh van nhân tạo là dòng hở lệch tâm, mức độ hở thường bị ước tính thấp hơn thực tế do hiệu ứng Coanda. Có thể sử dụng các thông số khác như Vena contracta, diện tích dòng hở, đậm độ phổ doppler của dòng hở. Ngoài ra, cần nghĩ tới hở cạnh van hai lá nhiều nếu có dấu hiệu đảo ngược dòng chảy tĩnh mạch phổi trong thì tâm thu. Có thể đo trực tiếp diện tích vùng bong van trên hình ảnh siêu âm 3D hoặc đo trực tiếp diện tích lỗ hở hiệu dụng (EROA) trên siêu âm 3D phối hợp với doppler màu. EROA đo trực tiếp trên siêu âm 3D màu có tương quan với mức độ hở cạnh van chặt chẽ hơn EROA giải phẫu. EROA > 0,65 trên siêu âm 3D màu tương ứng với hở cạnh van độ III hoặc IV.
Hội Siêu âm tim Hoa Kỳ (ASE) khuyến cáo ước tính mức độ hở cạnh van hai lá nhân tạo dựa trên tỷ lệ giữa diện tích dòng hở so với chu vi vòng van. Hở cạnh van nhẹ nếu diện tích hở cạnh van < 10% chu vi vòng van, ngược lại nếu tỷ lệ này > 20% tương ứng với hở nhiều. Trong trường hợp có nhiều dòng hở chưa có thông số siêu âm tối ưu để lượng hóa mức độ hở. Có thể sử dụng doppler liên tục để đánh giá chênh áp qua van hai lá nhân tạo. Nếu tăng chênh áp qua van đáng kể mà không có tình trạng kẹt van, cần nghi ngờ hở cạnh van có ý nghĩa gây tăng chênh áp.
(2) Van động mạch chủ
- Phát hiện mảng xơ vữa động mạch chủ có ý nghĩa hoặc tách thành động mạch chủ (rất quan trọng nếu bít rò cạnh van theo đường ngược dòng).
- Vị trí, số lượng rò cạnh van:
Xác định vị trí rò cạnh van động mạch chủ nhân tạo là một thách thức do bóng cản của van nhân tạo, đặc biệt trên các mặt cắt siêu âm tim qua thành ngực và mặt cắt trục dài trên siêu âm tim qua thực quản. Do đó cần đánh giá kỹ van động mạch chủ nhân tạo bằng siêu âm doppler màu trên mặt cắt từ mỏm tim trên siêu âm tim qua thành ngực và mặt cắt qua dạ dày trên siêu âm tim qua thực quản để tránh bóng cản từ van nhân tạo. Việc định vị chính xác chỗ rò cạnh van quyết định thành công của thủ thuật bởi đó chính là vị trí đích cần can thiệp. Tương tự như rò cạnh van hai lá nhân tạo, mô hình mặt đồng hồ được sử dụng để mô tả vị trí rò cạnh van động mạch chủ nhân tạo. Vị trí 5 giờ nằm giữa xoang Valsalva vành phải và vành trái, vị trí 8 giờ nằm giữa xoang Valsalva vành phải và xoang không vành còn vị trí 11 giờ nằm giữa xoang không vành và xoang vành trái. Rò cạnh van động mạch chủ nhân tạo thường nằm giữa 7 giờ tới 11 giờ (gần xoang Valsalva không vành) (Hình 100).
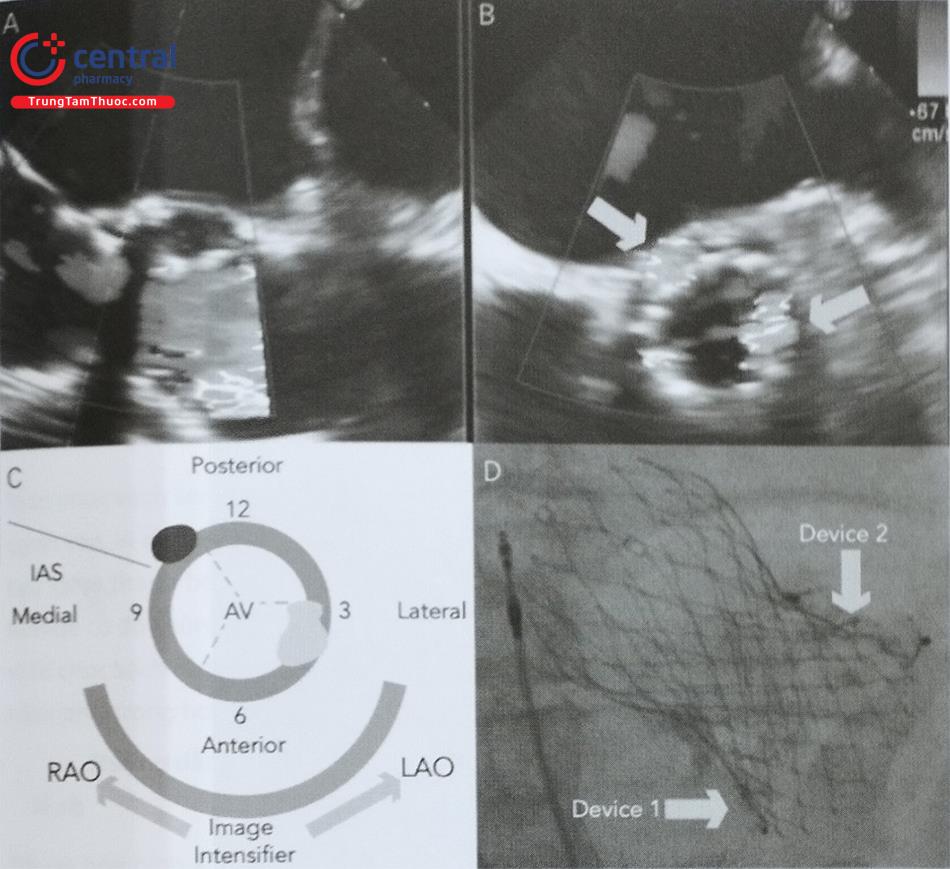
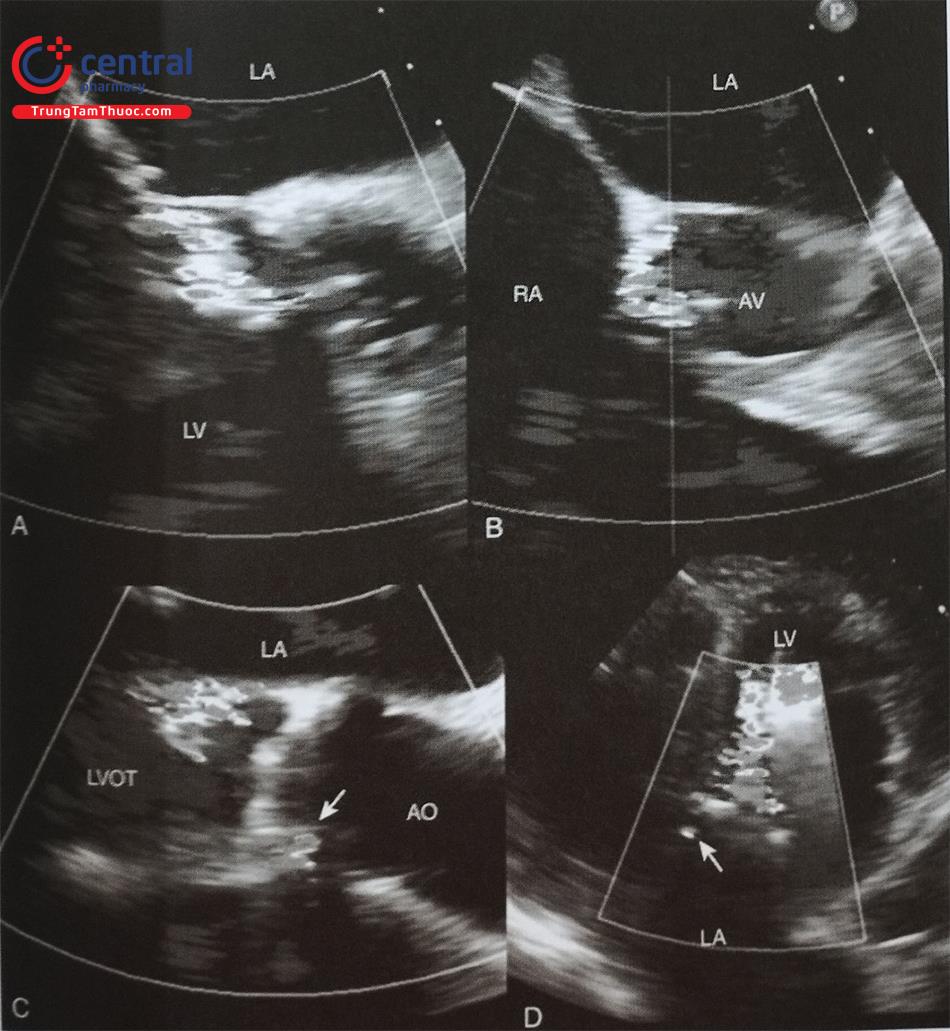
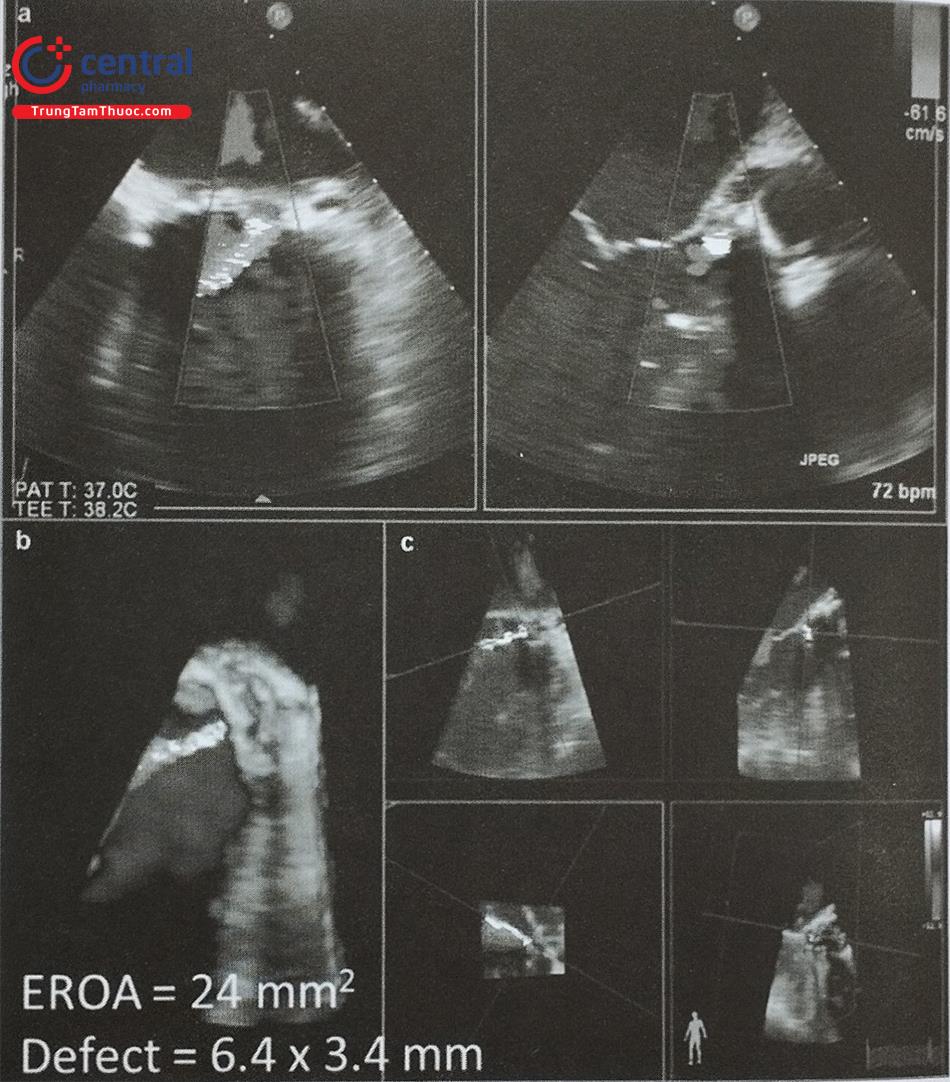
- Hình dạng, kích thước rò và mức độ hở cạnh van (Hình 15.101, 15.102): Tương tự như hở cạnh van hai lá nhân tạo, cần đánh giá chính xác kích thước và hình dạng của tổn thương rò cạnh van động mạch chủ nhân tạo trên siêu âm tim 2D hoặc 3D để lựa chọn dụng cụ bít phù hợp đặc biệt là khoảng cách và tương quan của lỗ rò với vòng van nhân tạo. Rò cạnh van động mạch chủ nhân tạo thường nhỏ hơn rò cạnh van hai lá nhân tạo và ít khi cần thả nhiều dụng cụ bít.
Mặt cắt trục ngắn cắt qua vùng dưới van có thể ước tính mức độ hở cao hơn thực tế trong trường hợp dòng hở lệch tâm. Cần đánh giá mức độ hở bằng các mặt cắt sâu trong dạ dày trên siêu âm tim qua thực quản, dựa trên độ dài và diện tích dòng hở. Bạn đọc có thể tham khảo thêm tại khuyến cáo chi tiết của ASE năm 2019.
Trong can thiệp
(1) Bít rò cạnh van hai lá nhân tạo
Can thiệp bít rò cạnh van hai lá nhân tạo có thể tiếp cận theo kiểu xuôi dòng (antegrade) bằng cách chọc vách liên nhĩ, ngược dòng (retrograde) hoặc tiếp cận trực tiếp theo đường mỏm tim. Lựa chọn cách tiếp cận phụ thuộc vào vị trí, số lượng và đặc điểm giải phẫu của tổn thương rò cạnh van. Sau đây, chúng tôi trình bày vai trò của siêu âm tim trong hướng dẫn can thiệp bít rò cạnh van hai lá nhân tạo theo đường xuôi dòng.
- Chọc vách liên nhĩ
Chọc vách liên nhĩ là cách tiếp cận thường sử dụng nhất trong can thiệp bít rò cạnh van hai lá nhân tạo. Mặt cắt trục ngắn qua động mạch chủ và mặt cắt qua hai tĩnh mạch chủ từ giữa thực quản là hai mặt cắt quan trọng nhất để hướng dẫn chọc vách liên nhĩ. Siêu âm tim 3D qua thực quản thời gian thực với mode X-plane cho phép trình diễn đồng thời 2 mặt cắt trên giúp bác sĩ can thiệp dễ dàng chọc vách liên nhĩ đúng vị trí bởi có thể đồng thời lựa chọn vị trí chọc vách theo cả 2 chiều trước sau (mặt cắt trục ngắn) và trên-dưới (mặt cắt qua 2 tĩnh mạch chủ). Có thể dùng mode Live 3D để ghi hình ảnh 3D vách liên nhĩ thời gian thực để hướng dẫn chọc vách liên nhĩ. Như đã phân tích trong phần trước, cần thấy được hình ảnh vách liên nhĩ bị ấn thành hình túp lều để bảo đảm kim chọc vách ở đúng vị trí.
Vị trí chọc vách liên nhĩ tối ưu phụ thuộc vào vị trí của lỗ rò cạnh van. Ví dụ nếu lỗ rò nằm ở phía ngoài của van nhân tạo (phía thành bên thất trái), nên chọc vách lên nhĩ cao hơn để có đủ không gian lái catheter đi qua lỗ rò. Ngược lại vị trí chọc vách liên nhĩ thấp phù hợp với can thiệp bít lỗ rò nằm phía trong hoặc ở phía trước van nhân tạo.
- Hướng dẫn định vị catheter và đưa catheter qua lỗ rò
Tối ưu hóa hình ảnh siêu âm 2D qua thực quản cơ sở để dựng hình ảnh 3D trực diện của van hai lá nhìn từ mặt nhĩ (góc nhìn của phẫu thuật viên) để xác định vị trí giải phẫu của lỗ rò cạnh van. Có thể tăng tốc độ khung hình 3D (volume rate) bằng cách dựng hình ảnh 3D nhiều nhát bóp (multi-beat) và điều chỉnh độ sâu, độ rộng của sector cũng như vị trí hội tụ cho phù hợp. Loại bỏ ảnh giả nối hình (stitched artifact) bằng chức năng giữ nhịp thở trên máy thở (bệnh nhân được gây mê toàn thân, đặt nội khí quản). Cần phối hợp với doppler màu để quan sát và xác định vị trí rò, tránh nhầm lẫn với ảnh giả khuyết hình (drop-out) trên hình ảnh 3D.
Cách tốt nhất để quan sát và theo dõi vị trí, đường đi của catheter trong buồng tim là sử dụng hình ảnh siêu âm tim 3D thời gian thực từ lúc catheter đi qua vách liên nhĩ. Hình ảnh 3D thời gian thực cho phép quan sát toàn bộ hệ thống delivery bao gồm toàn bộ chiều dài catheter và tương quan của catheter với các mốc giải phẫu. Nhờ vậy, bác sĩ siêu âm có thể phối hợp nhịp nhàng hơn với bác sĩ can thiệp trong quá trình đưa catheter và dây dẫn tới vị trí của lỗ rò.
Sau đó, cần sử dụng mode 3D Zoom để dựng hình ảnh 3D khu trú vào van hai lá nhân tạo và (các) tổn thương rò cạnh van (Hình 15.103). Cần lưu ý bản thân catheter cũng gây ra bóng cản và khuyết hình phía sau. Trong trường hợp này, cần chỉnh lại góc nghiêng của hình ảnh 3D để quan sát được toàn bộ van nhân tạo khi dây dẫn đi qua lỗ rò. Nếu lỗ rò lớn hoặc dự kiến cần thả nhiều dụng cụ bít, nên đưa sẵn 2 dây dẫn qua tổn thương trước khi thả dụng cụ. Điều này giúp cho việc thả thêm dụng cụ thứ hai thuận lợi hơn do hình dạng của lỗ rò cạnh van có thể bị thay đổi sau khi thải dụng cụ đầu tiên. Nếu có nhiều lỗ rò, hình ảnh siêu âm tim 3D thời gian thực đảm bảo dụng cụ đang được đưa qua đúng tổn thương đích cần can thiệp.
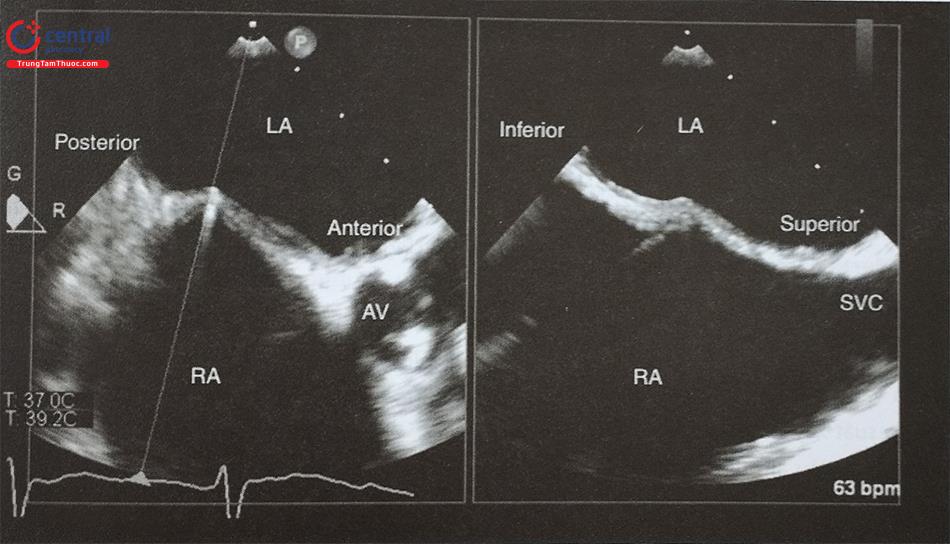
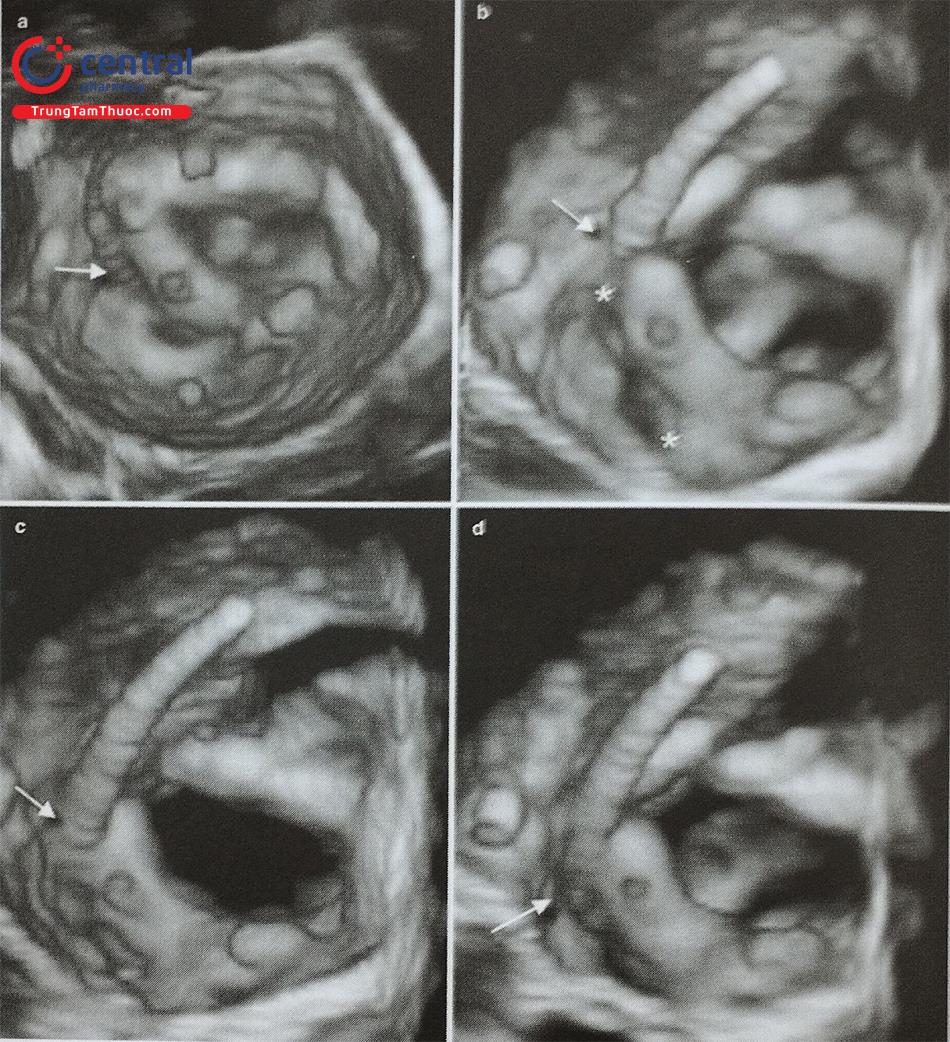
Thả dụng cụ
Hình ảnh 2D X-plane (hay Biplane) với 2 mặt cắt trực giao rất hữu ích để định vị dụng cụ bít. Mặt cắt qua 2 mép van (45-65O giữa thực quản) giúp đánh giá vị trí dụng cụ bít theo hướng trong – ngoài (vách – bên) còn mặt cắt trục dài (120-140O giữa thực quản) giúp định vị dụng cụ bít theo hướng trước – sau. Ngoài ra, mặt cắt trục dài còn giúp phát hiện tắc nghẽn đường ra thất trái nếu dụng cụ được thả ra phía trước quá nhiều. Ngoài mode X-plane, tái dựng hình ảnh 3D trực diện của van hai lá nhìn từ mặt nhĩ bằng mode Live 3D giúp hướng dẫn định vị dụng cụ bít tối ưu nhất.
Dụng cụ bít chèn vào cánh van nhân tạo là biến chứng nguy hiểm với tần suất xảy ra khoảng 4% nhưng có thể phát hiện nhanh bằng siêu âm tim qua thực quản trong can thiệp. Biến chứng này dễ xuất hiện hơn khi bít rò cạnh van hai lá cơ học hoặc van nhân tạo không gọng hoặc khi dùng dụng cụ bít kích thước lớn. Siêu âm tim qua thực quản có vai trò xác định lại chức năng van và vận động của các cánh van trước khi thả dụng cụ. Tương tác giữa đĩa phía thất của dụng cụ bít với cánh van nhân tạo được đánh giá dưới màn tăng sáng và hình ảnh siêu âm tim qua thực quản. Dụng cụ bít chèn ép vào cánh van hoặc đĩa van trong thì tâm trương có thể gây kẹt van và tăng chênh áp qua van. Ngược lại, dụng cụ bít chèn ép vào cánh van hoặc đĩa van trong thì tâm thu có thể gây hở van cấp. Đặt dụng cụ bít dưới hướng dẫn của siêu âm tim qua thực quản 3D thời gian thực giúp hạn chế biến chứng do dụng cụ bít chèn vào cánh van nhân tạo. Trong trường hợp hoạt động của van nhân tạo bị cản trở do dụng cụ bít rò cạnh van, cần chỉnh lại vị trí dụng cụ hoặc chuyển sang dụng cụ có kích thước nhỏ hơn.
Bác sĩ can thiệp thường sử dụng nghiệm pháp giật (tug test) để kiểm tra độ ổn định và chắc chắn của dụng cụ, tránh biến cố thuyên tắc do rơi dụng cụ. Nghiệm pháp này được thực hiện bằng cách dùng catheter đẩy vào dụng cụ bít trong khi hệ thống delivery được kéo về và quan sát đánh giá độ ổn định của dụng cụ trên siêu âm tim qua thực quản và màn tăng sáng. Nếu dụng cụ bít chưa chắc chắn, cần điều chỉnh lại vị trí của dụng cụ hoặc thay thế bằng dụng cụ khác phù hợp hơn, tránh biến cố rơi dụng cụ. Siêu âm tim 2D và 3D qua thực quản giúp đánh giá kỹ hơn độ ổn định của dụng cụ và tương tác giữa dụng cụ với van nhân tạo. Lưu ý: dụng cụ bít có thể chèn ép vào cánh van nhân tạo sau khi được thả khỏi hệ thống delivery. Trong trường hợp này, không thể thu lại dụng cụ nữa.
Trước khi thả dụng cụ, cần đo lại chênh áp qua van hai lá và so sánh với trước can thiệp (Hình 15.105). Sau khi đặt dụng cụ, chênh áp qua van hai lá nhân tạo cần giảm hơn hoặc tương đương với chênh áp trước can thiệp do dòng chảy qua van hai lá nhân tạo giảm đi sau khi bít rò cạnh van. Nếu chênh áp qua van tăng phải nghi ngờ kẹt van. Một vấn đề quan trọng là ghi và đánh giá lại hình ảnh dụng cụ bít, chức năng van hai lá nhân tạo cũng như mức độ hở van bởi dụng cụ có thể bị di lệch khỏi vị trí ban đầu sau khi thả. Quá trình hướng dẫn lái catheter tới khi thả dụng cụ được minh họa trong hình 106.

- Đánh giá mức độ hở cạnh van tồn lưu
Đánh giá chính xác mức độ hở cạnh van tồn lưu sau khi thả dụng cụ là một thách thức do bóng cản từ van nhân tạo và dụng cụ bít rò cạnh van. Siêu âm tim qua thực quản 3D thời gian thực phối hợp với doppler màu là thăm dò hình ảnh hữu ích. Nếu hở cạnh van tồn lưu có ý nghĩa, cần đặt lại vị trí của dụng cụ rồi đánh giá lại. Nếu mức độ hở tồn lưu vẫn không cải thiện, cần thả thêm dụng cụ hoặc xem xét đổi sang dụng cụ khác có kích thước lớn hơn.
Phải phân biệt dòng hở cạnh van tồn lưu với dòng rửa van nhân tạo và những dòng hở nhỏ cạnh dụng cụ bít (closing volume jets). Dòng rửa van nhân tạo là dòng hở bình thường nằm trong vòng van, quanh các điểm khớp của vòng van và hướng vào trong, khác với dòng hở cạnh van nằm ngoài vòng van và hướng ra phía ngoài. Dòng rửa van có tác dụng hạn chế huyết khối gây kẹt van và không được coi là bệnh lý. Dòng hở nhỏ cạnh dụng cụ bít là những dòng hở rất nhẹ nằm ở rìa của dụng cụ, xuất hiện do chuyển động của dụng cụ khi tim co bóp.
- Đánh giá huyết động sau khi thả dụng cụ
Sau khi thả dụng cụ, cần đo lại chênh áp qua van để đảm bảo không có tình trạng kẹt van. Các thông số sau đây giúp xác định hở cạnh van đã được cải thiện:
- Tăng thể tích nhát bóp qua đường ra thất trái (đo trên mặt cắt qua dạ dày trên siêu âm tim qua thực quản).
- Xuất hiện sóng S trên phổ doppler xung dòng chảy của tĩnh mạch phổi.
- Xuất hiện âm cuộn tự nhiên trong nhĩ trái.
- Giảm nhẹ phân suất tống máu thất trái do thể tích hở cạnh van nhân tạo giảm dẫn tới giảm tiền gánh thất trái, thể tích cuối tâm trương thất trái giảm nhẹ trong khi thể tích cuối tâm thu thất trái không đổi.
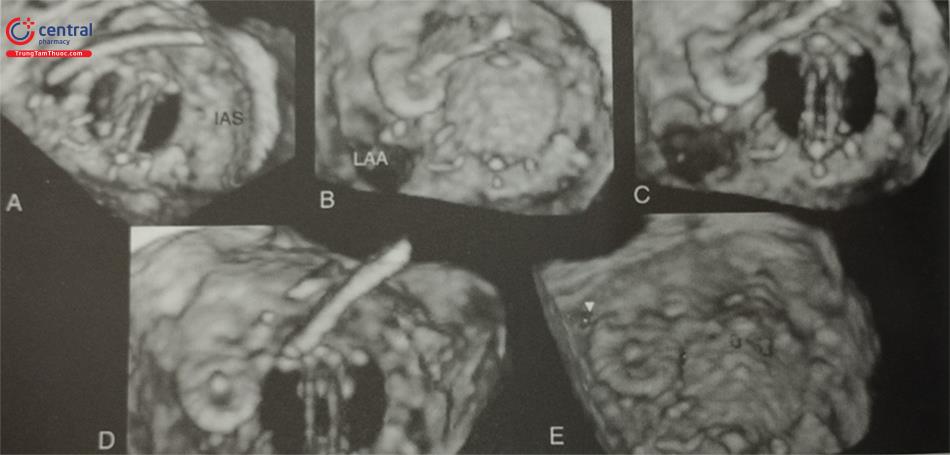
(2) Bít rò cạnh van động mạch chủ nhân tạo
Can thiệp bít rò cạnh van động mạch chủ nhân tạo bằng dụng cụ thường tiếp cận theo kiểu ngược dòng (retrograde) theo đường động mạch chủ. Do đó, trước can thiệp cần đánh giá và phát hiện mảng xơ vữa động mạch chủ có ý nghĩa hoặc tách thành động mạch chủ.
- Hướng dẫn định vị và lái catheter qua lỗ rò
Để quan sát hình ảnh của catheter và dây dẫn tại động mạch chủ lên, cần ghi hình mặt cắt trục dài (120O) giữa thực quản. Siêu âm tim 3D quan thực quản với mode X-plane (hoặc multiplane) trình diễn đồng thời 2 mặt cắt trực giao rất hữu dụng để hướng dẫn theo dõi liên tục vị trí của catheter và dây dẫn trong quá tình tiếp cận lỗ rò cạnh van. Đôi khi, cần chỉnh góc nghiêng của mặt cắt do bóng cản hoặc hiện tượng khuyết hình (dropout) do bản thân catheter gây ra. Tương tự như bít rò cạnh van hai lá nhân tạo, nếu tiên lượng cần sử dụng nhiều hơn 2 dụng cụ bít, cần đưa 2 dây dẫn qua lỗ rò. Can thiệp bít rò cạnh van động mạch chủ nhân tạo có thể khó hơn do khung kim loại của van dài và đường đi ngoằn ngoèo của tổn thương.
- Thả dụng cụ
Nếu sử dụng dụng cụ Amplatzer, đĩa xa của dụng cụ được mở trước ở trong đường ra thất trái, sau đó dụng cụ được kéo về phía lỗ rò. Để quan sát rõ dụng cụ, nên dùng mặt cắt trục dài (120O) hoặc dựng hình ảnh 3D thời gian thực của đường ra thất trái nhìn từ mặt thất. Phần đĩa gần của dụng cụ bít sẽ được mở ở ngay trên miệng lỗ rò.
Ngay sau khi dụng cụ được mở, cần đảm bảo dụng cụ không chèn ép vào van hai lá. Do đó, phải đánh giá kỹ tình trạng hẹp và hở hai lá trước khi thả dụng cụ. Ngoài ra, cần đảm bảo dụng cụ không chèn ép cánh van hoặc đĩa van động mạch chủ và van hai lá nhân tạo (nếu có) gây kẹt van hoặc hở van cấp. Mặt cắt qua dạ dày cho phép đo chênh áp qua đường ra thất trái và van động mạch chủ nhân tạo. Trước khi thả dụng cụ, bác sĩ can thiệp làm nghiệm pháp giật (tug test) để kiểm tra độ ổn định của dụng cụ. Quá trình lái catheter và thả dụng cụ bít hở cạnh van động mạch chủ nhân tạo được minh họa trong hình 107.
- Đánh giá hở cạnh van tồn lưu
Các mặt cắt trục dài và trục ngắn qua van động mạch chủ rất có ích để đánh giá dòng hở tồn lưu sau khi đặt dụng cụ. Quy trình đánh giá hở tồn lưu sau can thiệp tương tự như đánh giá hở cạnh van trước can thiệp.
- Đánh giá huyết động sau khi thả dụng cụ
Đánh giá lại chênh áp qua van động mạch chủ trên mặt cắt sâu qua dạ dày để đảm bảo không có tình trạng kẹt van.
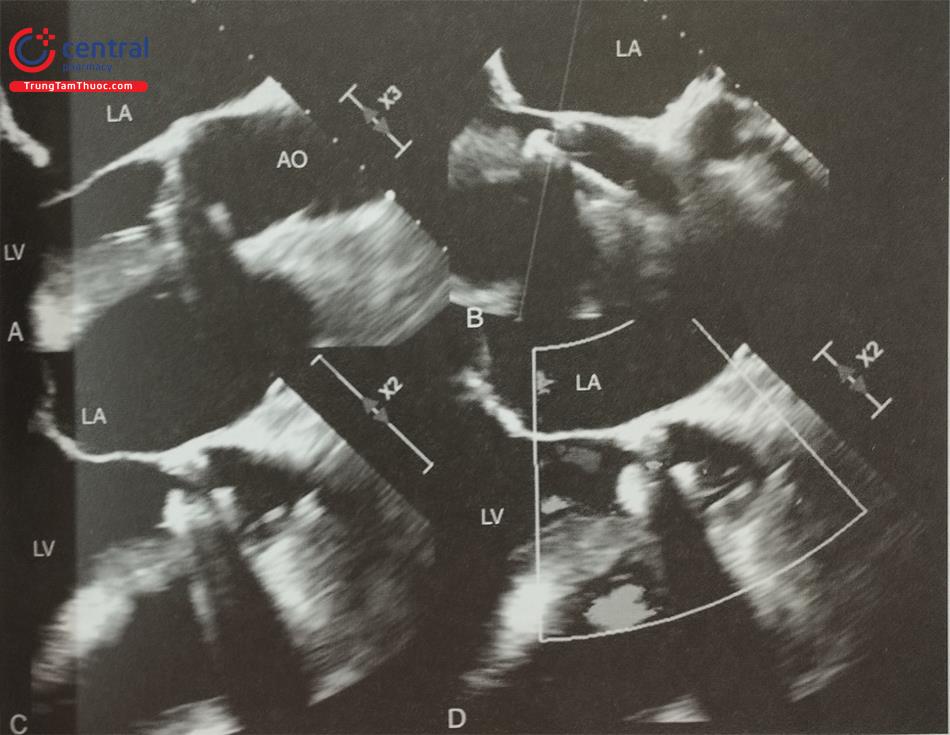
A- Catheter được đẩy qua lỗ rò theo hướng tiếp cận ngược dòng từ động mạch chủ. B- Đĩa xa nằm trong đường ra thất trái của dụng cụ bít được mở trước. C- Đĩa gần nằm trong động mạch chủ của dụng cụ bít được mở. D- Đánh giá hở cạnh van tồn lưu bằng hình ảnh doppler màu.
- Phát hiện biến chứng trong và sau can thiệp
Siêu âm tim qua thực quản 2D hoặc 3D có vai trò trung tâm trong phát hiện biến chứng ngay sau thả dụng cụ bít rò cạnh van nhân tạo, đặc biệt là các biến chứng nặng đe dọa đến tính mạng. Rơi dụng cụ gây biến cố thuyên tắc xảy ra < 1% có thể do lựa chọn kích thước dụng cụ nhỏ hơn mức cần thiết hoặc đặt dụng cụ ở vị trí chưa phù hợp. Tràn máu màng ngoài tim gây ép tim cấp có thể xảy ra do đầu dây dẫn làm thủng hoặc rách các cấu trúc tim, nhất là thành tâm nhĩ. Do đó, cần theo dõi liên tục hình ảnh màng ngoài tim trong suốt quá trình làm can thiệp.
Ngoài ra, siêu âm tim qua thực quản giúp phát hiện các biến chứng hiếm gặp như tổn thương động mạch vành trái, tổn thương xoang vành, vỡ vòng van hai lá, shunt tồn lưu qua vách liên nhĩ sau can thiệp bít rò cạnh van hai lá nhân tạo hoặc tách thành động mạch chủ, tắc lỗ vào động mạch vành trong can thiệp bít rò cạnh van động mạch chủ nhân tạo.
- Can thiệp đặt van trong van
Phẫu thuật thay van tim nhân tạo là biện pháp điều trị thông dụng dành cho các bệnh nhân bị bệnh lý van tim nặng với hình thái van tự nhiên không phù hợp để sửa van. Van nhân tạo được chia làm 2 loại: Van cơ học và van sinh học. Ưu điểm của van cơ học là có độ bền cao nhưng đòi hỏi phải dùng thuốc chống đông kháng vitamin K suốt đời và chỉnh liều nghiêm ngặt. Ngược lại, van sinh học có thể không cần dùng thuốc chống đông cả đời nhưng hạn chế không tránh khỏi của loại van nhân tạo này là thoái hóa van theo thời gian gây hẹp, hở van hoặc cả hai. Vì vậy, van sinh học thường được lựa chọn cho bệnh nhân cao tuổi (thường có bệnh động mạch vành hoặc các bệnh đồng mắc khác). Tuy nhiên, nhờ tiến bộ trong chăm sóc y khoa, tuổi thọ của các bệnh nhân tim mạch ngày càng kéo dài dẫn tới nhiều bệnh nhân phải phẫu thuật lại để thay van sinh học bị thoái hóa. Phẫu thuật van tim lại có nguy cơ tử vong cao với thời gian nằm viện dài và hạn chế khả năng hồi phục hoàn toàn.
Trong hơn một thập niên vừa qua, can thiệp qua đường ống thông để đặt van nhân tạo mới trong van nhân tạo sinh học cũ đã bị thoái hóa là kỹ thuật được phát triển để thay thế phẫu thuật kinh điển. Can thiệp này được gọi là can thiệp đặt “van trong van” để phân biệt với can thiệp đặt van nhân tạo trong van tự nhiên qua đường ống thông như TAVI hoặc can thiệp thay van động mạch phổi, thay van hai lá hoặc van ba lá qua da. Can thiệp đặt van trong van đã được chấp thuận trong thực hành y khoa. Năm 2017, FDA Hoa Kỳ đồng ý mở rộng chỉ định thay van Edward Sapiens 3 qua đường ống thông để can thiệp đặt van trong van ở vị trí van động mạch chủ hoặc van hai lá đối với bệnh nhân có nguy cơ phẫu thuật cao. Trong can thiệp van trong van đối với van động mạch chủ sinh học thoái hóa, có thể sử dụng van tự nở hoặc van nở trên bóng.
Trước can thiệp
Trước can thiệp đặt van trong van cần phối hợp nhiều phương tiện chẩn đoán hình ảnh tim mạch (multimodality) bao gồm siêu âm tim 2D hoặc 3D qua thực quản, chụp cắt lớp vi tính tim để đo đạc chính xác đường kính trong (inner dimension), chu vi và hình dạng của vòng van nhân tạo sinh học bị thoái hóa. Tốt nhất nên đo các thông số trước can thiệp trên hình ảnh 3D siêu âm tim hoặc MSCT. Siêu âm doppler có vai trò thiết yếu trong đánh giá mức độ hẹp và/hoặc hở van cũng ảnh hưởng huyết động do van thoái hóa. Cần lưu ý định vị chính xác dòng hở van nhân tạo. Cần phân biệt hở trong van nhân tạo do thoái hóa với hở cạnh van do bong van hay rò cạnh van. Trong trường hợp chỉ có rò cạnh van, có thể xem xét can thiệp bít rò bằng dụng cụ qua đường ống thông (phần 3.3.4) mà không cần đặt van trong van.
Trong can thiệp
Siêu âm tim qua thực quản (tốt nhất là siêu âm tim qua thực quản 3D thời gian thực) phối hợp với chiếu huỳnh quang thường được sử dụng để hướng dẫn can thiệp đặt van trong van. Hiện nay, kỹ thuật lồng ghép hình ảnh CT hoặc siêu âm 2D/3D với chiếu huỳnh quang như hệ thống EchoNav hoặc Cardiac Navigator của Philips với khả năng đặt chồng hình ảnh siêu âm hoặc CT lên màn tăng sáng giúp bác sĩ can thiệp dễ dàng điều khiển, lái catheter, dây dẫn và dụng cụ can thiệp tiếp cận đúng tổn thương đích.
Trong can thiệp các van tim phải như thay van ba lá hoặc đặt vòng van ba lá, thay van động mạch phổi bằng van Melody, catheter và dụng cụ được đưa vào tim phải theo đường tĩnh mạch trung tâm. Trong can thiệp các van tim trái, van động mạch chủ sinh học bị thoái hóa được tiếp cận ngược dòng theo đường động mạch chủ tương tự như TAVI. Can thiệp đặt van trong van ở vị trí van hai lá có thể tiếp cận theo kiểu xuôi dòng qua tĩnh mạch trung tâm rồi chọc vách liên nhĩ hoặc tiếp cận theo kiểu ngược dòng qua đường chọc mỏm thất trái. Nếu van sinh học thoái hóa bị hẹp có thể cần nong bóng trước khi đặt van mới trong van cũ. Vai trò của siêu âm tim trong hướng dẫn chọc vách liên nhĩ và nong van bằng bóng đã được trình bày trong các phần trước.
Van nở trên bóng: Dưới hướng dẫn của siêu âm tim qua thực quản 3D và màn huỳnh quang, dây dẫn được luồn qua van sinh học bị thoái hóa. Sau đó, catheter mang theo van sinh học mới (ở trạng thái chưa mở) được đẩy trên dây dẫn và đặt vào vị trí van sinh học thoái hóa tại lỗ van. Tiếp theo, bóng được bơm lên dần để mở van sinh học mới tại vị trí đích. Cần lưu ý, van sinh học nở trên bóng sau khi đã mở không thể thu lại hoặc đặt lại được. Do đó cần đặt van đúng vị trí trước khi lên bóng. Hiện nay, van nở trên bóng là lựa chọn duy nhất để can thiệp đặt van trong van tại vị trí van ba lá hoặc van hai lá.
Van tự nở: Trong can thiệp đặt van trong van ở vị trí van động mạch chủ, có thể lựa chọn van nở trên bóng hoặc van tự nở. Ưu điểm của van tự nở là có thể đặt lại van nếu vị trí chưa phù hợp trước khi thả van hoàn toàn.
Sau khi van nhân tạo mới được đặt trong van cũ, vai trò của siêu âm tim trong can thiệp là đánh giá lại mức độ hở van tồn lưu cũng như chênh áp qua van và diện tích lỗ van.
Phát hiện biến chứng sớm trong và ngay sau can thiệp
- Tràn máu màng ngoài tim gây ép tim do thủng thành tim do chọc vách liên nhĩ không đúng vị trí hoặc lái catheter kích thước lớn trong buồng tim gây tổn thương thành tim. Cần theo dõi liên tục tình trạng màng ngoài tim trên siêu âm.
- Can thiệp đặt van trong van theo đường mỏm tim có thể gây tràn máu màng tim hoặc màng phổi trái. Đôi khi cần bít vị trí chọc mỏm tim bằng dụng cụ.
- Hở van tồn lưu (đặc biệt là hở cạnh van) mức độ vừa trở lên.
- Hiếm gặp biến chứng van nhân tạo mới bị di lệch hoặc trôi
- Hẹp van tồn lưu hoặc lựa chọn van nhân tạo mới có kích thước không phù hợp với người bệnh là biến chứng cần lưu ý.
- Tắc nghẽn đường ra thất trái sau thay van trong van ở vị trí van hai lá là một biến chứng nặng có thể gây suy sụp huyết động phải phẫu thuật cấp cứu. Siêu âm tim qua thực quản 3D hoặc MSCT có vai trò quan trọng để dựng hình và đánh giá nguy cơ tắc nghẽn đường ra thất trái mới sau can thiệp (neo-LVOT).

3 Vai trò của siêu âm tim trong một số can thiệp điện sinh lý tim
Các can thiệp điện sinh lý tim, đặc biệt là can thiệp triệt đốt rối loạn nhịp tim đã có sự phát triển vượt bậc trong hơn hai thập niên vừa qua. Từ những can thiệp triệt đốt các rối loạn nhịp khu trú đơn giản như triệt đốt nhịp nhanh kịch phát trên thất do vòng vào lại nhĩ thất trong hội chứng Wolff-Parkinson-White, các kỹ thuật can thiệp hiện đại lần lượt ra đời cho phép điều trị các rối loạn nhịp phức tạp. Siêu âm tim và các phương tiện chẩn đoán hình ảnh tim mạch hỗ trợ các can thiệp triệt đốt rối loạn nhịp trên 3 phương diện: (1) cung cấp thông tin giải phẫu chi tiết của khu vực dự kiến triệt đốt và phát hiện các biến thể giải phẫu có thể gây khó khăn khi thao tác điều khiển catheter trong can thiệp; (2) hướng dẫn điều khiển catheter trong can thiệp bằng hình ảnh thời gian thực; (3) theo dõi liên tục vị trí và mức độ tiếp xúc giữa đầu catheter và mô cơ tim trong quá trình triệt đốt. Hiện nay tại hầu hết các trung tâm tim mạch lớn trên thế giới, hai kỹ thuật siêu âm tim thường được lựa chọn trong hướng dẫn can thiệp triệt đốt rối loạn nhịp là siêu âm tim qua thực quản 3D và siêu âm tim với đầu dò siêu âm trong buồng tim (ICE).
3.1 Vai trò của siêu âm tim qua thực quản 3D trong can thiệp điện sinh lý tim
3.1.1 Triệt đốt rối loạn nhịp nhĩ khởi nguyên từ vùng eo giữa van ba lá (CVTI) và tĩnh mạch chủ dưới bằng sóng có tần số radio
Giải phẫu khu vực eo giữa van ba lá và tĩnh mạch chủ dưới
Eo giữa van ba lá và tĩnh mạch chủ dưới (Cavo-tricuspid Ishmuth – CVTI) là một khu vực có dạng hình tứ giác nằm ở thành sau dưới nhĩ phải, được giới hạn phía trước bởi đường bám của van ba lá, phía sau bởi van Eustachian (Hình 15.109). Ranh giới phía vách và phía bên không thật sự rõ ràng, tương ứng với xoang vách (phía vách) và chỗ tận hết của mào tận cùng (phía bên). CVTI là khu vực can thiệp triệt đốt kiểu đường thẳng (linear ablation) với đường triệt đốt bắt đầu từ lỗ đổ vào nhĩ phải của tĩnh mạch chủ dưới và kết thúc tại đường bám của van ba lá để cắt đứt vòng vào lại trong cuồng nhĩ.
Dựa trên mục đích triệt đốt theo đường thẳng, khu vực tứ giác CVTI được chia thành 3 vùng (sector): vùng cận cận vách, vùng dưới và vùng dưới bên (Hình 15.109, 15.110). Vị trí thường được lựa chọn triệt đốt là vùng dưới bởi:
(1) khoảng cách giữa đường bám của van ba lá tới lỗ tĩnh mạch chủ dưới ngắn hơn so với vùng dưới bên, (2) đường triệt đốt nằm xa nút nhĩ thất và (3) thành tâm nhĩ ở khu vực này tương đối mỏng và chứa nhiều mảng mô xơ – mỡ nhỏ có tính chất trơ về điện học nên dễ triệt đốt xuyên thành hoàn toàn.

Các biến thể giải phẫu của CVTI có thể gây khó khăn cho quá trình triệt đốt, làm kéo dài thời gian của thủ thuật, trong đó các biến thể giải phẫu đáng lưu ý nhất gồm:
(1) Hố lõm hình túi dưới van Eustachie thường ở vùng dưới của CVTI, làm hạn chế khả năng triệt đốt xuyên thành. Đầu catheter triệt đốt có thể không chạm tới đáy của hố lõm hình túi nên đường triệt đốt không hoàn thiện. Trong trường hợp này, nên triệt đốt tại vùng bên dù đường triệt đốt dài hơn.
(2) Vùng eo dài và góc giữa tĩnh mạch chủ dưới với CVTI gần 90O hoặc van Eustachian quá phát và/hoặc rất cứng gây khó khăn khi lái
(3) Các dải cơ lược của tiểu nhĩ phải chạy cắt ngang từ vùng bên vào vùng giữa của CVTI tạo ra khoảng trống (gap) trên đường triệt đốt. Điều này làm tăng nguy cơ rối loạn nhịp tái phát sau can thiệp.
Đánh giá chi tiết giải phẫu khu vực CVTI giúp nâng cao tỷ lệ thành công và độ an toàn của can thiệp triệt đốt.
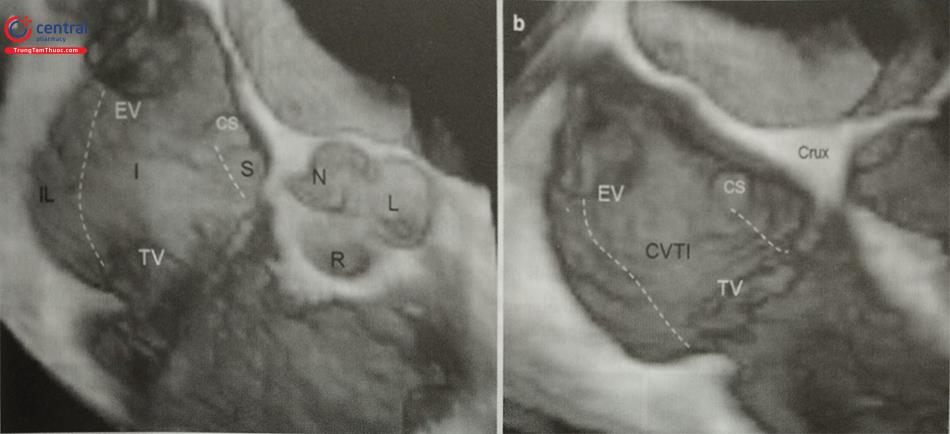
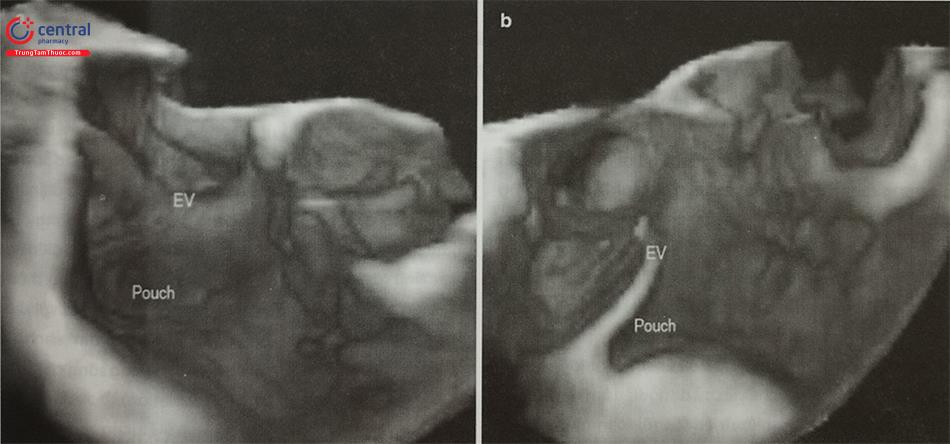
Siêu âm tim qua thực quản 3D hướng dẫn can thiệp
Trước can thiệp, siêu âm tim qua thực quản 2D hoặc 3D được chỉ định để loại trừ huyết khối. Siêu âm tim qua thực quản có thể cung cấp các thông tin có giá trị về biến thể giải phẫu tại CVTI liên quan tới chiến lược can thiệp. Ví dụ: cần sử dụng sheath tĩnh mạch dài hơn để hỗ trợ và giữ cố định catheter triệt đốt nếu van Eustachian quá phát và cứng hoặc bệnh nhân có CVTI dài. Nên lựa chọn đường triệt đốt phía vách gần lỗ xoang vành nếu có nhiều dải cơ lược chạy cắt ngang qua CVTI. Ngược lại, nên chọn đường triệt đốt phía bên để tránh các chướng ngại về giải phẫu như các hố lõm hình túi dưới van Eustachian.
Trong can thiệp, sử dụng siêu âm tim qua thực quản 3D phối hợp với màn tăng sáng giúp rút ngắn thời gian chiếu tia và thời gian làm can thiệp qua các nghiên cứu như nghiên cứu của Regoli và cộng sự. Siêu âm tim qua thực quản 3D trong can thiệp giúp theo dõi đường đi của catheter triệt đốt, phát hiện các vật cản giải phẫu, ghi hình rõ vị trí catheter bị mắc hoặc đi lạc chỗ giúp bác sĩ can thiệp điều khiển lái catheter tránh vật cản.
Ngoài ra, siêu âm tim qua thực quản 3D giúp đánh giá trực tiếp và liên tục mức độ tiếp xúc giữa đầu catheter với mô và độ ổn định của catheter trong quá trình triệt đốt, giúp nâng cao độ an toàn và hiệu quả trong các trường hợp triệt đốt tại CVTI phức tạp. Đánh giá mức độ tiếp xúc giữa đầu catheter triệt đốt và mô dựa trên dấu hiệu không có khoảng trống giữa đầu catheter và thành nhĩ trên hình ảnh siêu âm tim 3D từ nhiều hướng khác nhau. Có thể dễ dàng theo dõi quá trình di chuyển của catheter dọc theo đường triệt đốt (Hình 15.112) trên hình ảnh siêu âm tim 3D thời gian thực. Quá trình triệt đốt có thể tạo ra các vi bọt (bubble) tỏa ra tại nơi đầu mút catheter tiếp xúc với cơ nhĩ do hiệu ứng tạo hốc khi mô bị đốt bằng năng lượng sóng cao tần.
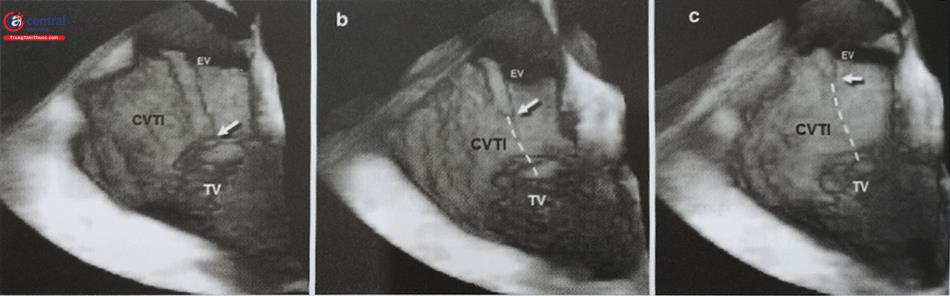
Bên cạnh những ưu điểm trên, siêu âm tim qua thực quản 3D trong can thiệp triệt đốt rối loạn nhịp nhĩ tại CVTI cũng có một số hạn chế liên quan đến vấn đề gây mê toàn thân, thở máy và các biến cố kèm theo. Trên thực tế, can thiệp triệt đốt rối loạn nhịp nhĩ tại vùng CVTI thường không phức tạp, không nhất thiết cần có sự hướng dẫn của siêu âm tim trong can thiệp. Việc huy động máy siêu âm tim qua thực quản 3D cùng bác sĩ siêu âm có trình độ và kinh nghiệm cũng làm hạn chế việc sử dụng siêu âm tim 3D qua thực quản trong can thiệp triệt đốt rối loạn nhịp nhĩ tại vùng CVTI. Vì vậy, siêu âm tim qua thực quản 3D chỉ được sử dụng khi rất cần rút ngắn thời gian chiếu tia như can thiệp cho phụ nữ có thai.
3.1.2 Triệt đốt rung nhĩ
Giải phẫu các tĩnh mạch phổi và liên quan tới rung nhĩ
Các tĩnh mạch phổi có vai trò quan trọng trong cơ chế kích phát và duy trì rung nhĩ do lớp cơ nhĩ tăng hoạt hóa điện học trải rộng tới lỗ đổ về của các tĩnh mạch phổi sau chỗ nối nhĩ thất. Sự phân bố cơ tim không đồng nhất dọc theo các tĩnh mạch phổi dẫn đến bất thường hoạt hóa điện học như ổ ngoại vị, vòng vào lại khu trú hoặc hoạt động điện khu trú dai dẳng dẫn tới rung nhĩ. Hiện nay, cô lập điện học các tĩnh mạch phổi bằng can thiệp qua đường ống thông là biện pháp điều trị rung nhĩ có triệu chứng, trơ với điều trị nội khoa khá phổ biến tại các trung tâm tim mạch. Có thể triệt đốt cô lập các tĩnh mạch phổi bằng sóng có tần số radio hoặc kỹ thuật áp lạnh (cryoablation).
Các tĩnh mạch phổi đổ về nhĩ trái tại thành sau nhĩ trái. Ở 70% người bình thường, mỗi bên phổi có 2 tĩnh mạch phổi đổ về nhĩ trái. Tĩnh mạch phổi trên phải đưa máu giàu oxy từ thùy trên và thùy giữa phổi phải còn các tĩnh mạch phổi trên trái dẫn máu giàu oxy từ thùy trên và thùy lưỡi phổi trái về nhĩ trái. Các tĩnh mạch phổi dưới phải và trái dẫn máu giàu oxy từ thùy dưới 2 phổi tương ứng về nhĩ trái. Các biến thể giải phẫu của các tĩnh mạch phổi khá hiếm gặp. Ở 15% dân số, các tĩnh mạch phổi trên và dưới của mỗi bên phổi có thể hợp lại thành một thân chung trước khi đổ vào nhĩ trái. Biến thể giải phẫu thường gặp là có thêm 1 tĩnh mạch phổi bên phải. Lỗ đổ về của các tĩnh mạch phổi tại nhĩ trái thường có hình bầu dục, đường kính từ 16 – 20 mm. Tuy nhiên, việc xác định chính xác chỗ nối giữa tĩnh mạch phổi và nhĩ trái rất khó bởi các tĩnh mạch phổi đổ vào nhĩ trái và đi trong thành nhĩ trái giống như đường hầm. Khu vực giữa 2 tĩnh mạch phổi cùng bên gọi là gờ liên tĩnh mạch phổi.
Siêu âm tim qua thực quản 3D trong hướng dẫn can thiệp
Trước can thiệp: Bệnh nhân có kế hoạch can thiệp cô lập các tĩnh mạch phổi được chỉ định siêu âm tim qua thực quản 2D/3D một cách thường quy để loại trừ huyết khối nhĩ trái và tiểu nhĩ trái.
Trong can thiệp:
Can thiệp triệt đốt rung nhĩ bằng sóng có tần số radio (RF) cần đưa 2 catheter qua vách liên nhĩ: catheter lập bản đồ (mapping catheter) và catheter triệt đốt (ablation cathe- ter). Vai trò của siêu âm tim qua thực quản 3D trong hướng dẫn chọc vách liên nhĩ đã được phân tích kỹ trong phần 2. Mặc dù bác sĩ can thiệp giàu kinh nghiệm có thể chọc vách liên nhĩ hai lần dưới hướng dẫn của màn tăng sáng, siêu âm tim qua thực quản vẫn được sử dụng để hướng dẫn chọc vách liên nhĩ trong trường hợp khó. Siêu âm tim qua thực quản 3D có thể dễ dàng phân biệt catheter triệt đốt (có vòng ở đầu tận) với catheter lập bản đồ (Hình 113). Trong hầu hết các trường hợp, bác sĩ siêu âm và bác sĩ can thiệp có thể dễ dàng theo dõi vị trí và đường đi của các catheter trên hình ảnh siêu âm tim qua thực quản 3D thời gian thực. Hình ảnh 3D với góc quét 60 độ x60 độ thường đủ rộng để quan sát được toàn bộ chiều dài catheter trong buồng tim với tốc độ khung hình (volume rate) khoảng 9 Hz. Mức độ tiếp xúc của đầu catheter triệt đốt với mô cơ nhĩ cần được đánh giá trên nhiều hình ảnh siêu âm 3D từ các phía khác nhau. Để đảm bảo đầu tận của catheter triệt đốt tiếp xúc với thành nhĩ, không được thấy khoảng trống (gap) giữa đầu tận của catheter với mô cơ nhĩ. Hình 114 cho thấy đầu tận của catheter triệt đốt đang tiếp xúc với cơ nhĩ tại phía tĩnh mạch phổi của gờ bên. Hình 115 cho thấy đầu catheter đang tiếp xúc với lỗ tĩnh mạch phổi trên phải. Cuối cùng, có thể theo dõi mức độ cố định của đầu catheter trong quá trình triệt đốt trên hình ảnh đa bình diện MPR hoặc hình ảnh 3D thời gian thực.
Tuy nhiên, trên thực tế siêu âm tim qua thực quản 3D trong hướng dẫn can thiệp cô lập tĩnh mạch phổi là một thách thức so với can thiệp triệt đốt tại vùng eo giữa van ba lá và tĩnh mạch chủ dưới (CVTI). Siêu âm tim bao gồm siêu âm tim qua thực quản 3D thường không ghi hình được toàn bộ các lỗ tĩnh mạch phổi trên cùng một bệnh nhân, đặc biệt là các lỗ tĩnh mạch phổi dưới trừ trường hợp nhĩ trái giãn lớn. Điều này liên quan tới hiện tượng gập góc khác nhau của các tĩnh mạch phổi dưới khi đổ và nhĩ trái. Do bản thân can thiệp cô lập tĩnh mạch phổi bằng RF là kỹ thuật đốt từng điểm quanh chu vi của các lỗ tĩnh mạch phổi, thời gian làm thủ thuật thường kéo dài. Vì vậy, quá trình theo dõi liên tục vị trí và mức độ tiếp xúc giữa đầu tận của catheter triệt đốt với thành nhĩ cũng dài hơn trong khi hình ảnh siêu âm tim 3D dễ bị ảnh hưởng bởi các hiện tượng ảnh giả và các vấn đề sinh lý như di động lồng ngực theo hô hấp hoặc nhu động của thực quản. Thêm vào đó, mặc dù catheter triệt đốt và catheter mapping có hình dạng khác nhau, nếu hai catheter nằm gần nhau, bóng cản do bản thân các catheter tạo ra có thể che lấp hình ảnh của catheter còn lại và hạn chế khả năng theo dõi mức độ tiếp xúc của catheter triệt đốt với thành nhĩ dù ghi hình rõ các lỗ tĩnh mạch phổi. Ngoài ra, hiện tượng ảnh giả do âm dội cũng là một vấn đề khó khăn khi theo dõi vị trí của các catheter trên hình ảnh siêu âm. Nếu catheter nằm gần như song song với chùm siêu âm, ảnh giả tạo ra do âm dội làm hình ảnh của catheter bị dài hơn thực tế nên khó nhận định chính xác vị trí đầu tận của catheter.
Dữ liệu từ các nghiên cứu đơn trung tâm cho thấy vai trò của siêu âm tim qua thực quản 3D trong can thiệp triệt đốt rung nhĩ bằng cách cô lập tĩnh mạch phổi phụ thuộc chặt chẽ vào kỹ thuật can thiệp. Kỹ thuật cô lập tĩnh mạch phổi bằng bóng áp lạnh nhanh chóng và thuận lợi hơn so với triệt đốt bằng RF. Vai trò của siêu âm tim trong trường hợp này là đánh giá vị trí của bóng áp lạnh (cryoballoon) tại các lỗ tĩnh mạch phổi. Khả năng chuyển đổi linh hoạt giữa hình ảnh 2D và 3D phối hợp với doppler màu giúp phát hiện dòng rò quanh bóng áp lạnh, nhờ đó bác sĩ can thiệp có thể đặt lại bóng áp sát các lỗ tĩnh mạch phổi bằng cách xoay catheter mang bóng.
Một số vấn đề khác liên quan tới việc sử dụng siêu âm tim qua thực quản 3D trong hướng dẫn can thiệp triệt đốt rung nhĩ: (1) Thay đổi vị trí đầu dò siêu âm tim trong thực quản để bộc lộ rõ hình ảnh của các lỗ tĩnh mạch phổi có thể làm thay đổi hình dạng của nhĩ trái trên siêu âm và ảnh hưởng tới thao tác điều chỉnh vị trí catheter; (2) đầu dò siêu âm tim trong thực quản có thể sinh nhiệt và làm tăng nhiệt độ sinh ra do hoạt động triệt đốt bằng RF. Cần thêm các nghiên cứu đánh giá nguy cơ gây tổn thương thực quản và ảnh hưởng tới kết quả triệt đốt do nhiệt năng sinh ra từ đầu dò siêu âm tim qua thực quản.
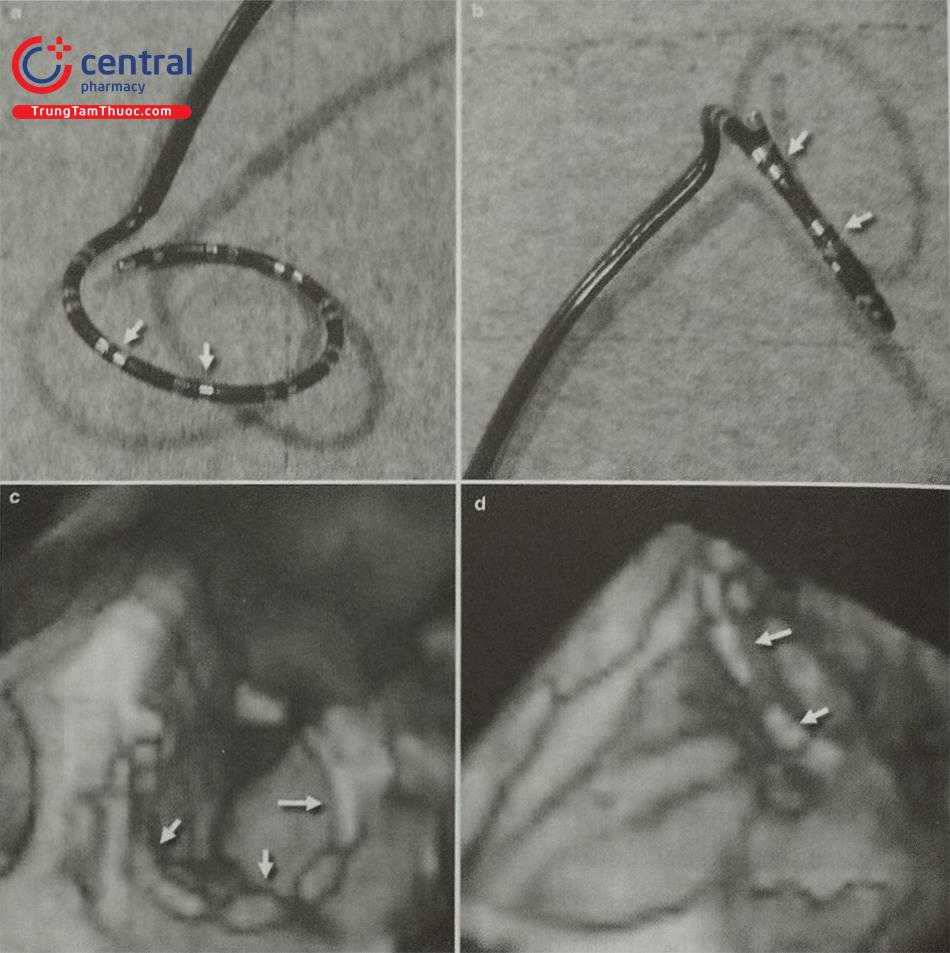
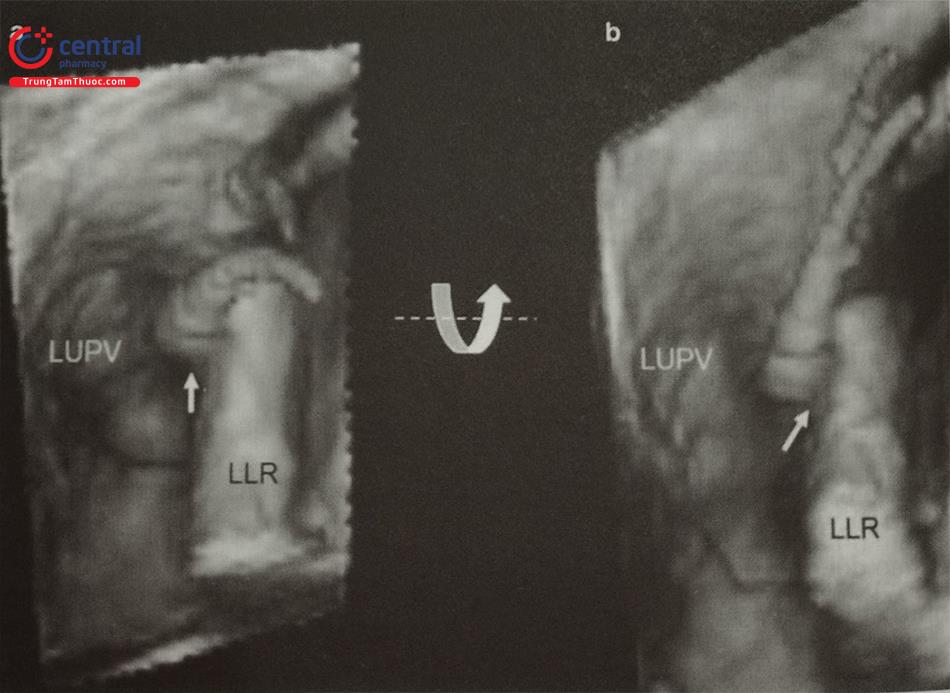
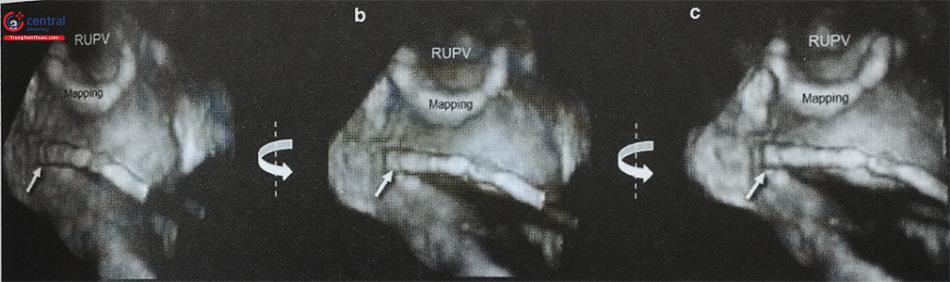
3.2 Vai trò của siêu âm tim với đầu dò siêu âm trong buồng tim trong can thiệp điện sinh lý tim
3.2.1 Triệt đốt rung nhĩ
Tại hầu hết các đơn vị can thiệp điện sinh lý tim tại Hoa Kỳ, ICE đã trở thành phương tiện thường quy trong hướng dẫn triệt đốt rung nhĩ bằng cách cô lập các lỗ tĩnh mạch phổi. Trên thực tế, ICE giữ vai trò quan trọng trong tất cả các bước của quy trình can thiệp, bao gồm:
- Đánh giá giải phẫu các tĩnh mạch phổi.
- Chọc vách liên nhĩ.
- Định vị và đánh giá mức độ tiếp xúc giữa catheter triệt đốt và mô cơ nhĩ.
- Đánh giá kết quả (sẹo tổn thương) triệt đốt.
- Phòng ngừa và phát hiện sớm biến chứng như tràn dịch màng ngoài tim, huyết khối…
- Đánh giá sinh lý dòng chảy đổ về qua tĩnh mạch phổi trước và sau can thiệp.
- Đánh giá liên quan giải phẫu giữa thực quản và các lỗ tĩnh mạch phổi.
Trước can thiệp, vai trò của ICE là đánh giá chi tiết giải phẫu các tĩnh mạch phổi, phát hiện các biến thể giải phẫu của tĩnh mạch phổi và đo đường kính lỗ đổ về của từng tĩnh mạch phổi để lựa chọn catheter lập bản đồ (mapping cath- eter) có kích thước phù hợp. Ngoài ra, ICE được sử dụng để loại trừ huyết khối tiểu nhĩ trái, đặc biệt nếu bệnh nhân bị chống chỉ định làm siêu âm tim qua thực quản hoặc hình ảnh siêu âm tim qua thực quản không rõ.
Trong can thiệp, ICE cung cấp hình ảnh thời gian thực để theo dõi vị trí của catheter triệt đốt so với lỗ đổ về của các tĩnh mạch phổi cũng như mức độ tiếp xúc của catheter và mô. Điều này đảm bảo đầu mút của catheter luôn nằm ở phần lỗ vào mà không đi vào trong các tĩnh mạch phổi. Đặc biệt khi đặt catheter ICE tại đường ra thất phải, có thể ghi hình rõ khu vực gờ ngăn cách các tĩnh mạch phổi với tiểu nhĩ trái. Ở mặt cắt này, có thể xác định catheter triệt đốt nằm bên phía tĩnh mạch phổi hay phía tiểu nhĩ trái so với gờ và vị trí của catheter triệt đốt đủ gần để không gây hẹp các tĩnh mạch phổi. Ngoài xác định vị trí giải phẫu chính xác của đầu catheter triệt đốt, cần đặc biệt lưu ý mức độ tiếp xúc và hướng triệt đốt tại vị trí đích. Trong trường hợp can thiệp cô lập các tĩnh mạch phổi bằng kỹ thuật áp lạnh, ICE cho phép đánh giá mức độ bít các tĩnh mạch phổi trong quá trình lên bóng. Đầu dò ICE với khả năng ghi hình doppler màu dễ dàng phát hiện các dòng rò quanh bóng áp lạnh và hướng dẫn bác sĩ can thiệp điều chỉnh lại vị trí catheter mang bóng áp lạnh cho phù hợp.
ICE cũng là công cụ hữu ích để theo dõi tình trạng hẹp các tĩnh mạch phổi trong quá trình triệt đốt. Sử dụng doppler xung để đo vận tốc đỉnh của dòng đổ về qua lỗ tĩnh mạch phổi với cổng lấy mẫu đặt song song với lỗ tĩnh mạch phổi. Sau quá trình triệt đốt, vận tốc đỉnh của dòng đổ về qua lỗ tĩnh mạch phổi có thể tăng nhẹ tới vừa. Nghiên cứu của Ren và cộng sự cho thấy vận tốc đỉnh tăng ≤ 158 cm/s có thể dung nạp tốt và có xu hướng quay trở về mức nền trước can thiệp sau 3 tháng bởi tình trạng tăng tốc có thể liên quan tới phù nề mô sau triệt đốt.
3.2.2 Triệt đốt cuồng nhĩ và các rối loạn nhịp khác
ICE là một công cụ hữu dụng trong hỗ trợ can thiệp triệt đốt rối loạn nhịp nhĩ khởi nguyên từ vùng eo giữa tĩnh mạch chủ dưới và vòng van ba lá (Cavo-tricuspid Ismuth – CVTI). Mặt cắt cơ sở (home view) của ICE cho phép đánh giá chiều dài của vùng eo giữa tĩnh mạch chủ dưới và van Eustachian cùng các bất thường giải phẫu gây khó khăn cho quá trình triệt đốt như van Eustachian quá phát, các dải cơ lược dày và các lỗ lõm sâu hình túi. Để đánh giá vị trí đầu catheter triệt đốt nằm ở phía vách hay phía bên, cần xoay nhẹ catheter ICE cùng chiều kim đồng hồ để bộc lộ rõ phía vách của vùng eo giữa van ba lá và tĩnh mạch chủ dưới (mặt cắt ghi hình cả xoang vành và gốc động mạch chủ đồng thời) hoặc xoay catheter ICE ngược chiều kim đồng hồ để ghi hình phía bên của vùng eo giữa van ba lá và tĩnh mạch chủ dưới.
ICE cho phép theo dõi liên tục quá trình rút catheter triệt đốt từ thất phải về tĩnh mạch chủ dưới nhờ hình ảnh siêu âm tim thời gian thực và đánh giá tổn thương hình thành sau triệt đốt như hình ảnh phù mô cơ tim hoặc vùng cơ tim tăng âm. Gờ Eustachian quá phát là một rào cản thường gặp trong can thiệp triệt đốt rối loạn nhịp nhĩ tại vùng eo giữa van ba lá và tĩnh mạch chủ dưới. Gờ này thường nằm xen giữa đầu catheter triệt đốt với eo dưới Eustachian khi catheter triệt đốt được kéo về từ thất phải. ICE có thể dễ dàng phát hiện và giúp bác sĩ can thiệp khắc phục vấn đề này bằng cách uốn cong nhẹ catheter triệt đốt ở phần giữa của nhĩ phải rồi kéo xuống cho tới khi đến được vùng eo dưới Eustachian.
ICE cũng giúp xác định các cấu trúc giải phẫu trong nhĩ phải hoặc nhĩ trái có thể là khởi nguyên của rối loạn nhịp nhĩ, đặc biệt là các gờ nội mạc và các cấu trúc quanh các van tim không hiện hình trên màn tăng sáng, ví dụ: mào tận cùng, gờ coumadin, vòng van hai lá, vòng van ba lá,…
Mặc dù chi phí cao làm hạn chế việc sử dụng ICE một cách thường quy trong can thiệp triệt đốt tại vùng eo giữa van ba lá và tĩnh mạch chủ dưới, kỹ thuật này nên được sử dụng trong trường hợp can thiệp triệt đốt kiểu truyền thống không thành công.
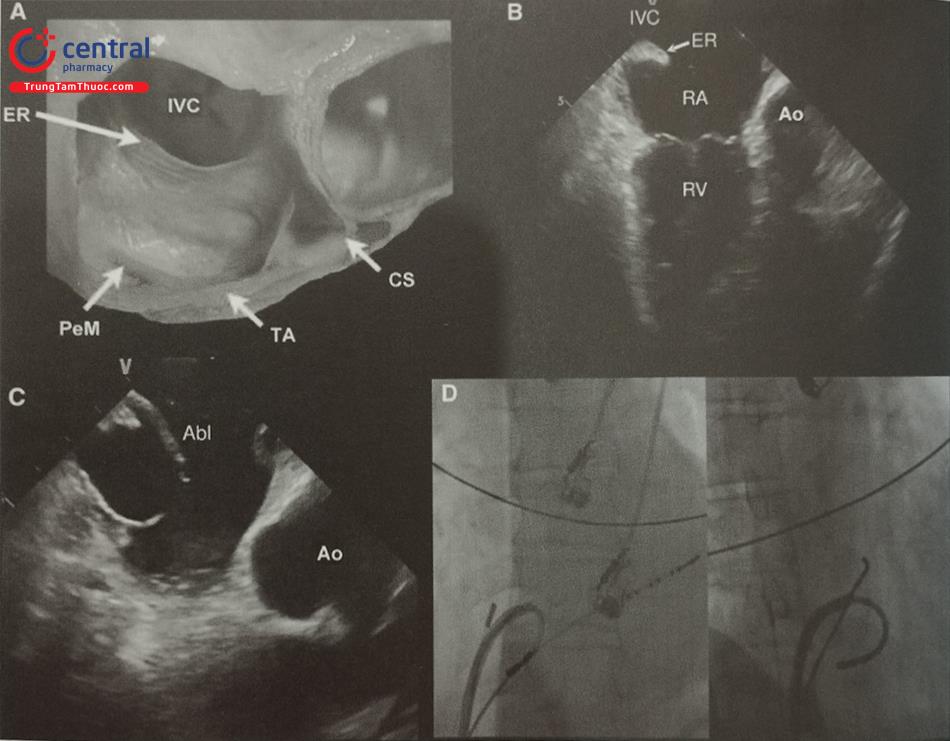

A- Triệt đốt rối loạn nhịp tại dải cơ điều hòa (MB) của thất phải (RV). Catheter triệt đốt (mũi tên) được đặt dọc theo trục dài của thất phải để dễ cố định catheter và tăng độ tiếp xúc giữa đầu catheter và cơ tim. Lưu ý sự có mặt của 3 cơ nhú gắn vào dải cơ điều hòa. B- Triệt đốt rối loạn nhịp thất tại cơ nhú sau giữa theo đường ngược dòng. Hình ảnh ICE thu được khi catheter ICE nằm trong thất phải. Catheter triệt đốt (mũi tên) được đặt sau cơ nhú với đầu mút được uốn cong lên trên để giữ cố định trong quá trình triệt đốt. C- Triệt đốt tại khu vực cận His, hình ảnh ICE ghi được từ nhĩ phải. Sheath dài được uốn cong xuống dưới tại vị trí van ba lá (mũi tên nhỏ) để đầu catheter được uốn cong (mũi tên to). Vùng cận His được đánh dấu bằng các chấm tròn màu. Cần kiểm tra khoảng cách an toàn giữa đầu catheter triệt đốt với bó His trên các mặt cắt khác nhau. D- Triệt đốt rối loạn nhịp thất vùng xoang Valsalva. Hình ảnh ICE ghi được từ đường ra thất phải. Catheter triệt đốt đang nằm tại xoang vành phải. Lưu ý lỗ vào của động mạch vành trái tại xoang vành trái và đường ra thất phải cùng diện sau vách của nó nằm đối diện với xoang Valsalva vành phải. E- Triệt đốt nhịp nhanh thất do bệnh tim thiếu máu cục bộ có phình lớn mỏm thất trái. Hình ảnh ICE cho thấy không có huyết khối buồng thất trái. Lưu ý sự chuyển tiếp từ vùng cơ tim bình thường (dày) sang vùng cơ tim bị nhồi máu (mỏng). Mũi tên đánh dấu vị trí triệt đốt. Lưu ý catheter mapping và catheter triệt đốt tiếp xúc với sẹo cơ tim tại mỏm tim. F- Triệt đốt nhịp nhanh thất trong bệnh cơ tim không do thiếu máu cục bộ với sẹo tại vùng sau vách liên thất. Hình ảnh ICE được ghi từ nhĩ phải. Catheter triệt đốt (mũi tên) được đặt vào vùng sẹo cơ tim theo đường ngược dòng. G- Tổn thương cơ tim tạo ra do kết quả của quá trình triệt đốt, xuất hiện vùng cơ tim tăng âm (trắng) quanh đầu catheter triệt đốt. H- Triệt đốt nhịp nhanh thất vùng thượng tâm mạc. Điểm được hệ thống lập bản đồ đánh dấu khi catheter triệt đốt cắt qua và không phải là ngoại tâm mạc. (Epi: thượng tâm mạc; LA: nhĩ trái; LCC: xoang vành trái; LV: thất trái; MB: dải cơ điều hòa; NCC: xoang không vành; PA: động mạch phổi; peri: ngoại tâm mạc; PMPM: cơ nhú sau bên; RA: nhĩ phải; PFC: catheter triệt đốt; RCC: xoang vành phải; RV: thất phải; RVOT: đường ra thất phải; VT: nhịp nhanh thất).
3.2.3 Triệt đốt rối loạn nhịp thất
Có thể nói ICE đặc biệt có giá trị trong hướng dẫn lập bản đồ và triệt đốt các rối loạn nhịp thất nhờ khả năng cung cấp hình ảnh thời gian thực để theo dõi vị trí của đầu catheter triệt đốt so với các cấu trúc giải phẫu đích cũng như mức độ tiếp xúc giữa đầu catheter với mô cơ thất. Đây là những yếu tố đảm bảo năng lượng triệt đốt được tập trung tại vị trí đích một cách hiệu quả, hạn chế tổn thương các cấu trúc lân cận. Quá trình hình thành tổn thương trong triệt đốt tại mô cơ thất trên hình ảnh ICE là một vùng cơ tim tăng âm mới xuất hiện (Hình 15.117G). Ngoài ra, ICE cũng có vai trò đánh giá cơ chất sinh rối loạn nhịp (arrhythmogenic substrate) nhờ xác định vùng sẹo cơ tim. Trong bệnh tim thiếu máu cục bộ, sẹo cơ tim là vùng cơ tim giảm hoặc không vận động và giãn mỏng, tăng âm (Hình 15.117E; 15.117F) tương ứng với vùng tưới máu của động mạch vành và những rối loạn về điện học trên lập bản đồ điện giải phẫu. Trong bệnh tim không do nguyên nhân thiếu máu cục bộ, ICE giúp phát hiện sẹo ở lớp cơ tim giữa và thượng tâm mạc, tương ứng với rối loạn điện thế đơn cực nội mạc và rối loạn điện thế lưỡng cực dưới thượng tâm mạc.
Thông tin giải phẫu do ICE mang lại có thể được kết hợp lồng ghép trong hệ thống lập bản đồ điện giải phẫu như trong hệ thống lập bản đồ CARTO bằng phần mềm CARTOSOUND (Biosense Webster) (Hình 15.118). Hệ thống này sử dụng một catheter ICE được cải tiến mang cảm biến định vị có thể được nhận diện trên hệ thống lập bản đồ CARTO. Các lát cắt siêu âm 2D trên các bình diện khác nhau của buồng tim cần khảo sát được ghi hình. Viền nội mạc được đánh dấu bằng phần mềm hoặc bằng tay. Những hình ảnh này được hệ thống CARTOSOUND phiên giải để xây dựng mô hình 3D trực tuyến. Các thông tin lập bản đồ được áp dụng trên mô hình giải phẫu tái dựng này. Vòng tròn màu xanh đánh dấu vị trí đầu tận của catheter theo thời gian thực khi tương tác với mặt cắt siêu âm của ICE.
ICE là công cụ đặc biệt hữu ích khi lập bản đồ triệt đốt rối loạn nhịp thất tại những cấu trúc không hiện hình rõ trên màn tăng sáng (Hình 15.117) bao gồm các xoang Valsalva, cơ nhú, dây chằng giả và dải cơ điều hòa của thất phải. Trong triệt đốt rối loạn nhịp thất tại xoang Valsalva, có thể dễ dàng đánh giá vị trí của catheter triệt đốt tại bất kỳ xoang Valsalva nào trên mặt cắt trục ngắn qua gốc động mạch chủ khi catheter ICE được đặt tại thất phải. Vị trí của đầu catheter triệt đốt so với điểm đáy của các lá van động mạch chủ được đánh giá trên mặt cắt trục dài khi xoay catheter ICE ngược chiều kim đồng hồ. Triệt đốt rối loạn nhịp thất khởi nguyên từ các xoang Valsalva dưới hướng dẫn của ICE hạn chế nhu cầu phải chụp động mạch vành trong can thiệp. Khoảng cách từ catheter triệt đốt tới lỗ vào của động mạch vành rất an toàn (> 1 cm) nếu catheter triệt đốt nằm ở chỗ nối giữa lá vành phải và lá vành trái trên mặt cắt trục ngắn. Tương tự, nếu đầu mút của catheter triệt đốt nằm dưới điểm đáy của các lá van trên mặt cắt trục dài, khoảng cách từ đầu mút catheter tới lỗ vào động mạch vành > 1 cm. Ngoài ra, có thể xác định lỗ vào, đường đi của đoạn gần các động mạch vành bằng siêu âm doppler màu và đưa hình ảnh này vào bản đồ 3D để đảm bảo vùng triệt đốt nằm xa các động mạch này.
Trong trường hợp triệt đốt rối loạn nhịp thất ở gần các cơ nhú, ICE là công cụ dẫn đường cần thiết để đánh giá các đặc điểm giải phẫu của cơ nhú (kích thước, hình dạng và số đầu), đảm bảo mức độ tiếp xúc cần thiết giữa đầu catheter triệt đốt với mô cơ thất cũng như hướng của catheter triệt đốt. ICE cũng giúp định vị sẹo cơ tim sinh rối loạn nhịp thể hiện bằng một vùng cơ tim tăng âm tương ứng với bất thường điện thế trên bản đồ điện giải phẫu. Đối với rối loạn nhịp thất khởi nguyên tại dải cơ điều hòa thất phải, ICE rất hữu ích để đánh giá giải phẫu và các biến thể giải phẫu của dải cơ điều hòa về hình thái và vị trí bám, tương quan vị trí giữa dải cơ điều hòa và các cơ nhú thất phải và đảm bảo catheter tiếp xúc ổn định với mô cơ thất trong quá trình triệt đốt.
Cuối cùng, ICE giúp hạn chế các biến chứng do sóng cao tần gây tổn thương các vùng lân cận vị trí đích cần triệt đốt. Khi lập bản đồ rối loạn nhịp thất gần bó His, ICE giúp xác định giải phẫu vùng lân cận với khu vực bó His giúp bác sĩ can thiệp có thể lập bản đồ từng vùng và quyết định vị trí triệt đốt có khả năng thành công cao và ít nguy cơ gây block nhĩ thất. Trong hình 15.117 khu vực bó His được đánh dấu bởi đầu catheter trên hình ảnh ICE. Nên lập bản đồ rối loạn nhịp thất ở vùng van ba lá một cách thận trọng dưới hướng dẫn liên tục của ICE để hạn chế nguy cơ làm tổn thương đường dẫn truyền.
4 Kết luận
Với tính chất cơ động vốn có, từ lâu hoạt động siêu âm tim không chỉ giới hạn trong không gian của echolab mà đã mở rộng tới tận giường bệnh, tại đơn vị hồi sức tích cực và đồng hành cùng các can thiệp tim mạch. Các phương thức siêu âm tim hiện đại bao gồm siêu âm tim qua thực quản 3D thời gian thực, siêu âm tim với đầu dò trong buồng tim và lồng ghép hình ảnh siêu âm tim với hình chiếu huỳnh quang đã trở thành công cụ dẫn đường đắc lực trong các can thiệp bệnh lý tim cấu trúc và điện sinh lý.
Như vậy, có thể nói, siêu âm tim và chẩn đoán hình ảnh tim mạch là mắt xích không thể thiếu trong “Heart team” để đảm bảo quá trình can thiệp diễn ra thuận lợi, an toàn và mang lại hiệu quả tối ưu cho người bệnh.
5 Tài liệu tham khảo
- Cardiology, S.o., The ESC Textbook of Cardiovascular Imaging. 3 ed. 2021: Oxford University Press.
- Joseph Mathew, A.N., Chakib M. Ayoub, Madhav Swaminathan, Clinical Manual and Review of Transesophageal Echocardiography. 2019.
- Puchalski, D., et al., Guidelines for Performing a Comprehensive Transesophageal Echocardiographic: Examination in Children and All Patients with Congenital Heart Disease: Recommendations from the American Society of Echocardiography. J Am Soc Echocardiogr, 2019. 32(2): p. 173-215.
- Cardiology, S.o., The EACVI Textbook of Echocardiography. 2016: Oxford University Press.
- Echocardiography, A.S.o., ASE’s Comprehensive Echocardiography. 3 ed. 2021:
- Enriquez, , et al., Use of Intracardiac Echocardiography in Interventional Cardiology: Working With the Anatomy Rather Than Fighting It. Circulation, 2018. 137(21): p. 2278-2294.
- Paul Leeson , A., Andrew R.J. Mitchell , and Harald Becher, Echocardiography (Oxford Specialist Handbooks in Cardiology). 2012: Oxford University Press.
- Otto, C., Textbook of Clinical Echocardiography. 2018:
- Michael H. Picard, J.P., Jacob P. Dal-Bianco, Intraprocedural Imaging of Cardiovascular Interventions. 2016: Springer.
- Francesco Fulvio Faletra, P., Natesa G. Pandian, Hans-Joachim Nesser, Itzhak Kronzon, Real-Time 3D Interventional Echocardiography. 2014: Springer.
- Anita Sadeghpour, A.A., Case-Based Textbook of Echocardiography. 2018:
- Hamid, N. and S.H. Ewe, Interventional Echocardiography: Current Role and Progress. Proceedings of Singapore Healthcare, 2015. 24(1): p. 4-15.
- Silvestry, E., et al., Guidelines for the Echocardiographic Assessment of Atrial Septal Defect and Patent Foramen Ovale: From the American Society of Echocardiography and Society for Cardiac Angiography and Interventions. J Am Soc Echocardiogr, 2015. 28(8): p. 910-58.
- Echocardiography, A.S.o., ASE’s Comprehensive Strain Imaging. 1 ed. 2021:
- Simpson, , et al., Three-dimensional echocardiography in congenital heart disease: an expert consensus document from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. Eur Heart J Cardiovasc Imaging, 2016. 17(10): p. 1071-97.
- Otto, M., et al., 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. 2021. 143(5): p. e72-e227.
- Vahanian, A., et al., 2021 ESC/EACTS Guidelines for the management of valvular heart disease. EuroIntervention, 2022. 17(14): p. e1126-e1196.
- Silbiger, J., Advances in Rheumatic Mitral Stenosis: Echocardiographic, Pathophysiologic, and Hemodynamic Considerations. J Am Soc Echocardiogr, 2021. 34(7): p. 709-722.e1.
- Wunderlich, N.C. and R.J. Siegel, Peri-interventional echo assessment for the MitraClip procedure. Eur Heart J Cardiovasc Imaging, 2013. 14(10): p. 935-49.
- Aman, and T.W. Smith, Echocardiographic guidance for transcatheter mitral valve repair using edge-to-edge clip. J Echocardiogr, 2019. 17(2): p. 53-63.
- Zamorano, J., et al., The use of imaging in new transcatheter interventions: an EACVI review paper. Eur Heart J Cardiovasc Imaging, 2016. 17(8): p. 835-835af.
- Zamorano, J.L., et al., EAE/ASE recommendations for the use of echocardiography in new transcatheter interventions for valvular heart disease. J Am Soc Echocardiogr, 2011. 24(9): p. 937-65.
- Kinno, , E.P. Cantey, and V.H. Rigolin, The transition from transesophageal to transthoracic echocardiography during transcatheter aortic valve replacement: an evolving field. Journal of Echocardiography, 2019. 17(1): p. 25-34.
- Bartel, , et al., Why is intracardiac echocardiography helpful? Benefits, costs, and how to learn. Eur Heart J, 2014. 35(2): p. 69-76.
- Gafoor, , et al., A Quick Guide to Paravalvular Leak Closure. Interv Cardiol, 2015. 10(2): p. 112-117.

