Sắc ký là gì? Phân loại và ứng dụng của phương pháp sắc ký trong y sinh học
Trường Đại Học Y Hà Nội - Bộ môn Khoa học xét nghiệm
Chủ biên PGS.TS.BS Đặng Thị Ngọc Dung, TS. Nguyễn Trọng Tuệ
Các tác giả tham gia biên soạn
PGS. TS. BS Đặng Thị Ngọc Dung, TS. Nguyễn Trọng Tuệ, TS. BS. Nguyễn Thúy Hương, TS. BS. Nguyễn Thị Thanh Hải
ThS. Đặng Quang Huy, Ths. BSNT. Nguyễn Quỳnh Giao, Ths. BSNT. Vũ Đức Anh, ThS. Trịnh Thị Phương Dung
Ths. BSNT. Lê Văn Toàn, Ths. BSNT. Ngô Diệu Hoa, BSNT. Phạm Thị Hương Trang, Ths. BSNT. Nguyễn Thị Thu Thảo
Ths. BS. Nguyễn Thị Hảo, CKI. Đỗ Thị Hường, CKI. Nguyễn Thúy Hà, ThS. Vũ Thị Bích Hồng
CN. Lê Thanh Thảo, CN. Nguyễn Hữu Hùng
Trong các phương pháp phân tách hiện nay, sắc ký là phương pháp hữu hiệu nhất để tách các chất ra khỏi một hỗn hợp, ngay cả những hỗn hợp phức tạp về thành phần và khác nhau về hàm lượng trọng hỗn hợp. Trong bài viết này, Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) xin gửi đến bạn đọc thông tin về các phương pháp sắc ký và ứng dụng của phương pháp này trong lĩnh vực y sinh học.
1 ĐẠI CƯƠNG
1.1 Định nghĩa
Định nghĩa (IUPAC-1993): Sắc ký (chromatography) là một phương pháp tách trong đó có các cấu tử được tách được phân bố giữa hai pha, một trong hai pha là pha tĩnh đứng yên còn pha kia chuyển động theo một hướng xác định.
Sắc ký có thể được phiên nghĩa của hai từ ghép trong tiếng la tinh là màu sắc và sự ghi lại. Sắc ký là một trong các kĩ thuật phân tích thường dùng trong phòng thí nghiệm để tách các chất trong một hỗn hợp. Nó bao gồm việc cho mẫu chứa chất cần phân tích trong "pha động", thường là dòng chảy của dung môi, di chuyển qua "pha tĩnh." Pha tĩnh trì hoãn sự di chuyển của các thành phần trong hỗn hợp. Khi các hỗn hợp di chuyển qua các pha tĩnh với tốc độ khác nhau, chúng sẽ được tách khỏi nhau theo thời gian.
Trong kĩ thuật sắc ký, hỗn hợp được chuyên chở trong chất lỏng hoặc khí và các thành phần trong hỗn hợp được tách ra do sự phân bố khác nhau của các chất tan khi chúng chảy qua pha tĩnh rắn hay lỏng. Nhiều kĩ thuật khác nhau đã được dùng để phân tích hợp chất phức tạp dựa trên ái tính khác nhau của các chất trong môi trường động dạng khí hoặc lỏng và đối với môi trường hấp phụ tĩnh mà chúng di chuyển qua, như giấy, gelatin hay gel. Có thể ứng dụng sắc ký để xác định danh tính và nồng độ các phân tử trong hỗn hợp hoặc dùng để tinh chế các chất có trong hỗn hợp.
1.1.1 Phân loại sắc ký
Nếu dựa theo tính chất của pha động thì có thể chia sắc ký thành 2 loại chính theo bảng 1.
| Pha động | Pha tĩnh | Tên gọi kỹ thuật | Phân loại theo hình thức |
| Chất lỏng | Chất rắn | Sắc ký lỏng-rắn | Sắc ký cột, sắc ký bản mỏng, sắc ký lỏng cao áp... |
| Chất lỏng | Sắc ký lỏng-lỏng | Sắc ký lỏng cao áp | |
| Chất khí | Chất rắn | Sắc ký khí-rắn | Sắc ký khí |
| Chất lỏng | Sắc ký khí-lỏng |
Người ta phân loại các phương pháp sắc ký dựa vào cơ chế hoạt động sắc ký: Hấp phụ, phân bố, trao đổi ion... và vào tính chất của pha tĩnh cũng như phương pháp thể hiện sắc ký. Ví dụ:
- Phương pháp sắc ký lỏng rắn trên cột, phương pháp sắc ký phân bố khí lỏng trên cột.
- Phương pháp sắc ký phân bố lỏng lỏng trên bản phẳng hai chiều.
- Phương pháp sắc ký phân bố lỏng lỏng pha ngược áp suất cao trên cột...
Cơ chế sắc ký có nhiều nhưng để thực hiện quá trình sắc ký thì chỉ có hai dạng: Dạng cột và dạng bản mỏng (bản kính, polime, kim loại, giấy). Trong sắc ký cột, pha tĩnh được giữ trong một cột ngắn và pha động được cho chuyển động qua cột bởi áp suất hoặc do trọng lực. Trong sắc ký bản mỏng, pha tĩnh được phủ trên một mặt phẳng thủy tinh hoặc kim loại. Thường để đơn giản hóa, tuy không chính xác người ta gọi tắt các phương pháp sắc ký: Sắc ký khí, sắc ký lỏng, sắc ký lỏng cao áp, sắc ký lớp mỏng, sắc ký gel...
Trong số các phương pháp sắc ký được biết, quan trọng nhất là sắc ký hấp phụ, sắc ký phân bố và sắc ký trao đổi ion.
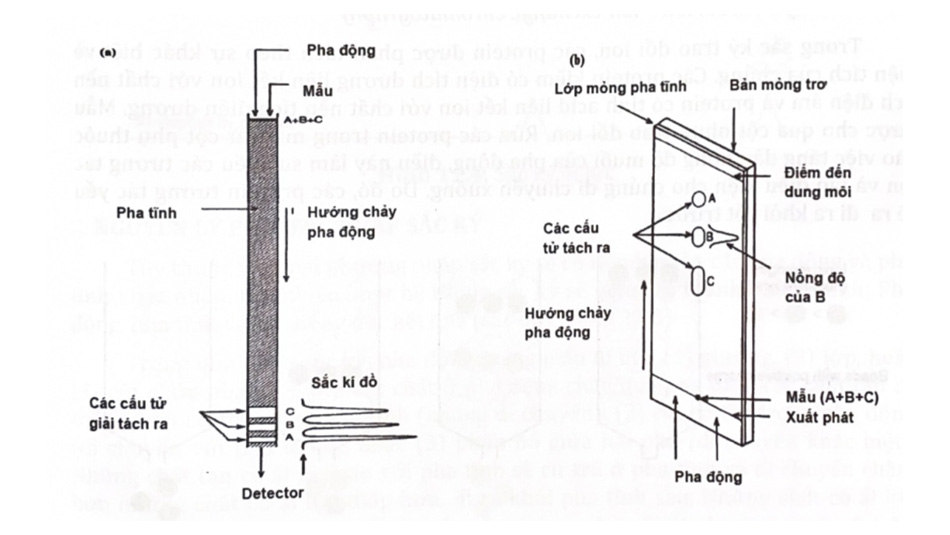
1.1.1.1 Sắc ký cột
- Sắc ký cột là phương pháp sắc ký phân tách và định lượng sinh chất dưới áp suất cao, giúp giảm đáng kể thời gian và hiệu quả, chất lượng phân tích.
- Các hạt của pha tĩnh hoặc hỗ trợ được phủ bằng pha tĩnh lỏng có thể lấp đầy toàn bộ thể tích bên trong ống hoặc tập trung dọc theo thành ống phía trong để tạo một đường dẫn mở, không giới hạn cho pha động phần giữa của ống (cột hình ống mở).
- Sự khác biệt về tốc độ di chuyển qua môi trường được tính theo thời gian lưu khác nhau của mẫu.
1.1.1.2 Sắc ký giấy và lớp mỏng (TLC)
- Sắc ký giấy là một kỹ thuật liên quan đến việc đặt một chấm nhỏ hoặc dòng dung dịch mẫu lên một dải giấy sắc ký. Giấy được đặt trong một thùng chứa với một lớp dung môi nông và niêm phong lại.
- Khi dung môi băng qua giấy, nó gặp hỗn hợp mẫu và bắt đầu di chuyển lên giấy với dung môi.
- Giấy này được làm từ celluose, một chất phân cực và các hợp chất trong hỗn hợp di chuyển xa hơn nếu chúng không phân cực. Nhiều chất phân cực liên kết với giấy cellulose nhanh hơn, do đó không đi xa được. Sắc ký lớp mỏng (TLC) là một kỹ thuật phòng thí nghiệm được sử dụng rộng rãi để phân tách các hóa sinh khác nhau trên cơ sở những điểm thu hút tương đối của chúng đối với pha tĩnh và pha động.
- Sắc ký bản mỏng. Thay vì sử dụng pha giấy cố định, nó bao gồm pha tĩnh của một lớp chất hấp phụ mỏng như silica gel, alumina hoặc cenllulose trên đế phẳng, trơn.
- TLC thích hợp cho các ứng dụng sàng lọc như kiểm tra nồng độ thuốc và độ tinh khiết của nước bởi khả năng nhiễm chéo thấp vì mỗi lần phân tách được thực hiện trên một lớp mới.
1.1.1.3 Sắc ký lọc gel - Gel-filtration chromatography
Trong sắc ký lọc gel (hay còn gọi là sắc ký rây phân tử), protein được phân tách theo trọng lượng phân tử. Pha rắn là các chất hạt tạo mạng lưới. Các protein trọng lượng thấp chảy qua khe các hạt theo hướng của dòng dung môi. Các protein có trọng lượng phân tử cao chảy quanh các hạt mà không tương tác với chất nền. Do đó, chúng qua cột chậm hơn đối với các protein nhỏ. Kết quả các protein được phân tách theo kích thước của chúng.
.jpg)
1.1.1.4 Sắc ký trao đổi ion – ion-exchange chromatography
Trong sắc ký trao đổi ion, các protein được phân tách theo sự khác biệt về điện tích của chúng. Các protein kiềm có điện tích dương liên kết ion với chất nền tích điện âm và protein có tính acid liên kết ion với chất nền tích điện dương. Mẫu được cho qua cột Nhựa trao đổi ion. Rửa các protein trong mẫu từ cột phụ thuộc vào việc tăng dần nồng độ muối của pha động, điều này làm suy yếu các tương tác ion và tạo điều kiện cho chúng di chuyển xuống. Do đó, các protein tương tác yếu sẽ ra đi ra khỏi cột trước.
.jpg)
1.1.1.5 Sắc ký ái lực – Affinity chromatography
Trong sắc ký ái lực, các protein được phân tách theo sự khác biệt về ái lực liên kết của chúng. Enzym, thụ thể và kháng thể có ái lực liên kết cao với các phối tử cụ thể. Khi một hỗn hợp protein được đưa qua cột được đóng gói bằng chất nền kết hợp phối tử, chỉ những protein liên kết với phối tử mới được giữ lại. Protein đích được rửa giải bằng dung dịch chứa chất hòa tan cạnh tranh vị trí liên kết của protein đích, tức là phối tử (hoặc chất tương tự của nó).
Một ví dụ phổ biến là tinh chế protein tái tổ hợp. Một chuỗi peptid xác định được gọi là epitope thường được gắn thêm các tín hiệu nhận biết. Protein tái tổ hợp có độ tinh khiết cao thu được bằng phương pháp sắc ký ái lực sử dụng các kháng thể đặc hiệu của epitop liên kết với chất nền. Các ví dụ khác bao gồm tinh chế protein dung hợp với protein huỳnh quang, protein liên kết carbohydrate hoặc protein liên kết kim loại.
.jpg)
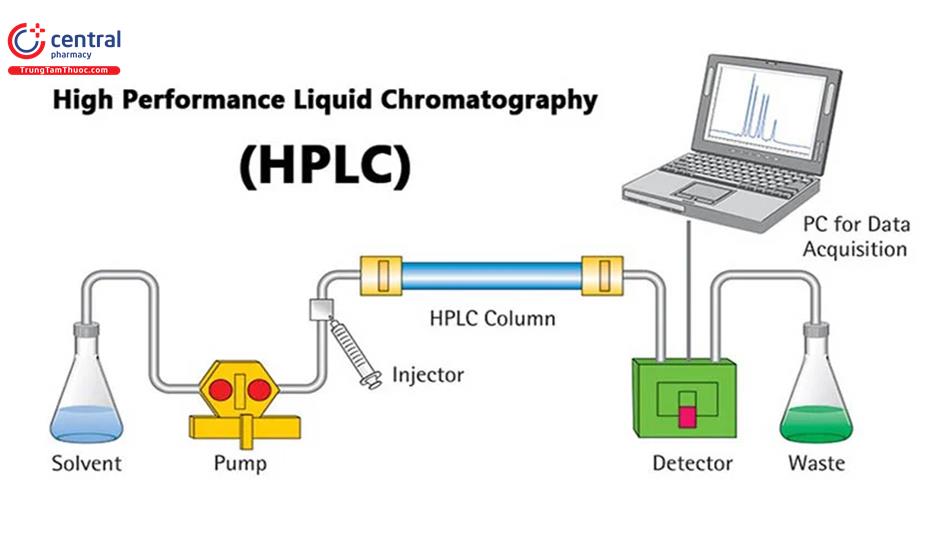
2 NGUYÊN LÝ PHƯƠNG PHÁP SẮC KÝ
Tùy thuộc vào loại phương pháp sắc ký sẽ có thành phần các pha động và pha tĩnh khác nhau, tuy nhiên, một hệ thống sắc ký sẽ gồm các thành phần chính: Pha động, pha tĩnh và hệ thống đọc kết quả (sắc đồ) (Hình 5).
Trong quá trình sắc ký, pha động mang mẫu đi qua (1) giường, (2) lớp, hoặc (3) cột chứa pha tĩnh. Khi các chất ở pha động chảy qua pha tĩnh, các chất tan có thể (1) chỉ cư trú trong pha tĩnh (không di chuyển), (2) chỉ cư trú trong pha động (di chuyển với pha động), hoặc (3) phân bố giữa hai pha (di chuyển khác biệt). Những chất tan có ái lực cao với pha tĩnh sẽ cư trú ở pha tĩnh và di chuyển chậm hơn những chất có ái lực thấp hơn, đi ra khỏi pha tĩnh sau. Những chất có ái lực thấp chủ yếu ở pha động và di chuyển nhanh hơn, đi ra khỏi pha tĩnh trước. Do đó, các chất tan có ái lực thấp sẽ tách biệt chất tan có ái lực cao hơn với pha tĩnh. Các chất tan có ái lực cao, liên kết mạnh sẽ được tách khỏi pha tĩnh nhờ vào các phản ứng thay đổi bản chất hóa học và vật lý của pha động.
.jpg)
Kết quả của quá trình sắc ký sẽ được biểu diễn bởi sắc đồ, mỗi peak của sắc đồ ứng với 1 hoặc 1 nhóm cấu tử của hỗn hợp cần tách. Các đỉnh này được mô tả theo thể tích hoặc thời gian lưu của đỉnh (tr- retension time) hoặc thể tích lưu (VR – retension volume) (1), (2) chiều rộng, (3) chiều cao và (4) diện tích. Thời gian lưu hoặc thể tích lưu của đỉnh có thể giúp xác định các hợp chất rửa giải, trong khi đó diện tích hoặc chiều cao của đỉnh được sử dụng để đo lượng chất phân tách. Chiều rộng của mỗi đỉnh phản ánh hiệu suất phân tách của hệ thống sắc ký. Đỉnh nhọn thì dễ đo và tạo ra các phát hiện tốt hơn so với đỉnh rộng.
3 ỨNG DỤNG CỦA PHƯƠNG PHÁP SẮC KÝ TRONG Y HỌC
Kỹ thuật sắc ký là một công cụ có giá trị trong hóa sinh, bên cạnh đó nó có thể được áp dụng dễ dàng trong thời gian nghiên cứu được thực hiện trong các phòng thí nghiệm lâm sàng. Ví dụ, sắc ký giấy được sử dụng để xác định một số loại đường và acid amin trong chất dịch cơ thể có liên quan đến rối loạn chuyển hóa di truyền. Sắc ký khí được sử dụng trong các phòng thí nghiệm để đo steroid, barbiturat và lipid. Kỹ thuật sắc ký cũng được sử dụng trong việc tách vitamin và protein và đặc biệt là định lượng HbA1c.
3.1 Định lượng HbA1c
3.1.1 Xét nghiệm HbA1c
Mục tiêu của quản lý bệnh đái tháo đường là duy trì nồng độ Glucose huyết tương trong hoặc gần ngưỡng cho phép.
Hemoglobin glycosyl hóa là thuật ngữ được sử dụng để mô tả sự hình thành hợp chất hemoglobin được tạo ra khi glucose (một loại đường khử) phản ứng với nhóm amin của hemoglobin (một loại protein). Phân tử glucose gắn không cần enzym vào phân tử hemoglobin để tạo thành một ketoamin. Tốc độ hình thành tỷ lệ thuận với nồng độ glucose huyết tương. Tế bào hồng cầu trung bình sống khoảng 120 ngày, mức hemoglobin glycosyl hóa tại thời điểm bất kỳ sẽ phản ánh mức glucose huyết tương trung bình từ 2 đến 3 tháng trước đó. Do đó, định lượng hemoglobin glycosyl hóa sẽ cung cấp thông tin về nồng độ glucose huyết tương trung bình trong 3 tháng trước của bệnh nhân giúp các bác sỹ lâm sàng quản lý bệnh nhân đái tháo đường tốt nhất.
Bảng 2. Mức tương quan giữa nồng độ glucose huyết tương và HbA1c
| Nồng độ glucose máu | HbA1c (%) |
| 65 mg/dL (3,5 mmol/L) | 4 |
| 100 mg/dL (5,5 mmol/L) | 5 |
| 135 mg/dL (7,5 mmol/L) | 6 |
| 170 mg/dL (9,5 mmol/L) | 7 |
| 205 mg/dL (11,5 mmol/L) 240 mg/dL (13,5 mmol/L) | 8 |
| 240 mg/dL (13,5 mmol/L) | 9 |
| 275 mg/dL (15,5 mmol/L) | 10 |
| 310 mg/dL (17,5 mmol/L) | 11 |
| 345 mg/dL (19,5 mmol/L) | 12 |
Hemoglobin AC (HbA1c), hemoglobin glycosyl hóa phổ biến nhất, được tạo ra do phân tử glucose gắn với một hoặc tất cả các vị trí N-terminal caline của chuỗi B polypeptid ở hemoglobin ở người lớn bình thường. HbA1c là một phương pháp đáng tin cậy hơn để theo dõi kiểm soát bệnh đái tháo đường lâu dài hơn so với glucose huyết tương ngẫu nhiên. Sử dụng mô hình hồi quy tuyến tính, Rohlfing và cộng sự xác định rằng cứ 1% thay đổi trong giá trị HbA1c, có sự thay đổi 35 mg/dL (2 mmol/L) trong glucose huyết tương trung bình (Bảng 11.1). Tuy nhiên, thông tin này cần được sử dụng cẩn trọng, vì trong nghiên cứu gần đây cho thấy mối liên quan giữa nồng đồ glucose huyết tương và HbA1c có thể thay đổi khác nhau phụ thuộc vào kiểm soát glucose máu của quần thể nghiên cứu. Hai yếu tố quan trọng cần lưu ý để xác định mức độ HbA1c: nồng độ glucose huyết tương và đời sống của hồng cầu. Nếu hồng cầu có đời sống ngắn vì các tình trạng bệnh lý khác nhau như bệnh lý về hemoglobin thì giá trị HbA1c sẽ thấp hơn.
Hiệp hội Đái tháo đường của Mỹ ADA (American Diabetes Association) khuyến cáo cần xét nghiệm HbA1c ít nhất 2 lần/năm với những bệnh nhân đái tháo đường giúp đạt được các mục tiêu điều trị và ổn định glucose huyết tương. Những bệnh nhân cần thay đổi điều trị hoặc không đạt mục tiêu điều trị, xét nghiệm HbA1c cần thực hiện 4 lần/năm. Giá trị HbA1c dưới 7% giúp giảm thiểu các biến chứng tim mạch, mắt và thận của bệnh đái tháo đường.
Định lượng HbA1c yêu cầu mẫu máu toàn phần trong ống chống đông bằng EDTA. Các phương pháp phân tích được chia thành 2 nhóm chính: (1) dựa trên sự khác biệt về điện tích giữa hemoglobulin glycosyl hóa và hemoglobulin không được glycosyl hóa (sắc ký trao đổi cation, điện di hoặc điện di tập trung đẳng điện) và (2) đặc điểm cấu trúc của nhóm glyco trong hemoglobin (sắc ký ái lực, miễn dịch và enzym).
Trong phương pháp sắc ký ái lực, hemoglobin được glycosyl hóa sẽ gắn với nhóm boronate của resin và rửa giải chọn lọc bằng dung dịch đệm. Phương pháp này không phụ thuộc vào nhiệt độ và không bị ảnh hưởng bởi hemoglobin S, F và C. Phương pháp khác được sử dụng là sắc ký trao đổi cation, trong đó các hemoglobin tích điện dương sẽ gắn vào các giường resin tích điện âm. Hemoglobin được glycosyl hóa được rửa giải chọn lọc từ giường resin bằng các dung dịch đệm có pH đặc biệt. Tuy nhiên, phương pháp này phụ thuộc vào nhiệt độ và bị ảnh hưởng bởi các bệnh lý về hemoglobin. Sự có mặt của hemoglobin F sẽ dẫn đến tăng HbA1c giả tạo, sự có mặt của hemoglobin S và C sẽ dẫn đến giảm HbA1c giả tạo. Phương pháp HbA1c trên thiết bị POCT dựa trên phương pháp ức chế ngưng kết miễn dịch latex, cả nồng độ HbA1c và tổng nồng độ hemoglobin đều được định lượng, và tỷ số được báo cáo là HbA1c. Trong phương pháp này, glycohemoglobin F sẽ không được đo, vì vậy nếu hemoglobin F cao (> 10%) thì lượng HbA1c sẽ thấp hơn dự kiến do kết quả bị nhiễu bởi hemoglobin F. Phương pháp sắc ký lỏng hiệu năng cao (HPLC) và điện di thường được sử dụng để phân tách các dạng khác nhau của hemoglobin. Với phương pháp HPLC, tất cả các dạng của hemoglobin được glycosyl hóa như A1a, A1b, và A1c đều được phân tách.
Việc chuẩn hóa cho xét nghiệm HbA1c tiếp tục gặp nhiều khó khăn, không có một sự đồng thuận về phương pháp tham chiếu và không có tiêu chuẩn đơn giản vào sẵn có sử dụng cho phương pháp đánh giá này. Giá trị HbA1c có thể thay đổi theo phương pháp và thực hành phòng xét nghiệm. Liên đoàn quốc tế về Hóa học lâm sàng và Phòng thí nghiệm y học IFCC đã phát triển một khái niệm chung cho HbA1c và một phương pháp tham chiếu đặc biệt giúp đo lường chỉ 1 loại phân tử A1c glycosyl hóa. Phương pháp này sử dụng HPLC khối phổ (HPLC/MS) hoặc HPLC điện di mao quản (HPLC-CE), chỉ sử dụng để chuẩn hóa HbA1c và không sử dụng để đo lường HbA1c trên lâm sàng. Gần đây, các nhóm đồng thuận quốc tế đã xác nhận rằng các kết quả HbA1c sẽ được công nhận trên toàn thế giới với đơn vị mmol/mol của IFCC và đơn vị % của Chương trình chuẩn hóa Glycohemoglobin quốc gia NGSP, sử dụng thuật toán quy đổi IFCC-NGSP [NGSP(%) = 0,09148 IFCC (mmol/l) + 2.152]. Nhà sản xuất thiết bị và hóa chất HbA1c được yêu cầu cung cấp các hồ sơ truy nguyên nguồn gốc đối với hệ thống tham chiếu IFCC với đơn vị mmol/mol (IFCC) và đơn vị dẫn xuất % (NGSP). Với những phát triển này, các phép đo HbA1c sẽ trở thành một chỉ số đáng tin cậy hơn giúp kiểm soát lượng glucose trong máu ở bệnh nhân đái tháo đường, mang tính nhất quán hơn về các kết quả giữa các phòng xét nghiệm.
| Các phương pháp dựa trên sự khác biệt về cấu trúc | ||
| Enzym | Enzym Protease phân cắt chuỗi Beta giải phóng các peptid. Các peptid thường là các dipeptid phản ứng với fructosyl peptid oxidase tạo thành hydro peroxid, định lượng bằng phương pháp đo quang để xác định nồng độ HbA1c | Không phát hiện được các biến thể của hemoglobin |
| Miễn dịch | Các kháng thể đơn dòng và đa dòng hướng tới nhóm N-terminal glycosyl hóa của chuỗi hemoglobin | Không phát hiện được các biến thể của hemoglobin |
| Sắc ký ái lực | Phân tách dựa trên cấu trúc hóa học sử dụng borat để liên kết với các protein glycosyl hóa | Không phụ thuộc nhiệt độ Không ảnh hưởng bởi các hemoglobin khác |
| Các phương pháp dựa trên sự khác biệt về điện tích | ||
| Sắc ký trao đổi ion | Giường resin tích điện | Phụ thuộc nhiệt độ Ảnh hưởng bởi các bệnh lý về hemoglobin |
| Điện di | Phân tách dựa trên sự khác biệt về điện tích | Giá trị hemoglobin F > 7% thì bị ảnh hưởng |
| Điện di tập trung đẳng | Loại điện di sử dụng điểm đẳng điện để phân tách | Ảnh hưởng bởi các pre-HbA1c |
| Sắc ký lỏng hiệu năng cao (HPLC) | Là 1 dạng của sắc ký trao đổi ion | Phân tách được tất cả các dạng hemoglobin glycosyl hóa: A1a, A1b, A1c. |
Phương pháp miễn dịch, enzym đã được mô tả kỹ ở bài trước. Phần này tập trung chủ yếu phân tích phương pháp sắc ký lỏng hiệu năng cao với nhiều ưu điểm và sử dụng phổ biến hiện nay.
3.1.1.1 Nguyên lý phương pháp
a. Nguyên lý hoạt động: Phương pháp sắc ký lỏng hiệu năng cao
Sắc ký lỏng hiệu năng cao (HPLC) là một dạng sắc ký lỏng cột được cải tiến, thay vì dung môi chảy dưới áp suất của trọng lực, dung môi chảy với áp suất cao lên tới 400 atm, làm tăng tốc độ chảy của dung môi pha động. HPLC hoạt động với nguyên tắc cơ bản: tách một mẫu gồm hỗn hợp thành phần thành các bộ phận cấu thành của nó dựa trên sự khác biệt về ái lực giữa các phân tử khác nhau với pha động và pha tĩnh được sử dụng trong quá trình tách.
Trong các máy HPLC dùng để định lượng HbA1c thường sử dụng phương pháp HPLC trao đổi ion. Pha tĩnh được phủ bởi các ion có điện tích trái dấu với ion trong mẫu. Pha động là các dung dịch đệm được kiểm soát pH và cường độ ion. Mẫu máu toàn phần được bộ tiêm mẫu đưa vào hệ thống, pha động gồm các chất rửa giải được bơm qua mẫu. Các tế bào hồng cầu được ly giải (pha động) sẽ được đi qua một lớp resin tích điện âm phủ lên bề mặt của cột HPLC (pha tĩnh). Các phân từ hemoglobin tích điện dương sẽ liên kết với các resin tích điện âm, vì vậy, các phân tử tích điện âm sẽ đi nhanh hơn. Các hemoglobin liên kết được giải phóng bởi các điều kiện dung môi khác nhau được bơm vào cột (ví dụ tăng hiệu ứng ion của hệ thống dung môi bằng cách tăng nồng độ muối của dung môi, tăng nhiệt độ cột, thay đổi pH của dung môi,...). Một sắc ký đồ thể hiện các thành phần rửa giải dưới dạng các đỉnh peak.
Trong phương pháp này đặc biệt chú ý đến chất lượng, loại và kích thước của hạt resin sử dụng trong cột. Vật liệu resin không xốp đã được chứng minh là một loại vật liệu cột hiệu quả trong phân tích HbA1c. Đối với máy sử dụng phương pháp HPLC phân tích HbA1c, ví dụ như máy Tosoh Automated Glycohemoglobin Analyzer HLC-723G8 sử dụng phương pháp sắc ký lỏng hiệu năng cao trao đổi ion cột resin không lỗ xốp.
3.1.1.2 Cấu tạo cơ bản của máy xét nghiệm
.jpg)
Các thành phần hệ thống HPLC:
- Bình dung môi: Đây là pha động của hệ thống, chứa các dung dịch rửa giải phân cực và không phân cực tùy thuộc vào thành phần của mẫu. Pha động trong HPLC cần có những yêu cầu:
+ Bền vững, không bị phân hủy trong quá trình chạy sắc ký.
+ Hòa tan được mẫu.
+ Có độ tinh khiết cao.
+ Có độ nhớt thấp và phù hợp với bộ phận detector (đầu dò tín hiệu).
- Bơm dung môi:
Bơm dung môi là một trong những thành phần quan trọng nhất của hệ thống HPLC. Bơm dung môi được phân loại thành máy bơm áp lực không đổi và máy bơm dòng chảy không đổi. Hiệu suất của bơm ảnh hưởng trực tiếp đến chất lượng toàn bộ hệ thống và độ tin cậy của kết quả phân tích.
- Bộ tiêm mẫu tự động:
Thiết bị lấy mẫu này được yêu cầu phải có độ kín tốt, thể tích chết nhỏ, độ lặp lại tốt để đảm bảo việc tiêm mẫu hiệu quả.
- Cột HPLC
Lựa chọn cột phải phù hợp với mẫu và mục đích phân tách. Cột HPLC nên duy trì nhiệt độ hằng định. Nếu nhiệt độ của cột bị thay đổi trong quá trình phân tách thì thời gian rửa giải sẽ bị thay đổi, dẫn đến kết quả phân tách không phù hợp. Nhiệt độ phân tích nên được lựa chọn dao động giữa 25 – 50°C là phù hợp.
- Bộ phận chất thải.
- Đầu dò tín hiệu yêu cầu độ nhạy cao, độ lặp lại tốt.
- Xử lý số liệu giúp thu thập, lưu trữ, hiển thị, in và xử lý số liệu sau phân tách.
3.1.1.3 Các yếu tố ảnh hưởng của các thành phần cấu tạo máy đến chất lượng xét nghiệm
Một số lỗi khiến sắc ký đồ bất thường: Sắc ký đồ bất thường thường đặc trưng bởi sự hiện diện 1 đỉnh không xác định, hình dạng biến dạng đỉnh, xác định sai 1 số loại hemoglobin. Cần phải xem xét các kết quả sắc ký đồ để xác định xem kết quả chính xác hay do lỗi phân tích. Sự cố do trục trặc của hệ thống như máy bơm, bộ phận tiêm mẫu, cột sử dụng thời gian dài hoặc thuốc thử đặt không chính xác hoặc sắp hết.
- Bình dung môi:
+ Sử dụng quá hạn dung dịch rửa giải.
+ Gắn nắp bình dung môi với hệ thống lỏng.
+ Hết dung dịch dung môi chưa thay thế, hút sẽ bị bọt.
- Bơm dung môi:
+ Máy phân tích không sử dụng trong thời gian dài sẽ dẫn tới không khí có thể lọt vào trong bình dung môi dẫn đến bơm không ổn định áp suất, sắc ký đồ không xác định được loại hemoglobin. Nếu gặp trường hợp này tiến hành mồi thủ công các dung dịch rửa giải.
+ Sensor của máy bị hỏng.
- Cột HPLC:
+ Máy đang hoạt động bị lỗi dừng máy đột ngột, mẫu vẫn còn trong cột, vì vậy, nếu để mẫu trong cột sẽ gây hỏng cột, giảm tuổi thọ của cột nên cần tiến hành rửa lại cột.
+ Nhiệt độ của cột không ổn định
+ Cần thay thế cột trong các tình huống sau:
+ Khi áp suất trong cột lớn hơn +4 Mpa và áp suất không giảm bằng cách thay thế bộ lọc.
+ Khi các peak trên sắc ký đồ bị rộng hoặc chia thành 2 phần.
+ Khi mẫu QC ngoài dải nhất quán mặc dù đã tiến hành calibration.
+ Khi lỗi calibration liên tục xảy ra.
+ Quá hạn sử dụng
- Bộ phận chất thải: Chất lỏng thải bị rò rỉ: ngay lập tức tắt máy phân tích, rút dây nguồn, kiểm tra kết nối giữa các ống, cột.
- Đầu dò tín hiệu và bộ xử lý số liệu:
+ Dữ liệu đầy.
+ Lỗi kết nối với màn hình, với máy chủ.
+ Diện tích peak quá thấp không đạt đến diện tích tối thiểu: cần kiểm tra lại
mẫu, dung môi buffer, dung dịch rửa.
3.2 Hoá học DNA
Sắc ký giấy trong thực tế là một phương pháp cực kỳ đơn giản. Chỉ cần một giọt nhỏ vật liệu cần kiểm tra được đặt khoảng 5 cm từ mép của một tờ giấy lọc hình chữ nhật và được để khô ở đó. Cạnh của giấy sau đó được nhúng vào một dung môi thích hợp, vật chất sẽ mao dẫn lên giấy. Khi chất lỏng đi qua điểm tương ứng cho mỗi hợp chất hóa học kéo theo chất lỏng với tốc độ đặc trưng của chất đó. Bằng cách sử dụng kỹ thuật này, một hỗn hợp các chất được áp dụng cho cùng một điểm có thể được tách ra khỏi nhau trên giấy lọc trong vài giờ vì chúng di chuyển với chất lỏng ở tốc độ khác nhau.
Ví dụ: nếu hỗn hợp A, G, C và T được cho vào tại một điểm và dung môi lỏng là rượu butyl đi qua nó, bốn chất sẽ tách ra khỏi nhau trong khoảng 18 giờ. Thymine di chuyển nhanh nhất, tiếp theo là cytosine, Adenine và guanine.
3.3 Xác định carbohydrate
Kỹ thuật sắc ký lỏng khí được sử dụng rộng rãi, đặc biệt là trong phân tích các polysaccarit trong thành tế bào thực vật và trong đo lường NSP.
Sắc ký lỏng cao áp (HPLC) giúp phân tách của tất cả các monosaccarit, disaccarit và oligosaccarit. Ban đầu các cột carbohydrate chưa ổn định nhưng sau đó đã tốt hơn. Các hệ thống ban đầu sử dụng chỉ số khúc xạ nhưng chúng không nhạy lắm và các hệ thống sau này đo cường độ xung đã vượt qua nhược điểm này.
.jpg)
3.4 Định danh một số hợp chất, tá dược
Tách và phát hiện vitamin bằng cách sử dụng sắc ký giấy với dung môi đệm. Các vitamin tan trong nước được tách thành công có thể được định vị sau khi áp dụng một thứ tự chọn lọc của các tác nhân phát hiện. Đối với các vitamin tan trong chất béo, các giá trị Rf và màu thu được với các tác nhân phát hiện thu được để xác định riêng lẻ Vitamin A, menadione và Biotin.
Các vitamin tan trong chất béo (A2, D3, E, K1 và K3) có thể được xác định trong thực phẩm bằng cách áp dụng sắc ký lỏng kết hợp với phép đo khối phổ (MS).
Kết hợp chiết chất lỏng siêu tới hạn (SFE) và sắc ký dịch siêu tới hạn (SFC) đã được có thể xác định vitamin K trong huyết thanh người.
HPLC có thể xác định đồng thời các vitamin tan trong chất béo bao gồm menadione và menaquinone trong chất lỏng sinh học như huyết thanh và nước tiểu.
.jpg)
3.5 Xác định các peptid
Sắc ký giấy và sắc ký lớp mỏng thường được sử dụng để tách các peptide, đặc biệt đối với các phân số được phân lập bằng sắc ký thẩm thấu gel (GPC) và sắc ký trao đổi ion (IEC), nhưng chúng là các quy trình dài, tốn thời gian với công suất phân giải thấp và khả năng tái lập thấp.
Sắc ký lọc gel trên các cột Sephadex mở với các kích thước lỗ khác nhau (G- 10, G-25 và G-50) sử dụng dung dịch đệm nước hoặc nước muối hoặc acid làm dung môi được sử dụng rộng rãi trong phân đoạn peptide. Việc phát hiện được thực hiện bằng cách đo độ hấp thụ của cột rửa giải bằng máy dò tia cực tím ở bước sóng 280nm, bước sóng hấp thụ đối với tyrosine và tryptophan, hoặc ở bước sóng 214nm, bước sóng hấp thụ đối với hầu hết các acid amin và liên kết peptide.
Các peptide nhỏ cần được tách ra khỏi các acid amin bằng lọc gel trên các cột hydroxypropylation (Sephadex LH-20), cột trao đổi ion trên diethylaminoethyl (DEAE) -cellulose hoặc DEAE-Sephadex với các phức Cu2+, hoặc các cột trao đổi phối tử với pha tĩnh được thay đổi với Cu2+. Sắc ký trao đổi ion trên DEAE-cellulose hoặc Aminex A-5 thường được sử dụng để tách các peptide có trọng lượng phân tử cao, sử dụng dung dịch đệm làm nước muối. Các phương pháp này hiện nay thường được sử dụng làm kỹ thuật chuẩn bị cho phương pháp sắc ký lỏng hiệu năng cao (HPLC) hoặc phân tích điện di của các phân số peptide.
3.6 Bệnh huyết sắc tố
3.6.1 Thang màu huyết sắc tố
Mẫu máu chích từ ngón tay được ngâm trong giấy sắc ký đặc biệt, được so sánh với các mẫu đã biết về nồng độ hemoglobin ở dạng kỹ thuật số chất lượng cao. Các màu được thể hiện với mức tăng 20 g/L từ 40 g/L đến 140 g/L. Phương pháp này không tốn kém, không đòi hỏi nhiều kinh nghiệm, bền trong điều kiện bụi, nóng, khô và ẩm ướt và có lẽ tốt hơn chẩn đoán lâm sàng để phát hiện mức độ thiếu máu nhẹ và trung bình. Nhược điểm là nó đòi hỏi giấy sắc ký cụ thể và ánh sáng tự nhiên tốt và nó không thể phát hiện ra những thay đổi trong huyết sắc tố dưới 10 g/L.
4 Tải liệu tham khảo
1. PGS. TS. BS. Đặng Thị Ngọc Dung, TS. Nguyễn Trọng Tuệ (2023). “Phương pháp sắc ký”. Kỹ thuật và thiết bị xét nghiệm y học. Nhà xuất bản y học, trang 201-216. Tải bản pdf tại đây.
2. Hướng dẫn sử dụng máy phân tích HbA1c Tosoh 723-G8.
3. Hướng dẫn sử dụng máy phân tích HbA1c Tosoh 723-GX.
4. Joanna Kałużna-Czaplińska (2011). Current medical research with the application of coupled techniques with mass spectrometry, Med Sci Monit.
5. Carl A. Burtis PhD, David E. Bruns MD (2015). Tietz Fundamentals of Clinical Chemistry and Molecular Diagnostic, 7th Edition, Elsevier.
6. Cas Weykamp, Ph.D (2013). HbA1c: A Review of Analytical and Clinical Aspects, Ann Lab Med;33:393-400.

