Quá trình tiến triển của tế bào gây ung thư niêm mạc tử cung ở phụ nữ
Đại học Huế - Trường ĐH Y Dược
Đồng chủ biên
GS.TS. Nguyễn Vũ Quốc Huy
GS.TS. Cao Ngọc Thành
PGS.TS. Lê Minh Tâm
PGS.TS. Trương Thành Vinh
Cùng nhiều tác giả tham gia biên soạn.
1 Phần 1. QUÁ SẢN NIÊM MẠC TỬ CUNG
1.1 ĐẠI CƯƠNG
Quá sản niêm mạc tử cung đặc trưng bởi sự tăng sinh của các tuyến niêm mạc với hình dạng và kích thước bất thường tỷ lệ tuyến/mô đệm tăng rõ (> 50%), thường là hệ quả của tác động kích thích của estrogen không được đối kháng bởi progesteron.
1.2 CÁC YẾU TỐ NGUY CƠ
Các yếu tố nguy cơ của quá sản niêm mạc tử cung cũng chính là yếu tố nguy cơ của ung thư niêm mạc tử cung. Đa số các yếu tố nguy cơ này đến từ việc niêm mạc tử cung chịu tác động liên tục bởi estrogen có thể có nguồn gốc nội sinh hoặc ngoại sinh, mà không có progestin đối kháng. Bên cạnh đó phụ nữ có hội chứng Lynch có nguy cơ quá sản niêm mạc tử cung cao.
Yếu tố | Nguy cơ tương đối (RR) | |
Liệu pháp estrogen không đối kháng | 2-10 | |
Liệu pháp Tamoxifen | 2 | |
Mãn kinh muộn (> 55 tuổi) | 2 | |
Không sinh con | 2 | |
Hội chứng buồng trứng đa nang | 3 | |
Đái tháo đường | 2 | |
Béo phì | Loại I | Loại II |
BMI 25-30 kg/m2 | 1,5 | 1,2 |
BMI 30-35 kg/m2 | 2,5 | 1,7 |
BMI 35-40 kg/m2 | 4,5 | 2,2 |
BMI > 40 kg/m2 | 7,1 | 3,1 |
Hội chúng Lynch | Nguy cơ trọn đời 22-50% | |
Hội chủng Cowden (mất chức năng gen PTEN - phosphatase and tensin homolog) | Nguy cơ trọn đời 13-19% | |
1.3 PHÂN LOẠI MỎ BỆNH HỌC
Tổ chức Y tế Thế giới (WHO: World Health Organization) năm 2014 phân quá sản niêm mạc tử cung thành 2 loại:
Quả sản niêm mạc tử cung điển hình (Hyperplasia without atypia) (không tấn sinh).
Quả sản niêm mạc tử cung không điển hình (Atypical endometrial hyperplasias) hay còn gọi tân sinh trong biểu mô niêm mạc tử cung (Endometrial Intraepithelial Neoplasia – EIN).
Tân sinh trong biểu mô niêm mạc tử cung là một thuật ngữ được giới thiệu để phân biệt rõ hơn hai loại tăng sản khác nhau về mặt lâm sàng. Phân loại chia quá sản niêm mạc thành 2 nhóm: lành tính và tân sinh trong biểu mô.
Quá sản lành tính (không tân sinh): Thường do các nguyên nhân gây kích thích liên tục bởi estrogen, còn được gọi là “quá sản tuyến nang", "quá sản nhẹ" hoặc "quá sản đơn giản”.
Tân sinh trong biểu mô niêm mạc: là tổn thương tiền ung thư niêm mạc, phần mô đệm còn lại ít hơn 1/2 thể tích niêm mạc ở giai đoạn không chế tiết, tế bảo thường đồng nhất về hình thái và phân biệt rõ với mô niêm mạc bình thường xung quanh.
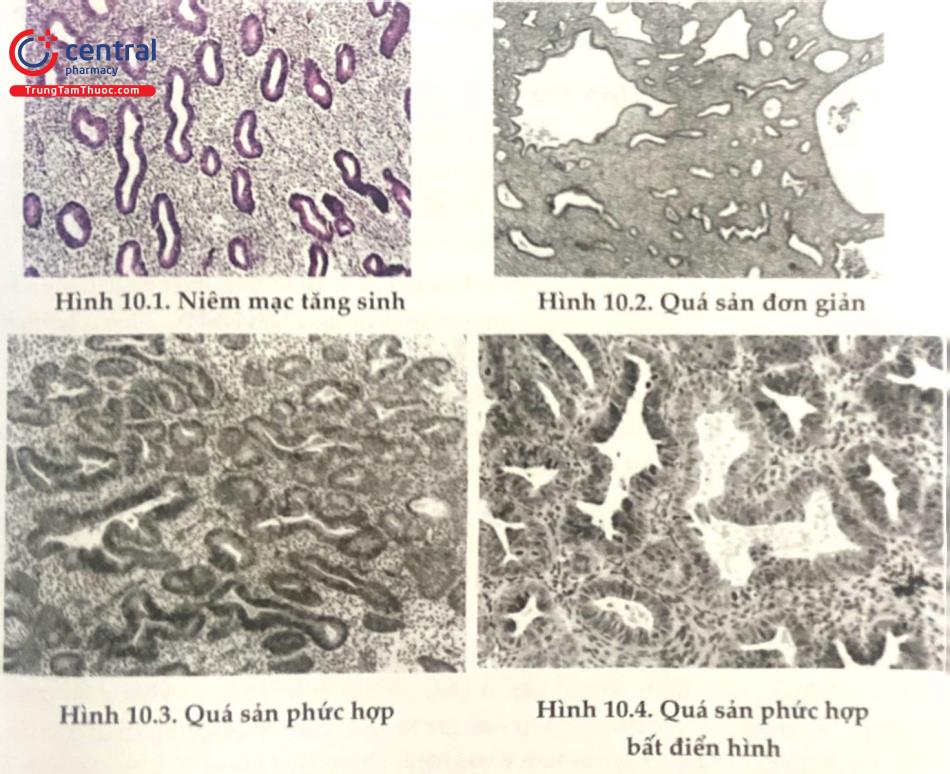
Trước đây, WHO năm 1994 phân chia quá sản niêm mạc tử cung thành 4 loại:
Quá sản niêm mạc tử cung điển hình:
(1) Quá sản đơn giản
(2) Quá sản phức tạp
Quá sản niêm mạc tử cung không điển hình:
(3) Quá sản đơn giản không điển hình
(4) Quá sản phức tạp không điển hình
Phân loại | Thay đổi di truyển | Nguy cơ cùng hiện diện carcinoma | Diễn tiến thành ung thư biểu mô niêm mạc tử cung |
Quá sản niêm mạc tử cung điển hình | Ít thay đổi | 1-5% | RR: 1,01 -1,03 |
Quá sản niêm mạc tử cung không điển hình | Nhiều đột biến đặc trưng ung thư dạng niêm mạc tử cung | 25-33% (2) 59% (1) | RR: 14-15 |
Phân loại | Nguy cơ tiến triển ung thư |
Quá sản đơn giản (Simple hyperplasia) | 1% |
Quá sản phức tạp (Complex hyperplasia) | 3% |
Quá sản đơn giản không điển hình (Simple atypical hyperplasia) | 8% |
Quả sản phức tạp không điển hình (Complex atypical hyperplasia) | 30% |
Quá sản niêm mạc đơn giản có nguy cơ tiến triển thành ung thư thấp, <1%. Nhóm quá sản phức hợp không có bất điển hình tế bào và không cắt tử cung có nguy cơ tích lũy tiến triển < 5%. Nguy cơ tiến triển thành ung thư niêm mạc ở nhóm quá sản bất điển hình là 15 – 28%, theo một nghiên cứu theo dõi trong vòng 20 năm, lưu ý nhiều phụ nữ trong nghiên cứu này được chỉ định liệu pháp Frogestin đường uống.
1.4 TRIỆU CHỨNG VÀ CHẨN ĐOÁN
Chảy máu bất thường từ tử cung (Abnormal Uterine Bleeding - AUB) là triệu chúng thường gặp, xảy ra ở phụ nữ quanh mãn kinh hoặc giai đoạn sớm sau mãn kinh. Ở phụ nữ không có triệu chứng ra máu, đôi khi quá sản niêm mạc tử cung được phát hiện thông qua tế bào tuyến niêm mạc bất thường trên phiến đồ cổ tử cung.
Quá sản là một chẩn đoán mô học, hay nói cách khác sinh thiết hoặc nong và nào niêm mạc là “tiêu chuẩn vàng” trong chẩn đoán quá sản niêm mạc tử cung. Ngoài ra quá sản niêm mạc tử cung còn có thể được chẩn đoán qua bệnh phẩm cắt tử cung. Liên đoàn Sản Phụ khoa Hoa Kỳ 2016 khuyến cáo sinh thiết hoặc nạo niêm mạc tử cung làm mô bệnh học với phụ nữ trên 45 tuổi có triệu chứng chảy máu bất thường từ tử cung hoặc những người dưới 45 tuổi, sử dụng estrogen quá mức và kéo dài (ngoại sinh hoặc nội sinh), chảy máu bất thường từ tử cung kéo dài.
Đối với các trường hợp chảy máu bất thường từ tử cung, siêu âm đầu dò âm đạo đánh giá độ dày niêm mạc tử cung cũng có thể tiên đoán quá sản niêm mạc tử cung. Đối với các trường hợp phụ nữ sau mãn kinh có chảy máu bất thường từ tử cung, nếu nội mạc dưới 4mm có liên quan đến chảy máu được cho là do teo niêm mạc tử cung (ACOG). Đôi khi độ dày niêm mạc tử cung trên 4mm có thể gặp ở phụ nữ sau mãn kinh và không có triệu chứng chảy máu, với các trường hợp này giá trị tiên đoán dương tính thấp. Do đó, việc sử dụng giá trị ngưỡng cao hơn ở các bệnh nhân này là hợp lý. Theo Hiệp hội Sản Phụ khoa Canada (SOGC: The Society of Obstetrics and Gynecology of Canada) đề nghị giá trị ngưỡng là 11mm.
Đối với phụ nữ trước mãn kinh, siêu âm giúp đánh giá các bất thường cấu trúc gây chảy máu bất thường như polyps, u xơ tử cung...Với độ tuổi này, độ dày niêm mạc tử cung thay đổi đáng kể theo chu kỳ kinh nguyệt. Từ các nghiên cứu, gợi ý ngưỡng bất thường nằm trong khoảng 4-16mm và các chuyên gia đồng thuận không xác định ngưỡng dày niêm mạc tử cung. Do đó, để loại trừ ung thư niêm mạc tử cung, sinh thiết niêm mạc tử cung được ưu tiên thực hiện cho những trường hợp phụ nữ trước mãn kinh có siêu âm nguy cơ cao và AUB.
Nội soi buồng tử cung có độ nhạy cao hơn đối với các tổn thương niêm mạc tử cung khu trú. Đối với quá sản niêm mạc tử cung hoàn toàn, nội soi buồng tử cung có độ nhạy kém hơn.
Ngoài ra, xét nghiệm tế bào cổ tử cung (nếu chưa làm) và xét nghiệm vi sinh âm đạo để loại trừ các nguyên nhân nhiễm trùng. Xét nghiệm nội tiết tố: T3, T4, prolactin, androgen, FSH, LH, estrogen.
1.5 ĐIỀU TRỊ
Quản lý phụ nữ quá sản niêm mạc tử cung chủ yếu phụ thuộc vào độ tuổi của bệnh nhân, nguy cơ phẫu thuật, mong muốn sinh sản và các đặc điểm mô học cụ thể. Ba phương pháp xử trí chính bao gồm theo dõi, liệu pháp nội tiết tố và cắt tử cung. Cắt tử cung là phương pháp điều trị dứt điểm nhất. Liệu pháp nội tiết tố bao gồm progestin uống hoặc tiêm, vòng tránh thai progestin (phóng thích Levonorgestrel).
Đi kèm với các phương pháp trên cần loại bỏ nguồn estrogen nội sinh hoặc ngoại sinh không được đối kháng bởi progestin như các thuốc bôi trên da, thuốc không kê đơn có chứa estrogen, điều chỉnh rối loạn chức năng buồng trứng (không phóng noãn) như hội chứng buồng trứng đa nang, cường prolactin máu, thực hành giảm cân, cắt bỏ khối u tiết estrogen. Ngoài ra, đối với phụ nữ thừa cân và béo phì, Metformin có tác dụng chống tăng sinh cũng như giảm đề kháng Insulin nên đã được dùng cho quá sản niêm mạc tử cung.
1.5.1 Quá sản niêm mạc tử cung điển hình
Phụ nữ trước mãn kinh: Tổn thương không điển hình có thể tự thoái triển mà không cần điều trị. Tuy nhiên, progestins nói chung có thể được sử dụng để giải quyết căn nguyên cơ bản, đó là dư thừa estrogen và không rụng trứng kéo dài. Liệu pháp progestin liều thấp 3-6 tháng. Cyclic medroxyprogesterone acetate (MPA) (Provera) uống trong chu kỳ 12-14 ngày mỗi tháng với liều 10-20mg/ngày hoặc dùng MPA 10mg/ngày liên tục (phù hợp và có thể hiệu quả hơn dùng theo chu kỳ). Có thể sử dụng thuốc tránh thai phối hợp (COC: Combination Oral Contraceptive) cho các trường hợp không có chống chỉ định. Vòng tránh thai phóng thích Levonorgestrel cũng cho thấy có hiệu quả.
Phụ nữ sau mãn kinh: Có thể điều trị với MPA đường uống liều thấp theo chu kỳ hoặc 10mg/ngày liên tục. Quá sản phức tạp không có bất điển hình thường được điều trị bằng progestins kéo dài. Sinh thiết niêm mạc tử cung được khuyến cáo mỗi 3-6 tháng.
Đáp ứng với Progestins: Trong trường hợp quá sản niêm mạc tử cung điển hình, nguy cơ tiến triển UTniêm mạc tử cung là thấp (1-3%). Tỷ lệ thoái triển về mặt lâm sàng và bệnh học đối với liệu pháp progestin khoảng từ 70-80%. Nếu quá sản tồn tại dai dẳng hoặc sinh thiết niêm mạc được lặp đi lặp nhiều lần có thể chuyển sang phác đồ liều cao hơn ví dụ MPA 40-100mg/ngày đường uống. Ngoài ra, Megestrol acetate (Megace) 160mg/ngày hoặc 80mg x 2 lần/ngày có thể phù hợp. Đánh giá sinh thiết niêm mạc tử cung sau một khoảng thời gian điều trị từ 3-6 tháng. Phẫu thuật cắt tử cung xâm lấn tối thiểu (MIS: minimally invasive surgery) như cắt tử cung qua nội soi hoặc qua đường âm đạo cân nhắc trong trường hợp không đáp ứng với liệu pháp nội tiết.
1.5.2 Quá sản niêm mạc tử cung không điển hình
Phẫu thuật cắt tử cung thích hợp hợp đối với các trường hợp quá sản niêm mạc tử cung không điển hình vì nguy cơ tiến triển ung thư theo thời gian khoảng 29%. Tỷ lệ phát hiện bệnh ác tính xâm lấn đồng thời cùng với quá sản không điển hình cũng rất đáng kể. Ở phụ nữ sau mãn kinh, khuyến cáo nên cắt tử cung với cắt 2 vòi tử cung và buồng trứng.
Ở phụ nữ trước mãn kinh và không có nguyện vọng sinh sản, có thể cân nhắc phẫu thuật cắt tử cung và phẫu thuật cắt 2 vòi tử cung được khuyến cáo thực hiện để giảm nguy cơ ung thư phát sinh từ vòi tử cung (ACOG 2019), việc cắt bỏ buồng trứng không bắt buộc. Đối với phụ nữ trước mãn kinh có mong muốn sinh, có thể điều trị bằng progestin. Liệu pháp progestin liều cao, megestrol acetate 80mg * 02 lần/ngày đường uống. Vòng tránh thai phóng thích 20 pg levonorgestrel cũng phù hợp.

2 Phần B. UNG THƯ NIÊM MẠC TỬ CUNG (ENDOMETRIAL CANCER)
Ung thư niêm mạc tử cung là ung thư xâm lấn thường gặp nhất của đường sinh dục nữ. Khoảng 2 – 3% phụ nữ có nguy cơ hình thành ung thư niêm mạc tử cung trong cuộc đời của họ. Khoảng 97% ung thư thân tử cung hình thành từ các tuyến niêm mạc và được gọi là ung thư niêm mạc tử cung, 3% còn lại đến từ mô cơ – đệm và được xếp vào nhóm sarcoma. Ở các quốc gia đang phát triển, ung thư niêm mạc tử cung xếp thứ ba trong số các ung thư phụ khoa, sau ung thư vú và ung thư cổ tử cung. Bệnh nhân thông thường có triệu chứng chảy máu bất thường từ tử cung, đặc biệt là chảy máu sau mãn kinh. Nếu được chẩn đoán sớm thì tiên lượng tốt.
2.1 YẾU TỐ NGUY CƠ
Estrogen không bị đối kháng (Unopposed estrogen therapy): Việc sử dụng Estrogen liên tục làm tăng nguy cơ ung thư niêm mạc tử cung đã được công nhận trong nhiều thập kỷ qua. Hiện nay, hiếm gặp một phụ nữ uống estrogen đơn thuần trong nhiều năm, mà thay vào đó, liệu pháp thay thế nội tiết tố (HRT: hormonal replacement therapy) estrogen kết hợp với progestin thường được chỉ định cho phụ nữ mãn kinh để giảm nguy cơ ung thư niêm mạc tử cung liên quan đến estrogen. Estrogen không bị đối kháng (nồng độ estrogen cao so với không có hoặc nồng độ thấp của progesterone) có thể liên quan đến béo phì, hội chứng buồng trứng đa nang, vô sinh, mãn kinh muộn, khối u sinh estrogen, không phóng noãn (rối loạn chức năng phóng noãn) và liệu pháp estrogen mà không có progesterone.
Béo phì: Là nguyên nhân phổ biến nhất của việc sản xuất quá mức estrogen nội sinh. Mô mỡ dư thừa làm tăng quá trình thơm hóa ngoại vi của androstenedione thành estrone. Ở phụ nữ tiền mãn kinh, nồng độ estrone tăng cao gây ra feedback bất thường trong trục dưới đồi - tuyến yên - buồng trứng. Kết quả là không rụng trứng (oligo hoặc anovulation), nội mạc tử cung tiếp xúc với sự kích thích của estrogen gần như liên tục.
Kinh nguyệt và sinh sản: Thường liên quan đến ung thư niêm mạc tử cung. Ví dụ, tuổi mãn kinh sớm hoặc tuổi mãn kinh muộn đều có nguy cơ ung thư cao hơn. Theo cổ điển, phụ nữ mắc hội chứng buồng trứng đa nang thường không có rụng trứng và do đó cũng có nguy cơ phát triển ung thư cao hơn.
Lớn tuổi: Có mối liên quan đến sự phát triển ung thư niêm mạc tử cung. Độ tuổi trung bình được chẩn đoán là 60 tuổi và khoảng 80% các trường hợp được chẩn đoán ở phụ nữ sau mãn kinh trên 55 tuổi. Từ cơ sở dữ liệu SEER (2018), khoảng 7% trường hợp ung thư niêm mạc tử cung dưới 45 tuổi. Nevadunsky và cộng sự (2014) cho rằng độ tuổi được chẩn đoán ung thư niêm mạc tử cung giảm một cách tuyến tính khi chỉ số khối cơ thể (BMI: Body mass index) tăng lên.
Tiền sử gia đình: là biểu hiện phổ biến nhất bên ngoài đường tiêu hóa của hội chứng Lynch hay còn gọi là ung thư đại trang di truyền không phát sinh polyp (Hereditary non-polyposis colorectal cancer, HNPCC). Hội chứng là một rối loạn di truyền trội trên nhiễm sắc thể thưởng chủ yếu do đột biến các gen sửa chữa MLHJ, MSH2, MSH6 và PMS2. Người mang gen đột biến này có nguy cơ phát triển UTniêm mạc tử cung dao động từ 40-60%, thường gặp ở người trẻ tuổi và phát triển sớm hơn 10 năm so với các trường hợp ung thư niêm mạc tử cung khác.
Liệu trình tamoxifen liều cao kéo dài: Tamoxifen là một hợp chất không steroid hoạt động bằng cách cạnh tranh với estrogen tại các thụ thế estrogen, được dùng nhiều trong ung thư vú. Tamoxifen tăng nguy cơ ung thư niêm mạc tử cung cao gấp 2-7 lần. Nguy cơ gia tăng hầu như chỉ ảnh hưởng đến phụ nữ sau mãn kinh và tỷ lệ ung thư tăng tuyến tính theo thời gian và liều lượng tích lũy của liệu pháp tamoxifen. Do đó, phụ nữ dùng tamoxifen được tư vấn về nguy cơ ung thư niêm mạc tử cung và được khảo sát niêm mạc tử cung thường quy, tư vấn về các dấu hiệu ra máu âm đạo, tiết dịch để phát hiện sớm hơn.
Ngược lại, sử dụng thuốc tránh thai kết hợp (COC) ít nhất 1 năm làm giảm nguy cơ ung thư niêm mạc tử cung từ 30-50% và kéo dài từ 10-20 năm. Dụng cụ tử cung chứa Progesterone cũng có tác dụng bảo vệ lâu dài ung thư niêm mạc tử cung.
| Yếu tố nguy cơ | Nguy cơ tương đối |
Sử dụng estrogen liều cao dài hạn trong liệu pháp hậu mãn kinh | 10-20 |
Cư dân vùng Bắc Mỹ, Bắc Âu | 3-18 |
Liệu trình tamoxifen liễu cao kéo dài | 3-7 |
Hội chứng buồng trứng đa nang hoặc u chế tiết estrogen | > 5 |
Béo phì | 2-5 |
Không sinh con | 3 |
Tuổi lớn | 2-3 |
Tiền sử vô sinh | 2-3 |
Mãn kinh muộn | 2-3 |
Dậy thì sớm | 1.5-2 |
2.2 CƠ CHẾ BỆNH SINH
Các cơ chế phân tử trong ung thư bao gồm thay đổi bộ gen quy mô lớn cũng như đột biến trong các gen/con đường cụ thể. Đó là sự mất ổn định vi vệ tinh (Microsatellite instability - MSI) hoặc mất ổn định nhiễm sắc thể (thay đổi số lượng bản sao DNA). MSI được báo cáo trong khoảng 20% ung thư niêm mạc tử cung loại I ở tất cả các loại, tuy nhiên phần lớn ung thư biểu mô niêm mạc tử cung không biểu hiện MSI nên đầy không phải là đặc điểm cần thiết trong ung thư biểu mô.
Sự thay đổi di truyền phổ biến nhất trong ung thư niêm mạc tử cung loại I là bất hoạt PTEN với tỷ lệ cao nhất là 83%. Đột biến trong KRAS gây ra kích hoạt bất thường có liên quan tới 10-30% ung thư niêm mạc tử cung loại I. Tăng đột biến chức năng ở exon 3 của gen CTNNB1 (ß-catenin) cũng được quan sát thấy ở 25-38% ung thư loại I.
Trái ngược với những thay đổi di truyền phổ biến đã được trình bày ở trên, sự tích lũy bất thường của protein p53 không hoạt động được quan sát thấy chỉ trong 5% bệnh ung thư niêm mạc tử cung loại I. Hơn nữa, cơ chế bất hoạt p53 khác nhau giữa các khối u loại I và II; trong khối u loại I, sự tích lũy p53 là do sự thay đổi của protein điều hòa ngược dòng, chẳng hạn như MDM2 và p14 ARF, trong khi khối u loại II thường có đột biến cắt p53. Ung thư niêm mạc tử cung loại II chứng minh sự mất ổn định di truyền ở cấp độ nhiễm sắc thể dẫn đến mức độ dị hợp cao trong khi vẫn duy trì sửa chữa sai lệch DNA nguyên vẹn. Khiếm khuyết di truyền nguyên phát là đột biến gen p53 được quan sát thấy ở 75-100% khối u.
.jpg)
Các tổn thương tiền ung thư loại I hay còn gọi là tân sản trong biểu mô niêm mạc (EIN) được cho là phát sinh từ ung thư tiềm ẩn, hay còn gọi là tuyến niêm mạc tử cung xuất hiện đột biến PTEN. Đột biến PTEN có thể được phát hiện bằng nhuộm hóa mô miễn dịch trong các trường hợp không thể phát hiện được bằng phương pháp chẩn đoán mô bệnh học thông thường. Tần suất xuất hiện của ung thư tiềm ẩn thiếu PTEN là rất phổ biến, xảy ra ở 43% phụ nữ tiền mãn kinh. Bất hoạt PTEN xảy ra sớm trong ung thư biểu mô niêm mạc tử cung loại I, trước khi có bất kỳ thay đổi mô học nào có thể phát hiện được. Các ung thư biểu mô thanh dịch (loại II) ban đầu được quan sát là ung thư nội biểu mô thanh dịch (Endometrial intraepithelial carcinoma EIC). Loạn sản tuyến nội mạc tử cung (Endometrial glandular dysplasia - EGD) là khối tổn thương mới được mô tả với bất hoạt p53 và mô học là trung gian giữa nội mạc bình thường và ung thư nội biểu mô thanh dịch. Sự tiến triển của các tổn thuong loạn sản tuyến niêm mạc tử cung theo thời gian vẫn chưa được xác định có phải các tổn thương loạn sản tuyến nội mạc tử cung là tiền thần thực sự của ung thư loại II. Hiếm khi, các khối u loại I lại có thể có một sự bất hoạt p53 sớm hoặc muộn, gây ra một khối u dị loại hoặc u hỗn hợp.
2.3 PHÂN LOẠI MÔ BỆNH HỌC
Ung thư niêm mạc tử cung được phân thành 2 loại mô bệnh học Bokham dựa vào các đặc điểm bệnh lý, yếu tố nội tiết – chuyển hóa và tiên lượng.
Loại I: Chiếm khoảng 80-90%, đại diện cho ung thư niêm mạc tử cung độ 1 và 2 theo FIGO. Độ mô học thấp. Mô bệnh học dạng niêm mạc. Đáp ứng tốt với estrogen và thường được chẩn đoán ở những phụ nữ trẻ, béo phì hoặc mãn kinh. Có thể xuất hiện các tổn thương tiền ung thư như u tân sinh niêm mạc tử cung. Ung thư biểu mô tuyến là loại mô học phổ biến nhất. Những khối u này có thể có tính mất ổn định vi vệ tinh (MSI) và các đột biến PTEN, PIK3CA, KRAS và CTNNBI.
Loại II: Chiếm khoảng 10-20%, bao gồm ung thư niêm mạc tử cung độ 3 theo FIGO và các loại mô học khác như tế bào sáng, thanh dịch, tế bào hỗn hợp và không biệt hóa. Thường có độ mô học cao. Ít nhạy cảm với estrogen, không liên quan đến béo phì. Thường được chẩn đoán ở giai đoạn muộn và tiên lượng kém hơn. Bệnh thường có xu hướng xuất hiện ở phụ nữ lớn tuổi. Khoảng 10-30% có đột biến p53 và biểu hiện quá mức HER2/neu (3,7).
Đặc tính | Loại I | Loại II |
Phụ thuộc Estrogen mãn tính | Phụ thuộc | Không phụ thuộc |
Tình trạng mãn kinh | Trước/sau mãn kinh | Sau mãn kinh |
Quá sản | Có | KHông |
Chủng tộc | Da trắng | Da đen |
Độ mô học | Thấp (Độ 1 hoặc độ 2) | Cao (Độ 3 hoặc 4) |
Xâm lấn cơ tử cung | Tối thiểu (Nông) | Sâu |
Trạng thái | Ổn định | Tiến triển |
Loại mô học | Dạng niêm mạc | Tế bào sáng, tế bào thanh dịch |
Tiên lượng | Tốt | Sấu |
Gần đây, Mạng lưới nghiên cứu bản đồ bộ gen ung thư (TCGA: The Cancer Genome Atlas Research Network) đề xuất phân loại ung thư niêm mạc tử cung thành bốn loại: DNA polymerase epsilon (POLE), tính mất ổn định vi vệ tinh cao (MSI-H), số bản sao thấp (dạng nội mạc tử cung) và số bản sao cao (như thanh dịch). Phân loại này hữu ích trong việc ứng dụng liệu pháp miễn dịch trúng đích trong điều trị.
Năm 2005, Alkushi và cộng sự đề nghị hệ thống phân loại mới chia độ ác tính UTBM nội mạc thành độ thấp (Low grade) và độ cao (High grade) dựa vào các tiêu chuẩn sau:
(1) Hình dạng nhú hoặc đám đặc là chủ yếu.
(2) Chỉ số nhân chia 2 6 trên 10 vị trường có độ phóng đại lớn.
(3) Nhân không điển hình rõ rệt.
Độ thấp: Nhiều nhất là có một trong ba tiêu chuẩn trên.
Độ cao: Ít nhất có hai trong ba tiêu chuẩn trên.
Theo phân loại của WHO (2014), ung thư biểu mô dạng nội mạc có ba độ mô học sau: độ 1 (Grade 1), độ 2 (Grade 2) và độ 3 (Grade 3).
Độ mô học (Grade) | |
G | Định nghĩa |
Gx | Không đánh giá được độ mô học |
G1 | Biệt hóa tốt; có không quá 5% thành phần không lát hoặc thành phần dạng đặc |
G2 | Biệt hóa vừa: có 6-50% thành phần không lát hoặc thành phần dạng đặc |
G3 | Biệt hóa kém: trên 50% thành phần không lát hoặc thành phần dạng đặc, bao gồm cả loại thanh dịch tuyến, tế bào sáng và carcinosarcoma |
Xâm lấn khoang mạch - bạch huyết (Lymphovascular invasion - LVI | |
Mã LV1 | Mô tả |
0 | Không có/không xác định LVI |
1 | Có LVT được xác định (không làm rõ thêm) |
2 | Chỉ xâm lấn mạch bạch huyết và mạch máu nhỏ (L) |
3 | Chỉ xâm lấn tĩnh mạch (mạch máu lớn) (V) |
4 | Xâm lẫn cả mạch bạch huyết và tĩnh mạch (mạch máu lớn) |
5 | Tinh trạng LVI không rõ/không xác định |
2.4 TRIỆU CHỨNG VÀ CHẨN ĐOÁN
Chảy máu bất thường từ tử cung là triệu chứng điển hình của ung thư niêm mạc tử cung. Cần thực hiện các khảo sát tiếp theo trong hai tình huống: (1) bất kỳ phụ nữ trên 45 tuổi có ra máu bất thưởng; (2) phụ nữ ≤ 45 tuổi có các yếu tố nguy cơ. tiền sử gia đình ung thư vú, đại tràng hoặc ung thư phụ khoa khác, béo phì; đã có quá sản niêm mạc tử cung; không phóng noãn mạn tính; liệu pháp tamoxifen hoặc estrogen.
Quy trình chẩn đoán bao gồm:
Khám phụ khoa để xác định nguồn chảy máu (cổ tử cung hoặc buồng tử cung). Ở giai đoạn sớm thường không có triệu chứng gì đặc biệt, nếu ở giai đoạn muộn tử cung có thể lớn và/hoặc dính.
Siêu âm đường âm đạo để đánh giá cấu trúc và độ dày của niêm mạc tử cung và để loại trừ các cấu trúc bệnh khác trong vùng chậu. Ở phụ nữ chưa mãn kinh độ dày niêm mạc không tương ứng với nguy cơ ung thư, phụ nữ mãn kinh có độ dày quanh 20mm trên siêu âm đường âm đạo sẽ có nguy cơ ung thư gia tăng (độ dày 4mm có nguy cơ bệnh lý niêm mạc thấp). Ngoài ra, siêu âm cũng được đánh giá như một phương tiện để xác định độ xâm lấn co tử cung và có thể tiên đoán chính xác độ xâm lấn cơ tử cung trong 75% trường hợp.
Chẩn đoán dựa vào xét nghiệm mô bệnh học, với bệnh phẩm lấy từ buồng tử cung bằng dụng cụ sinh thiết, hoặc nong và nạo; giá trị chẩn đoán của sinh thiết niêm mạc đạt khoảng 90-98% so với nong và nạo hoặc bệnh phẩm cắt tử cung. Sinh thiết niêm mạc bằng dụng cụ chuyên dụng có thể thực hiện ngoại trú, sau khi loại trừ có thai ở phụ nữ trong độ tuổi sinh sản. Nếu kết quả không đạt có thể chỉ định nong và nạo hoặc soi buồng tử cung và lấy mẫu bệnh phẩm. Nếu kết quả mô bệnh học bình thường nhưng bệnh nhân vẫn ra máu bất thường tái diễn cần đánh giá lại niêm mạc. Đôi khi kết quả sinh thiết có thể là “không đủ mô để đánh giá”, thường do niêm mạc quá thiếu dưỡng ở phụ nữ mãn kinh lâu.
Phiến đồ cổ tử cung không đủ tin cậy để chẩn đoán quá sản hoặc ung thư niêm mạc tử cung, do chỉ có khoảng 30-40% ung thư niêm mạc có kết quả phiến đồ cổ tử cung Bất thường. Ngược lại, nếu trên phiến đồ cổ tử cung có tế bào bất điển hình dạng niêm mạc hoặc tế bào tuyến bất điển hình có ý nghĩa không xác định cần nghĩ đến ướng thư niêm mạc tử cung.
Phát hiện hội chứng Lynch: Dựa vào tiền sử và xét nghiệm hóa mô miễn địch khối u niêm mạc tử cung để tìm kiếm thiếu hụt 4 protein sửa chữa ghép đôi bất xứng (mismatch repair proteins: MLH1, MSH2, MSH6 và PMS2).
2.5 PHÂN GIAI ĐOẠN UNG THƯ
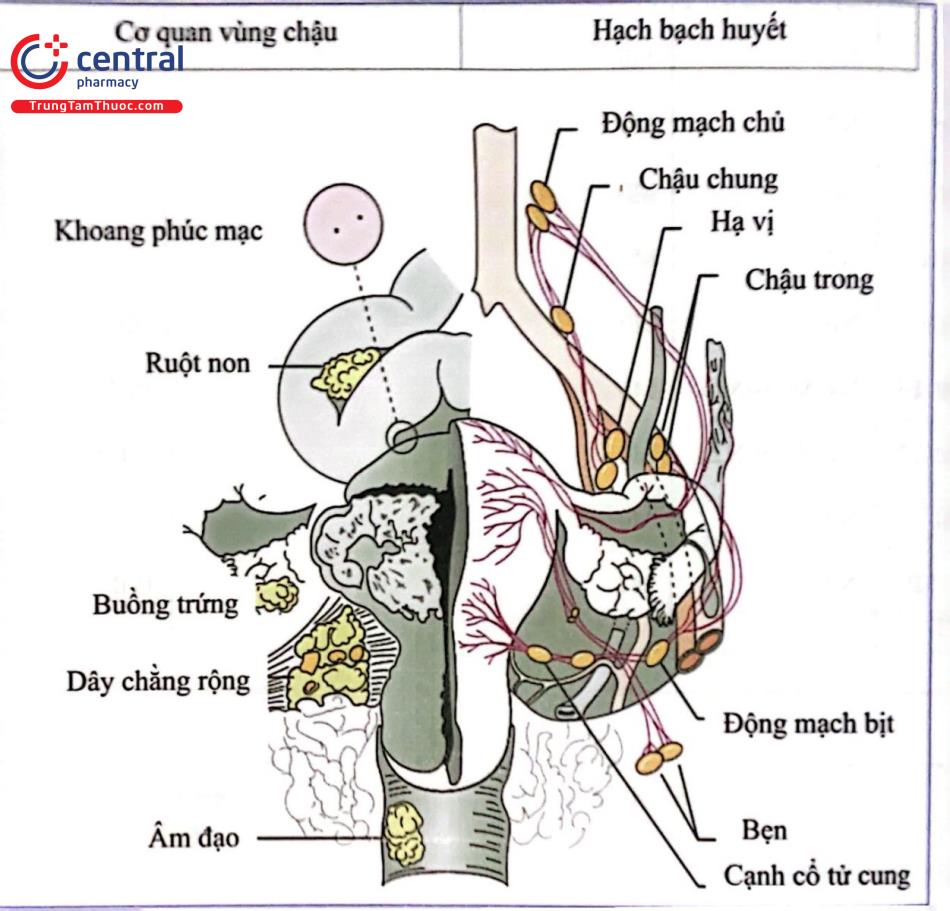
Ung thư niêm mạc tử cung được chẩn đoán giai đoạn chủ yếu thông qua phẫu thuật, cũng là một phương pháp điều trị đối với phần lớn trường hợp. Hệ thống phân giai đoạn cập nhật năm 2017 thống nhất giữa Liên đoàn Phụ Sản quốc tế (FIGO) và hệ thống TNM. Quy trình phẫu thuật phân giai đoạn bao gồm cắt tử cung toàn phần, cắt 2 phần phụ và bóc hạch bạch huyết.
Primary tumor (T) | |||
T | Giai đoạn FIGO | Tiêu chuẩn | |
TX |
| Không đánh giá được u nguyên phát | |
T0 |
| Không có bằng chứng về u nguyên phát | |
T1 | I | Khối u giới hạn ở thân tử cung, bao gồm cả xâm lấn tuyến ống cổ tử cung | |
T1a | IA | Khối u giới hạn ở niêm mạc hoặc xâm lấn < 50% cơ tử cung | |
T1b | IB | Khối u xâm lấn > 50% bề dày cơ tử cung | |
T2 | II | Khối xâm lấn mô liên kết cổ tử cung nhưng chưa ra ngoài tử cung. Không bao gồm xâm lấn tuyến cổ tử cung. | |
T3 | III | Khối u xâm lấn thanh mạc tử cung phần phụ, âm đạo hoặc dây chằng ngang cổ tử cung. | |
T3a | IIIA | Khối u xâm lấn thanh mạc tử cung và/hoặc phần phụ (lan tràn trực tiếp hoặc di căn) | |
T3b | IIIB | Xâm lấn âm đạo (lan tràn trực tiếp hoặc đi căn) hoặc đẩy chẳng ngang cổ tử cung | |
T4 | IVA | Khối u xâm lấn niêm mạc bàng quang và/hoặc trục trang (phù niêm không đủ để xếp khối u vào T4) | |
Hạch vùng (N) | |||
N | Giai đoạn FIGO | Tiêu chuẩn | |
NX |
| Không đánh giá được hạch vùng | |
N0 |
| Không có di căn hạch vùng | |
N0 (i+) |
| Các tế bào ung thư tách biệt trong hạch vùng kích thước không quá 0,2mm | |
N1 | IIIC1 | Di căn đến hạch vùng chậu | |
N1mi | IIIC1 | Di căn hạch vùng chậu (> 0,2mm nhưng không quá 2,0mm đường kính) | |
N1a | IIIC1 | Di căn hạch vùng chậu (vượt quá 2,0mm đường kính) | |
N2 | IIIC2 | Di căn hạch cạnh động mạch chủ, có hoặc không có hạch chậu (+) | |
N2mi | IIIC2 | Di căn hạch cạnh động mạch chủ (> 0,2mm nhưng không quá 2,0mm đường kính), có hoặc không có hạch chậu (+) | |
N2a | IIIC2 | Di căn hạch cạnh động mạch chủ (vượt quá 2,0mm đường kính), có hoặc không có hạch chậu (+) | |
Di căn xa (M) | |||
M | Giai đoạn FIGO | Tiêu chuẩn | |
cM0 |
| Không có di căn xa | |
cM1 | IVB | Di căn xa (hạch bạn, bệnh lý ổ phúc mạc, gan hoặc xương). (không tính di căn vùng chậu hoặc hạch cạnh động mạch chủ, âm đạo, thanh mạc tử cung hoặc phần phụ) | |
pM1 | IVB | Di căn xa được chẩn đoán vi thể (hạch bẹn, bệnh lý ổ phúc mạc, gan hoặc xương). (không tính di căn vùng chậu hoặc hạch cạnh động mạch chủ, âm đạo, thanh mạc tử cung hoặc phần phụ) | |
Giai đoạn tiên lượng | |||
Nếu T là...... | và N là........... | và M là............ | Giai đoạn |
T1 | N0 | M0 | I |
T1a | N0 | M0 | IA |
T1b | N0 | M0 | IB |
T2 | N0 | M0 | II |
T3 | N0 | M0 | III |
T3a | N0 | M0 | IIIA |
T3b | N0 | M0 | IIIB |
T1-T3 | N1/N1mi/N1a | M0 | IIIC1 |
T1-T3 | N2/N2mi/N2a | M0 | IIIC2 |
T4 | N bất kỳ | M0 | IVA |
T bất kỳ | N bất kỳ | M1 | IVB |

2.6 ĐIỀU TRỊ
2.6.1 Phẫu thuật và phân tầng nguy cơ
2.6.1.1 Đánh giá trước phẫu thuật
Xét nghiệm huyết học, chức năng đông máu, sinh hóa máu (SCOT, SGPT, Ure, Creatinin,...).
Chất chỉ điểm sinh học huyết thanh: CA125,...
X-quang ngực, siêu âm tử cung - phần phụ, siêu âm gan, thận
Soi bàng quang, trực tràng, đại tràng sigma và chụp khung đại tràng có cản quang cho các trưởng hợp bệnh nhân khám thấy có khối u nằm ngoài tử cung hoặc các triệu chứng ruột và bàng quang.
Chụp cắt lớp vi tính (CT Scan) não, gan và xương chỉ được dùng cho các bệnh nhân nghi có bệnh lý tiến triển.
MRI chỉ được sử dụng trong các trường hợp bệnh tiến triển để chứng minh di căn hạch bạch huyết hoặc di căn xa.
2.6.1.2 Ung thư niêm mạc nguy cơ thấp
Bệnh nhân nguy cơ thấp có đầy đủ các đặc điểm sau:
Độ mô học 1 hoặc 2.
Ung thư giới hạn ở niêm mạc hoặc xâm lấn dưới 50% độ dày cơ tử cung không xâm lấn khoang mạch bạch huyết.
Không nằm trong nhóm mô học nguy cơ cao (thanh dịch, tế bào sáng hoặc carcinosarcoma).
Phẫu thuật phân giai đoạn, bao gồm cắt tử cung toàn phần, cắt 2 phần phụ và bóc hạch bạch huyết kèm với đánh giá lan tràn ngoài tử cung là phương pháp điều trị ban đầu chuẩn cho ung thư niêm mạc nguy cơ thấp.
Đánh giá hạch gác: hạch gác được đánh dấu bằng tiêm dung dịch keo chứa Technetium-99m (99mTc), hoặc tiêm chất chỉ thị màu xanh (xanh isosulfan 1% hoặc Xanh Methylene 1%).
Sau phẫu thuật, nguy cơ tiên phát ở bệnh nhân nguy cơ thấp là tái phát tại chỗ, ví dụ ở mỏm cắt âm đạo, tuy nhiên nguy cơ này thấp, ≤ 5%, nên các bệnh nhân này chỉ cần được theo dõi sau phẫu thuật.
Ở bệnh nhân có lan tràn đến cổ tử cung, phẫu thuật bao gồm (1) cắt tử cung toàn phần triệt để + xạ trị hậu phẫu dựa trên các đặc điểm mô học, (2) cắt tử cung ngoại mạc + xạ trị hậu phẫu, hoặc (3) xạ trị tiên phát, sau đó cắt tử cung ngoại mạc.
Phẫu thuật cắt giảm mô tế bào được chỉ định cho bệnh nhân có lan tràn ngoài tử cung hoặc trong ổ bụng, xác định qua thăm khám hoặc chẩn đoán hình ảnh trước phẫu thuật, hoặc khi mở bụng; đây là tình huống hiếm gặp (<5% các ung thư niêm mạc).
Bảo tồn khả năng sinh sản: Ở một số ít phụ nữ có nhu cầu sinh sản và có nguy cơ thấp, liệu pháp progestin được chỉ định trong khi trì hoãn phẫu thuật cho đến khi mang thai và sinh xong. Bệnh nhân cần được tư vấn về nguy cơ gia tăng tái phát hoặc tồn tại bệnh lý, so với phẫu thuật cắt tử cung.
2.6.1.3 Ung thư niêm mạc nguy cơ trung bình
Sau khi phân giai đoạn phẫu thuật, bệnh nhân được xếp nhóm nguy cơ trung bình nếu có các đặc điểm sau:
Ung thư không nằm trong nhóm mô bệnh học nguy cơ cao, và
Độ mô học 1 hoặc 2, xâm lấn dưới 50% cơ tử cung, xâm lấn khoang mạch bạch huyết; hoặc
Độ mô học 1 hoặc 2, xâm lấn trên 50% cơ tử cung (giai đoạn IB) hoặc xâm lấn mô đệm cổ tử cung (giai đoạn II); hoặc
Độ mô học 3 và xâm lấn dưới 50% cơ tử cung. Lưu ý carcinoma dạng nội mạc độ 3 có xâm lấn >50% cơ tử cung được xem là nguy cơ cao.
Các bệnh nhân có đặc điểm như trên được xếp vào nhóm nguy cơ trung bình thấp, được chỉ định theo dõi, không xạ trị hay hóa trị bổ sung.
Theo Nhóm ung thư phụ khoa (GOG: Gynecologic Oncology Group), bệnh nhận được xếp vào nhóm nguy cơ trung bình cao nếu tuổi ≥ 70 + 1 yếu tố nguy cơ 50-69 tuổi + 2 yếu tố nguy cơ hoặc ≥ 18 tuổi + 3 yếu tố nguy cơ sau đây:
Xâm lấn sâu cơ tử cung
Độ mô học độ 2 hoặc 3
Xâm lấn khoang mạch bạch huyết.
Xạ trị bổ sung được khuyến cáo cho bệnh nhân nguy cơ trung bình cao, xạ trị áp đường âm đạo thường được sử dụng hơn là xạ vùng chậu (tác dụng phụ nhiều hơn, kể cả các triệu chứng đường tiểu và đường ruột dài hạn). Không khuyến cáo hóa trị đơn thuần hoặc kết hợp xạ trị bổ sung cho bệnh nhân nguy cơ trung bình cao.
2.6.1.4 Ung thư niêm mạc nguy cơ cao
Bệnh nhân được xếp loại nguy cơ cao nếu có bất kỳ đặc điểm nào sau đây
Adenocarcinoma thanh dịch (bất kỳ giai đoạn nào).
Adenocarcinoma tế bào sáng (bất kỳ giai đoạn nào).
Ung thư dạng nội mạc xâm lấn sâu, độ mô học 3.
Giai đoạn III/IV, bất kỳ giai đoạn nào.
Bệnh nhân nguy cơ cao ở giai đoạn sớm:
Giai đoạn IA, không có xâm lấn cơ tử cung (tế bào sáng hoặc thanh dịch có thể được theo dõi hoặc chỉ định bổ sung xạ áp sát đường âm đạo.
Giai đoạn IA có xâm lấn cơ tử cung, giai đoạn IB hoặc II, dạng nội mạc độ 3 hoặc thanh dịch: xạ vùng chậu đơn thuần hoặc phối hợp hóa liệu pháp.
Bệnh nhân nguy cơ cao ở giai đoạn tiến xa:
Giai đoạn III và IV: sau phẫu thuật được chỉ định hóa liệu pháp + xạ áp sát đường âm đạo nếu có nguy cơ cao tái phát tại chỗ.
Giai đoạn III hoặc IV không thể phẫu thuật được chỉ định hóa liệu pháp; xạ trị vùng chậu cần được cá thể hóa.
Hóa liệu pháp: Liệu trình phối hợp Carboplatin và Paclitaxel thường được sử dụng hơn bộ ba Cisplatin, Doxorubicin và paclitaxel (TAP), do có hiệu quả tương đương và độc tính thấp hơn. Các trường hợp có HER2 + mạnh cần sử dụng Trastuzumab ngay từ đầu.
2.6.2 Liệu pháp miễn dịch trúng đích
Phần lớn bệnh được chẩn đoán ở giai đoạn sớm, đáp ứng tốt với phẫu thuật, sau đó là điều trị bổ trợ bằng xạ trị và/hoặc hóa trị. Tuy nhiên, tiên lượng xấu hơn đáng kể đối với ung thư có di căn vùng và di căn xa, tỷ lệ sống sau 5 năm lần lượt là 69% và 16%. Nhóm bệnh nhân này thường đáp ứng kém với hóa trị. Do đó, cần thiết phải phát triển các phương pháp điều trị mới như liệu pháp ức chế chốt kiểm miễn dịch cho ung thư niêm mạc tử cung giai đoạn muộn.
Dựa trên một số nghiên cứu về cơ sở lý luận và thử nghiệm lâm sàng cho thấy ung thư niêm mạc tử cung là một “ùng cử viên” tiềm năng để thử nghiệm liệu pháp ức chế chốt kiểm miễn dịch. FDA đã phê duyệt pembrolizumab vào ngày 23/5/2017 để điều trị cho các khối u rắn không thể cắt bỏ hoặc di căn, trạng thái MSI-H, hoặc dMMR giai đoạn tiến triển sau khi điều trị trước đó hoặc không có lựa chọn điều trị thay thế phù hợp.
Nhìn chung, một số thử nghiệm ức chế PD-1 hoặc PD-L1 ở ung thư niêm mạc tử cung có kết quả tốt (ORR lên đến 57,1%). Hơn nữa, khi thiết kế liệu pháp phối hợp sử dụng ức chế chốt kiểm và các thuốc khác cũng có kết quả rất khả quan, có khả năng làm giảm bớt các cơ chế ức chế trong vi môi trường khối u. Liệu pháp kết hợp có khả năng mang lại lợi ích cộng hưởng hoặc hiệp đồng, so với điều trị đơn chất, cũng như khắc phục các cơ chế kháng thuốc được quan sát thấy khi sử dụng đơn trị liệu.
2.6.3 Theo dõi các bệnh nhân ung thư niêm mạc tử cung
Theo dõi bao gồm khám phụ khoa, khảo sát tế bào học âm đạo mỗi 3 tháng trong 3 năm đầu sau phẫu thuật, trong thời gian này có 76% trường hợp tái phát.
Khoảng 6-10% bệnh nhân ung thư biểu mô niêm mạc tử cung cũng mắc thêm một bệnh lý ác tính khác đặc biệt là vùng vú và ruột. Tầm soát thích hợp như là chụp nhũ ảnh hoặc soi đại tràng được nhấn mạnh.
Sau xạ trị xơ hóa và chít hẹp âm đạo có thể xảy ra. Bệnh nhân nên được tham vẫn là những hậu quả này có thể được tránh bằng cách giao hợp thường xuyên sử dụng chất bôi trơn.
Có thể dùng estrogen - progestin thay thế toàn thân cho các bệnh nhân giai đoạn I không còn u
Cũng như tất cả các bệnh nhân ung thư khác, các phụ nữ với ung thư niêm mạc tử cung cần được nâng đỡ về tâm lý và xã hội.
2.7 TIÊN LƯỢNG
Các yếu tố tiên lượng bao gồm: Giai đoạn phẫu thuật, mức độ biệt hóa mô học, di căn hạch, tế bào học dịch ổ bụng, loại mô học, xâm lấn cơ tử cung, di căn phần phụ, thụ thể nội tiết. Trong đó, giai đoạn phẫu thuật theo FIGO là yếu tố tiên lượng quan trọng nhất.
Các yếu tố tiên lượng xấu của ung thư niêm mạc tử cung bao gồm: giai đoạn phẫu thuật tiến triển, lớn tuổi, mô bệnh học loại Adenocarcinoma thanh dịch hoặc tế bào sáng hoặc carcinosarcoma, độ mô học cao, xâm lấn cơ tử cung, xâm lấn khoang mạch bạch huyết, kích thước khối u lớn.
Giai đoạn FIGO | Tỷ lệ sống 5 năm |
IA | 88% |
IB | 75% |
II | 69% |
IIIA | 58% |
IIIB | 50% |
IIIC | 47% |
IVA | 17% |
IVB | 15% |
3 TÀI LIỆU. THAM KHẢO
1. AJCC Cancer Staging Manual, Eighth Edition. Springer International Publishing, 2017
2. American College of Obstetricians and Gynecologists. Management of Uterine Cancer. ACOG Practice Bulletin # 65. Washington, DC: American College of Obstetricians and Gynecologists; 2005:2. Reaffirmed 2011.
3. Bộ Y tế. Hướng dẫn điều trị Sản Phụ khoa. Nhà xuất bản Y học. 2016.
4. Bokhman JV. Two pathogenetic types of endometrial carcinoma. Gynecol Oncol. 1983; 15:10.
5. Cao Ngọc Thành. Nguyễn Vũ Quốc Huy. Phụ khoa. Nhà xuất bản Y học. 2016. 6. Casanova R, Chuang A, Goepfert AR, Hueppchen NA, Weiss PM. Beckmann and Ling's obstetrics and gynecology. Wolters Kluwer. 2019.
7. Dunnick NR, Newhouse JH, Cohan RH, Maturen KE (Eds) Genitourinary Radiology, 6th ed, Wolters Kluwer, Philadelphia 2018.
8. Felix AS, Weissfeld JL, Stone RA, et al. Factors associated with Type I and Type II endometrial cancer. Cancer Causes Control. 2010; 21:1851.
9. Miller D, Filiaci V, Fleming G, et al. Late-Breaking Abstract 1: Randomized phase III noninferiority trial of first line chemotherapy for metastatic or recurrent endometrial carcinoma: A Gynecologic Oncology Group study. Gynecol Oncol. 2012; 125S:771.
10. Reed SD, Urban RR. Classification and diagnosis of endometrial hyperplasia. UpToDate version 20.0. https://www.uptodate.com/contents/ classification-and-diagnosis-of-endometrial-hyperplasia. Truy cập 08/8/2020.
11, Reed SD, Urban RR. Management of endometrial hyperplasia. UpToDate version 20.0. https://www.uptodate.com/contents/management-of-endometrial- hyperplasia. Truy cập 08/8/2020,
12. Setiawan VW, Yang HP, Pike MC, et al. Type I and II endometrial cancers: have they different risk factors? J Clin Oncol. 2013; 31:2607.
13. Smith RA, von Eschenbach AC, Wender R, et al. American Cancer Society guidelines for the early detection of cancer: Update of early detection guidelines for prostate, colorectal, and endometrial cancers. CA Cancer J Clin. 2001; 51:38.

