Phương pháp điện di và ứng dụng của phương pháp điện di trong y học
Trường Đại Học Y Hà Nội - Bộ môn Khoa học xét nghiệm
Chủ biên PGS.TS.BS Đặng Thị Ngọc Dung, TS. Nguyễn Trọng Tuệ
Các tác giả tham gia biên soạn
PGS. TS. BS Đặng Thị Ngọc Dung, TS. Nguyễn Trọng Tuệ, TS. BS. Nguyễn Thúy Hương, TS. BS. Nguyễn Thị Thanh Hải
ThS. Đặng Quang Huy, Ths. BSNT. Nguyễn Quỳnh Giao, Ths. BSNT. Vũ Đức Anh, ThS. Trịnh Thị Phương Dung
Ths. BSNT. Lê Văn Toàn, Ths. BSNT. Ngô Diệu Hoa, BSNT. Phạm Thị Hương Trang, Ths. BSNT. Nguyễn Thị Thu Thảo
Ths. BS. Nguyễn Thị Hảo, CKI. Đỗ Thị Hường, CKI. Nguyễn Thúy Hà, ThS. Vũ Thị Bích Hồng
CN. Lê Thanh Thảo, CN. Nguyễn Hữu Hùng
Điện di là quá trình mà các phân tử điện tích được tách ra trong một điện trường do khả năng di chuyển khác nhau của các phân tử. Điện di đóng vai trò quan trọng trong lâm sàng và nghiên cứu y học. Chủ yếu nhằm phát hiện mẫu và tách mẫu protein, DNA. Trong bài viết này, Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) xin gửi đến bạn đọc thông tin về phương pháp điện di và ứng dụng của phương pháp này trong lĩnh vực y học.
1 Điện di và các yếu tố ảnh hưởng
1.1 Khái niệm
Điện di là quá trình mà các phân tử mang điện tích được tách ra trong một điện trường do khả năng di chuyển khác nhau của các phân tử. Tốc độ di chuyển của các phần tử này phụ thuộc vào kích thước, hình dạng và điện tích trên bề mặt phân tử.
Nguyên tắc chung của điện di là dựa trên khả năng di chuyển của phần tử tích điện trong điện trường. Cả protein và acid nucleic đều có thể được phân tách bằng điện di. Protein được cấu tạo bởi các acid amin với nhiều nhóm có khả năng ion hóa, cũng giống như acid amin, chúng có tính chất lưỡng tính. Tùy theo pH môi trường mà protein có thể tồn tại dưới dạng tích điện dương, âm hoặc trung hòa về điện. pH mà tại đó protein không tích điện gọi là pH đẳng điện hay pHi. Nếu pH môi trường lớn hơn pHi, protein sẽ mang điện âm và sẽ di chuyển về phía cực dương. Nếu pH môi trường nhỏ hơn pHi, protein mang điện dương và di chuyển về phía cực âm. Khi pH môi trường bằng pH, trung hòa về điện nên sẽ không di chuyển trong điện trường.
Các phân tử tích điện khác như DNA, RNA cũng điện di theo nguyên tắc trên. Ở môi trường pH ≥ 8, DNA tích điện âm, dưới tác dụng của dòng điện nó sẽ di chuyển về cực dương.
1.2 Các yếu tố ảnh hưởng đến tốc độ di chuyển
Tốc độ di chuyển của các phân tử trong quá trình điện di phụ thuộc vào điện tích của phân tử, kích thước, hình dạng của phân tử, dung dịch đệm, điện trường chất giá (tính xốp, độ quánh), nhiệt độ và dòng điện nội thẩm.
1.2.1 Trọng lượng phân tử (TLPT) và cấu hình của tiểu phân
Phần tử có trọng lượng nhỏ sẽ di chuyển nhanh hơn các phân tử có trọng lượng lớn. Phần tử hình cầu di chuyển nhanh hơn phần tử có hình bầu dục hay hình sợi. Ví dụ: Albumin hình cầu di chuyển nhanh hơn fibrin hình sợi.
Lực F tác dụng lên phần tử có điện tích Q trong điện trường có cường độ E được tính bằng công thức
F=ExQ
Nếu trong môi trường không có độ nhớt thì phần tử thường xuyên bị kích thích và di chuyển về điện cực trái dấu với lực F. Tuy nhiên, dung dịch keo có độ nhớt đáng kể làm cản trở sự di chuyển của phần tử protein với lực F’. Theo định luật Stokes, lực F được tính như sau:
F' = 6πRην
R: bán kính tiểu phân protein
n: hệ số nhớt
v: tốc độ di chuyển
Như vậy, muốn phân tử protein di chuyển thì F > F’. Khi F = F′, ta có:
EQ = 6πRην
v = EQ/6πRην
Với điện trường E=1 V/cm → v=Q/6tRηv
Như vậy, nếu R càng lớn thì v hay vận tốc di chuyển của phần tử càng nhỏ.
1.2.2 Trạng thái hydrat hóa của tiểu phân
Trạng thái hydrat hóa là tình trạng phần tử ở dạng ion trong dung dịch tích điện, phân tử nước lưỡng cực gắn vào đầu phần tử tích điện trái dấu. Phần tử càng hydrat hóa thì tính linh động càng tăng. Trạng thái hydrat hóa phụ thuộc vào các nhóm ion tự do trong phần tử và pH của dung dịch đệm. Càng nhiều nhóm ion tự do và pH của dung dịch đệm càng xa pHi thì khả năng hydrat hóa càng lớn. Một phần tử protein càng hydrat hóa thì đường kính của nó càng lớn (mixen protein), tính linh động của nó càng tăng.
Vận tốc của phân tử protein ở trạng thái hydrat hóa được tính như sau:
v=Qd/4πR2η
Q : điện tích của phần tử protein
R : bán kính phần tử
d : chiều dày lớp điện kép
η : độ nhớt của dung dịch
Như vậy độ dày của lớp điện kép càng tăng thì phần tử protein càng linh động.
1.2.3 Thế điện động
Sự tích điện của phân tử chất keo protein là do sự phân ly của nhóm carboxyl (-COOH), nhóm amin (-NH2) và nhóm hydroxyl (OH-) và sự hấp thụ của phân tử với các ion của dung dịch đệm. Do hiệu ứng Debeye Huckel làm cho bề mặt phần tử protein có một lớp điện tích tạo bởi ion trái dấu và nồng độ ion tại đây cao hơn nồng độ của chúng trong dung dịch. Giữa điện tích của phân tử protein và lớp điện tích ion bề mặt tạo nên một đơn vị điện động (như một tụ điện). Hiệu điện thế của đơn vị điện động này càng tăng thì tốc độ di chuyển của phần tử càng nhanh. Theo lý thuyết tĩnh điện, hiệu điện thế - được tính như sau: ξ = 4πδd/D
δ: điện tích/1cm2
d: khoảng cách giữa 2 tấm tụ điện
D: hằng số điện môi
- Sự biến thiên của điện tích phụ thuộc vào pH của dung dịch đệm, pH của dung dịch đệm càng khác pHi thì sự tích điện càng lớn, thế điện động càng tăng.
- Sự biến đổi bề dày của lớp điện tích kép phụ thuộc vào lực ion của dung dịch đệm, dung dịch đệm càng loãng lực ion càng giảm, khoảng cách giữa hai tấm tụ điện càng tăng, thế điện động tăng.
Như vậy pH dung dịch đệm càng xa pHi và nồng độ ion của dung dịch càng loãng thì tốc độ di chuyển của tiểu phân càng tăng. Tuy nhiên, cần lưu ý nếu dung dịch quá loãng không đủ khả năng đệm thì hiệu quả điện di lại giảm thấp.
1.2.4 Vai trò của dung dịch đệm
Dòng điện chạy qua dung dịch chất điện ly sẽ gây ra sự thay đổi thành phần hóa học của dung dịch và làm thay đổi pH của dung dịch. pH của dung dịch là một trong những yếu tố quan trọng nhất trong quá trình điện di nên phải giữ cho pH của dung dịch điện di không thay đổi trong suốt quá trình điện di. Do đó, dung dịch điện di phải là dung dịch có khả năng đệm tốt, không quá loãng và không quá đặc, đảm bảo 2 yêu cầu sau:
- Dung dịch đệm phải giữ cho protein ở trạng thái bền vững không bị biến tính.
- Dung dịch đệm phải phân tách tốt hỗn hợp protein thành các cấu tử.
Các chỉ số đánh giá dung dịch đệm gồm: pH, lực ion và bản chất thành phần ion của dung dịch đệm.
1.2.5 pH của dung dịch đệm
Đây là yếu tố quan trọng nhất của phương pháp điện di. Protein có tính chất lưỡng tính, dấu và lượng điện tích của protein phụ thuộc vào giá trị của pH. pH < pHi, protein tích điện dương; pH > pH, protein tích điện âm; pH càng khác xa với pHi thì phần tử di chuyển càng nhanh. Tuy nhiên cần phải lưu ý pH không được quá kiềm (> 10) hay quá acid (< 3) vì sẽ làm biến tính chất cần điện di, làm mất khả năng tích điện của các phần tử, các phần tử sẽ không di chuyển.
1.2.6 Lực ion của dung dịch đệm
Như đã nói ở trên, tính linh động của phần tử protein phụ thuộc vào thế điện động. Đại lượng này phụ thuộc vào độ dày của lớp điện kép hấp thụ trên bề mặt của phân tử protein. Lực ion quá lớn sẽ làm giảm chiều dày của lớp điện kép và do đó giảm tính linh động của phần tử, ngược lại lực ion quá thấp làm tăng tính linh động nhưng dung tích đệm giảm và làm giảm khả năng hòa tan của protein điện di. Do đó, dung dịch đệm điện di phải có nồng độ ion phù hợp không quá cao hoặc quá thấp, đảm bảo dung tích đệm, tăng khả năng tan của protein đồng thời không làm giảm độ linh động của phần tử.
1.2.7 Bản chất của ion
Mức độ liên kết của các ion với protein là khác nhau. Hằng số phân ly các ion của các muối cũng khác nhau. Nếu 2 dung dịch đệm có pH giống nhau nhưng khác nhau về bản chất ion thì kết quả điện di cũng khác nhau. Do đó cần phải lựa chọn dung dịch đệm phù hợp với protein điện di và điều kiện thí nghiệm.
1.2.8 Điện thế và cường độ dòng điện
Tốc độ di chuyển của phần tử điện di tỷ lệ thuận với hiệu điện thế giữa hai điện cực của bể điện di. Tuy nhiên, hiệu điện thể tăng quá cao sẽ làm bay hơi nước nhiều và ảnh hưởng đến tốc độ điện di. Thông thường với điện di protein, điện thế được sử dụng phổ biến là 120 - 400V. Tuy nhiên với chất giá là polyacrylamid, hiệu điện thế có thể tăng tới 1200V.
Cường độ dòng điện không ảnh hưởng trực tiếp tới tốc độ điện di mà tỷ lệ thuận với khả năng sinh nhiệt trong quá trình điện di. Lượng nhiệt W tỏa ra khi một dòng điện đi qua một chất dẫn điện theo hiệu ứng Jun được tính như sau:
W = I2R/4,186 = VI/4,186
V: hiệu điện thế (Vol)
I: cường độ dòng điện
R: điện trở
Điện trở phụ thuộc vào kích thước, hình dáng của phân tử, độ xốp, độ quánh và nhiệt độ của chất giá. Mỗi chất giá khác nhau dùng một cường độ dòng điện khác nhau. Trong quá trình điện di, cường độ dòng điện, điện thế hoặc điện năng có thể giữ hằng định. Nếu cường độ dòng điện không đổi, khi điện trở tăng thì điện năng sẽ tăng và nhiệt độ tăng. Nếu điện thế hoặc điện năng được giữ không đổi, khi điện trở tăng thì cường độ dòng điện giảm làm tốc độ di chuyển chậm lại và nhiệt không tăng. Như vậy, điện di với chất giá có điện trở lớn với hiệu điện thế cao phù hợp sẽ làm tăng tốc độ di chuyển và làm giảm cường độ dòng điện và làm giảm sinh nhiệt. 1.2.9. Dòng điện nội thẩm (EEO)
EEO là dòng dung dịch đệm di chuyển về phía cực âm do chất giá tích điện âm khi đặt trong điện trường và làm cản trở phần tử đi về cực dương. Một số trường hợp EEO cao làm đẩy ngược chất điện di về phía cực cùng dấu (cực âm).
Đa phần phân tử protein sẽ tích điện âm và di chuyển về phía cực dương, ngược chiều EEO. Trong điện di protein huyết thanh trên giấy Y-globulin có thể bị đẩy ngược về cực âm.
1.2.9 Chất giá
Khả năng phân tách của các chất giá khác nhau là khác nhau. Các chất giá có tính chất là giá đỡ thông thường như giấy, agar, acetat cellulose thì khả năng phân tách kém. Nếu điện di protein huyết thanh chỉ tách được 5 - 6 thành phần. Các chất giá có tính chất sàng lọc phân tử như tinh bột, agarose, polyacrylamid thì khả năng phân tách tốt hơn, điện di protein huyết thanh có thể tách được 19 - 21 thành phần.
- Acetat cellulose:
+ Bản chất: cellulose được acetyl hóa bằng anhydrid acetic tạo thành acetat
cellulose.
+ Tính chất: là một màng khô, giòn, dễ gãy, có 80% khoảng không không khí khi ngâm với dung dịch đệm, các khoảng không này được làm đầy bằng các chất điện ly trở nên mềm và có thể gấp được.
+ Ưu điểm: rẻ, dễ dàng tự động hóa, không đòi hỏi bộ phận làm lạnh hay bộ nguồn đắt tiền. Có EEO cao nên khả năng phân tách tốt trong một số ứng dụng nhưng độ phân giải không cao.
+ Nhược điểm: đục, cần xử lý qua hóa học để làm trong trước khi đo mật độ.
- Gel agarose:
+ Bản chất: là polysaccarid trung tính.
+ Có độ tinh khiết khác nhau nên có thể tạo thành EEO cần thiết.
+ Kích thước các lỗ khác nhau tùy theo nồng độ agarose.
+ Các lỗ kích thước lớn có thể phân tách được các phân tử lớn như
lipoprotein.
+ Độ phân giải đạt được với agarose tốt hơn cellulose acetat.
- Gel polyacrylamid:
+ Bản chất: được tạo thành từ sự trùng hợp các monome acrylamid và các
cầu nối N, N methylen bisacrylamid.
+ Kích thước các lỗ thay đổi tùy theo nồng độ.
+ Có độ phân giải tốt.
+ Khả năng phân tách tốt, có thể phân tách được khoảng 20 thành phần trong huyết thanh (agarose và cellulose acetat chỉ tách được khoảng 5 thành phần).
+ Thường được dùng để nghiên cứu các thành phần nhỏ, riêng rẽ, ví dụ các
isoenzym.
+ Không có EEO.
1.2.10 Nhiệt độ và sự bay hơi
Nhiệt độ tăng hơi nước bay hơi làm thay đổi điều kiện điện di do đó có thể làm giảm sự tăng nhiệt độ bằng cách đặt băng điện di lên giá đỡ có dòng nước lạnh chảy qua hoặc chậu điện di được đặt trong tủ lạnh trong trường hợp phân tách các enzym.
Sự khuếch tán phần tử điện di vào gel tăng lên theo thời gian gây ra các băng có độ phân giải kém. Vì vậy độ phân giải sẽ tốt hơn nếu tốc độ di chuyển nhanh hơn. Do đó người ta điều chỉnh hiệu điện thế tăng cao có thể làm tăng tốc độ điện di nhưng đồng thời làm tăng nhiệt độ. Nhiệt quá cao sẽ làm gây biến tính và có thể thay đổi mật độ của chất giá. Sự tăng nhiệt và tốc độ di chuyển cần phải cân bằng cẩn thận để đảm bảo điều kiện điện di.
2 Các kỹ thuật điện di
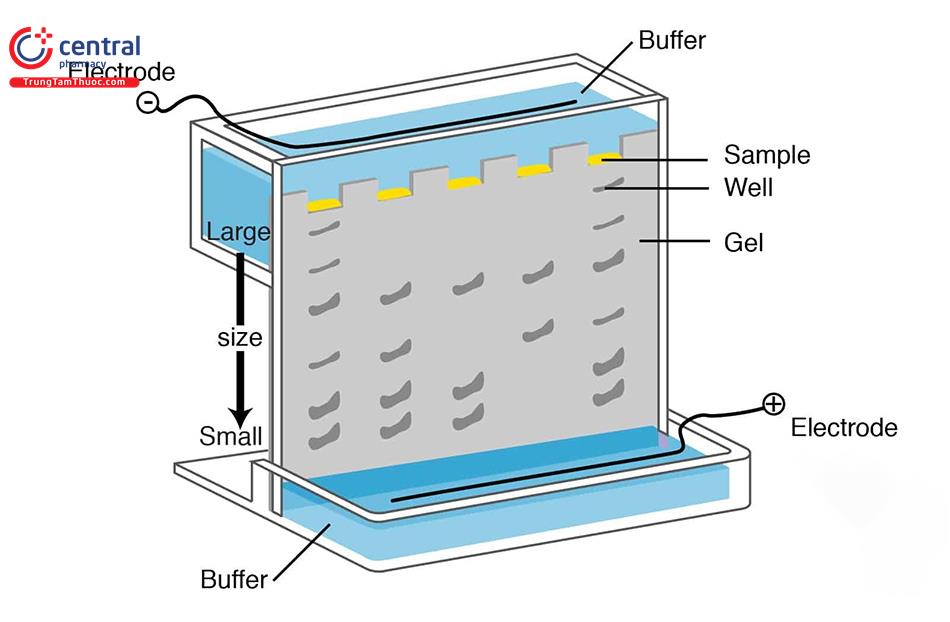
2.1 Các bước cơ bản của kỹ thuật điện di
- Đưa mẫu cần phân tích vào: mẫu có thể hút bằng pipet đặt trực tiếp lên chất giá dưới dạng một chấm hay đưa vào một lỗ trên chất giá, một giếng cắt trên chất giá...
Đặt chất giá vào trong điện trường bằng một trong ba cách sau:
+ Hai đầu của băng điện di hay mao quản được nhúng vào trong các buồng
dung dịch đệm chứa điện cực.
+ Các bấc làm bằng vật liệu hút ẩm nhúng vào buồng đệm và đi tới băng điện
di.
+ Các điện cực đặt trực tiếp lên gel.
- Xử lý chất giá để có thể nhìn thấy:
+ Cố định bằng cách gây kết tủa bằng acid, muối hay kháng thể hoặc làm khô trên máng nitrocellulose. Sự cố định sẽ không khuếch tán trong gel và các băng rõ nét.
+ Nhuộm màu có thể được tiến hành bằng cơ chất nếu là enzym hoặc sử dụng thuốc nhuộm màu hay kháng thể được đánh dấu. Các thuốc nhuộm thường được sử dụng là xanh Coomassie, amid black, ponceau S, bạc và các thuốc nhuộm miễn dịch được đánh dấu bằng Peroxidase. Trong trường hợp điện di mao quản, được rửa giải qua một bộ phận phát hiện nên bước cố định và nhuộm màu không cần nữa.
- Phép đo mật độ: Thường được dùng để định lượng các thành phần phân tách được. Ánh sáng huỳnh quang hay đầu dò huỳnh quang hoặc quang phổ được dùng để đo sự hấp thụ ánh sáng, kết quả thu được biểu diễn dưới dạng điện di đồ.
2.2 Điện di gel polyacrylamide
2.2.1 Điện di gel polyacrylamide 1D
Hình thức phổ biến nhất của điện di gel polyacrylamide (PAGE) là phân tích so sánh nhiều mẫu bằng điện di một chiều (1D). Gel thường có kích thước từ 2 x3 cm (nhỏ) đến 15 x 18 cm (khổ lớn). Kích thước phổ biến nhất khoảng 8 x 8 cm thường được gọi là "minigel". Gel cỡ trung bình (8 x 13 cm) được gọi là "midi gels". Các loại gel nhỏ đòi hỏi ít thời gian và thuốc thử hơn so với gel lớn. Các bản gel nhỏ phù hợp để sàng lọc protein nhanh. Tuy nhiên, gel lớn cung cấp độ phân giải tốt hơn và cần thiết để tách các protein gần nhau về trọng lượng phân tử hoặc một số lượng lớn các protein.
Có SDS và không có SDS
Người ta thêm chất tẩy sodium dodecyl sulfate (SDS) vào hệ thống điện di. SDS phủ lên phần tử làm chúng dễ tan hơn và tăng điện tích âm tỉ lệ thuận với kích thước của tiểu phân protein. Điều này cho phép phân tách riêng rẽ các tiểu phân dựa trên kích thước của chúng mà không bị ảnh hưởng bởi sự khác nhau về điện tích của mỗi phần tử. SDS-PAGE được dùng chủ yếu trong nghiên cứu để phân tách các tiểu phân có kích thước và điện tích ảnh hưởng tương đương nhau đến tốc độ di chuyển khi điện di.
Các mẫu protein được cho vào các giếng tại đỉnh gel. Khi dòng điện chạy qua, các protein di chuyển xuống qua lỗ gel, tạo ra các dải protein. Các protein dễ dàng so sánh với nhau sau khi nhuộm màu hoặc các kỹ thuật đánh dấu phát hiện khác. Mật độ màu nhuộm và độ dày của dải protein cho thấy nồng độ của protein. Vị trí (chiều cao) của dải protein trong các đường chạy tương ứng cho biết kích thước tương đối và các yếu tố khác ảnh hưởng đến sự di chuyển của chúng qua gel. Được ứng dụng trong phân tích, tinh sạch protein.
.jpg)
2.2.2 Điện di gel polyacrylamide 2D
Trong phương pháp điện di hai chiều 2D, các phân tử đầu tiên các phân tử được phân tích theo điểm đẳng điện theo chiều thứ nhất sau đó được phân tách theo kích thước phân tử theo chiều thứ hai trên gel SDS.
.jpg)
Có thể phân tách đến hàng ngàn protein khác nhau trên 1 gel.
Nhiều thành phần của một mẫu đơn có thể được giải quyết hoàn tất bằng phép điện di hai chiều (2D-PAGE). Đầu tiên tách protein theo điểm đẳng điện (pl) bằng cách sử dụng một dạng điện di gọi là tập trung đẳng điện (IEF). Thứ hai tách biệt theo khối lượng sử dụng SDS-PAGE thông thường. 2D PAGE cung cấp độ phân giải cao nhất cho phân tích protein và là một kỹ thuật quan trọng trong nghiên cứu proteomic, nơi mà đôi khi cần phải giải quyết hàng ngàn protein trên một gel.
2.3 Điện di mao quản
Điện di mao quản là phương pháp phân tách mới nhất dựa trên sự di chuyển của các phân tử trong một điện trường. Phương pháp này nhanh, nhạy và có thể tự động hóa được nên có thể sẽ là cuộc cách mạng trong nghiên cứu protein và peptid. Việc phân tách được tiến hành trong mao quản có đường kính trong 20 - 200 pm, chiều dài 10 - 100 cm. Thường thì các mao quản được làm đầy bằng đệm, đôi khi người ta sử dụng gel. Các mao quản rỗng có bề mặt tích điện âm và có EEO cao.
Trước tiên mao quản được làm đầy bằng đệm sau đó đưa mẫu vào. Mẫu được đặt phía cực âm và hai đầu của mao quản được nhúng trong đệm có chứa điện cực rồi đặt vào đó một điện trường. Sự phát hiện được thực hiện ở một đầu mao quản trực tiếp qua thành mao quản.
Các đầu dò UV - khả kiến thường được dùng để theo dõi phát hiện các chất phân tích nhưng có độ nhạy thấp do kích thước mao quản nhỏ. Các đầu dò huỳnh quang, laser huỳnh quang và hóa phát quang có độ nhạy cao hơn.
.jpg)
Điện di mao quản thường được dùng để phân tách, định lượng và xác định trọng lượng phân tử của protein, phân tích sản phẩm của PCR, giải trình tự gen, phân tích đột biến gen, phân tích các ion vô cơ, acid hữu cơ, thuốc, đồng phân quang học.
Điện di mao quản có thuận lợi là khả năng truyền nhiệt cao, cho phép sử dụng điện thế cao, phân tách nhanh và độ phân giải lớn, do đó chỉ cần một lượng mẫu rất nhỏ và không bị biến tính trong quá trình điện di.
Nhược điểm của phương pháp là sự phát hiện và định lượng khó khăn, thiết bị đắt tiền, phần tử điện di có thể bị hấp thụ vào cột.
2.4 Điện di đẳng điện tập trung
Điện di đẳng điện tập trung là một kỹ thuật đặc biệt được sử dụng khi cần độ phân giải cao như việc tách các isozym. Kỹ thuật được tiến hành bằng cách thêm các chất điện ly lưỡng tính vào giá đỡ (gel agarose hay polyacrylamid), gel này được gọi là isogel. Các chất điện ly lưỡng tính là những phân tử nhỏ lưỡng tính với các pH khác nhau, khi đặt vào trong điện trường sẽ di chuyển tạo gradient pH. Các phân tử khác nhau có trong mẫu khi đưa vào trong điện trường sẽ di chuyển tới vùng gel có pH bằng pH của protein thì dừng lại. Các phần tử sẽ tập trung thành các băng rất hẹp.
3 Ứng dụng của điện di trong y học
Trong y học điện di được ứng dụng nhiều trong lâm sàng và nghiên cứu. Chủ yếu nhằm phát hiện mẫu và tách mẫu protein và DNA.
3.1 Điện di protein
Lâm sàng: Điện di protein dùng trong chẩn đoán các bệnh về máu, thận, bệnh hemoglobin dựa vào thành phần, tỷ lệ các chất trong dịch sinh vật... VD: điện di protein huyết thanh giúp chẩn đoán các bệnh về máu, đặc biệt bệnh Kahler, số lượng Y-globulin miễn dịch tăng vọt hơn hẳn bình thường tạo thành peak cao, nhọn. Điện di protein trong nước tiểu giúp chẩn đoán bệnh thận, vị trí tổn thương và tình trạng bệnh. Nếu có thành phần micro albumin thì tổn thương ở cầu thận mức độ nhẹ, nếu có cả macro albumin niệu hoặc các thành phần protein khác của huyết thanh thì tổn thương mức độ nặng, a2-globulin xuất hiện chứng tỏ có tổn thương ống thận.
Nghiên cứu: điện di protein giúp tinh sạch loại enzym cần phân tách, đặc biệt có thể phân tách từng loại isoenzym. Vì cần phải giữ hoạt tính của enzym nên khi phân tách cần điện di ở môi trường lạnh, chất giá phải có khả năng phân tách tốt nhu polyacrylamid T 5%, agarose, acetate cenlulose.
3.2 Điện di DNA, RNA
Chủ yếu sử dụng trên gel agarose hoặc polyacrylamid nếu đòi hỏi độ chính xác cao hơn. Chủ yếu sử dụng trong các phòng thí nghiệm nhằm đánh giá chất lượng DNA, RNA sau tách chiết hoặc xác định sản phẩm PCR, tinh sạch DNA giải trình tự gen... Nếu tách chiết tốt thì vạch lên sẽ gọn đẹp, không có vạch mờ do đứt gẫy. Trong lâm sàng có thể dùng để xác định sự có mặt của virus hoặc vi khuẩn gây bệnh sau khi chạy PCR bằng cặp mồi đặc hiệu.
Điện di Hemoglobin: phát hiện bệnh về huyết sắc tố như HbE, HbS, bệnh Thalassemia.
Điện di lipoprotein: chất giá là giấy, agar-agar, agarose, nhuộm bằng Sudan IV.
3.3 Điện di huyết sắc tố
Xét nghiệm điện di huyết sắc tố được sử dụng để phát hiện các bất thường di truyền trong cấu trúc phân tử hemoglobin, thường được sử dụng trong các trường hợp bệnh nhân có các dấu hiệu hoặc triệu chứng của thiếu máu huyết tán hoặc bệnh nhân có tiền sử gia đình có bệnh lý về huyết sắc tố. Xét nghiệm điện di huyết sắc tố dựa trên nguyên lý của phương pháp điện di. Các phân tử tích điện hòa tan và phân tán trong dung môi sẽ di chuyển theo các hướng khác nhau với tốc độ và hướng di chuyển phụ thuộc vào điện tích hay kích thước của phân tử. Dựa trên nguyên lý này, các thành phần Hb khác nhau có trong mẫu sẽ được phân tách từ đó có thể được định danh và xác định tỷ lệ các loại Hb có trong mẫu thử. Để thực hiện xét nghiệm điện di huyết sắc tố có nhiều phương pháp khác nhau được sử dụng như: điện di trong môi trường pH kiềm trên giấy acetat cellulose, điện di trên gel agar trong môi trường pH acid, điện di đẳng điện trên gel agarose hay gel polyacrylamide, điện di mao quản... Trong nội dung cuốn sách này chúng tôi xin được giới thiệu những nội dung cơ bản của phương pháp điện di huyết sắc tố bằng điện di mao quản – một phương pháp được sử dụng nhiều trong thực hành lâm sàng.
3.4 Nguyên lý kỹ thuật
Cấu trúc không gian của Hb phụ thuộc vào bản chất và trình tự của chuỗi acid amin globin phân tử Hb. Do đó, khi có sự thay đổi về thành phần cấu trúc của acid amin do đột biến thì sẽ tạo ra những biến thể Hb có những khác biệt về điện tích trên bề mặt phân tử. Kết quả là khả năng di chuyển trong điện trường của các loại Hb này sẽ khác nhau, tạo nên các sự phân tách khác nhau của phân tử này trong điện di.
- Kỹ thuật điện di mao quản có thể được xem như một kỹ thuật giao thoa giữa kỹ thuật điện di cổ điển và kỹ thuật sắc ký lỏng. Phương pháp này có ưu điểm là có độ nhạy cao và có thể đo lường dễ dàng các thành phần Hb xuất hiện với tỷ lệ thấp trong mẫu máu của bệnh nhân như HbA2 và HbF.
- Điện di mao quản có độ nhạy phân tích cao, một trong những yếu tố dẫn đến điều này là các chất dịch chuyển đồng đều trong mao quản tạo nên các băng dịch chuyển chứ không phải là các vùng dịch chuyển dạng parabol nên hạn chế sự dãn rộng của các băng phân tách, và các đỉnh tín hiệu thu được cao hơn, độ phân giải cao hơn.
3.5 Cấu trúc cơ bản của máy điện di mao quản
.jpg)
Trong điện di mao quản các chất được phân tách trong một mao quản silica nung chảy được chứa đầy dung dịch điện giải. Hai đầu ống mao quản được nhúng vào dung dịch điện giải. Ở gần một đầu của mao quản được gắn với detector. Hai đầu mao quản được nối với hai cực của nguồn điện một chiều (có thể thay đổi điện thế được). Điện thế càng lớn các chất dịch chuyển càng nhanh nhưng có thể không kịp tách ra khỏi nhau. Thay đổi điện thế có thể đạt được việc phân tách tốt trong thời gian ngắn nhất.
Trong điện di mao quản các ion đều dịch chuyển về phía cực âm mặc dù lực điện di làm các ion âm và ion dương di chuyển ngược chiều nhau. Hiện tượng này là do dòng điện thẩm (electroosmotic flow) sinh ra trong dung dịch đệm nằm trong lòng mao quản. Dòng dịch chuyển này thay đổi tùy thuộc vào pH, độ nhớt của môi trường... và chúng thường lớn hơn tốc độ di chuyển của các ion theo lực điện di. Như vậy, các ion dương sẽ di chuyển với tốc độ lớn hơn các ion âm, còn các chất trung tính sẽ di chuyển theo lực điện thẩm. Các chất có cấu trúc và điện tích khác nhau sẽ tách nhau ra và dịch chuyển qua detector để được phát hiện và ghi lại dưới dạng biểu đồ.
Các detector được sử dụng rất đa dạng và có độ nhạy cao trong việc phát hiện các chất thông dụng nhất là detector tử ngoại (UV detector). Nó có thể được gắn trực tiếp trên mao quản để phát hiện, dùng mao quản như tế bào đo hay dùng các tế bào đo riêng biệt. Khi sử dụng detector trực tiếp trên mao quản có độ nhạy thấp do quãng đường di chuyển ngắn.
3.6 Các vấn đề thường gặp và hướng xử lý
Cũng tương tự như các phân tích khác kết quả điện di huyết sắc tố bị ảnh hưởng bởi nhiều yếu tố khác nhau như: kích thước của mao quản, điện thế, lực ion, pH...
3.6.1 Kích thước mao quản
Những thay đổi về đường kính và chiều dài mao quản có thể làm ảnh hưởng đến độ phân giải của kết quả điện di. Chiều dài mao quản tăng sẽ dẫn đến kéo dài thời gian di chuyển và làm tăng độ phân giải và làm giảm dòng điện. Đường kính tăng làm tăng dòng điện và tạo sự thay đổi gradient nhiệt độ bên trong cột làm giảm độ phân giải. Do đó, cần lưu ý về việc sử dụng mao quản có kích thước phù hợp và các quy trình bảo dưỡng đảm bảo mao quản không bị hẹp lòng ảnh hưởng đến tín hiệu phân tích.
3.6.2 Điện thế
Điện thế ảnh hưởng đến tốc độ di chuyển của các thành phần phân tích trong môi trường điện di, do đó ảnh hưởng đến kết quả của phép điện di. Các thiết bị phân tích cần được kiểm soát sự ổn định về giá trị điện thế để đảm bảo ổn định về mặt kết quả của phép phân tích.
3.6.3 pH
Độ nhạy phân tích và hình dạng của các đỉnh tín hiệu có thể thay đổi rõ rệt khi có sự thay đổi về giá trị pH vì thông số này ảnh hưởng đến mức ion hóa của chất tan và dòng điện thẩm. Dòng điện thẩm cao ở pH cao và thấp ở pH thấp, sự thay đổi của dòng điện thẩm làm thay đổi sự dịch chuyển không do điện trường của các chất như đã được trình bày ở trên. Do đó, việc kiểm soát giá trị pH thông qua việc kiểm soát chất lượng của dung dịch buffer sử dụng là rất quan trọng. Phòng xét nghiệm cần đảm bảo bảo quản dung dịch này đúng điều kiện và đảm bảo hạn sử dụng của hóa chất trước khi cho lên hệ thống để sử dụng.
4 Tài liệu tham khảo
1. Bishop, M. L., Fody, E. P., & Schoeff, L. E. (2018). Clinical chemistry: principles, techniques, and correlations. Eighth edition. Philadelphia: Wolters Kluwer.
2. Carl A. Burtis & David E.Bruns. (2015). Clinical chemistry and molecular diagnostics, pp 171-182.
3. PGS. TS. BS. Đặng Thị Ngọc Dung, TS. Nguyễn Trọng Tuệ (2023). “Phương pháp điện di”. Kỹ thuật và thiết bị xét nghiệm y học. Nhà xuất bản y học, trang 217-229. Tải bản pdf tại đây.

