Những huyền thoại và quan niệm sai lầm về thông khí giải phóng áp lực đường thở
Bản dịch của BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tải PDF tại đây
Trong quá trình theo đuổi khoa học, các ý tưởng cạnh tranh và tranh luận là những phương tiện cần thiết để đạt được kiến thức và phơi bày sự thiếu hiểu biết của chúng ta. Trích dẫn Murray Gell
Mann (người đoạt giải Nobel Vật lý năm 1969): "Chính thống khoa học giết chết sự thật". Trong thông khí cơ học, mục tiêu là cung cấp phương pháp tiếp cận tốt nhất để hỗ trợ bệnh nhân suy hô hấp cho đến khi bệnh nền được giải quyết, đồng thời giảm thiểu thiệt hại do điều trị. Sự thỏa hiệp này đặc trưng cho triết lý đằng sau khái niệm thông khí "bảo vệ phổi". Thật không may, sự không đầy đủ của mô hình khái niệm hiện tại - chỉ tập trung vào giá trị danh nghĩa của thể tích khí lưu thông thấp và thúc đẩy sự co lại của "phổi em bé" - được phản ánh trong tỷ lệ tử vong cao ở những bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính vừa và nặng. Những dữ liệu này đòi hỏi phải khám phá và điều tra các mô hình cạnh tranh được đánh giá kỹ lưỡng thông qua một quy trình khoa học. Thông khí giải phóng áp lực đường thở (Airway Pressure Release Ventilation - APRV) là một trong những chế độ thông khí cơ học được nghiên cứu nhiều nhất nhưng vẫn gây tranh cãi, cho thấy tiền cứu trong dữ liệu thực nghiệm và lâm sàng. Trong 3 thập kỷ qua, APRV đã phát triển từ một chiến lược cứu hộ thành một phương pháp tiếp cận phòng ngừa tổn thương phổi chủ động có khả năng ổn định phổi và phục hồi tính đồng nhất của phế nang. Tuy nhiên, cho đến nay, một số trở ngại đã cản trở việc đánh giá hiệu quả lâm sàng của APRV trong các thử nghiệm ngẫu nhiên quy mô lớn. Ví dụ, không có phương pháp chuẩn hóa nào được chấp nhận rộng rãi để thiết lập APRV và do đó, không xác định được liệu tác động của nó đối với kết quả lâm sàng là do chế độ máy thở hay phương pháp được áp dụng. Ngoài ra, một vấn đề đặc biệt cản trở việc đánh giá khoa học đúng đắn về APRV là sự hiện diện phổ biến của những huyền thoại và quan niệm sai lầm được trình bày nhiều lần trong tài liệu. Trong bài đánh giá này, chúng tôi thảo luận về một số quan niệm sai lầm này và trình bày dữ liệu để thúc đẩy diễn ngôn khoa học xung quanh việc sử dụng và sử dụng sai APRV trong tài liệu hiện tại.
1 Giới thiệu
“Sự dối trá bay đi, và sự thật khập khiễng theo sau nó……. ” —Jonathan Swift. Tương tự như vậy, một huyền thoại về thông khí giải phóng áp lực đường thở (APRV) có thể được công bố, duy trì và tin là sự thật trước khi khoa học có cơ hội thoát khỏi phòng thí nghiệm. Một số huyền thoại về APRV bắt nguồn từ những gì trực giác có vẻ hợp lý khi so sánh trong đầu giữa APRV và mô hình khái niệm hiện tại về việc cung cấp “thông khí bảo vệ phổi”
Thật không may, điều này vẫn chỉ xoay quanh việc thiết lập đơn giản giá trị danh nghĩa và tùy ý của thể tích khí lưu thông “thấp” (low tidal volume - LVT) và mức áp lực thúc đẩy sự co lại hơn nữa của “phổi em bé” (Marini và Gattinoni, 2020). Dữ liệu ngày càng cho thấy mô hình này không chỉ không chính xác mà còn có thể góp phần làm tăng tỷ lệ tử vong không thể chấp nhận được ở những bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính (acute respiratory distress syndrome - ARDS) ở mức trung bình và nặng (Amato và cộng sự, 2015; Costa và cộng sự, 2021; Goligher và cộng sự, 2021; Raschke và cộng sự, 2021). Những huyềnthoại và quan niệm sai lầm khác được tạo ra từ việc gộp chung các chế độ và phương pháp thở máy khác nhau dưới một thuật ngữ chung là APRV và hành vi thở máy khác nhau từ các cách triển khai khác nhau của các nhà sản xuất máy thở.
Để nghiên cứu khoa học bất kỳ chế độ máy thở nào, phương pháp nhất quán để thiết lập và điều chỉnh chế độ là điều cần thiết. Điều này đã được thấy rõ trong thử nghiệm Mạng lưới hội chứng nguy kịch hô hấp cấp tính (ARDS) (ARDSNet) về nghiên cứu thông khí thể tích khí lưu thông thấp (ARMA) sử dụng chế độ hỗ trợ-kiểm soát thể tích (volume assist–control - VAC) và so sánh các cài đặt thấp hơn với cao hơn của thể tích khí lưu thông (VT) và áp lực cao nguyên (Pplat) (ARDSNet 2000). Chỉ cần thay đổi hai thông số này đã dẫn đến giảm đáng kể tỷ lệ tử vong ngay cả khi sử dụng cùng một chế độ. Cũng đáng quan tâm không kém, trong một phân tích tiếp theo đối với 2.587 bệnh nhân từ nghiên cứu ARMA đáp ứng các tiêu chí nhưng không được ghi danh vì lý do kỹ thuật, đã chỉ ra rằng VT cao hoặc thấp sẽ làm tăng hoặc làm giảm tỷ lệ tử vong, tùy thuộc vào độ giãn nở hệ thống hô hấp (respiratory system compliance - CRS) của từng bệnh nhân như thể hiện trong Hình 1 (Deans và cộng sự, 2005). Những dữ liệu ban đầu này được hỗ trợ thêm bởi các nghiên cứu gần đây hơn (Amato và cộng sự, 2015; Costa và cộng sự, 2021; Goligher và cộng sự, 2021; Raschke và cộng sự, 2021) và làm rõ rằng chiến lược thông khí bảo vệ chỉ có thể được diễn giải trong bối cảnh cơ học hô hấp. Không còn nghi ngờ gì nữa, ngay cả những thay đổi nhỏ trong cài đặt chế độ cũng có thể có tác động đáng kể đến kết quả tùy thuộc vào mức độ bệnh lý phổi và tính không đồng nhất của bệnh nhân, cho thấy nhu cầu cá nhân hóa các chiến lược bảo vệ phổi (Nieman và cộng sự, 2017a; Pelosi và cộng sự, 2021; Cheng và cộng sự, 2022).
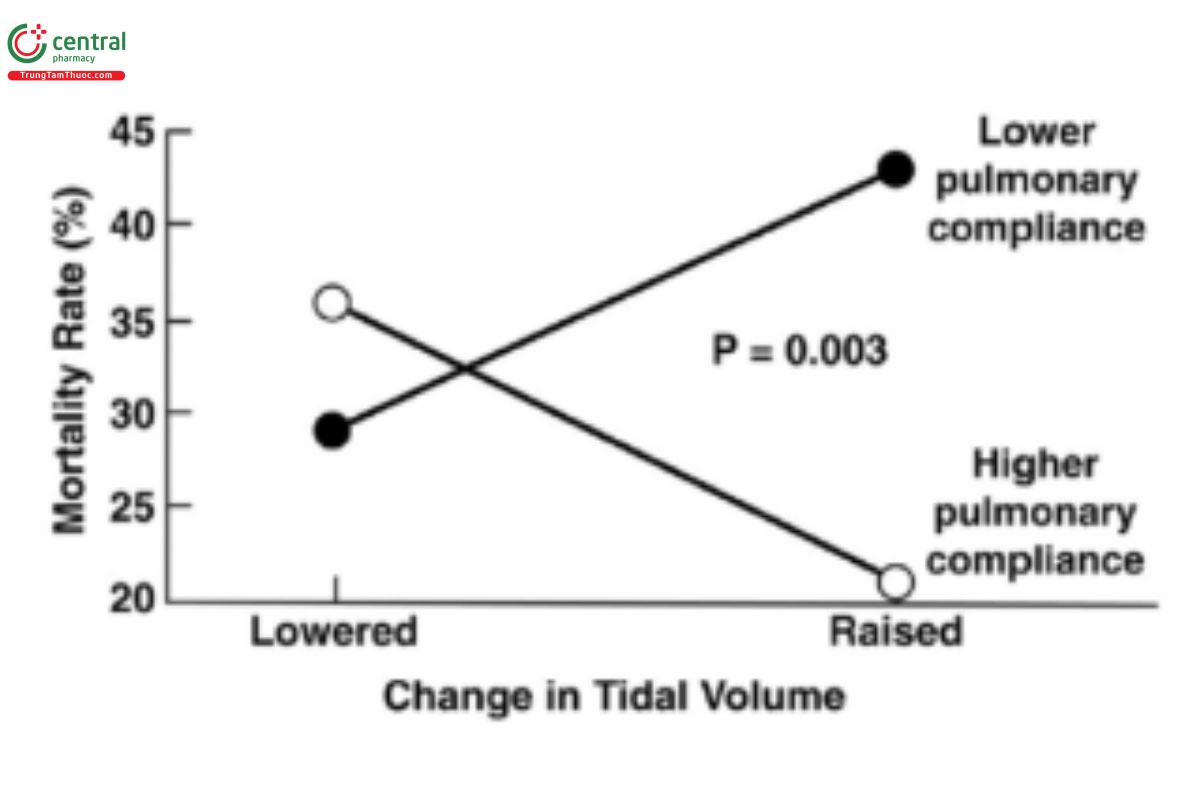
HÌNH 1. Dữ liệu từ Thử nghiệm ARMA ban đầu cho thấy mối tương quan giữa thể tích khí lưu thông (VT) và độ giãn nở hệ thống hô hấp (CRS) của từng bệnh nhân đối với tỷ lệ tử vong. Sử dụng chế độ kiểm soát hỗ trợ thể tích, VT thấp hơn làm giảm tỷ lệ tử vong với CRS thấp trong khi VT cao hơn làm tăng tỷ lệ tử vong ở những bệnh nhân có CRS cao. (Deans và cộng sự, 2005).
Mặc dù APRV đã có trên các máy thở thương mại từ năm 1987, nhưng phương pháp áp dụng chế độ này rất khác nhau trong các tài liệu y khoa và thực hành lâm sàng (Hình 2) (Jain và cộng sự, 2016; Habashi và cộng sự, 2021). Hiện tại, APRV là một từ viết tắt không rõ ràng, dùng để chỉ một chế độ mà không có phương pháp áp dụng nhất quán. Trên thực tế, APRV thường được sử dụng như một từ đồng nghĩa với chế độ áp lực đường thở dương hai pha (biphasic positive airway pressure - BIPAP) đến mức trong tài liệu thường được chỉ định là chế độ BIPAP/APRV vô nghĩa (Neumann và cộng sự, 2002; Dries và Marini, 2009; Kallet 2011; Daoud và cộng sự, 2012). Sau đó, kết quả trong cả nghiên cứu khoa học cơ bản và lâm sàng sử dụng APRV với các cài đặt khác nhau (Jain và cộng sự, 2016) đã dẫn đến sự nhầm lẫn hơn nữa về hiệu quả tương đối của các thành phần riêng lẻ của cài đặt APRV - đặc biệt là giá trị cài đặt thời gian hít vào (THigh) và thở ra (TLow) (Habashi và cộng sự, 2022). APRV ban đầu được mô tả là áp lực đường thở dương liên tục (continuous positive airway pressure - CPAP) với giai đoạn giải phóng. Có bốn cài đặt cơ bản để kiểm soát trong APRV ngoài FiO2: 1) PHigh (áp lực hít vào tương tự như Pplat; 2) THigh (thời gian hít vào) - khi kết hợp với PHigh kiểm soát thể tích phổi cuối thì hít vào và được gọi là giai đoạn CPAP; 3) PLow (áp lực thở ra tương tự như PEEP); 4) TLow (thời gian thở ra) - khi kết hợp với PLow kiểm soát thể tích phổi cuối thì thở ra (end expiratory lung volume - EELV) và được gọi là giai đoạn giải phóng (Release Phase) (Hình 3). Phương pháp thiết lập và điều chỉnh APRV đã được sử dụng nhiều nhất trong lâm sàng, kéo dài hơn 30 năm và được nghiên cứu tốt nhất một cách nhất quán trên các mô hình động vật chuyển dịch vượt quá hướng dẫn về mô hình động vật của Hiệp hội Lồng ngực Hoa Kỳ (Matute-Bello và cộng sự, 2011) là phương pháp Thông khí thích ứng có kiểm soát thời gian (Time Controlled Adaptive Ventilation - TCAV™) (Roy và cộng sự, 2012; Roy S. và cộng sự, 2013; Roy SK. và cộng sự, 2013; Andrews và cộng sự, 2013a; Andrews và cộng sự, 2013b; Emr và cộng sự, 2013; Kollisch-Singule và cộng sự, 2014a; Kollisch-Singule và cộng sự, 2014b; Kollisch Singule và cộng sự, 2015; Kollisch-Singule và cộng sự, 2016a; Kollisch-Singule và cộng sự cộng sự, 2019; Smith và cộng sự, 2015; Jain và cộng sự, 2017;Silva và cộng sự, 2018; Mahajan và cộng sự, 2019; Al-khalisy và cộng sự, 2020; Bates và cộng sự, 2020; de Magalhães và cộng sự, 2021; Vasconcellos de Oliveira và cộng sự, 2022).
Phương pháp TCAV™ nhấn mạnh vào việc kiểm soát thời gian áp lực trên và dưới và phương pháp thích ứng để cá nhân hóa chiến lược bảo vệ phổi cho cơ chế hô hấp của từng bệnh nhân trong suốt quá trình tiến triển hoặc hồi phục của bệnh phổi (Habashi 2005; Habashi và cộng sự, 2011; Habashi và Andrews, 2013; Habashi và cộng sự, 2019).
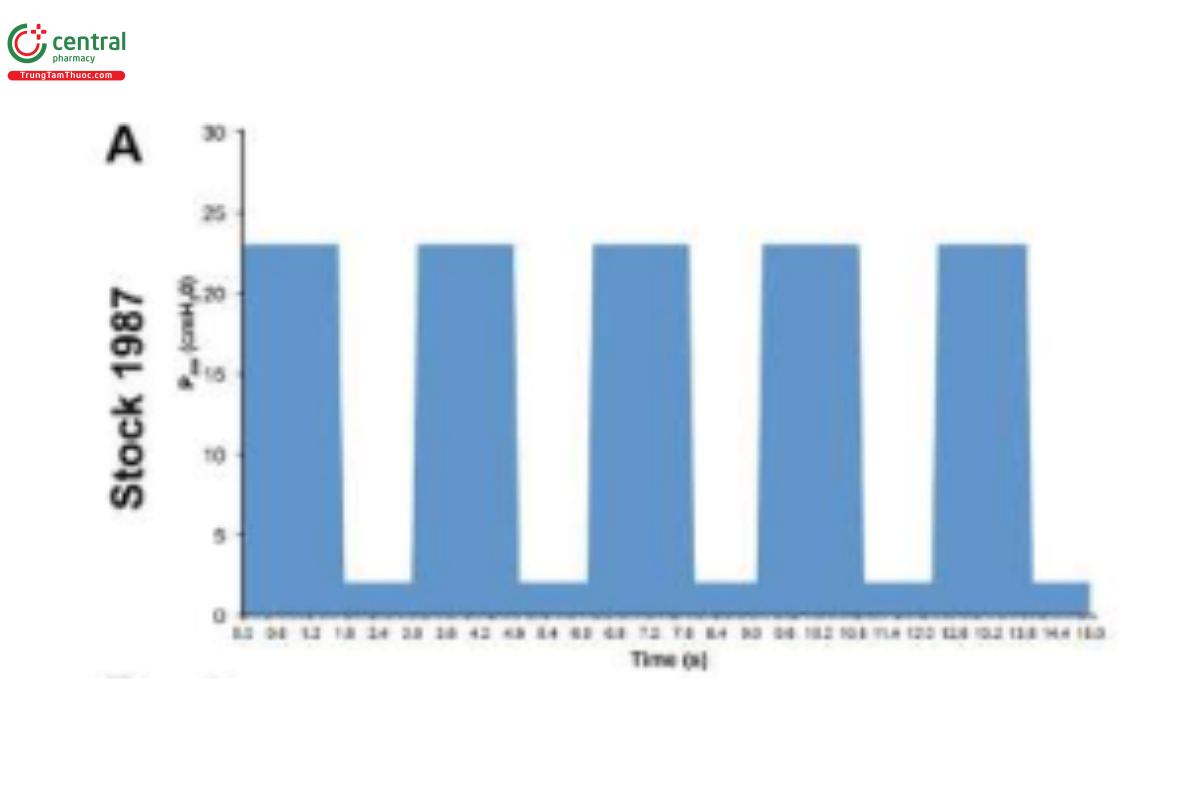
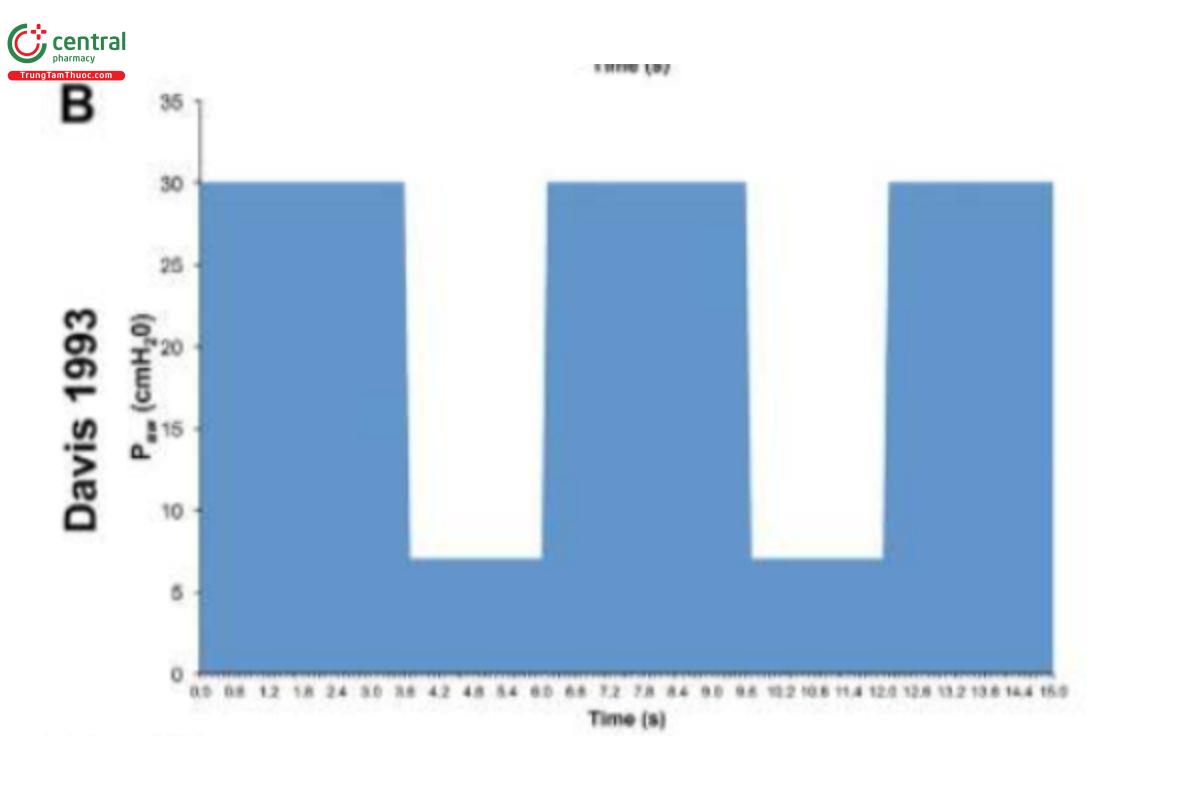
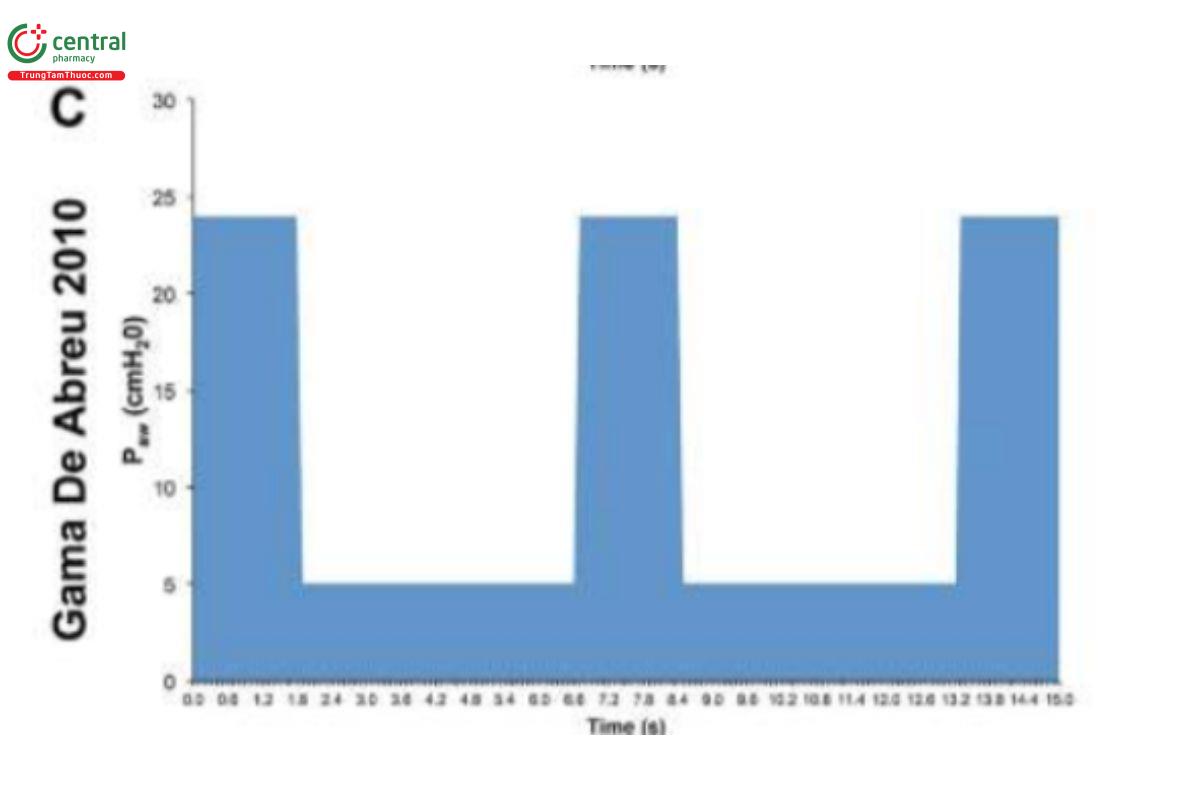
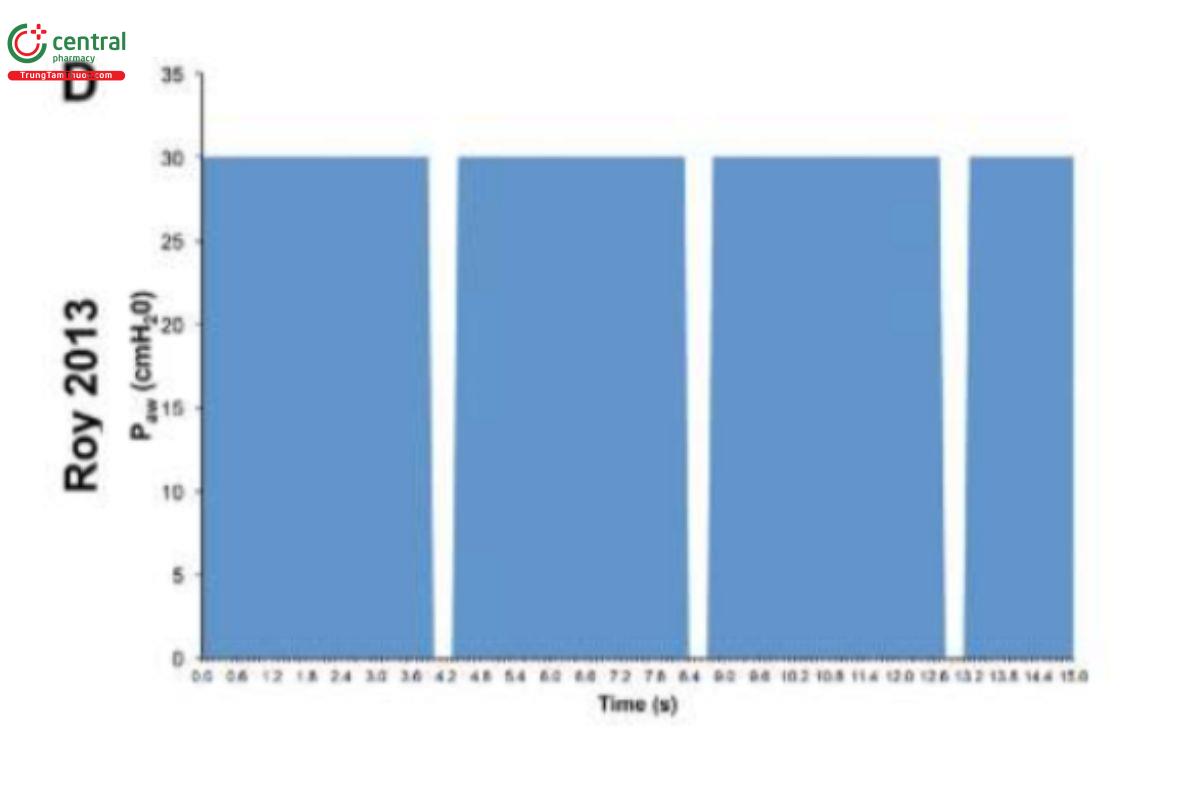 HÌNH 2. Dạng sóng áp lực/thời gian của Thông khí giải phóng áp lực đường thở (APRV) từ 4 nghiên cứu: (A) Stock và cộng sự, 1987 đặt thời gian ở PLow (TLow) là 1,27 giây (Stock và cộng sự, 1987); (B) Davis và cộng sự, 1993 sử dụng tỷ lệ hít vào/thở ra tăng lên (Davis và cộng sự, 1993); (C) Gama de Abreau 2010 mô phỏng thông khí thông thường (Gama de Abreau 2010); (D) Roy và cộng sự, 2013a sử dụng phương pháp thông khí thích ứng kiểm soát thời gian (Roy SK. và cộng sự, 2013). Điều này minh họa cho sự thay đổi lớn trong các phương pháp được sử dụng để đặt APRV, điều này có thể ảnh hưởng đáng kể đến kết quả (Jain và cộng sự, 2016).
HÌNH 2. Dạng sóng áp lực/thời gian của Thông khí giải phóng áp lực đường thở (APRV) từ 4 nghiên cứu: (A) Stock và cộng sự, 1987 đặt thời gian ở PLow (TLow) là 1,27 giây (Stock và cộng sự, 1987); (B) Davis và cộng sự, 1993 sử dụng tỷ lệ hít vào/thở ra tăng lên (Davis và cộng sự, 1993); (C) Gama de Abreau 2010 mô phỏng thông khí thông thường (Gama de Abreau 2010); (D) Roy và cộng sự, 2013a sử dụng phương pháp thông khí thích ứng kiểm soát thời gian (Roy SK. và cộng sự, 2013). Điều này minh họa cho sự thay đổi lớn trong các phương pháp được sử dụng để đặt APRV, điều này có thể ảnh hưởng đáng kể đến kết quả (Jain và cộng sự, 2016).
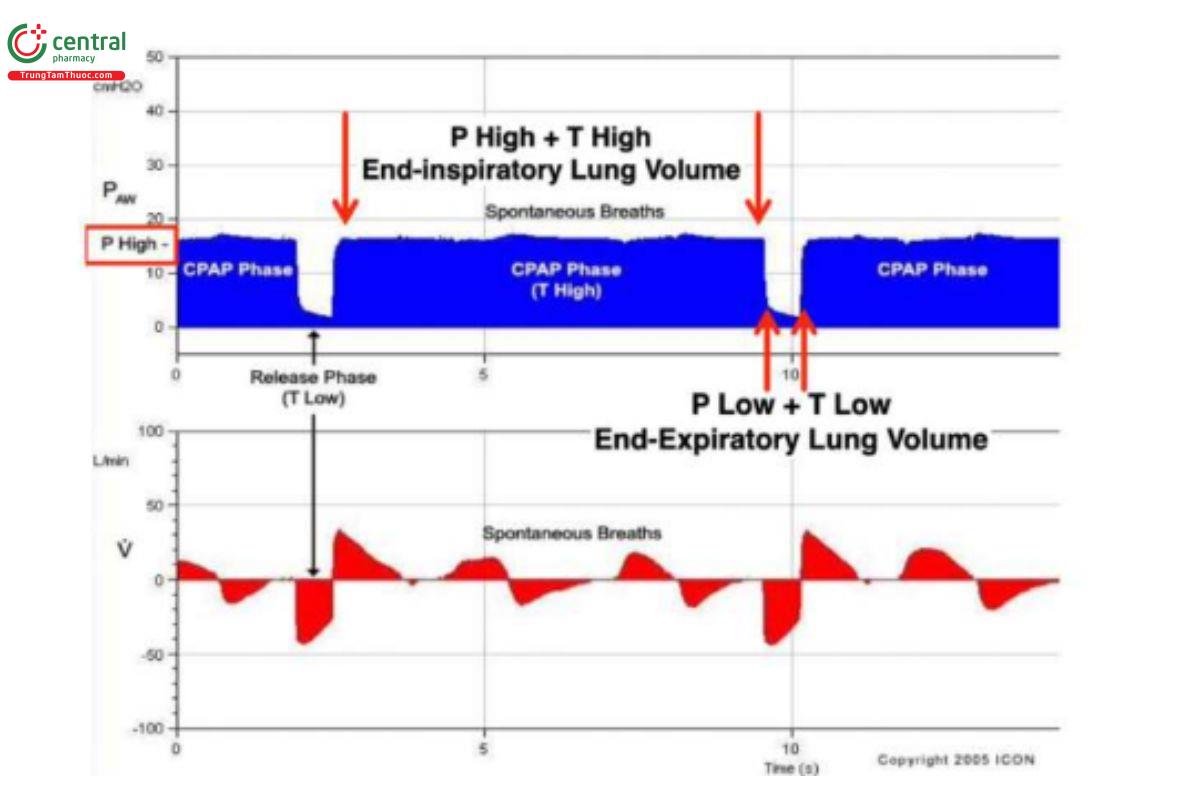
HÌNH 3. Thông khí giải phóng áp lực đường thở (APRV) là chế độ giới hạn áp lực, theo chu kỳ thời gian. Phương pháp thông khí thích ứng kiểm soát thời gian (TCAVTM) để thiết lập chế độ APRV bao gồm các thiết lập sau: 1) áp lực đường thở cao (PHigh); 2) áp lực đường thở thấp (PLow); 3) thời gian ở PHigh (THigh); và 4) thời gian ở PLow (TLow). Kết hợp, PHigh và THigh tạo thành Pha áp lực đường thở dương liên tục (CPAP) và tác động đến thể tích phổi cuối thì hít vào. Pha CPAP giải phóng thành PLow và TLow kết hợp, tạo thành Pha Giải phóng và tác động đến thể tích phổi cuối thì thở ra. Trong phương pháp APRV TCAVTM, máy thở luân phiên giữa Pha CPAP và Pha Giải phóng. Trong pha giải phóng, TLow được cài đặt để kết thúc ở 75% lưu lượng thở ra đỉnh sẽ ngăn chặn tình trạng mất ổn định phế nang. Sau đó, Giai đoạn CPAP duy trì sự ổn định của phế nang và tăng thể tích phổi theo thời gian (từ vài giờ đến vài ngày).
Điểm độc đáo của phương pháp TCAV™ để thiết lập APRV là sử dụng thở ra thụ động mà không có PEEP được thiết lập và phân tích độ dốc của đường cong lưu lượng - thời gian thở ra (SLOPEEF) (Dixon và Brodie, 1903; Rahn và cộng sự, 1946; Mead và Whittenberger, 1953; Brody, 1954; Comroe 1954; Brody và DuBois, 1956; McIlroy và cộng sự, 1963; Bergman 1966; Grimby và cộng sự, 1968; Ashutosh và Keighley, 1978; Behrakis và cộng sự, 1983; Richardson và cộng sự, 1989; Baydur và Carlson, 1994; Brunner và cộng sự, 1995; Guttmann và cộng sự, 1995; Nassar và cộng sự, 2012) để cá nhân hóa VT theo CRS, đã được xác nhận bằng thực nghiệm và lâm sàng (Roy và cộng sự, 2012; Roy S. và cộng sự, 2013; Roy SK. và cộng sự, 2013; Andrews và cộng sự, 2013b; Emr và cộng sự, 2013; Kollisch -Singule và cộng sự, 2014a; -Singule và cộng sự, 2014b; Kollisch Singule và cộng sự, 2015; Kollisch-Singule và cộng sự, 2016; Jain và cộng sự, 2017; Silva và cộng sự, 2018; Mahajan và cộng sự, 2019; Al-khalisy và cộng sự, 2020; Bates và cộng sự, 2020; de Magalhães và cộng sự, 2021; Vasconcellos de Oliveira và cộng sự, 2022). TLow được điều chỉnh theo độ đàn hồi của hệ hô hấp (ERS) để ngăn chặn sự xẹp phế nang, hỗ trợ sự ổn định của khoảng khí xa (distal airspace) và khi kết hợp với PHigh và THigh, pha CPAP dần dần bình thường hóa thể tích phổi trong nhiều giờ đến nhiều ngày (Kollisch-Singule và cộng sự, 2014a; Boehme và cộng sự, 2015; Kollisch-Singule và cộng sự, 2016a). Điều này cho phép phổi của mỗi bệnh nhân xác định thời gian để bình thường hóa thể tích phổi thay vì bác sĩ lâm sàng phải ép phổi mở ra như với các biện pháp huy động (recruitment maneuvers - RM).
Chúng tôi đã xem xét các tài liệu liên quan hiện tại được xác định bằng OvidSP và cơ sở dữ liệu MEDLINE của Thư viện Y khoa Quốc gia thông qua PubMed để tìm các bài báo đã xuất bản sử dụng APRV và xác định các huyền thoại và quan niệm sai lầm thường thấy trong tài liệu. Bài đánh giá này thảo luận về 10 huyền thoại và quan niệm sai lầm về APRV, phần lớn dựa trên các ý kiến hoặc sự không nhất quán về phương pháp luận và thiếu bằng chứng để hỗ trợ cho những tuyên bố không chính xác đó. Ngoài ra, chúng tôi thấy rằng nhiều huyền thoại về APRV bắt nguồn từ các bài báo tổng quan, bài xã luận hoặc phần thảo luận của các bài báo. Nói cách khác, chúng phản ánh các suy luận, suy diễn, niềm tin cá nhân bao gồm cả sự cường điệu nhưng lại thiếu sự thúc đẩy của bằng chứng khoa học đáng tin cậy. Những ý kiến này sau đó trở thành một buồng vọng vang vọng trong tài liệu và trở thành sự thật hiển nhiên.
2 Huyền thoại số 1—Thông khí giải phóng áp lực đường thở quá khó sử dụng
Một số bài báo đưa ra các tuyên bố như: “APRV đã phát triển thành một kiểu nhịp thở cơ học động, do sinh lý điều khiển, cực kỳ tinh vi với các thiết lập chính xác, điều này có thể gây ra khả năng sai lệch kiến thức của nhân viên” (Zhong và cộng sự, 2020) và “APRV phức tạp hơn vẻ bề ngoài của nó. Nó đòi hỏi nhiều kiến thức và kỹ năng hơn những gì có thể thấy rõ từ các mô tả trong tài liệu (Chatburn và cộng sự, 2016).” Những tuyên bố này và các tuyên bố khác (MacIntryre, 2011) khiến người đọc tin rằng APRV quá khó để sử dụng đối với bác sĩ lâm sàng đang hành nghề trung bình. Hơn nữa, có ý kiến cho rằng mô phỏng là cách thực tế duy nhất để hiểu về APRV vì kinh nghiệm tương đương với bệnh nhân thực tế có thể mất nhiều năm và khiến nhiều người gặp rủi ro (sic) (Chatburn và cộng sự, 2016). Điều này ngụ ý rằng không có rủi ro khi sử dụng bất kỳ chế độ máy thở nào khác cũng như không yêu cầu kỹ năng và bỏ qua tỷ lệ tử vong với các phương pháp tiếp cận hiện tại để quản lý ARDS vẫn dao động từ 35 đến 49% (Villar và cộng sự, 2014; Bellani và cộng sự, 2016; Cavalcanti và cộng sự, 2017). Hơn nữa, đào tạo thở máy nói chung thiếu cấu trúc, không chuẩn hóa - dẫn đến đào tạo và kiến thức kém về thở máy - và thường khiến người được đào tạo không hài lòng (Goligher và cộng sự, 2012; Wilcox và cộng sự, 2016; Keller và cộng sự, 2019; Seam và cộng sự, 2021). Thêm vào đó là sự tồn tại của đường cong học tập đối với bất kỳ thiết bị y tế, quy trình, kỹ thuật hoặc chế độ máy thở mới nào bao gồm APRV (Govindarajulu và cộng sự, 2017). Thật vậy, giống như bất kỳ chế độ nào khác, việc sử dụng APRV lần đầu tiên mà không có hiểu biết chung về cơ sở lý luận và các thiết lập trên một bệnh nhân ARDS nặng, bệnh nặng và không ổn định, đang thất bại với 'các liệu pháp thông thường' có thể không thành công như khi được áp dụng bởi những nhà cung cấp có kinh nghiệm và sử dụng hàng ngày như chiến lược thở máy chính của họ. Trên thực tế, APRV đã được sử dụng thành công trên hàng chục nghìn bệnh nhân trong hơn 30 năm và tiếp tục là một phần của hoạt động chăm sóc hàng ngày tại nhiều bệnh viện, thu thập được một lượng lớn dữ liệu thực nghiệm (Sadowitz và cộng sự, 2011; Andrews và cộng sự, 2013b; Mallory và Cheifetz, 2020; Rola và Daxon, 2022). Có thể hiểu được rằng những người dùng chưa bao giờ thực sự sử dụng APRV hoặc không quen với cách suy nghĩ này về thở máy có thể coi nó quá khó (Nieman và cộng sự, 2017a; Nieman và cộng sự, 2017b; Nieman và cộng sự, 2018b;Nieman và cộng sự, 2020a; Nieman và cộng sự, 2020b). Tuy nhiên, có nhiều thứ trong y học và thực hành lâm sàng có vẻ khó khăn hơn nhiều nhưng được sử dụng với giáo dục và đào tạo phù hợp như thông khí dao động tần số cao (high frequency oscillatory ventilation - HFOV) và oxygen hóa qua màng ngoài cơ thể. Trên thực tế, sau thử nghiệm ARMA, các bác sĩ lâm sàng tại 10 địa điểm ARDSNet ban đầu đã được khảo sát về cách sử dụng và kinh nghiệm của họ đối với giao thức ARDSNet (Rubenfeld và cộng sự, 2004). Cuộc khảo sát cho thấy các bác sĩ lâm sàng có kinh nghiệm tại giường bệnh nhận thấy những rào cản quan trọng đối với việc triển khai thông khí bảo vệ phổi. Rõ ràng, những hạn chế như vậy có thể được khắc phục bằng giáo dục, đào tạo và kinh nghiệm và không chỉ thấy ở APRV.
Mặc dù được nhấn mạnh quá mức, mối quan tâm về cài đặt APRV đã thấm nhuần trong tài liệu nhưng cách tiếp cận thông thường hơn đối với cài đặt máy thở như VT, nhịp thở (RR) và PEEP vẫn còn gây tranh cãi mặc dù đã có nhiều thập kỷ nghiên cứu và tranh luận (Deans và cộng sự, 2005; Amato và cộng sự, 2015; Sahetya và cộng sự, 2017; Algera và cộng sự, 2018; Costa và cộng sự, 2021; Goligher và cộng sự, 2021; Pelosi và cộng sự, 2021; Abrams và cộng sự, 2022; Dianti và cộng sự, 2022). Ngoài ra, các yếu tố quan trọng của thông khí cơ học như RR, thời gian và lưu lượng hít vào, thời gian và lưu lượng thở ra thường không được báo cáo hoặc bỏ qua - trong khi chúng là những thành phần thiết yếu của tổng năng lượng truyền đến phổi (Gattinoni và cộng sự, 2016; Bates và cộng sự, 2020) và sự kết hợp của các yếu tố này có thể thúc đẩy quá trình chữa lành hoặc gây tổn thương phổi.
Đối với việc là một chế độ thông khí cực kỳ phức tạp hoặc quá khó để học, APRV không yêu cầu hiểu biết sâu sắc về các cài đặt đặc biệt như tần số (chu kỳ mỗi giây) được đặt theo Hz và biên độ/công suất cũng như không cần sử dụng máy thở chuyên dụng như với HFOV. Trên thực tế, APRV có sẵn trên hầu hết các máy thở của khoa chăm sóc đặc biệt (ICU) dưới dạng chế độ tiêu chuẩn hoặc tùy chọn. Giống như bất kỳ chế độ máy thở nào, APRV sử dụng các yếu tố giống nhau: 1) áp lực, 2) lưu lượng và 3) thể tích. Chìa khóa là cấu hình cá nhân hóa của các yếu tố để tạo ra kiểu áp lực đường thở ổn định (giai đoạn CPAP) cung cấp tốc độ (giai đoạn giải phóng). Hồ sơ đường thở của APRV làm nổi bật và tận dụng việc sử dụng thời gian trong một cơ quan nhớt đàn hồi phụ thuộc vào thời gian như phổi (Nieman và cộng sự, 2017a; Nieman và cộng sự, 2017b; Nieman và cộng sự, 2020a; Nieman và cộng sự, 2020b). Cài đặt APRV tiêu chuẩn bao gồm: 1) áp lực đường thở cao (PHigh), 2) thời gian ở PHigh (THigh) [kết hợp những yếu tố này xác định pha CPAP]; 3) áp lực đường thở thấp (PLow) và 4) thời gian ở PLow (TLow) [kết hợp những yếu tố này xác định pha giải phóng] (Hình 3). Với phương pháp TCAV™, PHigh được đặt thành Pplat như bạn sẽ làm trong chế độ áp lực. PLow [thường được gọi là PEEP trong các chế độ thông khí khác] được đặt thành 0 cmH2O vì EELV được kiểm soát trực tiếp theo thời gian thay vì PEEP đã đặt. Điều này đơn giản hóa việc tìm kiếm PEEP tối ưu vốn vẫn khó nắm bắt mặc dù đã nghiên cứu và tranh luận trong hơn 50 năm và vẫn thiếu một phương pháp tiếp cận tinh chỉnh để cá nhân hóa (Sahetya và cộng sự, 2017). Việc điều chỉnh thời gian cũng được đơn giản hóa vì TLow được sử dụng để cân bằng ERS bằng cách duy trì EELV và ngăn ngừa sự sụp đổ khi thở ra (Kollisch-Singule và cộng sự, 2014a). Việc thiết lập và cá nhân hóa TLow để đạt được sự chấm dứt lưu lượng thở ra (EFT) ở 75% tốc độ lưu lượng thở ra đỉnh (EPF) trong ERS bình thường đến cao - và 25% với ERS thấp như bệnh phổi tắc nghẽn mạn tính (chronic obstructive pulmonary disease - COPD) - nắm bắt phần lớn các hằng số thời gian đóng, do đó duy trì sự ổn định của phế nang và tính thông suốt của ống dẫn (Kollisch Singule và cộng sự, 2014a, b; Vasconcellos de Oliveira và cộng sự, 2022). Việc cá nhân hóa TLow này giúp đơn giản hóa việc ghép nối VT với CRS và cung cấp đánh giá không xâm lấn, tại giường bệnh, thời gian thực bằng cách sử dụng SLOPEEF, tất cả đều phù hợp với những thay đổi đang diễn ra hoặc đang giải quyết trong cơ chế hệ hô hấp. Vì VT không tương quan tốt với cân nặng cơ thể dự đoán (predicted body weight - PBW) ở bệnh nhân ARDS và có vẻ như việc chuẩn hóa VT theo CRS (tức là áp lực đẩy) liên quan đến kết quả tốt hơn (Amato và cộng sự, 2015; Costa và cộng sự, 2021; Goligher và cộng sự, 2021; Pelosi và cộng sự, 2021), nên việc cá nhân hóa VT thấp theo CRS có thể dễ dàng hơn cho việc theo dõi bên giường bệnh theo thời gian thực và tỏ ra có lợi (Nieman và cộng sự, 2017a; Nieman và cộng sự, 2017b; Nieman và cộng sự, 2020a; Nieman và cộng sự, 2020b; Pelosi và cộng sự, 2021; Cheng và cộng sự, 2022; Habashi và cộng sự, 2022). Sau khi lực giật của phổi được trung hòa bằng TLow, THigh sẽ được điều chỉnh để thông khí bằng cách kiểm soát RR, đây là chế độ chung của tất cả các chế độ máy thở.
3 Huyền thoại số 2—Thông khí giải phóng áp lực đường thở gây ra chấn thương áp lực
Một trong những huyền thoại phổ biến nhất liên quan đến APRV là nó gây ra chấn thương áp lực (barotrauma) (Myers và Macintyre, 2007; Dries và Marini, 2009; Esan và cộng sự, 2010; Kallet 2011; Daoud và cộng sự, 2012; Mireles-Cabodevila và Kcmarek, 2016; Hirshberg và cộng sự, 2018; Kami và cộng sự, 2019), nhưng chưa được tài liệu khoa học hỗ trợ. Chúng tôi không nói rằng chấn thương do áp lực không xảy ra với APRV, nhưng chúng tôi muốn nói rằng nó không xảy ra thường xuyên hơn bất kỳ tình trạng thông khí nào khác - kể cả ở những bệnh nhân được thở máy không xâm lấn hoặc ống thông mũi lưu lượng cao (Hamouri và cộng sự, 2021; Palumbo và cộng sự, 2021; Shrestha và cộng sự, 2022). Trên thực tế, không có bằng chứng nào chứng minh bất kỳ thành phần nào (đơn lẻ hoặc kết hợp) là nguyên nhân duy nhất gây ra chấn thương do áp lực.
Sẽ rất khó để thiết lập mối quan hệ nhân quả chỉ từ một chế độ hoặc cài đặt máy thở cụ thể vì chấn thương do áp lực là đa yếu tố bao gồm tính không đồng nhất của quần thể, mức độ nghiêm trọng và tính không đồng nhất của bệnh phổi mà các cài đặt được áp dụng. Trên thực tế, một nghiên cứu trên 5.183 bệnh nhân cho thấy không có mối tương quan giữa chấn thương do áp lực và chế độ thông khí hoặc cài đặt máy thở (Anzueto và cộng sự, 2004). Hơn nữa, trong 30 năm thử nghiệm có đối chứng ngẫu nhiên (randomized controlled trials - RCT) quy mô lớn so sánh các chế độ, cài đặt và thông số máy thở khác nhau bao gồm VT 6 ml/kg so với 12 ml/kg (ARDSNet, 2000), PEEP thấp so với cao (Brower và cộng sự, 2004) và áp lực đường thở (Paw) trung bình thấp so với cao (Ferguson và cộng sự, 2013; Young và cộng sự, 2013), không có mối quan hệ trực tiếp nào liên kết chấn thương do áp lực với một chế độ hoặc cài đặt máy thở cụ thể. Ngoài ra, một đánh giá có hệ thống và phân tích tổng hợp của tám RCT so sánh các chiến lược PEEP cao hơn so với thấp hơn bao gồm 2.728 bệnh nhân mắc ARDS cho thấy không có sự khác biệt về tỷ lệ chấn thương do áp lực (Fan và cộng sự, 2017). Một ngoại lệ là thử nghiệm huy động phế nang cho hội chứng nguy kịch hô hấp cấp tính năm 2017, trong đó có sự khác biệt đáng kể về tỷ lệ chấn thương do áp lực giữa nhóm được điều trị RM phổi với hiệu chỉnh PEEP lên đến 45 cmH2O (5,6%) so với nhóm PEEP thấp (1,6%) (Cavalcanti và cộng sự, 2017).
Khả năng xảy ra chấn thương do áp lực có vẻ chủ yếu liên quan đến mức độ nghiêm trọng của bệnh phổi tiềm ẩn (cấp tính hoặc mãn tính), có thể trở nên trầm trọng hơn do thở máy (Anzueto và cộng sự, 2004). Gần đây hơn, tỷ lệ chấn thương do áp lực đã được báo cáo là xảy ra với tần suất cao hơn ở ARDS liên quan đến COVID (CARDS) nhưng không cụ thể cho bất kỳ chế độ máy thở nào (McGuinness và cộng sự, 2020; Gazivoda và cộng sự, 2021; Hamouri và cộng sự, 2021; Rajdev và cộng sự, 2021; Udi và cộng sự, 2021; Belletti và cộng sự, 2022; Shrestha và cộng sự, 2022). Trong một đánh giá có hệ thống và phân tích tổng hợp, mối liên hệ tuyến tính giữa tỷ lệ chấn thương do áp lực tăng với mức độ nghiêm trọng của bệnh tăng đã được quan sát thấy ở những bệnh nhân COVID-19 cần nhiều hình thức hỗ trợ hô hấp xâm lấn và không xâm lấn (Shrestha và cộng sự, 2022). Mặc dù nguy cơ chấn thương do áp lực tăng cao ở COVID-19, không thấy sự khác biệt về chấn thương do áp lực giữa APRV hoặc ARDSNet VT thấp (LVT) trong nghiên cứu gần đây trên bệnh nhân CARDS (Ibarra-Estrada và cộng sự, 2022).
Cho đến nay, trong các RCT so sánh APRV với các chế độ máy thở khác trong đó có báo cáo về tràn khí màng phổi hoặc tràn khí trung thất, không có tỷ lệ chấn thương áp lực tăng (Maxwell và cộng sự, 2010; Lim và cộng sự, 2016; Ganesan và cộng sự, 2018; Hirshberg và cộng sự, 2018; Lim và Litton, 2019; Zhong và cộng sự, 2020; Ibarra Estrada và cộng sự, 2022). Ngược lại, Maxwell và cộng sự (2010) cho thấy tỷ lệ tràn khí màng phổi thấp hơn ở APRV (0%) khi so sánh với LVT (3,1%) và phân tích tổng hợp của bảy RCT với 405 bệnh nhân đủ điều kiện không cho thấy sự khác biệt thống kê giữa LVT và APRV về tỷ lệ tràn khí màng phổi (Zhong và cộng sự, 2020). Ngoài ra, một đánh giá có hệ thống cho thấy tỷ lệ tử vong dường như thấp hơn với APRV và không có bằng chứng về nguy cơ tăng chấn thương do áp lực hoặc các hậu quả bất lợi khác với APRV so với LVT ở bệnh nhân ARDS (Lim và Litton, 2019). Cuối cùng, trong ba mô hình lợn có thể áp dụng lâm sàng về ARDS do nhiễm trùng huyết (Roy và cộng sự, 2012; Roy S. và cộng sự, 2013; Roy SK. và cộng sự, 2013; Kollisch-Singule và cộng sự, 2015) và một mô hình hội chứng suy hô hấp ở trẻ sơ sinh trên lợn (Kollisch-Singule và cộng sự, 2016a), không ghi nhận chấn thương do áp lực và ngăn ngừa tổn thương phổi khi sử dụng APRV.
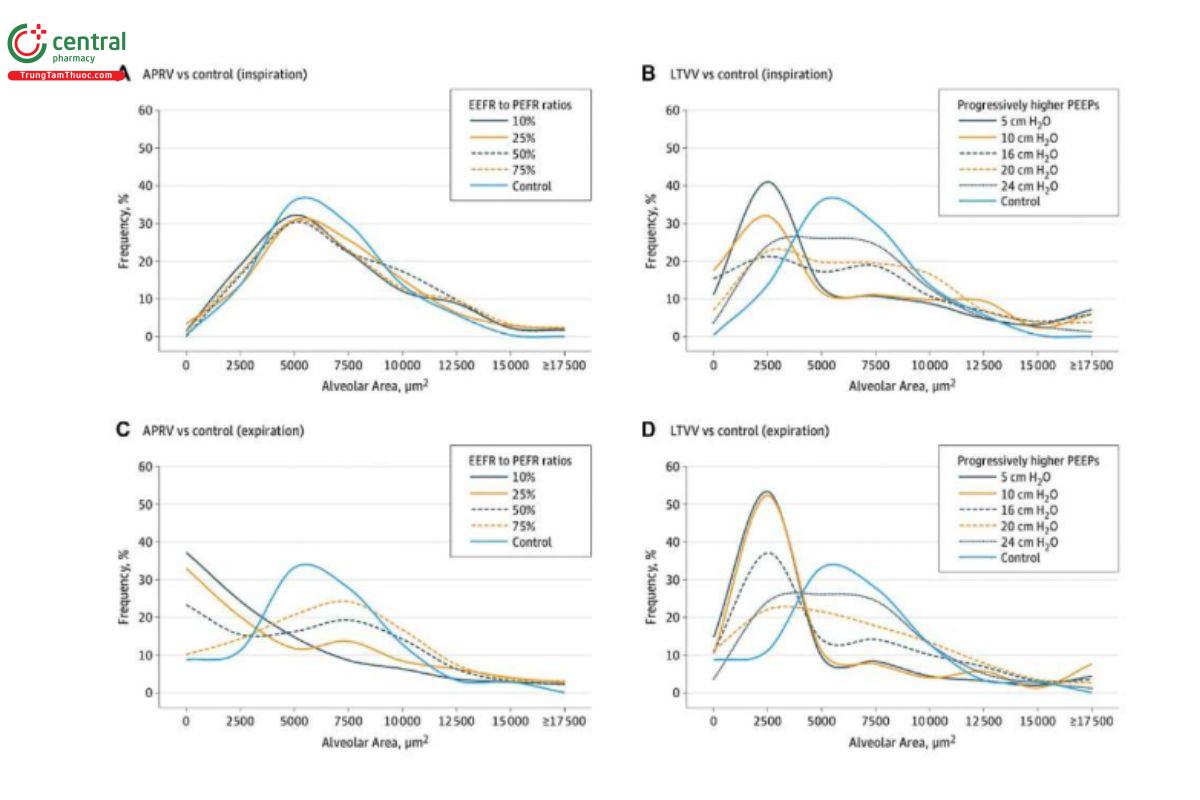
Theo thực nghiệm, các nghiên cứu về strain (biến dạng) vi mô sử dụng APRV với phương pháp TCAV™ so với LVT cho thấy APRV có strain thấp nhất lên các khoảng khí xa (Hình 4) (phế nang và ống dẫn), giảm thiểu tình trạng giãn ống dẫn (Hình 5) và phục hồi tính đồng nhất của phế nang (Hình 6) sau tổn thương phổi không đồng nhất khi so sánh với LVT với PEEP lên đến 24 cmH2O (Kollische Singule và cộng sự, 2014a; Kollische-Singule và cộng sự, 2014b; Kollische-Singule và cộng sự, 2015). Các nghiên cứu này cho thấy strain phổi thấp hơn với phương pháp TCAV™ và có thể có lợi để giảm tỷ lệ chấn thương do áp lực. Tóm lại, bệnh phổi tiềm ẩn là nguy cơ chính gây ra chấn thương do áp lực (Anzueto và cộng sự, 2004; McGuinness và cộng sự, 2020; Gazivoda và cộng sự, 2021; Hamouri và cộng sự, 2021; Rajdev và cộng sự, 2021; Udi và cộng sự, 2021; Shrestha và cộng sự, 2022) và do đó rất khó để xác định bất kỳ chế độ hoặc cài đặt máy thở nào.
4 Huyền thoại số 3—Thông khí giải phóng áp lực đường thở tạo ra thể tích khí lưu thông cao dẫn đến chấn thương thể tích
Một số bài báo ý kiến (Kallet 2011; Modrykamien và cộng sự, 2011; Daoud và cộng sự, 2012) tham khảo các nghiên cứu ngụ ý rằng bản thân APRV tạo ra VT cao (Räsänen và cộng sự, 1991; Neumann và cộng sự, 2002; Varpula và cộng sự, 2004), có khả năng góp phần gây ra chấn thương thể tích (volutrauma). Tuy nhiên, các nghiên cứu này chứng minh rằng các cài đặt do người vận hành lựa chọn (và không phải chế độ) tạo ra VT cao nhưng vẫn không báo cáo bằng chứng nào về chấn thương thể tích. Ví dụ, trong nghiên cứu của Räsänen và cộng sự (1991), không đề cập rằng mặc dù VT ở nhóm APRV là 9 ml/kg, nhưng nó thấp hơn đáng kể so với nhóm thở máy áp lực dương thông thường là 12 ml/kg. Trong nghiên cứu năm 2004 của Varpula và cộng sự. (2004), APRV được chỉ định riêng cho VT cao, nhưng một điểm chính không được đề cập đến là cả hai nhóm (kiểm soát áp lực bắt buộc ngắt quãng đồng bộ/hỗ trợ áp lực (SIMV PC/PS) và APRV) đều nhắm mục tiêu VT 8–10 ml/kg mà không có sự khác biệt về VT giữa các chế độ. Điều thú vị là, mặc dù các bài báo ý kiến này có tham chiếu đến Varpula và cộng sự (2004) về VT cao trong APRV, nhưng họ lại không trích dẫn một nghiên cứu năm 2003 [cũng của Varpula] so sánh các chế độ giống nhau nhưng VT ở nhóm APRV thấp hơn đáng kể so với SIMV-PC/PS (Vapula và cộng sự, 2003).
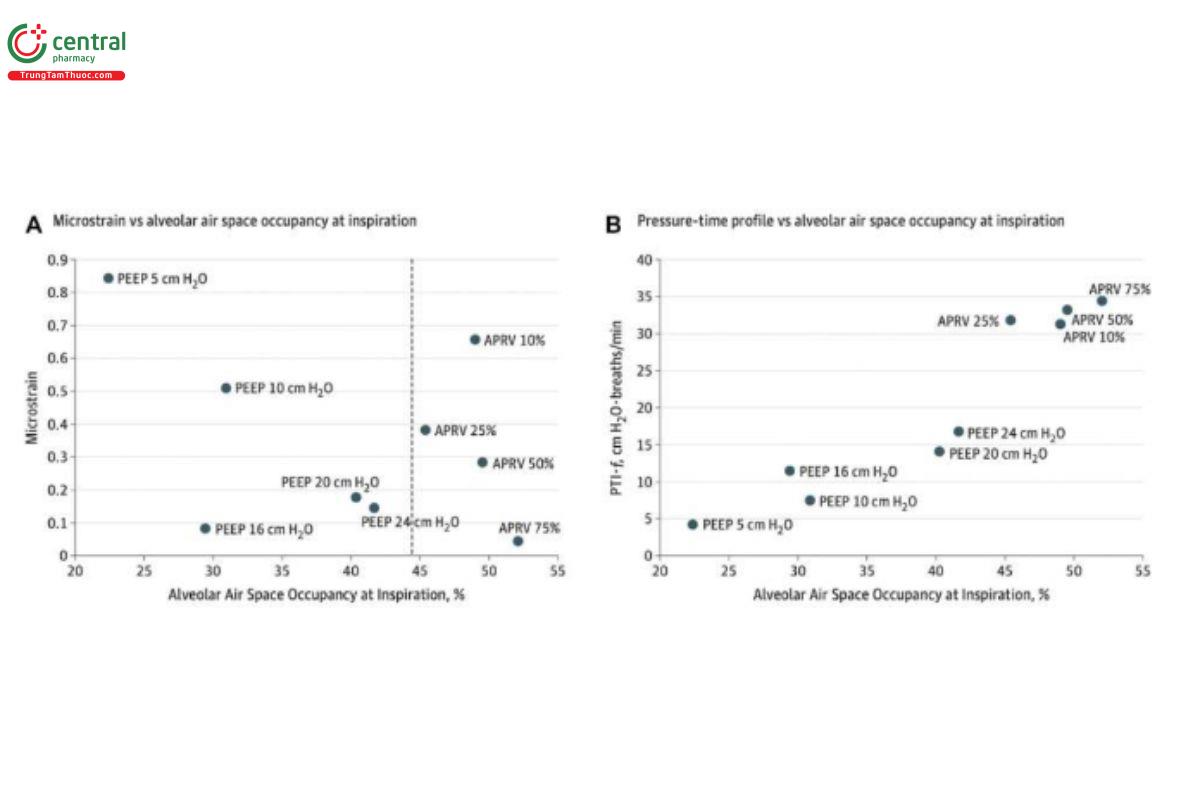
HÌNH 4. (A) Độ biến dạng (strain) vi mô so với độ chiếm chỗ khoảng khí phế nang (Aa) khi hít vào. Đường đứt nét cho thấy sự khác biệt về Aa giữa thông khí giải phóng áp lực đường thở (APRV) và thông khí bắt buộc có kiểm soát. (B) Hồ sơ áp lực-thời gian chuẩn hóa trong một phút so với Aa khi hít vào. PEEP biểu thị áp lực cuối thì thở ra dương và % đối với APRV biểu thị tỷ lệ kết thúc lưu lượng thở ra đỉnh so với lưu lượng thở ra đỉnh.
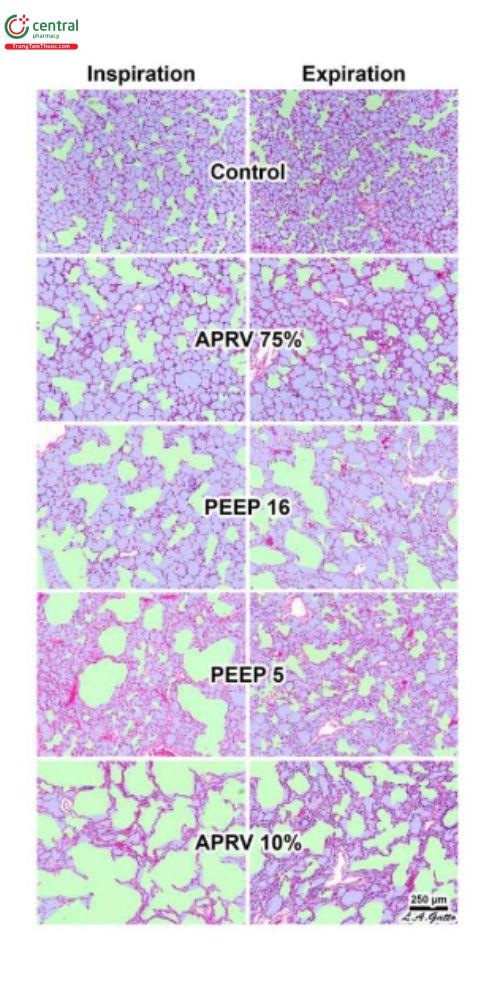
HÌNH 5. Nhóm thông khí giải phóng áp lực đường thở (APRV) 75% tạo ra độ chiếm dụng không gian phế nang (Aa) lớn nhất ở cả thì hít vào và thở ra (I/E), với các giá trị tương tự nhóm chứng (p > 0,05) và dẫn đến biến dạng vi mô đường thở dẫn khí ít nhất. Độ chiếm dụng không gian đường thở dẫn khí (Ca) so với độ chiếm dụng không gian phế nang Aa, Ca/Aa tại I/E, rất phù hợp với sự phân bố khí ở đầu cuối phổi bình thường không bị tổn thương. Nhóm APRV 10% (TLow mở rộng) có ít Aa nhất ở cả I/E và biến dạng vi mô đường thở dẫn khí lớn nhất, cho thấy việc kiểm soát thời gian chính xác là rất quan trọng. Trong nhóm thở máy thông thường, việc tăng PEEP từ 5 đến 16 cmH2O dẫn đến mức Ca lớn hơn thay vì tăng Aa tại I/E, cho thấy mức tăng PEEP chủ yếu làm giãn các đường thở dẫn khí hơn là huy động khí phế nang và không thể phục hồi Ca/Aa bình thường của phổi.
Một số tác giả (Modrykamien và cộng sự, 2011) đưa ra tuyên bố chưa được xác thực về việc đặt TLow (sic) “40% EFP (khoảng 0,6–0,8 giây).” TLow 40% EFP không chỉ đảm bảo VT lớn hơn TCAV™ 75% mà còn làm tăng chấn thương xẹp phổi ở khoảng khí xa và gây tổn thương phổi (Kollische-Singule và cộng sự, 2014a; Kollische
Singule và cộng sự, 2014b; Kollische-Singule và cộng sự, 2016a; Jain và cộng sự, 2017). Cuối cùng, một nghiên cứu của Neumann và cộng sự (2002) cũng thường được tham chiếu liên quan đến VT lớn hơn 1 L và sự dao động áp lực màng phổi lớn dẫn đến áp lực xuyên phổi lớn có thể góp phần gây ra chấn thương thể tích và tổn thương phổi do máy thở (VILI) (Esan và cộng sự, 2010; Maxwell và cộng sự, 2010; Kallet 2011; Modrykamien và cộng sự, 2011; Daoud và cộng sự, 2012). Tuy nhiên, điều không được thảo luận là thời gian giải phóng (TLow) lên đến 2,5 giây đã được sử dụng, tạo ra VT lớn không giống như khi chúng giảm TLow xuống 0,5 giây (thường được sử dụng với phương pháp TCAV™ của APRV) và sự giảm tiếp theo của VT khi TLow giảm từ 2,5 xuống 0,5 giây.
Nếu người vận hành nhắm mục tiêu vào VT, thì chế độ không thể bị đổ lỗi nếu VT này được thực hiện. Giống như bất kỳ chế độ máy thở nào, VT cao có thể được tạo ra với APRV do các phương pháp khác nhau như đã thấy trong một số nghiên cứu APRV (Jain và cộng sự, 2016). Tuy nhiên, không giống như thử nghiệm ARDSNet năm 2000, không có nghiên cứu APRV nào liên kết sự gia tăng tỷ lệ tử vong giữa các nhóm ngay cả khi VT vượt quá 6 ml/kg (Maxwell và cộng sự, 2010; Lim và cộng sự, 2016; Ganesan và cộng sự, 2018; Hirshberg và cộng sự, 2018; Lim và Litton, 2019; Zhong và cộng sự, 2020; Ibarra-Estrada và cộng sự, 2022).
Với bất kỳ chế độ định dạng áp lực nào của thông khí cơ học, người dùng sẽ chọn áp lực được áp dụng và VT tiếp theo phụ thuộc vào các yếu tố như CRS, thể tích khí, sức cản đường thở (RAW) và tính đồng nhất về cấu trúc của phổi. Do đó, phổi càng khỏe mạnh với CRS gần như bình thường thì VT càng có khả năng tăng vượt quá con số "thần kỳ" là 6 ml/kg. Ví dụ, nếu VT trong VAC được đặt thành 12 ml/kg, thì VT cao sẽ được tạo ra và nếu được đặt thành 6 ml/kg, thì LVT sẽ được tạo ra.
HÌNH 6. Biểu đồ histogram chồng lên diện tích phế nang bình thường và tổn thương, và tần suất phân bố phản ánh tính không đồng nhất của phế nang sau tổn thương phổi. (A, B) cho thấy biểu đồ histogram hít vào với bình thường trước chấn thương (đường màu xanh) trong đó các đường còn lại là sau chấn thương, chứng tỏ APRV bình thường hóa tính không đồng nhất sau chấn thương. Nhóm LVT cho thấy VT với nhiều mức áp lực cuối thì thở ra dương tính (PEEP) khác nhau (5 đến 24 cmH2O) không thể khôi phục tính đồng nhất trước chấn thương. (C, D) cho thấy biểu đồ histogram thở ra với bình thường trước chấn thương (đường màu xanh) trong đó phần còn lại là sau chấn thương, chứng tỏ APRV bình thường hóa tính không đồng nhất sau chấn thương. Nhóm LVT với nhiều mức PEEP khác nhau không thể khôi phục tính đồng nhất trước chấn thương.
Thực tế là VT và các cài đặt được xác định nhiều hơn bởi cơ học hơn là bởi các hướng dẫn đã được chứng minh trong phân tích lại gần đây về dữ liệu LUNG-SAFE, trong đó những bệnh nhân có CRS lớn hơn nhận được VT cao hơn (trung bình 8,5 ml/kg PBW) so với những bệnh nhân có CRS thấp nhận được VT thấp hơn (trung bình 7,5 ml/kg PBW) (Goligher và cộng sự, 2021). Những bệnh nhân nào được thở máy bảo vệ nhiều hơn? Giá trị áp lực đẩy (ïP) cho thấy bệnh nhân rõ ràng được thông khí bảo vệ nhiều hơn (dựa trên các giá trị VT được ghi nhận thấp hơn) thực tế đã tiếp xúc với ïP cao hơn đáng kể và do đó có nguy cơ cao hơn vì ïP—không phải VT —có liên quan đến nguy cơ tử vong cao hơn (Amato và cộng sự, 2015; Bellani và cộng sự, 2016; Goligher và cộng sự, 2021). Ngoài ra, việc chỉ định VT rất thấp cho những bệnh nhân có CRS và RAW bình thường dẫn đến nhiều tình trạng bất đồng bộ, xếp chồng nhịp thở và cuối cùng là nguy cơ tử vong cao hơn (Deans và cộng sự, 2005; Bellani và cộng sự, 2016; Cavalcanti và cộng sự, 2017; Costa và cộng sự, 2021; Goligher và cộng sự, 2021; Raschke và cộng sự, 2021).
Trong mô hình lợn ARDS do nhiễm trùng huyết không kiểm soát, việc áp dụng APRV phòng ngừa bằng phương pháp TCAV™ đã được so sánh với ARDSNet LVT (Roy S. và cộng sự, 2013).
Trong mô hình phòng ngừa ARDS này, phổi bình thường và không bị tổn thương khi bắt đầu thí nghiệm. Trong nhóm APRV, CRS phổi vẫn bình thường trong suốt 48 giờ nhiễm trùng huyết không kiểm soát và VT duy trì ở mức 12 ml/kg nhưng vẫn ngăn ngừa được sự phát triển của ARDS hoặc chấn thương thể tích, trong khi nhóm LVT có VT là 6 ml/kg lại phát triển ARDS nghiêm trọng. Điều này càng ủng hộ rằng VT nên được chuẩn hóa theo CRS, điều này đã được thể hiện trong dữ liệu VT (Deans và cộng sự, 2005), dữ liệu ïP (Amato và cộng sự, 2015; Costa và cộng sự, 2021; Goligher và cộng sự, 2021; Raschke và cộng sự, 2021) và dữ liệu tập thể dục gắng sức trong đó VT dao động từ 36 đến 40 ml/kg (Dominelli và cộng sự, 1985; Harms và cộng sự, 1998; Guenette và cộng sự, 2007; Guenette và cộng sự, 2009). Với phương pháp TCAV™, khi CRS phổi cải thiện, VT thường tăng lên, sau đó sẽ cho phép giảm PHigh và có khả năng kéo dài THigh. Ngoài ra, trong một nghiên cứu về cơ chế với tổn thương phổi cấp tính, APRV sử dụng TCAV™ có VT khí quản lớn hơn hiển thị trên máy thở (thông khí vĩ mô), tuy nhiên VT phế nang (thông khí vi mô) thấp hơn VAC với VT được đặt và đo là 6 ml/kg (Kollisch-Singule và cộng sự, 2014a). Trong nghiên cứu này, VT phế nang được định nghĩa là sự thay đổi diện tích phế nang giữa hít vào và thở ra (Hình 7). Trong nhóm APRV, sự thay đổi diện tích là < 5% với TLow được đặt thành 75% EFT/EFP; trong khi nhóm LVT cho thấy sự thay đổi diện tích là 50% ngay cả với mức PEEP được sử dụng nhiều nhất trên lâm sàng (10 cmH2O) (Bellani và cộng sự, 2016) (Hình 8) cho thấy mức PEEP thường được sử dụng này có liên quan đến chấn thương xẹp phổi đáng kể. Hơn nữa, kính hiển vi trong cơ thể sống của phế nang dưới màng phổi cho thấy TLow được điều chỉnh theo CRS (tức là 75% EFT/EFP) ổn định phế nang trong một chu kỳ thở, ngăn chặn tình trạng xẹp và giãn phế nang lặp đi lặp lại (repetitive alveolar collapse and expansion - RACE) do chấn thương do xẹp phổi (Kollisch-Singule và cộng sự, 2014a). Với phương pháp TCAV™, quá trình thở ra thụ động của TLow tạo ra SLOPEEF được sử dụng để cá nhân hóa VT theo CRS (Dixon và Brodie, 1903; Rahn và cộng sự, 1946; Mead và Whittenberger, 1953; Brody 1954; Comroe 1954; Brody và Dubois, 1956; McIlroy và cộng sự, 1963; Bergman 1966; Grimby và cộng sự, 1968; Ashutosh và Keighley, 1978; Behrakis và cộng sự, 1983; Richardson và cộng sự, 1989; Baydur và Carlson, 1994; Brunner và cộng sự, 1995; Guttmann và cộng sự, 1995; Nassar và cộng sự, 2012).
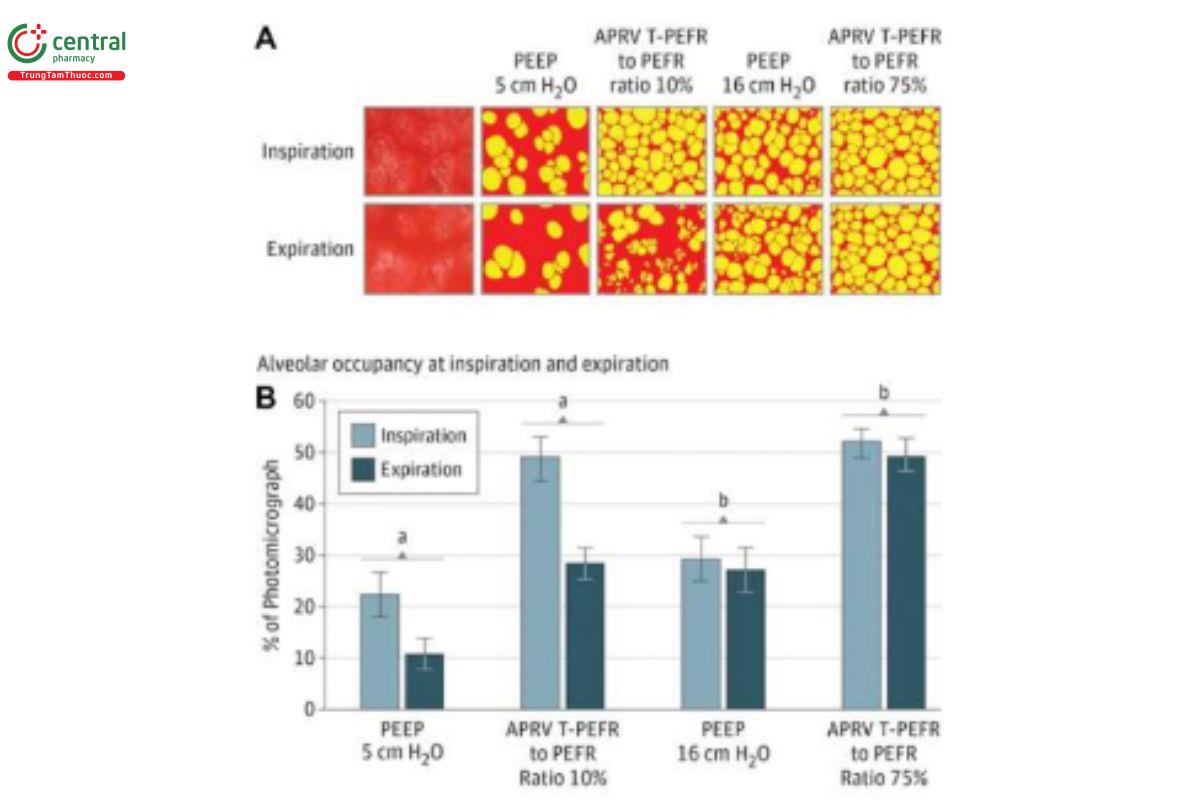
HÌNH 7. (A) Ảnh chụp vi thể trong cơ thể khi hít vào và thở ra (I/E) từ trái sang phải: 1) áp lực dương cuối kỳ thở ra (PEEP) 5 cmH2O; 2) tỷ lệ thông khí giải phóng áp lực đường thở (APRV) khi kết thúc lưu lượng đỉnh thở ra (EFT) so với lưu lượng đỉnh thở ra (EFP) là 10%; 3) PEEP 16 cmH2O; và 4) APRV EFT/EFP 75% (độ phóng đại ban đầu ×10). Phế nang (màu vàng) và mô không phải phế nang (màu đỏ). (B), Độ chiếm chỗ của khoang khí phế nang được truyền tải dưới dạng phần trăm của ảnh chụp vi thể chứa phế nang phồng lên (màu vàng trong A) tại I/E. Dữ liệu được hiển thị dưới dạng giá trị trung bình; thanh lỗi biểu thị lỗi tiêu chuẩn của giá trị trung bình. A) P<.0— PEEP 5 cmH2O so với EFT/EFP 10%; B) P<.05—PEEP 16 cmH2O so với EFT/EFP 75%. Tỷ lệ chiếm dụng phế nang I/E cho thấy APRV 75% có số lượng khoảng khí mở lớn nhất khi hít vào, gần gấp đôi so với PEEP 16 cmH2O và mất ít khoảng khí mở nhất khi thở ra, dẫn đến thay đổi thể tích phế nang dưới 5% giữa I/E. Điều này dẫn đến biến dạng vi mô thấp nhất với APRV 75%.
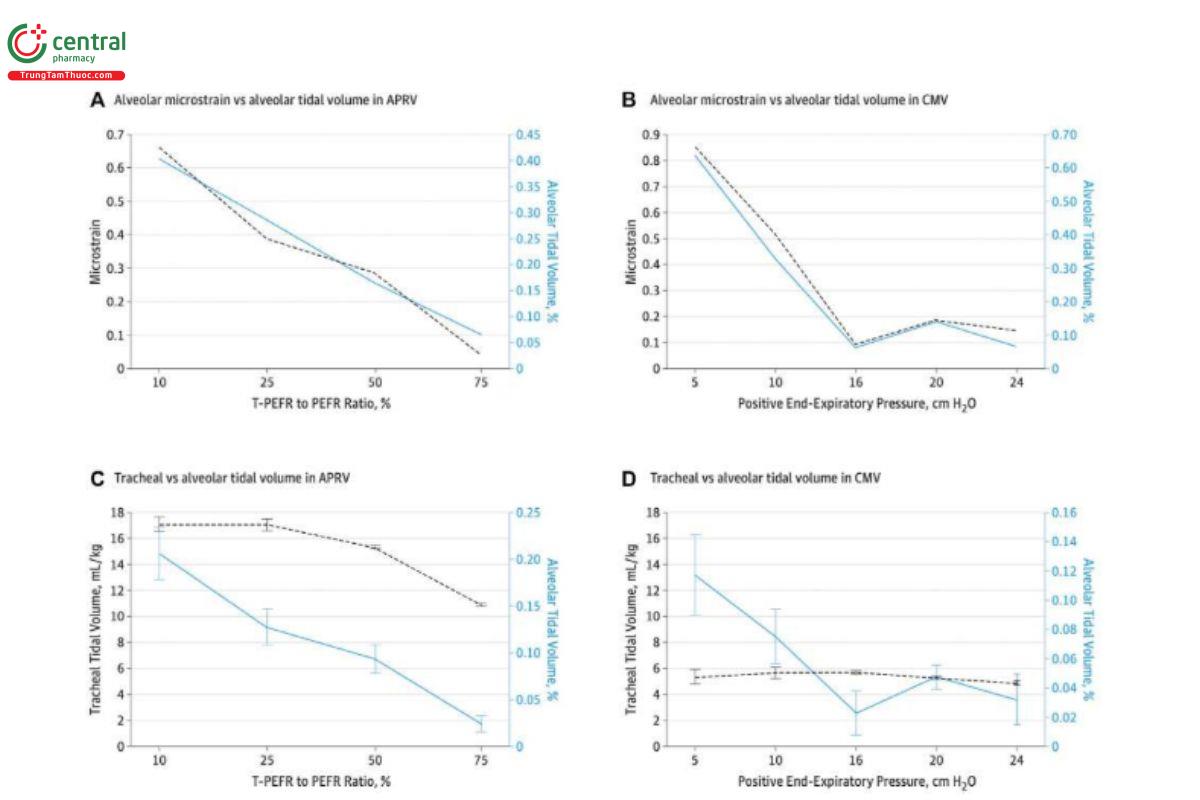
HÌNH 8. (A,C) —Khi TLow được điều chỉnh về phía kết thúc 75% của lưu lượng thở ra đỉnh (EFT) thành lưu lượng thở ra đỉnh (EFP), thể tích khí lưu thông phế nang (VT) giảm mặc dù thể tích khí quản là 11 mL/kg. (B,D) với chiến lược VT thấp, điều ngược lại là đúng mặc dù VT khí quản là 6 ml/kg với VT phế nang cao hơn. Ở PEEP là 10 cmH2O, VT phế nang và VT khí quản là 6 ml/kg cao hơn 3 lần so với VT phế nang với APRV là 75% mặc dù VT khí quản là 11 ml/kg.
Độ dốc EF của TLow đặc trưng cho độ đàn hồi (ERS) bao gồm thành ngực và thích ứng với cơ học phổi đang tiến hóa, do đó tối ưu hóa sự ổn định của phế nang và hướng dẫn cá nhân hóa TLow, chuẩn hóa EELV và VT theo CRS không nên được đặt theo thời lượng cố định hoặc điều chỉnh <75% EFT/EFP để đạt được VT mong muốn.
Cuối cùng, máy thở có thể sử dụng hỗ trợ áp lực với APRV kết hợp một cửa sổ kích hoạt để cố gắng đồng bộ hóa tỷ lệ hít vào/thở ra (I:E) tạo ra TLow không ổn định có thể ngẫu nhiên "bật ra" vượt quá mức đã cài đặt (Hình 9). Điều này đã được chứng minh là tạo ra VT cực kỳ cao trong đó TLow thực tế hiển thị trên dạng sóng đồ họa có thời lượng dài hơn TLow đã cài đặt. Ví dụ trong Hình 9 cho thấy rằng mặc dù cài đặt TLow là 0,5 giây (Hình 9A), TLow được kéo dài đến khoảng 1,0 giây (Hình 9B), sau đó tạo ra VT cao. Video cho thấy những thay đổi tự phát về thời lượng của TLow mà không có bất kỳ thay đổi nào đối với cài đặt TLow. (Video bổ sung S1). Ngoài ra, trong một số biến thể của APRV (tức là BiLevel trên máy thở Covidien), nếu người dùng đặt THigh nhưng không đặt TLow, các thay đổi RR tiếp theo sẽ vô tình làm tăng thời lượng TLow, dẫn đến VT lớn hơn. Có thể tránh được hậu quả không mong muốn này bằng cách khóa TLow, giúp loại bỏ việc liên kết TLow với RR, giữ TLow cố định ở cài đặt mong muốn và tránh vô tình tạo ra VT lớn hơn.
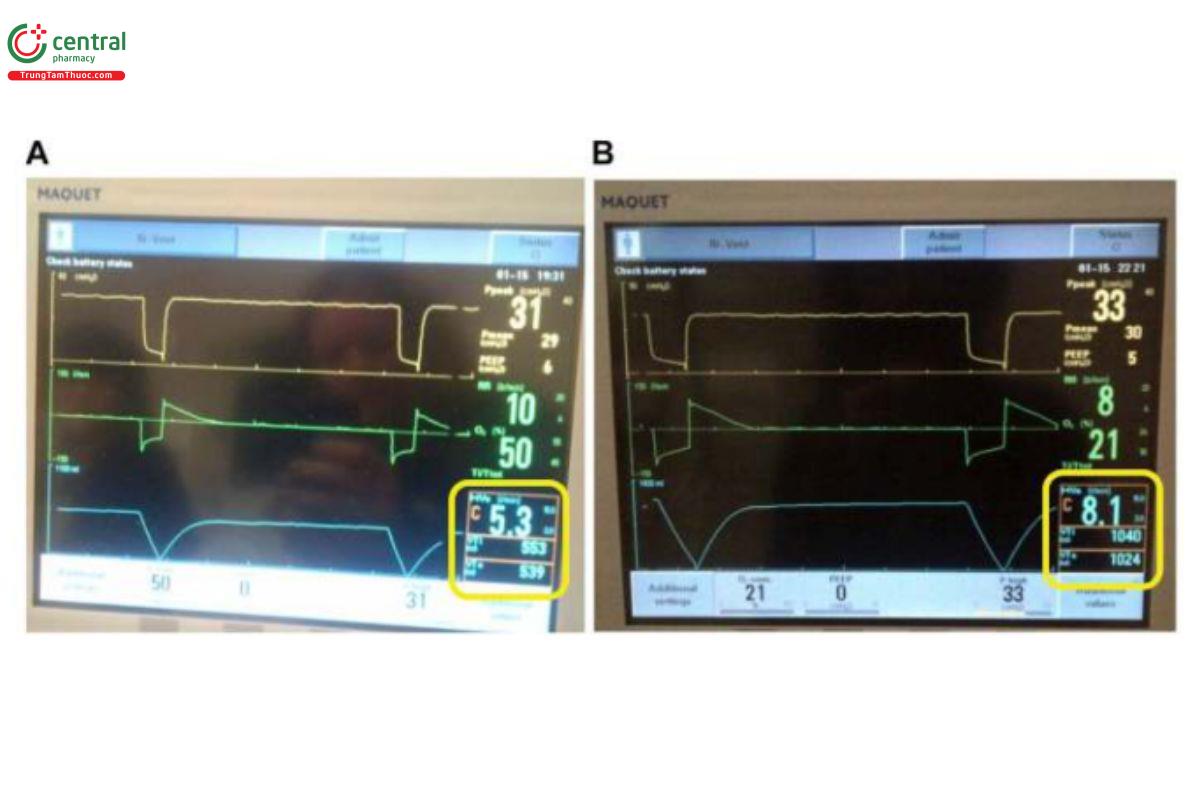
HÌNH 9. Máy thở được đặt ở chế độ Bi-Vent (APRV). (A) TLow được đặt thành 0,5 giây và thời gian giải phóng là 0,5 giây với VTE 539 ml. (B) TLow (thời gian giải phóng) đang tăng lên 1,0 giây mặc dù được đặt ở mức 0,5 giây với VTE tăng đáng kể lên 1024 ml. Điều này xảy ra ở các máy thở cho phép hỗ trợ áp lực (kích hoạt cố hữu và cửa sổ kích hoạt) được thêm vào PHigh.
5 Huyền thoại số 4—Thông khí giải phóng áp lực đường thở làm tăng hậu tải và strain của tâm thất phải
Một số bài báo cảnh báo việc sử dụng APRV dẫn đến tăng hậu tải thất phải (right ventricular - RV), làm nặng thêm tình trạng tăng áp phổi và rối loạn chức năng RV, và giảm hồi lưu tĩnh mạch (venous return - VR) dẫn đến hạ huyết áp toàn thân (Kallet, 2011; Modrykamien và cộng sự, 2011; Chatburn và cộng sự, 2016; Chen và cộng sự, 2017). Thậm chí còn có những tuyên bố rằng về mặt lý thuyết, APRV có nguy cơ mắc bệnh tim phổi cao hơn (Kallet, 2011; Chatburn và cộng sự, 2016; Chen và cộng sự, 2017). Thật vậy, áp lực đường thở được áp dụng có thể dẫn đến giảm VR và cung lượng tim (cardiac output - CO). Tuy nhiên, không có bằng chứng khoa học nào cho thấy điều này xảy ra thường xuyên hơn ở APRV so với bất kỳ chế độ nào khác như những tuyên bố này gợi ý. Mặc dù bệnh tim phổi có liên quan đến việc tăng tỷ lệ tử vong, nhưng không có nghiên cứu nào cho thấy sự gia tăng tỷ lệ tử vong này có liên quan đến APRV so với LVT. Trên thực tế, các phân tích tổng hợp cho thấy xu hướng thiên về khả năng sống sót cao hơn ở APRV (Lim và Litton, 2019; Zhong và cộng sự, 2020). Điều này khiến những tuyên bố như vậy trở nên không hợp lý và không đáng tin, khiến cần phải xem xét lại cơ bản về sinh lý học để giúp điều hướng những quan niệm sai lầm này (Luecke và Pelosi, 2005). Cần phải nhận ra rằng các cài đặt máy thở và tương tác giữa phổi và thành ngực có vai trò quan trọng trong việc ảnh hưởng đến tim và những tương tác này có thể không trực quan. Mặc dù một số khía cạnh của áp lực dương có thể có lợi, chẳng hạn như giảm hậu tải thất trái bằng CPAP, nhưng hầu hết các huyền thoại đều liên quan đến chức năng RV với suy luận về tình trạng hạ huyết áp toàn thân xảy ra thường xuyên hơn ở APRV so với các chế độ máy thở khác.
Vì RV không có khả năng tạo ra áp lực đáng kể do giới hạn khối lượng cơ, nên nó dựa vào sự sụt áp lớn trên nền mạch máu phổi rộng lớn có khả năng giãn nở cao để hạn chế sức cản lưu lượng. Sự sụt áp xảy ra ở các mạch máu phổi nhỏ nhưng nhiều, được phân bổ đều giữa tuần hoàn phổi động mạch và tĩnh mạch với động mạch phổi có sức cản cao nhất trong mạch (Gaar và cộng sự, 1967). Tải trọng tim phải liên quan đến thể tích phổi, sức cản mạch máu phổi (pulmonary vascular resistance - PVR) và những thay đổi về áp lực màng phổi. Vì mạch phổi cản trở đầu ra của RV, bất kỳ điều gì ảnh hưởng đến phổi đều có thể ảnh hưởng đến hoạt động của tim phải.
Đầu tiên, PVR và tải trọng tim phải tăng lên ở các giá trị cực đại của thể tích phổi—1) thể tích cặn (thể tích phổi); và 2) tổng dung tích phổi (total lung capacity - TLC) (Suresh và Shimoda, 2016) như thể hiện trong Hình 10. PVR thấp nhất và hậu tải RV tiếp theo là khi phổi đạt dung tích cặn chức năng (functional residual capacity - FRC) (Simmons và cộng sự, 1961). Nhiều bệnh nhân cần thở máy bị mất FRC (tức là xẹp phổi) (Rahn và cộng sự, 1946; Puybasset và cộng sự, 1998; Rylander và cộng sự, 2004; Bikker và cộng sự, 2008; Bellani và cộng sự, 2011; Gonazalez-Lopez và cộng sự, 2012; Gommers, 2014; Hopkins và Sharma, 2022) và áp lực đường thở dương để phục hồi FRC thường dẫn đến giảm PVR và cải thiện chức năng RV xác nhận bằng phản xạ sóng động mạch phổi (Sipmann và cộng sự, 2018) và siêu âm tim (Duggan và cộng sự, 2003). Thứ hai, tương tác phổi-thành ngực cũng ảnh hưởng đến huyết động học và EELV. Tương tự như vậy, khái niệm này cũng có thể không trực quan và vượt ra ngoài nhận thức quá đơn giản rằng tải RV chỉ phụ thuộc vào áp lực đường thở được áp dụng hoặc PEEP (Van Den Berg và cộng sự, 2001). Ví dụ, thành ngực bật ra với thể tích cao hơn vào cuối thì thở ra trong khi phổi đồng thời co lại thành thể tích thấp hơn với khoang bụng xác định ranh giới (cơ hoành) của thành ngực và hoạt động như một ngăn chứa chất lỏng hơn là một cấu trúc đàn hồi (Agostini và Hyatt, 1973; Agostoni và Hyatt, 1986; West, 1989; Nunn, 1995; Lumb, 2010). Do hiệu ứng lò xo của thành ngực, áp lực màng phổi âm xảy ra ở cuối thì thở ra ngay cả ở mức PEEP cao, về mặt chức năng, điều này dẫn đến phổi được treo mà không có bất kỳ lực nén nào từ thành ngực ở cuối thì thở ra (Stenqvist và cộng sự, 2012; Stenqvist và cộng sự, 2015; Persson và cộng sự, 2016; Persson và cộng sự, 2017). Tăng PEEP dẫn đến phổi phồng lên và dịch chuyển thành ngực và cơ hoành đến trạng thái cân bằng áp lực-thể tích mới, làm giảm dần áp lực màng phổi trong các nhịp thở tiếp theo (Rahn và cộng sự, 1946; Katz và cộng sự, 1981; Stenqvist và cộng sự, 2012). Do áp lực nhĩ phải và VR có khả năng bị ảnh hưởng bởi áp lực màng phổi nên khả năng thích nghi tăng lên của ngăn thành ngực chậm cho phép EELV tăng mà không làm tăng áp lực màng phổi (Stenqvist và cộng sự, 2012;Stenqvist và cộng sự, 2015; Persson và cộng sự, 2016; Persson và cộng sự, 2017). Trên thực tế, ngay cả RM có áp lực đường thở cao cũng được dung nạp tốt hơn về mặt huyết động nếu được thực hiện từng bước thay vì tăng áp lực đột ngột (Odenstedt và cộng sự, 2005; Santos và cộng sự, 2016). Điều này có thể giải thích tại sao những bệnh nhân có khả năng huy động phổi cao ít bị tổn thương huyết động hơn khi đáp ứng với việc tăng áp lực đường thở so với những bệnh nhân có phổi không huy động được. Tuy nhiên, dữ liệu cho thấy ïP (thay vì PEEP) có liên quan đến việc tăng nguy cơ mắc bệnh tim phổi và tác động huyết động của PEEP phụ thuộc vào khả năng huy động phổi (tức là giảm vùng phổi không được thông khí để đáp ứng với sự gia tăng áp lực) (McGuinness và cộng sự, 2020; Gazivoda và cộng sự, 2021; Hamouri và cộng sự, 2021; Rajdev và cộng sự, 2021; Udi và cộng sự, 2021).
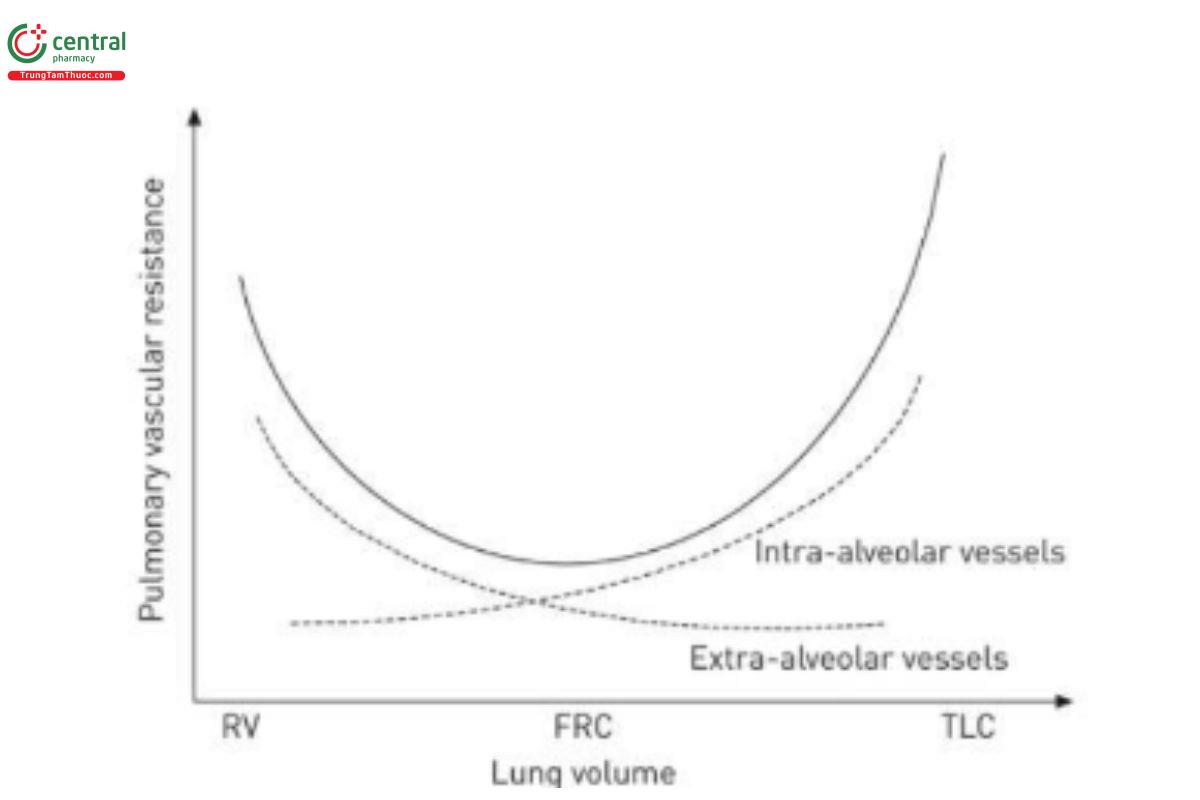
HÌNH 10. Sức cản mạch máu phổi (PVR) ở mức thấp nhất tại dung tích cặn chức năng (FRC). Ở mức cực đại của thể tích phổi từ thể tích cặn (RV) đến tổng dung tích phổi (TLC), PVR tăng lên, do đó làm tăng hậu tải RV.
Tương tác cơ bản giữa VR và thông khí áp lực dương cũng thường bị hiểu lầm. Vì VR được điều chỉnh bởi độ chênh lệch huyết áp hệ thống trung bình (mean systemic pressure - MSP) − áp lực tâm nhĩ phải (right atrial - RA), việc áp dụng PEEP và tác động của nó lên áp lực RA (về lý thuyết) sẽ làm giảm độ chênh lệch MSP − RA và giảm VR. Tuy nhiên, nhiều nghiên cứu cho thấy cơ chế của PEEP trên VR không phải là làm giảm độ chênh lệch vì áp lực tác dụng lên ngực đồng thời được truyền đến khoang bụng hoạt động như một khoang chứa đầy dịch (Fessler và cộng sự, 1989; Nanas và Magder, 1992; Fessler và cộng sự, 1993). Do đó, áp lực làm tăng MSP như nhau, bảo toàn độ chênh lệch cho VR. Fessler và cộng sự (1993) sử dụng MRI cho thấy khi PEEP và thể tích phổi tăng lên, một điểm áp lực bằng nhau được đạt đến, chèn ép tĩnh mạch chủ khi nó đi vào ngực từ bụng, hoạt động như một sức cản starling làm giảm VR và làm suy yếu việc đổ đầy RV (Knowlton và Starling, 1912). Cuối cùng, thể tích phổi là yếu tố chính gây ra những thay đổi về áp lực màng phổi và có thể ảnh hưởng đến VR, áp lực nhĩ phải và hậu tải RV (O'Quinn và cộng sự, 1985).
Những khái niệm vật lý về tương tác phổi tim này áp dụng cho tất cả các chế độ thông khí. Đặc biệt, nên tránh thể tích phổi cực đại và duy trì thể tích phổi ở FRC có tác dụng tốt nhất đến tình trạng tim phổi (Hình 10). Nếu thể tích phổi thấp hơn đáng kể so với FRC (tức là thể tích cặn), áp lực đường thở cần thiết để tăng EELV sẽ không làm tăng strain cho tim; ngược lại nếu thể tích phổi cao hơn FRC (tức là TLC), áp lực đường thở tăng sẽ làm tăng strain cho tim. Trên thực tế, khi thể tích phổi cải thiện khi huy động, kích thước của tim phải sẽ giảm (Duggan và cộng sự, 2003). Duggan và cộng sự (2003) đã chỉ ra rằng 150 phút mất huy động ở chuột dẫn đến giãn đáng kể RV, vị trí nghịch lý của vách liên thất và tâm thất trái không được đổ đầy. Sau khi phổi được huy động với sự gia tăng áp lực đường thở được áp dụng, tình trạng quá tải RV giảm và cải thiện tình trạng đổ đầy thất trái và thanh thải lactate. Nhiều nghiên cứu cho thấy việc tăng thể tích phổi với RM hoặc tăng mức PEEP thích hợp sẽ cải thiện chức năng RV và áp lực động mạch phổi (Reis Miranda và cộng sự, 2004; Reis Miranda và cộng sự, 2006; Longo và cộng sự, 2017). Nhìn chung, tỷ lệ mắc bệnh tâm phế (cor pumonale) trong quá trình LVT dường như tăng ở những bệnh nhân được thở máy với mức PEEP thấp hơn (Boissier và cộng sự, 2013). Một mẫu tiền cứu gồm 200 bệnh nhân được áp dụng các chế độ thở máy khác nhau cho thấy APRV có liên quan đến ïP thấp nhất khi so sánh với VAC hoặc thông khí kiểm soát áp lực (PCV) (Andrews và cộng sự, 2019).
Cho đến nay, chưa có nghiên cứu nào chứng minh tình trạng hạ huyết áp tăng hoặc sử dụng thuốc vận mạch tăng khi dùng APRV so với bất kỳ chế độ thở máy nào khác trong khi một số nghiên cứu không cho thấy sự khác biệt hoặc cải thiện huyết động ở APRV so với các chế độ khác. Ví dụ, ở những bệnh nhân ARDS bị suy tim, APRV đã được chứng minh là làm giảm nhu cầu thuốc vận mạch đồng thời cải thiện chỉ số tim, lượng nước tiểu và Độ thanh thải lactate (Kaplan và cộng sự, 2001). Ngoài ra, một phân tích tổng hợp của bảy RCT với 405 bệnh nhân đủ điều kiện cho thấy APRV có huyết áp động mạch trung bình cao hơn đáng kể vào ngày thứ 3 (Zhong và cộng sự, 2020) và một RCT so sánh APRV với PCV ở những bệnh nhân sau phẫu thuật bắc cầu tim cho thấy có thể tích nhát bóp, CO và tỷ lệ PaO2/FiO2 (P/F) cao hơn đáng kể với APRV (Ge và cộng sự, 2021). Dữ liệu gần đây hơn cho thấy sự giảm hỗ trợ thuốc vận mạch ở những bệnh nhân CARDS được điều trị bằng APRV (Joseph và cộng sự, 2020). Ngoài ra, dữ liệu nhi khoa bao gồm một loạt ca bệnh nhi khoa cho thấy APRV có thể được sử dụng an toàn ở bệnh nhân ARDS nhi khoa mà không làm suy giảm huyết động đáng kể (Kawaguchi và cộng sự, 2015), không có sự khác biệt về tình trạng mất ổn định huyết động ở bệnh nhân nhi khoa khi so sánh APRV với LVT (Ganesan và cộng sự, 2018) và Walsh và cộng sự (2011) cho thấy lưu lượng máu phổi, cung cấp oxy và CO [trong nhóm Tứ chứng Fallot] đều được cải thiện đáng kể với APRV so với PCV ở trẻ em trải qua phẫu thuật tim. Cuối cùng, các nghiên cứu thực nghiệm đã chỉ ra không có sự khác biệt hoặc cải thiện về huyết động học với ít thuốc vận mạch hơn và MAP cao hơn ở APRV khi sử dụng phương pháp TCAV™ so với các chế độ thông thường bao gồm LVT (Roy và cộng sự, 2012; Roy S. và cộng sự, 2013; Roy SK. và cộng sự, 2013; Emr và cộng sự, 2013; Kollisch-Singule và cộng sự, 2015; Kollisch-Singule và cộng sự, 2016b; Jain và cộng sự, 2017; Vasconcellos de Oliveira và cộng sự, 2022).
6 Huyền thoại số 5—Khó kiểm soát PaCO2 bằng phương pháp thông khí giải phóng áp lực đường thở
Quan niệm sai lầm về việc không thể kiểm soát áp lực riêng phần của CO2 động mạch (PaCO2) khiến các bác sĩ lâm sàng tin rằng chính chế độ máy thở kiểm soát các cài đặt chứ không phải người vận hành. Ví dụ, người ta đã nói "Trong APRV, một số mức độ ứ CO2 không phải là bất thường" (Modrykamien và cộng sự, 2011), "các nhịp thở bắt buộc trong APRV được cố tình đặt ở tần suất thấp hơn (tức là 10 nhịp thở/phút) so với các chế độ thông thường" (Mireles Cabodevila và Kacmarek, 2016) và RR với APRV thường là 8–12 nhịp thở/phút (sic) (Daoud và cộng sự, 2012). Những tuyên bố này hoàn toàn không đúng vì khả năng kiểm soát PaCO2 và đặt RR cao hơn trong APRV cũng giống như bất kỳ chế độ máy thở nào khác. Trên thực tế, APRV đã được chứng minh là hiệu quả hơn trong việc loại bỏ PaCO2. Một đánh giá tài liệu cụ thể về độ thanh thải PaCO2 với APRV trong vòng 25 năm cho thấy APRV có liên quan đến PaCO2 thấp hơn khi thông khí phút (MVe) được kết hợp hoặc PaCO2 tương tự với MVe thấp hơn (Stock và cộng sự, 1987; Valentine và cộng sự, 1991; Smith và Smith, 1995; Maung và cộng sự, 2011). Nói cách khác, thể tích CO2 (VCO2) trên một lít VT thở ra lớn hơn ở APRV so với thông khí thông thường (Bratzke và cộng sự, 1998). Ngoài ra, PaCO2 phụ thuộc vào hai hiện tượng: 1) khoảng chết sinh lý tự nó; và 2) PaCO2 tăng được thấy trong trường hợp phân suất shunt cao, đặc biệt là khi có sự tăng chênh lệch giữa máu tĩnh mạch hỗn hợp và PaCO2. Tăng thời gian hít vào cho phép có nhiều thời gian hơn cho trao đổi khuếch tán PaCO2 trong đó thở ra bắt đầu khi CO2 phế nang (PACO2) gần cân bằng với máu tĩnh mạch trộn. Ngược lại, với thời gian hít vào ngắn, thở ra bắt đầu khi PACO2 ở mức thấp nhất. Dữ liệu sinh lý chứng minh rằng việc tối ưu hóa trao đổi khí khuếch tán và đối lưu [dòng khí thở ra lớn vào môi trường] làm tăng hiệu quả thông khí, do đó làm giảm nhu cầu MVe để thanh thải PaCO2 tương đương (Haycroft và Edie, 1891; Knelson và cộng sự, 1970; Engel và cộng sự, 1973; Fukuchi và cộng sự, 1976; Fuleihan và cộng sự, 1976; Fredberg, 1980;Valentine và cộng sự, 1991; Falkenhain và cộng sự, 1992; Smith và Smith, 1995; Mercat và cộng sự, 2001; Tsuda và cộng sự, 2011; Aboab và cộng sự, 2012). Khái niệm rằng việc huy động và mất huy động phế nang phụ thuộc vào thời gian thường bị các bác sĩ lâm sàng bỏ qua. Mặc dù có sự thay đổi về khả năng huy động phế nang giữa các bệnh nhân ARDS, thời gian vẫn là yếu tố quan trọng của việc mở lại và đóng khoảng khí xa (Allen và cộng sự, 2002; Allen và Bates, 2004; Allen và cộng sự, 2005; Albert và cộng sự, 2009).
Ngoài việc kiểm soát RR, THigh thúc đẩy việc huy động phế nang theo thời gian dần dần trên khắp phổi, do đó làm giảm tỷ lệ shunt và tăng diện tích bề mặt phổi để trao đổi PaCO2 dựa trên Định luật khuếch tán của Fick (Fick 1855; Wagner 1977). Tuy nhiên, điều này không có nghĩa là tất cả bệnh nhân, đặc biệt là những bệnh nhân bị rối loạn chức năng phổi đáng kể (tức là ARDS) nên bắt đầu APRV với tần số 8–12 nhịp/phút (tức là THigh 4–6 giây). Thay vào đó, THigh nên được điều chỉnh để cung cấp đủ thông khí và PaCO2 cho một mức độ đương (Haycroft và Edie, 1891; Knelson và cộng sự, 1970; Engel và cộng sự, 1973; Fukuchi và cộng sự, 1976; Fuleihan và cộng sự, 1976; Fredberg, 1980;Valentine và cộng sự, 1991; Falkenhain và cộng sự, 1992; Smith và Smith, 1995; Mercat và cộng sự, 2001; Tsuda và cộng sự, 2011; Aboab và cộng sự, 2012). Khái niệm rằng việc huy động và mất huy động phế nang phụ thuộc vào thời gian thường bị các bác sĩ lâm sàng bỏ qua. Mặc dù có sự thay đổi về khả năng huy động phế nang giữa các bệnh nhân ARDS, thời gian vẫn là yếu tố quan trọng của việc mở lại và đóng khoảng khí xa (Allen và cộng sự, 2002; Allen và Bates, 2004; Allen và cộng sự, 2005; Albert và cộng sự, 2009).
Ngoài việc kiểm soát RR, THigh thúc đẩy việc huy động phế nang theo thời gian dần dần trên khắp phổi, do đó làm giảm tỷ lệ shunt và tăng diện tích bề mặt phổi để trao đổi PaCO2 dựa trên Định luật khuếch tán của Fick (Fick 1855; Wagner 1977). Tuy nhiên, điều này không có nghĩa là tất cả bệnh nhân, đặc biệt là những bệnh nhân bị rối loạn chức năng phổi đáng kể (tức là ARDS) nên bắt đầu APRV với tần số 8–12 nhịp/phút (tức là THigh 4–6 giây). Thay vào đó, THigh nên được điều chỉnh để cung cấp đủ thông khí và PaCO2 cho một mức độ rối loạn chức năng phổi nhất định. Khi diện tích bề mặt tăng lên và độ ổn định của phế nang được cải thiện, trao đổi khí khuếch tán tăng lên và nhu cầu trao đổi khí đối lưu (tức là RR) giảm xuống. Theo thời gian, thông khí trở nên hiệu quả hơn (12–36 giờ) cho phép tăng THigh thích hợp. Điều chỉnh tình trạng tăng CO2 máu bằng các thao tác TLow để tạo ra VT lớn hơn có thể cải thiện tạm thời PaCO2, nhưng diện tích bề mặt khuếch tán giảm do mất thể tích phổi, cuối cùng làm mất đi sự ổn định của phế nang và sau đó chế độ này bị đổ lỗi cho tình trạng VT cao và tăng CO2 máu cùng lúc.
Trong các nghiên cứu chỉ trích sự bất lực của APRV trong việc quản lý PaCO2 (Batchinsky và cộng sự, 2011; Ibarra-Estrada và cộng sự, 2022), TLow đã được tăng lên [EFT/EFP <75%] để điều chỉnh cho tình trạng tăng CO2, dẫn đến tăng VT đã được chứng minh là sau đó làm tăng sự xẹp phế nang, làm trầm trọng thêm tình trạng mất ổn định và không đồng nhất của phế nang, làm tăng strain vi mô và khuếch đại stress trong toàn bộ phổi (Kollische-Singule và cộng sự, 2014a; Kollische Singule và cộng sự, 2014b; Kollische-Singule và cộng sự, 2016a; Jain và cộng sự, 2017). Do đó, khi TLow được điều chỉnh thành EFT/EFP <75%, sự xẹp phế nang và mất ổn định sẽ xảy ra, cuối cùng dẫn đến tình trạng tăng CO2 thêm nữa. Ngoài ra, thay vì điều chỉnh THigh để tăng RR, các nghiên cứu này đã sử dụng RR thấp hơn nhiều ở nhóm APRV so với các chế độ thông thường (Batchinsky và cộng sự, 2011; Ibarra-Estrada và cộng sự, 2022). Ngược lại, trong một nghiên cứu lớn trên 411 bệnh nhân trong một đơn vị bỏng sử dụng APRV, pH và PaCO2 được duy trì trong phạm vi bình thường với tỷ lệ P/F được cải thiện (Foster và cộng sự, 2021) và Maxwell và cộng sự (2010) báo cáo rằng phát hiện thú vị nhất trong nghiên cứu của họ là nhóm LVT có PaCO2 cao hơn nhóm APRV mặc dù MVe cao hơn đáng kể.
Nếu bệnh nhân bị suy chức năng phổi đang được điều trị APRV được điều trị giống như bệnh nhân thở máy ổn định về mặt thông khí đối lưu (tức là RR 8–12 với THigh 4–6 giây) thì có thể dự kiến sẽ bị tăng CO2 máu. Điều này đã được chứng minh trong một nghiên cứu gần đây về CARDS (Ibarra Estrada và cộng sự, 2022), trong đó nhiều bệnh nhân hơn trong nhóm APRV có các đợt tăng CO2 máu nặng thoáng qua (≤24 giờ) (42% so với 15%; p = 0,009) nhưng không liên quan đến những thay đổi về huyết động. Tuy nhiên, nhóm APRV được điều trị với THigh 4–6 giây, được dịch thành ∼10– 12 nhịp/phút dẫn đến RR thấp hơn đáng kể so với nhóm LVT (p < 0,001). Điều quan trọng cần lưu ý là những bệnh nhân này có tỷ lệ P/F ARDS từ trung bình đến nặng (theo tiêu chuẩn Berlin) (Lực lượng đặc nhiệm định nghĩa ARDS, 2012) do COVID, một bệnh lý phổi có tỷ lệ khoảng chết cao (Morales Quinteroset al., 2021).
7 Huyền thoại số 6—Thông khí giải phóng áp lực đường thở giống như kiểm soát áp lực tỷ lệ nghịch
Một số bài báo nhận xét rằng APRV về mặt chức năng giống nhau và không thể phân biệt được với PCV tỷ lệ nghịch (IR-PCV) khi không có nhịp thở tự nhiên (Dries và Marini, 2009; Esan và cộng sự, 2010; Kallet 2011; Mireles Cabodevila và Kacmarek, 2016). Mặc dù đúng là cả hai chế độ đều có điểm tương đồng với các thiết lập kiểm soát áp lực và thời gian, nhưng có những khác biệt chính thường bị bỏ qua. Sự khác biệt chính đầu tiên là thời gian hít vào và thở ra trong APRV được kiểm soát trực tiếp, độc lập và chính xác, trong khi tỷ lệ thời gian I:E được sử dụng trong IR-PVC với pha thở ra là "sản phẩm phụ" gián tiếp phát sinh từ thời gian hít vào và RR đã đặt. Tương tự như cài đặt RR trong IR-PCV, APRV sử dụng THigh để kiểm soát RR trong khi ngược lại với trực giác, việc giảm THigh sẽ làm tăng RR và việc tăng THigh sẽ làm giảm RR. Ngoài ra, giống như thời gian hít vào trong IR PCV, THigh điều chỉnh thời gian của PHigh tạo ra pha CPAP để thúc đẩy sự giãn nở dần dần của các phế nang bị xẹp (Syring và cộng sự, 2007; Boehme và cộng sự, 2015). Tuy nhiên, do thời gian TLow ngắn, APRV với RR bằng nhau thường có I:E cao hơn nhiều so với IR-PCV trên hầu hết các máy thở ICU (Hình 11), điều này trở nên hạn chế hơn dần dần với IR-PCV khi RR cài đặt tăng lên. Hình 11 cho thấy VAC thông thường (11A) với RR cài đặt là 16 và tỷ lệ I:E là 1:3,2 chuyển sang APRV (BiLevel trên Covidien) (11B) với cùng RR và TLow được đặt thành 0,32 giây để đạt được 75% EFT/EFP tạo ra tỷ lệ I:E là 11:1. Sau đó, VT giảm từ 408 xuống 308 ml (Nieman et al., 2020a; Nieman et al., 2020b). Sự khác biệt chính thứ hai là không giống như IR-PCV, PEEP thường không được đặt bằng APRV vì EELV được kiểm soát theo thời gian (TLow) thay vì áp lực (PLow). Mặc dù các nghiên cứu cho thấy PLow trong APRV có thể được đặt ở bất kỳ mức nào, nhưng nhìn chung nó được đặt ở mức 0 cmH2O khi TLow được sử dụng làm bộ điều khiển EELV (Habashi, 2005; Habashi và cộng sự, 2022). Trên thực tế, chúng tôi đã chỉ ra rằng việc cá nhân hóa TLow theo EFT/EFP 75% trong bệnh phổi hạn chế cấp tính (tức là tăng ERS) cho phép ổn định nhanh chóng phế nang bằng cách ngăn chặn sự xẹp phế nang, mất EELV và xẹp phổi do RACE gây ra (Roy và cộng sự, 2012; Roy S. và cộng sự, 2013; Roy SK. và cộng sự, 2013; Andrews và cộng sự, 2013b; Emr và cộng sự, 2013; Kollisch-Singule và cộng sự, 2014a; Kollisch - Singule và cộng sự, 2014b; 2019; Smith và cộng sự, 2015; Jain và cộng sự, 2017; Silva và cộng sự, 2018; Bates và cộng sự, 2020; de Magalhães và cộng sự, 2021; Vasconcellos de Oliveira và cộng sự, 2022). Ngoài ra, khi PLow được đặt thành 0 cmH2O, SLOPEEF được sử dụng để phân tích lực phản hồi khi thở ra, cho phép cá nhân hóa bằng cách tinh chỉnh TLow theo cơ học phổi của bệnh nhân.
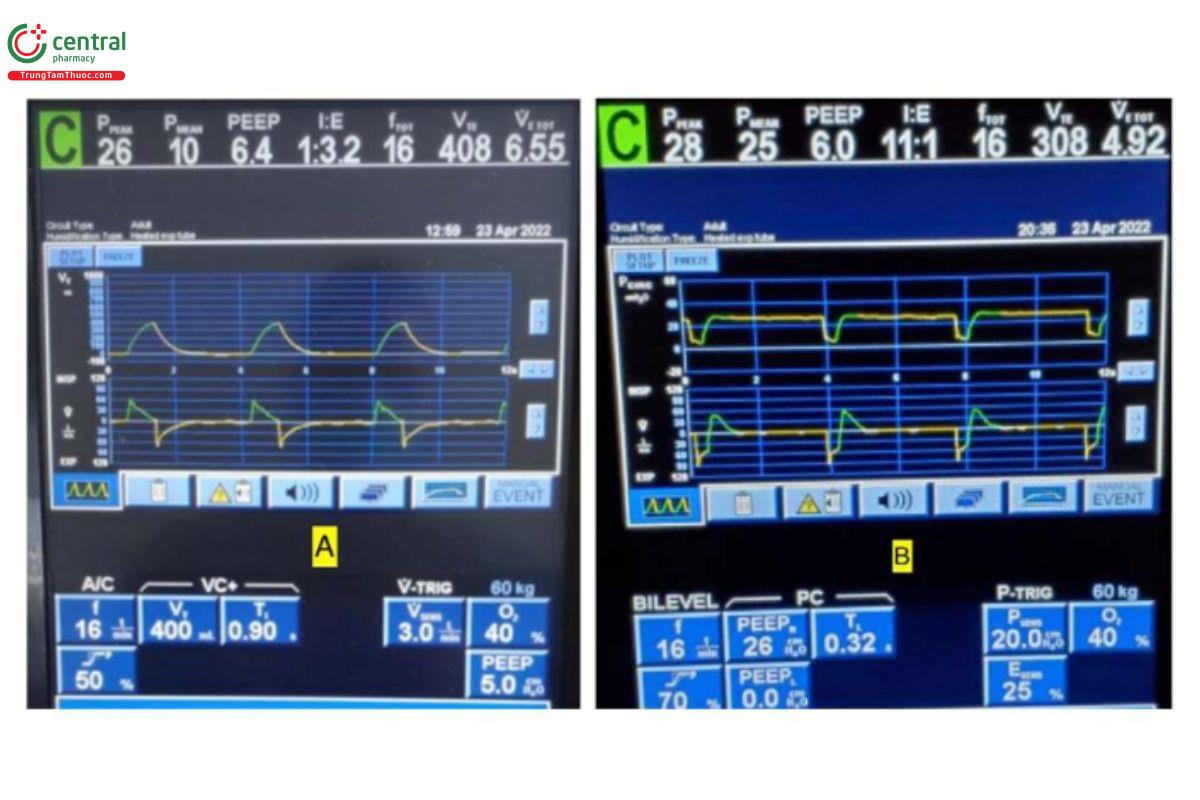
HÌNH 11. (A) Chế độ kiểm soát hỗ trợ thể tích (VAC) thông thường với tần số hô hấp (RR) được đặt là 16 và tỷ lệ hít vào/thở ra (I:E) là 1:3,2. (B) Cùng một bệnh nhân chuyển sang BiLevel (APRV) với cùng tần số và TLow được đặt thành 0,32 giây để kết thúc ở 75% lưu lượng thở ra đỉnh (EFT/EFP) tạo ra tỷ lệ I:E là 11:1. Lưu ý thêm rằng ở EFT/EFP 75%, thể tích khí lưu thông giảm từ 408 xuống 308 ml để phù hợp với CRS hiện tại.
Điều này cho phép bác sĩ lâm sàng điều chỉnh TLow theo những thay đổi của EELV và CRS, dựa trên SLOPEEF. Việc theo dõi cơ học hô hấp theo thời gian thực tại bên giường bệnh nhân bằng nhịp thở này là không thể với IR-PCV vì van PEEP làm giảm lực giật làm biến dạng SLOPEEF, không còn phản ánh ERS của quá trình thở ra thụ động (Dixon và Brodie, 1903; Rahn và cộng sự, 1946; Mead và Whittenberger, 1953; Brody 1954; Comroe 1954; Brody và Dubois, 1956; McIlroy và cộng sự, 1963; Bergman 1966; Grimby và cộng sự, 1968; Ashutosh và Keighley, 1978; Behrakis và cộng sự, 1983; Richardson và cộng sự, 1989; Baydur và Carlson, 1994; Brunner và cộng sự, 1995; Guttmann và cộng sự, 1995; Nassar và cộng sự, 2012).
Cuối cùng, tên của chế độ máy thở và những gì người dùng có thể cấu hình khác nhau giữa các thương hiệu máy thở. Ví dụ, APRV thường bị nhầm lẫn với các biến thể của APRV (tức là BiPAP, Bilevel) vì các nhà sản xuất có thương hiệu riêng của chế độ APRV như: Bi-Vent/APRV (Servo/Maquet), BiLevel/PC (Puritan Bennett/Covidien), APRV/BiPhasic (Avea/CareFusion) và APRV/PC-APRV (Dräger) để kể tên một vài cái tên. Yếu tố quan trọng khi lựa chọn chế độ APRV là khả năng cài đặt và điều chỉnh THigh và TLow một cách độc lập và chính xác.
8 Huyền thoại số 7—Thông khí giải phóng áp lực đường thở tạo ra PEEP tự động không an toàn
Một số người cho rằng APRV dẫn đến auto-PEEP không kiểm soát được và thậm chí không an toàn (Dries và Marini, 2009; Modrikyniem và cộng sự, 2011; Daoud và cộng sự, 2012). Mặc dù là một tuyên bố phổ biến, nhưng không có dữ liệu nào hỗ trợ auto-PEEP không kiểm soát và tăng căng phồng động (dynamic hyperinflation - DHI) chỉ xảy ra hoặc xảy ra với tần suất cao hơn ở APRV (tức là CPAP có giải phóng) so với bất kỳ chế độ máy thở nào khác. Cả thuật ngữ và nhận thức về auto-PEEP khi áp dụng cho APRV đều được cho là bằng DHI, có thể gây ra chấn thương do áp lực và mất ổn định huyết động và—theo định nghĩa - tăng theo thời gian. Tuy nhiên, việc duy trì EELV tĩnh không nên được gộp chung là tương đương với DHI và trên thực tế, thể tích phổi tĩnh với CPAP (tức là không giải phóng) có thể làm giảm DHI ở COPD (Petrof và cộng sự, 1990; Fessler và cộng sự, 1995; O'Donahuhe và cộng sự, 2002; Lopes và cộng sự, 2011). Ý kiến này về auto-PEEP nảy sinh vì APRV không tuân theo thông lệ chính thống của PEEP đã đặt. Thay vào đó, trong phương pháp TCAV™, TLow ngăn ngừa đóng đường thở và duy trì EELV với khả năng kiểm soát thời gian ngắn, chính xác được cá nhân hóa theo cơ chế hệ hô hấp của từng cá nhân [lực giật]. Vì EELV là hàm của ERS và thể tích PEEP, tỷ lệ thuận với FRC và được xác định bởi thời lượng TLow và vì TLow được điều chỉnh dựa trên tỷ lệ phần trăm cố định của lưu lượng thở ra, là một tích phân của thể tích, thay vì thời gian cố định hoặc tùy ý, do đó, sự dịch chuyển thể tích và EELV được kiểm soát trực tiếp.
Thông thường, thể tích phổi ở cuối kỳ thở ra xấp xỉ thể tích thư giãn của hệ hô hấp. Điều này định nghĩa FRC, trong đó lực đẩy của phổi về phía rốn phổi được trung hòa bởi lực hướng ra ngoài của thành ngực và có chức năng duy trì trao đổi khí ổn định, giảm thiểu công thở (work of breathing - WOB) đàn hồi và tối ưu hóa chức năng tim phổi (Rahn và cộng sự, 1946). Mất FRC thường gặp ở những bệnh nhân nằm viện phải thở máy (gọi là EELV) (Puybasset và cộng sự, 1998; Rylander và cộng sự, 2004; Bikker và cộng sự, 2008; Bellani và cộng sự, 2011; Albert, 2012; Gonazalez-Lopez và cộng sự, 2012; Gommers, 2014; Albert, 2022; Hopkins và Sharma, 2022) và được khuếch đại trong ARDS, nơi vai trò của EELV tĩnh không chỉ cần thiết cho lợi ích tim phổi mà còn có thể cải thiện hiệu quả của các chiến lược bảo vệ phổi vì nó giảm thiểu tình trạng strain phổi, có thể cao mặc dù có chiến lược LVT (Chiumello và cộng sự, 2008; Gonzalez-Lopez và cộng sự, 2012; Xie và cộng sự, 2017).
Mặc dù PEEP được thiết lập nhằm mục đích duy trì hoặc tăng EELV bằng cách tạo ra sự chậm trễ thở ra, quan điểm về việc tạo ra PEEP tự động này báo trước rằng chỉ trong APRV, sự gia tăng EELV mới không thể kiểm soát được. Vì EELV đầy đủ trong quá trình thở máy là cần thiết trong quá trình thở máy bảo vệ, nên vẫn còn một câu hỏi hợp lý là liệu có nên sử dụng áp lực được cài đặt (PEEP) để gián tiếp duy trì EELV hay hướng dẫn thời gian lưu lượng (TLow) để trực tiếp duy trì và kiểm soát EELV hay không, vì thể tích là một tích phân của lưu lượng. Vì cả PEEP và TLow đều có thể duy trì EELV, nên sự khác biệt chính là giữa tình trạng căng phồng tĩnh (mong muốn) so với DHI (không mong muốn). Mối quan tâm chung đối với PEEP tự động, "bẫy khí" và DHI với APRV dường như là phản ứng với thời gian giải phóng thở ra ngắn (TLow). Tuy nhiên, vai trò của thời gian thở ra trong quá trình thở máy có ít tác động đến việc làm giảm DHI ngay cả trong COPD (Leatherman và cộng sự, 2004; Ku, 2016; Natalini và cộng sự, 2016). Leatherman và cộng sự (2004) lưu ý rằng việc kéo dài thời gian thở ra lên >7 giây không làm thay đổi đáng kể DHI ngay cả ở những bệnh nhân hen suyễn. Tương tự như vậy, ở 186 bệnh nhân bị hạn chế lưu lượng khí/bệnh phổi tắc nghẽn, Natalini và cộng sự (2016) nêu rằng “Điều đáng ngạc nhiên là chúng tôi quan sát thấy trong mẫu bệnh nhân thở máy của chúng tôi, các biến số đặc trưng cho kiểu thở (f, TE, VT và thông khí phút) dường như có vai trò không đáng kể trong auto PEEP” và “Có vẻ như ngay cả ở những bệnh nhân bị hạn chế lưu lượng khí, auto-PEEP có thể được giảm hiệu quả hơn bằng cách tác động chủ yếu vào các đặc điểm có thể thay đổi của bệnh nhân, trong khi việc điều chỉnh kiểu thở chỉ có thể có tác động không đáng kể đến giá trị auto-PEEP tổng thể”.
Điểm áp lực bằng nhau góp phần làm tăng sức cản đường thở ngoài lực đàn hồi tạo ra các hạn chế luồng khí và làm chậm quá trình làm rỗng phổi, cho phép nỗ lực hít vào/nhịp thở tiếp theo xảy ra trước khi đạt được thể tích cân bằng tĩnh, dẫn đến DHI (Voets và Van Helvoort, 2013). Ngoài ra, ở những bệnh nhân bị hạn chế luồng khí, EELV có thể vượt quá FRC dự đoán (Kimball và cộng sự, 1982; Pepe và Marini, 1982). Mặc dù đã được mô tả đầy đủ trong tài liệu, tỷ lệ mắc auto-PEEP vẫn chưa được biết; tuy nhiên, hầu hết các trường hợp DHI xảy ra ở những bệnh nhân bị hạn chế luồng khí ngay cả khi không thở máy hoặc thường thở máy thông thường (Wright và Gong, 1990; O'Donnell và Laveneziana, 2006). Trong khi auto-PEEP "mức thấp" đã được mô tả với LVT (Marini và cộng sự, 1985; de Durante và cộng sự, 2002; Patroniti và Pesenti, 2003). Bergman (1972) lần đầu tiên mô tả tình trạng bẫy khí tiến triển bằng thuật ngữ DHI được gây ra bằng cách tăng RR lên đến 66 nhịp/phút kết hợp với tăng VT lên đến 1 L ở bảy bệnh nhân được gây mê. Sau đó, Pepe và Marini (1982) đã mô tả "hiệu ứng PEEP tự động" trong một loạt ca mô tả DHI ở ba bệnh nhân, hai bệnh nhân mắc COPD đã biết và một bệnh nhân bị co thắt phế quản đang hoạt động bằng cách sử dụng VT 11–12 ml/kg với VAC. Vì những bệnh nhân mắc COPD biểu hiện tốc độ làm rỗng phổi giảm vào cuối thì thở ra do tăng RAW và có nguy cơ mắc DHI cao nhất, nên một PEEP được đặt được sử dụng để giảm RAW và do đó là DHI. PEEP được đặt này dẫn đến tốc độ làm rỗng phổi nhanh hơn và đồng đều hơn (Kondili và cộng sự, 2004), điều này dường như có lợi trong việc giảm DHI và có thể cải thiện việc kích hoạt máy thở (Chao và cộng sự, 1997). Tương tự như vậy, ở những bệnh nhân mắc ARDS, tốc độ xẹp phổi giảm dần do sức cản thở ra tăng đáng kể ở thể tích phổi thấp (Koutsoukou và cộng sự, 2000; Kondili và cộng sự, 2002) vì kích thước đường thở giảm trong quá trình mất thể tích phổi (Wilson và cộng sự, 1993). Do đó, việc áp dụng PEEP trong ARDS làm giảm sức cản thở ra tương tự như ở bệnh nhân COPD và dẫn đến tốc độ làm rỗng phổi tương đối ổn định và nhanh (Koutsoukou và cộng sự, 2000; Kondili và cộng sự, 2002). Ngoài ra, dữ liệu về cấu trúc siêu nhỏ của phổi cho thấy PEEP làm giãn ống dẫn như một cơ chế có thể làm giảm RAW (Kollisch-Singule và cộng sự, 2014b).
Vì PEEP làm giảm RAW ở COPD và ARDS, nên việc tăng làm rỗng phổi có thể có lợi để giảm DHI ở COPD khi ERS thấp (tức là lực giật thấp); tuy nhiên, khi ERS cao (tức là ARDS), phổi có thể thoát khí nhanh chóng, thúc đẩy chấn thương do xẹp phổi. Do đó, những bệnh nhân có ERS cao sẽ thích nghi với thể tích phổi hít vào ít hơn và duy trì lực giật cao và khi không có những hạn chế đáng kể về luồng khí thì khả năng xảy ra DHI ít hơn (Gottfried và cộng sự, 1985; Gottfried, 1991; Marini 2011). Ví dụ, trong mô hình thỏ rửa nước muối, việc huy động phổi theo chu kỳ đã được đánh giá bằng đầu dò PaO2 nhanh so sánh thời gian thở ra ngắn (TExp) (0,83 giây) và PEEP thấp (3 cmH2O) với TExp kéo dài (2,9 giây) và PEEP cao (14cmH2O) (Syring và cộng sự, 2007). Kết quả cho thấy so với nhóm PEEP thấp/TExp ngắn, nhóm PEEP cao/TExp kéo dài có sự huy động theo chu kỳ nhiều hơn (P 0,001). Hơn nữa, PEEP thấp/TExp ngắn không tạo ra PEEP nội tại (PEEPi). Các tác giả tóm tắt “Việc ngăn ngừa mất huy động cuối kỳ thở ra mà không có PEEPi cho thấy một cơ chế khác, khác với PEEPi, đóng vai trò trong hành vi động của chứng xẹp phổi”. Ngoài ra, CO tăng trung bình 13% trong nhóm TExp ngắn so với nhóm PEEP cao (P 0,001), cũng như độ bão hòa tĩnh mạch hỗn hợp (P 0,001). Trong mô hình rửa phổi ARDS ở lợn con, Boehme và cộng sự (2015) phát hiện ra rằng pha hít vào kéo dài dẫn đến PaO2 trung bình cao hơn trong khi TExp ngắn làm giảm dao động PaO2 theo chu lỳ thở, cho thấy sự giảm trong việc huy động - mất huy động theo chu kỳ (cR/D) với TExp ngắn. Rút ngắn TExp bằng thông khí tỷ lệ nghịch (IRV) làm giảm thời gian có sẵn để mất huy động, dẫn đến huy động trung bình nhiều hơn. Sử dụng chụp cắt lớp trở kháng điện, khi I:E tăng từ 1:4 lên 4:1, những thay đổi trong thông khí khu vực đã xảy ra, tạo ra sự phân phối lại từ các vùng phổi không phụ thuộc sang các vùng phổi phụ thuộc. Boehme và cộng sự (2015) cũng phát hiện ra PEEP nội tại không đáng kể khi TExp giảm trong mọi cài đặt. Các tác giả kết luận rằng "Hằng số thời gian cho việc huy động và mất huy động, và phân phối thông khí khu vực, phản ánh những phát hiện này và làm nổi bật sự phụ thuộc vào thời gian của việc huy động và mất huy động theo chu kỳ" (Boehme và cộng sự, 2015).
Mặc dù EELV thường được quản lý bằng PEEP, nhưng vẫn chưa rõ mức PEEP nào ngăn ngừa tình trạng đóng đường thở ở một bệnh nhân nhất định tại một thời điểm nhất định (Kalenka và cộng sự, 2016). Mặc dù việc tăng PEEP cho thấy mối tương quan tuyến tính với quá trình oxygen hóa và thường được sử dụng làm đại diện thay thế cho quá trình huy động, nhưng nó vẫn là một dấu hiệu kém về sự ổn định của phế nang khi quan sát bằng kính hiển vi trong cơ thể sống (Andrews và cộng sự, 2015). Các nghiên cứu về PEEP giảm dần khiến một mức PEEP khó kiểm soát hành vi của phổi theo thời gian (Maggiore và cộng sự, 2001; Sahetya và cộng sự, 2017; Bates và Smith, 2018; Baumgardner 2019; Broche và cộng sự, 2019; Scaramuzzo và cộng sự, 2019). Dữ liệu về tác động của PEEP lên cấu trúc vi mô phổi cho thấy PEEP chủ yếu gây giãn ống dẫn thay vì ngăn ngừa sự xẹp phế nang và làm tăng tính không đồng nhất của phế nang (Kollisch-Singule và cộng sự, 2014b; Kollisch-Singule và cộng sự, 2016a) (Hình 5). Trên thực tế, thang đo PEEP-FiO2 gần đây đã bị thách thức là nguy hiểm đối với bệnh nhân CARDS (Gattinoni và cộng sự, 2020a, 2020b; Tsolaki và cộng sự, 2020; Barthélémy và cộng sự, 2021; Ceruti và cộng sự, 2021).
Ngoài ra, TLow được thiết lập theo hằng số thời gian chiếm ưu thế (Bates và cộng sự, 2020) đã chứng minh rằng APRV với phương pháp TCAV™ làm tăng độ ổn định của phế nang, giảm độ biến dạng vi mô và tính không đồng nhất của phế nang và bình thường hóa khoảng khí với độ giãn ống ít hơn PEEP (Kollisch-Singule và cộng sự, 2014a; Kollisch-Singule và cộng sự, 2014b; Kollisch Singule và cộng sự, 2016a) (Hình 4–7). Với phương pháp TCAV™, TLow được điều chỉnh để nhắm mục tiêu EFT/EFP 75% ở mức bình thường đến ERS cao (tức là ARDS) và <50%–25% đối với những bệnh nhân có ERS thấp (tức là COPD, hen suyễn) (Hình 12). Cuối cùng, việc phân tích SLOPEEF bằng phương pháp TCAV™ cung cấp đánh giá thời gian thực về cơ học hô hấp khi quá trình bệnh của bệnh nhân tiến triển thay vì lựa chọn PEEP tùy ý hoặc cố gắng sử dụng oxygen hóa làm dấu hiệu của sự ổn định phế nang và là đại diện thay thế cho tình trạng căng thẳng phổi thấp (Andrews và cộng sự, 2015). Trong APRV với PLow được đặt thành 0 cmH2O, các hạn chế lưu lượng khí và những thay đổi của EELV được quan sát theo thời gian thực với những thay đổi của ERS hoặc sức cản bao gồm các mô hình COPD thực nghiệm (Vasconcellos de Oliveira và cộng sự, 2022). Hình 13 cho thấy sự tiến triển của TLow ở một bệnh nhân bị co thắt phế quản cấp tính (trạng thái hen suyễn), được ghi lại bằng cách theo dõi tại giường theo thời gian thực về các hạn chế lưu lượng khí và các điều chỉnh TLow tương ứng (Hình 13). Khi đạt được mức độ thở tự nhiên chấp nhận được và vì giai đoạn giải phóng trong APRV-TCAV™ rất ngắn, nên có ba hàm ý chính: 1) nhịp thở tự nhiên chủ yếu xảy ra trong giai đoạn CPAP bảo toàn thời gian hít vào của thần kinh; 2) CPAP ở những bệnh nhân có hạn chế luồng khí có liên quan đến việc giảm DHI, cho phép bệnh nhân bảo vệ thể tích phổi của mình, khiến DHI không được kiểm soát là điều không thể xảy ra (Petrof và cộng sự, 1990; Fessler và cộng sự, 1995; O'Donahuhe và cộng sự, 2002; Lopes và cộng sự, 2011); và 3) van thở ra chủ động so với van thở ra đóng trong giai đoạn hít vào cho phép bệnh nhân thở ra vượt quá tần số giải phóng đã đặt và nhận được sự hỗ trợ hít vào bằng cách sử dụng các cơ thở ra ở bụng (Torres và cộng sự, 1993).
9 Huyền thoại số 8—PLow 0 cmH2O dẫn đến chấn thương và sụp đổ phế nang
Mặc dù mức PEEP nào có tác dụng bảo vệ vẫn chưa được xác định, nhưng có ý kiến cho rằng quá trình chuyển đổi đột ngột từ PHigh sang PLow là 0 cmH2O là không kiểm soát được trong APRV, tạo ra khả năng gây tổn thương cơ học, nếu không thì sẽ được PEEP bảo vệ (Neumann và cộng sự, 2002; Dries và Marini, 2009) và PLow là 0 cmH2O cho phép phế nang xẹp ngay cả khi TLow trong thời gian ngắn (Myers và Macintyre, 2007; Modrikyniem và cộng sự, 2011; Daoud và cộng sự, 2012). Về cơ bản, khi sử dụng phương pháp TCAV™ của APRV, PLow được đặt thành 0 cmH2O vì thời gian [thay vì áp lực] được sử dụng để kiểm soát EELV. Ngoài ra, PLow > 0 cmH2O làm thay đổi quá trình lưu lượng thời gian của quá trình thở ra thụ động, do đó làm giảm lực giật lùi khi SLOPEEF không còn biểu thị cơ học của hệ hô hấp nữa.
Giống như PEEP, không có sự đồng thuận về mức PLow trong APRV. Tuy nhiên, các nghiên cứu đã chỉ ra rằng APRV PLow 0 cmH2O và TLow được đặt thành EFT/EFP 75% duy trì EELV, ngăn ngừa sự xẹp khoảng khí cuối thì thở ra, tạo ra độ strain vi mô thấp nhất trên các khoảng khí xa (phế nang và ống dẫn) (Hình 4), giảm thiểu sự giãn nở ống dẫn (Hình 5) và phục hồi tính đồng nhất của phế nang sau tổn thương phổi không đồng nhất so với LVT với PEEP lên đến 24 cmH2O (Hình 6) (Kollisch-Singule và cộng sự, 2014a, Kollisch Singule và cộng sự, 2014b, Kollisch-Singule và cộng sự, 2016a, Kollisch-Singule và cộng sự, 2016b) cho thấy trong một mô hình tổn thương phổi cấp tính, diện tích phế nang thay đổi giữa hít vào và thở ra là < 5% trong nhóm APRV với PLow là 0 cmH2O và TLow được đặt thành EFT/EFP 75%, mô phỏng sự thay đổi diện tích của phổi không bị tổn thương; trong khi nhóm LVT với PEEP được sử dụng phổ biến nhất trên lâm sàng là 10 cmH2O (Bellani và cộng sự, 2016) đã chứng minh sự thay đổi diện tích 50% giữa thì hít vào và thở ra, gợi ý chấn thương do xẹp phổi do RACE gây ra lớn hơn gấp 10 lần (Hình 8). Ngoài ra, để xác định hiệu quả của APRV, một mô hình chuyển dịch so sánh APRV với LVT cho thấy nhóm APRV với TLow được đặt thành 75% EFT/EFP và PLow 0 cmH2O không gây tổn thương phổi theo tỷ lệ P/F, mô học hoặc các dấu hiệu viêm, trong khi nhóm LVT phát triển ARDS ở tất cả các động vật theo tỷ lệ P/F, mô học và các dấu hiệu viêm (Roy và cộng sự, 2012; Roy S. và cộng sự, 2013; Roy SK. và cộng sự, 2013; Silva và cộng sự, 2018; de Magalhães và cộng sự, 2021). Ngoài ra, một nghiên cứu quan sát về phòng ngừa ARDS đã xem xét 231 bệnh nhân được thiết lập với giao thức APRV sử dụng TLow 75% EFT/EFP và PLow 0 cmH2O (Andrews và cộng sự, 2013b) và không cho thấy tỷ lệ ARDS cao hơn hoặc tử vong như đã giả định nếu sử dụng TLow 75% EFT/EFP và PLow 0 cmH2O không thể hạn chế tình trạng sụp đổ, do đó làm tổn thương phổi nặng hơn.
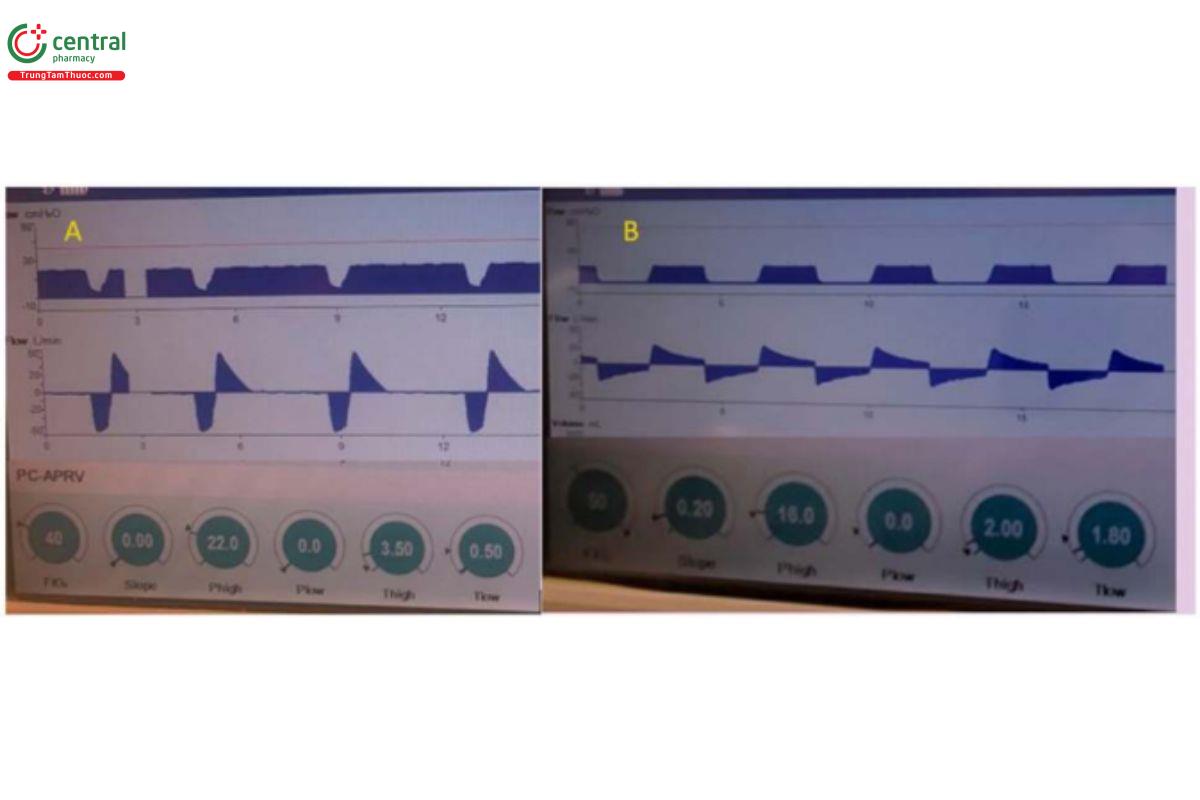
HÌNH 12. Thở ra thụ động để xác định cơ học phổi trong APRV - Phương pháp Thông khí thích ứng kiểm soát theo thời gian (TCAVTM) của Thông khí giải phóng áp lực đường thở (APRV) sử dụng độ dốc của đường cong lưu lượng thở ra thụ động để xác định cơ học hô hấp. Ví dụ (A) (bên trái) là một bệnh nhân có độ đàn hồi cao của hệ hô hấp (ERS) được biểu thị bằng lưu lượng thở ra >50 lít/phút và góc giảm tốc độ dốc cấp tính. Độ giảm tốc độ dốc bị ảnh hưởng bởi thể tích phổi hít vào và sức cản hạ lưu (đường thở tự nhiên và nhân tạo và PLow > 0 cmH2O). Những thay đổi của ERS (tức là lực giật trên một đơn vị thể tích) hoặc tăng sức cản đường thở (giới hạn luồng khí) làm thay đổi lưu lượng thở ra đỉnh (EFP) và góc dốc. TLow với ERS cao được điều chỉnh để chấm dứt lưu lượng thở ra (EFT) ở 75% lưu lượng thở ra đỉnh (EFP). Thể tích phổi cuối thì thở ra (EELV) được kiểm soát thông qua việc điều chỉnh chính xác và cá nhân hóa thời gian lưu lượng như một tích phân của thể tích. Vì việc cá nhân hóa TLow được điều chỉnh dựa trên độ co giãn đàn hồi của phổi và ERS, nên không nên điều chỉnh để đạt được thể tích khí lưu thông (VT) hoặc kiểm soát PaCO2. EFT/EFP 75% đã được hiệu chuẩn thực nghiệm, xác nhận lâm sàng và được chứng minh là tối ưu hóa EELV, ngăn ngừa đóng đường thở và giảm căng thẳng phổi ở những phổi có ERS bình thường đến tăng. Ví dụ (B) (bên phải) là một bệnh nhân có ERS thấp, lực co giãn thấp và sức cản cao được biểu thị bằng lưu lượng thở ra <20 lít/phút và góc giảm tốc độ dốc ít cấp hơn, trong đó TLow được điều chỉnh để đạt được 25% EFT/EFP, đã được hiệu chuẩn để giảm tính không đồng nhất của phế nang, viêm phổi, phù nề và biểu hiện gen của các dấu hiệu sinh học liên quan đến tổn thương phổi do máy thở và cải thiện hiệu suất thất phải bằng cách cá nhân hóa mô hình COPD.
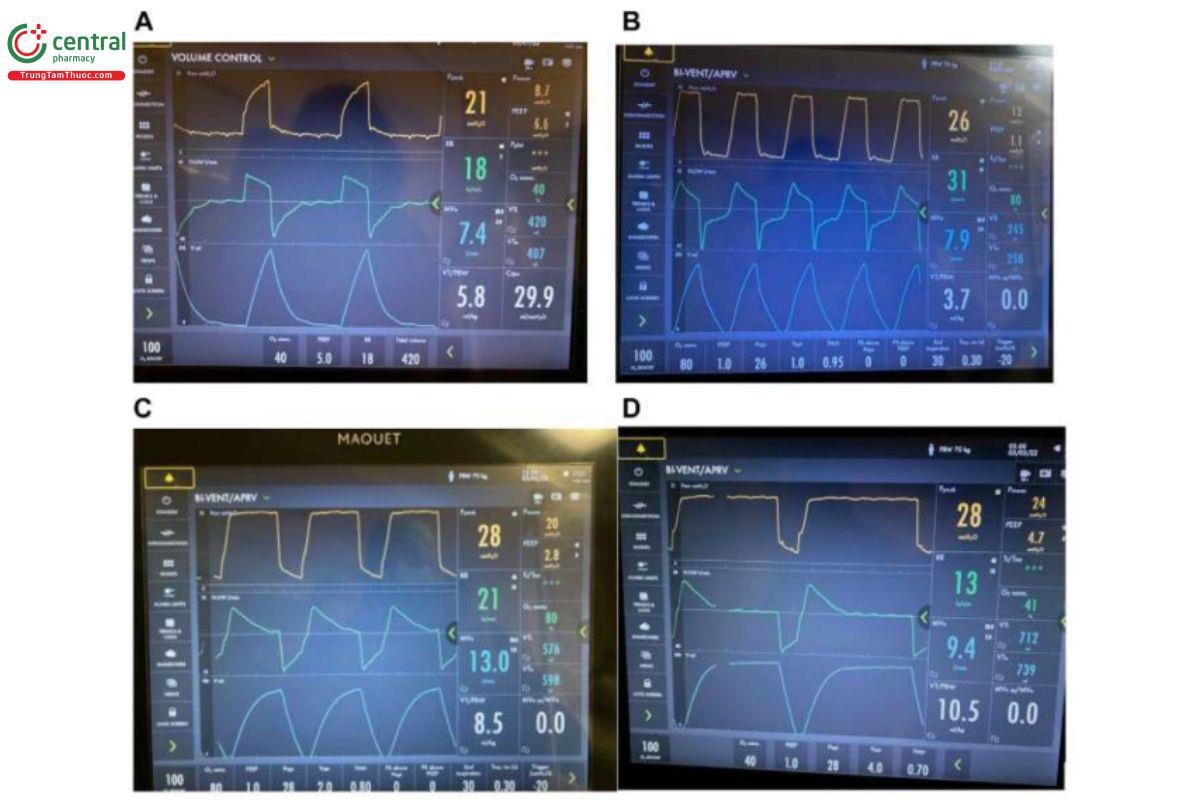
HÌNH 13. Cài đặt TLow ở bệnh nhân bị co thắt phế quản cấp tính (trạng thái hen suyễn). Theo dõi bên giường các hạn chế luồng khí với điều chỉnh TLow theo thời gian thực với thông khí giải phóng áp lực đường thở (APRV) BI-VENT ở bệnh nhân bị co thắt phế quản đang hoạt động (A) Chế độ kiểm soát thể tích khi không thấy áp lực dương cuối thì thở ra (PEEP) động lực nội tại (Dyn) trong dạng sóng lưu lượng thở ra (B) Chế độ được thay đổi thành BI-VENT/APRV với lưu lượng thở ra đỉnh (EFP) đo được là -20 L/phút, phù hợp với hạn chế luồng khí nghiêm trọng. Lưu ý, EFP được đo khi bắt đầu giảm tốc và không phải là hiện tượng giả từ nén khí mạch mất tức thời. TLow được điều chỉnh thành 0,95 giây nhắm mục tiêu kết thúc lưu lượng (EFT) >25% đến <50% đối với bệnh nhân bị hạn chế luồng khí. (C) Giải quyết tình trạng co thắt phế quản cấp tính, EFP gần 70 l/phút cho phép giảm TLow xuống 0,8 giây trong khi vẫn tiếp tục nhắm mục tiêu EFT/EFP >25% đến <50%. (D) Tiếp tục cải thiện tình trạng co thắt phế quản khi EFP gần 80 l/phút cho phép giảm TLow xuống 0,7 giây trong khi vẫn tiếp tục nhắm mục tiêu EFT/EFP >25% đến <50%. Tăng dần thể tích khí lưu thông và thông khí phút cho phép giảm dần PHigh (không hiển thị). Lưu ý, máy thở này không cho phép PLow là 0 cmH2O với 1 cmH2O là cài đặt thấp nhất có thể.
Người ta cũng khẳng định rằng PLow bằng 0 cmH2O không làm tăng EFP (Zhou và Chatburn, 2012). Tuy nhiên, điều này dựa trên dữ liệu được tạo ra từ một mô hình mô phỏng, không thể định lượng hành vi mô nhớt đàn hồi của phổi và thành ngực, trong đó người ta suy đoán rằng EFP sẽ không thay đổi mà không có độ trễ khi so sánh các thiết lập PLow. Để đạt được mục tiêu của họ, PHigh đã được tăng lên với mỗi lần tăng PLow để duy trì ï 25 cmH2O. Tất nhiên, điều này không đại diện cho ứng dụng lâm sàng của APRV và sẽ tương tự như việc tăng áp lực hít vào trong PCV mỗi khi tăng PEEP. Không có gì ngạc nhiên khi kết quả của họ cho thấy sự gia tăng EFP với mỗi lần tăng PHigh và đồng thời tăng PLow vì sự gia tăng độ giật trong một mô hình ngăn đơn là điều mong đợi. Tuy nhiên, khái niệm này đã được thử nghiệm trên 20 bệnh nhân, trong đó chỉ có PLow tăng chứ không phải PHigh (Madden và cộng sự, 2016), phản ánh thông lệ lâm sàng tiêu chuẩn khi sử dụng TLow để kiểm soát EELV và cho thấy EPF giảm dần khi PLow tăng tuần tự > 0 cmH2O.
Do lưu lượng thở ra rất quan trọng đối với việc loại bỏ tiết dịch, Mahajan và cộng sự (2019) đã xác nhận thêm việc thiết lập PLow là 0 cmH2O trong mô hình phổi lợn bảo quản được gắn ống nội khí quản. Nhiều kết hợp của tốc độ hít vào đỉnh và EFP đã được sử dụng để so sánh APRV (phương pháp TCAV™) với LVT (giao thức ARDSnet). PHigh/Pplat được thiết lập như nhau ở cả hai nhóm. Trong nhóm APRV, chỉ có PLow được điều chỉnh từ 0 đến 5 đến 10 cmH2O theo gia số và trong nhóm LVT, PEEP được điều chỉnh theo gia số từ 5 đến 10 đến 20 cmH2O. Khi PLow tăng lên, cả EPF và chuyển động chất nhầy đều giảm, điều này rất quan trọng vì các nghiên cứu cho thấy việc thanh thải chất nhầy được tạo điều kiện thuận lợi khi EPF tăng (Kim và cộng sự, 1987; Dennesen và cộng sự, 2003; de Prost và cộng sự, 2007; Powell và cộng sự, 2018). Nhóm APRV-TCAV™ dẫn đến chuyển động chất nhầy gần lớn nhất so với không chuyển động chất nhầy ở nhóm LVT ở bất kỳ mức PEEP nào như thể hiện trong Hình 14. Hơn nữa, trong một nghiên cứu so sánh APRV-TCAV™ với VAC trong viêm phổi thực nghiệm (de Magalhães và cộng sự, 2021), APRV-TCAV™ có liên quan đến ít tổn thương phổi hơn, ít nhiễm trùng huyết hơn và giảm biểu hiện gen của các chất trung gian liên quan đến tình trạng viêm.
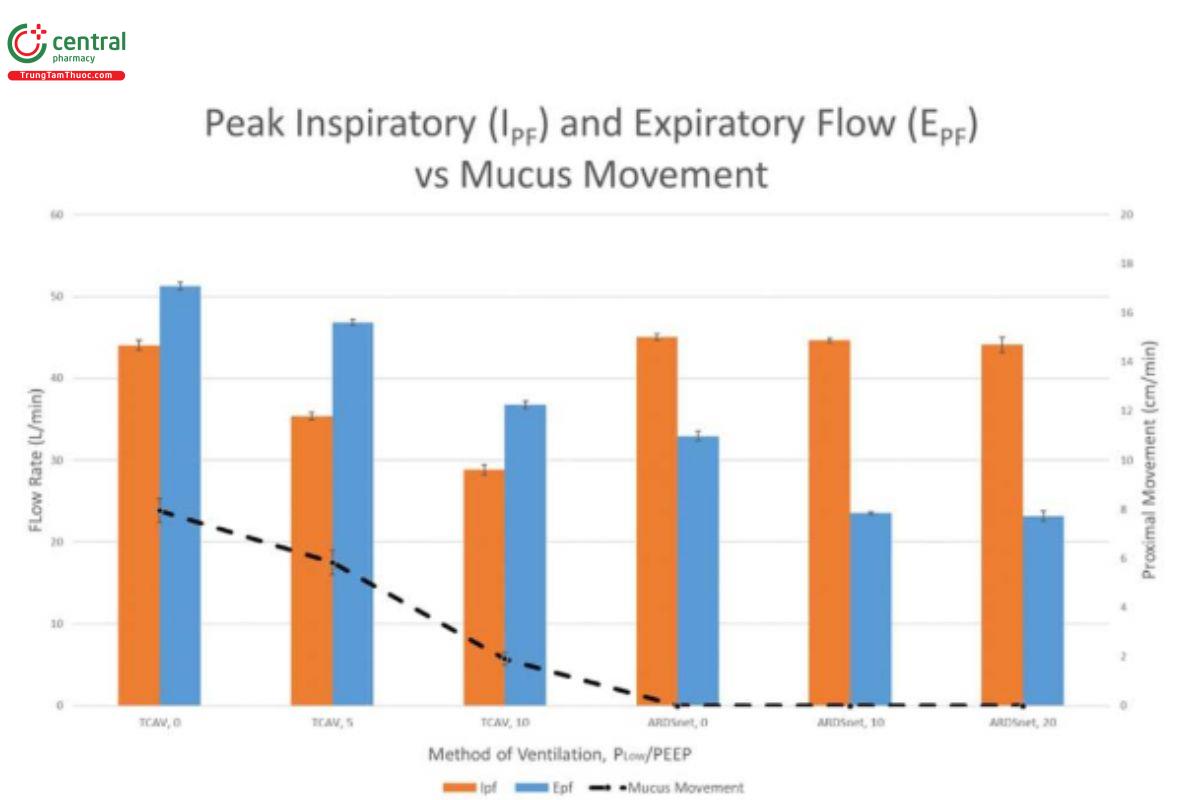
HÌNH 14. Lưu lượng hít vào đỉnh (IPF), lưu lượng thở ra đỉnh (EPF) và chuyển động chất nhầy gần cho các nhóm thử nghiệm so sánh Thông khí giải phóng áp lực đường thở (APRV) và Thể tích khí lưu thông thấp (LVT). Các thanh màu cam và xanh lam biểu thị IPF và EPF tương ứng (trục dọc bên trái). Chuyển động chất nhầy gần được biểu thị bằng đường chấm chấm nối các điểm dữ liệu (trục dọc). Nhóm giao thức TCAV 1, 2 và 3 sử dụng APRV với PLow thay đổi (APRV-TCAVTM chuẩn với 0 cmH2O) và 5 và 10 cmH2O tương ứng. Nhóm LVT ARDSNet 4, 5 và 6 thay đổi cài đặt áp lực cuối thì thở ra dương (PEEP) lần lượt là 0, 10 và 20 cmH2O.
Tóm lại, khi sử dụng phương pháp TCAV™ của APRV, việc thiết lập mức PLow là không cần thiết và việc thay đổi mức PLow cũng tùy ý như việc thay đổi mức PEEP, vốn vẫn chưa ổn định và có thể vẫn như vậy trong tương lai gần. Tuy nhiên, tất cả các mô hình thử nghiệm đều cho thấy ít tổn thương hơn hoặc ngăn ngừa hoàn toàn tổn thương phổi khi sử dụng PLow 0 cmH2O với TLow
75% EFT/EFP (Roy và cộng sự, 2012; Roy S. và cộng sự, 2013; Roy SK. và cộng sự, 2013; Kollisch-Singule và cộng sự, 2014a; Kollisch Singule và cộng sự, 2014b; Singule và cộng sự, 2016a; Kollisch-Singule và cộng sự, 2016b; Silva và cộng sự, 2018; de Magalhães và cộng sự, 2021). Về mặt lâm sàng, các thử nghiệm cho thấy APRV với PLow 0 cmH2O với TLow 75% EFT/EFP không kém hơn LVT, điều này sẽ không xảy ra nếu APRV gây tổn thương phổi (Andrews và cộng sự, 2013a; Andrews và cộng sự, 2013b). Có một sai lầm phổ biến khi cho rằng tính tuyến tính giữa các thông số thông khí vĩ mô hiển thị trên máy thở và những gì đang diễn ra trong môi trường vi mô của phổi) trong khi APRV thực sự tạo ra biến dạng động tối thiểu (Kollisch-Singule và cộng sự, 2018).
10 Huyền thoại số 9 – Không thể đo áp lực đẩy trong APRV
Trong một nghiên cứu của Zhou và cộng sự (2017), các tác giả đã nêu, “Để làm cho ïP của APRV và LVT có thể so sánh được, ïP của APRV đã được đo trong cùng điều kiện như với LVT” (sic). Các tác giả tạm thời thay đổi chế độ trong nhóm APRV thành VAC để đo ïP. Niềm tin rằng không thể đo ïP trong APRV có thể một phần là kết quả của một nghiên cứu của Kacmarek và cộng sự (1995) sử dụng mô hình phổi thử nghiệm ngăn đơn so sánh PEEP đặt với PEEP tự động thường được tham chiếu và dữ liệu được ngoại suy để ngụ ý rằng APRV sẽ tạo ra sự phân bố không đồng nhất của áp lực cuối thì thở ra và EELV, do đó làm cho ïP không chính xác. Thật không may, nghiên cứu này không cung cấp thông tin chi tiết về thời lượng sử dụng để cân bằng áp lực thở ra và quan trọng hơn là phổi thử nghiệm không nắm bắt được hành vi phục hồi ứng suất mô trong phổi và các mô thành ngực do hành vi nhớt đàn hồi của chúng (Bates và cộng sự, 1988; Kochi và cộng sự, 1988). Sau đó, các tác giả đã suy rộng thêm dữ liệu mô hình phổi thử nghiệm bằng cách đưa ra giả thuyết rằng APRV sẽ tạo ra thông khí không đồng nhất như vậy để làm tăng nguy cơ chấn thương thể tích và chấn thương do xẹp phổi (Chatburn và cộng sự, 2016). Tuy nhiên, dữ liệu sinh học hiện có khiến những ý kiến này trở thành suy đoán không chính xác.
Trong mô hình động vật, IRV tạo ra VT 8– 12 ml/kg được sử dụng để tạo ra PEEP nội tại (PEEPi) và so sánh phép đo tĩnh (PEEPi stat) với phép đo động (PEEPi dyn) (Hernandez và cộng sự, 1994). PEEPi stat được đo bằng cách giữ thì thở ra trong 5 giây và PEEPi dyn được đo bằng cách thở ra đến trạng thái không có luồng khí. Kết quả cho thấy PEEPi dyn chỉ đánh giá thấp PEEPi stat trong tình trạng tắc nghẽn đường thở không đồng nhất cấp tính do methacholine (MCh) gây ra trong khi PEEPi stat xấp xỉ PEEPi dyn mà không có co thắt phế quản do MCh gây ra. Điều này cho thấy những hạn chế về luồng khí, chẳng hạn như khi co thắt phế quản, có tác động lớn nhất đến phép đo PEEPi dyn [không phải PEEPi stat] và khả năng ước tính áp lực phế nang và đo ïP. Kollisch-Singule và cộng sự. (2016a), đã chỉ ra trong một mô hình tổn thương phổi với APRV rằng tính không đồng nhất của phế nang sau khi phổi bị tổn thương đã được chuẩn hóa để phù hợp với sự phân bố kích thước phế nang bình thường không bị tổn thương, do đó khôi phục tính đồng nhất của phế nang trong khi LVT không thể chuẩn hóa tính không đồng nhất của phế nang bằng cách sử dụng PEEP bên ngoài trong phạm vi từ 5 đến 24 cmH2O. Tóm lại, APRV vượt trội hơn LVT với PEEP bên ngoài trong việc tạo ra kích thước và sự phân bố phế nang đồng đều sau khi phổi bị tổn thương. Trong một nghiên cứu khác điều tra tỷ lệ phân phối khí phế nang-ống dẫn của việc chiếm giữ khoảng không khí đường dẫn khí dẫn đến chiếm giữ khoảng không khí phế nang ở khoảng không khí xa, APRV với TLow được đặt thành EFT/EFP 75% đã khôi phục tỷ lệ khí phế nang ống dẫn khí rất giống với tỷ lệ trước khi bị tổn thương. Ngược lại, LVT và PEEP cho thấy không có khả năng khôi phục thể tích khí phế nang nhưng thể tích ống dẫn phế nang bị giãn quá mức dần dần (Kollisch-Singule và cộng sự, 2014b). Cuối cùng, trong một mô hình chấn thương phổi lợn tinh vi tạo ra "phổi trẻ em" với các vùng phổi phụ thuộc bị thương và vùng phổi bình thường không phụ thuộc, việc sử dụng quá căng APRV đã được mô phỏng với PHigh là 40 cmH2O. Với APRV EFT/EFP 75%, không có chấn thương do xẹp phổi hay quá căng nào xảy ra và gây ra ít tổn thương nhất cho cả vùng phổi bình thường và bị thương (Jain và cộng sự, 2017).
Người ta cũng ngụ ý rằng APRV gây ra suy RV có thể là do ∆P cao từ APRV mà không có dữ liệu hỗ trợ (Chen và cộng sự, 2017). Ngược lại, ∆P được đo ở 200 bệnh nhân có hệ hô hấp thụ động như bệnh nhân sau phẫu thuật (tức là gây mê hoặc thuốc chẹn thần kinh cơ) bằng cách giữ thì thở ra trong 4 giây để cân bằng (Andrews và cộng sự, 2019). Dữ liệu được thu thập và chia thành bốn chế độ máy thở: 1) n = 86 VAC); 2) n = 28 PCV; 3) n = 74 APRV-TCAV™ là chế độ chăm sóc tiêu chuẩn (S-APRV); và 4) n = 12 APRV-TCAV™ là chế độ cứu hộ (R-APRV) được sử dụng khi bệnh nhân không đáp ứng với các chế độ máy thở thông thường. ∆P thấp nhất ở nhóm S-APRV so với cả nhóm VAC (giá trị p = 0,0010) và nhóm PCV (giá trị p = 0,0002) nhưng không khác biệt đáng kể so với nhóm R-APRV (giá trị p = 0,3379). Cuối cùng, mặc dù Neumann và cộng sự thường được tham chiếu liên quan đến những biến động áp lực màng phổi lớn với APRV làm tăng nguy cơ chấn thương thể tích và chấn thương xẹp phổi, họ đã chỉ ra ïP của nhịp thở cơ học mà không thở tự nhiên giảm khi TLow giảm từ 2,5 xuống 0,5 giây, chẳng hạn như với phương pháp TCAV trong đó EFT/EFP được đặt thành 75% (Neumann và cộng sự, 2002).
Công suất cơ học của thở máy, được định nghĩa là lượng năng lượng truyền từ máy thở đến phổi, bao gồm áp lực đẩy (delta P), VT (delta V), RR, PEEP và lưu lượng khí hít vào sao cho việc cung cấp khí hít vào nhanh với lưu lượng thở ra chậm sẽ làm tăng công suất (Gattinoni và cộng sự, 2016). Hai biến được phát hiện có liên quan nhiều nhất đến tỷ lệ tử vong tăng là ∆P và RR (Costa và cộng sự, 2021). Với các cài đặt thời gian được sử dụng trong APRV (THigh và TLow), thở máy thường được cung cấp với RR và ïPLow hơn. TLow và PHigh phụ thuộc vào CRS, khả năng huy động và vì TLow ngắn nên THigh thường dài hơn 1–1,5 lần so với thở máy thông thường đối với một RR nhất định. THigh kéo dài dần dần phục hồi thể tích phổi, cải thiện hiệu quả trao đổi khí dẫn đến RR thấp dần và khi kết hợp với việc ghép nối VT với CRS (tức là delta P), các cài đặt thời gian này sẽ làm giảm các biến số công suất cơ học chính. Công suất cơ học được phát hiện giảm đáng kể ở APRV (11,9 J/phút) so với LVT (20,7 J/phút) trong mô hình thực nghiệm về tổn thương phổi do nổ (Scott và cộng sự, 2020).
11 Huyền thoại số 10—Bệnh nhân phải tự thở để APRV có hiệu quả/Thở tự nhiên trong APRV rất nguy hiểm
Huyền thoại này đi theo một vòng tròn với cả những tuyên bố ủng hộ và phản đối về việc thở tự nhiên với APRV. Người ta cho rằng nếu không có việc thở tự nhiên, APRV sẽ không hiệu quả và những lợi thế sinh lý quan trọng sẽ mất đi (Dries và Marini, 2009; Modrykamien và cộng sự, 2011), nhưng những người khác lại cho rằng APRV có thể có tác động đáng kể đến công thở (WOB) và khả năng gây hại với chi phí thở tự nhiên trong quá trình APRV tăng cao đáng kể. (Kallet, 2011; Daoud và cộng sự, 2012; Mireles Cabodevila và Kacmarek, 2016).
Đầu tiên, chúng tôi giải quyết khiếu nại liên quan đến lợi ích của APRV bị mất khi không có thở tự nhiên. Mặc dù việc thở tự nhiên có thể được tạo điều kiện thuận lợi bằng APRV, nhưng chắc chắn đó không phải là điều kiện tiên quyết. Dữ liệu thực nghiệm và lâm sàng cho thấy lợi ích của APRV mà không cần thở tự nhiên (Roy S. et al., 2013; Roy SK. et al., 2013; Emr et al., 2013; Kollisch-Singule et al., 2014a; Kollisch-Singule et al., 2014b; Kollisch - Singule et al., 2016a; Kollisch-Singule et al., 2016b; Jain et al., 2017). Vì APRV với phương pháp TCAV™ có thể ngăn ngừa hoặc dừng tiến triển của VILI và sau đó ổn định phổi, nên phương pháp này có thể được sử dụng thành công ngay cả ở những người hiến tặng chết não, những người rõ ràng không thở tự nhiên (Roy và cộng sự, 2017; Koch và cộng sự, 2019). Trên thực tế, trong một nghiên cứu về những người hiến tặng được quản lý bằng APRV, việc sử dụng phổi xảy ra nhiều hơn ở nhóm APRV (84%) so với nhóm VAC (18%) (p < 0,001) (Hanna và cộng sự, 2011). Ngoài ra, dữ liệu phục hồi cơ quan chứng minh sự gia tăng tổng số cơ quan được phục hồi ở những người hiến tặng khi APRV được sử dụng trong quá trình quản lý người hiến tặng (Roy và cộng sự, 2017; One Legacy. 2022).
Thứ hai, các tuyên bố rằng thở tự nhiên trong APRV là có hại và liên quan đến tăng WOB không có dữ liệu hỗ trợ cũng như xác nhận rằng điều này xảy ra với tần suất cao hơn ở APRV so với bất kỳ chế độ máy thở nào khác (Kallet 2011; Daoud và cộng sự, 2012; Mireles Cabodevila và Kacmarek, 2016; Yoshida và cộng sự, 2017). Bài báo năm 2002 của Neumann và cộng sự (Neumann và cộng sự, 2002) được tham chiếu theo chu kỳ để buộc tội thở tự nhiên với APRV là luôn có hại. Được trích dẫn sai là thử nghiệm lâm sàng trên 35 bệnh nhân (Myers và Macintyre, 2007), trên thực tế đây là một nghiên cứu quan sát với quần thể hỗn hợp gồm 28 bệnh nhân: COPD (25%), tổn thương phổi cấp tính (32%) (ARDS vừa phải theo tiêu chuẩn Berlin) và bệnh lý không đặc hiệu (43%). Trong giao thức Neumann, máy thở Dräger Evita 1 được sử dụng ở chế độ BIPAP, có bộ kích hoạt và kết thúc lưu lượng cố định ở mức 25% và có thể tăng WOB cho bệnh nhân COPD. PHigh được tăng dần cho đến khi bệnh nhân tự ngừng thở và sau đó giảm 25% PHigh chưa biết để kích thích bệnh nhân tự thở, có khả năng gây mất huy động và suy hô hấp. Trên thực tế, các tác giả bày tỏ lo ngại trong bản thảo rằng việc giải phóng áp lực từ PHigh xuống PLow [ngay cả trong thời gian ngắn] có thể gây xẹp phổi. Tuy nhiên, họ tiến hành sử dụng một giao thức làm giảm đột ngột PHigh và kéo dài thời gian ở PLow khi bắt đầu thu thập dữ liệu, có khả năng tạo ra mức độ xẹp phổi và suy hô hấp lớn hơn. Các tác giả cũng chỉ ra rằng: "Do đó, nếu sử dụng thời gian giải phóng rất ngắn như vậy cho những bệnh nhân bệnh nặng, thì phải đảm bảo hỗ trợ thông khí đầy đủ". Ngoài ra, họ tuyên bố: “Điều này có thể đạt được bằng cách tăng PHigh để tăng áp lực đẩy của nhịp thở cơ học hoặc tăng chu kỳ giải phóng” (tức là, buộc bệnh nhân thở tự nhiên khi bắt đầu suy hô hấp rất có thể sẽ phát hiện ra WOB quá mức). Cuối cùng, vì mỗi cài đặt thông khí chỉ được sử dụng trong khoảng 30 phút, nên các tác giả thừa nhận: “Do đó, không thể rút ra kết luận nào về các tác động tiềm ẩn lâu dài (ví dụ, phát triển tình trạng mệt mỏi cơ hô hấp hoặc cải thiện oxygen hóa) của các cài đặt hô hấp được sử dụng trong nghiên cứu hiện tại”.
Bài báo này cũng bị cản trở bởi nhiều vấn đề về phương pháp luận và thống kê như quy mô mẫu nhỏ với độ lệch chuẩn cao và thiếu sức mạnh, đặc biệt là với dữ liệu xuyên phổi [được sử dụng để đánh giá WOB] và nghịch lý Simpson gộp chung một phổ các bệnh lý phổi. Ví dụ, không có khả năng các thông số máy thở tối ưu cho bệnh nhân mắc ALI sẽ giống hệt với thông số của bệnh nhân mắc COPD. Không có tác dụng phụ lớn nào được quan sát thấy với các thiết lập TLow ngắn đối với huyết động học, khả năng thở tự nhiên hoặc trao đổi khí ở bất kỳ nhóm bệnh nhân nào trong ba nhóm. Quan trọng nhất là các tác giả không bao giờ kết luận rằng APRV làm tăng WOB hoặc có hại và kết luận thực tế của nghiên cứu là: "Thông khí giải phóng áp lực đường thở là một hệ thống mở cho phép bệnh nhân duy trì "kiểm soát thời gian" trong chu kỳ hô hấp độc lập với khoảng thời gian đã chọn cho PHigh và PLow."
WOB quá mức rất quan trọng nhưng thường bị đánh giá thấp ở những bệnh nhân trong quá trình thở máy (Yoshida và cộng sự, 2017). Thật không may, khó thở và suy hô hấp là phổ biến và xảy ra ngay cả ở các chế độ thở máy thông thường (Schmidt và cộng sự, 2011, 2014). Khó thở trong quá trình thở máy thường liên quan đến lo lắng, đau đớn cũng như cài đặt máy thở không phù hợp (Schmidt và cộng sự, 2011, 2014; Worsham và cộng sự, 2021) và có liên quan đến tỷ lệ tử vong cao hơn trong quá trình nhập viện của bệnh nhân ngoài 2 năm sau khi xuất viện (Stevens và cộng sự, 2021). Hơn nữa, khó thở sau khi rút nội khí quản có liên quan đến việc tăng nguy cơ suy hô hấp tái phát (Dres và cộng sự, 2021). Bệnh nhân cũng có thể gặp phải tình trạng khó chịu về mặt tinh thần và một dạng hội chứng stress sau chấn thương (post traumatic distress syndrome - PTSD) trong quá trình thở máy (Schmidt và cộng sự, 2014; Worsham và cộng sự, 2021; Schwartzstein và Campbell, 2022). Tuy nhiên, mặc dù có nguy cơ thở tự nhiên gây khó thở và nỗ lực thở quá mức, việc không thở tự nhiên trong quá trình thở máy cũng có hại như nhau. Trên thực tế, cả thở quá mức hoặc loại bỏ thở tự nhiên đều kéo dài thời gian thở máy và ảnh hưởng đến kết quả của bệnh nhân (Goligher và cộng sự, 2018). Khi xem xét thở tự nhiên, điều quan trọng là phải hiểu rằng nó không bao giờ được coi là một sự kiện nhị phân - tức là chỉ được mô tả là có hoặc không - hoặc chỉ phụ thuộc vào từ viết tắt của chế độ máy thở - mà quan trọng hơn là phụ thuộc vào tương tác của máy thở với hệ hô hấp của bệnh nhân.
Quá trình thở tự nhiên tự động bắt nguồn và được kiểm soát ở thân não. Thân não kiểm soát động lực thở và đầu ra của các cơ hô hấp, được điều chỉnh bởi phản hồi dồi dào của các thụ thể hóa học và cơ học phải được thỏa mãn để đạt được nhiều lợi ích và hiệu quả của quá trình thở tự nhiên. Kiểm soát theo thứ bậc các yếu tố như trao đổi khí, thể tích phổi, CRS, mức độ rối loạn chức năng cơ hô hấp và vị trí cơ hoành đều ảnh hưởng đến khả năng thực hiện thở tự nhiên có thể chấp nhận được của bệnh nhân mà không có WOB quá mức. Không có chế độ thở máy nào bao gồm APRV hoặc tình trạng thở máy có thể đảm bảo lời hứa không gây ra WOB quá mức. Thay vào đó, vai trò của bác sĩ lâm sàng là hỗ trợ, lựa chọn và chuẩn bị cho bệnh nhân có khả năng thở tự nhiên vô hại và loại bỏ các biến chứng như VILI và rối loạn chức năng cơ hoành do máy thở (Goligher và cộng sự, 2015; Goligher và cộng sự, 2018; Goligher và cộng sự, 2020). Vì cả tình trạng thở tự nhiên quá mức và không thở tự nhiên hiện được coi là bất lợi cho kết quả của bệnh nhân, điều này đòi hỏi hơn bao giờ hết các phương pháp tiếp cận tối ưu và hiểu biết về hệ hô hấp. Chúng ta không thể tiếp tục tự mãn khi để bệnh nhân trì trệ trên máy thở trong khi chiêm ngưỡng các thông số thở máy, đo độ bão hòa oxy trong máu và khí động mạch.
Tăng nỗ lực hít vào có thể có tác động có hại đến phổi—đây là khái niệm về tổn thương phổi do bệnh nhân tự gây ra (P-SILI) (Brochard và cộng sự, 2017). Vì P-SILI được xác định bởi những thay đổi về áp lực xuyên phổi không phụ thuộc vào chế độ thông khí cụ thể và có thể xảy ra ngay cả khi không có máy thở. Do đó, việc thiết lập APRV và lựa chọn bệnh nhân một cách thích hợp sẽ không khiến bệnh nhân có nguy cơ mắc P-SILI cao hơn. Vì nhu cầu lưu lượng cao và tình trạng đói khí là dạng khó thở tồi tệ nhất nên điều quan trọng là phải hiểu cài đặt máy thở nào có thể làm giảm hoặc làm trầm trọng thêm tình trạng khó chịu. Tình trạng đói khí giảm khi tăng mức PEEP bằng cách tăng EELV (Vovk và Binks, 2007). Ví dụ, việc thở tự nhiên ở mức PEEP thấp có liên quan đến tổn thương phổi và cơ hoành lớn hơn trong khi thở tự nhiên ở mức PEEP cao hơn có tác dụng bảo vệ (Yoshida và cộng sự, 2016; Morias và cộng sự, 2018). Về mặt sinh lý, khi thể tích phổi tăng, các thụ thể cơ học sẽ cung cấp phản hồi cho thân não, làm giảm nỗ lực hít vào và báo hiệu cho các cơ thở ra để thở ra chủ động nếu cần (Road và Leevers, 1988; Road và Leevers, 1990; Torres và cộng sự, 1993). Ngược lại, khi thể tích phổi thấp, quá trình thở ra bị ức chế với động lực hít vào tối đa được kích hoạt (Dempsey 1994). Thể tích phổi và sự co cơ hoành được định vị tối ưu để bắt đầu thở tại FRC. Những thay đổi về thể tích phổi từ FRC làm thay đổi đường cong của cơ hoành và thay đổi khả năng tạo lực (Road và Leevers, 1988; Road và Leevers, 1990). Khi thể tích phổi tăng, độ cong của cơ hoành giảm đi (phẳng đi) sao cho khả năng tạo lực giảm đi (tức là mối quan hệ lực-chiều dài) (Braun và cộng sự, 1982; Road và Leevers, 1988; Road và Leevers, 1990). Điều ngược lại là đúng ở thể tích phổi thấp, khi cả lực tạo ra từ cơ hoành đều là tối đa và được hiệp đồng với lực đẩy hít vào cao ở thân não (Yoshida và cộng sự, 2017). Trên thực tế, một báo cáo trường hợp của Kallet và cộng sự (1999) minh họa điều này ở một bệnh nhân chuyển từ PCV sang VAC LVT cho thử nghiệm ARMA, người đã phát triển phù phổi áp lực âm khởi phát nhanh và giảm CRS và sau đó phục hồi nhanh chóng tình trạng phù phổi khi loại bỏ LVT. Điều này khiến các tác giả nói rằng: “…… đợt cấp của phù phổi cấp trùng với việc thiết lập và loại bỏ chiến lược bảo vệ phổi. Thực tế là phù phổi nhanh chóng xuất hiện và giải quyết khi thiết lập và loại bỏ VT thấp chiến lược thông khí khiến chúng tôi nghi ngờ rằng những nỗ lực hít vào mạnh mẽ là nguyên nhân gây ra tình trạng suy giảm đột ngột về tình trạng tim mạch hô hấp của bệnh nhân.” Những gì các tác giả này ghi lại được hiểu rõ trong sinh lý học của chứng khó thở và sự kiểm soát thể tích phổi của thân não. Nhiều bệnh lý hô hấp như trao đổi khí bị suy yếu, tổn thương phổi và kích hoạt thành ngực và các thụ thể khác có thể làm tăng hoạt động trung khu hô hấp và cảm giác khó thở, kích thích phản xạ các nỗ lực tiếp theo để tăng VT. Bệnh nhân mắc ARDS được áp dụng chiến lược LVT có nhiều khả năng bị đói khí, khó thở và phải thở máy trong thời gian dài, có khả năng làm tăng nguy cơ mắc các triệu chứng PTSD (Schmidt và cộng sự, 2011, 2014; Worsham và cộng sự, 2021; Schwartzstein và Campbell, 2022). Tuy nhiên, chiến lược LVT
phản đối cơ chế sinh lý vốn có để giải quyết chứng khó thở - tăng thể tích phổi (Worsham và cộng sự, 2021). Ngoài ra, thể tích phổi thấp hơn định vị cơ hoành để tạo ra lực và áp lực cao hơn để thỏa mãn động lực hít vào cao. Ngoài ra, thở tự nhiên trong APRV với phương pháp TCAV™ nhắm mục tiêu vào việc bắt đầu thở ở hoặc cao hơn một chút so với FRC. Khi FRC được thiết lập lại, pha CPAP của APRV sẽ giảm nỗ lực hít vào và tình trạng đói không khí miễn là đáp ứng được nhu cầu về thể tích phổi và lưu lượng thích hợp (Gregory và cộng sự, 1971; Gherini và cộng sự, 1979). Nỗ lực hít vào thường là tối thiểu vì kiểu thở điển hình là để bảo vệ thể tích phổi trong khi các cơ thở ra hỗ trợ hít vào (Torres và cộng sự, 1993). Pha CPAP (hay PHigh) cho phép hiệu chỉnh thể tích phổi, cho phép bệnh nhân chuyển đổi giữa thở ra chủ động và nỗ lực hít vào tối thiểu. Kết hợp với hệ thống thở mở, khả năng thở tự nhiên không bị hạn chế của bệnh nhân sẽ bảo tồn thời gian hít vào thần kinh khiến bệnh nhân bớt suy hô hấp hơn. Các tính năng này cải thiện tương tác giữa bệnh nhân và máy thở trong quá trình thiết lập APRV phù hợp và lựa chọn bệnh nhân phù hợp để đáp ứng nhu cầu hô hấp, cho phép kiểm soát quá trình thông khí và tăng sự thoải mái, cho thấy APRV có thể tạo điều kiện cho quá trình thở tự nhiên với mức độ làm việc phù hợp.
Quan niệm sai lầm về thử nghiệm APRV Chúng tôi tin rằng chúng tôi đã cung cấp đủ bằng chứng để làm sáng tỏ 10 huyền thoại được lưu truyền trong tài liệu thông qua các tuyên bố chưa được chứng minh, nhưng vẫn còn những huyền thoại khác chưa được giải quyết trong bài đánh giá này. Tuy nhiên, chúng tôi muốn thảo luận về sự phản đối thường gặp khi sử dụng APRV, đó là sai lệch nhớ lại của các nghiên cứu tiêu cực. Mặc dù cho đến nay chưa có RCT đa trung tâm nào cho thấy APRV vượt trội hơn LVT, nhưng cũng chưa có RCT đa trung tâm nào cho thấy LVT vượt trội hơn APRV. Trên thực tế, các phân tích tổng hợp gần đây cho thấy ước tính điểm có lợi cho APRV - mặc dù tính không đồng nhất là cao (Lim và Litton, 2019; Zhong và cộng sự, 2020).
Ba thử nghiệm thường được nhấn mạnh là thất bại của APRV. Điều quan trọng cần lưu ý là trước thử nghiệm ARMA ARDSNet năm 2000 (ARDSNet 2000), ba nghiên cứu LVT sử dụng nhiều phương pháp khác nhau đã không cho thấy bất kỳ lợi ích nào (Brochard và cộng sự, 1998; Stewart và cộng sự, 1998; Brower và cộng sự, 1999). Sau đó, phải mất đến thử nghiệm ARMA trị giá 41 triệu đô la so sánh hai phương pháp đặt VT trong VAC với phương pháp LVT (6 ml/kg) so với phương pháp (HVT) (12 ml/kg) (ARDSNet 2000) để cho thấy tỷ lệ tử vong giảm. Khi đọc ngoài các 'tiêu đề' trong ba thử nghiệm được cho là tiêu cực với APRV, một đánh giá quan trọng cho thấy những điều sau:
1. Thử nghiệm Hirshberg và cộng sự (2018) đã bị dừng lại vì vô ích nhưng không phải vì chế độ APRV vô ích hoặc gây hại cho bệnh nhân. Mục tiêu của nghiên cứu là điều chỉnh APRV VT
thành ≤ 6 ml/kg tương tự như LVT và đã bị dừng lại vì mục tiêu này không thể đạt được. Có ba nhóm: 1) LVT với VAC nhắm mục tiêu VT 6 ml/kg (n = 17); 2) APRV nhắm mục tiêu VT 6 ml/kg (n = 18); 3) APRV không có mục tiêu VT (n = 17). Cho phép TLow được điều chỉnh thành 50–75% EFT/EFP có thể giải thích VT vượt quá 12 ml/kg. Điều thú vị là ngay cả khi VT vượt quá 12 ml/kg ở cả hai nhóm APRV, không có sự gia tăng về chấn thương do áp lực hoặc tử vong. Ngoài mục tiêu VT không đạt được, không có sự khác biệt đáng kể nào về huyết động học hoặc nhu cầu vận mạch, tỷ lệ chấn thương do áp lực, thuốc an thần hoặc sử dụng NMBA, đặt lại nội khí quản, số ngày không thở máy, tỷ lệ tử vong trong bệnh viện hoặc thời gian nằm viện tại ICU.
2. Thử nghiệm Ibarra-Estrada và cộng sự (2022) được gọi là nghiên cứu APRV đối với bệnh nhân CARDS đã bị dừng lại do tử vong. Sau đây là những sự thật. Sau bốn đợt chấn thương do áp lực, một đánh giá của hội đồng giám sát an toàn dữ liệu đã khuyến nghị ngừng huy động những bệnh nhân mắc COVID-19, mặc dù quyết định này không được nhất trí. Trước khi nghiên cứu bị dừng lại, không có sự khác biệt về tỷ lệ tử vong hoặc sự khác biệt về tỷ lệ chấn thương do áp lực giữa các nhóm, đây là động lực để khuyến nghị dừng thử nghiệm. Shrestha và cộng sự (2022) đã chỉ ra trong một đánh giá có hệ thống và phân tích tổng hợp rằng tỷ lệ chấn thương do áp lực tăng có liên quan đến mức độ nghiêm trọng của bệnh tăng lên ở COVID-19 và không liên quan đến một chế độ cụ thể. Trước đây, chúng tôi đã xem xét chi tiết nghiên cứu Ibarra-Estrada và cộng sự (2022) và tỷ lệ tăng CO2 trong nhóm APRV trong đó RR thấp hơn so với nhóm LVT. Các tác giả thừa nhận các bác sĩ lâm sàng không muốn sử dụng THigh thấp hơn mức thông thường là 4–6 giây được sử dụng ở những bệnh nhân ít bệnh hơn, do đó làm giảm RR đã đặt trong nhóm APRV.
3. Thử nghiệm Ganesan và cộng sự báo cáo rằng APRV có liên quan đến xu hướng tử vong cao hơn so với LVT khi được sử dụng làm chiến lược thông khí chính ở trẻ em mắc ARDS (Ganesan và cộng sự, 2018). Tuy nhiên, những bệnh nhân trong nhóm APRV có nguyên nhân chính gây tổn thương phổi/ARDS có thời gian mắc các bệnh về hô hấp dài hơn và nhiều trường hợp ARDS nghiêm trọng hơn khi ghi danh, cho thấy nhóm bệnh nhân này bệnh nặng hơn. Ngoài ra, có một số lượng lớn các trường hợp bị nhiễm trùng trong nhóm APRV, được định nghĩa là những người cần một chế độ thông khí thay thế nhưng chưa được giải thích đầy đủ. Ngược lại, xu hướng về tỷ lệ chấn thương do áp lực, sử dụng thuốc an thần và giảm đau và tình trạng huyết động không ổn định thấp hơn ở nhóm APRV. Các tác giả chỉ ra rằng thở tự nhiên là điều kiện tiên quyết đối với APRV, điều mà chúng tôi đã xem xét trước đây là không cần thiết. Tuy nhiên, tương tự như nghiên cứu Ibarra -Estrada và cộng sự (2022) THigh được đặt ở mức 4,0 giây, điều này sẽ làm giảm đáng kể RR đã đặt và buộc bệnh nhân phải chịu phần lớn tổng MVe. THigh ở mức 4,0 giây là cực kỳ cao ở bệnh nhân ARDS nhi khoa khi điều này sẽ chuyển thành RR [cao nhất] là 14 nhịp/phút vì TLow trên máy thở được sử dụng (Hamilton Galileo) không thể được đặt < 0,2 giây. THigh ở mức 4,0 giây không chỉ tạo ra Giai đoạn CPAP kéo dài, trong đó bệnh nhân chịu phần lớn tổng MVe và tải trọng chuyển hóa mà còn không đặt TLow để đạt EFT/EFP là 75%, tình trạng mất ổn định phế nang và RACE không bao giờ dừng lại để có thể bắt đầu huy động. Cuối cùng, nếu không đạt được Pplat đáng tin cậy trong nghiên cứu này, thì PHigh ban đầu được đặt ở mức 15 cmH2O và được điều chỉnh tăng dần lên đến PHigh là 28 cmH2O để đạt được tỷ lệ P/F tương quan. Tuy nhiên, nếu VT vượt quá 6–7 ml/kg trọng lượng cơ thể lý tưởng (IBW), PHigh giảm xuống, điều này có thể dẫn đến mất huy động thêm, mất diện tích bề mặt và sau đó làm trầm trọng thêm tình trạng tăng CO2 và WOB quá mức. Tóm lại, tình trạng mất ổn định phế nang có thể không bao giờ dừng lại dẫn đến tỷ lệ P/F tệ hơn và xu hướng gia tăng tỷ lệ tử vong sau đó ở nhóm APRV có thể là kết quả của các thiết lập mà THigh rất có thể quá cao đối với bệnh nhân ARDS nhi khoa, TLow có thể không được thiết lập để đạt 75% nếu cần < 0,2 giây và PHigh giảm nếu VT vượt quá 6–7 ml/kg IBW. Những vấn đề phân tích thống kê này và các vấn đề bổ sung đã được các tác giả khác giải quyết (Daxon 2018).
12 Tóm tắt
Khoa học phải dựa trên bằng chứng. Các phản ứng tiêu cực và đôi khi là phản ứng Pavlovian liên quan đến APRV được công bố mà không có dữ liệu hỗ trợ. Một số tác giả thậm chí còn tuyên bố "APRV là một chế độ nguy hiểm" (Kallet và cộng sự, Respir. Care, 2011, 56(2), 190–203), "không có lý do gì để xem xét cách tiếp cận này để hỗ trợ máy thở" và "APRV là con đẻ của quỷ dữ" (Mireles Cabodevila và Kacmarek, 2016) mà không có bất kỳ khoa học nào xác thực những tuyên bố này. Trên thực tế, một số phản đối nhiệt tình nhất đối với APRV đã được tiếp nối bằng việc thừa nhận rằng có rất ít hoặc không có kinh nghiệm lâm sàng khi sử dụng chế độ này (Mireles Cabodevila và Kacmarek, 2016). Sẽ là "phản khoa học" nếu bỏ qua hoặc lên án dữ liệu mới vì chúng không phù hợp với ý tưởng trước đây của một người. Cách tiếp cận phù hợp sẽ là xem xét và cân nhắc kỹ lưỡng tất cả thông tin khoa học và lâm sàng để hiểu toàn bộ và trở thành một nhà phê bình hữu ích.
Mục tiêu của bài đánh giá này là làm nổi bật những huyền thoại và quan niệm sai lầm được công bố nhiều nhất và đánh giá xem bất kỳ tuyên bố nào trong số này có được hỗ trợ về mặt khoa học hay không. Những gì chúng tôi tìm thấy là những tuyên bố lặp đi lặp lại thiếu sự hỗ trợ và nhiều tuyên bố là ngụy biện logic được tái chế. Mặc dù APRV còn lâu mới được nghiên cứu đầy đủ về mặt khoa học, nhưng phương pháp TCAV™ làm nổi bật các khái niệm phi truyền thống về quản lý phổi, đảm bảo việc khám phá sâu hơn để mở rộng kiến thức của chúng ta về phổi nói chung và tương tác giữa phổi và máy thở. Chúng tôi tin rằng chúng tôi đã chứng minh được APRV không phải là một chế độ quá phức tạp, quá khó hiểu, có thể phân biệt được với IR-PCV, bản thân nó không tạo ra chấn thương do áp lực hoặc chấn thương do thể tích và bản thân nó tạo ra VT cao, không gây tăng căng thẳng RV hoặc PEEP tự động không an toàn, không gây xẹp phế nang nếu PLow được đặt thành 0 cmH2O, có thể kiểm soát PaCO2 và đặt RR đủ, có thể đạt được ∆P và có thể sử dụng cho dù bệnh nhân có tự thở hay không. Khoa học luôn được hưởng lợi từ những ý tưởng cạnh tranh, tranh luận và sự tinh chỉnh liên tục khái niệm của chúng ta, tất cả đều được các nhà phê bình hiểu biết đưa ra. Thật không may, thông tin sai lệch là kẻ thù của khoa học.
Như Albert Einstein đã nói: “Điều quan trọng là không bao giờ ngừng đặt câu hỏi”.

