Nguy cơ tổn thương phổi gây ra do dùng máy thở ở những bệnh nhân nhi

Angurana, Suresh Kumar; Sudeep, K. C.; Prasad, Shankar J Pediatr Crit Care 2023;10:107-14. | DOI: 10.4103/jpcc.jpcc_27_23
Bản dịch của BS. Đặng Thanh Tuấn – BV Nhi đồng 1
Xem đầy đủ bản PDF tại đây
1 Tóm tắt
Thông khí cơ học là một trong những biện pháp can thiệp cứu sống phổ biến được sử dụng trong việc chăm sóc trẻ bị bệnh nặng nhập viện Khoa Chăm sóc đặc biệt (ICU) dành cho trẻ em. Tuy nhiên, nó có thể gây viêm phổi, có thể gây ra hoặc làm nặng thêm tổn thương phổi. Tổn thương phổi do máy thở (VILI) được định nghĩa là tổn thương phổi cấp tính do máy thở gây ra hoặc trầm trọng hơn. Khi có bệnh phổi từ trước (viêm phổi và hội chứng nguy kịch hô hấp cấp tính), hệ thống miễn dịch phản ứng quá mức có thể dẫn đến tổn thương phổi nhiều tầng do thở máy. Các cơ chế có thể được đưa ra là thể tích khí lưu thông
quá cao (chấn thương thể tích), áp lực quá mức (chấn thương khí áp), việc mở và đóng lặp đi lặp lại các phế nang (chấn thương do xẹp phổi), viêm (chấn thương sinh học), nhiễm độc oxy, tương tác bất lợi giữa tim và phổi, chấn thương liên quan đến xẹp xuống, tổn thương liên quan đến nỗ lực và sự biến đổi di truyền trong biểu hiện của các chất trung gian gây viêm. Phòng ngừa là chiến lược quan trọng nhất đối với VILI bằng cách sử dụng các chiến lược thở máy bảo vệ phổi để ngăn ngừa chấn thương thể tích, chấn thương khí áp và chấn thương do xẹp phổi. Thông khí thể tích khí lưu thông thấp, áp lực dương cuối thì thở ra và FiO2 tối ưu, hạn chế áp lực bình nguyên, thuốc chẹn thần kinh cơ và tư thế nằm sấp là một số chiến lược quan trọng để phòng ngừa và điều trị VILI. VILI có khả năng gây ra bệnh tật, tử vong đáng kể và di chứng phổi lâu dài. Sự liên quan về mặt lâm sàng của VILI chưa được hiểu rõ ở trẻ em bị bệnh nặng do thiếu tài liệu về nhi khoa và hầu hết thông tin đều được lấy từ tài liệu dành cho người lớn. Trong bài đánh giá này, chúng tôi sẽ làm sáng tỏ dịch tễ học, nguyên nhân gây bệnh, đánh giá lâm sàng, quản lý và các biện pháp làm giảm hoặc ngăn ngừa VILI.
2 Giới thiệu
Khái niệm tổn thương phổi thứ phát sau thở máy là một khái niệm lâu đời và được quan tâm trở lại trong những năm gần đây. Năm 1744, John Fothergill lưu ý rằng thông khí miệng-miệng có thể là một lựa chọn
tốt hơn ống máy thổi do luồng không khí phụt ra không kiểm soát được có thể làm hỏng phổi. Trong trận dịch bại liệt năm 1952, người ta đã ghi nhận rằng thở máy có thể gây tổn thương cấu trúc cho phổi. Sau đó vào năm 1967, người ta đã chứng minh rằng ở những bệnh nhân được thở máy, bệnh lý phổi sau khi chết cho thấy thâm nhiễm phế nang lan rộng và màng hyaline được gọi là “phổi máy thở”.[1] Webb và Tierney vào năm 1974 đã công bố nghiên cứu in vivo đầu tiên của họ về tổn thương phổi do máy thở (ventilator-induced lung injury, VILI) ở những con chuột khỏe mạnh được thở máy với áp lực đường thở đỉnh là 45 cmH2O và áp lực dương cuối thì thở ra (positive end-expiratory pressure, PEEP) bằng 0, chúng chết vì phù phổi xuất huyết nặng trong vòng 20 - 30 phút. Tuy nhiên, việc thêm PEEP ở mức 10 cmH2O vào cùng áp lực đường thở đỉnh sẽ gây ra tổn thương phổi ở mức tối thiểu hoặc không gây ra tổn thương nào.[2] Người ta cho rằng sự phụ thuộc lẫn nhau giữa các mạch máu (áp suất thủy tĩnh cao) là nguyên nhân gây ra phù phổi.[2] Trong thời gian gần đây, thử nghiệm Mạng lưới Hội chứng suy hô hấp cấp tính (thử nghiệm ARDSNet) không chỉ cung cấp bằng chứng xác nhận rằng VILI xảy ra khi thở máy mà còn chứng minh rằng thể tích khí lưu thông thấp vượt trội hơn so với thông khí thể tích khí lưu thông cao ở người lớn mắc ARDS.[3] nặng còn hạn chế và chủ yếu được ngoại suy từ dữ liệu thực nghiệm hoặc dữ liệu của người lớn.[6] Không giống như người lớn, phổi của trẻ em dễ bị VILI cơ học ngay cả khi không có tổn thương phổi từ trước. Plötz và cộng sự đã chứng minh rằng ở trẻ sơ sinh không có chấn thương phổi từ trước, thở máy tự chọn trong 2 giờ với thể tích khí lưu thông 10 mL/kg dẫn đến phản ứng tiền viêm.
3 Định nghĩa
VILI được định nghĩa là tổn thương phổi cấp tính (acute lung injury, ALI) gây ra hoặc trầm trọng hơn do thở máy. Thông khí cơ học ở trẻ em có hoặc không có ARDS cần phải được điều chỉnh cẩn thận, vì biện pháp can thiệp cứu sống này có thể gây ra tình trạng viêm phổi, có thể gây ra hoặc làm nặng thêm tổn thương phổi và góp phần đáng kể vào tỷ lệ mắc bệnh và tử vong.[4, 5, 6] Nó có thể xảy ra cả trong quá trình thở máy xâm lấn hoặc không xâm lấn và ở phổi bình thường hoặc phổi bị bệnh. Tuy nhiên, VILI thường xảy ra nhất ở những bệnh nhân có tổn thương sinh lý tiềm ẩn ở phổi như viêm phổi, ARDS, nhiễm trùng huyết, phẫu thuật lớn hoặc chấn thương. Trong những tình huống này, có những stress ở cấp độ vi mô cao hơn và hệ thống miễn dịch đã sẵn sàng cho phản ứng dòng thác với ALI do thở máy.[4, 5, 6]
4 Dịch tễ học
Dữ liệu liên quan đến tỷ lệ mắc VILI và kiến thức về mức độ liên quan lâm sàng của VILI ở trẻ em bị bệnh. Không giống như người lớn, phổi của trẻ em dễ bị VILI cơ học ngay cả khi không có tổn thương phổi từ trước. Plötz và cộng sự đã chứng minh rằng ở trẻ sơ sinh không có chấn thương phổi từ trước, thở máy tự chọn trong 2 giờ với thể tích khí lưu thông 10 mL/kg dẫn đến phản ứng tiền viêm.
5 Căn bệnh nguyên lý
Cơ chế bệnh sinh của VILI là đa yếu tố và bao gồm sự tương tác phức tạp giữa các yếu tố liên quan đến máy thở và bệnh nhân. Các cơ chế chính dẫn đến VILI bao gồm căng quá mức phế nang (chấn thương thể tích), áp lực quá mức (chấn thương khí áp), chấn thương do xẹp phổi, viêm (chấn thương sinh học) và stress oxy hóa.[4,5,7,10,11] Các yếu tố liên quan đến bệnh nhân bao gồm phổi chưa trưởng thành và chất hoạt động bề mặt thiếu hụt ở trẻ sơ sinh non tháng, bệnh phổi không đối xứng/không đồng nhất, viêm phổi, biến thể di truyền trong biểu hiện của các chất trung gian gây viêm và nỗ lực hô hấp quá mức [10,12] [Hình 1]. Mặc dù thiếu sự đồng thuận về việc liệu chấn thương thể tích hay chấn thương khí áp là yếu tố quyết định quan trọng hơn đến tổn thương phổi, cả hai đều có liên quan với nhau và mức độ căng phồng quá mức của phổi quyết định tổn thương phổi.[12]
Chấn thương thể tích (volutrauma) Thể tích khí lưu thông cao và độ giãn quá mức dẫn đến chấn thương thể tích. Sự căng phồng phế nang và hậu quả là tổn thương làm tăng tính thấm của phế nang và mao mạch, phù phế nang và mô kẽ, xuất huyết phế nang, hình thành màng hyaline, giảm chất hoạt động bề mặt và xẹp phế nang. Hơn nữa, chấn thương thể tích dẫn đến giải phóng các cytokine, Protease, chemokine, kích hoạt bạch cầu trung tính và đại thực bào dẫn đến viêm và tổn thương phổi.[5, 12,13] Tác dụng có lợi của thông khí thể tích khí lưu thông thấp trong việc cải thiện tỷ lệ tử vong ở người lớn đã được chứng minh trong thử nghiệm ARDSNet mang tính bước ngoặt.[3,14] Thể tích khí lưu thông cao hơn được tạo ra do nỗ lực hô hấp tự phát cao hơn của bệnh nhân cũng đã được chứng minh là dẫn đến tổn thương phổi được gọi là “chấn thương phổi do bệnh nhân tự gây ra” (patient self‐inflicted lung injury, P-SILI).[5, 10]
5.1 Chấn thương khí áp (barotrauma)
Tổn thương phổi do cơ học liên quan đến áp lực đường thở hoặc phế nang cao được gọi là chấn thương khí áp. Phổi không đồng nhất và căng quá mức vùng trong ARDS là những yếu tố chính gây ra VILI. Áp suất rất cao có thể dẫn đến hội chứng rò rỉ khí (tràn khí trung thất và tràn khí màng phổi). Hạn chế áp lực bơm phồng lên (tức là áp lực bình nguyên <28–30cm H2O) để ngăn ngừa tình trạng căng phổi quá mức là một phần của chiến lược thông khí bảo vệ phổi (lung protective ventilation, LPV) ở bệnh nhân mắc ARDS. Chuẩn độ áp lực xuyên phổi (transpulmonary pressure, TPP) (áp lực phế nang - áp lực màng phổi) giúp đạt được thể tích khí lưu thông mong muốn bằng cách giữ áp lực đường thở trong giới hạn an toàn. Tại giường, áp lực bình nguyên có thể được sử dụng làm biện pháp thay thế cho TPP trong trường hợp không có giám sát TPP thực tế.
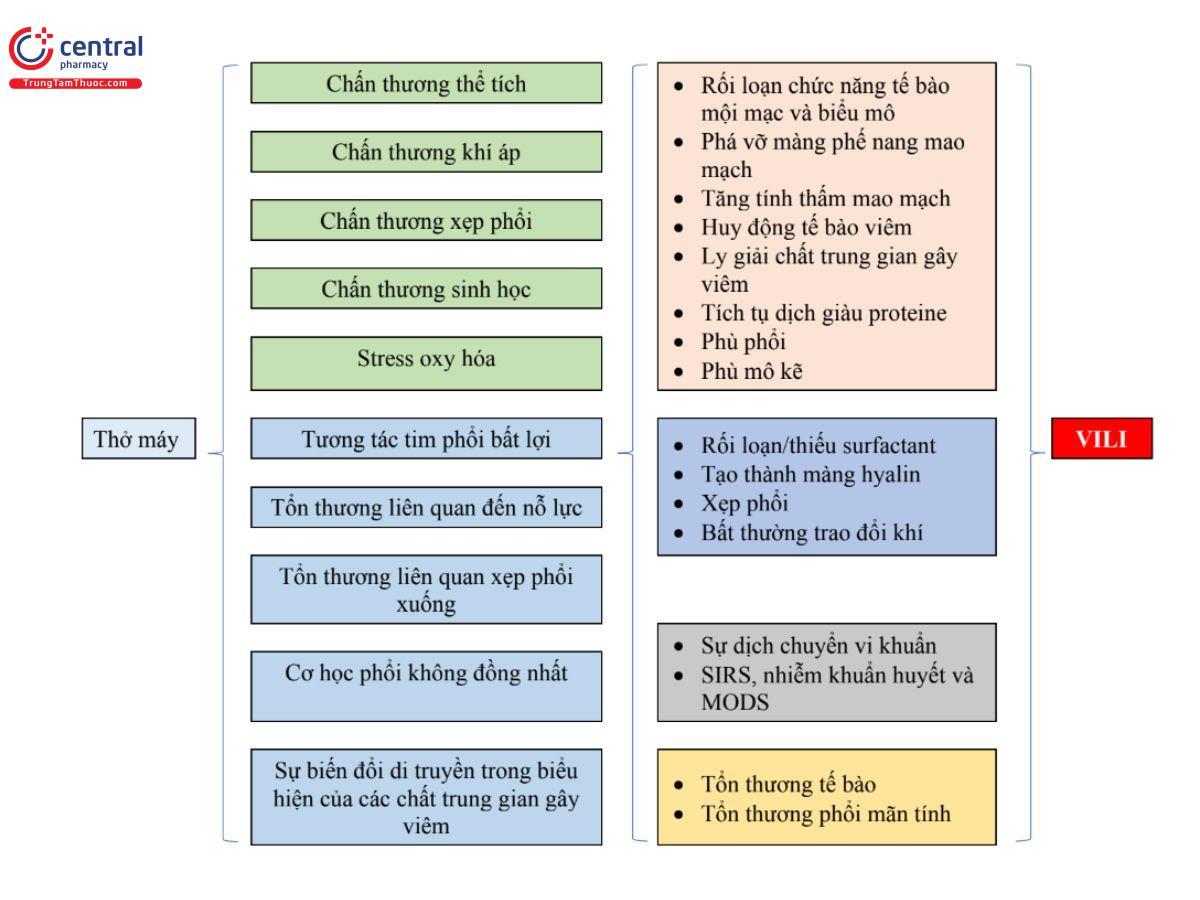
Chấn thương do xẹp phổi (atelectotrauma) Nó xảy ra do cắt (shear) và ứng suất (stress) thứ phát do sự đóng mở lặp đi lặp lại theo chu kỳ của các phế nang bị xẹp trong chu kỳ hô hấp. Điều này cũng làm tổn thương các phế nang và đường thở không được chọn lọc lân cận.[5,15]
PEEP rất thấp dẫn đến thể tích cặn thấp, dung tích cặn chức năng (functional residual capacity, FRC) thấp và xẹp phế nang. Ngoài ra, PEEP rất cao gây ra tình trạng căng quá mức của phế nang. Xẹp phổi gây ra chấn thương thể tích khu vực khi thể tích khí lưu thông được cung cấp đi vào con đường có ít lực cản nhất và căng ra và làm tổn thương phổi được thông khí tương đối tốt hơn là phổi bị xẹp phổi. Điều này là do phổi được thông khí có áp suất mở tới hạn thấp hơn so với phổi bị xẹp. Áp dụng PEEP tối ưu ngăn chặn việc đóng và mở các phế nang bị xẹp theo chu kỳ và là một chiến lược quan trọng để ngăn ngừa VILI do chấn thương do xẹp phổi.[5,15]
Chấn thương sinh học (biotrauma) Chấn thương sinh học là do giải phóng các chất trung gian gây viêm (cytokine và chemokine) cục bộ từ phổi bị tổn thương hoặc một cách có hệ thống để đáp ứng với chấn thương thể tích, chấn thương khí áp, chấn thương do xẹp phổi, ngộ độc oxy và nhiễm trùng huyết, làm trầm trọng thêm vết thương ban đầu. Các đại thực bào phế nang và tế bào biểu mô, bạch cầu trung tính và đại thực bào tiết ra một số chất trung gian gây viêm (yếu tố hoại tử khối u-alpha, interleukin [IL]-6, IL-8, yếu tố hạt nhân phiên mã kappa B [NK-κβ] và ma trận metallicoproteinase-9) dẫn đến tổn thương phổi cục bộ, tổn thương cơ quan ở xa và hội chứng rối loạn chức năng đa cơ quan (multiple organ dysfunction syndrome, MODS).[4]
Căng thẳng oxy hóa (oxidative stress) Oxy thường được sử dụng ở trẻ bị suy hô hấp do thiếu oxy. Tuy nhiên, lượng oxy dư thừa (tăng oxy máu) dẫn đến tổn thương phổi, đặc biệt ở trẻ sơ sinh non
tháng do cơ chế chống oxy hóa kém phát triển. Căng thẳng oxy hóa được gây ra bởi việc tạo ra các loại oxy phản ứng (ROS) oxy hóa lipid màng tế bào, protein, axit nucleic và enzyme, gây chết tế bào và tổn thương mô.[4,5,12,16]
5.2 Tương tác bất lợi tim-phổi
Nó góp phần vào VILI, đặc biệt là trong việc cài đặt thể tích khí lưu thông cao và PEEP thấp. Trong thì hít vào (nhịp thở cơ học), lưu lượng máu đến phổi giảm do phổi giãn nở chèn ép tâm thất phải và ngược lại khi thở ra. Chu kỳ lưu lượng thấp-lưu lượng cao lưu lượng thấp trong tuần hoàn phổi làm tổn thương nội mô mao mạch phổi (suy giảm áp lực mao mạch) dẫn đến tăng tính thấm mao mạch, rò rỉ nước và protein và phù phổi.[17] Theo thời gian, suy tâm thất phải xảy ra và sự giãn nở của nó đẩy vách liên thất về phía tâm thất trái dẫn đến tăng áp lực cuối tâm trương thất trái, làm nặng thêm tình trạng phù phổi.[10,17]
Chấn thương xẹp phổi (lung deflation injury) Mất PEEP đột ngột do ngắt kết nối máy thở đột ngột (để hút, rút ống hoặc dừng thông khí không xâm lấn [noninvasive ventilation, NIV] đột ngột) gây ra tổn thương xẹp phổi. Trong quá trình bơm phồng kéo dài, cung lượng tim giảm thường được bù đắp bằng tăng sức cản mạch máu hệ thống (systemic vascular resistance, SVR) để duy trì huyết áp. Trong quá trình xẹp phổi xuống đột ngột, cung lượng tim tăng lên, nhưng tim phải đối mặt với hậu tải đáng kể do SVR tăng, dẫn đến tăng áp lực cuối tâm trương thất trái và dẫn đến phù phổi. Hơn nữa, lưu lượng máu phổi cao khi xẹp phổi xuống đột ngột gây ra sự gia tăng đột ngột áp lực mao mạch gây tổn thương mao mạch.[18] Những yếu tố huyết động thay đổi này khi xẹp phổi xuống đột ngột dẫn đến tăng lượng nước trong phổi, suy giảm sức căng mao mạch, rò rỉ vi mạch, viêm, độ giãn nở của phổi kém, xẹp phổi và oxygen hóa kém dẫn đến VILI.
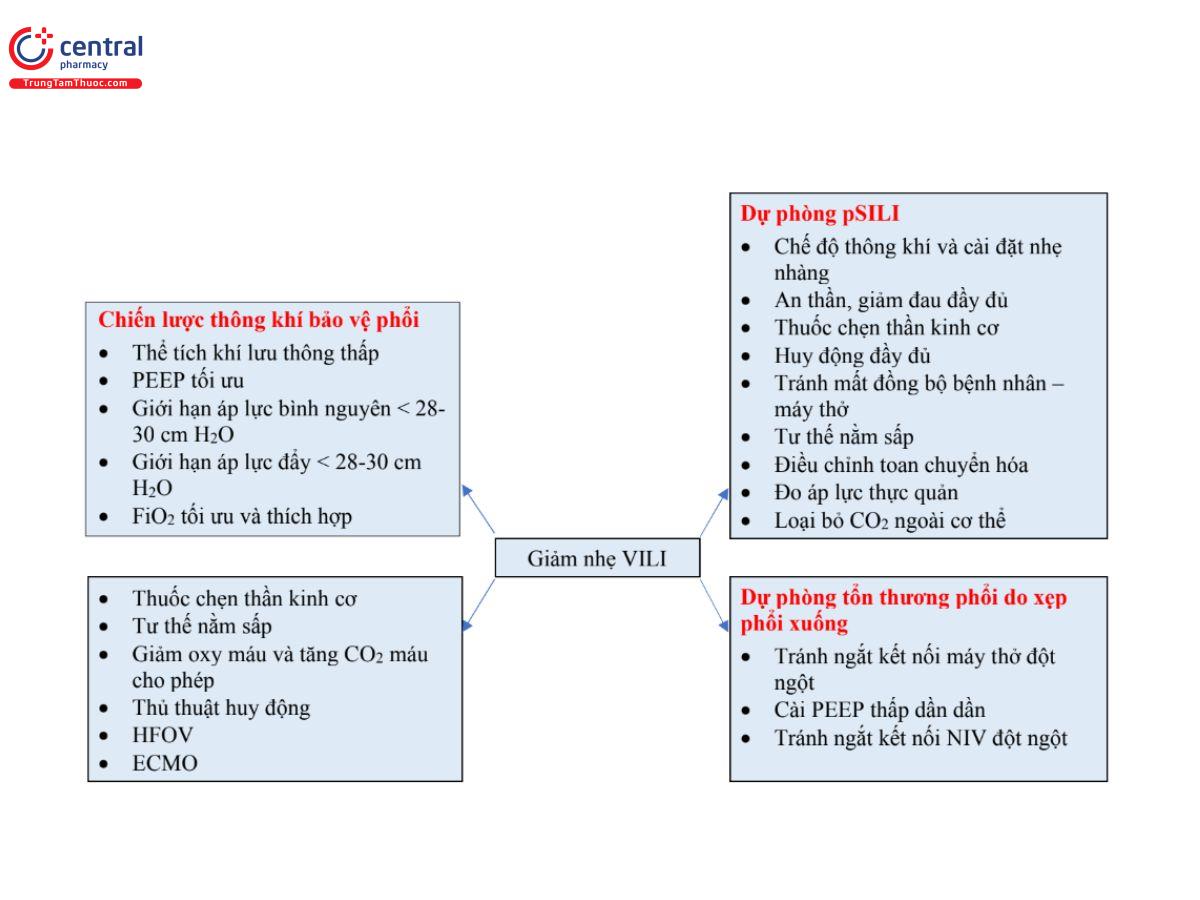
Những tác động này có thể được giảm thiểu bằng cách tránh hút mở, ngắt kết nối ngẫu nhiên khỏi máy thở và rút ống nội khí quản ngoài kế hoạch; giảm dần PEEP ở bệnh nhân ARDS; và tránh bị ngắt kết nối đột ngột khỏi NIV.[4,10,18,17]
5.3 Chấn thương phổi do nỗ lực (effort‑induced lung injury)
Dùng thuốc liệt thần kinh cơ sớm ở bệnh nhân thở máy mắc ARDS đã được chứng minh là cải thiện chức năng phổi và tỷ lệ tử vong.[19] Người ta đã chứng minh rằng NIV ở những bệnh nhân mắc ARDS nặng có kết quả xấu hơn so với thở máy xâm lấn.[20] Ở trẻ em mắc ARDS, thông khí giải phóng áp lực đường thở, thúc đẩy tự phát thông khí, có liên quan đến việc tăng tỷ lệ tử vong.[21] Kết quả của những nghiên cứu này cho thấy rằng thở tự nhiên khi thở máy là có hại, đặc biệt là khi có bệnh lý phổi tiềm ẩn. Khái niệm này đã được gắn nhãn là P-SILI.
Các định đề về P-SILI bao gồm tăng áp lực âm trong màng phổi (trong những nỗ lực tự phát) dẫn đến TPP cao hơn và thể tích khí lưu thông (tidal volume, TV) cao hơn, cơ chế , pendelluft dẫn đến huy động theo chu kỳ thở của các phế nang đã bị tổn thương và tăng áp lực xuyên mạch dẫn đến phổi phù nề và sự không đồng bộ giữa bệnh nhân-máy thở làm tổn thương phổi trở nên trầm trọng hơn.[4,10]
Đồng thời, tác dụng có lợi của việc thở tự nhiên (không quá mức) bao gồm duy trì trương lực và chức năng cơ hoành (hữu ích trong quá trình cai máy), tăng tiền tải thất phải và giảm hậu tải thất phải (cải thiện tưới máu phổi). Vì vậy, điều quan trọng là duy trì sự cân bằng giữa những nỗ lực tự phát đầy đủ và quá mức ở đầu giường. Lựa chọn chế độ và cài đặt thông khí thích hợp, giảm đau an thần phù hợp, thuốc chẹn thần kinh cơ, huy động đầy đủ (làm phẳng cơ hoành và giảm mức độ nỗ lực), giảm thiểu sự không đồng bộ giữa bệnh nhân và máy thở, tư thế nằm sấp, điều chỉnh nhiễm toan, đo áp lực thực quản và loại bỏ CO2 ngoài cơ thể là những bước quan trọng nhằm tạo điều kiện cho sự cân bằng.
Cong suất cơ học (mechanical power), ứng suất (stress) và sức căng (strain)
Công suất cơ học được định nghĩa là lượng năng lượng được truyền từ máy thở đến phổi trên một đơn vị thời gian (joules mỗi phút). Nguy cơ VILI tỷ lệ thuận với lượng và thời gian năng lượng được cung cấp cho phổi, do đó phụ thuộc vào các thông số thông khí đã cài đặt (thể tích khí lưu thông, nhịp thở và PEEP). [22‑24] Nguy cơ mắc VILI tỷ lệ thuận với kích thước phổi và mức độ nghiêm trọng của bệnh phổi. Phổi có diện tích bề mặt lớn và tính chất cơ học đồng đều sẽ ít truyền năng lượng hơn. Mặt khác, nguy cơ VILI sẽ cao hơn đáng kể (đối với cùng một công suất cơ học được cung cấp) ở những phổi nhỏ và không đồng nhất với các đặc tính cơ học khác nhau. [24] Gattinoni và cộng sự [23] đề xuất rằng công suất cơ học có thể được sử dụng như một biến số duy nhất cho nguyên nhân gây tổn thương phổi liên quan đến máy thở. Nó có thể được tính toán và phân tích ngay tại giường từ thể tích khí lưu thông/áp lực đẩy, lưu lượng, PEEP và nhịp thở bằng cách sử dụng phần mềm đặc biệt.
Ứng suất của phổi được định nghĩa là lực trên một đơn vị diện tích (được biểu thị bằng cùng đơn vị với áp suất) và sức căng của phổi được định nghĩa là sự thay đổi thể tích phổi do ứng suất của phổi gây ra. Ứng suất và sức căng của phổi là những yếu tố trung
gian quan trọng của VILI trong phổi không đồng nhất vì ứng suất và sức căng tập trung ở các vùng giữa các đơn vị phổi xẹp và các đơn vị phổi thông khí. Thể tích khí lưu thông được áp dụng ưu tiên đi vào và làm căng quá mức phổi bình thường lân cận, vốn bị hạn chế bởi phổi xẹp phổi không thể giãn nở được. Ứng suất tập trung ở những vùng này có thể lớn hơn hai lần so với TPP áp dụng cho toàn bộ phổi. Ngoài ra, nguy cơ mắc VILI còn phụ thuộc vào sức căng của phổi là động hay tĩnh. Sức căng động được gây ra bởi sự thay đổi thể tích phổi qua trung gian thể tích khí lưu thông và sức căng tĩnh được gây ra bởi sự thay đổi thể tích qua trung gian PEEP. Sức căng động có hại cho phổi hơn sức căng tĩnh.[25,26]
6 Hậu quả của tổn thương phổi do máy thở gây ra
Được đặc trưng bởi tình trạng viêm phổi và tổn thương phế nang lan tỏa. Bệnh lý cho thấy sự gián đoạn của quá trình phế nang hóa và tạo mạch, kích hoạt nội mô, rối loạn chức năng nội mô và biểu mô, phá vỡ màng mao mạch phế nang, tăng tính thấm mao mạch, thu hút các tế bào viêm, giải phóng các chất trung gian gây viêm và tích tụ chất lỏng giàu protein trong phổi (phù phổi). Những thay đổi này làm tăng khoảng cách giữa các tế bào biểu mô phế nang và tế bào nội mô mao mạch, rối loạn chức năng và thiếu hụt chất hoạt động bề mặt, hình thành màng hyaline và xẹp phổi dẫn đến bất thường trong trao đổi khí. Các chất trung gian gây viêm và hệ vi khuẩn ở phổi chuyển sang tuần hoàn hệ thống dẫn đến hội chứng đáp ứng viêm toàn thân, nhiễm trùng huyết và MODS. Tổn thương phổi dai dẳng dẫn đến khả năng phục hồi phổi dưới mức tối ưu và tổn thương phổi mãn tính [4,5,10] [Hình 1].
7 Đánh giá lâm sàng
Chẩn đoán VILI chủ yếu dựa vào lâm sàng. Biểu hiện điển hình bao gồm một bệnh nhân đang thở máy bị tình trạng thiếu oxy ngày càng trầm trọng. Nó đòi hỏi mức độ nghi ngờ cao, bệnh sử và khám thực thể chi tiết, xem xét tình trạng oxygen hóa và thông khí, các thông số máy thở, chụp X quang ngực, xét nghiệm và loại trừ các trường hợp giống hệt tình trạng thiếu oxy ở bệnh nhân thở máy. Đánh giá lâm sàng bao gồm tìm hiểu tiền sử sốt khởi phát gần đây, lượng dịch truyền vào hoặc cân bằng dịch, truyền máu và dị ứng thuốc. Kiểm tra các ran phổi hoặc co thắt phế quản mới khởi phát, bằng chứng tràn khí màng phổi, tràn dịch màng phổi, phù chân tay, cổ trướng và tăng áp lực trong ổ bụng.
Các xét nghiệm trong phòng thí nghiệm bao gồm các dấu hiệu viêm (tổng số lượng bạch cầu và tỷ lệ bạch cầu, số lượng tiểu cầu, protein phản ứng C và procalcitonin) và cấy vi khuẩn (máu và dịch rửa phế quản phế nang). Enzym tim, nồng độ Lipase, nội soi phế quản sợi quang, Doppler chi dưới và chụp động mạch phổi có thể cần thiết trong một số trường hợp.[4] Chụp X quang ngực trong VILI có thể giống như ARDS và các phát hiện thường gặp bao gồm thâm nhiễm phế nang/mô kẽ lan tỏa mà không có tim to. Chụp cắt lớp vi tính ngực là không bắt buộc hoặc có thể thực hiện được trong mọi trường hợp, nhưng nó có thể cho thấy các vùng đông đặc và xẹp phổi không đồng nhất hai bên với các vùng tăng sáng khu trú gợi ý đến sự căng quá mức của phế nang.[4]
8 Chẩn đoán phân biệt
Chẩn đoán phân biệt phổ biến của VILI bao gồm nhiễm trùng phổi mới khởi phát, phù phổi do tim, hít sặc, hội chứng rò rỉ khí (tràn khí màng phổi), tràn dịch màng phổi, auto-PEEP, đặt nội khí quản, chướng bụng, tổn thương phổi liên quan đến truyền máu, bỏng và tổn thương do đường hô hấp, viêm tụy nặng, phẫu thuật bắc cầu tim phổi và các ca phẫu thuật lớn; và tình huống đặc biệt ở người lớn bao gồm hội chứng mạch vành cấp tính và tắc mạch (mỡ, nước ối, không khí).[4]
9 Xử trí
Phòng ngừa là chiến lược quan trọng nhất của VILI. Việc sử dụng NIV trong các trường hợp được lựa chọn phù hợp; lựa chọn cài đặt thông khí thích hợp nhất để ngăn ngừa sự căng quá mức của phế nang và dẫn đến chấn thương thể tích, chấn thương khí áp và chấn thương do xẹp phổi; và sớm cai thở máy là những chiến lược phòng ngừa quan trọng. Để phòng ngừa P-SILI, thuốc an thần đầy đủ, thuốc phong tỏa thần kinh cơ, huy động đầy đủ, điều trị nhiễm toan, tư thế nằm sấp và tránh kích hoạt kép là những biện pháp quan trọng [17] [Hình 2].
Khái niệm “phổi trẻ em” trong ARDS đại diện cho các vùng nhỏ của phổi được thông khí tương đối được bảo tồn (chỉ bằng kích thước phổi của trẻ em). Phần phổi này cần được bảo vệ khỏi tổn thương khi thở máy. Trong ARDS, phần lớn phổi bị xẹp và không được thông khí. Việc cung cấp thể tích khí lưu thông lớn sẽ làm “phổi trẻ em” bị căng phồng quá mức, gây tổn thương cho bộ phận này. Thể tích khí lưu thông lý tưởng là thể tích cần thiết để thông khí cho “phổi trẻ em”. Tuy nhiên, “phổi trẻ em” không phải là một cấu trúc giải phẫu cố định vì có sự phân bổ lại các đơn vị phổi bị xẹp trong quá trình bệnh tiến triển/cải thiện và định vị.[4,5]
10 Chiến lược thông khí bảo vệ phổi
Chiến lược LPV đã được đưa ra với trọng tâm là cung cấp thể tích khí lưu thông nhỏ (để tránh chấn thương thể tích) và PEEP tối ưu (để ngăn ngừa xẹp phế nang). Tối ưu hóa việc huy động phổi, giữ cho phổi luôn thông thoáng và đảm bảo rằng phổi nhận được sự phân bổ đồng đều thể tích khí lưu thông được cung cấp (khái niệm phổi mở) là những nguyên tắc cơ bản của chiến lược LPV. Người ta đã chứng minh rằng ở người lớn mắc ARDS, VILI có thể được giả m thiểu bằng cách sử dụng chiến lược LPV. Thử nghiệm ARDSNet cho thấy chiến lược thể tích khí lưu thông thấp (6 mL/kg trọng lượng cơ thể dự đoán và áp lực bình nguyên < 30 cmH2O) dẫn đến tỷ lệ tử vong thấp hơn hơn thể tích khí lưu thông cao hơn (12 mL/kg trọng lượng cơ thể dự đoán và áp lực bình nguyên <50 cmH2O).[3] Ngay cả ở những bệnh nhân không mắc ARDS, thể tích khí lưu thông thấp (6–8 mL/kg trọng lượng cơ thể dự đoán) có liên quan đến khả năng sống sót được cải thiện.[27] Những phát hiện của thử nghiệm ARDSNet là sự chuyển dịch lâm sàng quan trọng của các khái niệm trên. PEEP là một thành phần quan trọng của thông khí ARDS. Nó dẫn đến việc huy động phế nang, bảo vệ khỏi chấn thương do xẹp phổi và dẫn đến quá trình oxy hóa tốt hơn. Tuy nhiên, PEEP cần phải được điều chỉnh cẩn thận vì PEEP rất cao và PEEP thấp có thể gây ra tình trạng căng quá mức và xẹp phế nang tương ứng. PEEP tối ưu phụ thuộc vào FiO2 (theo tiêu chí lựa chọn PEEP của thử nghiệm ARDSNet), phân tích vòng lặp áp lực-thể tích, TPP và phân tích siêu âm phổi. Theo các tài liệu về nhi khoa, không có thử nghiệm ngẫu nhiên có đối chứng nào về tác động của cài đặt và kết quả thở máy. Vấn đề về thể tích khí lưu thông tối ưu là một vấn đề gây tranh cãi. Các nghiên cứu nhi khoa hiện có (hồi cứu và tiến cứu) đã chứng minh các kết quả khác nhau, một số cho thấy tác dụng có lợi của thể tích khí lưu thông lớn hơn và một số khác cho thấy không có mối quan hệ giữa thể tích khí lưu thông và kết quả của bệnh nhân.[28-30] Trong một phân tích tổng hợp trong số 7 nghiên cứu (n = 1756), không thể xác định được một ngưỡng thể tích khí lưu thông nào có liên quan đến việc tăng tỷ lệ tử vong bất kể có hay không có ALI /ARDS.[31] Việc thiếu mối liên hệ giữa thể tích khí lưu thông và kết quả ở trẻ em có thể giải thích việc tuân thủ kém các chiến lược LPV ở trẻ em.[32-33] Tuy nhiên, mối quan hệ trực tiếp giữa áp lực hít vào đỉnh và tỷ lệ tử vong đã được chứng minh trong một số nghiên cứu quan sát ở trẻ mắc ALI. [34,35] Tương tự, dữ liệu về PEEP tối ưu trong ALI/ARDS ở trẻ em còn hạn chế. Các bác sĩ hồi sức nhi khoa có xu hướng sử dụng PEEP thấp hơn và chấp nhận FiO2 cao hơn vì sợ ảnh hưởng đến huyết động. [36] Tuy nhiên, những sai lệch trong cách tiếp cận so với giao thức. Mạng ARDS có liên quan đến kết quả kém ở trẻ mắc ARDS. [33] Áp lực đẩy (áp lực bình nguyên – PEEP, hoặc thể tích khí lưu thông/độ giãn nở tĩnh) là biến số vật lý có mối tương quan tốt nhất với tỷ lệ tử vong.[35] Chiến lược thông khí cơ học dựa trên áp lực để ngăn ngừa VILI ở bệnh nhân mắc ARDS là vấn đề tranh luận trong những năm gần đây.[37,38] Thuốc ức chế thần kinh cơ được dùng trong 48 giờ ở bệnh nhân mắc ARDS (n = 340) đã được chứng minh là làm giảm tỷ lệ tử vong (lợi ích tử vong 10% ở mức ngày 28 và ngày 90) (thử nghiệm ACURASYS).[19] Lợi ích do thuốc ức chế thần kinh cơ có thể là do giảm nồng độ cytokine, giảm chấn thương sinh học và giảm rối loạn chức năng đa cơ quan.[39]
Thông khí ở tư thế nằm sấp giúp cải thiện quá trình oxy hóa bằng cách tăng tính đồng nhất của thông khí và bảo vệ chống lại tổn thương phổi. Thử nghiệm PROSEVA đã chứng minh rằng ở những bệnh nhân mắc ARDS nặng có PaO2/FiO2 <150 (n = 466), tư thế nằm sấp có liên quan đến việc giảm 16,8% tỷ lệ tử vong trong 28 ngày.[40]
Ngăn chặn việc vô tình ngắt kết nối thở máy và rút ống nội khí quản ngoài kế hoạch; cai đột ngột PEEP cao hoặc cai nhanh NIV; và sử dụng ống thông hút kín sẽ ngăn ngừa tình trạng mất huy động phế nang và tổn thương xẹp phổi. Các thủ thuật huy động từng được cho là làm giảm VILI; tuy nhiên, do các biến chứng (giảm huyết động và tràn khí màng phổi) và lợi ích lâm sàng không chắc chắn nên những thuốc này không được sử dụng thường xuyên. Thông khí dao động tần số cao (HFOV) cung cấp thể tích khí lưu thông rất thấp, áp lực căng liên tục (do đó ngăn ngừa xẹp phổi) và tạo ra các dao động áp lực nhỏ chồng lên (ngăn ngừa chấn thương thể tích). Về mặt lý thuyết, HFOV đủ điều kiện cho chế độ thông khí bảo vệ phổi lý tưởng vì nó có thể ngăn ngừa VILI.
Tuy nhiên, hai thử nghiệm lớn (thử nghiệm OSCILLATE và OSCAR) đã không chứng minh được lợi ích sống sót của HFOV ở người lớn mắc ARDS.[41, 42] Arnold và cộng sự [43] đã chứng minh rằng ở trẻ em bị suy hô hấp do thiếu oxy cấp tính (n = 58), tỷ lệ tử vong là như nhau thành hai nhóm; tuy nhiên, trẻ em trong nhóm HFOV có sự cải thiện về oxygen hóa theo thời gian và nhu cầu oxy bổ sung thấp hơn vào ngày thứ 30, cho thấy nhóm HFOV ít bị tổn thương phổi hơn. Gupta và cộng sự [44] trong một nghiên cứu hồi cứu đã chứng minh tỷ lệ tử vong cao hơn và tỷ lệ mắc bệnh ở trẻ em được điều trị bằng HFOV so với thở máy thông thường. Gần đây, Bateman và cộng sự [45] trong một và so sánh xu hướng (đối với mức độ nghiêm trọng của bệnh (dữ liệu từ Đánh giá ngẫu nhiên về chuẩn độ thuốc an thần cho bệnh suy hô hấp và nghiên cứu RESTORE đã chứng minh rằng HFOV sớm (bắt đầu trong vòng 24–48 giờ sau khi đặt nội khí quản) có liên quan đến thời gian thở máy dài hơn nhưng không gây tử vong so với thở máy thông thường hoặc HFOV muộn.
Hỗ trợ ngoài cơ thể là một biện pháp can thiệp đầy hứa hẹn trong việc giảm VILI; tuy nhiên, dữ liệu về lợi ích lâm sàng của hỗ trợ ngoài cơ thể còn hạn chế. Thuốc chống viêm và tế bào gốc trung mô đã được sử dụng trên mô hình động vật để giảm VILI. Tuy nhiên, các nghiên cứu lâm sàng còn hạn chế. Ketamine và Propofol đã được sử dụng làm chất chống viêm để giảm IL-1β, caspase-1 và NF-κB, với ketamine được cho là vượt trội hơn propofol.[46]
11 Tiên lượng
VILI có liên quan đến việc tăng tỷ lệ mắc bệnh và tử vong. MODS thứ phát sau chấn thương sinh học là yếu tố góp phần chính. Các biến chứng của VILI bao gồm phù phổi, chấn thương khí áp và tình trạng thiếu oxy máu trầm trọng hơn dẫn đến thở máy kéo dài. VILI có liên quan đến tình trạng viêm lan rộng và tổn thương phổi nghiêm trọng cũng như tình trạng xơ hóa lan rộng có thể dẫn đến tình trạng khuyết tật hô hấp lâu dài, nhiễm trùng phổi tái phát và bệnh tâm phế ở những người sống sót.[4]
12 Định hướng tương lai
Dữ liệu hạn chế về VILI ở trẻ em mở ra cơ hội cho các nghiên cứu lâm sàng được thiết kế tốt nhằm làm sáng tỏ dịch tễ học và cơ chế bệnh sinh của VILI; sử dụng tối ưu và sinh lý của thông khí cơ học; và ảnh hưởng của thể tích khí lưu thông, PEEP và các biện pháp can thiệp khác ở trẻ có hoặc không có ARDS. Cho đến thời điểm đó, các bác sĩ hồi sức nhi khoa nên sử dụng thở máy một cách thận trọng dựa trên các hướng dẫn và đề xuất từ Hội nghị đồng thuận thông khí cơ học ở trẻ em và Tổ chức hợp tác đồng thuận ALI ở trẻ em.[47,48,49, 50]
13 Kết luận
Mặc dù thông khí cơ học là phương pháp cứu sống ở trẻ bị bệnh nặng, nhưng nó có thể dẫn đến VILI do sự tương tác phức tạp giữa đường thở (áp lực bình nguyên và thể tích khí lưu thông cao) và lực mạch máu (tổn thương mạch máu do tương tác bất lợi giữa tim và phổi). Có thể ngăn ngừa hoặc giảm thiểu VILI ở trẻ thở máy bằng cách sử dụng chiến lược LPV.
Tránh căng quá mức phế nang cuối thì hít vào, duy trì FRC đầy đủ và nhắm mục tiêu trao đổi khí ở mức chấp nhận được (không hoàn toàn bình thường) với thông khí ít gây tổn hại nhất là những nguyên tắc quan trọng. Trong mọi trường hợp cần thở máy, điều quan trọng trước tiên là phải xác định tính khả thi của NIV trước khi đặt nội khí quản.

