Người cao tuổi nên dùng thuốc giảm đau Opioid thế nào cho an toàn và hiệu quả?

Đại học Y Dược Thành phố Hồ Chí Minh - Bộ môn Lão khoa
Chủ biên PGS.TS.BS. Nguyễn Văn Tân
PGS.TS.BS. Nguyễn Văn Trí
TS.BS. Nguyễn Thanh Huân
Các tác giả tham gia biên soạn
Trịnh Thị Bích Hà
Nguyễn Ngọc Hoành Mỹ Tiên
Nguyễn Ngọc Hoàn Băng
Người cao tuổi là đối tượng đặc biệt cần được chăm sóc sức khỏe cũng như cẩn trọng trong việc sử dụng thuốc. Vậy, sử dụng thuốc opioid trong giảm đau cho người cao tuổi có những điểm khác biệt nào so với dùng cho người trưởng thành. Trong bài viết này, Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) xin gửi đến bạn đọc thông tin về sử dụng opioid trong giảm đau ở người cao tuổi.
1 Mở đầu
Đau rất phổ biến ở người cao tuổi (NCT). Đến 40% NCT sống độc lập' và 80% sống trong viện dưỡng lão báo cáo đau. Trong đó, khoảng 40% bệnh nhân ở viện dưỡng lão tả cơn đau của họ nghiêm trọng, không thể chịu đựng được. Tương tự những người trẻ, đau ở NCT có liên quan đến đau khổ tâm lý đáng kể, suy giảm chức năng thể chất.
Tuy nhiên, bệnh nhân cao tuổi có nguy cơ điều trị đau không đầy đủ. Nhưng tình trạng dùng thuốc giảm đau quá mức đặc biệt là opioid trong dân số lão khoa ngày càng đáng lo ngại. Đơn thuốc opioid tăng gấp 4 lần trong thập kỷ qua, nhưng không cải thiện tỷ lệ đau, tàn tật. NCT là nhóm có nhiều khả năng sử dụng opioid lâu dài. Năm 2017, thống kê của Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh (Centers for Disease Control and Prevention [CDC]) cho thấy: 17,4% dân số Hoa Kỳ đã mua ít nhất 1 đơn thuốc opioid và nhóm được kê đơn opioid cao nhất là NCT (265 tuổi), chiếm 26,8%.
Ở Hoa Kỳ, năm 2016, tỷ lệ đau mạn tính (26 tháng) chiếm tỷ lệ rất cao lần lượt 27,6 - 33,6% ở tuổi từ 65 - 84 tuổi và trên 85 tuổi. Đau mạn tính cũng ảnh hưởng mạnh đến hoạt động chức năng, 10,7% người từ 65 - 84 tuổi và 15,8% ở người trên 85 tuổi.
2 Phân loại thuốc Opioid
Khoảng 3.000 năm trước công nguyên, opioid được người Ai Cập dùng ở dạng opium để trị đau rất hiệu quả. Là thuốc có nguồn gốc tự nhiên từ cây anh túc, tên khoa học là Papaver somniferum. Người ta thu hoạch dịch mủ của vỏ quả, sấy khô, tán thành dạng bột màu trắng. Opium dạng bột chứa một số alkaloid và chỉ một số ít morphin.
Các hợp chất tương tự opium được tổng hợp, bào chế, tạo thành một họ các thuốc lớn, bao gồm cả opium, được gọi là opiate. Opiate gồm hơn 20 loại alkaloid riêng. Thuốc thuộc nhóm opiate chọn lọc như morphin, heroin, hydromorphon, oxymorphon, codein, hydrocodon, drocode, oxycodon, levorphanol, methadon, fentanyl, nalbuphin, propoxyphe, buprenorphin, pentazocin, butorphanol. Tên gọi opioid dùng để chỉ bất kỳ chất nào có đặc tính chức năng và dược lý của opioid.
2.1 Phân loại theo nguồn gốc
| Tự nhiên (nguyên thủy) | Bán tổng hợp | Tổng hợp |
Morphin, Codein, Thebain, Papaverin | Diamorphin (heroin), Dihydromorphon, Buprenorphin, Oxycodon | Pethidin, Fentanyl, Methadon, Alfentanil, Remifentanil, Tapentadol
|
2.2 Phân loại theo tính tan trong nước-mỡ
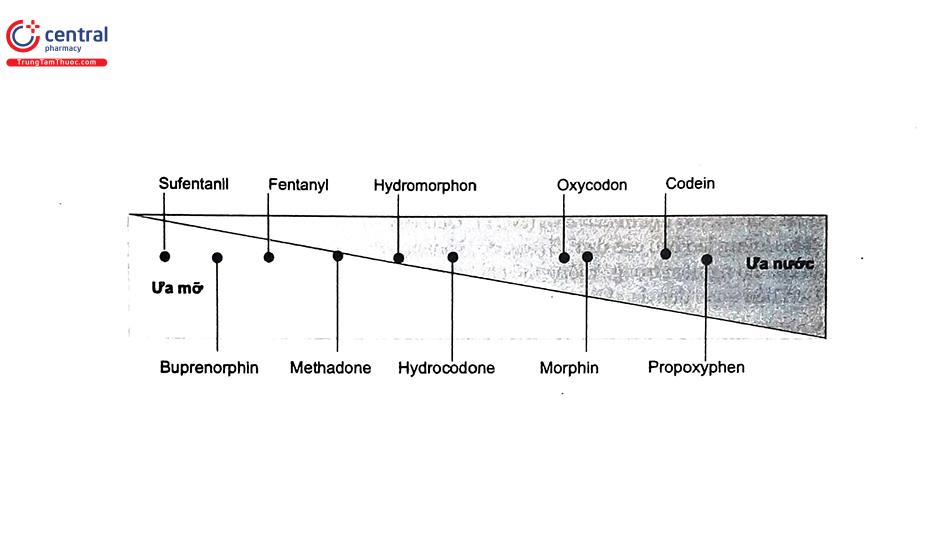
2.3 Phân loại theo tác dụng mạnh yếu
Opioid được phân loại là opioid yếu và mạnh dựa trên tác dụng giảm đau, được Tổ chức Y tế Thế giới (WHO) ủng hộ. Nhóm opioid yếu bao gồm: codein, dihydrocodein, dextropropoxyphen, tramadol. Nhóm opioid mạnh bao gồm: morphin, methadon, fentanyl, hydromorphon, pethidin, oxycodon, buprenorphin, levorphanol dextromoramide.
2.4 Phân loại theo tác dụng đồng vận-đối vận thụ thể opioid
- Nhóm đồng vận: gắn kết thụ thể kích thích hoạt động sinh lý, không có liều trần trong tác dụng giảm đau.
- Nhóm đối vận: không có hoạt tính dược lý nội tại nhưng có thể can thiệp vào hoạt động của nhóm đồng vận nếu cả hai tương tác với cùng thụ thể. Các thuốc đối vận có thể cạnh tranh nếu chúng liên kết với cùng một thụ thể và không cạnh tranh nếu ngăn chặn các hiệu ứng theo một cách khác.
- Nhóm đồng vận - đối vận: có tác dụng trần với hoạt tính kháng cảm thụ (antinociception), có tác dụng đồng vận với một số thụ thể và tác dụng đối vận các thụ thể khác nhau. Dùng đồng thời thuốc đồng vận opioid với thuốc đối vận opioid hoặc thuốc đồng vận - đối vận hoặc đồng vận bán phần, có thể dẫn đến các triệu chứng cai thuốc.
- Nhóm đồng vận bán phần: có tác dụng hoạt tính kháng cảm thụ nhưng có hiệu quả thấp với thụ thể opioid.
| Đồng vận | Đối vận | Đồng vận-Đối vận | Đồng vận bán phần |
Morphin, Codein, Oxycodon, Pethidin, Diamorphin, Hydromorphon, Levorphanol, Methadon, Fentanyl, Sufentanyl, Remifentanyl, Tramadol, Tapedolol | Naloxon, Naltrexon, Nalmefen, Diprenorphin | Nalorphin, Pentazocin, Nalbuphin , Butorphanol, Dezocin | Meptazinol, Buprenorphin |
3 Nguyên tắc sử dụng giảm đau Opioid
3.1 Mục tiêu và nguyên tắc chung trong điều trị giảm đau
3.1.1 Mục tiêu
- Điều trị giảm đau tối ưu.
- Cải thiện chất lượng cuộc sống, tối ưu hoạt động sinh hoạt hằng ngày, ảnh hưởng của đau lên tâm lý, tâm thần kinh.
- Giảm thiểu tác dụng phụ do điều trị giảm đau.
- Tránh chuyển hướng, sai lệch về mục đích dùng thuốc, đặc biệt là opioid.
3.1.2 Nguyên tắc
- Tất cả bệnh nhân có triệu chứng đau ở bất kỳ giai đoạn nào của bệnh đều phải được điều trị, trừ khi bệnh nhân từ chối (rất hiếm).
- Kế hoạch điều trị đau cần được cá thể hóa dựa trên đánh giá và đáp ứng điều trị. Thảo luận, xác định mong đợi và mục tiêu của bệnh nhân muốn đạt được trong điều trị đau. Qua đó lập kế hoạch rõ ràng để thực hiện trong tương lai.
- Tối ưu hóa điều trị nguyên nhân gây đau (nếu có thể).
- Điều trị đau song hành với điều trị các triệu chứng khác.
- Cung cấp các hỗ trợ về tâm lý, tâm linh và xã hội.
3.2 Khi nào dùng opioid để điều trị đau?
Opioid được xếp vào nhóm thuốc gây nghiện, không được kê đơn tùy ý. Không phải đau mức độ từ trung bình-nặng hoặc nặng là kê đơn opioid theo thang giảm đau 3 bậc của Tổ chức Y tế Thế giới (Hình 2)". Đây chỉ là thang giảm đau dành cho bệnh nhân ung thư, chỉ tham khảo cho nhóm đau không do ung thư. Trong trường hợp cơn đau nặng không do ung thư như viêm tụy cấp, thuốc opioid mạnh như morphin được dùng ngay, là hoàn toàn không nên vì chưa đảm bảo được cân bằng về nguy cơ và lợi ích.

3.2.1 Các câu hỏi cần đặt ra
Để cân bằng giữa nguy cơ-lợi ích, đặc biệt là khả năng sử dụng opioid dài hạn.
|
3.2.2 Đặc điểm đau
Giúp xét tính thỏa đáng để sử dụng opioid, chẩn đoán và điều trị đau chính xác: xác định mức độ, thời gian, đặc điểm của đau, cung cấp thông tin hỗ trợ chẩn đoán, giúp quyết định lựa chọn phương pháp và thuốc điều trị, đánh giá hiệu quả tương đối của các liệu pháp khác nhau và nghiên cứu các cơ chế gây đau và giảm đau.
- Mức độ đau
Đánh giá mức độ đau dựa trên tự đánh giá chủ quan của người bệnh. Điểm số của cơn đau dùng để theo dõi diễn tiến cơn đau trên cùng một người bệnh.
Hầu hết các thang điểm đau được thiết kế để sử dụng cho người trẻ. Dữ liệu có sẵn ủng hộ sử dụng các thang đo mức độ đau ở NCT, thang đo mô tả bằng lời nói (verbal descriptor scales [VDS]), thang điểm đánh giá số (numerical rating scales [NRS]), điểm hộp (box scores), thang đo dựa trên nét mặt (facial pain scales [FPS]), và nhiệt kế đau (pain thermometers).
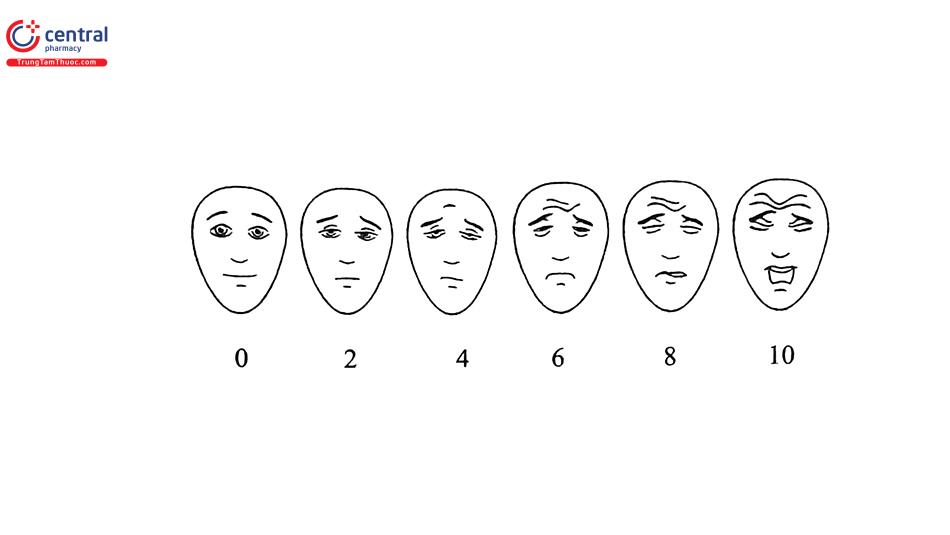
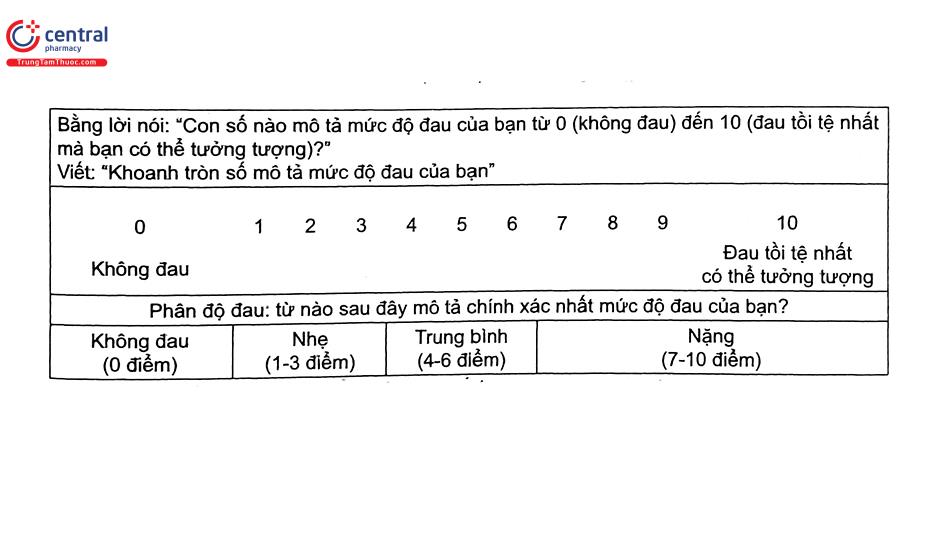
- Đau cấp tính và man tính
Đau cấp tính (<1 tháng, không kể đau cấp trên nền mạn) nguyên nhân thường là có thể điều trị đặc hiệu được: nhồi máu cơ tim gây đau ngực, viêm tụy cấp gây đau thượng vị, gãy xương, bỏng, hậu phẫu... Điều trị giảm đau với opioid khi đau cấp tính nghiêm trọng mà NSAID và các liệu pháp khác chống chỉ định hoặc có khả năng không hiệu quả. Chỉ dùng morphin tạm thời, sau đó sẽ giảm liều hoặc ngừng hẳn”. Tránh kê đơn opioid cho cơn đau cấp tính trở thành liệu pháp opioid lâu dài, chỉ vì thuốc được tiếp tục mà không được đánh giá lại.
Opioid không là liệu pháp đầu tay, thường quy với đau bán cấp (1-3 tháng), mạn tính (>3 tháng). Không có nghĩa là bệnh nhân phải tuần tự thất bại với liệu pháp không dùng thuốc, dùng thuốc hoặc phải dùng bất kỳ phương pháp điều trị cụ thể nào trước khi điều trị opioid. Bệnh nhân đau bán cấp đã dùng opioid trong ≥30 ngày, cần đảm bảo các nguyên nhân đau mạn tính có khả năng đảo ngược được giải quyết.
| Tiêu chí | 0 điểm | 1 điểm | 2 điểm |
| Thở độc lập với phát âm | Bình thường | Thỉnh thoảng khó thở Tăng thông khí giai đoạn ngắn | Thở khó nhọc gây tiếng động Tăng thông khí kéo dài Hô hấp kiểu Cheyne-Stokes |
| Phát âm tiêu cực | Không | Thỉnh thoảng rên, kêu Nói đoạn ngắn âm thanh có chất lượng không tốt | Gọi hỗn loạn lặp lại Rên hoặc kêu to Khóc |
| Vẻ mặt | Cười hoặc không biểu lộ | Buồn Sợ hãi Khó chịu | Nhăn nhó |
| Ngôn ngữ cơ thể | Thoải mái | Căng người Nhịp độ đau khổ Bồn chồn | Co cứng Siết chặt tay Co đầu gối lên Kéo hoặc đẩy Vùng vẫy |
| An ủi | Không cần an ủi | Làm sao nhãng hoặc trấn an bằng lời nói hoặc tiếp xúc | Không thể an ủi, làm sao nhãng hoặc trấn an |
3.2.3 Tiền căn sử dụng opioid hay chưa từng sử dụng opioid?
Bệnh nhân đã sử dụng opioid thì khả năng bệnh nhân đã dung nạp opioid, nguy cơ quá liều thấp và chấp nhận sử dụng opioid.
3.2.4 Tiền căn hoặc đang mắc các rối loạn liên quan sử dụng opioid
Bệnh nhân có tiền căn hoặc đang mắc các rối loạn liên sử dụng opioid như lệ thuộc, nghiện thuốc là một đối tượng cần được quản lý riêng và chuyên biệt.
3.2.5 Tối ưu hóa liệu pháp non-opioid
Đau cấp tính
Các liệu pháp non-opioid ít nhất cũng hiệu quả như opioid đối với nhiều loại đau cấp tính phổ biến, gồm”3: đau thắt lưng, đau cổ, đau do chấn thương cơ xương khác (ví dụ: bong gân, căng cơ, viêm gân và viêm bao hoạt dịch), đau liên quan đến các tiểu phẫu với tổn thương mô tối thiểu và đau nhẹ sau phẫu thuật (ví dụ: nhổ răng đơn giản), đau răng, cơn đau quặn thận và đau đầu bao gồm cả đau nửa đầu từng cơn. Nên tối đa các liệu pháp không dùng thuốc (chườm lạnh, chườm ấm, nghỉ ngơi, bất động hoặc vận động), dùng thuốc non-opioid phù hợp (NSAID uống, thoa, Acetaminophen), chỉ xét liệu pháp opioid cho cơn đau cấp nếu lợi ích lớn hơn nguy cơ.
Đau bán cấp và mạn tính
Biện pháp không dùng thuốc
- Đau lưng, đau xơ cơ và thoái hóa khớp háng hoặc gối: tập thể dục như bài tập aerobic, dưới nước hoặc có kháng lực.
- Thoái hóa khớp gối: giảm cân.
- Sử dụng thuốc opioid trong giảm đau ở người cao tuổi
- Thoái hóa khớp háng: liệu pháp bằng tay (manual therapies).
- Đau thắt lưng: liệu pháp tâm lý, thao tác cột sống (spinal manipulation), laser cường độ thấp, xoa bóp, chánh niệm, yoga, châm cứu, phục hồi chức năng đa ngành.
- Đau cổ: yoga, thái cực quyền, khí công, mát-xa và châm cứu.
- Đau xơ cơ: liệu pháp nhận thức hành vi, xoa bóp thả lỏng cơ, chánh niệm, thái cực quyền, khí công, châm cứu và phục hồi chức năng đa ngành.
- Đau đầu căng cơ: thao tác cột sống.
Biện pháp dùng thuốc non-opioid
- Thoái hóa khớp: khi không đáp ứng đau với các can thiệp không dùng thuốc, thêm NSAID tại chỗ khi đau ở một hoặc vài khớp gần bề mặt da (gối). Với bệnh nhân đau nhiều khớp, cân nhắc duloxetin hoặc NSAID toàn thân. Dùng liều thấp nhất có hiệu quả, thời gian ngắn nhất. Thận trọng ở NCT, bệnh tim mạch, bệnh thận mạn, tiền sử xuất huyết tiêu hóa.
- Đau thần kinh: thuốc chống trầm cảm ba vòng, tetracyclic và SNRI, thuốc chống co giật chọn lọc (pregabalin, Gabapentin enacarbil, oxcarbazepin), miếng dán capsaicin, Lidocaine. Duloxetin và pregabalin được FDA phê duyệt cho bệnh thần kinh ngoại biên do đái tháo đường. Pregabalin và gabapentin được FDA phê duyệt cho đau dây thần kinh hậu zona. Ở NCT, chống trầm cảm ba vòng nên thận trọng vì nguy cơ lú lẫn, té ngã.
- Đau xơ cơ: thuốc chống trầm cảm ba vòng (Amitriptylin), chống trầm cảm SNRI (duloxetin, milnacipran), NSAID (Diclofenac tại chỗ), chống co giật (pregabalin, gabapentin) được sử dụng để cải thiện cơn đau, chức năng, chất lượng cuộc sống. Duloxetin, milnacipran, pregabalin được FDA chấp thuận cho đau xơ cơ hóa.
- Đau và trầm cảm đồng thời có thể có lợi ích từ thuốc chống trầm cảm.
3.2.6 Thảo luận và thiết lập mục tiêu trước khi sử dụng opioid
Mục tiêu cần đạt
- Bệnh nhân nhận thức được lợi ích mong đợi, nguy cơ thường gặp, nguy cơ nghiêm trọng và các lựa chọn thay thế cho opioid.
- Hiểu và áp dụng các mục tiêu, nguyện vọng, giá trị của bệnh nhân để có thông tin đưa ra quyết định khởi trị opioid.
- Không nên bắt đầu liệu pháp opioid khi bác sĩ và bệnh nhân không lường trước chiến lược rút lui nếu liệu pháp opioid không thành công.
Thiết lập kỳ vọng và mục tiêu
Đau có thể giảm đi nhưng không thể biến mất hoàn toàn. Thảo luận về mức độ đau mà họ có thể sinh hoạt, làm việc, chất lượng cuộc sống tốt. Việc cải thiện được 30-50% cơn đau và chức năng là có ý nghĩa trên lâm sàng.
Cần đặt ra các mục tiêu cụ thể đối với bệnh nhân, ví dụ như: tôi muốn nấu được một bữa ăn trong ngày cho gia đình của mình, tôi muốn đi bộ một lần mỗi ngày...
Một số mẫu câu hỏi như:
- Tìm hiểu trải nghiệm đau của bệnh nhân và cách kiểm soát đau trước đây: “Điều gì khiến bạn lo lắng nhất về kiểm soát đau của mình?”, “Có tình huống hoặc yếu tố nào trong cuộc sống khiến bạn khó kiểm soát đau hơn không?”, “Kinh nghiệm trước đây của bạn trong kiểm soát đau là gì?”
- Tìm hiểu mong muốn của bệnh nhân: “Bạn nghĩ bắt đầu dùng thuốc opioid sẽ giúp ích gì cho bạn?”, “Bạn nghĩ thuốc opioid có thể cải thiện cuộc sống của bạn như thế nào?”
- Tìm hiểu mối quan tâm của bệnh nhân: “Nỗi sợ hãi và lo lắng lớn nhất của bạn khi bắt đầu dùng thuốc opioid là gì?”, “Có tình huống nào khiến bạn không muốn bắt đầu hoặc tiếp tục dùng thuốc opioid không?”
Nguy cơ và yêu cầu khi sử dụng opioid
- Sử dụng opioid trong thời gian ngắn có thể dẫn đến sử dụng opioid thời gian dài ngoài ý muốn, cần có kế hoạch giảm dần opioid một cách thích hợp khi cơn đau thuyên giảm nếu opioid đã được sử dụng đều đặn theo giờ trong hơn một vài ngày.
- Các tác dụng phụ nghiêm trọng của opioid gồm, ức chế hô hấp có thể gây tử vong và tiến triển rối loạn sử dụng opioid nghiêm trọng tiềm ẩn có thể gây đau khổ, không có khả năng thực hiện các chức năng xã hội (như nơi làm việc, trường học, gia đình).
- Các tác dụng thường gặp của opioid như táo bón, khô miệng, buồn nôn, nôn, buồn ngủ, lú lẫn, dung nạp, phụ thuộc thể chất, triệu chứng cai nghiện khi ngừng opioid.
- Để giúp bệnh nhân đánh giá khi nào cần một liều opioid, hãy giải thích rằng mục tiêu là giảm đau để làm cho nó có thể kiểm soát được hơn là để loại bỏ cơn đau.
- Tăng nguy cơ rối loạn sử dụng opioid, ức chế hô hấp và tử vong ở liều lượng cao hơn, nên chỉ dùng lượng opioid được kê đơn (tức là không dùng nhiều opioid hơn quy định hoặc dùng thường xuyên).
- Tăng nguy cơ ức chế hô hấp khi dùng opioid cùng với benzodiazepin, thuốc an thần khác, rượu, thuốc không kê đơn hoặc bất hợp pháp (heroin), thuốc opioid khác.
- Nguy cơ cho các thành viên trong gia đình và người khác nếu opioid được chia sẻ có chủ ý hoặc vô ý mà không được kê đơn. Khả năng những người khác có thể bị quá liều với liều lượng tương đương hoặc thấp hơn so với liều cho bệnh nhân, trẻ nhỏ và vật nuôi dễ bị ăn phải không chủ ý.
3.3 Lựa chọn loại opioid
Nguyên tắc lựa chọn
Opioid phóng thích kéo dài hay phóng thích tức thì
Khi bắt đầu điều trị opioid cho đau cấp tính, bán cấp, mạn tính, nên sử dụng opioid phóng thích tức thì.
Lựa chọn thuốc chi phí thấp, có sẵn để kiểm soát đau cho tất cả bệnh nhân, đặc biệt bệnh nhân có thu nhập thấp, không có bảo hiểm y tế hay bảo hiểm không đầy đủ.
Sử dụng thuốc opioid trong giảm đau ở người cao tuổi
Chỉ xem xét chế phẩm phóng thích kéo dài cho bệnh nhân đã dùng một số liều opioid phóng thích tức thì nhất định hằng ngày trong ít nhất 1 tuần.
Khi chuyển sang opioid phóng thích kéo dài, nên tham khảo hướng dẫn sử dụng thuốc và.
Thận trọng với opioid phóng thích kéo dài, giảm tổng liều dùng hằng ngày do dung nạp chéo khi chuyển, cân nhắc khoảng thời gian dùng thuốc dài hơn khi có rối loạn chức năng thận, gan vì độ thanh thải thuốc giảm gây tích tụ thuốc đến mức gây hại. Miếng dán fentanyl chỉ nên được kê đơn bởi bác sĩ lâm sàng quen sử dụng thuốc và có kế hoạch giáo dục bệnh nhân, người nhà biết cách sử dụng.
Thuốc opioid nào được ưu tiên
Opioids tác dụng ngắn đồng vận hoàn toàn với thụ thể mu như morphin, oxycodon, hydromorphon, oxymorphon được ưa chuộng trong điều trị đau mức độ trung bình - nặng ở bệnh nhân ung thư chưa từng dùng opioid. Không có bằng chứng ủng hộ thuốc nào vượt trội hơn trong hiệu quả và dung nạp.
Morphin được ưa chuộng hàng đầu, thiết yếu nhất trong chăm sóc giảm nhẹ. Oxycodon không được khuyến cáo vì không tốt hơn morphin nhưng giá cao hơn. Codein có biến thiên di truyền trong chuyển hóa và không thể tiên đoán được hiệu quả của thuốc nên ít được chọn trong điều trị đau, chủ yếu được sử dụng để giảm ho. Meperidin cũng ít được dùng do có nhiều độc tính.
Lựa chọn opioids còn tùy thuộc tình trạng chức năng gan và thận của bệnh nhân.
Bệnh nhân suy thận, fentanyl, methadon là an toàn nhất, sử dụng hydromorphon, morphin và oxycodon thận trọng, tránh dùng codein và meperidin.
Bệnh nhân suy gan, fentanyl là an toàn nhất, cần cẩn trọng khi sử dụng morphin, oxycodon và hydromorphon, tránh methadon, meperidin và codein.
3.4 Đường dùng, chế độ và liều lượng dùng opioid
3.4.1 Đường dùng
Đường uống: đường uống là ưu tiên vì dễ tiếp cận, dung nạp tốt, bệnh nhân tự quản lý được.
Tiêm dưới da: lựa chọn để kiểm soát đau do ung thư vì dễ quản lý, an toàn khi không thể uống thuốc tại nhà Tốc độ hấp thu chậm, hằng định, mang lại hiệu quả từ từ và bền vững. Thuốc thường được sử dụng: morphin, fentanyl, hydromorphon. Methadon pethidin có nhiều khả năng gây ra phản ứng viêm, không được khuyến cáo”.
Tiêm bắp: tiêm bắp khiến bệnh nhân khó chấp nhận hơn, xâm lấn nhiều hơn, nguy cơ nhiễm trùng, tổn thương thần kinh nhiều hơn. Tiêm bắp cũng không được dùng để giảm đau khẩn cấp vì tiêm tĩnh mạch tác dụng nhanh hơn.
Đường tĩnh mạch: hữu ích nhất trong nội viện cần chăm sóc cấp tính. Tuy nhiên, đường tĩnh mạch về lâu dài, đặc biệt là ngoại trú, khó tiếp cận hơn so với tiêm dưới da.
Đường trực tràng: lựa chọn thay thế cho bệnh nhân: buồn nôn, nôn, khó nuốt, tắc ruột... không uống opioid bằng đường miệng. Thuốc được hấp thụ ở cả tuần hoàn hệ thống và tuần hoàn cửa, trong đó ở tuần hoàn cửa có giảm mức độ chuyển hóa thuốc.
Miếng dán qua da: fentanyl và buprenorphin là hai thuốc được dùng dán qua da trong thực hành lâm sàng hiện nay Sau khi dán, thuốc sẽ thấm vào da và tạo một “kho chứa” trong lớp sừng. Cần 12 giờ để có tác dụng giảm đau và cần 16 giờ để đạt đầy đủ hiệu quả lâm sàng. Nồng độ thuốc trong huyết tương ổn định sau 2 miếng dán liên tiếp và động học dường như không thay đổi với các lần dùng lặp lại”. T1/2 huyết tương sau khi loại bỏ miếng dán khoảng 17 giờ. Do chậm đạt nồng độ ổn định, nồng độ này ổn định trong thời gian dài, giảm chậm sau khi bỏ miếng dán, nên không phù hợp với đau cấp và mạn tính chưa kiểm soát. Sốt, nguồn nhiệt ngoài (đèn sưởi, nước nóng) có thể làm tăng hấp thu fentanyl, dẫn đến quá liều. Nếu xảy ra an thần, ức chế hô hấp quá mức, cần duy trì thuốc đối vận trong thời gian dài. Tác dụng phụ ngoài da của miếng dán thường nhẹ như phát ban, ngứa. Do hấp thu dưới lưỡi, má nhanh chóng, hiệu quả, nên y văn đã ghi nhận các trường hợp nghiện opioid đã nhai miếng dán, bị quá liều, một số ca đã tử vong.
| Opioid | Sinh khả dụng uống | Opioid | Sinh khả dụng uống |
| Hydromorphon | 20% | Oxycodon | 60% |
| Morphin | 30% | Levorphanol | 70% |
| Diamorphin | 30% | Tramadol | 80% |
| Pethidin (meperidin) | 30% | Methadon | 80% |
| Codein | 60% |
3.4.2 Các chế độ dùng opioid
Liều khi cần (dose as needed): là liều khi bệnh nhân xuất hiện đau cơn đau hoặc đau tăng trở lại. Thường được áp dụng cho bệnh nhân đau cấp tính không do ung thư để hạn chế tối đa lượng opioid được dùng.
Liều đều đặn theo giờ (around the clock): khi cơn đau mạn ở mức độ từ trung bình đến nặng, thuốc giảm đau nên được dùng thường xuyên vào những giờ cố định.
Liều cứu hộ (rescue dose): liều cứu hộ bổ sung thêm cho liều đều đặn theo giờ để kiểm soát cơn đau đột xuất 6. Mỗi liều cứu hộ bằng 10% tổng liều opioid sử dụng trong 24 giờ qua (một số tài liệu cho phép 10-20%). Nếu opioid tác dụng ngắn đều theo giờ, liều cứu hộ 25-50% liều opioid theo giờ. Với opioid truyền liên tục, liều cứu hộ 50-150% tốc độ truyền mỗi giờ. Ví dụ: morphin truyền tĩnh mạch liên tục 2 mg/giờ, liều cứu hộ sẽ là morphin 1-3 mg bolus tĩnh mạch. Nếu cơn đau đột xuất thường xảy ra và cần sử dụng liều cứu hộ thường xuyên, liều giảm đau đều đặn theo giờ cần được chỉnh tăng thêm.
Ví dụ, một người bệnh đang dùng morphin đường uống 10mg/lần, mỗi 4 giờ Tổng liều điều trị trong ngày là: 10 mg x 6 = 60 mg Liều cứu hộ: 10% x 60 mg = 6 mg mỗi 2-4 giờ khi cần Tổng liều hằng ngày: tổng liều hằng ngày bằng tổng liều opioid được sử dụng trong 24 giờ bao gồm liều đều đặn theo giờ + liều cứu hộ. |
Ví dụ, nếu người bệnh đang dùng morphin liều 10 mg/lần, mỗi 4 giờ, đồng thời cần dùng thêm liều cứu hộ là 6mg/lần, 5 lần/ngày; Tổng liều cứu hộ: 6mg x 5 lần = 30 mg/ngày; Vì vậy, liều đều đặn theo giờ tăng lên thành 15mg/lần, mỗi 4 giờ. |
Nếu người bệnh có cơn đau đột xuất có thể dự đoán trước do tắm rửa, đi lại hoặc các hoạt động thể chất khác, liều cứu hộ được thêm vào trước các hoạt động đó là trước 30 phút với đường uống và trước 10 phút với đường tiêm.
Lưu ý đối với đau cấp tính cần sử dụng opioid nên dùng opioid giải phóng tức thì ở liều thấp nhất có hiệu quả, chế độ dùng khi cần hơn đều đặn theo giờ và giảm liều opioid khi dùng đều đặn theo giờ nhiều hơn vài ngày.
3.4.3 Liều dùng opioid ban đầu
- Đơn vị đo lường liều lượng
Hướng dẫn quốc tế lấy đơn vị đo lường liều lượng dùng opioid là MME (morphin miligram equivalent), là số mg morphin đường uống tương đương. Chuyển đổi và so sánh giữa các opioid cũng thường dựa vào MME. Ví dụ, 10mg oxycodon đường uống xấp xỉ bằng 15 mg morphin đường uống, hoặc 15 MME.
| Opioid | Hệ số chuyển đổi | Opioid | Hệ số chuyển đổi |
| Codein | 0,15 | Hydromorphon | 4 |
| Tramadol | 0,2 | Methadon 1-20 mg/ngày 21-40 mg/ngày 41-60 mg/ngày >=61-80 mg/ngày | 4 8 10 12 |
| Fentanyl miếng dán (mcg/h) | 2,4 | ||
| Hydrocodon | 1 | ||
| Morphin | 1 | ||
| Oxycodon | 1,5 | ||
| Oxymorphon | 3 |
- Khuyến cáo
Nguy cơ quá liều, tử vong do quá liều, tăng liều liên tục và không có ngưỡng liều nguy cơ. Do đó, tránh tăng liều trên mức có khả năng lợi ích so với nguy cơ. Khi bắt đầu sử dụng opioid cho bệnh nhân chưa từng dùng opioid bị đau cấp tính, bán cấp hoặc mạn tính, nên cho liều thấp nhất có hiệu quả. Liều khởi đầu thấp nhất thường tương đương 5-10 MME hoặc 20-30 MME/ngày. Hiệu chỉnh khi cần dựa trên mức độ của đau, yếu tố khác như suy thận, suy gan.
| GFR (mL/phút) | > 50 | 10-50 | < 10 |
| Morphin | 100% | 50-75% | 25-50% |
| Hydromorphon, hydrocodon | 50-100% | 50% | 25% |
| Oxycodon | 100% | 50% | Không sử dụng |
| Methadon | 100% | 100% | 50-75% |
| Fentanyl | 100% | 75-100% | 50% |
3.5 Thay đổi về loại, đường dùng và liều dùng opioid
3.5.1 Thay đổi về loại và đường dùng opioid
Khi nào cần thay đổi
- Đau không được kiểm soát thích hợp.
- Không kiểm soát được tác dụng phụ.
- Không thể chỉnh tăng liều do tác dụng phụ.
- Tình trạng bệnh nhân thay đổi (khó nuốt, không thể ăn đường miệng, chuyển ăn sonde, chức năng gan thận xấu).
- Bệnh nhân xuất viện không sử dụng thuốc đường tiêm.
- Thuốc không được thanh toán bảo hiểm y tế/quá khả năng chi trả.
Nguyên tắc thay đổi
Đối với thay đổi loại opioid (không kèm thay đổi đường dùng), trừ liều opioid dung nap chéo không hoàn toàn. Khoảng 25-50% (trung bình là 33%) tùy trường hợp, trừ gần 50% hơn đối với bệnh nhân cao tuổi, suy yếu, đang dùng tổng lượng opioid tương đối cao, gần 25% hơn nếu không có các đặc điểm trên.
Đối với thay đổi đường dùng opioid (không thay đổi loại opioid), không trừ dung nạp chéo.
| Uống | Tiêm | Miếng dán qua da | |
| Tramadol | 50 mg mỗi 6 giờ | 32 mg mỗi 6 giờ | |
| Codein | 67 mg mỗi 3-4 giờ | 36 mg mỗi 3-4 giờ | |
| Morphin | 10 mg mỗi 3-4 giờ | 3 mg mỗi 3-4 giờ | |
| Fentanyl | 30 mcg mỗi 1-2 giờ |
| Uống | Tiêm | Miếng dán qua da | |
| Morphin | 50 mg/ngày | 17 mg/ngày | |
| Fentanyl | 25 mcg/h |
3.5.2 Thay đổi về liều dùng opioid
- Nguyên tắc chung
Nên cân nhắc cẩn thận cả lợi ích và nguy cơ của tiếp tục dùng, tăng liều, giảm liều opioid”. Tối ưu hóa các liệu pháp non-opioid trong khi vẫn tiếp tục liệu pháp opioid.
Khi lợi ích < nguy cơ, nên tối ưu hóa các liệu pháp khác và giảm dần liều opioid một cách thích hợp tùy theo bệnh cảnh lâm sàng.
Trường hợp lợi ích và nguy cơ của tiếp tục dùng opioid như nhau, không rõ ràng, chia sẻ ra quyết định chung với bệnh nhân là quan trọng. Đôi khi, bệnh nhân và bác sĩ không thể đi đến thống nhất về lợi ích và nguy cơ, bác sĩ nên thừa nhận sự bất đồng này, bày tỏ sự đồng cảm, tìm cách thay đổi điều trị lấy bệnh nhân làm trung tâm và tránh bỏ rơi bệnh nhân.
- Tiếp tục dùng và tăng liều opioid
Nên sử dụng thuốc non-opioid khi có thể. Nếu cần tăng liều opioid (ví dụ: đối với đau cấp tính nặng chồng lên), chỉ tăng liều đủ trong thời gian đau nặng, sau đó trở lại liều opioid ban đầu càng sớm càng tốt, giảm dần liều đều đặn theo giờ nếu opioid bổ sung được dùng nhiều hơn một vài ngày.
Nếu opioid được tiếp tục cho đau bán cấp hoặc mạn tính, thận trọng khi kê đơn opioid ở bất kỳ liều lượng nào (đặc biệt với liều 250 MME/ngày), đánh giá cẩn thận lợi ích, nguy cơ khi tăng liều.
- Giảm liều opioid
Khi nào cần giảm liều opioid
Bệnh nhân yêu cầu giảm liều hoặc ngừng opioid.
Đau được cải thiện và giải quyết được nguyên nhân cơ bản.
Liệu pháp opioid không làm giảm đau hoặc cải thiện chức năng có ý nghĩa.
Đã được điều trị bằng opioid trong một thời gian dài (nhiều năm), sự cân bằng lợi ích-nguy cơ không rõ ràng (ví dụ: giảm tác dụng tích cực do khả năng dung nạp và các triệu chứng như giảm tập trung hoặc trí nhớ có thể do opioid).
Sử dụng opioid liều cao nhưng không có bằng chứng về lợi ích từ liều cao.
Gặp các tác dụng phụ làm giảm chất lượng cuộc sống hoặc suy giảm chức năng. Tồn tại bằng chứng về lạm dụng opioid,
Bị quá liều hoặc biến cố nghiêm trọng khác (dẫn đến nhập viện hoặc tổn thương) hoặc
có các dấu hiệu cảnh báo cho một biến cố sắp xảy ra (lú lẫn, an thần, nói lắp).
Đang dùng thuốc (ví dụ: benzodiazepin) hoặc tình trạng bất thường khác (ngưng thở khi ngủ, bệnh gan, bệnh thận, nguy cơ té ngã) làm tăng nguy cơ các kết cục bất lợi.
- Khuyến cáo
Đồng hành với bệnh nhân trong kế hoạch giảm liều, bao gồm tốc độ và mức độ
giảm và khi nào cần tạm dừng giảm liều.
Theo dõi thường xuyên (ít nhất là hàng tháng). Các thành viên trong nhóm (điều dưỡng, dược sĩ, chuyên gia sức khỏe hành vi) hỗ trợ bác sĩ và bệnh nhân.
Nên giảm đủ chậm để giảm thiểu các triệu chứng, dấu hiệu cai opioid (lo lắng, mất ngủ, đau bụng, nôn mửa, tiêu chảy, toát mồ hôi, run, rối loạn nhịp tim).
Thời gian điều trị opioid lâu có thể cần giảm liều lâu hơn, cá nhân hóa dựa trên mục tiêu, mối quan tâm. Thuốc giảm dần 10% mỗi tháng hoặc chậm hơn.
Những bệnh nhân đang vật lộn chịu đựng cơn đau khi giảm liều, bác sĩ nên tối ưu hóa các phương pháp điều trị non-opioid và giải quyết tình trạng đau khổ về hành vi.
Các triệu chứng cai opioid có ý nghĩa lâm sàng có thể cần chậm hơn nữa tốc độ giảm. Có thể phải tạm dừng quá trình giảm liều và khởi động lại khi bệnh nhân đã sẵn sàng. Trước khi đảo chiều tăng liều trở lại, nên đánh giá, thảo luận cẩn thận với bệnh nhân về lợi ích, nguy cơ của tăng liều opioid. Tăng nguy cơ quá liều khi đột ngột quay trở lại liều cao hơn đã kê đơn vì mất khả năng dung nạp opioid và cung cấp naloxon.
Khi đạt đến liều nhỏ nhất, khoảng cách giữa các liều kéo dài, có thể ngừng opioid khi cần dùng ít hơn 1 lần/ngày.
Sàng lọc lo âu, trầm cảm, lạm dụng opioid hoặc rối loạn sử dụng opioid.
Theo dõi chặt chẽ và giáo dục bệnh nhân không thể giảm liều, tiếp tục dùng opioid liều cao hoặc có nguy cơ cao khác (ví dụ: opioid được kê đơn đồng thời với benzodiazepin) và cung cấp naloxon.
Có trách nhiệm quản lý hoặc chuyển chuyên khoa phối hợp quản lý đau.
3.6 Thời gian dùng và theo dõi
3.6.1 Đau cấp tính
Thời gian dùng
Khi đau cấp tính cần dùng opioid, không nên kê đơn thời gian dài hơn mức cần thiết, tránh kê đơn bổ sung opioid để đề phòng đau tiếp tục. Thời gian điều trị opioid dài hơn khi cơ chế tổn thương dẫn đến đau dữ dội kéo dài (ví dụ: tổn thương do chấn thương nặng).
Theo dõi và giảm liều
- Cần được đánh giá ít nhất 2 tuần/lần nếu tiếp tục opioid để điều trị đau cấp.
- Nếu opioid sử dụng liên tục hơn một vài ngày với đau cấp, nên kê toa giảm liều ngắn hạn để giảm thiểu các triệu chứng cai.
- Chỉnh khoảng cách giảm liều tùy vào thời gian kê đơn ban đầu.
- Sử dụng thuốc opioid trong giảm đau ở người cao tuổi
- Kế hoạch giảm liều nên thảo luận với bệnh nhân trước xuất viện và bác sĩ điều phối chăm sóc ngoại trú.
- Để giảm thiểu tác động ngoài ý muốn với bệnh nhân, bác sĩ, trung tâm thực hành và hệ thống y tế nên có các quy trình cho nhóm nhỏ bệnh nhân bị đau cấp tính nghiêm trọng kéo dài hơn thời gian dự kiến. Tái đánh giá kịp thời để xác định hoặc sửa đổi chẩn đoán ban đầu và chỉnh kiểm soát đau phù hợp.
3.6.2 Đau mạn tính
- Ngoài đánh giá lợi ích, nguy cơ của opioid trước khi bắt đầu điều trị, nên đánh giá lợi ích, nguy cơ của opioid trong vòng 1-4 tuần khi bắt đầu điều trị lâu dài, tăng liều.
- Cân nhắc theo dõi ban đầu ngắn hơn 1-4 tuần khi bắt đầu hoặc tăng liều opioid phóng thích kéo dài vì nguy cơ quá liều cao xảy ra trong 2 tuần đầu hoặc khi tổng liều opioid hằng ngày >50 MME/ngày.
- Cân nhắc khoảng thời gian theo dõi ban đầu khoảng 4 tuần khi bắt đầu sử dụng opioid giải phóng tức thì với liều <50 MME/ngày.
- Thường xuyên đánh giá lại (ít nhất 3 tháng/lần) cho bệnh nhân đang điều trị opioid dài hạn, cả bệnh nhân mới bắt đầu nhưng điều trị opioid lâu dài.
- Sàng lọc và đánh giá lại những bệnh nhân có nguy cơ cao bị rối loạn, quá liều, (trầm cảm, bệnh tâm thần khác, tiền sử rối loạn sử dụng chất kích thích, tiền sử quá liều, dùng >50 MME/ngày, dùng các thuốc ức chế hệ thần kinh trung ương), thường xuyên hơn 3 tháng một lần. Tối ưu hóa điều trị trầm cảm, lo âu, các bệnh tâm lý.
- Xem xét quan điểm và mục tiêu của bệnh nhân, xem opioid có tiếp tục đáp ứng các mục tiêu điều trị, gồm cải thiện đau, chức năng, tác dụng phụ.
- Bác sĩ, hệ thống y tế giúp giảm thiểu những tác động ngoài ý muốn bằng cách đảm bảo tất cả bệnh nhân có thể tiếp cận và đủ khả năng chi trả cho đánh giá theo dõi.
- Hiện nay, thăm khám trực tuyến là một phần của chăm sóc tiêu chuẩn (vùng sâu vùng xa, bệnh nhân suy yếu nặng), phương thức chăm sóc sức khỏe từ xa cho phép giao tiếp, theo dõi và đánh giá bệnh nhân.
4 Chống chỉ định
Không có chống chỉ định tuyệt đối, một số chống chỉ định tương đối gồm:
- Quá mẫn (phản vệ) với opioid.
- Ức chế hô hấp cấp.
- Cơn hen phế quản.
- Hội chứng nghiện rượu cấp.
- Nghi ngờ bụng ngoại khoa.
- Liệt ruột.
- Đang dùng hoặc ngưng trong vòng 14 ngày thuốc ức chế monoamin oxidase.
- Tăng áp lực nội sọ và/hoặc chấn thương đầu, nếu thông khí không được kiểm soát.
5 Hướng dẫn sử dụng chi tiết các Opioid thường dùng
5.1 Tramadol
5.1.1 Chế phẩm sẵn có
Viên uống: TRAMADOL/PARACETAMOL 37,5 mg/325 mg.
Ống tiêm: TRAMADOL 50 mg/ml, ống 2 mL.
5.1.2 Chỉ định và liều lượng
Tramadol được điều trị đau từ trung bình đến trung bình-nặng, có lợi ích đặc biệt cho bệnh nhân bị đau hỗn hợp vừa thụ thể, vừa thần kinh do cơ chế hoạt động kép.
Đau cấp tính
Cần giới hạn thời gian dự kiến kiểm soát đau cấp. Thời gian điều trị <3 ngày thường là đủ, hiếm khi cần >7 ngày. Chế phẩm tác dụng dài không khuyến cáo điều trị đau cấp ở bệnh nhân chưa từng dùng opioid. Một số chuyên gia khuyên tránh dùng tramadol ở bệnh nhân đau cấp mức trung bình đến nặng do sự thay đổi giữa các bệnh nhân về chuyển hóa thuốc, tác dụng phụ, tác dụng giảm đau không đáng tin cậy.
Tiêm tĩnh mạch chậm (2-3 phút) hay truyền tĩnh mạch: liều 50-100 mg mỗi 4-6 giờ, liều tối đa cho mỗi lần dùng 100mg, tổng liều tối đa trong ngày 400 mg.
Uống: liều thông thường với viên uống phối hợp (TRAMADOL/PARACETAMOL 37,5 mg/325 mg) 1-2 viên mỗi 4-6 giờ, tối đa là 8 viên.
Đau mạn tính
Phác đồ dùng thuốc lý tưởng chưa rõ ràng; cân nhắc liều ban đầu <300 mg tramadol ngày (tức là tương đương <50 mg morphin/ngày).
Tiêm tĩnh mạch chậm (2-3 phút) hay truyền tĩnh mạch: liều ban đầu 25-50
mg mỗi 6 giờ, tăng liều khi cần 50-100 mg mỗi 4-6 giờ (tối đa: 400 mg/ngày).
Uống: liều thông thường với viên uống phối hợp (TRAMADOL/PARACETAMOL 37,5 mg/325 mg) 1-2 viên mỗi 4-6 giờ, tối đa là 8 viên.
5.2 Morphin
5.2.1 Chế phẩm sẵn có tại Việt Nam
Ống tiêm: MORPHIN HYDROCHLORIDE hoặc MORPHIN SULFAT 10 mg/1 mL.
Viên nang (phóng thích tức thì): MORPHIN SULFAT 30 mg.
Viên nén (phóng thích kéo dài): MS CONTIN 30 mg, 10 mg.
5.2.2 Hướng dẫn sử dụng trên lâm sàng
Đường tiêm
Morphin được thiết kế có thể tích chỉ 1 mL, nên khi dùng liều thấp (<10 mg) cần phải pha loãng thêm nước cất để tiêm đúng liều thuốc. Pha 1 ống morphin 10 mg/1 mL và nước cất đủ 10mL để thu được dung dịch 10 mg/10 mL (1 mg morphin tương ứng với 1 mL dung dịch
Sử dụng thuốc opioid trong giảm đau ở người cao tuổi
đã pha). Tránh ghi y lệnh tiêm morphin không rõ, bên cạnh ghi liều lượng morphin là bao nhiêu mg (hoặc .../10 ống), cần ghi rõ “pha thêm nước cất thành đủ 10 mL và tiêm ...mL).
Đường uống
Thường dùng morphin uống liều thấp (<30 mg). Pha lượng bột thuốc trong viên nang với 30mL nước uống để được dung dịch 30 mg/30 mL (1 mg tương ứng 1 mL morphin), rút bằng xi lanh bơm tiêm một thể tích morphin theo y lệnh toa thuốc. Dung dịch thuốc đã pha có thể để nhiệt độ phòng trong 24 giờ. Bệnh nhân dùng morphin liều cao (uống nguyên viên), không được nghiền, nhai, do phóng thích nhanh, có khả năng gây tử vong.
5.2.3 Chỉ định và liều lượng
Hội chứng mạch vành cấp tính, đau thắt ngực kháng trị
Tiêm tĩnh mạch liều ban đầu 2-4 mg, sau đó 2-8 mg mỗi 5-15 phút khi cần*, hoặc 1-5 mg ban đầu, sau đó là 1-5 mg mỗi 5-30 phút khi cần.
Đau cấp tính ở bệnh nhân chưa sử dụng opioid
Đường uống dạng phóng thích tức thì (dung dịch uống hoặc viên nang): liều 10 mg mỗi 4 giờ, nếu không giảm đau, có thể tăng lên nếu dung nạp, liều tối đa 30mg mỗi 4 giờ cho đau cấp mức độ nặng ở nội viện kèm nguy cơ ức chế hô hấp thấp
Đường tĩnh mạch: khởi đầu 1-4 mg mỗi 1-4 giờ khi cần, nếu không giảm đau, có thể tăng nếu dung nạp, liều tối đa 10 mg mỗi 4 giờ khi cần cho đau cấp mức độ nặng ở bệnh nhân nội viện kèm nguy cơ ức chế hô hấp thấp. Đối với đau cấp nặng (chấn thương), tần suất cho thuốc nên thường xuyên hơn (mỗi 5-15 phút), khi mức độ giảm đau đạt, giảm tần suất cho thuốc (mỗi 3-4 giờ khi đau).
Tiêm bắp (không khuyến cáo thường quy): không khuyến cáo tiêm bắp do đau vị trí tiêm, hấp thu thay đổi, trì hoãn thời gian đạt đỉnh. Liều ban đầu 5-10 mg mỗi 3-4 giờ khi cần, có thể tăng liều khi đau và dung nạp.
Đặt trực tràng: liều ban đầu 10 mg mỗi 4 giờ hoặc khi cần, có thể tăng hoặc giảm liều khi dung nạp. Liều tối đa tương tự như dùng đường uống lên đến 30 mg mỗi 4 giờ hoặc khi cần.
Đau cấp tính ở bệnh nhân đang dùng giảm đau opioid dài hạn
Thường là cơn đau đột xuất do ung thư. Thêm liều cứu hộ phóng thích tức thì, khoảng 5-20% tổng liều morphin hằng ngày, điều chỉnh liều tiếp theo đáp ứng của bệnh nhân
Đau cấp tính sau phẫu thuật
Kiểm soát đau ban đầu trong đơn vị hồi tỉnh. Tiêm tĩnh mạch 1-3 mg mỗi 5 phút đến khi đạt được tác dụng giảm đau mong muốn hoặc xuất hiện tác dụng phụ không mong muốn (ức chế hô hấp, độ bão hòa oxy trong máu giảm, hạ huyết áp). Với các trường hợp sử dụng morphin ngắn hạn khi đã dùng với tổng liều tích lũy tối đa (20 mg) cần đánh giá lại việc tiếp tục sử dụng morphin
Kiểm soát đau liên tục. Tiêm tĩnh mạch 1-4 mg mỗi 1 đến 4 giờ khi cần, liều tối đa 10 mg mỗi 2-4 giờ nếu cần đối với cơn đau cấp tính, nặng ở những bệnh nhân có nguy cơ ức chế hô hấp thấp.
Đau mạn tính, bao gồm đau mạn tính do ung thu
Đối với bệnh nhân chưa sử dụng opioid
Đối với đau không do ung thư, nên sử dụng morphin phóng thích tức thì. Với đau do ung thư, có thể chuyển sang tác dụng dài sớm hơn trong quá trình điều trị
Đường uống (phóng thích tức thì), liều ban đầu 5-30 mg mỗi 4 giờ 47 Đối với đau mạn không do ung thư, hầu hết kiểm soát đau tốt với liều ban đầu < 50 mg/ngày. Chỉnh liều: đối với đau mạn không do ung thư có thể tăng liều từ từ không quá 25-50% tổng liều hằng ngày. Đối với đau mạn do ung thư, có thể tăng liều cố định từ 30-100% tổng liều dùng 24 giờ trước đó, đồng thời xét tổng lượng thuốc cứu hộ được sử dụng; nếu điểm đau giảm, hãy tiếp tục dùng thuốc hiệu quả hiện tại”. Lưu ý, để giảm nguy cơ quá liều, hãy thận trọng khi tăng liều opioid lên 250 MME/ngày và tránh tăng liều lên >90 MME/ngày.
Tiêm dưới da, tiêm tĩnh mạch dành cho đợt bệnh cấp, không thể dung nạp đường uống. Với các bệnh tiến triển (ung thư), truyền tĩnh mạch hoặc dưới da liên tục giảm đau dưới sự kiểm soát bệnh nhân, được dùng khi mức đau tăng lên. Liều tiêm dưới da tương đương liều tiêm tĩnh mạch, liều ban đầu 2-5 mg mỗi 2-4 giờ khi cần.
Đối với bệnh nhân dung nạp opioid
Nên dùng đường uống (phóng thích kéo dài), tuy nhiên không nên khởi đầu. Nên bắt đầu bằng chế phẩm phóng thích tức thì để xác định chính xác nhu cầu opioid hằng ngày, giảm nguy cơ quá liều. Trừ khi đau có liên quan đến ung thư, chăm sóc giảm nhẹ hoặc bệnh hồng cầu hình liềm, CDC khuyến cáo, opioid phóng thích kéo dài cho dùng opioid phóng thích tức thì hằng ngày trong 21 tuần nhưng vẫn còn đau nặng, liên tục.
Viên nang phóng thích kéo dài (Kadian): liều tính toán có thể được dùng một lần mỗi ngày hoặc mỗi 12 giờ.
Viên nén phóng thích kéo dài (Arymo ER, MorphaBond ER, MS Contin): có thể chia 2 liều (mỗi 12 giờ) hoặc 3 liều (mỗi 8 giờ).
Xét giảm liều với một số liều đầu tiên khi chuyển từ công thức phóng thích tức thì.
5.2.4 Bệnh nhân bị bệnh nặng trong ICU cần giảm đau và an thần
Liều tải: tiêm tĩnh mạch 2-10 mg, sau đó liều duy trì, có thể cần nhiều hơn 1 liều tải; khởi phát tác dụng sau truyền tĩnh mạch là 5-10 phút. Giảm hoặc bỏ qua liều tải ban đầu ở một số bệnh nhân (NCT, giảm thể tích tuần hoàn, nguy cơ rối loạn huyết động).
Liều duy trì: tiêm tĩnh mạch 2-4 mg mỗi 1-2 giờ hoặc 4-8 mg mỗi 3-4 giờ.
5.3 Fentanyl
5.3.1 Chế phẩm sẵn có ở Việt Nam
Miếng dán da: DUROGESIC hàm lượng 25 mcg/h, 50 mcg/h, 75 mcg/h, 100 mcg/h. Ống tiêm: FENTANYL CITRATE 500, ống 2 mL.
Sử dụng thuốc opioid trong giảm đau ở người cao tuổi
5.3.2 Hướng dẫn sử dụng miếng da DUROGESIC
- Không sử dụng miếng dán bị hư, cắt, rò rỉ vì kém hiệu quả hơn.
- Vị trí dán: vùng da phẳng, không bị kích ứng, không bị chiếu xạ như ngực, lưng, hông sườn hoặc cánh tay, ở bệnh nhân suy giảm nhận thức nên dán ở vùng lưng trên.
- Vệ sinh trước dán: lông vị trí dán có thể cắt (không được cạo). Khi vệ sinh dùng nước sạch, lau khô hoàn toàn. Không dùng xà phòng, dầu, kem dưỡng, cồn, bất kỳ tác nhân nào để sạch da vì gây kích ứng da, thay đổi đặc điểm da.
- Dán: đeo găng tay, mở bao bì và dán ngay, ấn chặt miếng dán và giữ 30 giây, sau đó rửa tay ngay bằng xà phòng và nước. Nếu miếng không bám chắc, dùng băng y tế dán cố định các cạnh miếng dán, hay băng phim dính (Bioclusive, Tegaderm). Cách ly: tránh tiếp xúc với vùng da đã gỡ miếng dán chưa được vệ sinh do phơi nhiễm thứ phát. Tránh để vùng da đang dán fentanyl tiếp xúc với nguồn nhiệt bên ngoài (đệm sưởi ấm, chăn điện, đèn sưởi ấm, nước nóng, tắm nắng...). Thay miếng dán mỗi 72 giờ và thay đổi vị trí dán.
- Gỡ miếng dán: bệnh nhân tại nhà, đeo găng tay, gỡ miếng dán, gấp các đầu dính lại, vứt vào cầu bồn cầu và xả nước ngay. Bệnh nhân nội viện: gỡ miếng dán tương tự tại nhà, lưu trữ tạm thời trong hộp đựng chất sinh học nguy hiểm, trả khoa Dược.
| Thời gian khởi phát | Thời gian đạt đỉnh | Thời gian kéo dài | |
| Fentanyl | 7-8 phút | 1-2 giờ | |
| Tiêm bắp | Gần như tức thì | 0,5-1 giờ | |
| Tiêm tĩnh mạch | 6 giờ | 72-96 giờ | 20-72 giờ |
| Miếng dán qua da | |||
Morphin | |||
| Viên/dung dịch uống phóng thích tức thì | 30 phút | 1 giờ | 3-5 giờ |
Viên uống phóng thích kéo dài | 3-4 giờ | 8-24 giờ | |
| Tiêm tĩnh mạch | 5-10 phút | 20 phút | 3-5 giờ |
| Tramadol | |||
| Đường uống/tiêm | Trong vòng 1 giờ | 2-3 giờ | 6 giờ |
5.3.3 Chỉ định và liều lượng
Đau cấp tính hậu phẫu
Tiêm tĩnh mạch 25-50 mcg mỗi 5 phút (đau mức trung bình) hoặc 50-100 mcg mỗi 2 đến 5 phút (đau mức độ nặng) cho đến khi cơn đau thuyên giảm hoặc các tác dụng phụ không mong muốn xuất hiện.
Tiêm bắp 50-100 mcg mỗi 1-2 giờ khi cần (khi không sẵn đường truyền tĩnh mạch).
Đau cấp tính mức độ nặng ở bệnh nhân không phải hậu phẫu
Áp dụng cho bệnh nhân ICU hoặc được theo dõi sát. Tiêm tĩnh mạch, tiêm bắp ngắt quãng: 25-50 mcg hoặc 0,35-0,5 mcg/kg mỗi 30-60 phút, với tần suất nhiều hơn nếu cần do fentanyl tĩnh mạch có thời gian tác dụng ngắn.
Đau mạn tính, bao gồm đau mạn tính do ung thư
Truyền dưới da liên tục
Các bệnh tiến triển (ung thư), truyền dưới da liên tục, có hoặc không có kiểm soát đau của bệnh nhân. Liều truyền dưới da liên tục tương đương truyền tĩnh mạch liên tục
Miếng dán qua da
Ngừng hoặc giảm dần tất cả các opioid khác khi bắt đầu miếng dán fentanyl qua da. Dù có sẵn bảng tương đương opioid hữu ích, nhưng có sự thay đổi đáng kể giữa bệnh nhân về liều tương đối của các chế phẩm opioid. Do đó, sẽ an toàn hơn với đánh giá nhu cầu fentanyl hằng ngày thấp hơn và giảm đau cứu hộ bằng opioid giải phóng tức thì. Những bệnh nhân kiểm soát đau ổn khi truyền fentanyl tĩnh mạch, có thể chuyển sang dùng liều qua da với tốc độ tương đương truyền tĩnh mạch, theo 2 bước sau:
Tiếp tục truyền fentanyl tĩnh mạch thêm 12 giờ sau khi dán miếng dán, trong đó 6 giờ đầu, giữ nguyên tốc độ truyền và 6 giờ sau, giảm tốc độ truyền 50%. Ngưng truyền fentanyl tĩnh mạch sau khi đã dán miếng dán đủ 12 giờ.
Chỉnh liều: không chỉnh liều < 3 ngày/một lần sau dán miếng dán đầu tiên hoặc < 6 ngày/một lần từ miếng dán thứ 2. Opioid tác dụng ngắn để cứu hộ khi đau đột xuất. Khi tăng liều, liều mới được dựa trên nhu cầu opioid hằng ngày cộng liều opioid cứu hộ khi dán miếng dán. Ví dụ, nếu morphin uống cứu hộ là 50 mg/24 giờ, có thể tăng liều fentanyl qua da thêm 25 mcg/giờ 2.
Bệnh nhân bị bệnh nặng trong ICU cần giảm đau và an thần
Tiêm tĩnh mạch ngắt quãng
Liều tải: 25-100 mcg hoặc 1-2 mcg/kg; lặp lại liều nếu đau vẫn mức độ nặng, tác dụng phụ tối thiểu. Sau đó dùng liều duy trì không liên tục hoặc truyền liên tục.
Liều duy trì: 25-50 mcg hoặc 0,35-0,5 mcg/kg mỗi 30 đến 60 phút khi cần.
Truyền tĩnh mạch liên tục
Sau liều nạp ban đầu (tương tự liều nap tiêm tĩnh mạch ngắt quãng), tốc độ ban đầu từ 25-50 mcg/giờ; chỉnh liều mỗi 30-60 phút đến khi có hiệu quả (kiểm soát con đau và hoặc an thần). Khoảng liều thông thường: 50-200 mcg/giờ (một số bệnh nhân có thể liều cao như 300 mcg/giờ); liều lượng dựa trên cân nặng: 0,7-10 mcg/kg/giờ. Fentanyl có thể tích tụ trong lipid khi dùng thời gian dài, gây an thần kéo dài, giảm khả năng cai máy thở. Có thể dùng một liều bolus nhỏ bổ sung (25 mcg) trước khi tăng tốc độ truyền”.
Thủ thuật cần an thần và giảm đau
Khu vực ngoài phòng mổ (thuốc thay thế, không chính thống). Tiêm tĩnh mạch: 0,5-1 mcg/ kg mỗi 2 phút đến khi đạt mức độ an thần, giảm đau mong muốn; tổng liều tối đa là 250 mcg. Nếu dùng với thuốc an thần khác (etomidate, Propofol, Midazolam), sử dụng liều duy nhất không vượt quá 0,5 mcg/kg.
Giảm đau trong quá trình gây mê hoặc gây tê vùng tại phòng mổ. Tiêm tĩnh mạch khoảng liều ban đầu thông thường 0,5-2 mcg/kg, bolus thêm các liều cứu hộ 25-50 mcg đến khi có đạt giảm đau mong muốn. Khi sử dụng kết hợp với thuốc an thần (midazolam), xem xét giảm liều.
Đặt nội khí quân tiền mê hoặc cấp cứu
Tiêm tĩnh mạch liều thông thường 50-200 mcg (hoặc 1-3 mcg/kg) trong 30-60 giây và khoảng 3 phút trước thủ thuật. Bệnh nhân có tình trạng rối loạn huyết động, sử dụng liều thấp hơn (1 mcg/kg [hoặc 50 mcg]) hoặc tránh sử dụng; bệnh nhân bị tăng áp lực nội sọ, sử dụng liều cao hơn (3 mcg/kg [hoặc 200 mcg]).
6 Phòng ngừa và quản lý tác dụng phụ Opioid
6.1 Ngộ độc cấp tính
Ngộ độc opioid cấp có thể do quá liều ngẫu nhiên hoặc cố ý tự tử. Có thể do tiêm opioid vào vùng da lạnh, bệnh nhân bị huyết áp thấp, sốc, nên thuốc không được hấp thu hoàn toàn và bệnh nhân được cho thuốc tiếp tục. Khi tuần hoàn phục hồi, một lượng thuốc quá mức có thể hấp thụ đột ngột.
Ở người không dung nạp, có thể ngộ độc nặng với methadon sau khi uống 40-60 mg. Với morphin, một người bình thường không đau sẽ không tử vong sau khi uống liều dưới 120 mg, hoặc không bị ngộ độc nặng với liều tiêm dưới 30 mg.
| Thường gặp | Đôi khi | Hiếm gặp |
Buồn nôn, nôn Táo bón An thần Buồn ngủ Suy giảm nhận thức Co đồng tử Ức chế họ Bí tiểu | Ảo giác Thay đổi khi sắc Lo âu Ngứa Giật cơ Cứng cơ Khô miệng Liệt dạ dày Co thắt phế quản | Ức chế hô hấp Sång Co giật Tăng cảm đau Loạn cảm đau Co thắt đường mật Phù phổi không do tim Dung nạp Lệ thuộc thể chất Nghiện |
6.1.1 Biểu hiện lâm sàng
Tam chứng quan trọng: hôn mê, đồng tử đầu đinh ghim, ức chế hô hấp gợi ý nhiều đến ngộ độc opioid. Quá liều opioid thường ngủ gà, lơ mơ, có thể hôn mê sâu. Tần số thở sẽ rất thấp, có thể ngừng thở và tím tái. Nếu được hỗ trợ đầy đủ oxy sớm, huyết áp sẽ cải thiện; nếu tình trạng thiếu oxy kéo dài không được điều trị, có thể có tổn thương mao mạch. Đồng tử 2 bên sẽ đối xứng, kích thước bằng đầu đinh; nếu tình trạng thiếu oxy nghiêm trọng, đồng tử có thể dãn ra.
Các triệu chứng khác:
- Thể tích nước tiểu giảm.
- Nhiệt độ cơ thể giảm, da lạnh và ẩm.
- Cơ xương mềm ra, hàm thả lỏng, và lưỡi có thể tụt ra sau làm tắc nghẽn đường thở.
- Co giật đôi khi ghi nhận ở trẻ sơ sinh và trẻ em.
- Phù phổi không do tim.
- Tử vong hầu như là do giảm hô hấp. Ngay cả khi tình trạng hô hấp được phục hồi, tử vong vẫn có thể xảy ra do các biến chứng trong hôn mê, như viêm phổi hoặc sốc.
6.1.2 Điều trị
Thông thoáng đường thở và hỗ trợ thông khí
Bước đầu tiên là giữ cho đường thở thông thoáng và hỗ trợ thông khí, theo dõi nhịp thở, độ bão hòa oxy. Không cần điều trị nếu độ bão hòa oxy máu bình thường. Hỗ trợ thông khí áp lực cho bệnh nhân phù phổi do quá liều opioid.
Thuốc đối vận opioid
Thuốc đối vận opioid (naloxon) có thể đảo ngược tình trạng ức chế hô hấp nặng. Thận trọng tránh tình trạng cai thuốc ở bệnh nhân lệ thuộc thuốc vì họ cực kỳ nhạy cảm với thuốc đối vận.
Pha loãng 0,4 mg naloxon vào 9 mL nước muối, liều ban đầu tiêm tĩnh mạch 0,08-0,12 mg (2-3 mL) mỗi 2 phút cho đến khi nhịp thở về bình thường.
Cơn đau dữ dội có thể xuất hiện. Theo dõi tri giác, nhịp thở tùy thời gian tác dụng của opioid trước đó. Tác dụng naloxon chỉ 1 giờ, nên dùng lặp lại khi cần thiết.
6.1.3 Theo dõi
Cần theo dõi tình trạng tăng dội ngược trong hoạt động của hệ thần kinh giao cảm, hậu quả có thể dẫn đến rối loạn nhịp tim và phù phổi.
Nếu không thấy đáp ứng sau tổng liều 10 mg naloxon, cần xem lại chẩn đoán.
Đặc biệt quan trọng khi quá liều methadon. Tác dụng ức chế của những thuốc này có thể kéo dài 24-72 giờ và đã xảy ra trường hợp tử vong do ngừng naloxon sớm. Trường hợp quá liều các thuốc này, xét truyền naloxon liên tục. Ngộ độc do quá liều pentazocin, opioid khác có tác dụng hỗn hợp có thể cần naloxon liều cao hơn.
6.2 Ức chế hô hấp
Tình trạng ức chế hô hấp có ý nghĩa lâm sàng hiếm xảy ra với liều giảm đau thông thường khi không có các yếu tố đi kèm khác. Tử vong do ngộ độc opioid luôn do ngừng thở, tắc nghẽn đường hô hấp. Opioid ức chế tất cả giai đoạn của hô hấp (nhịp thở, thể tích khí lưu thông, thông khí phút) và tạo nhịp thở không đều, không theo chu kỳ. Thể tích khí lưu thông giảm chủ yếu do nhịp thở chậm; Với opioid liều gây độc, nhịp thở giảm xuống còn 3-4 lần/phút. Opioid phải dùng thận trọng ở bệnh nhân hen, COPD, bệnh tim phổi, người có giảm dự trữ hô hấp, ức chế hô hấp, giảm oxy, tăng CO, máu.
6.2.1 Cơ chế bệnh sinh
- Sử dụng thuốc opioid trong giảm đau ở người cao tuổi
- Ức chế trực tiếp lên quá trình tạo nhịp thở.
- Ức chế đáp ứng thông khí với tăng CO, máu.
- Giảm đáp ứng tăng thông khí khi giảm O2 máu.
- Giảm sự dãn nở của thành ngực.
- Giảm độ thông thoáng của đường hô hấp trên.
6.2.2 Yếu tố nguy cơ
- Quá liều có thể xảy ra ở liều điều trị nếu có yếu tố thuận lợi, tăng liều, chưa từng dùng opioid, lạm dụng, dùng sai mục đích.
- Kết hợp opioid với các thuốc an thần khác tạo sự ức chế hô hấp thêm: thuốc mê toàn thân, an thần, đặc biệt là nhóm benzodiazepin, rượu, thuốc ngủ có tác dụng an thần.
- Giấc ngủ tự nhiên làm giảm độ nhạy cảm của trung tâm hành tủy đối với CO,.
- Tuổi tác: bệnh nhân cao tuổi có nguy cơ bị ức chế cao hơn do giảm độ đàn hồi của phổi, giảm độ dãn nở thành ngực và giảm dung tích sống.
- Bệnh nền: bệnh tim-phổi trong đó quan trọng nhất là COPD, béo phì bệnh lý, suy gan, suy thận, suy mòn.
6.2.3 So sánh tác động ức chế hô hấp giữa các loại opioid khác nhau
Nhiều nghiên cứu cho thấy, khi dùng liều giảm đau tương đương không có sự khác biệt đáng kể. Ức chế hô hấp tối đa xảy ra trong 5-10 phút sau khi tiêm morphin tĩnh mạch hoặc 30-90 phút sau tiêm bắp, tiêm dưới da. Thuốc càng hòa tan tốt trong lipid có tốc độ ức chế hô hấp càng nhanh. Sau liều điều trị, thông khí phút có thể giảm trong 4-5 giờ. Thuốc có dược động kéo dài (methadon), phải theo dõi cẩn thận, đặc biệt khi tăng liều. Cải thiện tình trạng ngủ gà sau cho thuốc đối vận là dấu hiệu chẩn đoán quá liều opioid. Hầu hết, thuốc đối vận opioid có thời gian tác dụng ngắn so với thuốc đồng vận (morphin, methadon) nên hiện tượng “tái mê man” gây tử vong có thể xảy ra.
6.3 Táo bón
Tác dụng phụ táo bón dao động 15-90%. Cơ chế do giảm nhu động, giảm bài tiết dịch tiêu hóa, tăng trương lực cơ vòng do kích hoạt thụ thể opioid ngoại biên. Theo thời gian, táo bón trơ với thuốc mềm phân, nhuận tràng, dẫn đến tắc ruột, thủng ruột. Do tính không dung nạp, phòng ngừa, điều trị táo bón luôn song song khi kê đơn opioid. Khuyên bệnh nhân uống nhiều nước, chất xơ, duy trì hoạt động có thể. Cần thăm trực tràng và lấy phân bằng tay.
Liệu pháp dùng thuốc gồm:
- Nhuận tràng kích thích: bisacodyl 5-10 mg uống 1-2 lần/ngày, tối đa 30 mg/ngày. Nhuận tràng thẩm thấu hiệu quả kém hơn nhuận tràng kích thích: polyethylen glycol uống 1-2 lần/ngày, Lactulose 15-45 mL uống x 2-3 lần/ngày, duy trì 30-90 mL/ngày.
- Thuốc thụt tháo với natri phosphate hoặc dầu khoáng x 1 lần/ngày.
- Trường hợp nặng: naloxon 1-3 mg uống mỗi 8 giờ khi cần.
6.4 Buồn nôn và nôn
Khoảng 2/3 gặp tác dụng phụ buồn nôn và nôn khi khởi trị opioid”, thường gặp ở bệnh nhân ngoại trú với tỷ lệ buồn nôn và nôn khoảng 40% và 15%. Buồn nôn, nôn do opioid do tăng độ nhạy của tiền đình”, liệt dạ dày sau phẫu thuật, quan trọng nhất là kích thích trực tiếp vùng kích hoạt thụ thể hóa học (CTZ) gây nôn ở trung tâm nôn hành tủy. Tác dụng phụ này liên quan với liều và dung nạp nhanh.
Điều trị dùng Metoclopramide 10-15 mg uống/tiêm tĩnh mạch mỗi 6 giờ. Nếu nghiêm trọng, Haloperidol 0,5-1 mg uống hoặc tiêm tĩnh mạch mỗi 4 giờ. Tác dụng ngoại ý haloperidol và metoclopramid nếu dùng kéo dài là rối loạn vận động chậm, rung giật cơ đặc biệt đối với NCT. Nếu nôn kéo dài không đáp ứng với thuốc chống nôn, có thể xem xét chuyển opioid khác hoặc thay đổi đường dùng.
| Điều trị | Ghi chú | |
| Khô miệng | Giữ miệng ẩm bằng uống nhấp nước thường xuyên hoặc ngậm miếng bọt biển/que gòn ướt | Triệu chứng xuất hiện kéo dài khi sử dụng opioid |
| An thần | Trấn an người bệnh | Thường tự hết vài ngày |
| Giật cơ | Không cần điều trị nếu không gây khó chịu cho người bệnh Chuyển đổi sang loại opioid khác Diazepam 2-5 mg uống hoặc tiêm mạch chậm mỗi 8 giờ khi cần | Diazepam làm tăng nguy cơ sảng hoặc an thần |
| Ngứa | Thay opioid khác nếu có thể | Triệu chứng xuất hiện kéo dài khi sử dụng opioid |
| Bí tiểu | Tránh dùng đồng thời với kháng cholinergic Điều trị đặc hiệu bệnh tiền liệt tuyến Xem xét đặt thông bàng quang | Thường gặp ở nam có tuyến tiền liệt lớn hoặc bệnh thần kinh (đột quỵ, bàng quang thần kinh) |
7 Kết luận
Opioid là thuốc giảm đau hiệu quả trong điều trị đau cấp tính, chăm sóc giảm nhẹ. Cần thận trọng khi kê toa opioid cho đau mạn tính không do ung thư, do thiếu bằng chứng hiệu quả trong cải thiện cơn đau, chất lượng cuộc sống và tác dụng phụ của dùng opioid lâu dài. Rối loạn sử dụng opioid là mối lo ngại về sức khỏe cộng đồng, cần thận trọng đánh giá tuân thủ điều trị, nguy cơ lạm dụng, sử dụng sai mục đích, chuyển hướng sử dụng. Người kê đơn opioid phải cập nhật kiến thức dược lý của opioid, sự phán đoán và nhạy bén để áp dụng điều trị cụ thể hóa cho từng bệnh nhân, lấy bệnh nhân làm trung tâm, điều này sẽ mang lại lợi ích và giải quyết nguyên nhân đau thích hợp nhất.
8 Tài liệu tham khảo
- Nguyễn Văn Tân, Nguyễn Văn Trí, Nguyễn Thanh Huân (2023). “Sử dụng thuốc opioid trong giảm đau ở người cao tuổi”, Cấp cứu các bệnh thường gặp ở người cao tuổi. Nhà xuất bản Y học, trang 763-789. Tải bản PDF tại đây.
- Thomas E, Peat G, Harris L, Wilkie R. Croft PR. (2004) The prevalence of pain and pain interference in a general population of older adults: cross-sectional findings from the North Staffordshire Osteoarthritis Project (NorStOP). Pain.
- Takai Y, Yamamoto-Mitani N, Okamoto Y, Koyama K, Honda A. (2010) Literature review of pain prevalence among older residents of nursing homes. Pain Manag Nurs.
- Parmelee P. (2005) Measuring mood and psychosocial function associated with pain in late life. Progress in pain research and management.
- Yates PM, Edwards HE, Nash RE, et al. (2002) Barriers to effective cancer pain management: a survey of hospitalized cancer patients in Australia. Journal of pain and symptom management.
- Sites BD, Beach ML, Davis MA. (2014) Increases in the use of prescription opioid analgesics and the lack of improvement in disability metrics among users. Reg Anesth Pain Med.
- Rummans TA, Burton MC, Dawson NL. (2018) How Good Intentions Contributed to Bad Outcomes: The Opioid Crisis. Mayo Clin Proc.
- Shah A, Hayes CJ, Martin BC. (2017) Characteristics of Initial Prescription Episodes and Likelihood of Long-Term Opioid Use - United States, 2006-2015. MMWR Morb Mortal Wkly Rep.
- Moreland B, Lee R. (2021) Emergency department visits and hospitalizations for selected nonfatal injuries among adults aged≥65 years-United States, 2018. Morbidity and Mortality Weekly Report.
- Tony Yaksh, Wallace M. (2018) Opioids, Analgesia, and Pain Management. In: Laurence L. Brun- ton, Randa Hilal-Dandan, Knollmann BC, eds. Goodman and Gilman's the pharmacological basis of therapeutics. 13 ed. McGraw-Hill Education;
- Busse GD. (2006) The History of Opium and Morphine. DRUGS The Straight Facts Morphine.
- Pathan H, Williams J.(2012) Basic opioid pharmacology: an update. Br J Pain.
- Dmitry M. Arbuck, Gary H. Wright, Miguel R. (2023) Effective Opioid Therapies Across The Spectrum Of Chronic Pain. 2023. https://www.medscape.org/viewarticle/474635
- Inturrisi CE, AG L. (2009) Bonica's Management of Pain. Lippincott, Williams & Wilkins
- BA C.(2009) Clinical Anesthesia. Lippincott Williams & Wilkins
- Vallejo R, Barkin RL, Wang VC. (2011) Pharmacology of opioids in the treatment of chronic pain syndromes. Pain Physician.
- Hướng dẫn chăm sóc giảm nhẹ (2022).
- WHO Guidelines Approved by the Guidelines Review Committee. (2018) WHO Guidelines for the Pharmacological and Radiotherapeutic Management of Cancer Pain in Adults and Adoles- cents. World Health Organization.
- Ronald Melzack, Katz J.(2013) Pain Measurement in Adult Patients. In: Stephen B. McMahon, Irene Tracey, Martin Koltzenburg, Turk DC, eds. Wall and Melzack's Textbook of Pain. Elservier
- Lucia Gagliese, Melzack R.(2013) Pain in Older Persons. In: Stephen B. McMahon, Irene Tracey, Martin Koltzenburg, Turk DC, eds. Wall and Melzack's Textbook of Pain. Elservier;.
- Hicks C, Baeyer C, Spafford P, van Korlaar I, Goodenough B. (2001) The Faces Pain Scale - Revised: Toward a common metric in pediatric pain measurement. Pain.
- Childs JD, Piva SR, Fritz JM. (2005) Responsiveness of the numeric pain rating scale in patients with low back pain. Spine (Phila Pa 1976).
- Warden V, Hurley AC, Volicer L. (2003) Development and psychometric evaluation of the Pain Assessment in Advanced Dementia (PAINAD) scale. J Am Med Dir Assoc.
- Dowell D, Ragan KR, Jones CM, Baldwin GT, Chou R. (2022) CDC Clinical Practice Guide- line for Prescribing Opioids for Pain - United States, 2022. MMWR Recomm Rep.
- Aebischer JH, Dieckmann NF, Jones KD, St John AW. (2021) Chronic pain clinical and prescriptive practices in the cannabis era. Pain Management Nursing.
- Schug SA. (2013) Opioids: Clinical Use. In: Stephen B. McMahon, Irene Tracey, Martin Koltzenburg, Turk DC, eds. Wall and Melzack's Textbook of Pain. Elservier;.
- Nelson KA, Glare PA, Walsh D, Groh ES. (1997) A prospective, within-patient, crossover study of continuous intravenous and subcutaneous morphine for chronic cancer pain. J Pain Symptom Manage.
- Bruera E, Fainsinger R, Moore M, Thibault R, Spoldi E, Ventafridda V. (1991) Local toxicity with subcutaneous methadone. Experience of two centers. Pain.
- Momeni M, Crucitti M, De Kock M. (2006) Patient-controlled analgesia in the management of postoperative pain. Drugs.
- Allan L, Hays H, Jensen NH, et al. (2001) Randomised crossover trial of transdermal fentanyl and sustained release oral morphine for treating chronic non-cancer pain. Bmj.
- Grape S, Schug SA, Lauer S, Schug BS. (2010) Formulations of fentanyl for the management of pain. Drugs.
- Portenoy RK. (1994) Tolerance to opioid analgesics: clinical aspects. Cancer Surv.
- Nielsen S, Degenhardt L, Hoban B, Gisev N. (2016) A synthesis of oral morphine equivalents. (OME) for opioid utilisation studies. Pharmacoepidemiol Drug Saf.
- Aronoff GR.(2007) Drug prescribing in renal failure. ACP Press.
- Chou R, Cruciani RA, Fiellin DA, et al. (2014) Methadone safety: a clinical practice guideline from the American Pain Society and College on Problems of Drug Dependence, in collaboration. with the Heart Rhythm Society. J Pain..
- McPherson ML, Walker KA, Davis MP, et al. (2019) Safe and Appropriate Use of Methadone in Hospice and Palliative Care: Expert Consensus White Paper. J Pain Symptom Manage. Mar
- Krakauer E. (2008) To change from one opioid to another.
- Dowell D, Compton WM, Giroir BP. (2019) Patient-centered reduction or discontinuation of long term opioid analgesics: the HHS guide for clinicians. Jama.
- Chou R, Gordon DB, de Leon-Casasola OA, et al. (2016) Management of Postoperative Pain: a clinical practice guideline from the American pain society, the American Society of Region- al Anesthesia and Pain Medicine, and the American Society of Anesthesiologists' commit- tee on regional anesthesia, executive committee, and administrative council. The journal of pain.
- Dowell D, Haegerich TM, Chou R. (2016) CDC Guideline for Prescribing Opioids for Chronic Pain - United States, 2016. MMWR Recomm Rep.
- Busse JW, Craigie S, Juurlink DN, et al. (2017) Guideline for opioid therapy and chronic noncancer pain. Cmaj.
- O'Gara PT, Kushner FG, Ascheim DD, et al.(2013) 2013 ACCF/AHA guideline for the manage- ment of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation.
- Amsterdam EA, Wenger NK, Brindis RG, et al. (2014) 2014 AHA/ACC guideline for the manage- ment of patients with non-ST-elevation acute coronary syndromes: a report of the Ameri- can College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation.
- Herzig SJ, Stefan MS, Pekow PS, et al. (2020) Risk Factors for Severe Opioid-Related Adverse Events in a National Cohort of Medical Hospitalizations. J Gen Intern Med. Feb.
- Azhar A, Kim YJ, Haider A, et al. (2019) Response to Oral Immediate-Release Opioids for Break- through Pain in Patients with Advanced Cancer with Adequately Controlled Background Pain. Oncologist.
- Aubrun F, Mazoit JX, Riou B. (2012) Postoperative intravenous morphine titration. Br J Anaesth.
- arr J, Fraser GL, Puntillo K, et al.(2013) Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit Care Med. Jan.
- Paice JA, Ferrell B. (2011) The management of cancer pain. CA Cancer J Clin.
- Anderson SL, Shreve ST. (2004) Continuous subcutaneous infusion of opiates at end-of-life. Ann Pharmacother..
- Lexicomp. Morphine, Fentanyl, Tramadol: Drug information.
- Miller RS, Peterson GM, Abbott F, Maddocks I, Parker D, McLean S. (1995) Plasma concentrations of fentanyl with subcutaneous infusion in palliative care patients. Br J Clin Pharmacol..
- Kornick CA, Santiago-Palma J, Khojainova N, Primavera LH, Payne R, Manfredi PL. (2001) A safe and effective method for converting cancer patients from intravenous to transdermal fentanyl. Cancer..
- McPherson MLM. (2010) Demystifying opioid conversion calculations: a guide for effective dosing. American Society of Health System Pharmacists. Inc Bethesda, MD.;
- Peng PW, Sandler AN. (1999) A review of the use of fentanyl analgesia in the management of acute pain in adults. Anesthesiology. .
- Bahn EL, Holt KR. (2005) Procedural sedation and analgesia: a review and new concepts. Emerg Med Clin North Am.
- Lawlor PG, Bruera E. (1998) Side-effects of opioids in chronic pain treatment. Curr Opin Anaesthesiol.
- Schug SA, Zech D, Grond S. (1992) Adverse effects of systemic opioid analgesics. Drug Saf.
- Lembke A, Humphreys K, Newmark J. (2016) Weighing the Risks and Benefits of Chronic Opioid Therapy. Am Fam Physician.

